INIBIDORES DAS FOSFODIESTERASES
DOS NUCLEÓTIDOS CÍCLICOS NA TERAPÊUTICA
FARMACOLÓGICA
Sandra Morgado
PharmD, MScEspecialista em Farmácia Hospitalar. Centro Hospitalar Cova da Beira, E.P.E. E-mail: sandracristinamorgado@gmail.com
Manuel Morgado
PharmD, PhDEspecialista em Farmácia Hospitalar. Professor Auxiliar Convidado. CICS-UBI – Centro de Investigação em Ciências da Saúde, Universidade da Beira Interior
Isabel Margarida Costa
PharmD, PhDProfessora associada. Centro de Investigação Interdisciplinar Egas Moniz, Instituto Superior de Ciências da Saúde Egas Moniz
Resumo
As fosfodiesterases dos nucleótidos cíclicos (PDE) são enzimas que regulam os níveis celulares dos
se-gundos mensageiros adenosina 3´,5´-monofosfato cíclico (AMPc) e de guanosina 3´,5´-monofosfato cíclico
(GMPc) através do controlo das suas taxas de degradação. O aumento dos níveis intracelulares de AMPc e
GMPc, através da inibição das PDE, constitui uma estratégia extremamente útil para a obtenção de
diver-sos efeitos farmacológicos com aplicação clínica relevante. A diferente distribuição tecidular e celular e a
grande diversidade na estrutura, regulação e função das isoenzimas de PDE permitem o desenvolvimento de
inibidores seletivos para cada uma das isoenzimas, dotados de grande interesse farmacológico.
Neste artigo é feita uma revisão dos diferentes inibidores das PDE disponíveis no mercado farmacêutico
nacional e internacional e das suas aplicações na terapêutica farmacológica. É ainda feita uma abordagem
dos principais inibidores das PDE que se encontram atualmente em fase de investigação, bem como do
po-tencial terapêutico da inibição de determinadas PDE.
Foi efetuada uma revisão da literatura científica, através da pesquisa bibliográfica na PubMed, utilizando
os termos «cyclic nucleotide phosphodiesterases» e «phosphodiesterase inhibitors», para a obtenção de
re-ferências bibliográficas publicadas desde 1998 até ao momento atual. Foram ainda consultadas as bases de
dados de medicamentos da Autoridade Nacional do Medicamento e Produtos de Saúde, I. P. (INFARMED),
da European Medicines Agency (EMA) e da Food and Drug Administration (FDA) para pesquisa dos
inibi-dores das PDE autorizados para utilização na prática clínica.
Atualmente, encontram-se disponíveis no mercado farmacêutico mundial 15 inibidores seletivos das PDE,
utilizados como cardiotónicos, relaxantes do músculo liso vascular e brônquico, antitrombóticos,
anti-in-flamatórios e antidepressivos. Os inibidores das PDE disponíveis em maior número são os inibidores das
famílias 3 e 5, mas existem muitos outros inibidores seletivos com interesse na terapêutica farmacológica e
um número considerável de fármacos em fase de desenvolvimento para utilização clínica.
Palavras-chave: AMPc, GMPc, nucleótido cíclico, inibidores das fosfodiesterases.
Abstract
Cyclic nucleotide phosphodiesterases (PDEs) are enzymes that regulate the cellular levels of the second
messen-gers adenosine 3´5´-cyclic monophosphate (cAMP) and guanosine 3´5´-cyclic monophosphate (cGMP) by
control-ling their rates of degradation. The increase of intracellular levels of cAMP and cGMP, through PDE inhibition,
represents a useful strategy for eliciting a variety of pharmacological effects with important clinical applications.
The different tissue and cellular distribution and large diversity in structure, regulation and function among PDE
isozymes, make it possible to develop selective and pharmacologically useful inhibitors of individual isozymes.
28This paper reviews the various PDE inhibitors currently licensed on the national and international
phar-maceutical market and their therapeutic indications. It also reviews the main PDE inhibitors that are
cur-rently in pre-clinical or clinical trials as well as the therapeutic potential of certain isozyme-selective PDE
inhibitors not yet discovered.
A revision of the scientific literature was carried out, through a search on PubMed for papers published
from 1998 to the present time, using the MeSH terms “cyclic nucleotide phosphodiesterases” and
“phos-phodiesterase inhibitors”. Drug databases of the Portuguese National Authority of Medicines and Health
Products (INFARMED, I.P.), the European Medicines Agency (EMA) and the Food and Drug
Administra-tion (FDA) were also searched to retrieve PDE inhibitors approved for clinical use.
There are currently 15 selective PDE inhibitors available in the pharmaceutical market, approved for
clini-cal use as cardiotonics, relaxants of vascular and bronchial smooth muscle, antithrombotics,
anti-inflam-matories and antidepressives. Although selective PDE inhibitors of families 3 and 5 predominate, there are
several other PDE inhibitors already licensed for pharmacological therapeutics. At present, PDE inhibitors
are a pharmacological group under intense scrutiny and there are many PDE inhibitors in development for
treatment of several pathological conditions.
Keywords: cAMP, cGMP, ciclic nucleotide, phosphodiesterase inhibitors.
Introdução
O AMPc e o GMPc encontram-se amplamente
distri-buídos nos tecidos e células dos mamíferos e são
se-gundos mensageiros que intervêm em muitas vias de
sinalização intracelulares, controlando uma grande
di-versidade de funções celulares e fisiológicas, tais como
a contração dos miócitos cardíacos, o relaxamento do
músculo liso vascular, a broncodilatação, a secreção
hormonal, a motilidade gastrointestinal, a proliferação
e diferenciação celulares, a reprodução, a plasticidade
sináptica, a memória, etc.
1-5.
O AMPc e o GMPc são sintetizados pela adenilciclase
(a partir do ATP, adenosina 5’-trifosfato) e pela
gua-nilciclase (a partir do GTP, guanosina 5’-trifosfato),
respetivamente, e são degradados nos seus metabolitos
biologicamente inativos (5´-AMP, adenosina
5’-mo-nofosfato e 5´-GMP, guanosina 5’-mo5’-mo-nofosfato) pelas
PDE. Os níveis celulares de AMPc e de GMPc e a
am-plitude e a duração das respostas mediadas por estes
nucleótidos cíclicos são o reflexo do balanço existente
entre as suas taxas de síntese (pelas ciclases) e as suas
taxas de degradação (pelas PDE)
6.
As ações celulares e fisiológicas de muitas hormonas,
neurotransmissores, odorantes e de muitas outras
mo-léculas e, ainda, da própria luz, são mediadas por
va-riações, muito controladas e localizadas, nas
concen-trações daqueles nucleótidos (NC). Estas variações nos
níveis intracelulares de NC contribuem para a
regula-ção de uma grande diversidade de processos
fisiológi-cos, de que são exemplo a visão, o olfato, a contração do
músculo liso, o equilíbrio hidroeletrolítico, as respostas
imunitárias e o metabolismo glucídico e lipídico
4,7.
O aumento dos níveis intracelulares de AMPc e GMPc
através da inibição das PDE constitui uma estratégia
extremamente útil para a obtenção de diversos
efei-tos farmacológicos com aplicação clínica relevante.
A diferente distribuição tecidular e celular e a grande
diversidade na estrutura, regulação e função das
iso-enzimas de PDE tornam possível o desenvolvimento
de inibidores seletivos para cada uma das isoenzimas,
dotados de grande interesse farmacológico.
Foram identificados, até momento, 21 genes do
geno-ma hugeno-mano envolvidos na codificação de 11 famílias
de PDE, que se encontram subdivididas num total de
21 subfamílias, apresentando ainda, cada subfamília,
diversas variantes
4,6.
A existência de múltiplas isoenzimas de PDE com
propriedades estruturais, regulatórias e funcionais
distintas e a sua diferente distribuição tecidular,
ce-lular e subcece-lular, sugerem a possibilidade de
desen-volver compostos capazes de inibir especificamente
uma determinada isoenzima, expressa de forma
pre-dominante num determinado tecido ou célula e
asso-ciada a determinadas funções fisiológicas e também,
por inferência, a determinadas patologias
6.
Os inibidores das PDE classificam-se como seletivos
quando inibem predominantemente uma única
famí-lia de PDE e como não seletivos quando inibem, com
uma seletividade semelhante, duas ou mais famílias
de PDE. Embora ambos os tipos de inibidores se
uti-lizem na terapêutica farmacológica, os inibidores
se-letivos apresentam, em geral, um perfil mais favorável
de efeitos adversos.
Na última década, o potencial dos inibidores das PDE
na terapêutica farmacológica de diversas patologias
tem suscitado um grande interesse por parte da
dústria farmacêutica, tendo sido sintetizado um
gran-de número gran-de inibidores relativamente potentes
(efi-cazes em concentrações nanomolar e subnanomolar) e
seletivos (inibição de uma única família de PDE).
O sucesso clínico e comercial de vários
medicamen-tos utilizados no tratamento da disfunção erétil, tais
como o Viagra®, o Cialis® e o Levitra®, cujos
prin-cípios ativos (sildenafil, tadalafil e vardenafil,
res-petivamente) são inibidores das PDE5, constitui o
exemplo mais mediático do potencial destas enzimas
como alvos da terapêutica farmacológica. A
hiper-tensão arterial pulmonar, a insuficiência cardíaca, a
doença pulmonar obstrutiva crónica, a asma e a
clau-dicação intermitente constituem outros exemplos de
indicações terapêuticas atualmente autorizadas para
os inibidores das PDE.
As PDE constituem uma superfamília de isoenzimas
com um elevado potencial para o desenvolvimento de
novas terapêuticas farmacológicas, sendo,
atualmen-te, os inibidores das PDE uma classe farmacológica
sujeita a intensa investigação científica em vários
domínios da medicina, como a cardiologia
4,7-9, a
der-matologia
10, a gastrenterologia
11,12, a nefrologia
13, a
neurologia
14-17, a hemato-oncologia
18, a obstetrícia
19,
a pneumologia
20-23, a psiquiatria
24-26, a
reumatolo-gia
27,28e a urologia
29-33.
Métodos
Foi efetuada uma revisão da literatura científica,
atra-vés de pesquisa bibliográfica na base de dados MeSH
(Medical Subject Headings) da PubMed, utilizando
os termos «cyclic nucleotide phosphodiesterases»
e «phosphodiesterase inhibitors», para a obtenção
de referências bibliográficas publicadas, em língua
inglesa, desde 1998 até julho de 2011. Esta pesquisa
bibliográfica foi realizada em agosto de 2011. Nesta
revisão bibliográfica foram incluídos todos os artigos
que fizessem referência a uma indicação clínica, ou
potencial indicação clínica, dos inibidores das PDE já
disponíveis no mercado farmacêutico mundial e/ou
em fase de investigação clínica (fase I, II, III ou IV).
Foram excluídos os artigos que não tinham como
ob-jeto principal da investigação o estudo da utilização,
ou potencial utilização, de um inibidor das PDE numa
determinada indicação clínica. Foram igualmente
ex-cluídos os artigos em que os autores reportaram a
ob-tenção de resultados negativos, isto é, resultados sem
qualquer benefício clínico potencial.
Foram ainda consultadas as bases de dados de
medi-camentos da Autoridade Nacional do Medicamento
e Produtos de Saúde, I. P. (INFARMED), da
Euro-pean Medicines Agency (EMA) e da Food and Drug
Administration (FDA), para pesquisa dos inibidores
das PDE autorizados para utilização na prática
clíni-ca e análise do resumo das clíni-característiclíni-cas do mediclíni-ca-
medica-mento (RCM) destes medicamedica-mentos.
Resultados
A pesquisa bibliográfica efetuada conduziu à
obten-ção de 158 artigos, dos quais 42 foram excluídos por
não cumprirem com os critérios de inclusão definidos
e/ou se encontrarem abrangidos pelos critérios de
exclusão mencionados. Destes 42 artigos não
inclu-ídos, 18 foram excluídos por não terem como objeto
principal da investigação o estudo da utilização, ou
potencial utilização, de um inibidor das PDE numa
determinada indicação clínica; dez foram excluídos
por consistirem fundamentalmente em estudos de
farmacocinética; 12 foram excluídos por consistirem
em estudos de interação medicamento-medicamento;
dois foram excluídos por mencionarem,
inequivoca-mente, a obtenção de resultados negativos.
Atualmente, encontram-se disponíveis no mercado
farmacêutico mundial 15 inibidores seletivos das PDE
(Tabela 1). A PDE3 é a família de PDE que possui,
atualmente, mais inibidores seletivos autorizados na
prática clínica (oito princípios ativos), os quais
in-cluem compostos com propriedades cardiotónicas,
vasodilatadoras e antitrombóticas. De acordo com
diversos autores, a inibição da PDE3A resulta na
esti-mulação da contractilidade do miocárdio, inibição da
agregação plaquetária, relaxamento do músculo liso
vascular e brônquico e inibição da maturação
ooci-tária
34,35. Por outro lado, a inibição da PDE3B origina
inibição da ação antilipolítica da insulina e
potencia-ção da secrepotencia-ção de insulina
35,36. A possibilidade de
desenvolver inibidores seletivos para as subfamílias
de PDE permite antever o potencial dos inibidores
das isoformas PDE3B no tratamento da obesidade e
da diabetes
mellitus tipo 2
35,37,38.
A PDE5 é a segunda família de PDE com mais
inibi-dores seletivos autorizados na prática clínica (cinco
princípios ativos), que apresentam propriedades
va-sodilatadoras e têm indicação no tratamento da
dis-função erétil e/ou na hipertensão arterial pulmonar.
A PDE1 e a PDE10 apresentam, cada uma delas, um
único inibidor seletivo autorizado na prática clínica,
a vinpocetina e a papaverina, respetivamente. De
refe-rir, no entanto, que o efeito espasmolítico do músculo
liso por parte da papaverina não se deve unicamente à
inibição da PDE10, devendo também estar envolvidas
outras PDE (particularmente a PDE4), donde resulta
um aumento dos nucleótidos cíclicos, responsável pelo
relaxamento da musculatura lisa. Além da inibição das
PDE, está também descrito um mecanismo de ação que
envolve a inibição da fosforilação oxidativa
39,40.
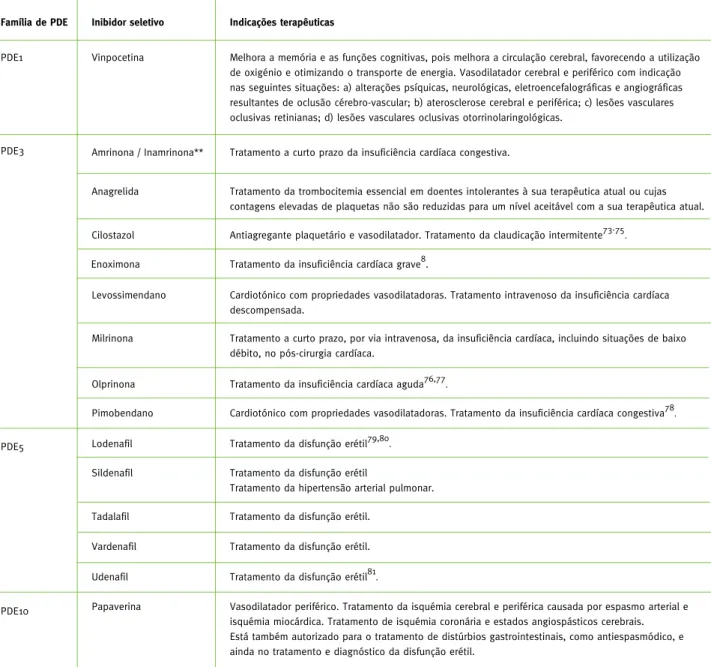
30Tabela 1 - Inibidores seletivos das PDE utilizados na terapêutica farmacológica e respetivas indicações
terapêuticas autorizadas
70-72*
Família de PDE PDE1
Inibidor seletivo Indicações terapêuticas
Vinpocetina Melhora a memória e as funções cognitivas, pois melhora a circulação cerebral, favorecendo a utilização de oxigénio e otimizando o transporte de energia. Vasodilatador cerebral e periférico com indicação nas seguintes situações: a) alterações psíquicas, neurológicas, eletroencefalográficas e angiográficas resultantes de oclusão cérebro-vascular; b) aterosclerose cerebral e periférica; c) lesões vasculares oclusivas retinianas; d) lesões vasculares oclusivas otorrinolaringológicas.
PDE3 Amrinona / Inamrinona** Tratamento a curto prazo da insuficiência cardíaca congestiva.
Anagrelida Tratamento da trombocitemia essencial em doentes intolerantes à sua terapêutica atual ou cujas contagens elevadas de plaquetas não são reduzidas para um nível aceitável com a sua terapêutica atual. Cilostazol Antiagregante plaquetário e vasodilatador. Tratamento da claudicação intermitente73-75.
Levossimendano Cardiotónico com propriedades vasodilatadoras. Tratamento intravenoso da insuficiência cardíaca descompensada.
Milrinona Tratamento a curto prazo, por via intravenosa, da insuficiência cardíaca, incluindo situações de baixo débito, no pós-cirurgia cardíaca.
Olprinona Tratamento da insuficiência cardíaca aguda76,77.
Pimobendano Cardiotónico com propriedades vasodilatadoras. Tratamento da insuficiência cardíaca congestiva78.
Lodenafil Tratamento da disfunção erétil79,80.
PDE5
Sildenafil Tratamento da disfunção erétil
Tratamento da hipertensão arterial pulmonar. Tadalafil Tratamento da disfunção erétil.
Vardenafil Tratamento da disfunção erétil. Udenafil Tratamento da disfunção erétil81.
Papaverina Vasodilatador periférico. Tratamento da isquémia cerebral e periférica causada por espasmo arterial e isquémia miocárdica. Tratamento de isquémia coronária e estados angiospásticos cerebrais. Está também autorizado para o tratamento de distúrbios gastrointestinais, como antiespasmódico, e ainda no tratamento e diagnóstico da disfunção erétil.
PDE10
* A informação contida nesta tabela foi retirada dos sítios Internet do INFARMED, da EMA ou da FDA, exceto nas situações em que está especificamente assinalada uma referência bibliográfica.
** A amrinona (Inocor®, solução injetável) já teve AIM em Portugal, mas foi revogada em fevereiro de 2002. A sua utilização continua, no entanto, autorizada nos Estados Unidos, embora com a designação de inamrinona. A mudança de designação de amrinona para inamrinona ocorreu em 1 de julho de 2000 e deveu-se a questões de segurança, de modo a evitar possíveis confusões a amiodarona82.
Relativamente aos inibidores não seletivos das PDE,
encontram-se disponíveis na terapêutica
farmacoló-gica sete compostos (Tabela 2).
Dos sete inibidores não seletivos das PDE
disponí-veis no mercado farmacêutico mundial, cinco são
de-rivados da xantina (aminofilina, cafeína, diprofilina,
pentoxifilina e teofilina). A aminofilina, a diprofilina
e a teofilina são utilizadas na terapêutica
farmacoló-gica devido às suas propriedades broncodilatadoras,
a cafeína devido às suas propriedades estimulantes do
SNC e respiratórias e a pentoxifilina devido ao facto
de melhorar o fluxo sanguíneo capilar em
consequên-cia do aumento da deformabilidade dos eritrócitos
e da redução da viscosidade do sangue. Os outros
dois inibidores não seletivos são o dipiridamol e o
ibudilast, ambos com propriedades vasodilatadoras
e inibidoras da agregação plaquetária, possuindo,
ainda, o ibudilast propriedades broncodilatadoras
Enoximona Tratamento da insuficiência cardíaca grave8.
Tabela 2 - Inibidores não seletivos das PDE utilizados na terapêutica farmacológica e respetivas indicações
terapêuticas autorizadas
70-72*
Inibidor não seletivo das PDE
Aminofilina
(atua a nível celular após metabolização em teofilina)
Indicações terapêuticas Broncodilatador.
Tratamento sintomático do broncospasmo agudo. Tratamento sintomático da asma brônquica e DPOC.
Redução do broncospasmo grave em crianças com fibrose quística.
Cafeína Estimulante do SNC.
Estimulante respiratório, sobretudo em neonatologia, em situações de apneia.
Diprofilina / Difilina Broncodilatador.
Tratamento sintomático da asma brônquica e broncospasmo reversível associado a bronquite crónica e enfisema.
Pentoxifilina Tratamento de claudicação intermitente devido perturbações circulatórias arteriais e arteriovenosas de origem arteriosclerótica ou diabética.
Tratamento de perturbações oculares e auditivas associadas a processos vasculares degenerativos com baixa da visão e da audição.
Tratamento de perturbações circulatórias cerebrais consecutivas a esclerose e acidente vascular cerebral, tais como redução da concentração e da memória, vertigens, cefaleias, alterações do sono e zumbidos.
Teofilina Broncodilatador.
Tratamento sintomático do broncospasmo.
Profilaxia e tratamento sintomático da asma e do broncospasmo reversível associado à bronquite crónica e enfisema.
Dipiridamol Vasodilatador coronário e inibidor da agregação plaquetária, especialmente como adjuvante dos anticoagulantes orais na profilaxia do tromboembolismo associado a próteses valvulares cardíacas. Ibudilast Vasodilatador, broncodilatador e inibidor da agregação plaquetária.
Tratamento do acidente vascular cerebral isquémico e da asma brônquica83.
* A informação contida nesta tabela foi retirada dos sítios Internet do INFARMED, da EMA ou da FDA, exceto nas situações em que está especificamente assinalada uma referência bibliográfica.
utilizadas no tratamento da asma brônquica.
Estu-dos recentes revelaram que o ibudilast tem também
propriedades neuroprotectoras e antidemência
41,42,
apresentando potencial para o tratamento da
escle-rose múltipla
43,44e da doença de Krabbe
45. No que
respeita ao dipiridamol, este tem sido estudado na
prevenção do acidente vascular cerebral em
associa-ção com outros antiagregantes plaquetários, como o
ácido acetilsalicílico
46e o clopidogrel
47.
Nem todos os inibidores das PDE utilizados na
tera-pêutica farmacológica se encontram disponíveis em
Portugal. Na Tabela 3 encontram-se representados
os inibidores das PDE autorizados pelo INFARMED,
pela EMA e pela FDA.
A PDE4 é uma das famílias de PDE em que a
investi-gação para a obtenção de inibidores seletivos é mais
acentuada, apresentando estes um elevado potencial
de utilização na terapêutica de diversas doenças
in-flamatórias e autoimunes, como a asma, a DPOC
48,
a esclerose múltipla
49,50, a artrite reumatoide
51-53, a
doença de Crohn, a colite ulcerativa
54,55, a psoríase
e outras patologias dermatológicas
56. Demonstraram
também potencial clínico em patologias do sistema
ner-voso central (SNC), incluindo a depressão
25, a perda de
memória
57e a doença de Alzheimer
25,58.
Os inibidores da PDE5 já autorizados na prática
clíni-ca, sobretudo o sildenafil, do qual se dispõe de mais
in-formação, são atualmente alvo de intensa investigação
tendo em vista a sua utilização noutras patologias além
das já autorizadas, sendo de salientar as áreas
cardiovas-cular, urológica, neurológica e oncológica. Os inibidores
da PDE10 são atualmente investigados tendo em vista
o tratamento de doenças neuropsiquiátricas, sobretudo
da esquizofrenia, podendo também vir a ser utilizados
no tratamento da obesidade, da síndrome metabólica,
da diabetes
mellitus tipo 2 e da intolerância à glucose, a
avaliar mais pelo elevado número de patentes registadas
do que pelos resultados divulgados. Nos últimos anos
foram registadas cerca de 30 patentes de compostos que
apresentam propriedades inibitórias da PDE10A
59,
algu-mas das quais dizem respeito à utilização de inibidores
da PDE10A no tratamento do cancro
60-63e no
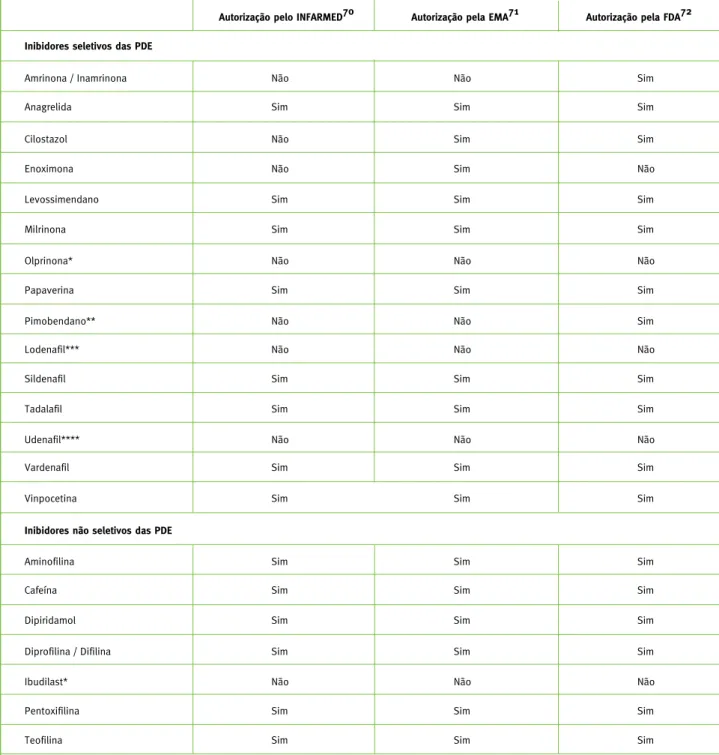
trata-32Tabela 3 - Inibidores das PDE autorizados para utilização na prática clínica pelo INFARMED, pela EMA e pela FDA
Autorização pelo INFARMED70
Autorização pela EMA71 Autorização pela FDA72 Inibidores seletivos das PDE
Amrinona / Inamrinona Não Não Sim
Anagrelida Sim Sim Sim
Cilostazol Não Sim Sim
Enoximona Não Sim Não
Levossimendano Sim Sim Sim
Milrinona
Não Não Não
Olprinona*
Sim Sim
Sim
Papaverina Sim Sim Sim
Pimobendano** Não Não Sim
Lodenafil*** Não Não Não
Sildenafil Sim Sim Sim
Tadalafil Sim Sim Sim
Udenafil**** Não Não Não
Vardenafil Sim Sim Sim
Inibidores não seletivos das PDE
Aminofilina Sim Sim Sim
Sim Sim
Sim Cafeína
Dipiridamol Sim Sim Sim
Diprofilina / Difilina Sim Sim Sim
Ibudilast* Não Não Não
Pentoxifilina Sim Sim Sim
Teofilina Sim Sim Sim
* Autorizado para utilização na terapêutica farmacológica humana no Japão77.
** Autorizado pela FDA apenas para utilização na terapêutica farmacológica veterinária72, estando autorizado no Japão também para utilização na terapêutica farmacológica humana78.
*** Autorizado para utilização na terapêutica farmacológica humana no Brasil84. **** Autorizado para utilização na terapêutica farmacológica humana na Coreia do Sul85.
mento de doenças neurodegenerativas, em particular
da doença de Parkinson
64,65.
De mencionar ainda a investigação em curso com
o objetivo de desenvolver um inibidor seletivo da
PDE9 com potencial para o tratamento da doença de
Alzheimer
66,67e de utilizar as propriedades
relaxan-tes do músculo liso da vinpocetina no tratamento de
outras patologias
68,69.
Conclusões
Existem atualmente no mercado farmacêutico
ini-bidores das PDE utilizados como cardiotónicos,
re-Vinpocetina Sim Sim Sim
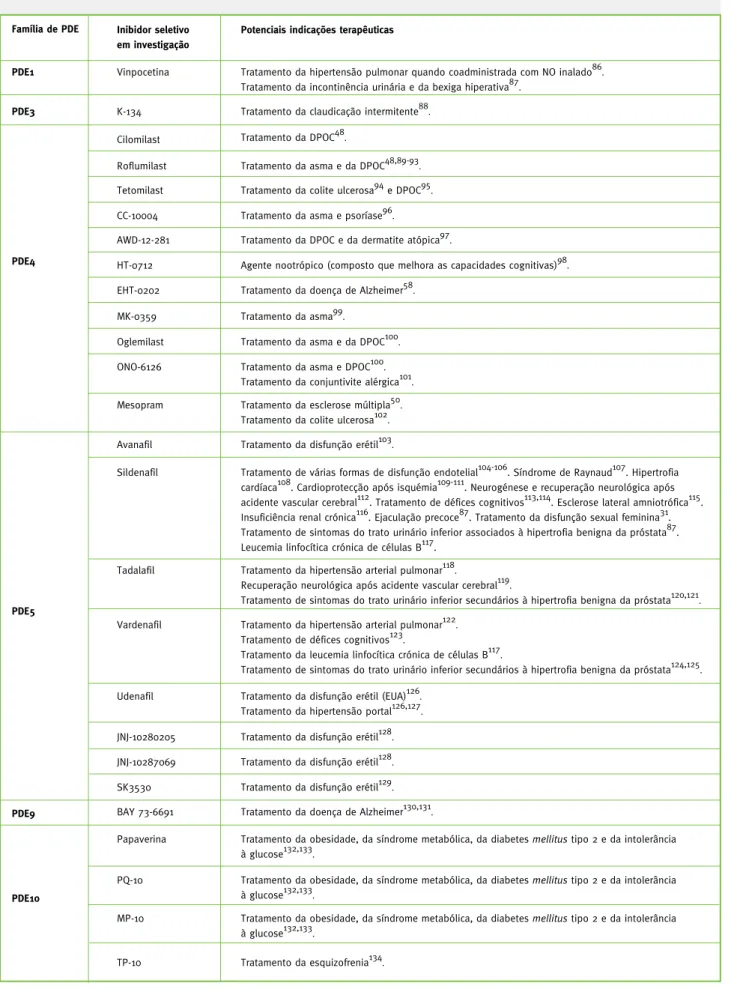
Tabela 4 - Inibidores seletivos das PDE que se encontram atualmente em fase investigação.
Família de PDE PDE1 Inibidor seletivo em investigaçãoPotenciais indicações terapêuticas
Tratamento da hipertensão pulmonar quando coadministrada com NO inalado86.
Tratamento da incontinência urinária e da bexiga hiperativa87.
Vinpocetina
PDE3 K-134 Tratamento da claudicação intermitente88.
PDE4
Cilomilast Tratamento da DPOC48.
Roflumilast Tratamento da asma e da DPOC48,89-93.
Tetomilast Tratamento da colite ulcerosa94 e DPOC95.
CC-10004 Tratamento da asma e psoríase96.
AWD-12-281 Tratamento da DPOC e da dermatite atópica97.
HT-0712 Agente nootrópico (composto que melhora as capacidades cognitivas)98.
EHT-0202 Tratamento da doença de Alzheimer58.
MK-0359 Tratamento da asma99.
Oglemilast Tratamento da asma e da DPOC100.
ONO-6126 Tratamento da asma e DPOC100.
Tratamento da conjuntivite alérgica101.
Mesopram Tratamento da esclerose múltipla50.
Tratamento da colite ulcerosa102.
PDE5
Avanafil Tratamento da disfunção erétil103.
Sildenafil Tratamento de várias formas de disfunção endotelial104-106. Síndrome de Raynaud107. Hipertrofia cardíaca108. Cardioprotecção após isquémia109-111. Neurogénese e recuperação neurológica após acidente vascular cerebral112. Tratamento de défices cognitivos113,114. Esclerose lateral amniotrófica115. Insuficiência renal crónica116. Ejaculação precoce87. Tratamento da disfunção sexual feminina31. Tratamento de sintomas do trato urinário inferior associados à hipertrofia benigna da próstata87. Leucemia linfocítica crónica de células B117.
Tadalafil Tratamento da hipertensão arterial pulmonar118.
Recuperação neurológica após acidente vascular cerebral119.
Tratamento de sintomas do trato urinário inferior secundários à hipertrofia benigna da próstata120,121.
Vardenafil Tratamento da hipertensão arterial pulmonar122.
Tratamento de défices cognitivos123.
Tratamento da leucemia linfocítica crónica de células B117.
Tratamento de sintomas do trato urinário inferior secundários à hipertrofia benigna da próstata124,125.
Udenafil Tratamento da disfunção erétil (EUA)126.
Tratamento da hipertensão portal126,127.
JNJ-10280205 Tratamento da disfunção erétil128.
JNJ-10287069 Tratamento da disfunção erétil128.
SK3530 Tratamento da disfunção erétil129.
BAY 73-6691 Tratamento da doença de Alzheimer130,131.
PDE9
Papaverina Tratamento da obesidade, da síndrome metabólica, da diabetes mellitus tipo 2 e da intolerância à glucose132,133.
PDE10
Tratamento da obesidade, da síndrome metabólica, da diabetes mellitus tipo 2 e da intolerância à glucose132,133.
PQ-10
Tratamento da obesidade, da síndrome metabólica, da diabetes mellitus tipo 2 e da intolerância à glucose132,133.
MP-10
Tratamento da esquizofrenia134.
TP-10
laxantes do músculo liso vascular e brônquico,
anti-trombóticos, anti-inflamatórios e antidepressivos. Os
inibidores não seletivos (por exemplo, aminofilina, cafeína,
pentoxifilina, teofilina) apresentam, em geral, um perfil
de efeitos adversos menos favorável que os inibidores
seletivos. Os inibidores das PDE3 têm sido
principal-mente utilizados como cardiotónicos, vasodilatadores e
antitrombóticos, os inibidores das PDE4s como
bronco-dilatadores e antiasmáticos e os inibidores das PDE5 no
tratamento da disfunção erétil e da hipertensão
pulmo-nar. Embora os inibidores das PDE das famílias 3, 4 e 5
sejam os mais estudados e disponíveis, existem também
inibidores seletivos de isoenzimas de outras famílias
com grande interesse na terapêutica farmacológica.
As
doenças
cardiovasculares,
inflamatórias,
neurodegenerativas e oncológicas, a diabetes
mellitus
tipo 2 e a obesidade constituem potenciais alvos da
te-rapêutica farmacológica utilizando inibidores seletivos
das PDE. Doenças que, na sua grande maioria, têm em
comum o facto de serem características do
envelheci-mento, da civilização ocidental e do século XXI e que
permitem antever o elevado potencial clínico e
comer-cial dos inibidores das PDE.
Referências Bibliográficas
1. Glavas NA, Ostenson C, Schaefer JB, Vasta V, Beavo JA. T cell ac-tivation up-regulates cyclic nucleotide phosphodiesterases 8A1 and 7A3. Proc Natl Acad Sci U S A. 2001 Mai 22;98(11):6319-24. 2. Gupta R, Kumar G, Kumar RS. An update on cyclic nucleo-tide phosphodiesterase (PDE) inhibitors: phosphodiesterases and drug selectivity. Methods Find Exp Clin Pharmacol. 2005 Mar;27(2):101-18.
3. Lugnier C. Cyclic nucleotide phosphodiesterase (PDE) superfami-ly: a new target for the development of specific therapeutic agents. Pharmacol Ther. 2006 Mar;109(3):366-98.
4. Omori K, Kotera J. Overview of PDEs and their regulation. Circ Res. 2007 Fev 16;100(3):309-27.
5. Soderling SH, Beavo JA. Regulation of cAMP and cGMP signaling: new phosphodiesterases and new functions. Curr Opin Cell Biol. 2000 Abr;12(2):174-9.
6. Conti M, Beavo J. Biochemistry and physiology of cyclic nucleo-tide phosphodiesterases: essential components in cyclic nucleonucleo-tide signaling. Annu Rev Biochem. 2007;76:481-511.
7. Lehnart SE, Marks AR. Phosphodiesterase 4D and heart failure: a cautionary tale. Expert Opin Ther Targets. 2006 Out;10(5):677-88. 8. Feldman AM, Oren RM, Abraham WT, Boehmer JP, Carson PE, Ei-chhorn E, et al. Low-dose oral enoximone enhances the ability to wean patients with ultra-advanced heart failure from intravenous inotropic support: results of the oral enoximone in intravenous inotrope-depen-dent subjects trial. American heart journal. 2007 Nov;154(5):861-9. 9. Angiolillo DJ, Capranzano P, Ferreiro JL, Ueno M, Capodanno D, Dharmashankar K, et al. Impact of adjunctive cilostazol therapy on platelet function profiles in patients with and without diabetes
mellitus on aspirin and clopidogrel therapy. Thromb Haemost. 2011 Ago;106(2):253-62.
10. Gottlieb AB, Strober B, Krueger JG, Rohane P, Zeldis JB, Hu CC, et al. An open-label, single-arm pilot study in patients with severe plaque-type psoriasis treated with an oral anti-inflammatory agent, apremilast. Curr Med Res Opin. 2008 Mai;24(5):1529-38.
11. Ichikawa H, Okamoto S, Kamada N, Nagamoto H, Kitazume MT, Kobayashi T, et al. Tetomilast suppressed production of proin-flammatory cytokines from human monocytes and ameliorated chronic colitis in IL-10-deficient mice. Inflamm Bowel Dis. 2008 Jul 10;14(11):1483-90.
12. Bremer HC, Kreisel W, Roecker K, Dreher M, Koenig D, Kurz-Schmieg AK, et al. Phosphodiesterase 5 inhibitors lower both portal and pulmonary pressure in portopulmonary hypertension: a case re-port. J Med Case Reports. 2007;1:46.
13. Cheng J, Grande JP. Cyclic nucleotide phosphodiesterase (PDE) inhibitors: novel therapeutic agents for progressive renal disease. Exp Biol Med (Maywood). 2007 Jan;232(1):38-51.
14. Gong B, Vitolo OV, Trinchese F, Liu S, Shelanski M, Arancio O. Persistent improvement in synaptic and cognitive functions in an Alzheimer mouse model after rolipram treatment. J Clin Invest. 2004 Dez;114(11):1624-34.
15. Puzzo D, Sapienza S, Arancio O, Palmeri A. Role of phosphodies-terase 5 in synaptic plasticity and memory. Neuropsychiatr Dis Tre-at. 2008 Abr;4(2):371-87.
16. Wirtz-Brugger F, Giovanni A. Guanosine 3’,5’-cyclic monophos-phate mediated inhibition of cell death induced by nerve growth factor withdrawal and beta-amyloid: protective effects of propento-fylline. Neuroscience. 2000;99(4):737-50.
17. Kamal AK, Naqvi I, Husain MR, Khealani BA. Cilostazol versus aspirin for secondary prevention of vascular events after stroke of arterial origin. Cochrane Database Syst Rev. 2011(1):CD008076. 18. Lerner A, Epstein PM. Cyclic nucleotide phosphodiesterases as targets for treatment of haematological malignancies. Biochem J. 2006 Jan 1;393(Pt 1):21-41.
19. Jensen JT, Zelinski MB, Stanley JE, Fanton JW, Stouffer RL. The phosphodiesterase 3 inhibitor ORG 9935 inhibits oocyte maturation in the naturally selected dominant follicle in rhesus macaques. Con-traception. 2008 Abr;77(4):303-7.
20. Grootendorst DC, Gauw SA, Verhoosel RM, Sterk PJ, Hospers JJ, Bredenbroker D, et al. Reduction in sputum neutrophil and eosi-nophil numbers by the PDE4 inhibitor roflumilast in patients with COPD. Thorax. 2007 Dez;62(12):1081-7.
21. van Schalkwyk E, Strydom K, Williams Z, Venter L, Leichtl S, Schmid-Wirlitsch C, et al. Roflumilast, an oral, once-daily phospho-diesterase 4 inhibitor, attenuates allergen-induced asthmatic reac-tions. J Allergy Clin Immunol. 2005 Ago;116(2):292-8.
22. Trachte AL, Lobato EB, Urdaneta F, Hess PJ, Klodell CT, Martin TD, et al. Oral sildenafil reduces pulmonary hypertension after cardiac surgery. Ann Thorac Surg. 2005 Jan;79(1):194-7 (discussion -7). 23. Zeng WJ, Lu XL, Xiong CM, Shan GL, Liu ZH, Ni XH, et al. The effi-cacy and safety of sildenafil in patients with pulmonary arterial hyper-tension associated with the different types of congenital heart disease. Clin Cardiol. 2011 Ago;34(8):513-8.
24. Kanes SJ, Tokarczyk J, Siegel SJ, Bilker W, Abel T, Kelly MP. Rolipram: a specific phosphodiesterase 4 inhibitor with potential antipsychotic activity. Neuroscience. 2007 Jan 5;144(1):239-46. 25. Halene TB, Siegel SJ. PDE inhibitors in psychiatry--future op-tions for dementia, depression and schizophrenia? Drug discovery today. 2007 Out;12(19-20):870-8.
26. Adan A, Serra-Grabulosa JM. Effects of caffeine and glucose, alo-ne and combialo-ned, on cognitive performance. Hum Psychopharma-col. 2010 Jun;25(4):310-7.
27. Jeon YH, Heo YS, Kim CM, Hyun YL, Lee TG, Ro S, et al. Phosphodiesterase: overview of protein structures, potential thera-peutic applications and recent progress in drug development. Cell Mol Life Sci. 2005 Jun;62(11):1198-220.
28. Brueckner CS, Becker MO, Kroencke T, Huscher D, Scherer HU, Worm M, et al. Effect of sildenafil on digital ulcers in systemic scle-rosis: analysis from a single centre pilot study. Ann Rheum Dis. 2010 Ago;69(8):1475-8.
29. Becker AJ, Uckert S, Stief CG. [The basics of phosphodiesterase type 5 (PDE5) inhibition in urology.]. Urologe A. 2008 Out 16. 30. Uckert S, Stief CG, Mayer M, Jonas U, Hedlund P. Distribu-tion and funcDistribu-tional significance of phosphodiesterase isoenzymes in the human lower urinary tract. World journal of urology. 2005 Dez;23(6):368-73.
31. Mayer M, Stief CG, Truss MC, Uckert S. Phosphodiesterase inhi-bitors in female sexual dysfunction. World journal of urology. 2005 Dez;23(6):393-7.
32. Gokce A, Halis F, Demirtas A, Ekmekcioglu O. The effects of three phosphodiesterase type 5 inhibitors on ejaculation latency time in lifelong premature ejaculators: a double-blind laboratory set-ting study. BJU Int. 2011 Abr;107(8):1274-7.
33. Aydogdu O, Gokce MI, Burgu B, Baltaci S, Yaman O. Tadalafil rehabilitation therapy preserves penile size after bilateral nerve sparing radical retropubic prostatectomy. Int Braz J Urol. 2011 Mai-Jun;37(3):336-44 (discussion 44-6).
34. Shakur Y, Holst LS, Landstrom TR, Movsesian M, Degerman E, Manganiello V. Regulation and function of the cyclic nucleotide phosphodiesterase (PDE3) gene family. Prog Nucleic Acid Res Mol Biol. 2001;66:241-77.
35. Degerman E, Manganiello V. Phosphodiesterase 3B: An Im-portant Regulator of Energy Homeostasis. In: Beavo J, Francis S, Houslay M, editors. Cyclic Nucleotide Phosphodiesterases in Health and Disease. Boca Raton: CRC Press, Taylor & Francis Group; 2007. p. 79-97.
36. Eriksson H, Ridderstrale M, Degerman E, Ekholm D, Smith CJ, Manganiello VC, et al. Evidence for the key role of the adipocyte cGMP-inhibited cAMP phosphodiesterase in the antilipolytic ac-tion of insulin. Biochim Biophys Acta. 1995 Abr 6;1266(1):101-7. 37. Pyne NJ, Furman BL. Cyclic nucleotide phosphodiesterases in pancreatic islets. Diabetologia. 2003 Set;46(9):1179-89.
38. Furman B, Pyne N, Flatt P, O’Harte F. Targeting beta-cell cyclic 3’5’ adenosine monophosphate for the development of novel drugs for treating type 2 diabetes mellitus. A review. J Pharm Pharmacol. 2004 Dez;56(12):1477-92.
39. Shimizu K, Ichikawa T, Urakawa N, Nakajyo S. Inhibitory me-chanism of papaverine on the smooth muscle of guinea pig urinary bladder. Jpn J Pharmacol. 2000 Jun;83(2):143-9.
40. Shimizu K, Yoshihara E, Takahashi M, Gotoh K, Orita S, Urakawa N, et al. Mechanism of relaxant response to papaverine on the smooth muscle of non-pregnant rat uterus. J Smooth Muscle Res. 2000 Jun;36(3):83-91.
41. Mizuno T, Kurotani T, Komatsu Y, Kawanokuchi J, Kato H, Mit-suma N, et al. Neuroprotective role of phosphodiesterase inhibitor ibudilast on neuronal cell death induced by activated microglia. Neuropharmacology. 2004 Mar;46(3):404-11.
42. Wakita H, Tomimoto H, Akiguchi I, Lin JX, Ihara M, Ohtani R, et al. Ibudilast, a phosphodiesterase inhibitor, protects against whi-te matwhi-ter damage under chronic cerebral hypoperfusion in the rat. Brain Res. 2003 Nov 28;992(1):53-9.
43. Feng J, Misu T, Fujihara K, Sakoda S, Nakatsuji Y, Fukaura H, et al. Ibudilast, a nonselective phosphodiesterase inhibitor, regula-tes Th1/Th2 balance and NKT cell subset in multiple sclerosis. Mult Scler. 2004 Out;10(5):494-8.
44. Barkhof F, Hulst HE, Drulovic J, Uitdehaag BM, Matsuda K, Landin R. Ibudilast in relapsing-remitting multiple sclerosis: a neu-roprotectant? Neurology. 2010 Mar 30;74(13):1033-40.
45. Kagitani-Shimono K, Mohri I, Fujitani Y, Suzuki K, Ozono K, Urade Y, et al. Anti-inflammatory therapy by ibudilast, a phospho-diesterase inhibitor, in demyelination of twitcher, a genetic demyeli-nation model. J Neuroinflammation. 2005 Abr 6;2(1):10.
46. Uchiyama S, Ikeda Y, Urano Y, Horie Y, Yamaguchi T. The Japa-nese aggrenox (extended-release dipyridamole plus aspirin) stroke prevention versus aspirin programme (JASAP) study: a randomi-zed, double-blind, controlled trial. Cerebrovascular diseases (Basel, Switzerland). 2011;31(6):601-13.
47. Sprigg N, Gray LJ, England T, Willmot MR, Zhao L, Sare GM, et al. A randomised controlled trial of triple antiplatelet therapy (aspirin, clopidogrel and dipyridamole) in the secondary prevention of stroke: safety, tolerability and feasibility. PloS one. 2008;3(8):e2852. 48. Lipworth BJ. Phosphodiesterase-4 inhibitors for asthma and chronic obstructive pulmonary disease. Lancet. 2005 Jan 8-14;365(9454):167-75.
49. Dyke HJ, Montana JG. Update on the therapeutic potential of PDE4 inhibitors. Expert Opin Investig Drugs. 2002 Jan;11(1):1-13.
50. Dinter H, Tse J, Halks-Miller M, Asarnow D, Onuffer J, Faulds D, et al. The type IV phosphodiesterase specific inhibitor mesopram inhibits ex-perimental autoimmune encephalomyelitis in rodents. J Neuroimmunol. 2000 Ago 1;108(1-2):136-46.
51. Burnouf C, Pruniaux MP. Recent advances in PDE4 inhibitors as immunoregulators and anti-inflammatory drugs. Curr Pharm Des. 2002;8(14):1255-96.
52. Hogan CJ, Fang GD, Scheld WM, Linden J, Diduch DR. Inhibiting the inflammatory response in joint sepsis. Arthroscopy. 2001 Mar;17(3):311-5. 53. Francischi JN, Yokoro CM, Poole S, Tafuri WL, Cunha FQ, Teixeira MM. Anti-inflammatory and analgesic effects of the phosphodiesterase 4 inhibitor rolipram in a rat model of arthritis. Eur J Pharmacol. 2000 Jul 7;399(2-3):243-9.
54. Keshavarzian A, Mutlu E, Guzman JP, Forsyth C, Banan A. Phos-phodiesterase 4 inhibitors and inflammatory bowel disease: emer-ging therapies in inflammatory bowel disease. Expert Opin Investig Drugs. 2007 Set;16(9):1489-506.
55. Videla S, Vilaseca J, Medina C, Mourelle M, Guarner F, Salas A, et al. Selective inhibition of phosphodiesterase-4 ameliorates chronic colitis and prevents intestinal fibrosis. The Journal of pharmacology and experimental therapeutics. 2006 Fev;316(2):940-5.
56. Baumer W, Hoppmann J, Rundfeldt C, Kietzmann M. Highly selective phosphodiesterase 4 inhibitors for the treatment of aller-gic skin diseases and psoriasis. Inflamm Allergy Drug Targets. 2007 Mar;6(1):17-26.
57. Zhang HT, Crissman AM, Dorairaj NR, Chandler LJ, O’Donnell JM. Inhibition of cyclic AMP phosphodiesterase (PDE4) reverses memory deficits associated with NMDA receptor antagonism. Neu-ropsychopharmacology. 2000 Ago;23(2):198-204.
58. Vellas B, Sol O, Snyder PJ, Ousset PJ, Haddad R, Maurin M, et al. EHT0202 in Alzheimer’s disease: a 3-month, randomized, placebo-controlled, double-blind study. Current Alzheimer research. 2011 Mar;8(2):203-12.
59. Kehler J, Ritzén A, Greve DR. The potential therapeutic use of phosphodiesterase 10 inhibitors. Expert Opin Investig Patents. 2007;17(2):147-58.
60. Zhang C, Fan D, Wang Y, Li T, Boyer SJ, Burke J, et al., inventors; Bayer, assignee. 2-Substituted Pyrrolo[2.1-a]dihydroisoquinoline Against Cancer. World Patent WO/2003/051877. Jun 3, 2003. Ale-manha 2003 03.06.2003.
61. Niewöhner U, Bauser M, Ergüden J, Flubacher D, Naab P, Repp T, et al., inventors; Bayer, assignee. 3-Substituted Pyrrolo[2.1-a] dihydroisoquinolines Derivatives. World Patent WO/2003/014117. Fev 20, 2003. Alemanha 2003 20.02.2003.
62. Niewöhner U, Bauser M, Ergüden J, Flubacher D, Naab P, Repp T, et al., inventors; Bayer, assignee. Pyrrolo[2.1-a]dihydroisoquinolines and Their Use as Phosphodiesterase10A Inhibitors. World Patent WO/2002/048144. Jun 20, 2002. Alemanha 2002 20.06.2002. 63. Vennemann M, Baer T, Braunger J, Gekeler V, Gimmnich P, Contreras J, et al., inventors; Altana Pharma AG, assignee. Novel Pyrrolodihydroisoquinolines Useful in the Treatment of Cancer. World Patent WO/2005/003130. Jan 13, 2005. Alemanha 2005 13.01.2005. 64. Nagasawa M, Mackenzie SJ, inventors; Kyorin Pharmaceutical CO., LTD., assignee. Phosphodiesterase10A Inhibitors. World Pa-tent WO/2004/050091. Jun 17, 2004. Japão 2004 17.06.2004. 65. Niewöhner U, Ergüden J, Bauser M, Burkhardt N, Flubacher D, Friedl A, et al., inventors; Bayer, assignee. Novel Use for PDE10A Inhibitors. World Patent WO/2003/000269. Jan 3, 2003. Alemanha 2003 03.01.2003.
66. Hutson PH, Finger EN, Magliaro BC, Smith SM, Converso A, Sanderson PE, et al. The selective phosphodiesterase 9 (PDE9) inhibitor PF-04447943 (6-[(3S,4S)-4-methyl-1-(pyrimidin-2-ylme- thyl)pyrrolidin-3-yl]-1-(tetrahydro-2H-pyran-4-yl)-1,5-dihydro-4H-pyrazolo[3,4-d]pyrimidin-4-one) enhances synaptic plasti-city and cognitive function in rodents. Neuropharmacology. 2011 Set;61(4):665-76.
67. Vardigan JD, Converso A, Hutson PH, Uslaner JM. The selective phosphodiesterase 9 (PDE9) inhibitor PF-04447943 attenuates a scopolamine-induced deficit in a novel rodent attention task. J Neu-rogenet. 2011 Dez;25(4):120-6.
68. Sumer A, Altinli E, Senger S, Koksal N, Onur E, Eroglu E, et al. Effect of pentoxifylline and vinpocetine on the healing of ischemic colon anastomosis: an experimental study. Ulus Travma Acil Cer-rahi Derg. 2011 Nov;17(6):482-7.
69. Nyakas C, Felszeghy K, Szabo R, Keijser JN, Luiten PG, Szom-bathelyi Z, et al. Neuroprotective effects of vinpocetine and its major metabolite cis-apovincaminic acid on NMDA-induced neurotoxici-ty in a rat entorhinal cortex lesion model. CNS Neurosci Ther. 2009 Summer;15(2):89-99.
70. Autoridade Nacional do Medicamento e Produtos de Saúde I.P. – INFARMED. INFOMED. Disponível em www.infarmed.pt/info-med/inicio.php [acedido em janeiro de 2012].
71. European Medicines Agency. Disponível em www.ema.europa. eu [acedido em janeiro de 2012].
72. Food and Drug Administration. Disponível em www.fda.gov [acedido em janeiro de 2012].
73. Hiatt WR, Money SR, Brass EP. Long-term safety of cilostazol in patients with peripheral artery disease: the CASTLE study (Cilostazol: A Study in Long-term Effects). J Vasc Surg. 2008 Fev;47(2):330-6.
74. Samra SS, Bajaj P, Vijayaraghavan KS, Potdar NP, Vyas D, Devani RG, et al. Efficacy and safety of cilostazol, a novel phosphodiesterase inhibitor in patients with intermittent claudication. Journal of the Indian Medical Association. 2003 Set;101(9):561-2, 4.
75. Strandness DE, Jr., Dalman RL, Panian S, Rendell MS, Comp PC, Zhang P, et al. Effect of cilostazol in patients with intermittent claudication: a randomized, double-blind, placebo-controlled study. Vascular and endovascular surgery. 2002 Mar-Abr;36(2):83-91. 76. Mizushige K, Ueda T, Yukiiri K, Suzuki H. Olprinone: a phosphodiesterase III inhibitor with positive inotropic and vasodilator effects. Cardiovascular drug reviews. 2002 outono;20(3):163-74. 77. Ueda T, Mizushige K. The effects of olprinone, a phosphodieste-rase 3 inhibitor, on systemic and cerebral circulation. Current vascu-lar pharmacology. 2006 Jan;4(1):1-7.
78. Kusuri-no-Shiori Drug Information Sheet. RAD-AR Council, Japão. Abril 2005. Disponível em www.rad-ar.or.jp/siori/english/ kekka.cgi?n=54 [acedido em janeiro de 2012].
79. Glina S, Fonseca GN, Bertero EB, Damiao R, Rocha LC, Jardim CR, et al. Efficacy and tolerability of lodenafil carbonate for oral the-rapy of erectile dysfunction: a phase III clinical trial. The journal of sexual medicine. 2010 Mai;7(5):1928-36.
80. Glina S, Toscano I, Gomatzky C, de Goes PM, Junior AN, Claro JF, et al. Efficacy and tolerability of lodenafil carbonate for oral the-rapy in erectile dysfunction: a phase II clinical trial. The journal of sexual medicine. 2009 Fev;6(2):553-7.
81. Paick JS, Kim SW, Yang DY, Kim JJ, Lee SW, Ahn TY, et al. The efficacy and safety of udenafil, a new selective phosphodiesterase type 5 inhibitor, in patients with erectile dysfunction. The journal of sexual medicine. 2008 Abr;5(4):946-53.
82. Network USPPR. Amrinone Becomes Inamrinone – Practitioner Survey Persuasive in USP and USAN Council Decisions. USP Quali-ty Review. [QualiQuali-ty Review]. 2000 março;73(março):1-2.
83. Rolan P, Gibbons JA, He L, Chang E, Jones D, Gross MI, et al. Ibudilast in healthy volunteers: safety, tolerability and pharmacoki-netics with single and multiple doses. British journal of clinical phar-macology. 2008 Dez;66(6):792-801.
84. ClinicalTrials.gov. Disponível em http://clinicaltrials.gov/ct2/ show/NCT00817830 [acedido em janeiro de 2012].
85. DrugBank. Disponível em www.drugbank.ca/drugs/DB06267 [acedido em janeiro de 2012].
86. Evgenov OV, Busch CJ, Evgenov NV, Liu R, Petersen B, Falkowski GE, et al. Inhibition of phosphodiesterase 1 augments the pulmonary vasodilator response to inhaled nitric oxide in awake lambs with acute pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol. 2006 Abr;290(4):L723-L9.
87. Montorsi F, Corbin J, Phillips S. Review of phosphodiesterases in the urogenital system: new directions for therapeutic intervention. The journal of sexual medicine. 2004 Nov;1(3):322-36.
88. Lewis RJ, Connor JT, Teerlink JR, Murphy JR, Cooper LT, Hiatt WR, et al. Application of adaptive design and decision making to a phase II trial of a phosphodiesterase inhibitor for the treatment of intermittent claudication. Trials. 2011;12:134.
89. Louw C, Williams Z, Venter L, Leichtl S, Schmid-Wirlitsch C, Bredenbroker D, et al. Roflumilast, a phosphodiesterase 4 inhibitor, reduces airway hyperresponsiveness after allergen challenge. Respi-ration; international review of thoracic diseases. 2007;74(4):411-7. 90. Bateman ED, Izquierdo JL, Harnest U, Hofbauer P, Magyar P, Schmid-Wirlitsch C, et al. Efficacy and safety of roflumilast in the treatment of asthma. Ann Allergy Asthma Immunol. 2006 Mai;96(5):679-86.
91. Rabe KF, Bateman ED, O’Donnell D, Witte S, Bredenbroker D, Bethke TD. Roflumilast--an oral anti-inflammatory treatment for chronic obstructive pulmonary disease: a randomised controlled trial. Lancet. 2005 Ago 13-19;366(9485):563-71.
92. Hatzelmann A, Schudt C. Anti-inflammatory and immunomo-dulatory potential of the novel PDE4 inhibitor roflumilast in vitro. The Journal of pharmacology and experimental therapeutics. 2001 Abr;297(1):267-79.
93. Houslay MD, Schafer P, Zhang KY. Keynote review: phosphodiesterase-4 as a therapeutic target. Drug discovery today. 2005 Nov 15;10(22):1503-19.
94. Schreiber S, Keshavarzian A, Isaacs KL, Schollenberger J, Guz-man JP, Orlandi C, et al. A randomized, placebo-controlled, phase II study of tetomilast in active ulcerative colitis. Gastroenterology. 2007 Jan;132(1):76-86.
95. McIntyre JA, Castaner J, Castaner RM. Tetomilast. Drugs of the Future. 2004;29(10):1003-6.
96. McKenna JM, Muller GW. Medicinal Chemistry of PDE4 Inhi-bitors. In: Beavo J, Francis S, Houslay M, editors. Cyclic Nucleotide Phosphodiesterases in Health and Disease. Boca Raton: CRC Press, Taylor & Francis Group; 2007. p. 667-99.
97. Kuss H, Hoefgen N, Johanssen S, Kronbach T, Rundfeldt C. In
vivo efficacy in airway disease models of N-(3,5-dichloropyrid-4-yl)-[1-(4-fluorobenzyl)-5-hydroxy-indole-3-yl]-glyo xylic acid amide (AWD 12-281), a selective phosphodiesterase 4 inhibitor for inhaled administration. The Journal of pharmacology and experimental the-rapeutics. 2003 Out;307(1):373-85.
98. Helicon Therapeutics Inc. Helicon Study of HT-0712 on Prima-te Memory Formation Reveals Significant Enhancement. San Diego CA: Press Release, julho 22, 2008; 2008 [apud 2008 julho 22, 2008]. 99. Lu S, Liu N, Dass SB, Reiss TF, Knorr BA. Randomized, placebo-controlled study of a selective PDE4 inhibitor in the treatment of asthma. Respiratory medicine. 2009 Mar;103(3):342-7.
100. Giembycz MA. Can the anti-inflammatory potential of PDE4 inhibitors be realized: guarded optimism or wishful thinking? Bri-tish journal of pharmacology. 2008 Out;155(3):288-90.
101. Ono Pharmaceutical Co. L, Santen Pharmaceutical Co. L. Licen-sing Agreement on PDE4 Inhibitor ONO-6126. Osaka, Japão: Press Release; março 22, 2006.
102. Loher F, Schmall K, Freytag P, Landauer N, Hallwachs R, Bauer C, et al. The specific type-4 phosphodiesterase inhibitor mesopram alleviates experimental colitis in mice. The Journal of pharmacology and experimental therapeutics. 2003 Mai;305(2):549-56.
103. Jung J, Choi S, Cho SH, Ghim JL, Hwang A, Kim U, et al. Tole-rability and pharmacokinetics of avanafil, a phosphodiesterase type 5 inhibitor: a single- and multiple-dose, double-blind, randomized, placebo-controlled, dose-escalation study in healthy Korean male volunteers. Clinical therapeutics. 2010 Jun;32(6):1178-87.
104. Hryniewicz K, Dimayuga C, Hudaihed A, Androne AS, Zheng H, Jankowski K, et al. Inhibition of angiotensin-converting enzyme and phosphodiesterase type 5 improves endothelial function in he-art failure. Clin Sci (Lond). 2005 Abr;108(4):331-8.
105. Katz SD, Balidemaj K, Homma S, Wu H, Wang J, Maybaum S. Acute type 5 phosphodiesterase inhibition with sildenafil enhances flow-mediated vasodilation in patients with chronic heart failure. Journal of the American College of Cardiology. 2000 Set;36(3):845-51.
106. Sommer F, Schulze W. Treating erectile dysfunction by endo-thelial rehabilitation with phosphodiesterase 5 inhibitors. World journal of urology. 2005 Dez;23(6):385-92.
107. Boin F, Wigley FM. Understanding, assessing and treating Raynaud’s phenomenon. Current opinion in rheumatology. 2005 Nov;17(6):752-60.
108. Takimoto E, Champion HC, Li M, Belardi D, Ren S, Rodriguez ER, et al. Chronic inhibition of cyclic GMP phosphodiesterase 5A prevents and reverses cardiac hypertrophy. Nature medicine. 2005 Fev;11(2):214-22.
109. Kukreja RC, Ockaili R, Salloum F, Yin C, Hawkins J, Das A, et al. Cardioprotection with phosphodiesterase-5 inhibition--a novel pre-conditioning strategy. Journal of molecular and cellular cardiology. 2004 Fev;36(2):165-73.
110. Kukreja RC, Salloum F, Das A, Ockaili R, Yin C, Bremer YA, et al. Pharmacological preconditioning with sildenafil: Basic mecha-nisms and clinical implications. Vascular pharmacology. 2005 Abr-Mai;42(5-6):219-32.
111. Bremer YA, Salloum F, Ockaili R, Chou E, Moskowitz WB, Kukreja RC. Sildenafil citrate (viagra) induces cardioprotective effects after ischemia/reperfusion injury in infant rabbits. Pediatric research. 2005 Jan;57(1):22-7.
112. Zhang RL, Zhang Z, Zhang L, Wang Y, Zhang C, Chopp M. De-layed treatment with sildenafil enhances neurogenesis and improves functional recovery in aged rats after focal cerebral ischemia. Journal of neuroscience research. 2006 Mai 15;83(7):1213-9.
113. Rutten K, Vente JD, Sik A, Ittersum MM, Prickaerts J, Blokland A. The selective PDE5 inhibitor, sildenafil, improves object memory in Swiss mice and increases cGMP levels in hippocampal slices. Behavioural brain research. 2005 Out 14;164(1):11-6.
114. Prickaerts J, Sik A, van der Staay FJ, de Vente J, Blokland A. Dissociable effects of acetylcholinesterase inhibitors and phosphodiesterase type 5 inhibitors on object recognition memory: acquisition versus consolidation. Psychopharmacology. 2005 Fev;177(4):381-90.
115. Nakamizo T, Kawamata J, Yoshida K, Kawai Y, Kanki R, Sawada H, et al. Phosphodiesterase inhibitors are neuroprotective to cultu-red spinal motor neurons. Journal of neuroscience research. 2003 Fev 15;71(4):485-95.
116. Rodriguez-Iturbe B, Ferrebuz A, Vanegas V, Quiroz Y, Espino-za F, Pons H, et al. Early treatment with cGMP phosphodiesterase inhibitor ameliorates progression of renal damage. Kidney interna-tional. 2005 Nov;68(5):2131-42.
117. Sarfati M, Mateo V, Baudet S, Rubio M, Fernandez C, Davi F, et al. Sildenafil and vardenafil, types 5 and 6 phosphodiesterase inhibi-tors, induce caspase-dependent apoptosis of B-chronic lymphocytic leukemia cells. Blood. 2003 Jan 1;101(1):265-9.
118. de Carvalho AC, Hovnanian AL, Fernandes CJ, Lapa M, Jardim C, Souza R. Tadalafil as treatment for idiopathic pulmonary arterial hyper-tension. Arquivos brasileiros de cardiologia. 2006 Nov;87(5):e195-7. 119. Zhang L, Zhang Z, Zhang RL, Cui Y, LaPointe MC, Silver B, et al. Tadalafil, a long-acting type 5 phosphodiesterase isoenzyme inhi-bitor, improves neurological functional recovery in a rat model of embolic stroke. Brain research. 2006 Nov 6;1118(1):192-8.
120. Porst H, McVary KT, Montorsi F, Sutherland P, Elion-Mboussa A, Wolka AM, et al. Effects of once-daily tadalafil on erectile function in men with erectile dysfunction and signs and symptoms of benign prostatic hyperplasia. European urology. 2009 Out;56(4):727-35. 121. McVary KT, Roehrborn CG, Kaminetsky JC, Auerbach SM, Wachs B, Young JM, et al. Tadalafil relieves lower urinary tract symptoms secondary to benign prostatic hyperplasia. The Journal of urology. 2007 Abr;177(4):1401-7.
122. Aizawa K, Hanaoka T, Kasai H, Kogashi K, Kumazaki S, Koya-ma J, et al. Long-term vardenafil therapy improves hemodynamics in patients with pulmonary hypertension. Hypertens Res. 2006 Fev;29(2):123-8.
123. Prickaerts J, van Staveren WC, Sik A, Markerink-van Ittersum M, Niewohner U, van der Staay FJ, et al. Effects of two selective phosphodiesterase type 5 inhibitors, sildenafil and vardenafil, on ob-ject recognition memory and hippocampal cyclic GMP levels in the rat. Neuroscience. 2002;113(2):351-61.
124. Stief CG, Porst H, Neuser D, Beneke M, Ulbrich E. A randomi-sed, placebo-controlled study to assess the efficacy of twice-daily vardenafil in the treatment of lower urinary tract symptoms se-condary to benign prostatic hyperplasia. European urology. 2008 Jun;53(6):1236-44.
125. Auerbach SM, Gittelman M, Mazzu A, Cihon F, Sundaresan P, White WB. Simultaneous administration of vardenafil and tamsulosin does not induce clinically significant hypotension in patients with benign prostatic hyperplasia. Urology. 2004 Nov;64(5):998-1003 (discussion -4).
126. Dong-A PharmTech Co. L. Dong-A PharmTech Co., Ltd. An-nounces Positive Results for Udenafil,,Its New Long Acting Drug For Erectile Dysfunction. SEOUL, Coreia do Sul: Press Release; março 28, 2007.
127. Dong-A PharmTech Co. L. Dong-A PharmTech Co., Ltd. Annou-nces Portal Hypertension Clinical Trial With Udenafil. Seul, Coreia do Sul: Press Release; fevereiro 25, 2008.
128. Qiu Y, Bhattacharjee S, Kraft P, Mathew John T, Haynes-John-son D, Jiang W, et al. JNJ-10280205 and JNJ-10287069: Novel PDE5 inhibitors as clinical candidates for erectile dysfunction. Internatio-nal jourInternatio-nal of impotence research. 2006 Set-Out;18(5):477-83. 129. Paick JS, Choi HK, Kim SC, Ahn TY, Kim JJ, Park JK, et al. Effi-cacy and safety of oral SK3530 for the treatment of erectile dysfunc-tion in Korean men: a multicenter, randomized, double-blind, place-bo-controlled, fixed dose, parallel group clinical trial. Asian journal of andrology. 2008 Set;10(5):791-8.
130. Wunder F, Tersteegen A, Rebmann A, Erb C, Fahrig T, Hendrix M. Characterization of the first potent and selective PDE9 inhibi-tor using a cGMP reporter cell line. Molecular pharmacology. 2005 Dez;68(6):1775-81.
131. van der Staay FJ, Rutten K, Barfacker L, Devry J, Erb C, Heckro-th H, et al. The novel selective PDE9 inhibitor BAY 73-6691 impro-ves learning and memory in rodents. Neuropharmacology. 2008 Out;55(5):908-18.
132. Kehler J, Ritzen A, Greve DR. The potential therapeutic use of phosphodiesterase 10 inhibitors. Expert Opin Investig Patents. 2007;17(2):147-58.
133. Black SC, Gibbs EM, inventors; Pfizer Products Inc, assignee. Phosphodiesterase 10 Inhibition as Treatment for Obesity-Related and Metabolic Syndrome-Related Conditions. World Patent WO/2005/120514. Dez 22, 2005. EUA 2005 22.12.2005.
134. Schmidt CJ, Chapin DS, Cianfrogna J, Corman ML, Hajos M, Harms JF, et al. Preclinical characterization of selective phos-phodiesterase 10A inhibitors: a new therapeutic approach to the treatment of schizophrenia. The Journal of pharmacology and experimental therapeutics. 2008 Mai;325(2):681-90.