Alternativas vegetais aos lácteos: perfil nutricional e potencial impacto na saúde
Plant-based dairy alternatives: nutritional profile and potential health impact
Ana Gabriela Oliveira Cabilhas
Orientado por: Professor Doutor Nuno Borges
Revisão Temática
1.º Ciclo em Ciências da Nutrição
Faculdade de Ciências da Nutrição e Alimentação da Universidade do Porto
A procura de alternativas vegetais ao leite tem vindo a intensificar-se nas últimas décadas, ao passo que o consumo de leite tem diminuído. Atualmente, as alternativas vegetais ao iogurte e queijo estão também no centro das atenções dos consumidores. As alternativas vegetais aos produtos lácteos são frequentemente percecionadas como saudáveis, contudo a sua utilização inadequada pode levar a possíveis défices nutricionais. Como tal, a presente revisão tem como objetivos: 1) comparar o perfil nutricional do leite de vaca com os diferentes tipos de alternativas vegetais ao leite, 2) comparar o perfil nutricional do iogurte e queijo com as respetivas alternativas vegetais e 3) rever o potencial impacto na saúde da substituição de produtos lácteos por alternativas vegetais aos produtos lácteos.
O perfil nutricional das alternativas vegetais ao leite é variável, entre diferentes classes e quando utilizada a mesma base vegetal. Sobre as alternativas vegetais ao iogurte e queijo, a literatura aponta desafios que têm surgido no seu desenvolvimento, logo não foi possível analisar o perfil nutricional. Assim, é crucial conduzir investigação futura ao nível de novas técnicas que melhorem a qualidade destas alternativas.
Ademais, urge consciencializar os consumidores para o facto de as alternativas vegetais aos produtos lácteos não serem equivalentes aos lácteos do ponto de vista nutricional. Não existe evidência que suporte a utilização destas alternativas como substitutos de produtos lácteos. Novos estudos deverão avaliar os efeitos do consumo de alternativas vegetais aos produtos lácteos na saúde humana.
Palavras chave: Produtos lácteos, alternativas vegetais aos produtos lácteos, perfil
Abstract
The demand for plant-based milk alternatives has been increasing in recent decades, while milk consumption has declined. Currently, plant-based alternatives to yoghurt and cheese are also at the center of consumers’ attention. Plant-based dairy alternatives are often perceived as healthy, but their inadequate use may lead to possible nutritional deficits. Therefore, the objective of the present review is to: 1) compare the nutritional profile of cow's milk with the different types of plant-based milk alternatives, 2) compare the nutritional profile of yoghurt and cheese with the corresponding plant-based alternatives and 3) evaluate the potential health impact of substituting dairy products by plant-based alternatives.
The nutritional profile of the plant-based alternatives is variable, both concerning different classes and when the same vegetal base is used. As to plant-based alternatives to yoghurt and cheese, the literature points out challenges that have arisen in its development, so it was not possible to analyze the nutritional profile. Thus, it is crucial to conduct future research developing new techniques that improve the quality of these alternatives.
In addition, it is urgent to make consumers aware that plant-based dairy alternatives are not equivalent to dairy products from a nutritional point of view. There is no evidence to support the use of these alternatives as a substitute for dairy products. New studies should also evaluate the effects of the consumption of plant-based dairy alternatives on human health.
Keywords: Dairy products, plant-based dairy products, nutritional profile,
AVL – Alternativas vegetais ao leite
AVPL – Alternativas vegetais aos produtos lácteos DIAAS – Índice de aminoácidos essenciais digeríveis
IAN-AF – Inquérito Alimentar Nacional e de Atividade Física LV – Leite de vaca
PDCAAS – Índice de aminoácidos corrigido pela digestibilidade proteica PL – Produtos lácteos
THC – Teor de hidratos de carbono TP – Teor proteico
Sumário
Resumo ... i
Abstract ... ii
Lista de abreviaturas, siglas e acrónimos ... iii
Introdução ... 1
Metodologia ... 3
1. Uma visão sobre os produtos lácteos ... 3
2. Alternativas vegetais aos produtos lácteos: perfil nutricional e comparação com os produtos lácteos ... 4
2.1. Alternativas vegetais ao leite ... 4
2.2. Alternativas vegetais ao iogurte e queijo ... 10
3. Potencial impacto na saúde ... 11
Análise crítica ... 13
Conclusão ... 15
Referências ... 16
Introdução
Os produtos lácteos (PL) são alimentos de grande riqueza nutricional(1). Em
particular, o leite fornece um conjunto de nutrientes importantes para o organismo humano, sendo, por isso, considerado um alimento completo(1-3). Durante vários
séculos, o leite de vaca (LV) foi largamente consumido em todo o mundo, representando uma das principais fontes proteicas da dieta(2).
A restrição do seu consumo começou em indivíduos alérgicos à proteína do LV ou intolerantes à lactose(4-7). Recentemente, muitos consumidores têm aumentado
o consumo de alternativas vegetais ao leite (AVL), possivelmente influenciados por um conjunto de informações, nem sempre de base científica, que têm associado o consumo de PL a efeitos negativos na saúde humana(8). As AVL são também
incluídas em dietas vegetarianas e veganas, dietas com considerações éticas contra o consumo de LV ou que espelham preocupações ambientais(2, 4-6, 9-11).
Como tal, o aumento da procura de AVL tem vindo a intensificar-se nas últimas décadas, ao passo que o consumo de LV tem diminuído(2, 3, 8, 10, 12, 13).
Em Portugal, segundo dados de balanças alimentares, a tendência de redução do consumo de leite teve início em 2005 e continuou até 2015, com uma taxa anual negativa de 2,4%. Em 2015, o consumo de leite atingiu o valor mínimo obtido desde 1985(14). Nos Estados Unidos da América, em 2018, as vendas de leite
decresceram 18,8% em relação a 2014. Nesse mesmo ano, as vendas de AVL aumentaram 52% face a 2013(15). A continuação do forte crescimento deste setor é
retratado nas estimativas para 2023, que apontam vendas na ordem dos 3,1 mil milhões de dólares(15).
A bebida de soja é a AVL mais comum e amplamente consumida(2, 4-6, 16). Para
além da soja, outras fontes vegetais têm sido utilizadas no desenvolvimento de AVL(16). Neste contexto, destaca-se a bebida de amêndoa, atualmente responsável
por mais de metade do valor das vendas de AVL. Paralelamente, as bebidas de arroz, aveia, caju, coco e quinoa começam a emergir de forma mais pronunciada(2, 5, 15). Os produtos fermentados, como as alternativas vegetais ao iogurte e queijo
estão recentemente no centro das atenções dos consumidores, contribuindo para uma expansão ainda maior do setor das alternativas vegetais aos PL (AVPL)(4).
O mercado das AVPL é impulsionado por vários interesses e influenciado por diferentes opiniões(4). Dados recentes concluem que, na sua maioria, a escolha de
AVPL, em detrimento de PL, é motivada por questões relacionadas com a preferência do consumidor e não por questões de necessidade(17). Evidencia-se
ainda que os consumidores frequentemente percecionam as AVL como saudáveis(4, 12). Cerca de 69% dos americanos acredita que as AVL são
nutricionalmente adequadas para crianças(17). Contudo, o seu perfil nutricional varia
consideravelmente(8, 12). Assim, a substituição total do LV por AVL, sem qualquer
tipo de alterações na dieta, começa a ser vista como uma preocupação em termos de saúde pública(11), podendo levar a possíveis défices nutricionais(3, 16, 18).
Como esta tendência continua a crescer, torna-se crucial comparar as AVPL com os PL, quer ao nível da composição nutricional como da biodisponibilidade de nutrientes(12). Embora a bebida de soja tenha sido extensamente investigada,
existem poucos estudos referentes ao vasto leque de AVL disponíveis no presente(2, 5, 6). Por outro lado, a evidência científica sobre as alternativas vegetais
fermentadas também é escassa(4). Deste modo, a presente revisão tem como
comparar o perfil nutricional do iogurte e queijo com as respetivas alternativas vegetais e 3) rever o potencial impacto na saúde da substituição de PL por AVPL.
Metodologia
Foi realizada uma revisão da literatura, recorrendo às bases de dados PubMed, Scopus e Web of Science, usando como expressões de pesquisa dairy products,
milk, yogurt, yoghurt ou cheese, combinadas com dairy-free, non dairy, vegan, soy, plant-based, milk alternatives ou milk substitutes. O termo functional beverages foi
combinado com non-dairy ou plant-based e excluíram-se breastfeeding ou human
milk. Não foram estabelecidas restrições relativas ao ano ou idioma de publicação.
A bibliografia dos artigos previamente selecionados também foi alvo de revisão.
1. Uma visão sobre os produtos lácteos
Apesar da opinião controversa sobre o consumo de PL, estes continuam a fazer parte das recomendações alimentares de muitos países(8). Para além de serem
uma importante fonte de energia, gordura, hidratos de carbono e proteína de alto valor biológico, contribuem para o aporte de cálcio, fósforo, iodo, magnésio, potássio, selénio, ácido pantoténico, riboflavina e vitamina B12(1, 2, 18). Pelo Inquérito
Alimentar Nacional e de Atividade Física (IAN-AF) 15-16, os PL contribuem em 15,9% para a ingestão diária de proteína e 44,8% para a ingestão diária de cálcio dos portugueses(19).
A evidência atual sugere que a ingestão de PL parece ser protetora da maioria das doenças crónicas não transmissíveis prevalentes na sociedade, designadamente excesso de peso ou obesidade(20-23), diabetes tipo 2(24), doenças
2. Alternativas vegetais aos produtos lácteos: perfil nutricional e comparação com os produtos lácteos
2.1. Alternativas vegetais ao leite
As AVL são extratos aquosos de base vegetal, que após processamento tecnológico, se assemelham ao LV na sua aparência e consistência(4, 6, 16).
Pela primeira vez na literatura, Sethi et al. (2016) propõem uma classificação para as AVL, subdividindo-as em 5 classes - 1) à base de cereais: bebidas de arroz, aveia, espelta ou milho; 2) à base de frutos oleaginosos: bebidas de amêndoa, avelã, coco, noz ou pistacho; 3) à base de leguminosas: bebidas de amendoim, tremoço, feijão ou soja; 4) à base de pseudocereais: bebidas de amaranto, quinoa ou teff e 5) à base de sementes: bebidas de cânhamo, girassol ou sésamo(16).
O perfil nutricional das diferentes AVL varia amplamente, pois depende de fatores como matéria prima, processamento, fortificação com vitaminas e minerais ou presença de ingredientes como óleos(6). Para determinar se as AVL podem ser
substitutos do LV, deve ser comparada a composição em macronutrientes e cálcio(11). Na sequência, o valor energético e teores de proteína, gordura, hidratos
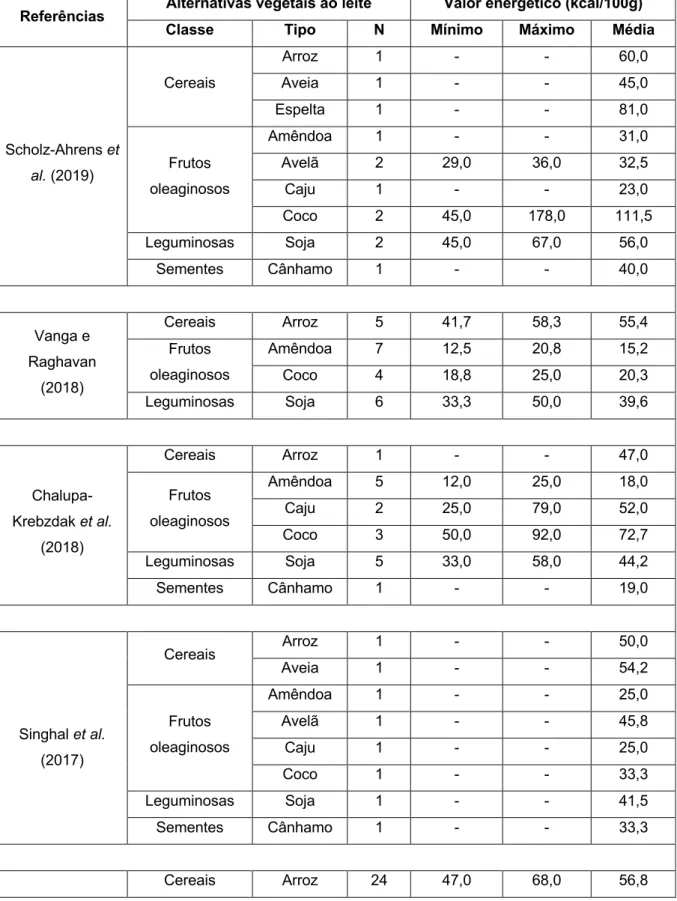
de carbono e cálcio das AVL analisadas na literatura foram sumariados no Anexo A. Na análise do perfil nutricional, os valores são expostos por 100 g ou 100 mL.
Valor Energético
O valor energético (VE) do LV varia em função do teor de gordura, sendo que o leite gordo, meio gordo e magro apresentam 62, 47 e 34 kcal, respetivamente(30).
Da revisão efetuada, é evidente que o VE dos diferentes tipos de AVL varia largamente, não sendo esta variação padronizada como no LV. O VE da maioria das AVL aproxima-se do VE do leite meio gordo e magro(2, 3, 6, 11, 12, 16, 31). Porém,
em algumas, o VE excede o do leite gordo, devido essencialmente à presença de açúcares e óleos(3, 6, 8, 11, 12, 16, 31). O reduzido número de calorias em algumas destas
bebidas é um dos principais motivos para a sua procura(2).Das várias AVL, a bebida
de amêndoa apresenta não só o menor VE de todos, como também, o menor intervalo de variação(2, 11). Por oposição, a bebida de coco é a que exibe valores
mais discrepantes entre si(2, 3, 6, 12, 16, 31).
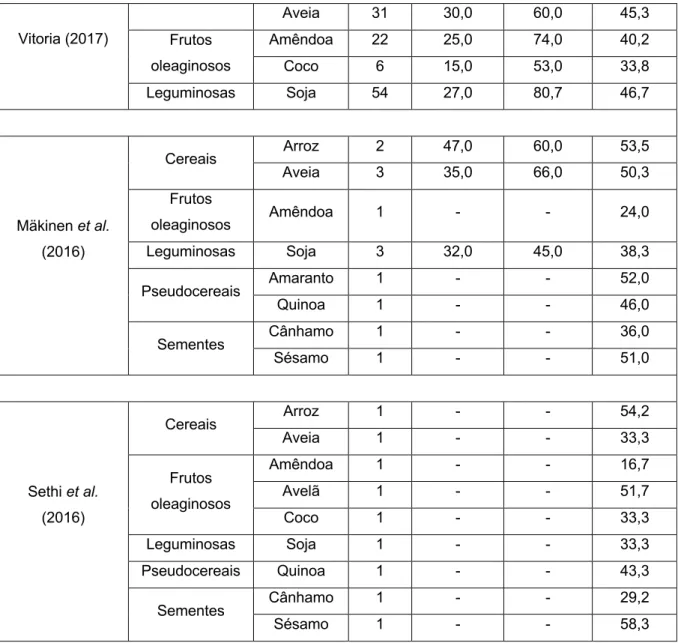
Proteína
A principal desvantagem das AVL disponíveis no mercado é o seu baixo teor proteico (TP)(4). Algumas bebidas de amêndoa, arroz, aveia, avelã, caju e coco
contêm um TP muito baixo (<0,5%)(2, 3, 6, 11, 12, 16, 31). Também metade das amostras
analisadas por Jeske et al. (2017) apresentaram um TP <0,5%(5). Em contraste, a
bebida de soja contém entre 2,1 a 5% de proteína(2, 3, 6, 11, 12, 16, 31), valores próximos
ao TP do LV (cerca de 3%(30)). Como tal, a bebida de soja é a única que se aproxima
ao LV no que concerne à quantidade de proteína(4, 6, 8, 16). Para além desta, outras
bebidas à base de leguminosas, como misturas de amendoim e feijão, podem atingir um TP de 4%(32). Ademais, existe uma variação expressiva no TP das
AVL(11), que é visível, tanto dentro da mesma classe, por exemplo, nas bebidas à
base de cereais(3), como quando utilizada a mesma base vegetal, como indicado
nas 5 bebidas de amêndoa analisadas por Chalupa-Krebzdak et al. (2018)(11).
Para além do baixo TP de algumas AVL, também a qualidade das proteínas vegetais é inferior às proteínas do LV(4, 5), devido ao menor teor em aminoácidos
essenciais e à baixa digestibilidade(33). O índice de aminoácidos corrigido pela
para avaliar a qualidade das proteínas alimentares. Recentemente, a Organização das Nações Unidas para Alimentação e Agricultura e a Organização Mundial de Saúde recomendaram o índice de aminoácidos essenciais digeríveis (DIAAS)(34). A
diferença entre estes não contempla o objetivo desta revisão, ainda assim, os dois oferecem uma boa indicação da qualidade de uma proteína, segundo a presença de aminoácidos essenciais(11). Os valores disponíveis na literatura mostram que,
considerando quer o PDCAAS, quer o DIAAS, as proteínas do LV detêm uma qualidade proteica superior a qualquer uma das proteínas vegetais. Os valores de PDCAAS (%) para as proteínas do LV são 112(35) e 121(36), enquanto que os valores
para algumas fontes vegetais utilizadas nas AVL são mais baixos: soja (93(35, 37),
91(36), 90(38), 86(37)), caju (90(39)), amaranto (83, 63(40)), quinoa (68(41)), cânhamo
(66-49(42)), arroz (65(38), 54(35)), aveia (60(35), 52-41(43)) e amêndoa (23(44)). Ao contrário
da maioria das proteínas vegetais, a de soja é a que apresenta valores mais elevados de PDCAAS, comparáveis ao LV(11). O mesmo se verifica com o DIAAS
(%) (84, 89(37), 90(45)), permitindo a alegação “boa fonte de proteína” (≥75 DIAAS
<100)(34). As proteínas do LV possibilitam a alegação “excelente fonte de proteína”
(DIAAS ≥100)(34, 37, 45). Os principais aminoácidos limitantes em fontes vegetais são
a metionina, cisteína e/ou lisina(46), pelo que, mesmo ao misturar várias farinhas ou
proteínas, possivelmente os valores de PDCAAS ou DIAAS para as AVL permanecerão baixos, pela sobreposição de aminoácidos limitantes(11).
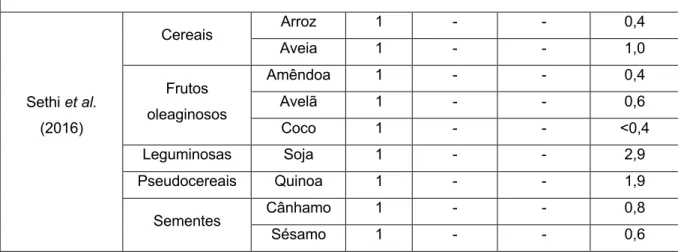
Gordura
O teor lipídico do LV varia consoante este seja gordo, meio gordo ou magro, sendo os valores respetivos de gordura total 3,5%, 1,6% e 0,2%(30). Os ácidos
gordos saturados predominam, estando também presente uma quantidade significativa de colesterol(47, 48).
O teor de gordura das AVL varia consideravelmente(2, 3, 5, 6, 11, 12, 16, 31). A
informação sobre o perfil de ácidos gordos nem sempre está disponível, contudo, é possível verificar que os ácidos gordos saturados estão presentes em baixa quantidade nas AVL(6, 8, 11, 12), enquanto que ácidos gordos mono e polinsaturados
são predominantes(11). Especificamente, a bebida de soja destaca-se pelo seu teor
em ácidos gordos polinsaturados(11, 16, 31). A exceção à tendência são as bebidas
de coco, por serem distintamente ricas em gordura saturada(2, 3, 11, 31). Deste modo,
também o perfil em ácidos gordos é variável(11). Naturalmente, as AVL não contêm
colesterol, um fator que parece contribuir para o aumento da sua procura(2, 8).
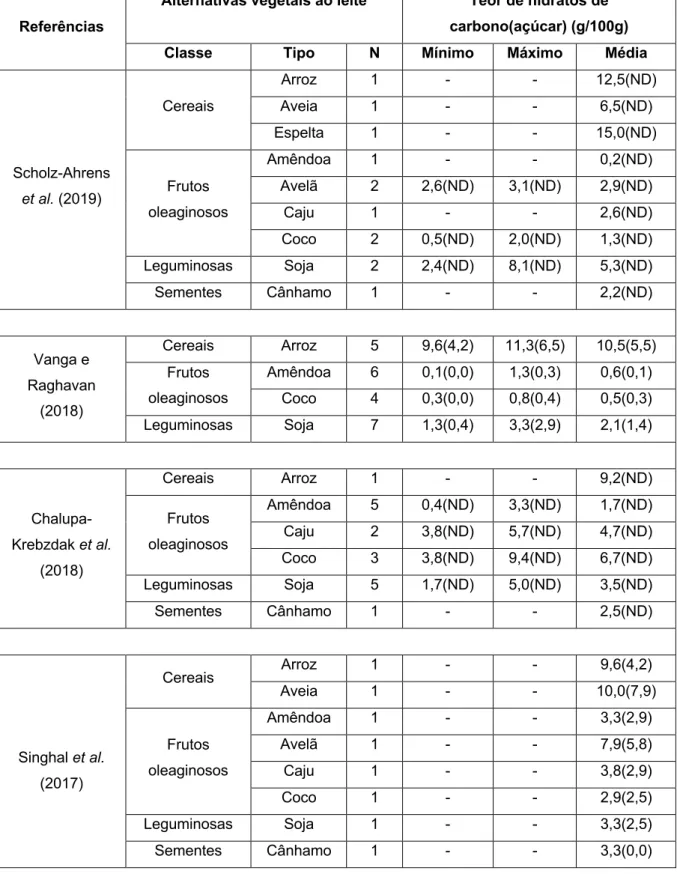
Hidratos de Carbono
Em média, o LV apresenta cerca de 4,8 g de hidratos de carbono totais(30),
sendo a lactose o principal(1, 5). Em contraste, nenhuma AVL contém lactose(5, 31).
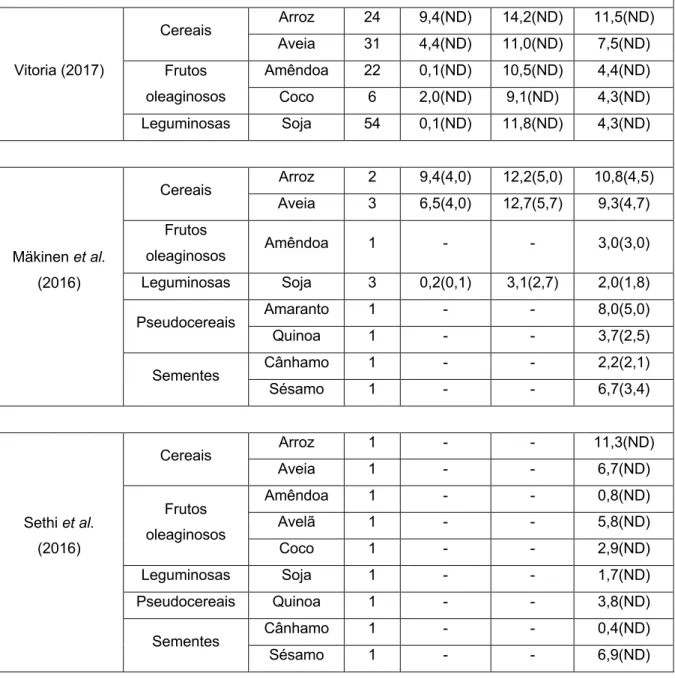
Segundo a revisão realizada, o teor de hidratos de carbono (THC) das AVL varia entre 0,1 e 15,0 g. Esta variabilidade pode ser atribuída a diferenças nas formulações das bebidas ou a diferentes diluições da matéria vegetal utilizada(11).
Vários autores mostram que a bebida de arroz distingue-se pelo seu elevado THC e açúcares, verificando-se o oposto com a bebida de amêndoa(2, 3, 6, 11, 12, 16, 31). Algumas bebidas de amêndoa, coco e soja têm um THC e açúcares inferior ao
do LV(2, 3, 6, 11, 12, 16, 31). Já o THC das AVL à base de cereais foi alvo de observação
por Scholz-Ahrens et al. (2019) por ser visivelmente superior ao do LV(3), o que vai
de encontro ao exposto na literatura(2, 6, 11, 12, 16, 31). Relativamente às AVL à base
de frutos oleaginosos, a de avelã apresenta um THC superior à de amêndoa(3, 11).
certamente mais elevada em comparação com as bebidas sem adição(5). Na
maioria das AVL, mais de 70% dos hidratos de carbono presentes são açúcares(31).
Adicionalmente, a apreciação do índice glicémico e carga glicémica das AVL mostra-se interessante(11). Contudo, estes dados não constam nos artigos revistos.
Jeske et al. (2017) determinaram o índice glicémico e carga glicémica de AVL e do LV, sendo de salientar o facto do índice glicémico das AVL (47,53-99,96) ser superior ao do LV (46,93)(5). Das 17 amostras analisadas, 8 apresentaram um baixo
índice glicémico, assim como o LV, 6 um índice glicémico médio e 3 um índice glicémico alto, sendo estas últimas bebidas de coco e arroz(5). Os valores
encontrados são concordantes com outros retratados na literatura(49, 50). Dado o seu
alto THC, as bebidas de arroz foram as únicas que apresentaram carga glicémica elevada(5), cujos valores são comparáveis aos de refrigerantes ou bolos(51).
Cálcio
O LV representa uma importante fonte de cálcio na dieta(1, 52). Não só porque é
particularmente rico em cálcio, com cerca de 112 mg(30), mas porque este é
altamente biodisponível(52). Mais se sabe que outros constituintes do leite, como a
lactose ou as caseínas, aumentam a permeabilidade intestinal dos sais de cálcio e a absorção intestinal, respetivamente(52).
Fontes vegetais utilizadas nas AVL, como os cereais, apresentam quantidades reduzidas de cálcio(16). Como tal, muitas AVL são fortificadas neste micronutriente (2-6, 11, 12, 16), com a finalidade de se tornarem comparáveis ao LV(2, 3) e, assim, ser
mais fácil atingir as recomendações de ingestão diária de cálcio(16). Metade das 164
AVL analisadas por Vitoria (2017) eram fortificadas em cálcio, sendo comummente adicionados 120 mg(31). É ainda possível verificar que o teor de cálcio das AVL é
apresenta entre 0 e 10 mg de cálcio. Por outro lado, quando fortificadas, muitas AVL revelam um teor de cálcio superior ao do LV(2, 11, 12), com valores a atingirem
os 200 mg. Porém, a adição de cálcio não garante que as AVL e o LV sejam equivalentes do ponto de vista nutricional, mesmo quando o teor de cálcio rotulado é semelhante, dado que a sua biodisponibilidade varia significativamente(53).
A biodisponibilidade de cálcio depende da matriz alimentar, nomeadamente a presença de potenciadores e de inibidores de absorção, como fitatos ou oxalatos, presentes em cereais, frutos oleaginosos e leguminosas(54-59). A presença natural
de fitatos na aveia leva a que a biodisponibilidade de cálcio nesta seja de apenas 3,77%(57). Ellis e Lieb (2015) reportaram um teor em oxalatos elevado em bebidas
de amêndoa, comparativamente ao valor desprezível no LV(60).
A escolha do agente de fortificação determina a biodisponibilidade de cálcio nas AVL(61). Tanto o carbonato de cálcio como o fosfato de tricálcio têm sido
reportados como os mais comummente usados(3, 11, 61). Embora a estabilidade do
carbonato de cálcio seja menor, este exibe uma absorção equivalente ao cálcio no LV(61-63). Já a absorção no fosfato de tricálcio é de apenas 75%(64). O cálcio
naturalmente associado às caseínas no LV continua a apresentar vantagens particulares face ao cálcio adicionado(11). A sua sedimentação permanece um
problema, e neste contexto, tanto o carbonato de cálcio como o fosfato de tricálcio sedimentam de forma apreciável(63, 65, 66). Análises a bebidas de soja comerciais
revelaram que, quando não agitadas, estas continham apenas 31% do teor de cálcio rotulado, e quando agitadas, perto de 59%, refletindo-se numa menor ingestão de cálcio(65). Outra fonte de cálcio utilizada nas AVL é o pó da alga marinha Lithothamnium calcareum, que fornece sensivelmente 32% de cálcio(3).
Outros micronutrientes
De forma a combater possíveis défices nutricionais que possam surgir com a exclusão de LV e outros PL da dieta, algumas AVL são fortificadas em vitaminas, principalmente B12, B2, D e A(6, 31). Considerando o estudo de Vitoria (2017), 23
das 54 bebidas de soja analisadas foram fortificadas com vitamina D, sendo comummente adicionados 0,75 μg(31). Sobre os minerais, as AVL possuem
menores teores de fósforo, potássio, selénio e iodo, relativamente ao leite(67-69).
Aqui, importa considerar que, quer durante o processamento das AVL, quer no seu armazenamento, podem ocorrer perdas de vitaminas e minerais(4, 16, 70, 71).
Vanga e Raghvan (2018) reconhecem que, no que diz respeito ao conteúdo em vitaminas e minerais, dentro das AVL, a bebida de soja é a que mais se aproxima do LV(2). Quando as AVL são fortificadas em alguns micronutrientes, as suas
concentrações variam consideravelmente, existindo, também, AVL que não são fortificadas ou cuja quantidade de determinados micronutrientes é mínima(2, 3, 6).
2.2. Alternativas vegetais ao iogurte e queijo
As AVL podem ser fermentadas, de forma a produzir alternativas vegetais ao iogurte e queijo(4, 6). A fermentação torna os produtos mais palatáveis e melhora a
digestibilidade de proteínas e biodisponibilidade de micronutrientes(4, 6, 72-74).
Jeske et al. (2018) apontam desafios que têm surgido ao longo dos últimos anos no desenvolvimento destas alternativas. Como tal, a literatura disponível assenta no estudo de novas abordagens para o desenvolvimento de alternativas vegetais ao iogurte e queijo que sejam capazes de melhorar as suas características sensoriais bem como o perfil nutricional, para além do estudo do seu potencial enquanto produtos alimentares funcionais, através da adição de probióticos(4, 75-81).
Contudo, grande parte dos estudos substitui apenas parcialmente os ingredientes de origem láctea e centra-se maioritariamente em alternativas à base de soja. Não obstante, alguns estudos apontam resultados promissores das alternativas vegetais ao iogurte e queijo à base de soja, podendo representar uma alternativa proteica(74, 80). Deste modo, apesar do crescente interesse dos consumidores em
alternativas vegetais ao iogurte e queijo, estas têm recebido pouca atenção da comunidade científica(4). Como tal, não foi possível comparar o perfil nutricional do
iogurte e queijo com as suas alternativas vegetais.
3. Potencial impacto na saúde
Uma vez que as AVL são produtos processados, quaisquer efeitos na saúde associados ao consumo de fontes vegetais naturais, como grãos de soja, não deverão ser extrapolados para o consumo de AVL, devendo ser estudado diretamente o impacto do seu consumo na saúde humana(8). Na literatura
disponível, apenas alguns estudos comparam os efeitos do consumo de AVL com o consumo de LV em marcadores de risco para doenças. Num ensaio clínico aleatorizado, com desenho em cross-over (n=28), uma dose diária de 25 g de proteína, provenientes de bebida de soja, reduziu 5% do colesterol LDL plasmático, em comparação com o LV, em adultos com níveis elevados de colesterol LDL(82).
Por outro lado, um ensaio clínico aleatorizado, cego (n=32), numa população feminina, pós-menopausa, não mostrou um efeito hipocolesterolémico significativo associado ao consumo de bebida de soja(83). Uma revisão sistemática recente, que
compilou resultados de oito ensaios clínicos, concluiu que a evidência disponível sobre o impacto da bebida de soja nos lípidos plasmáticos é limitada e permanece
controversa(84). O consumo de bebida de soja foi novamente alvo de estudo na
população feminina, pós menopausa, num ensaio clínico aleatorizado, cego (n=31), onde não foi demostrado um efeito significativo do consumo desta bebida sobre marcadores de inflamação e stress oxidativo(85). Num estudo com igual desenho
(n=19), um produto alimentar à base de aveia e leite reduziu os níveis de glicemia pós-prandial de forma tão eficiente como um iogurte(86). Noutro ensaio clínico
aleatorizado, em cross-over (n=24), foi proposto que o alto teor de beta glucanos na bebida de aveia seja responsável pela diminuição das concentrações plasmáticas de colesterol LDL, ainda que o efeito também possa estar associado à substituição de ácidos gordos saturados por ácidos gordos insaturados(87). Alguns
destes estudos não incluíram bebidas comercialmente disponíveis. Perante estes resultados, é possível concluir que os ensaios clínicos deverão ser melhor conduzidos, com tamanho amostral e duração maiores, que uniformizem as doses administradas e considerem fatores confundidores como a ingestão diária. Desta forma, a evidência atual é insuficiente para concluir que as AVPL possam possuir benefícios para a saúde superiores aos PL(8).
Ainda assim, muitos são os casos de deficiências nutricionais graves relatadas em crianças, como resultado do consumo inadequado de AVL, nomeadamente deficiência proteico-energética, de vitaminas e minerais, não comuns na sociedade ocidental, para além da ocorrência de condições que podem colocar em risco a vida humana(3, 60, 88-92). Em bebés e crianças, a utilização de bebidas de soja não
fortificadas com vitaminas ou minerais está associada principalmente a casos de raquitismo(89, 93, 94), as bebidas de arroz a kwashiorkor(88, 89, 92, 95-103) e as bebidas de
amêndoa a alcalose metabólica grave, ainda que também tenham sido descritos casos de raquitismo, hiperoxalúria ou escorbuto(60, 88, 92, 104-106). Recentemente, foi
observada uma associação dose-dependente entre o maior consumo de bebidas vegetais e uma menor altura na infância(107). Em crianças, o consumo destas
bebidas foi associado negativamente a níveis séricos de 25-hidroxivitamina D(108).
O consumo de produtos alimentares à base de soja, em particular, bebidas de soja fermentadas com probióticos, são apontados como úteis na redução do risco de cancro da mama(109-111). Já nas bebidas à base de arroz foi reportado um alto
teor de arsénio inorgânico(67), cuja ingestão a longo prazo tem sido associada a
problemas de saúde graves como alguns tipos de cancro(112).
Análise crítica
Em contraste com o LV, as AVL não apresentam um padrão de identidade. As diferenças nas formulações das bebidas vegetais resultam numa grande variabilidade do seu perfil nutricional, entre as diferentes classes e quando utilizada a mesma base vegetal(5, 6, 8, 11, 12). A presente revisão também identifica as principais
divergências do perfil nutricional das AVL comparativamente ao LV, evidenciando que estes são muito diferentes(8). O perfil nutricional das AVL é inferior ao do LV,
pelo menor teor e qualidade proteicas, diferente composição em ácidos gordos, maior THC e açúcares, menor teor de vitaminas e minerais, menor biodisponibilidade de cálcio e pela presença de fatores antinutricionais. A bebida de soja é a que mais se aproxima do LV pelo TP. As bebidas de coco e arroz são pobres do ponto de vista nutricional, dado que, para além do baixo TP, detêm um teor de gordura saturada e de açúcares elevados, respetivamente.
A variabilidade do TP entre as AVL, assim como o menor TP em algumas bebidas, poderá conduzir a uma diminuição da ingestão proteica, bem como a
efeitos adversos decorrentes de uma ingestão inadequada de aminoácidos essenciais(11). Segundo o IAN-AF 15-16, para o total nacional, a prevalência de
inadequação proteica por défice é de 12,7%, sendo maior em mulheres e idosos(19).
Nestes casos, o consumo de AVL poderá potencialmente contribuir para uma inadequação maior. Ademais, continua a ser especulado que o efeito biológico da substituição de proteína animal por vegetal possa ser maior que a interpretação dos valores de PDCAAS ou DIAAS(11). Foi documentado que a proteína de soja resulta
em menores taxas de síntese proteica muscular pós-prandial, em comparação com o leite(113). Um dos micronutrientes com maior proporção da população abaixo das
necessidades médias, a nível nacional, é o cálcio, com percentagens superiores em mulheres e idosos(19). De igual modo, também o consumo de AVL poderá
contribuir para uma inadequação maior. Mesmo que as AVL apresentem maior teor de cálcio, devido à sua sedimentação e dificuldades na solubilização, é incerto que o cálcio biodisponível seja equivalente ao do LV.
O valor nutricional do LV está bem documentado, ao passo que as AVL não foram ainda minuciosamente estudadas(12). A maioria dos estudos que comparam
o perfil nutricional das AVL com o LV apresentam limitações, nomeadamente o baixo número de amostras e a ausência de informação sobre a biodisponibilidade dos nutrientes, dado que a análise é baseada nos valores que constam no rótulo. Assim sendo, no desenho de estudos futuros, deve ser considerado um maior número de amostras, representativas da panóplia de alternativas existentes, assegurando a variabilidade entre marcas. Outra consideração deve ser tecida - novos produtos são lançados continuamente no mercado, o que obriga a uma atualização constante das AVPL disponíveis para consumo. Dos estudos analisados, nenhum retrata a realidade em Portugal. Como tal, no Anexo B, foi
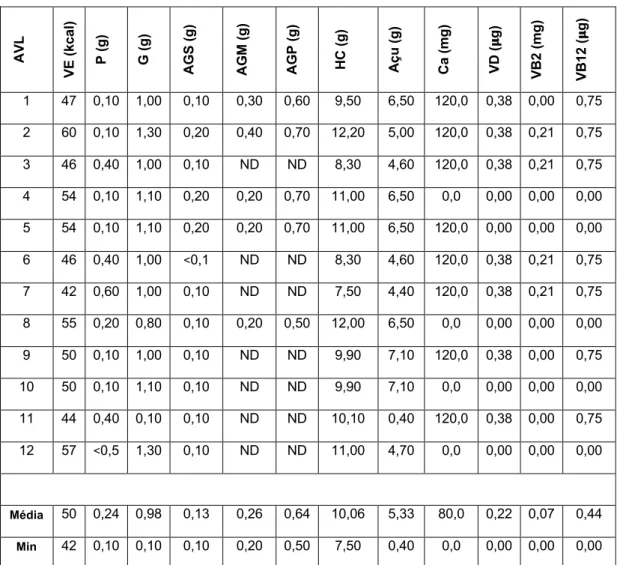
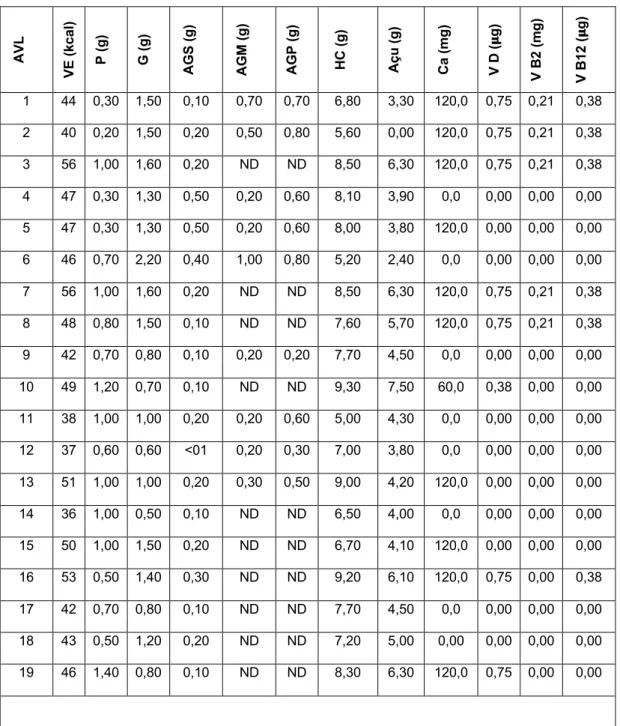
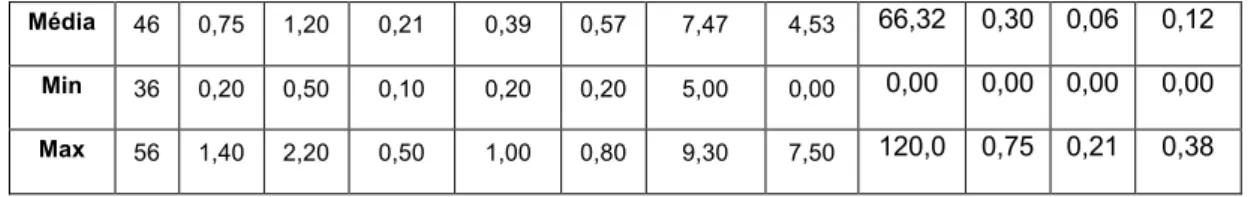
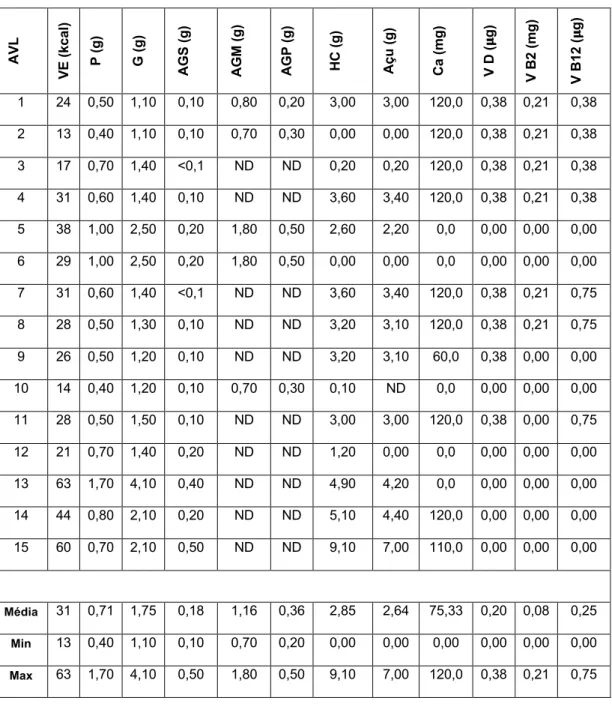
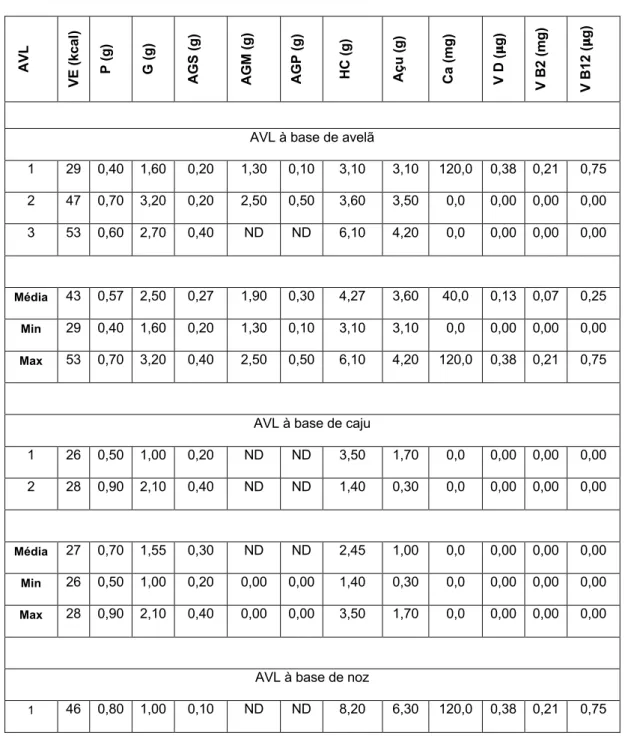
compilado o perfil nutricional de um leque de AVL disponíveis no mercado português (n=109), que poderá servir como base para um estudo aprofundado sobre o tema. Não obstante, denota-se de forma elucidativa a variabilidade do perfil nutricional das AVL, sobretudo do VE (13-78kcal/100g), TP (0,07-3,90%) e THC (0,00-12,50%), bem como ao nível da adição de micronutrientes.
Mais se conclui que é imperioso conduzir investigação futura ao nível de novas técnicas e metodologias, que permitam melhorar a qualidade das AVPL, tendo em consideração o perfil nutricional, estabilidade e características sensoriais, permitindo responder às exigências dos consumidores atuais e futuros(2, 4-6, 16).
Neste contexto, o TP deverá ser um fator determinante para o desenvolvimento de novos produtos(4).
Na sequência deste trabalho, é claro que são precisos estudos que avaliem os potenciais efeitos do consumo de AVPL na saúde humana, bem como as implicações de uma substituição completa e prolongada dos PL pelas suas alternativas vegetais, não só em crianças, como também na população em geral.
Conclusão
Em suma, face ao rápido crescimento do mercado e popularidade das AVPL, e dado que estas são frequentemente percecionadas como saudáveis, torna-se crucial consciencializar os consumidores para o facto de as AVPL não serem equivalentes aos PL do ponto de vista nutricional. Não existe evidência que suporte a utilização de AVPL como substitutos de PL. Dado que o perfil nutricional entre estes varia de forma considerável, é presumível que o seu potencial impacto na saúde seja diferente.
Referências
1. Muehlhoff E, Bennett A, McMahon D. Milk and dairy products in human nutrition. Rome: Food and Agriculture Organization of the United Nations (FAO); 2013.
2. Vanga SK, Raghavan V. How well do plant based alternatives fare nutritionally compared to cow's milk? Journal of Food Science and Technology. 2018; 55(1):10-20.
3. Scholz-Ahrens KE, Ahrens F, Barth CA. Nutritional and health attributes of milk and milk imitations. European Journal of Nutrition. 2019
4. Jeske S, Zannini E, Arendt EK. Past, present and future: The strength of plant-based dairy substitutes based on gluten-free raw materials. Food Research International. 2018; 110:42-51.
5. Jeske S, Zannini E, Arendt EK. Evaluation of Physicochemical and Glycaemic Properties of Commercial Plant-Based Milk Substitutes. Plant Foods for Human Nutrition. 2017; 72(1):26-33.
6. Mäkinen OE, Wanhalinna V, Zannini E, Arendt EK. Foods for Special Dietary Needs: Non-dairy Plant-based Milk Substitutes and Fermented Dairy-type Products. Critical Reviews in Food Science and Nutrition. 2016; 56(3):339-49.
7. Crittenden RG, Bennett LE. Cow’s Milk Allergy: A Complex Disorder. Journal of the American College of Nutrition. 2005; 24(sup6):582S-91S.
8. Thorning TK, Raben A, Tholstrup T, Soedamah-Muthu SS, Givens I, Astrup A. Milk and dairy products: good or bad for human health? An assessment of the totality of scientific evidence. Food & Nutrition Research. 2016; 60:32527-27. 9. Melina V, Craig W, Levin S. Position of the Academy of Nutrition and Dietetics: Vegetarian Diets. Journal of the Academy of Nutrition and Dietetics. 2016; 116(12):1970-80.
10. McCarthy KS, Parker M, Ameerally A, Drake SL, Drake MA. Drivers of choice for fluid milk versus plant-based alternatives: What are consumer perceptions of fluid milk? Journal of Dairy Science. 2017; 100(8):6125-38.
11. Chalupa-Krebzdak S, Long CJ, Bohrer BM. Nutrient density and nutritional value of milk and plant-based milk alternatives. International Dairy Journal. 2018; 87:84-92.
12. Singhal S, Baker RD, Baker SS. A Comparison of the Nutritional Value of Cow's Milk and Nondairy Beverages. Journal of Pediatric Gastroenterology and Nutrition. 2017; 64(5):799-805.
13. Stewart H, Dong D, Carlson A. Why are Americans consuming less fluid milk? A look at generational differences in intake frequency. 2013.
14. Instituto Nacional de Estatística IP. Estatísticas da Produção e Consumo de Leite 2015. Lisboa, Portugal; 2016.
15. Mintel. Dairy and Non-Dairy Milk - US - September 2018. 2018.
16. Sethi S, Tyagi SK, Anurag RK. Plant-based milk alternatives an emerging segment of functional beverages: a review. Journal of Food Science and Technology. 2016; 53(9):3408-23.
17. Mintel. US sales of dairy milk turn sour as non-dairy milk sales grow 9% in 2015. 2016. [citado em: maio 2019]. Disponível em: https://www.mintel.com/press- centre/food-and-drink/us-sales-of-dairy-milk-turn-sour-as-non-dairy-milk-sales-grow-9-in-2015.
18. Joe Millward D, Garnett T. Plenary Lecture 3 Food and the planet: nutritional dilemmas of greenhouse gas emission reductions through reduced intakes of meat
and dairy foods: Conference on ‘Over- and undernutrition: challenges and approaches’. Proceedings of the Nutrition Society. 2010; 69(1):103-18.
19. Lopes C TD, Oliveira A, Severo M, Alarcão V, Guiomar S, Mota J, Teixeira P, Rodrigues S, Lobato L, Magalhães V, Correia D, Carvalho C, Pizarro A, Marques A, Vilela S, Oliveira L, Nicola P, Soares S, Ramos E. Inquérito Alimentar Nacional e de Atividade Física, IAN-AF 2015-2016: Relatório de resultados. Universidade do Porto; 2017.
20. Lu L, Xun P, Wan Y, He K, Cai W. Long-term association between dairy consumption and risk of childhood obesity: a systematic review and meta-analysis of prospective cohort studies. European Journal Of Clinical Nutrition. 2016; 70:414. 21. Abargouei AS, Janghorbani M, Salehi-Marzijarani M, Esmaillzadeh A. Effect of dairy consumption on weight and body composition in adults: a systematic review and meta-analysis of randomized controlled clinical trials. International Journal Of Obesity. 2012; 36:1485.
22. Chen M, Pan A, Malik VS, Hu FB. Effects of dairy intake on body weight and fat: a meta-analysis of randomized controlled trials. The American Journal of Clinical Nutrition. 2012; 96(4):735-47.
23. Booth AO, Huggins CE, Wattanapenpaiboon N, Nowson CA. Effect of increasing dietary calcium through supplements and dairy food on body weight and body composition: a meta-analysis of randomised controlled trials. British Journal of Nutrition. 2015; 114(7):1013-25.
24. Gijsbers L, Ding EL, Malik VS, de Goede J, Geleijnse JM, Soedamah-Muthu SS. Consumption of dairy foods and diabetes incidence: a dose-response meta-analysis of observational studies. The American Journal of Clinical Nutrition. 2016; 103(4):1111-24.
25. Nordic Nutrition Recommendations 2012: Integrating nutrition and physical activity. 5 ed. Copenhagen: Nordisk Ministerråd; 2014.
26. Qin L-Q, Xu J-Y, Han S, Zhang Z-L, Zhao Y, Szeto IM. Dairy consumption and risk of cardiovascular disease: an updated meta-analysis of prospective cohort studies. Asia Pacific Journal of Clinical Nutrition. 2014
27. Alexander DD, Bylsma LC, Vargas AJ, Cohen SS, Doucette A, Mohamed M, et al. Dairy consumption and CVD: a systematic review and meta-analysis. British Journal of Nutrition. 2016; 115(4):737-50.
28. O’Sullivan TA, Hafekost K, Mitrou F, Lawrence D. Food Sources of Saturated Fat and the Association With Mortality: A Meta-Analysis. American Journal of Public Health. 2013; 103(9):e31-e42.
29. Diet, nutrition, physical activity and cancer: A global perspective. Continuous Update Project Expert Report. World Cancer Research Fund/American Institute for Cancer Research; 2018.
30. Tabela da Composição de Alimentos. Lisboa: Instituto Nacional de Saúde Doutor Ricardo Jorge; 2007.
31. Vitoria I. The nutritional limitations of plant-based beverages in infancy and childhood. Nutrición Hospitalaria. 2017; 34(5).
32. Tano-Debrah K, Asiamah K, Sakyi-Dawson E, Budu AS. Effect of malt enzyme treatment on the nutritional and physicochemical characteristics of cowpea-peanut milk. In; Pretoria. University of Pretoria; 2005. p. 1-7.
33. Friedman M. Nutritional Value of Proteins from Different Food Sources. A Review. Journal of Agricultural and Food Chemistry. 1996; 44(1):6-29.
34. Dietary protein quality evaluation in human nutrition, report of an FAO expert consultation. Food and Nutrition Paper no 92. Rome: FAO 2013.
35. Michaelsen KF, Hoppe C, Roos N, Kaestel P, Stougaard M, Lauritzen L, et al. Choice of Foods and Ingredients for Moderately Malnourished Children 6 Months to 5 Years of Age. Food and Nutrition Bulletin. 2009; 30(3_suppl3):S343-S404. 36. Schaafsma G. The Protein Digestibility–Corrected Amino Acid Score. The Journal of Nutrition. 2000; 130(7):1865S-67S.
37. Mathai JK, Liu Y, Stein HH. Values for digestible indispensable amino acid scores (DIAAS) for some dairy and plant proteins may better describe protein quality than values calculated using the concept for protein digestibility-corrected amino acid scores (PDCAAS). British Journal of Nutrition. 2017; 117(4):490-99.
38. Millward DJ, Jackson AA. Protein/energy ratios of current diets in developed and developing countries compared with a safe protein/energy ratio: implications for recommended protein and amino acid intakes. Public Health Nutrition. 2004; 7(3):387-405.
39. Freitas JB, Fernandes DC, Czeder LP, Lima JCR, Sousa AG, Naves MMV. Edible seeds and nuts grown in Brazil as sources of protein for human nutrition. Food and Nutrition Sciences. 2012; 3(06):857.
40. Escudero N, De Arellano M, Luco J, Gimenez M, Mucciarelli S. Comparison of the chemical composition and nutritional value of Amaranthus cruentus flour and its protein concentrate. Plant Foods for Human Nutrition. 2004; 59(1):15-21.
41. Ruales J, Grijalva Yd, Lopez-Jaramillo P, Nair BM. The nutritional quality of an infant food from quinoa and its effect on the plasma level of insulin-like growth factor-1 (IGF-1) in undernourished children. International Journal of Food Sciences and Nutrition. 2002; 53(2):143-54.
42. House JD, Neufeld J, Leson G. Evaluating the Quality of Protein from Hemp Seed (Cannabis sativa L.) Products Through the use of the Protein Digestibility-Corrected Amino Acid Score Method. Journal of Agricultural and Food Chemistry. 2010; 58(22):11801-07.
43. Pedo I, Sgarbieri V, Gutkoski L. Protein evaluation of four oat (Avena sativa L.) cultivars adapted for cultivation in the south of Brazil. Plant Foods for Human Nutrition. 1999; 53(4):297-304.
44. Ahrens S, Venkatachalam M, Mistry AM, Lapsley K, Sathe SK. Almond (Prunus dulcis L.) protein quality. Plant Foods for Human Nutrition. 2005; 60(3):123-28.
45. Rutherfurd SM, Fanning AC, Miller BJ, Moughan PJ. Protein Digestibility-Corrected Amino Acid Scores and Digestible Indispensable Amino Acid Scores Differentially Describe Protein Quality in Growing Male Rats. The Journal of Nutrition. 2014; 145(2):372-79.
46. Boye J, Wijesinha-Bettoni R, Burlingame B. Protein quality evaluation twenty years after the introduction of the protein digestibility corrected amino acid score method. British Journal of Nutrition. 2012; 108(S2):S183-S211.
47. Jensen R, Ferris A, Lammikeefe C. Symposium-milk-fat composition, function, and potential for change-the composition of milk-fat. Journal of Dairy Science. 1991; 74(9):3228-43.
48. Kratz M, Baars T, Guyenet S. The relationship between high-fat dairy consumption and obesity, cardiovascular, and metabolic disease. European Journal of Nutrition. 2013; 52(1):1-24.
49. Atkinson FS, Foster-Powell K, Brand-Miller JC. International Tables of Glycemic Index and Glycemic Load Values: 2008. Diabetes Care. 2008; 31(12):2281-83.
50. Pineli LdLdO, Botelho RBA, Zandonadi RP, Solorzano JL, de Oliveira GT, Reis CEG, et al. Low glycemic index and increased protein content in a novel quinoa milk. Food Science and Technology. 2015; 63(2):1261-67.
51. Foster-Powell K, Holt SH, Brand-Miller JC. International table of glycemic index and glycemic load values: 2002. The American Journal of Clinical Nutrition. 2002; 76(1):5-56.
52. Bos C, Gaudichon C, Tomé D. Nutritional and Physiological Criteria in the Assessment of Milk Protein Quality for Humans. Journal of the American College of Nutrition. 2000; 19(sup2):191S-205S.
53. Heaney RP, Rafferty K, Dowell MS, Bierman J. Calcium Fortification Systems Differ in Bioavailability. Journal of the American Dietetic Association. 2005; 105(5):807-09.
54. Weaver CM, Heaney RP. Food Sources, Supplements, and Bioavailability. In: Weaver CM, Heaney RP, editores. Calcium in Human Health. Totowa: Humana Press; 2006. p. 129-42.
55. Sandberg A-S. Bioavailability of minerals in legumes. British Journal of Nutrition. 2002; 88(S3):281-85.
56. Ghavidel RA, Prakash J. The impact of germination and dehulling on nutrients, antinutrients, in vitro iron and calcium bioavailability and in vitro starch and protein digestibility of some legume seeds. Food Science and Technology. 2007; 40(7):1292-99.
57. Dendougui F, Schwedt G. In vitro analysis of binding capacities of calcium to phytic acid in different food samples. European Food Research Technology. 2004; 219(4):409-15.
58. Al-Wahsh IA, Horner HT, Palmer RG, Reddy MB, Massey LK. Oxalate and Phytate of Soy Foods. Journal of Agricultural and Food Chemistry. 2005; 53(14):5670-74.
59. Ritter MMC, Savage GP. Soluble and insoluble oxalate content of nuts. Journal of Food Composition and Analysis. 2007; 20(3):169-74.
60. Ellis D, Lieb J. Hyperoxaluria and Genitourinary Disorders in Children Ingesting Almond Milk Products. The Journal of Pediatrics. 2015; 167(5):1155-58. 61. Zhao Y, Martin BR, Weaver CM. Calcium bioavailability of calcium carbonate fortified soymilk is equivalent to cow's milk in young women [Conference Paper]. Journal of Nutrition. 2005; 135(10):2379-82.
62. Kruger MC, Gallaher BW, Schollum LM. Bioavailability of calcium is equivalent from milk fortified with either calcium carbonate or milk calcium in growing male rats. Nutrition Research. 2003; 23(9):1229-37.
63. Chaiwanon P, Puwastien P, Nitithamyong A, Sirichakwal PP. Calcium Fortification in Soybean Milk and In Vitro Bioavailability. Journal of Food Composition and Analysis. 2000; 13(4):319-27.
64. Heaney RP, Dowell MS, Rafferty K, Bierman J. Bioavailability of the calcium in fortified soy imitation milk, with some observations on method. The American Journal of Clinical Nutrition. 2000; 71(5):1166-69.
65. Heaney RP, Rafferty K. The Settling Problem in Calcium-Fortified Soybean Drinks. Journal of the Academy of Nutrition and Dietetics. 2006; 106(11):1753. 66. Heaney RP, Rafferty K, Bierman J. Not All Calcium-fortified Beverages Are Equal. Nutrition Today. 2005; 40(1):39-44.
67. Slutrapport: Næringsstofindhold i ris-, havre-, mandel- og sojadrikke. Ministry of Environment and Food of Denmark; 2015.
68. Bath SC, Hill S, Infante HG, Elghul S, Nezianya CJ, Rayman MP. Iodine concentration of milk-alternative drinks available in the UK in comparison with cows’ milk. British Journal of Nutrition. 2017; 118(7):525-32.
69. Wendy M, Xuemei H, Lewis B. Iodine Content in Milk Alternatives. Thyroid. 2016; 26(9):1308-10.
70. Zhang H, Önning G, Triantafyllou AÖ, Öste R. Nutritional properties of oat-based beverages as affected by processing and storage. Journal of the Science of Food and Agriculture. 2007; 87(12):2294-301.
71. KWOK K-C, NIRANJAN K. Effect of thermal processing on soymilk. International Journal of Food Science & Technology. 1995; 30(3):263-95.
72. Taylor J, Taylor JRN. Alleviation of the adverse effect of cooking on sorghum protein digestibility through fermentation in traditional African porridges. International Journal of Food Science & Technology. 2002; 37(2):129-37.
73. Greffeuille V, Polycarpe Kayodé AP, Icard-Vernière C, Gnimadi M, Rochette I, Mouquet-Rivier C. Changes in iron, zinc and chelating agents during traditional African processing of maize: Effect of iron contamination on bioaccessibility. Food Chemistry. 2011; 126(4):1800-07.
74. Silva SI, Tavano OL, Demonte A, Rossi EA, Pinto A. Nutritional evaluation of soy yoghurt in comparison to soymilk and commercial milk yoghurt. Effect of fermentation on soy protein. Acta Alimentaria. 2012; 41(4):443-50.
75. Donkor ON, Henriksson A, Vasiljevic T, Shah NP. α-Galactosidase and proteolytic activities of selected probiotic and dairy cultures in fermented soymilk. Food Chemistry. 2007; 104(1):10-20.
76. Bansal S, Mangal M, Sharma SK, Gupta RK. Non-dairy Based Probiotics: A Healthy Treat for Intestine. Critical Reviews in Food Science and Nutrition. 2016; 56(11):1856-67.
77. Gupta S, Abu-Ghannam N. Probiotic Fermentation of Plant Based Products: Possibilities and Opportunities. Critical Reviews in Food Science and Nutrition. 2012; 52(2):183-99.
78. Rivera-Espinoza Y, Gallardo-Navarro Y. Non-dairy probiotic products. Food Microbiology. 2010; 27(1):1-11.
79. Granato D, Branco GF, Nazzaro F, Cruz AG, Faria JAF. Functional Foods and Nondairy Probiotic Food Development: Trends, Concepts, and Products. Comprehensive Reviews in Food Science and Food Safety. 2010; 9(3):292-302. 80. Ahmad N, Li L, Yang XQ, Ning ZX, Randhawa MA. Improvements in the flavour of soy cheese. Food Technology and Biotechnology. 2008; 46(3):252-61. 81. Martensson O, Andersson C, Andersson K, Oste R, Holst O. Formulation of an oat-based fermented product and its comparison with yoghurt. Journal of the Science of Food and Agriculture. 2001; 81(14):1314-21.
82. Gardner CD, Messina M, Kiazand A, Morris JL, Franke AA. Effect of Two Types of Soy Milk and Dairy Milk on Plasma Lipids in Hypercholesterolemic Adults: A Randomized Trial. Journal of the American College of Nutrition. 2007; 26(6):669-77.
83. Beavers KM, Serra MC, Beavers DP, Hudson GM, Willoughby DS. The Lipid-Lowering Effects of 4 Weeks of Daily Soymilk or Dairy Milk Ingestion in a Postmenopausal Female Population. Journal of Medicinal Food. 2010; 13(3):650-56.
84. Eslami O, Shidfar F. Soy milk: A functional beverage with hypocholesterolemic effects? A systematic review of randomized controlled trials. Complementary Therapies in Medicine. 2019; 42:82-88.
85. Beavers KM, Serra MC, Beavers DP, Cooke MB, Willoughby DS. Soymilk supplementation does not alter plasma markers of inflammation and oxidative stress in postmenopausal women. Nutrition Research. 2009; 29(9):616-22.
86. Lindström C, Voinot A, Forslund A, Holst O, Rascón A, Öste R, et al. An oat bran-based beverage reduce postprandial glycaemia equivalent to yoghurt in healthy overweight subjects. International Journal of Food Sciences and Nutrition. 2015; 66(6):700-05.
87. Önning G, Åkesson B, Öste R, Lundquist I. Effects of Consumption of Oat Milk, Soya Milk, or Cow’s Milk on Plasma Lipids and Antioxidative Capacity in Healthy Subjects. Annals of Nutrition and Metabolism. 1998; 42(4):211-20.
88. Le Louer B, Lemale J, Garcette K, Orzechowski C, Chalvon A, Girardet JP, et al. Conséquences nutritionnelles de l’utilisation de boissons végétales inadaptées chez les nourrissons de moins d’un an. Archives de Pédiatrie. 2014; 21(5):483-88. 89. Carvalho NF, Kenney RD, Carrington PH, Hall DE. Severe Nutritional Deficiencies in Toddlers Resulting From Health Food Milk Alternatives. Pediatrics. 2001; 107(4):e46-e46.
90. Anil M, Demirakca S, Dotsch J, Kiess W. Hypocalcemia-hyperphosphatemia due to soy milk feeding in early infancy. Klinische Padiatrie. 1996; 208(6):323-26. 91. Straub S, Hückel D, Borte M, Schuster V. Hypocalcaemic tetany through feeding with almond milk. Internistische Praxis. 2006.
92. Fourreau D, Peretti N, Hengy B, Gillet Y, Courtil-Teyssedre S, Hess L, et al. Pediatric nutrition: Severe deficiency complications by using vegetable beverages, four cases report. La Presse Médicale. 2013; 42(2):e37-e43.
93. Fox AT, Du Toit G, Lang A, Lack G. Food allergy as a risk factor for nutritional rickets. Pediatric Allergy and Immunology. 2004; 15(6):566-69.
94. Imataka G, Mikami T, Yamanouchi H, Kano K, Eguchi M. Vitamin D deficiency rickets due to soybean milk. Journal of Paediatrics and Child Health. 2004; 40(3):154-55.
95. Massa G, Vanoppen A, Gillis P, Aerssens P, Alliet P, Raes M. Protein malnutrition due to replacement of milk by rice drink. European Journal of Pediatrics. 2001; 160(6):382-84.
96. Liu T, Howard RM, Mancini AJ, Weston WL, Paller AS, Drolet BA, et al. Kwashiorkor in the United States: fad diets, perceived and true milk allergy, and nutritional ignorance. Archives of Dermatology. 2001; 137(5):630-36.
97. Novembre E, Leo G, Cianferoni A, Bernardini R, Pucci Nu, Vierucci A. Severe hypoproteinemia in infant with AD. Allergy. 2003; 58(1):88-89.
98. Kuhl J, Davis MD, Kalaaji AN, Kamath PS, Hand JL, Peine CJ. Skin signs as the presenting manifestation of severe nutritional deficiency: report of 2 cases. Archives of Dermatology. 2004; 140(5):521-24.
99. Katz KA, Mahlberg MH, Honig PJ, Yan AC. Rice nightmare: Kwashiorkor in 2 Philadelphia-area infants fed Rice Dream beverage. Journal of the American Academy of Dermatology. 2005; 52(5):S69-S72.
100. Tierney EP, Sage RJ, Shwayder T. Kwashiorkor from a severe dietary restriction in an 8-month infant in suburban Detroit, Michigan: case report and review of the literature. International Journal of Dermatology. 2010; 49(5):500-06.
101. Diamanti A, Pedicelli S, D’Argenio P, Panetta F, Alterio A, Torre G. Iatrogenic Kwashiorkor in three infants on a diet of rice beverages. Pediatric Allergy and Immunology. 2011; 22(8):878-79.
102. Keller MD, Shuker M, Heimall I, Cianferoni A. Severe malnutrition resulting from use of rice milk in food elimination diets for atopic dermatitis. Israel Medical Association Journal. 2012; 14(1):40.
103. Mori F, Serranti D, Barni S, Pucci N, Rossi ME, de Martino M, et al. A kwashiorkor case due to the use of an exclusive rice milk diet to treat atopic dermatitis. Nutrition Journal. 2015; 14(1):83.
104. Vitoria I, López B, Gómez J, Torres C, Guasp M, Calvo I, et al. Improper Use of a Plant-Based Vitamin C–Deficient Beverage Causes Scurvy in an Infant. Pediatrics. 2016; 137(2):e20152781.
105. Doron D, Hershkop K, Granot E. Nutritional deficits resulting from an almond-based infant diet. Clinical Nutrition. 2001; 20(3):259-61.
106. Mesa Medina O, González JL, García Nieto V, Romero Ramírez S, Marrero Pérez C. Alcalosis metabólica de origen dietético en un lactante. Anales de Pediatría. 2009; 70(4):370-73.
107. Morency M-E, Birken CS, Lebovic G, Chen Y, L’Abbé M, Lee GJ, et al. Association between noncow milk beverage consumption and childhood height. The American Journal of Clinical Nutrition. 2017; 106(2):597-602.
108. Lee GJ, Birken CS, Parkin PC, Lebovic G, Chen Y, L'Abbé MR, et al. Consumption of non-cow's milk beverages and serum vitamin D levels in early childhood. Canadian Medical Association Journal. 2014; 186(17):1287-93.
109. Wu J, Zeng R, Huang J, Li X, Zhang J, Ho JC-M, et al. Dietary Protein Sources and Incidence of Breast Cancer: A Dose-Response Meta-Analysis of Prospective Studies. Nutrients. 2016; 8(11):730.
110. Zaheer K, Akhtar MH. An updated review of dietary isoflavones: Nutrition, processing, bioavailability and impacts on human health. Critical Reviews in Food Science and Nutrition. 2017; 57(6):1280-93.
111. Takagi A, Kano M, Kaga C. Possibility of Breast Cancer Prevention: Use of Soy Isoflavones and Fermented Soy Beverage Produced Using Probiotics. International Journal of Molecular Sciences. 2015; 16(5):10907-20.
112. Authority EFS. Dietary exposure to inorganic arsenic in the European population. EFSA Journal. 2014; 12(3):3597.
113. van Vliet S, Burd NA, van Loon LJ. The Skeletal Muscle Anabolic Response to Plant- versus Animal-Based Protein Consumption. The Journal of Nutrition. 2015; 145(9):1981-91.
Índice de Anexos
Anexo A ... 26 Tabela I. Valor energético das alternativas vegetais ao leite alvo de revisão. ... 26 Tabela II. Teor de proteína das alternativas vegetais ao leite alvo de revisão. ... 27 Tabela III. Teores de gordura e gordura saturada das alternativas vegetais ao leite alvo de revisão. ... 29 Tabela IV. Teores de hidratos de carbono e açúcar das alternativas vegetais ao leite alvo de revisão. ... 31 Tabela V. Teor de cálcio das alternativas vegetais ao leite alvo de revisão. ... 32 Anexo B ... 35 Tabela VI. Perfil nutricional de alternativas vegetais ao leite à base de arroz disponíveis no mercado português, num total de 8 marcas. ... 35 Tabela VII. Perfil nutricional de alternativas vegetais ao leite à base de aveia disponíveis no mercado português, num total de 12 marcas. ... 36 Tabela VIII. Perfil nutricional de alternativas vegetais ao leite à base de espelta disponíveis no mercado português, num total de 3 marcas. ... 37 Tabela IX. Perfil nutricional de alternativas vegetais ao leite à base de amêndoa disponíveis no mercado português, num total de 10 marcas. ... 38 Tabela X. Perfil nutricional de alternativas vegetais ao leite à base de avelã (3 marcas), à base de caju (2 marcas) e à base de noz (1 marca) disponíveis no mercado português. ... 39 Tabela XI. Perfil nutricional de alternativas vegetais ao leite à base de coco disponíveis no mercado português, num total de 7 marcas. ... 40 Tabela XII. Perfil nutricional de alternativas vegetais ao leite à base de soja disponíveis no mercado português, num total de 9 marcas. ... 40
Tabela XIII. Perfil nutricional de alternativas vegetais ao leite à base de quinoa disponíveis no mercado português, num total de 2 marcas. ... 42
Anexo A
Tabela I. Valor energético das alternativas vegetais ao leite alvo de revisão.
Referências Alternativas vegetais ao leite Valor energético (kcal/100g)
Classe Tipo N Mínimo Máximo Média
Scholz-Ahrens et al. (2019) Cereais Arroz 1 - - 60,0 Aveia 1 - - 45,0 Espelta 1 - - 81,0 Frutos oleaginosos Amêndoa 1 - - 31,0 Avelã 2 29,0 36,0 32,5 Caju 1 - - 23,0 Coco 2 45,0 178,0 111,5 Leguminosas Soja 2 45,0 67,0 56,0 Sementes Cânhamo 1 - - 40,0 Vanga e Raghavan (2018) Cereais Arroz 5 41,7 58,3 55,4 Frutos oleaginosos Amêndoa 7 12,5 20,8 15,2 Coco 4 18,8 25,0 20,3 Leguminosas Soja 6 33,3 50,0 39,6 Chalupa-Krebzdak et al. (2018) Cereais Arroz 1 - - 47,0 Frutos oleaginosos Amêndoa 5 12,0 25,0 18,0 Caju 2 25,0 79,0 52,0 Coco 3 50,0 92,0 72,7 Leguminosas Soja 5 33,0 58,0 44,2 Sementes Cânhamo 1 - - 19,0 Singhal et al. (2017) Cereais Arroz 1 - - 50,0 Aveia 1 - - 54,2 Frutos oleaginosos Amêndoa 1 - - 25,0 Avelã 1 - - 45,8 Caju 1 - - 25,0 Coco 1 - - 33,3 Leguminosas Soja 1 - - 41,5 Sementes Cânhamo 1 - - 33,3 Cereais Arroz 24 47,0 68,0 56,8
Vitoria (2017) Aveia 31 30,0 60,0 45,3 Frutos oleaginosos Amêndoa 22 25,0 74,0 40,2 Coco 6 15,0 53,0 33,8 Leguminosas Soja 54 27,0 80,7 46,7 Mäkinen et al. (2016) Cereais Arroz 2 47,0 60,0 53,5 Aveia 3 35,0 66,0 50,3 Frutos oleaginosos Amêndoa 1 - - 24,0 Leguminosas Soja 3 32,0 45,0 38,3 Pseudocereais Amaranto 1 - - 52,0 Quinoa 1 - - 46,0 Sementes Cânhamo 1 - - 36,0 Sésamo 1 - - 51,0 Sethi et al. (2016) Cereais Arroz 1 - - 54,2 Aveia 1 - - 33,3 Frutos oleaginosos Amêndoa 1 - - 16,7 Avelã 1 - - 51,7 Coco 1 - - 33,3 Leguminosas Soja 1 - - 33,3 Pseudocereais Quinoa 1 - - 43,3 Sementes Cânhamo 1 - - 29,2 Sésamo 1 - - 58,3
Tabela II. Teor de proteína das alternativas vegetais ao leite alvo de revisão.
Referências Alternativas vegetais ao leite Teor de proteína (g/100g)
Classe Tipo N Mínimo Máximo Média
Scholz-Ahrens et al. (2019) Cereais Arroz 1 - - 0,3 Aveia 1 - - 1,0 Espelta 1 - - 1,1 Frutos oleaginosos Amêndoa 1 - - 0,8 Avelã 2 0,4 0,6 0,5 Caju 1 - - 0,5 Coco 2 0,5 1,6 1,1
Leguminosas Soja 2 3,4 3,7 3,6 Sementes Cânhamo 1 - - 1,0 Vanga e Raghavan (2018) Cereais Arroz 5 0,0 0,8 0,4 Frutos oleaginosos Amêndoa 6 0,4 2,1 0,7 Coco 4 0,0 0,0 0,0 Leguminosas Soja 7 2,9 5,0 3,6 Chalupa-Krebzdak et al. (2018) Cereais Arroz 1 - - 0,3 Frutos oleaginosos Amêndoa 5 0,3 2,1 0,8 Caju 2 0,4 2,2 1,3 Coco 3 0,6 2,0 1,3 Leguminosas Soja 5 2,5 3,2 2,9 Sementes Cânhamo 1 - - 0,8 Singhal et al. (2017) Cereais Arroz 1 - - 0,4 Aveia 1 - - 1,7 Frutos oleaginosos Amêndoa 1 - - 0,4 Avelã 1 - - 1,5 Caju 1 - - <0,4 Coco 1 - - 0,4 Leguminosas Soja 1 - - 2,9 Sementes Cânhamo 1 - - 0,8 Vitoria (2017) Cereais Arroz 24 0,1 0,8 0,3 Aveia 31 0,3 1,4 0,9 Frutos oleaginosos Amêndoa 22 0,3 1,6 0,8 Coco 6 0,1 0,5 0,2 Leguminosas Soja 54 2,1 3,8 3,1 Mäkinen et al. (2016) Cereais Arroz 2 0,1 0,2 0,2 Aveia 3 0,4 1,0 0,7 Frutos oleaginosos Amêndoa 1 - - 0,5 Leguminosas Soja 3 2,9 3,7 3,3 Pseudocereais Amaranto 1 - - 0,6 Quinoa 1 - - 1,5 Sementes Cânhamo 1 - - 1,3 Sésamo 1 - - 0,6
Sethi et al. (2016) Cereais Arroz 1 - - 0,4 Aveia 1 - - 1,0 Frutos oleaginosos Amêndoa 1 - - 0,4 Avelã 1 - - 0,6 Coco 1 - - <0,4 Leguminosas Soja 1 - - 2,9 Pseudocereais Quinoa 1 - - 1,9 Sementes Cânhamo 1 - - 0,8 Sésamo 1 - - 0,6
Tabela III. Teores de gordura e gordura saturada das alternativas vegetais ao leite alvo de revisão.
Referências Alternativas vegetais ao leite Teor de gordura (saturada) (g/100g)
Classe Tipo N Mínimo Máximo Média
Scholz-Ahrens et al. (2019) Cereais Arroz 1 - - 0,9(ND) Aveia 1 - - 1,5(ND) Espelta 1 - - 1,8(ND) Frutos oleaginosos Amêndoa 1 - - 2,9(ND) Avelã 2 1,6(ND) 2,6(ND) 2,1(ND) Caju 1 - - 1,1(ND) Coco 2 4,5(ND) 18,5(ND) 11,5(ND) Leguminosas Soja 2 2,1(ND) 2,2(ND) 2,2(ND) Sementes Cânhamo 1 - - 2,9(ND) Vanga e Raghavan (2018) Cereais Arroz 5 0,8(0,0) 1,1(0,2) 1,0(0,1) Frutos oleaginosos Amêndoa 7 0,8(0,0) 1,5(0,0) 1,1(0,0) Coco 4 1,7(1,5) 2,1(2,1) 1,8(1,7) Leguminosas Soja 7 1,0(0,0) 2,5(0,4) 1,8(0,3) Chalupa-Krebzdak et al. (2018) Cereais Arroz 1 - - 1,0(0,0) Frutos oleaginosos Amêndoa 5 0,8(0,0) 1,1(0,0) 1,0(0,0) Caju 2 1,0(0,0) 5,3(0,9) 3,2(0,4) Coco 3 4,1(3,5) 6,0(5,0) 5,0(2,8)
Leguminosas Soja 5 1,5(1,3) 3,7(0,2) 2,0(0,4) Sementes Cânhamo 1 - - 1,3(0,0) Singhal et al. (2017) Cereais Arroz 1 - - 1,0(0,0) Aveia 1 - - 1,0(0,0) Frutos oleaginosos Amêndoa 1 - - 1,0(0,0) Avelã 1 - - 0,8(0,0) Caju 1 - - 1,0(0,0) Coco 1 - - 2,1(1,9) Leguminosas Soja 1 - - 1,7(0,2) Sementes Cânhamo 1 - - 2,9(0,2) Vitoria (2017) Cereais Arroz 24 0,8(ND) 2,0(ND) 0,9(ND) Aveia 31 0,5(ND) 1,8(ND) 1,1(ND) Frutos oleaginosos Amêndoa 22 1,1(ND) 2,8(ND) 2,0(ND) Coco 6 0,1(ND) 3,3(ND) 1,8(ND) Leguminosas Soja 54 0,9(ND) 2,9(ND) 1,8(ND) Mäkinen et al. (2016) Cereais Arroz 2 1,0(0,1) 1,2(0,2) 1,1(0,2) Aveia 3 0,7(0,1) 1,5(0,6) 1,2(0,3) Frutos oleaginosos Amêndoa 1 - - 1,1(0,1) Leguminosas Soja 3 1,7(0,3) 2,0(0,3) 1,9(0,3) Pseudocereais Amaranto 1 - - 1,9(0,5) Quinoa 1 - - 2,8(0,7) Sementes Cânhamo 1 - - 2,4(0,3) Sésamo 1 - - 2,4(0,5) Sethi et al. (2016) Cereais Arroz 1 - - 0,8(ND) Aveia 1 - - 1,7(ND) Frutos oleaginosos Amêndoa 1 - - 1,3(ND) Avelã 1 - - 2,5(ND) Coco 1 - - 2,1(ND) Leguminosas Soja 1 - - 1,7(ND) Pseudocereais Quinoa 1 - - 2,5(ND) Sementes Cânhamo 1 - - 2,5(ND) Sésamo 1 - - 2,5(ND)
Tabela IV. Teores de hidratos de carbono e açúcar das alternativas vegetais ao leite alvo de revisão.
Referências
Alternativas vegetais ao leite Teor de hidratos de carbono(açúcar) (g/100g)
Classe Tipo N Mínimo Máximo Média
Scholz-Ahrens et al. (2019) Cereais Arroz 1 - - 12,5(ND) Aveia 1 - - 6,5(ND) Espelta 1 - - 15,0(ND) Frutos oleaginosos Amêndoa 1 - - 0,2(ND) Avelã 2 2,6(ND) 3,1(ND) 2,9(ND) Caju 1 - - 2,6(ND) Coco 2 0,5(ND) 2,0(ND) 1,3(ND) Leguminosas Soja 2 2,4(ND) 8,1(ND) 5,3(ND) Sementes Cânhamo 1 - - 2,2(ND) Vanga e Raghavan (2018) Cereais Arroz 5 9,6(4,2) 11,3(6,5) 10,5(5,5) Frutos oleaginosos Amêndoa 6 0,1(0,0) 1,3(0,3) 0,6(0,1) Coco 4 0,3(0,0) 0,8(0,4) 0,5(0,3) Leguminosas Soja 7 1,3(0,4) 3,3(2,9) 2,1(1,4) Chalupa-Krebzdak et al. (2018) Cereais Arroz 1 - - 9,2(ND) Frutos oleaginosos Amêndoa 5 0,4(ND) 3,3(ND) 1,7(ND) Caju 2 3,8(ND) 5,7(ND) 4,7(ND) Coco 3 3,8(ND) 9,4(ND) 6,7(ND) Leguminosas Soja 5 1,7(ND) 5,0(ND) 3,5(ND) Sementes Cânhamo 1 - - 2,5(ND) Singhal et al. (2017) Cereais Arroz 1 - - 9,6(4,2) Aveia 1 - - 10,0(7,9) Frutos oleaginosos Amêndoa 1 - - 3,3(2,9) Avelã 1 - - 7,9(5,8) Caju 1 - - 3,8(2,9) Coco 1 - - 2,9(2,5) Leguminosas Soja 1 - - 3,3(2,5) Sementes Cânhamo 1 - - 3,3(0,0)
Vitoria (2017) Cereais Arroz 24 9,4(ND) 14,2(ND) 11,5(ND) Aveia 31 4,4(ND) 11,0(ND) 7,5(ND) Frutos oleaginosos Amêndoa 22 0,1(ND) 10,5(ND) 4,4(ND) Coco 6 2,0(ND) 9,1(ND) 4,3(ND) Leguminosas Soja 54 0,1(ND) 11,8(ND) 4,3(ND) Mäkinen et al. (2016) Cereais Arroz 2 9,4(4,0) 12,2(5,0) 10,8(4,5) Aveia 3 6,5(4,0) 12,7(5,7) 9,3(4,7) Frutos oleaginosos Amêndoa 1 - - 3,0(3,0) Leguminosas Soja 3 0,2(0,1) 3,1(2,7) 2,0(1,8) Pseudocereais Amaranto 1 - - 8,0(5,0) Quinoa 1 - - 3,7(2,5) Sementes Cânhamo 1 - - 2,2(2,1) Sésamo 1 - - 6,7(3,4) Sethi et al. (2016) Cereais Arroz 1 - - 11,3(ND) Aveia 1 - - 6,7(ND) Frutos oleaginosos Amêndoa 1 - - 0,8(ND) Avelã 1 - - 5,8(ND) Coco 1 - - 2,9(ND) Leguminosas Soja 1 - - 1,7(ND) Pseudocereais Quinoa 1 - - 3,8(ND) Sementes Cânhamo 1 - - 0,4(ND) Sésamo 1 - - 6,9(ND)
Legenda: ND – Não Definido
Tabela V. Teor de cálcio das alternativas vegetais ao leite alvo de revisão.
Referências Alternativas vegetais ao leite Teor de cálcio (mg/100g)
Classe Tipo N Mínimo Máximo Média
Scholz-Ahrens et al. (2019) Cereais Arroz 1 - - ND Aveia 1 - - 120,0 Espelta 1 - - 120,0 Frutos oleaginosos Amêndoa 1 - - ND Avelã 2 - - 120,0
Caju 1 - - ND Coco 2 ND Leguminosas Soja 2 - - 120,0 Sementes Cânhamo 1 - - ND Vanga e Raghavan (2018) Cereais Arroz 5 9,2 137,5 102,3 Frutos oleaginosos Amêndoa 7 9,2 206,3 135,5 Coco 4 18,3 206,3 102,0 Leguminosas Soja 7 0,0 160,4 85,8 Chalupa-Krebzdak et al. (2018) Cereais Arroz 1 - - 118,0 Frutos oleaginosos Amêndoa 5 42,0 197,0 160,0 Caju 2 9,0 188,0 98,5 Coco 3 0,0 176,0 58,7 Leguminosas Soja 5 0,0 188,0 113,0 Sementes Cânhamo 1 - - 12,0 Singhal et al. (2017) Cereais Arroz 1 - - 8,3 Aveia 1 - - 145,8 Frutos oleaginosos Amêndoa 1 - - 187,5 Avelã 1 - - 125,0 Caju 1 - - 187,5 Coco 1 - - 187,5 Leguminosas Soja 1 - - 187,5 Sementes Cânhamo 1 - - 125,0 Vitoria (2017) Cereais Arroz 24 - - ND Aveia 31 - - ND Frutos oleaginosos Amêndoa 22 - - ND Coco 6 - - ND Leguminosas Soja 54 - - ND Mäkinen et al. (2016) Cereais Arroz 2 - - ND Aveia 3 - - ND Frutos oleaginosos Amêndoa 1 - - ND
Leguminosas Soja 3 - - ND Pseudocereais Amaranto 1 - - ND Quinoa 1 - - ND Sementes Cânhamo 1 - - ND Sésamo 1 - - ND Sethi et al. (2016) Cereais Arroz 1 - - ND Aveia 1 - - ND Frutos oleaginosos Amêndoa 1 - - ND Avelã 1 - - ND Coco 1 - - ND Leguminosas Soja 1 - - ND Pseudocereais Quinoa 1 - - ND Sementes Cânhamo 1 - - ND Sésamo 1 - - ND