UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
EFEITO DA MIELOGRAFIA NO TEMPO DE ESTUDO POR RESSONÂNCIA MAGNÉTICA DE BAIXO CAMPO EM 69 CÃES NA REGIÃO T3-L3
DISSERTAÇÃO DE MESTRADO EM MEDICINA VETERINÁRIA
Leandro Xavier Resende Rocha
ORIENTADOR
Professor Doutor Mário Manuel Dinis Ginja
COORIENTADOR
Doutor João Carlos Gil da Silva Ribeiro
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
EFEITO DA MIELOGRAFIA NO TEMPO DE ESTUDO POR RESSONÂNCIA MAGNÉTICA DE BAIXO CAMPO EM 69 CÃES NA REGIÃO T3-L3
DISSERTAÇÃO DE MESTRADO EM MEDICINA VETERINÁRIA
Leandro Xavier Resende Rocha
ORIENTADOR
Professor Doutor Mário Manuel Dinis Ginja
COORIENTADOR
Doutor João Carlos Gil da Silva Ribeiro
COMPOSIÇÃO DO JÚRI Professor Doutor Artur Varejão Professor Doutor Nuno Alegria
Doutor João Carlos Gil da Silva Ribeiro
DECLARAÇÃO
NOME: LEANDRO XAVER RESENDE ROCHA
C.C.: 13632078
TELEMÓVEL: (+351) 916804017
CORREIO ELECTRÓNICO: LEANDRO.XAVIER.ROCHA@GMAIL.COM
DESIGNAÇÃO DO MESTRADO: MESTRADO INTEGRADO EM MEDICINA VETERINÁRIA
TÍTULO DA DISSERTAÇÃO DE MESTRADO EM MEDICINA VETERINÁRIA:
EFEITO DA MIELOGRAFIA NO TEMPO DE ESTUDO POR RESSONÂNCIA MAGNÉTICA DE BAIXO CAMPO EM 69 CÃES NA REGIÃO T3-L3
ORIENTADORES:
PROFESSOR DOUTOR MÁRIO MANUEL DINIS GINJA DOUTOR JOÃO CARLOS GIL DA SILVA RIBEIRO
ANO DE CONCLUSÃO: 2013
DECLARO QUE ESTA DISSERTAÇÃO DE MESTRADO É RESULTADO DA MINHA PESQUISA E TRABALHO PESSOAL E DAS ORIENTAÇÕES DOS MEUS SUPERVISORES. O SEU CONTEÚDO É ORIGINAL E TODAS AS FONTES CONSULTADAS ESTÃO DEVIDAMENTE MENCIONADAS NO TEXTO, E NA BIBLIOGRAFIA FINAL. ESTE TRABALHO NÃO FOI APRESENTADO EM NENHUMA OUTRA INSTITUIÇÃO PARA OBTENÇÃO DE QUALQUER GRAU ACADÉMICO.
DECLARO AINDA QUE PARTE DO CONTEÚDO DESTE TRABALHO FOI APRESENTADO PUCLICAMENTE NO 26º SIMPÓSIO ANUAL DA SOCIEDADE EUROPEIA DE NEUROLOGIA VETERINÁRIA E DO COLÉGIO EUROPEU DE NEUROLOGIA VETERINÁRIA SOB A FORMA DE UM POSTER.
Dedicatória
Aos meus pais Ao meu irmão
Agradecimentos
As minhas primeiras palavras de agradecimento dirigem-se ao Prof. Doutor Mário Ginja, meu orientador que sempre esteve presente e disponível ao longo deste longo processo, ajudando e transmitindo os seus conhecimentos para a realização deste trabalho.
Ao Doutor João Ribeiro por me ter recebido como estagiário no Centro de Referência Veterinária, me ter aceitado como coorientador e por todos os conhecimentos transmitidos. De realçar a paciência que teve comigo e agradecer a forma como nos faz chegar o conhecimento, instigando a pesquisa e a auto superação de forma a assimilar os conhecimentos. Um grande obrigado a toda a equipa que faz parte do Centro de Referência Veterinária.
Um especial agradecimento às enfermeiras Sílvia Ferreira e Susana Ferreira pelos momentos de aprendizagem e bom humor passados durante o meu estágio. Pelos conhecimentos transmitidos e pela paciência comigo.
A todas as pessoas que conheci pela minha breve passagem em León, pela experiência de vida e conhecimentos partilhados.
Aos meus amigos de longa data, que estão lá sempre quando preciso deles. Ricardo Santos, Edgar Coelho, Tomé Azevedo, Diogo Ferreira, David Pinho, Pedro Moreira, Maria Andrade, um muito obrigado por fazerem parte deste percurso e por estarem lá para mim quando é necessário.
Às grandes amizades feitas nestes anos académicos, pessoas que me acompanham e fazem parte da minha vida, as quais não irei esquecer. Um grande obrigado ao Alfredo Teixeira, Rui Pedro Freitas, Paulo Afonso, Moisés Gonçalves, Jorge Lopes, Carlos Costa, Marcos Silva.
Ao meu irmão pelos bons e maus momentos passados, pela cumplicidade existente, por ser uma excelente pessoa do qual tenho imenso orgulho.
Por fim, aos meus pais que fizeram os possíveis e impossíveis ao longo da minha vida para me poderem proporcionar esta magnífica experiência. Um muito obrigado por me terem acompanhado neste longo percurso e por me terem possibilitado tudo aquilo que experienciei nesta longa vida académica. Um muito obrigado.
Resumo
A nível neurológico, a incidência de lesões medulares é muito comum na prática veterinária, sendo a hérnia discal o diagnóstico de maior ocorrência. Na coluna vertebral, a incidência das lesões ao nível toracolombar (T3-L3) é maior que nas regiões cervical, lombar e lombossagrada, sendo reportadas percentagens de incidência que rondam os 66 a 83% das lesões medulares.
Os casos incluídos, após anamnese completa seguida de exame neurológico rigoroso, efetuaram o mesmo processo de diagnóstico imagiológico que combina a radiografia de contraste (mielografia) seguida de ressonância magnética à zona suspeita determinada pela mielografia ou, noutros casos, à zona toracolombar (T3-L3) completa devido a uma mielografia inconclusiva.
As ressonâncias magnéticas de baixo campo em veterinária promovem estudos que consomem muito tempo devido a longas sequências necessárias para adquirir imagens com qualidade diagnóstica. Estas unidades de diagnóstico têm um campo de imagem (FOV – field of view) máximo pequeno. Regiões anatómicas que ultrapassem este limite necessitam de estudos mais longos, repetindo as sequências necessárias ao longo da região que se pretende estudar, principalmente na região toracolombar.
Foram avaliados os tempos de mielografia e de ressonância magnética de 69 animais com lesão toracolombar com o objetivo de investigar o efeito da mielografia combinada com a ressonância magnética de baixo campo no tempo de estudo final da mesma e comparar com o tempo estimado para a zona toracolombar do mesmo animal se fosse uma ressonância sem mielografia prévia.
Este estudo permitiu concluir que a mielografia contribuiu para reduzir o tempo de estudo em ressonância magnética (média de 39min, intervalo 6-67) e o número de FOVs necessários (média de 1,23) comparativamente com o tempo estimado (ET-MR), especialmente em cães maiores (TLd> 29cm).
Palavras-chave
Abstract
At a neurological level, the incidence of spinal cord injuries are very common in veterinary practice, with disc herniation diagnosis being the major occurrence. The incidence of injury to the thoracolumbar (T3-L3) region is higher than that in the cervical, lumbar and lombossagrada regions, with reported rates of incidence are around 66-83% of spinal cord injuries.
The cases included in this study, after complete recollection of history followed by thorough neurological exam, underwent the same diagnostic imaging process that combines myelography followed by magnetic resonance at the suspected area determined by myelography or, in other cases, the complete thoracolumbar area (L3-T3) due to an inconclusive myelography.
In veterinary, the low-field MRI promote time-consuming studies due to long sequences necessary to acquire images with diagnostic quality. These diagnostic units have a small maximum field of view (FOV). Some regions, that exceeds this limit, require longer studies, repeating sequences throughout the region, especially in the thoracolumbar region.
The time of myelography and magnetic resonance imaging of 69 animals with thoracolumbar injury were recorded and evaluated in order to investigate the effect of myelography combined with low-field MRI in the time of study and compare it with the estimated time of a resonance for the thoracolumbar area without prior myelography.
This study concluded that myelography helped reduce the MRI study time (average 39min, range 6-67) and the number of FOVs required (average 1.23) compared with the estimated time (ET-MR) especially in larger dogs (TLD> 29cm).
Keywords
Índice Geral
Dedicatória ... v Agradecimentos ... vii Resumo ... ix Abstract ... xi Índice de figuras ... xvÍndice de gráficos ... xvii
Lista de abreviaturas ... xix
Introdução ... 1
Capítulo I
... 31. Revisão bibliográfica ... 3
1.1. Métodos de pesquisa e estrutura ... 3
1.2. Anatomia do disco intervertebral ... 3
1.3. Anatomia da medula espinhal ... 5
1.4. Degenerescência do disco intervertebral ... 7
1.4.1. Etiologia e fisiopatologia ... 7 1.4.2. Sinais clínicos ... 9 1.4.3. Diagnóstico ... 12 1.4.3.1. Anamnese ... 12 1.4.3.2. Exame físico ... 12 1.4.3.2.1. Exame neurológico ... 13 1.4.3.3. Diagnóstico imagiológico... 15 1.4.4. Diagnóstico diferencial ... 16 1.4.5. Tratamento... 17 1.4.5.1. Tratamento conservador ... 17 1.4.5.2. Tratamento cirúrgico ... 18 1.4.6. Prognóstico ... 19 1.5. Mielopatia degenerativa ... 21 1.6. Mielografia ... 22 1.6.1. Considerações gerais ... 22 1.6.2. Efeitos secundários ... 24
1.6.3. Interpretação ... 25
1.7. Ressonância Magnética ... 27
1.7.1. Princípios básicos ... 27
1.7.2. Sequências Spin-Echo ... 30
1.7.3. Sequências de inversão da recuperação ... 31
1.7.4. Ressonância magnética no diagnóstico de doença discal... 32
Capítulo II
... 38 2.1. Objetivos ... 38 2.2. Material e métodos ... 38 2.3. Resultados ... 40 2.4. Discussão ... 55 2.5. Conclusão ... 57Capítulo III
– Referências bibliográficas ... 59Índice de figuras
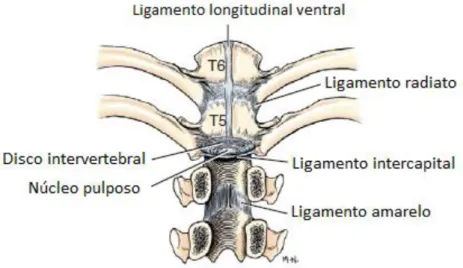
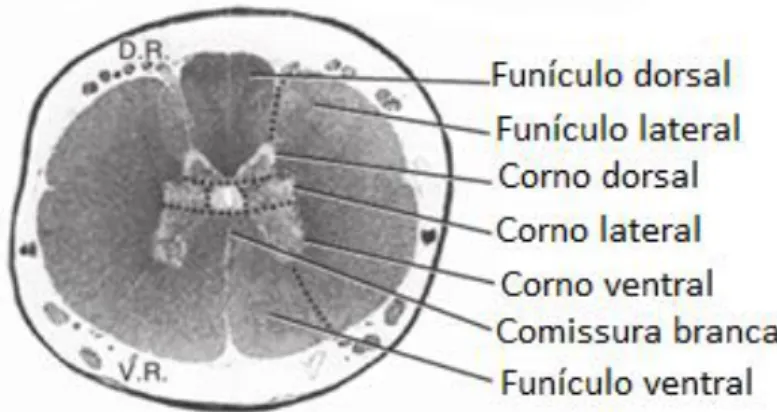
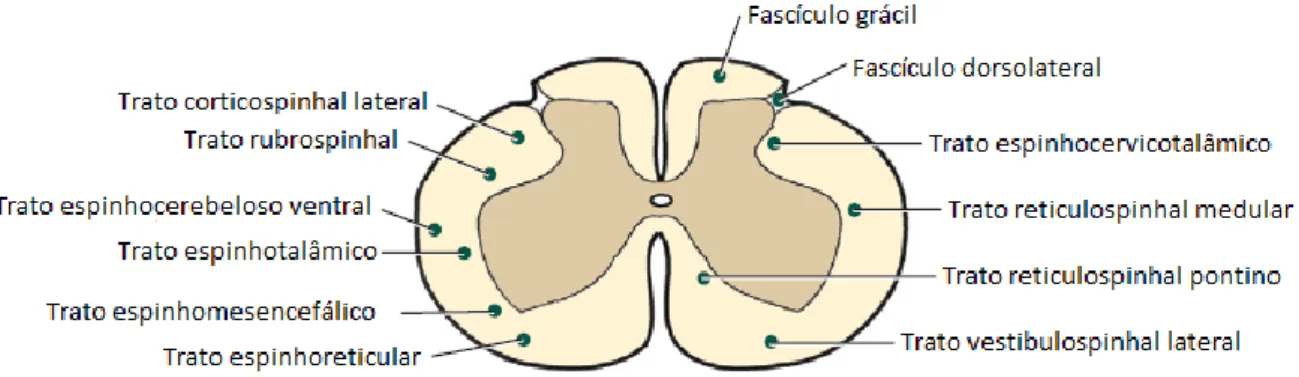
Figura 1 Representação do disco intervertebral ... 4 Figura 2 Ligamentos da coluna vertebral e costelas, aspeto ventral ... 4 Figura 3 Características morfológicas da medula espinhal representadas em corte transversal ... 5 Figura 4 Representação de alguns tratos da medula espinhal ... 7 Figura 5 Representação da orientação aleatória dos átomos ...27 Figura 6 Representação da dupla orientação dos átomos face a um campo magnético externo (B0) ...28
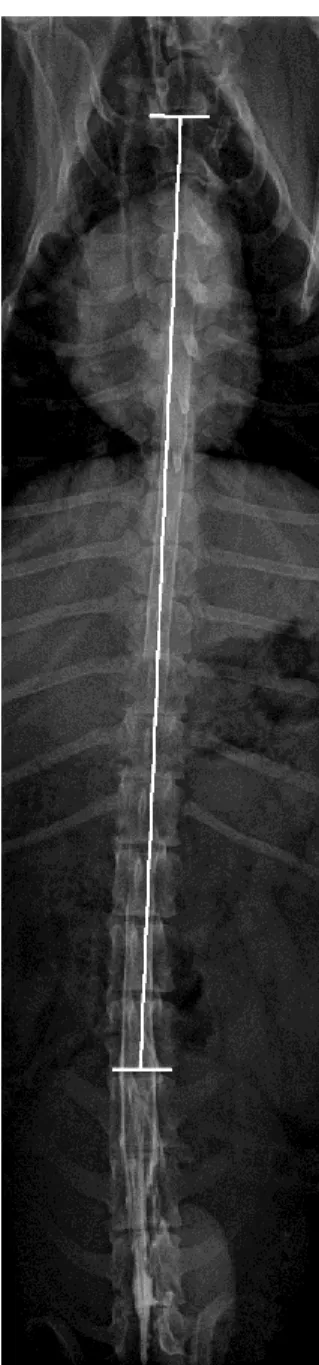
Figura 7 Representação da precessão do átomo face à influência de um campo magnético externo ...28 Figura 8 Representação da medição da região toracolombar. Bordo cranial da vértebra T2 até bordo caudal da vértebra L3 ...39 Figura 9 Projeções ortogonais de mielografia de animal com lesão toracolombar não localizada por mielografia. A - Projeção lateral. B - Projeção oblíqua direita. C - Projeção oblíqua esquerda. D - projeção ventrodorsal ...46 Figura 10 Imagens de ressonância magnética do mesmo animal representado na fig.9. A - Sagital T2w. B - Sagital T1w. C - STIR dorsal. D - Transversais T1w ao nível dos discos T10-T11, T12-T13, L2, L2-L3. E - Transversais T2w ao nível dos discos T10-T10-T11, T12-T13, L1-L2, L2-L3. ...47 Figura 11 Projeções ortogonais de mielografia de animal com lesão toracolombar localizada por mielografia. A - Projeção lateral. B - Projeção oblíqua direita. C - Projeção oblíqua esquerda. D - projeção ventrodorsal...49 Figura 12 Imagens de ressonância magnética do mesmo animal representado na fig.11. A - Sagital T2w. B- Transversais T1w ao nível do disco T13-L1. C - Transversais T2w ao nível do disco T13-L1. ...50
Índice de gráficos
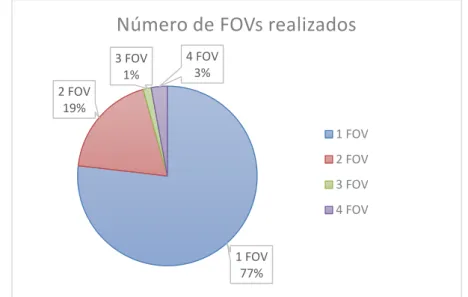
Gráfico 1 Representação do número de FOVs necessários numa ressonância magnética sem
mielografia prévia ...40
Gráfico 2 Representação do número de FOVs efetuados numa ressonância magnética com mielografia prévia ...41
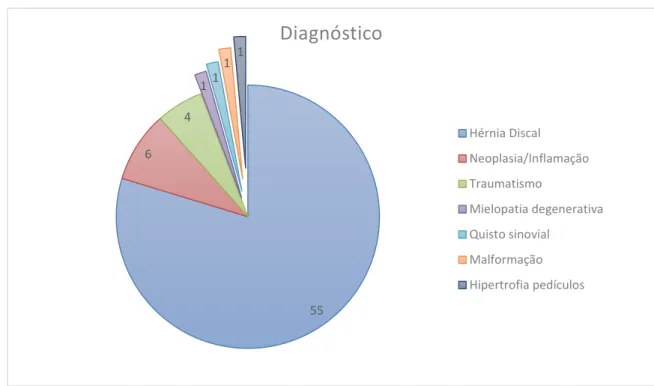
Gráfico 3 Diagnósticos dos 69 casos inseridos no estudo ...42
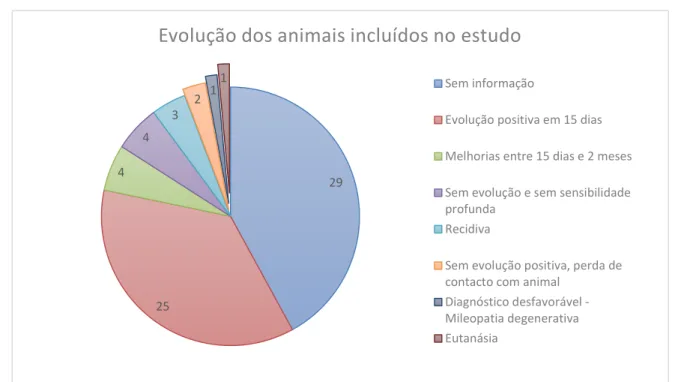
Gráfico 4 Representação da evolução dos animais incluídos no estudo ...43
Gráfico 5 Local de injeção de contraste no animais inseridos no estudo ...44
Gráfico 6 Representação dos discos afetados ...45
Gráfico 7 Discos afetados representados em percentagem ...45
Gráfico 8 Relação entre o comprimento de T2-L3 e o número de FOVs necessários para efetuar o diagnóstico nessa zona. Comparação entre o número de FOVs necessários e os efetuados após mielografia. ...51
Gráfico 9 Demonstração da diferença entre o tempo estimado de ressonância magnética e o tempo de imagiologia efetuado (mielografia + RM posterior). A linha vermelha demonstra a média da diferença (39min) indicando o ganho médio de tempo ...52
Gráfico 10 Relação entre o tempo de imagiologia (mielografia + ressonância magnética) com o tempo estimado de ressonância magnética sem mielografia prévia. ...53 Gráfico 11 Ilustração do número variável de sequências efetuadas nos diferentes animais .54
Lista de abreviaturas
B0 – Campo Magnético ExternoET-MR – Tempo Estimado de Ressonância Magnética FLAIR – Fluid Attenuated Inversion Recovery
FOV – Field of View
GAGs - Glicosaminoglicanos LCR - Líquido Cefalorraquidiano M+DP - Média e Desvio Padrão ME – Medula Espinhal
MNI – Motoneurónio Inferior MNS – Motoneurónio Superior MP – Membros Pélvicos MT – Membros Torácicos NP – Núcleo Pulposo
PCO – Paradoxical Contrast Obstruction RF – Rádio Frequência
RM – Ressonância Magnética SE – Spin Echo
SNR – Signal to Noise Ratio
STIR – Short Tau Inversion Sequence T1w – Imagem ponderada em T1 T2w – Imagem ponderada em T2 TC – Tomografia Computorizada TE – Tempo de Eco
TI – Tempo de Inversão
TLd – Distância do bordo cranial da vértebra T2 até ao bordo caudal da vértebra L3 TR - Tempo de Repetição
Introdução
As doenças da medula espinhal toracolombar são comuns, com inúmeros processos possíveis de afetar os segmentos T3-L3, sendo reportado como 19,6% dos casos neurológicos num hospital de referência (Fluehmann et al., 2006).
Com o aumento da disponibilidade de métodos de diagnóstico é essencial chegar a um diagnóstico, decidir sobre o tratamento a seguir e traçar um prognóstico com a maior fiabilidade e celeridade. Desde há muito tempo que a mielografia em radiografia era o método recomendado para efetuar um diagnóstico imagiológico na medula espinhal. Este método tem as suas vantagens em termos de custos reduzidos e elevada disponibilidade, mas também são mencionadas desvantagens como a dificuldade de execução e possíveis efeitos secundários posteriores (McCartney, 1997; Platt e Olby, 2004).
Um outro método de diagnóstico é a tomografia computorizada que permite a avaliação de lesões compressivas extradurais, possibilitando também a visualização do espaço subaracnoide quando se complementa com a mielografia. Tem como principais vantagens os efeitos secundários reduzidos e a reconstrução de imagens (Griffin et al., 2009).
A ressonância magnética (RM) é o método de diagnóstico que nos permite visualizar a própria medula espinhal sem aceder ao canal medular sendo só necessário a anestesia do animal em questão (Sether et al., 1990; Ito et al., 2005; Parry et al., 2010). A sua disponibilidade veterinária ainda é relativamente reduzida e muitas das que existem são normalmente RM de baixo campo, com um campo de visão reduzido, levando a um estudo prolongado, sendo por vezes necessárias mudanças da posição do animal de forma a serem conseguidas as imagens com qualidade diagnóstica para efetuar a avaliação da medula espinhal T3-L3 por completo.
Nestas situações uma mielografia em radiografia prévia pode melhorar esta limitação, indicando-nos uma zona anómala da medula espinhal que deve ser estudada por RM. Este estudo tem como objetivo investigar o efeito da radiografia de contraste (mielografia) prévia combinada com a ressonância magnética no tempo de estudo imagiológico final comparativamente com o tempo estimado da ressonância sem mielografia prévia de toda a zona toracolombar (T3-L3).
A recolha de dados para a execução da componente prática deste trabalho foi feita durante o estágio realizado no Centro de Referência Veterinária de julho a dezembro de 2012.
Capítulo I
Capítulo I
1. Revisão bibliográfica
1.1. Métodos de pesquisa e estrutura
As publicações relacionadas com o tema “efeito da mielografia no tempo de estudo de ressonância magnética de baixo campo em 69 cães na região T3-L3” foram pesquisadas na “Medline”, através de palavras-chave adequadas, tais como, “intervertebral disc degeneration”, “myelography”, “magnetic resonance”, “dog”. Tendo em conta os casos clínicos incluídos na componente prática, as doenças subjacentes e os meios de diagnóstico utilizados, nesta revisão bibliográfica abordamos temas como: a degenerescência do disco intervertebral (principal causa de lesões toracolombares neste estudo); a mielopatia degenerativa (de forma mais sintetizada devido ao seu baixo número de casos); as neoplasias como etiologia de lesão medular (como a sua representação é diminuta neste estudo e a etiologia do processo é desconhecida, apenas é feita uma breve referência); o estudo radiográfico de contraste (mielografia); breve descrição dos fundamentos físicos da ressonância magnética. Para introduzir o tema, é feita uma abordagem anatómica ao disco intervertebral e da medula espinhal.
1.2. Anatomia do disco intervertebral
O disco intervertebral consiste num anel fibroso exterior chamado ânulo fibroso e numa porção central amorfa e gelatinosa à qual se dá o nome de núcleo pulposo (NP), estando presentes em todos os espaços intervertebrais, exceto entre C1-C2, permitindo a união dos corpos vertebrais (Figura 1). O ânulo fibroso é constituído por fibras paralelas que cursam obliquamente de um corpo vertebral para outro fornecendo uma forma de dispersar o stresse originado pelos movimentos da coluna vertebral. Junto do núcleo pulposo o ânulo fibroso perde a sua estrutura distinta e torna-se mais cartilaginoso. Uma característica desta estrutura é a sua diferente espessura na porção ventral e porção dorsal, sendo a primeira 1,5 a 3 vezes mais espessa que a porção dorsal. O tecido fibroso é constituído, principalmente por fibras de colagénio tipo I (Bray e Burbidge, 1998; Evans e De Lahunta, 2012).
O núcleo pulposo tem uma consistência semifluida e é constantemente posto sobre pressão aquando os movimentos dos corpos vertebrais. Quando o ânulo fibroso degenera ou rutura, o núcleo pulposo forma uma protuberância em direção ao canal vertebral (Evans e De Lahunta, 2012).
Revisão bibliográfica
Associados a cada disco intervertebral existem quatro ligamentos. O longitudinal dorsal e o ventral encontram-se na face dorsal e ventral respetivamente, e efetuam o trajeto entre corpos vertebrais levando à sua fusão. O ligamento da cabeça da costela estende-se da cabeça da costela até ao próprio disco intervertebral. Por fim, o ligamento intercapital estende-se do aspeto dorsal de uma costela até ao aspeto dorsal da costela oposta, sobre o disco intervertebral, ventralmente ao ligamento longitudinal dorsal e sob o chão do canal vertebral (Figura 2) (King, 1999; Evans e De Lahunta, 2012). Herniações traumáticas ou espontâneas raramente ocorrem nos espaços intervertebrais entre T1 e T10 devido a este ligamento intercapital, que promove estabilidade adicional a esta porção da coluna (King, 1999).
Figura 1 Representação do disco intervertebral. Adaptado de Evans e De Lahunta (2012)
Em raças condrodistróficas pode ocorrer uma degenerescência condróide em animais jovens, podendo levar à calcificação do NP. Com esta calcificação, o NP perde a função de dissipar as forças mecânicas que advêm do movimento da coluna vertebral, e poderá favorecer a rutura do ânulo fibroso levando à protusão ou extrusão do material degenerado para o canal vertebral. Um processo similar pode ocorrer em raças não condrodistróficas em idade avançada, devendo-se a uma degenerescência fibróide (Evans e De Lahunta, 2012).
1.3. Anatomia da medula espinhal
A medula espinhal (ME) é constituída pela substância branca na periferia e pela substância cinzenta na região central. A substância branca contem os axónios mielinizados dos neurónios sendo dividida em três funículos: o dorsal, localizado entre o sulco dorsal até ao ponto de origem das raízes dorsais dos nervos espinhais; o lateral, localizado entre as raízes dorsal e ventral dos nervos espinhais; o ventral, localizado entre a raiz ventral e a fissura mediana ventral. Os funículos dorsais esquerdo e direito são completamente separados pelo sulco dorsal, que é preenchido por uma mistura de pia máter e neuroglia. Os funículos dorsais estão também subdivididos por um septo adicional que dá origem ao fascículo grácil (medial) e fascículo cuneato (lateral). Relativamente aos funículos ventrais, estes não estão completamente separados pela fissura mediana ventral e axónios mielinizados cruzam de um lado para o outro, dando origem à comissura branca (Evans e De Lahunta, 2012).
A substância cinzenta contem os núcleos dos neurónios. Está dividida em duas ou três porções consoante a região anatómica em que nos encontramos. O corno dorsal existe ao longo de toda a ME e contém os corpos celulares dos neurónios aferentes somáticos e viscerais. O corno ventral, também presente em toda a ME, contém os corpos celulares dos neurónios eferentes que enervam os músculos estriados do corpo. Ao nível torácico e lombar cranial está presente o corno lateral, que contém os corpos celulares dos neurónios eferentes viscerais (Thomson e Hahn, 2012).
Figura 3 Características morfológicas da medula espinhal representadas
Revisão bibliográfica
Os tratos aferentes da medula espinhal são o fascículo grácil, o fascículo cuneiforme, o fascículo dorsolateral, o espinhocerebeloso dorsal, o espinhocerebeloso ventral e o espinhotalamico. A porção eferente da transmissão de informação é efetuada pelo trato rubroespinhal, córtico-espinhal lateral, tectotegmentospinhal lateral, reticulospinhal medular (lateral), reticulospinhal pontino (ventral), vestibulospinhal lateral, tecto-espinhal, cortico-espinhal ventral, vestibulospinhal medial, fascículo longitudinal medial (Figura 4) (Thomson e Hahn, 2012). O fascículo próprio, que efetua a conexão entre segmentos espinhais e é usado nos arcos reflexos. Os tratos aferentes recolhem a informação do corpo para o cérebro. O fascículo grácil é sensorial e tem como função recolher informação sobre propriocepção e informação táctil da porção caudal do corpo. O fascículo cuneiforme é também sensorial e tem a mesma função que o fascículo grácil, mas a porção da qual recolhe informação é a porção cranial do corpo. O fascículo dorsolateral é um trato multissináptico que recolhe informação sensorial, nociceptiva e térmica. O espinhocerebeloso dorsal afere informação sobre corpo caudalmente ao membro torácico enquanto o espinhocerebeloso ventral recolhe a informação proprioceptiva da metade caudal do corpo, e o espinhocerebeloso cranial, que se encontra no aspeto medial, recolhe informação proprioceptiva da metade cranial do corpo do animal. O espinhotalamico é um trato multissináptico e recolhe informação nociceptiva, térmica e de tacto, informações essas que também podem ser transmitidas por outros tratos nos funículos ventral e lateral (Figura 4) (Thomson e Hahn, 2012).
Os tratos eferentes da medula espinhal tem como função a transmissão de informação para a execução de movimentos. Existem dois tipos de tratos, os extrapiramidais e os piramidais. Os tratos extrapiramidais não passam pelas fibras piramidais da medula oblonga e são os rubroespinhal, reticulospinhal medular, reticulospinhal pontino, vestibulospinhal lateral, vestíbulo espinhal medial, fascículo longitudinal medial, tectotegmentospinhal lateral e tectospinhal medial (Figura 4). Os tratos piramidais são aqueles que passam pelas fibras da medula oblonga e são os cortico-espinhal lateral e medial e cortico-nuclear (Thomson e Hahn, 2012).
A sensibilidade à dor profunda é desencadeada por estímulo químico, térmico ou mecânico que pode ativar respostas somáticas ou autónomas, assim com reflexas. A informação, para ser transmitida, usa o funículo dorsal (fascículo grácil e cuneiforme) e podem usar tratos do funículo lateral e ventral como o espinhotalamico, espinhocervicotalamico, espinhorreticular e espinhomesencefálico (Figura 4). O ponto-chave é que os tratos são bilaterais e multissinápticos, isto é, para que a lesão cause a perda total de sensibilidade à dor profunda é necessário uma destruição extensa que afete todos os tratos possíveis de transmitir a informação (Thomson e Hahn, 2012).
A dor visceral é transmitida via nervos simpáticos das vísceras torácicas, abdominais e nervos pudendos das vísceras pélvicas.
1.4. Degenerescência do disco intervertebral 1.4.1. Etiologia e fisiopatologia
Como já foi referido, o disco intervertebral é composto pelo ânulo fibroso multilaminado que forma a periferia do disco e o núcleo pulposo. Este último é um remanescente embriológico da notocorda, forma a porção central do disco e é altamente hidratado tendo como principais componentes moleculares proteínas colagénias e não-colagénias, proteoglicanos e glicoproteínas. Os glicosaminoglicanos (GAGs) são proteoglicanos agregados que tem como função absorver água tendo concentrações mais elevadas no núcleo pulposo. Algumas doenças e a idade estão associadas com uma diminuição progressiva no conteúdo de GAGs, levando consequentemente a uma diminuição em água e proteoglicanos no interior do núcleo e ânulo fibroso (Platt e Garosi, 2012) tornando este disco mais propenso às doenças. Um núcleo pulposo de um recém-nascido é composto aproximadamente por 80% de água, mas quando degenera, o conteúdo aquoso diminui e o conteúdo em colagénio aumenta (Adams et al., 1995). A proporção de proteínas não-colagenosas também aumenta com a idade e estas alterações degenerativas ocorrem mais cedo em raças condrodistróficas podendo ocorrer uma metamorfose condróide já a partir dos dois meses de idade (Platt e Garosi, 2012).
A metamorfose condróide ocorre durante os primeiros dois anos de vida. Com a degenerescência do disco ocorre desidratação e, ao mesmo tempo, o NP é invadido por cartilagem hialina (Hansen, 1952). Estas alterações levam a que o disco intervertebral perda a capacidade de absorver as forças compressivas que ocorrem naturalmente com o movimento da coluna vertebral. O aumento da rigidez do NP induz a rutura do ânulo fibroso degenerado para o canal vertebral (De Lahunta e Glass, 2009). Muitos dos discos que
Revisão bibliográfica
sofreram a metamorfose condróide mineralizam, mudando de consistência gelatinosa para uma substância dura e arenosa (Sharp e Wheeler, 2005b). Raças condrodistróficas como o Dachshund, Pequinês, Bulldog Francês, Welsh Corgi, Beagle, Lhasa Apso e Poodle costumam ser as mais afetadas (Ball et al., 1982; Platt e Garosi, 2012).
Nas raças não condrodistróficas ocorre metamorfose fibróide. O núcleo pulposo desidrata e é invadido por fibrocartilagem em vez de cartilagem hialina. Este processo tem um começo mais tardio e os discos estão normais enquanto o cão é jovem e ativo (Sharp e Wheeler, 2005b; De Lahunta e Glass, 2009).
Em 1952, Hansen descreveu a degenerescência do disco intervertebral, e desde então a nomenclatura usada é Hansen tipo I para as extrusões discais e Hansen tipo II para as protusões discais. Em cães, cerca de 80% das extrusões ou protusões toracolombares ocorrem entre T10 e L3 (Braund e Vandevelde, 1978; Levine et al., 2006). Esta situação pode estar relacionada com o grande movimento da coluna vertebral neste local comparativamente com a zona torácica. Adiciona-se o facto de que nas primeiras dez vértebras torácicas existe o ligamento intercapital que cursa sobre a face dorsal do disco intervertebral ligando as cabeças das costelas (Figura 2). Esta situação proporciona um suporte adicional à articulação e pode ajudar a prevenir uma extrusão ou protusão (De Lahunta e Glass, 2009).
Cães pequenos, principalmente condrodistróficos, costumam ter hérnia discal Hansen tipo I, que tem o potencial de libertar um volume relativamente grande de núcleo pulposo calcificado para o canal vertebral, resultando num estreitamento marcado do disco intervertebral afetado e aumento da opacidade do canal vertebral nesse local (Lamb et al., 2002). Por outro lado, cães grandes não condrodistróficos e cães mais velhos de qualquer raça estão predispostos a doença discal Hansen tipo II, na qual o ânulo fibroso aumenta devido a hipertrofia e alongamento, tendo menos potencial para extrusão de tecido discal calcificado (Lamb et al., 2002).
A herniação discal causa lesões primárias e secundárias ao nível da ME. A lesão primária é provocada por um dano direto às membranas celulares e microvasculatura. Os danos secundários desenvolvem-se nas primeiras 24 a 48 horas e resultam de anomalias vasculares e bioquímicas que incluem isquémia, aumento do cálcio intracelular e produção de radicais livres (Janssens, 1991; Olby, 1999; Dumont et al., 2001) que provocam morte neuronal e inflamação da ME (Bush et al., 2007). Extrusões discais com grande volume podem causar lesões agudas como se de um traumatismo externo se tratasse, com hemorragia, edema e necrose de ambas as substâncias branca e cinzenta. A principal causa para a formação de hematoma é a rutura do plexo venoso vertebral interno (McKee et al., 2010). Protusões com volume significativo causam degenerescência axonal, desmielinização e
Existe um terceiro tipo de hérnia discal que é reconhecida clinicamente e é melhor observada por RM. Está frequentemente associada a traumatismos externos como atropelamentos ou quedas (De Lahunta e Glass, 2009; Henke et al., 2013). Exercício vigoroso resulta numa força excessiva que rutura o ânulo fibroso dorsal, causando uma rápida extrusão do NP para o canal vertebral. Este material causa contusão sem resultar em massa compressiva (De Risio et al., 2009). A mielografia revela tumefação difusa intramedular com atenuação do espaço subaracnóide e com a RM visualiza-se o disco intervertebral colapsado, mostrando as alterações focais no parênquima da ME, mas sem compressão significativa resultante do disco presuntivamente extrudido (Griffiths, 1970). Foram sugeridos vários nomes para este tipo de hérnia, tais como prolapso discal traumático (Hansen, 1952); herniação discal traumática, “high velocity-low volume disc disease” (Lu et al., 2002a); explosão discal (Griffiths, 1970); extrusão discal traumática (Chang et al., 2007); extrusão aguda não-compressiva do núcleo pulposo (De Risio et al., 2009; McKee et al., 2010). Também foi sugerido o termo Hansen tipo III, mas é inapropriado porque não há degenerescência discal e o termo não foi proposto por Hansen (Chang et al., 2007).
1.4.2. Sinais clínicos
Os sinais associados com herniação discal dependem da gravidade e localização da lesão e podem incluir hiperestesia paraespinhal, ataxia, parésia, plégia, postura Schiff-Sherrington, incontinência urinária e fecal, e em alguns casos, choque espinhal (Smith e Jeffery, 2005; Cerda-Gonzalez e Olby, 2006), com sensibilidade à dor profunda presente ou ausente. A localização de lesões discais baseada só em sinais clínicos é insuficiente (Smith et al., 1997; Schulz et al., 1998). Acrescenta-se o facto da possibilidade de lateralização da extrusão discal e consequente compressão da medula espinhal pode causar assimetria dos sinais neurológicos (Platt e Olby, 2004; Platt e Garosi, 2012).
Os sinais clínicos podem ser subagudos (<1 hora), agudos (<24 horas) ou graduais (>24h). Os animais podem demonstrar sinais de choque espinhal ou posição Schiff-Sherrington que indica uma lesão aguda e grave, mas não determina o prognóstico (Platt e Garosi, 2012).
Foram desenvolvidas várias escalas para classificar as lesões toracolombares como a desenvolvida por Scott e Mckee (1999) e modificada por Sharp e Wheeler (2005), que engloba 5 graus diferentes: 0 como normal; 1 presença de dor sem défices neurológicos; 2 paraparésia e ataxia (o animal ainda caminha, mas com défices neurológicos); 3 paraparésia não ambulatória (tem movimento voluntário nos MP e na cauda, mas não consegue caminhar, mantém controlo voluntário da micção); 4 paraplegia (ausência de movimento voluntário nos membros pélvicos (MP) e na cauda, sem controlo urinário) mas com sensibilidade à dor
Revisão bibliográfica
profunda aplicada caudalmente à lesão; 5 paraplegia sem sensibilidade à dor profunda caudalmente à lesão.
Em casos mais graves por vezes os animais aparecem em choque espinhal ou com uma deterioração rápida dos sinais neurológicos que pode ser devido à presença de mielomalacia.
O choque espinhal é um fenómeno que ocorre imediatamente após lesões graves na ME e em pequenos animais é “rapidamente transitória”, verifica-se uma depressão profunda temporária nos segmentos espinhais (reflexos) caudais à lesão, mesmo que os arcos reflexos se mantenham intactos (Gopal e Jeffery, 2001; Smith e Jeffery, 2005). Foi sugerido que o choque espinhal esteja associado com a interrupção súbita do “input” supraespinhal descendente nos neurónios motores alfa e interneurónios, causando uma disfunção transitória do motoneurónio inferior (MNI) (Smith e Jeffery, 2005; De Lahunta e Glass, 2009). Este fenómeno tem implicações importantes, podendo levar a uma localização neuroanatómica e investigações diagnósticas incorretas. Ocorre em lesões espinhais agudas e geralmente transversas entre T3 e L3. Fraturas são as lesões mais frequentes, mas também pode ocorrer em enfartes devido a embolia fibrocartilaginosa e mielopatias associadas a extrusão de disco intervertebral. Os animais evidenciam extensão grave e persistente dos membros torácicos devido à desinibição dos neurónios motores extensores da intumescência cervical. Quando são suportados, a marcha dos MT é normal exceto uma ligeira rigidez (De Lahunta e Glass, 2009). A desinibição resulta de uma súbita perda de axónios num trajeto interneuronal longo que se origina dos corpos das células neuronais primariamente na substância cinzenta de L1 a L5 e não é resultado de disfunção dos tratos motoneurónios superiores (MNS), daí conseguirem caminhar se suportados. Os axónios cursam cranialmente no fascículo próprio e terminam por sinapse nos MNI para o membro torácico na intumescência cervical. A função normal destes axónios é inibir os motoneurónios extensores (De Lahunta e Glass, 2009).
A presença de Schiff-Sherrington indica uma lesão grave e um prognóstico reservado, mas não significa que o animal não recupere. A lesão que causa Schiff-Sherrington normalmente é responsável por paraplegia devido à completa interrupção dos trajetos do MNS e resulta em analgesia caudal à lesão devido à lesão dos trajetos nociceptivos. A paraplegia surge primeiro que a analgesia, sugerindo que os trajetos nociceptivos são mais resistentes à compressão medular e isquemia. Em casos em que o Schiff-Sherrington está presente em lesões toracolombares transversas e graves, existe hipotonia nos MP. Ao examinar os animais passado poucas horas da paraplegia aparecer, pode haver reflexos espinhais e tónus muscular muito deprimidos ou ausentes. Estes sinais paradoxais que mimetizam lesão do MNI em animais com interrupção nos trajetos do MNS representa aquilo a que é chamado choque
Em animais domésticos, a ausência de reflexos espinhais é observada por apenas poucas horas após a lesão, mas a hipotonia persiste entre 10 a 14 dias, que é substituída por tónus normal e depois por hipertonia (Smith e Jeffery, 2005; De Lahunta e Glass, 2009). A razão para que esta lesão do MNS cause sinais do MNI é pouco entendida. A única explicação é que a súbita perda de sinapses no MNS, indiretamente via interneurónios ou diretamente devido às zonas dendríticas, cause uma certa perda nos corpos celulares do MNI que não consigam funcionar por um curto período de tempo. Para identificar Schiff-Sherrington e choque espinhal deve-se efetuar estímulo doloroso num dígito do membro pélvico. Não ocorrerá movimento ou existe um ligeiro reflexo de flexão se é após umas horas do aparecimento dos sinais clínicos. Deve-se também efetuar um mínimo estímulo compressivo nos membros torácicos estendidos e verificar se há um vigoroso reflexo de retirar o membro. Isto indica-nos que temos uma lesão transversa toracolombar com Schiff-Sherrington nos membros torácicos (MT) e choque espinhal nos MP (De Lahunta e Glass, 2009).
Num período curto de tempo, neurónios motores desenervados tornam-se hipersensitivos, demonstrando um aumento de resposta aos “inputs” recebidos (Little, 1986). Na medula espinhal normal, neurónios motores recebem “inputs” não só de fontes supraespinhais, mas também de interneurónios dentro da ME e de fibras aferentes primárias. Quando o “input” supraespinhal é perdido, estes neurónios locais potencialmente podem formar novas sinapses excitatórias com o neurónio motor. O tempo que demora a aparecer estas sinapses depende do comprimento do axónio. Esta situação explica o aumento da amplitude do reflexo devido a duas ondas de sinapses, uma proveniente de interneurónios (cujos corpos celulares se encontram perto da terminação axonal) e de outra dos aferentes sensoriais primários muito mais longos (Smith e Jeffery, 2005).
A existência de choque espinhal no cão tem importantes implicações para a clínica veterinária que lida com a lesão medular, porque os sinais do animal podem levar a uma localização neuroanatómica da lesão errada e, assim, alterar o processo de diagnóstico e prognóstico (Smith e Jeffery, 2005). Exames neurológicos subsequentes reduzem a possibilidade deste erro (Smith e Jeffery, 2005).
A mielomalacia ocorre como consequência a uma lesão aguda como uma extrusão de disco intervertebral (Griffiths, 1972; De Lahunta e Glass, 2009). É caracterizado por uma necrose isquémica ou hemorrágica da ME, representando dano extensivo na vasculatura espinhal intramedular (Platt et al., 2006b). Aparenta ser o resultado dos efeitos do traumatismo, isquémia e a libertação de substâncias vasoativas, radicais livres de oxigénio e enzimas (Gebarski et al., 1985). Pode ser focal ou pode-se estender cranial ou caudalmente ao longo da medula espinhal, resultando em mielomalacia difusa e grave (Griffiths, 1978; Lu
Revisão bibliográfica
et al., 2002b) tipicamente na base do funículo dorsal (Griffiths, 1978). Esta forma difusa de mielomalacia é muitas vezes chamada mielomalacia ascendente ou descendente (Summers et al, 1995). Tem como sinais clínicos a paraplegia flácida, arreflexia total dos membros pélvicos, cauda e ânus, perda de perceção à dor profunda caudal ao local de lesão, musculatura abdominal flácida devido à paralisia diafragmática e musculatura intercostal (De Lahunta e Glass, 2009). Existem alguns sinais que podem indicar progressão da mielomalacia como a perda de sensibilidade à dor profunda caudalmente ao local da lesão medular; flacidez ou arreflexia anal; perda do reflexo panicular a um nível mais cranial num período de horas ou dias; desenvolvimento de sinais MNI nos membros pélvicos; dificuldades respiratórias devido a parésia ou paralisia dos músculos intercostais ou diafragmático e por fim desenvolvimento de tetraparesia (Scott e McKee, 1999; Lu et al., 2002b; Olby et al., 2003).
Extrusões discais com grande volume de material no canal medular são mais prováveis de resultar em mielomalacia (Fundquist, 1962; Griffiths, 1972). Em dois estudos com perda de sensibilidade à dor profunda devido a hérnia discal, a evidência de mielomalacia foi de 6/34 (18%) (Scott e McKee, 1999) e de 20/46 (43%) (Duval et al., 1996).
Diferenciação de mielomalacia e edema em RM é difícil. Os animais com aumento de sinal T2w tinham pior prognóstico o que demonstra que a RM não e só um bom método de imagiologia da ME, mas também de prognóstico (Besalti et al., 2005).
1.4.3. Diagnóstico 1.4.3.1. Anamnese
Recolher a história e efetuar um exame físico completo são pré requisitos essenciais para um adequado diagnóstico. Deve-se obter informação sobre evidência de traumatismo, avaliar a progressão da doença (progressiva, estática ou episódica), episódios anteriores de doença, sinais de dor, estado vacinal, história de viagens e função urinária, principalmente se consegue indicar ao dono quando quer urinar, se consegue esvaziar por ele próprio ou se goteja sem o animal dar conta (Sharp e Wheeler, 2005b). Todos estes dados são essenciais na avaliação e na formação de um futuro diagnóstico. A duração dos sinais clínicos influencia o tempo de recuperação, especialmente em cães com sinais clínicos por mais de seis dias (Ferreira et al, 2002).
1.4.3.2. Exame físico
Deve ser efetuado um exame físico completo a todos os sistemas do corpo. É essencial para detetar anormalidades sistémicas que poderão influenciar o sistema nervoso central, como por exemplo, animais com lesão hepática apresentando-se com convulsões e alterações do estado mental ou animais com lesões ortopédicas que alteram a postura e
marcha do animal, podendo mimetizar uma lesão a nível da medula espinhal (Platt e Olby, 2004). Distúrbios congénitos, infeções, alterações imunológicas, metabólicas e nutricionais, toxicidade, traumatismo, doenças vasculares, doenças degenerativas e alterações idiopáticas devem ser tomados em conta aquando a avaliação do animal que precede o exame neurológico.
1.4.3.2.1. Exame neurológico
Na avaliação do animal, o mesmo deve ser encorajado a movimentar-se, exceto quando sofreu traumatismo espinhal agudo ou em casos agudos de dor (Sharp e Wheeler, 2005b). Alterações de postura são as apresentações neurológicas mais frequentes tornado a avaliação da coordenação de movimentos essencial. Deve ser avaliada num local no qual o animal se possa movimentar livremente, mas acompanhado pelo dono. Se o animal não se movimenta por ele próprio, deve ser suportado de modo a verificar se manifesta movimento voluntário (Platt e Olby, 2004).
Para o animal efetuar uma marcha normal é necessário que a função do tronco cerebral, cerebelo, medula espinhal, nervos periféricos, junções neuromusculares e músculos esteja intacta. Uma marcha anormal pode ser devido a alteração de coordenação (ataxia), da força dos movimentos voluntários (parésia) ou uma combinação destas duas situações. Esta ataxia pode ser classificada em hipométrica, hipermétrica ou dismétrica consoante as alterações demonstradas pelo animal. A parésia é designada como uma dificuldade ou impossibilidade em gerar movimento voluntário, enquanto uma plégia é designada como a total ausência de movimento voluntário. Consoante os membros afetados, há designações diferentes, sendo referido como tetraparesia/tetraplegia quando os quatro membros estão afetados, paraparésia/paraplegia quando são os membros pélvicos afetados, monoparésia/monoplegia quando só um membro se encontra afetado e hemiparesia/hemiplegia quando estão afetados os membros torácico e pélvico de um lado do animal. Animais aparentemente paraplégicos podem demonstrar algum movimento voluntário se suportados, sendo necessário este suporte para conseguir classificar a sua situação neurológica. Défices sensoriais unilaterais podem ser revelados suportando o animal em estação e obrigando-o a executar hemi-andamento. A avaliação do tónus muscular também é importante, pressionando os ombros e quadris para visualizar a reação do animal. Com estes testes efetuados, podemos classificar o animal como paraparético, hemiparético ou tetraparético (Platt e Olby, 2004).
A avaliação da propriocepção é efetuada através do posicionamento proprioceptivo do membro, saltos e hemi-andamento. Na avaliação do posicionamento proprioceptivo do membro, esta é colocada numa posição anormal, isto é, com a superfície dorsal colocada no chão, de forma a determinar o quão rápido o animal corrige essa posição. Deve ser suportado
Revisão bibliográfica
o peso do animal para que este teste seja mais sensível e também para permitir a avaliação de membros que o animal possa estar relutante a apoiar devido à dor. O teste da folha de papel é outro teste que permite avaliar a propriocepção. Neste caso, a folha de papel é colocada sob o membro do animal e é puxada lenta e lateralmente. Uma reação normal passa pelo animal corrigir a posição do membro, permitindo avaliar a propriocepção consciente da porção proximal do membro. O teste do salto é efetuado suportando o animal e colocando a maioria do seu peso num dos membros enquanto se força o movimento lateral. A reação normal é a do animal saltar para acomodar-se à constante mudança de posição. Por sua vez, o hemi-andamento é efetuado suportando o animal e forçá-lo a executar movimentos apoiado apenas no membro torácico e no pélvico do mesmo lado do animal. O animal deve ser movimentado lateralmente e deve ser observado com que velocidade e coordenação o animal corrige a sua posição anormal (Platt e Olby, 2004).
Avaliação dos reflexos espinhais do membro pélvico é efetuada de forma a permitir avaliar diferentes regiões neuroanatómicas da medula espinhal do animal. O reflexo de retirar o membro avalia a integridade dos segmentos L4-S2, assim como os nervos ciático e femoral. Neste reflexo belisca-se o membro do animal e espera-se um reflexo normal caracterizado pela flexão da anca e joelho na tentativa de retirar o membro. O reflexo patelar avalia integridade do segmento L4-L6 assim como o nervo femoral. É executado com o animal em decúbito lateral estimulando-se o tendão patelar induzindo uma extensão do membro pélvico devido à contração reflexa do músculo quadríceps. Uma reação ausente ou fraca indica a presença de lesão dos segmentos espinhal L4-L6 ou do nervo femoral. Uma lesão cranial a este segmento pode também alterar o reflexo, tornando-o exagerado, mas há casos em que se mantém normal (Platt e Olby, 2004).
O reflexo cranial tibial e gastrocnémio são menos precisos que o reflexo patelar e são avaliados mediante estimulação mecânica dos tendões do músculo cranial tibial e gastrocnémio. A reação normal do reflexo cranial tibial é avaliada pela flexão do tarso, enquanto o reflexo do gastrocnémio promove a extensão do mesmo. Estes reflexos avaliam a integridade do segmento L6-S1 (cranial tibial) e L7-S1 (gastrocnémio) (Platt e Olby, 2004).
A avaliação da cauda e ânus é avaliada pelo reflexo perineal, onde se estimula o períneo com uma pinça hemostática e visualiza-se a contração do esfíncter anal e flexão da cauda. Este reflexo avalia a integridade dos nervos da cauda, o nervo pudendo e segmentos espinhais S1-Cd5.
Uma avaliação sensorial é importante no exame neurológico do animal e esta depende de testes de sensibilidade (nocicepção). Alguns termos devem ser definidos, como anestesia, que se refere à perda total de todos os tipos de sensação; hipoestesia é uma diminuição de
é efetuado. Avaliar esta sensação requer um estímulo doloroso e a posterior avaliação da resposta do animal.
A avaliação do reflexo cutâneo do tronco é efetuada beliscando a pele no dorso do tronco entre T2 e L4-L5 e observar se existe contração do músculo cutâneo do tronco bilateralmente. Este reflexo só está presente na zona toracolombar da coluna vertebral. O teste deve ser começado ao nível das asas do ílio e ser continuado cranialmente.
A avaliação da sensibilidade à dor profunda é efetuada usando uma pinça hemostática para pressionar os ossos de um dos dígitos e avaliar a reação do animal. A reação normal que se procura passa pela vocalização, virar-se para o local que está a ser pressionado e/ou tentar morder. Nesta avaliação, recolher o membro não deve ser interpretado como presença de sensibilidade à dor profunda.
Deve também ser realizada a palpação da coluna vertebral, pressionando os processos espinhais. Esta pressão deve ser aumentada gradualmente permitindo determinar a presença de hiperestesia em certo local da coluna vertebral (Platt e Olby, 2004).
1.4.3.3. Diagnóstico imagiológico
Um estudo imagiológico da medula espinhal (radiografia simples, mielografia, tomografia computorizada ou RM) é necessário para confirmar a presença e a extensão da lesão. Uma radiografia sem contraste apenas consegue identificar mineralização do disco intervertebral in situ associada com a presença de doença degenerativa do disco, estreitamento do espaço intervertebral, opacificação do canal medular, mas também exclui outros diagnósticos diferenciais que causam lesões ósseas (Platt e Garosi, 2012). Estas radiografias carecem de sensibilidade e precisão para a identificação da localização exata do disco extrudido, variando de 51-61% (Lamb et al., 2002).
Na mielografia é injetado um meio de contraste radiográfico iodado não iónico no espaço subaracnóide da região lombar caudal (L4/L5, L5/L6) ou cisterna cerebelo medular. São utilizadas várias projeções como a lateral, a ventrodorsal e a oblíqua, que são úteis para determinar a localização circunferencial, longitudinal e extensão da compressão extradural (Kirberger et al., 1992; McKee, 2000; Gibbons et al., 2006). A localização longitudinal da lesão por mielografia em doença do disco intervertebral toracolombar tem cerca de 90% de precisão (Black, 1988; Olby et al., 1994). Atualmente está a ser substituída pela RM devido à sua maior precisão e ausência da necessidade de aceder ao espaço subaracnóide para a injeção de meio de contraste (Seiler et al., 2003; Besalti et al., 2006), o que elimina o risco de reações adversas (Roberts and Selcer, 1993; Carroll et al., 1997). Uma das mais importantes vantagens da RM sobre a mielografia é a capacidade de detetar, caracterizar e prever a extensão de uma doença da ME intraparenquimatosa (Sanders et al., 2002). A RM pode ser
Revisão bibliográfica
considerada vantajosa comparada com mielografia porque permite uma melhor visualização da anatomia espinhal e diferentes doenças (Sether et al., 1990; Ito et al., 2005), é não invasiva e providencia um detalhe anatómico superior para programação cirúrgica (Parry et al., 2010).
A RM permite vistas multiplanares da compressão medular, possibilitando uma aproximação cirúrgica mais precisa e também ajuda a identificar hemorragias e a determinar a extensão da descompressão cirúrgica necessária, podendo também identificar lesões do parênquima (Platt e Olby, 2004; De Lahunta e Glass, 2009). Assim sendo, a RM é útil para a realização de um diagnóstico presuntivo fiável em cães com história e sinais clínicos apropriados de extrusão discal traumática (Chang et al., 2007).
Como já referido, a RM é superior no reconhecimento de doença intramedular e tornou-se o padrão para a avaliação de lesão aguda da medula espinal em pacientes humanos. Como exemplo, doenças agudas da medula espinhal que são vistas como uma hiperintensidade T2 incluem necrose, mielomalacia, hemorragia intramedular, inflamação e edema. Áreas de hiperintensidade focal T2 na medula espinhal são sugestivas de mielomalacia focal (Platt e Garosi, 2012). A combinação de sequências múltiplas em RM podem potencialmente ser consideradas “gold standard” em estudos futuros para herniações discais em cães de raça pequenas (Bos et al., 2012).
Resumindo, a mielografia e a RM têm usos distintos, assim como o uso de ambos poderá facilitar a confirmação do local cirúrgico em certas situações (Bos et al., 2012).
A tomografia computorizada (TC) também é utilizada no diagnóstico da degenerescência do disco intervertebral. Permite a avaliação de lesões compressivas extradurais visualizando-se o material herniado heterogéneo dependendo da quantidade da componente mineral do mesmo (Olby et al., 2000). Com o avançar do tempo, o material torna-se mais homogéneo devido ao aumento destorna-se mesmo componente mineral. A TC pode torna-ser combinada com a mielografia, permitindo a visualização do espaço subaracnóide melhorando a precisão em distinguir causas intramedulares ou extramedulares de tumefação medular e determinar a localização da herniação. As vantagens da TC passam por poucos efeitos secundários registados e a possibilidade de reconstrução de imagens (Griffin et al., 2009).
Na avaliação do disco intervertebral, a TC permite demonstrar alterações morfológicas no disco, como a mineralização, mas não é capaz de identificar mudanças subtis de degenerescência discal (Modic et al., 1988).
1.4.4. Diagnóstico diferencial
O diagnóstico diferencial de doença discal aguda é baseado na progressão do estado neurológico, simetria da lesão e na presença de hiperestesia paraespinhal. Hiperestesia paraespinhal geralmente está associada à compressão e/ou inflamação de estruturas que
envolvem o canal medular, que incluem o periósteo das vértebras, meninges, raízes nervosas e camadas superficiais do ânulo fibroso. Lesões que tipicamente não manifestam dor paraespinhal incluem neoplasia intramedular e mielopatia embólica fibrocartilaginosa (Platt e Garosi, 2012). Os diagnósticos diferenciais têm várias etiologias: vasculares (embolia fibrocartilaginosa, trombose, enfarte); inflamatória ou infeciosa (meningite/mielite, empiema medular epidural, discoespondilite); não infeciosa (meningoencefalite de etiologia desconhecida, meningite responsiva a esteroides, vasculite); traumática (fraturas vertebrais/luxações, instabilidade atlantoaxial); neoplasia primária (extradural, intradural extramedular, intramedular) ou secundária (metástase).
1.4.5. Tratamento
1.4.5.1. Tratamento conservador
As indicações para o tratamento médico de herniação discal incluem incidência de dor na coluna vertebral pela primeira vez, paresia leve a moderada (Platt e Garosi, 2012). O tratamento médico consiste na combinação de repouso em jaula, reabilitação física, administração de analgésicos, relaxantes musculares e drogas anti-inflamatórias (glucocorticoides ou anti-inflamatórios não esteroides) (Coates, 2000; Sharp e Wheeler, 2005a).
A terapia médica é usada em cães ambulatórios com história de aparecimento dos sinais clínicos de forma aguda, apesar de também ser usada em cães não ambulatórios ou animais afetados cronicamente (Coates, 2000; Sharp e Wheeler, 2005a). O repouso em jaula é visto como essencial para o sucesso do tratamento médico de animais com diagnóstico presumido de hérnia discal, visto permitir a regeneração dos ligamentos, prevenir a extrusão posterior de mais núcleo pulposo e reduzir a probabilidade de lesões traumáticas acidentais em animais atáxicos (Coates, 2000; Sharp e Wheeler, 2005a). O tempo de repouso recomendado é variável, com alguns autores a sugerir até 6 semanas (Coates, 2000).
A fluidoterapia é importante após a lesão a fim de manter a perfusão da medula espinhal. A administração de corticosteroides é controversa desde o ponto de vista de competição contra os mecanismos fisiopatológicos, e a sua eficácia ainda precisa ser comprovada (Platt e Garosi, 2012).
O tratamento médico pode levar a um resultado aceitável em muitos cães com diagnóstico presumido de hérnia discal. Num estudo foram reportadas melhorias significativas na função neurológica sem recorrência de sinais clínicos em 54,4% dos animais, enquanto uma falha de tratamento, sendo casos de eutanásia ou de intervenção cirúrgica, só ocorrerem em 14,4% dos cães (Levine et al., 2007). Estes resultados são concordantes com estudos antigos (Wilcox, 1965; Davies e Sharp, 1983), que indicavam que o tratamento médico muitas
Revisão bibliográfica
vezes leva a um resultado favorável em animais com diagnóstico presumido de hérnia discal. No estudo referido, a duração do repouso em jaula não influenciou o sucesso do tratamento médico nem alterou as informações por parte dos donos face à qualidade de vida do animal (Levine et al., 2007), assim como a administração de glucocorticoides esteve associada a uma menor qualidade de vida e a uma diminuição da probabilidade de um resultado favorável (Levine et al., 2007).
Os cães tratados de forma conservadora devem ser avaliados diariamente no seu nível de estado neurológico, dor, conforto, controlo do esvaziamento da bexiga e evidência de ulceração decúbito (Platt e Garosi, 2012).
1.4.5.2. Tratamento cirúrgico
O tratamento cirúrgico é usado quando existe paraparésia não ambulatória ou paraplegia, cronicidade dos sinais clínicos ou então quando não existe melhoria com o tratamento médico em animais paraplégicos com sensibilidade à dor profunda intacta e paraplégicos com sensibilidade à dor profunda ausente há menos de 24-48 horas (Coates, 2000; Sharp e Wheeler, 2005a; Platt e Garosi, 2012).
A perda prolongada da sensibilidade à dor profunda (por mais de 48 horas) tem um prognóstico reservado e os proprietários devem ser bem informados sobre esta situação antes da cirurgia (Jeffery, 1988; Platt e Garosi, 2012).
O objetivo do tratamento cirúrgico de cães com lesão medular passa pela descompressão, remoção de material discal extrudido e da hemorragia associada. A cronicidade de extrusão disco no momento da cirurgia pode influenciar a facilidade da remoção do material discal. Os procedimentos descompressivos para herniação discal incluem laminectomia dorsal, hemilaminectomia, corpectomia parcial, pediculotomia e mini-hemilaminectomia. O principal objetivo da cirurgia descompressiva é permitir a adequada exposição do canal vertebral para a remoção do material discal minimizando a manipulação da medula espinhal (Platt e Garosi, 2012). Numerosas doenças da ME, mesmo intramedulares podem ser resolvidas cirurgicamente com sucesso se for efetuado um diagnóstico correto (Sanders et al., 2002).
Se o animal não demonstra sensibilidade à dor profunda antes da cirurgia, uma durotomia (incisão da dura máter) pode ser considerada para uma visualização da parênquima medular e determinar a extensão da tumefação, verificando se está presente mielomalacia (Laitinen e Puerto, 2005).
A cirurgia pode não ser o standard absoluto para a determinação da lateralização da extrusão. Numa situação em que o local da cirurgia foi escolhido pelo cirurgião (sua preferência) foram removidas grandes quantidades de material discal. Há também casos em
que grandes volumes de material discal extrudido bilateralmente não apresentam lateralização clínica ou radiográfica (Schulz et al., 1998). Entre 6% a 14% dos casos em que se previu a lateralização por sinais clínicos, a lateralização determinada por cirurgia era oposta (Smith et al., 1997).
Em termos cirúrgicos, a hemilaminectomia e pediculotomia são preferíveis à laminectomia dorsal, visto promoverem uma menor exposição e disseção, permitindo o acesso aos aspetos laterais e ventrais do canal vertebral (Bos et al., 2007). As principais vantagens da hemilaminectomia passam por uma menor área incidida, processo espinhoso intacto, um só lado da coluna afetado, período de convalescença pós-operatório curto e menos fibrose epidural (McKee, 1992).
Embora controversa, a fenestração dos discos intervertebrais tem sido defendida como um procedimento profilático para evitar futuras extrusões em espaços adjacentes. Em herniação discal toracolombar, a fenestração do disco afetado no momento da descompressão da coluna vertebral é recomendado para evitar a extrusão adicional de material de disco (Forterre et al., 2008). Existe uma significativa redução da taxa de recorrência, mas num estudo com população variada e em grande número, esta taxa foi de 19,2% mesmo efetuando a fenestração (Mayhew et al., 2004).
Argumentos para a não execução da fenestração passam pelas complicações cirúrgicas, aumento do tempo de anestesia e aumento de custos (Funkquist, 1978; Bartels et al., 1983).
1.4.6. Prognóstico
Vários fatores, especialmente estado neurológico, idade e peso podem influenciar o tempo de recuperação pós-cirúrgico (Olby et al., 2003), assim como o intervalo entre o aparecimento de sinais, a cirurgia e a velocidade de progressão dos sinais (Platt e Garosi, 2012). Em termos imagiológicos, o prognóstico não pode ser feito só pela severidade do dano parenquimatoso visualizado nas imagens de RM, a severidade e cronicidade dos sinais neurológicos devem ser sempre considerados (Platt et al., 2006a)
O sucesso de uma abordagem cirúrgica consiste numa melhoria neurológica gradual do animal, mas pode não se traduzir numa completa normalidade. Em animais paraplégicos e com sensibilidade à dor profunda intacta, uma cirurgia efetuada o mais rápido possível após aparecimentos dos sinais é a melhor aproximação a estes casos (Ferreira et al., 2002).
Em geral, os cães com disfunção motora mais grave tendem a ter tempos mais longos de recuperação, mas a idade e o peso do animal têm também uma associação com o tempo necessário para a recuperação da capacidade de caminhar. Além disso, a reabilitação física pode ser uma forma dos cães atingirem esse objetivo mais rapidamente (Platt e Garosi, 2012).
Revisão bibliográfica
Em casos em que não há melhorias ou há deterioração clínica recomenda-se uma segunda RM para se obter um melhor prognóstico. Esta situação é comummente associada com lesão compressiva que se desenvolveu ou que ficou após cirurgia (Forterre et al, 2010). A cicatrização também pode ser confirmada em T1w e T2w, visualizando-se o tecido cicatricial como isointenso e relativamente hipointenso respetivamente, em comparação com o disco intervertebral (Levitski et al., 1999).
Um pior prognóstico está associado com défices neurológicos severos, especialmente perda da sensibilidade à dor profunda (Duval et al., 1996). A sensibilidade à dor profunda é conduzida por fibras não mielinizadas dos tratos espinhotalamico e espinhoreticular que se encontram profundos na substância branca dos funículos ventrais e laterais da ME (De Lahunta e Glass, 2009). Estas fibras são relativamente resistentes à compressão, logo, a perda da sensibilidade à dor profunda em cães com herniação discal indica uma lesão grave da ME e é considerado um mau prognóstico (McKee, 1992). Em geral, a maioria dos cães com sensibilidade à dor profunda intacta, mesmo paraplégico ou paraparético, tem um prognóstico favorável, especialmente se tratados cirurgicamente. Sem cirurgia ou com cirurgia adiada, cães com sensibilidade à dor profunda ausente têm um prognóstico reservado, embora a duração de ausência de sensibilidade à dor profunda antes da cirurgia como um indicador de prognóstico seja controversa. Assume-se que os cães com perda de sensibilidade à dor profunda durante mais de 24-48 horas antes da cirurgia apresentam um pior prognóstico para o retorno da função (Platt e Garosi, 2012).
Em vários estudos, cães não ambulatórios afetados com herniação discal toracolombar, a descompressão cirúrgica leva a recuperação de movimentos voluntários em 86-96% dos cães que têm sensibilidade à dor profunda aquando a primeira avaliação (Davis e Brown, 2002; Ferreira et al., 2002; Ruddle et al., 2006). A recuperação de movimentos voluntários após descompressão cirúrgica ocorre em 43-62% dos cães que não têm sensibilidade à dor profunda antes da cirurgia (Duval et al., 1996; Olby et al., 2003; Ito et al., 2005). Nestes casos, a execução de uma durotomia pode oferecer informações úteis sobre o prognóstico, podendo revelar sinais de mielomalacia (Laitinen e Puerto, 2005). Num outro estudo foi reportado que 9% dos animais sem sensibilidade à dor profunda desenvolveram mielomalacia difusa e foram eutanasiados intraoperatoriamente (Scott e McKee, 1999).
O regresso da sensibilidade à dor profunda dentro de duas semanas após cirurgia é um indicador de prognóstico razoável (Laitinen e Puerto, 2005). Em cães com esta sensibilidade presente dentro de 2 semanas pós-operatório tiveram um rácio de sucesso superior (66,7%) do que aqueles que não a demonstraram durante o mesmo período de tempo (10%) (Laitinen e Puerto, 2005).
Os resultados de um estudo sugerem que o prognóstico de cães sem sensibilidade à dor profunda devido a traumatismo é reservado, enquanto cães com herniação discal têm maior probabilidade de recuperar a função motora. Nesse mesmo estudo 58% (37 de 64) animais que sofreram intervenção cirúrgica recuperaram a sensibilidade à dor profunda (Olby et al., 2003). 78 % dos cães que recuperaram, fizeram-no no espaço de 2 semanas após cirurgia, recuperando a ambulação. Para os animais que recuperaram a sensibilidade à dor profunda para além destas duas semanas, o desenvolvimento de movimento voluntário da cauda foi um sinal útil para o prognóstico ser favorável (Olby et al., 2003). Uma forte correlação positiva entre a presença de movimentos voluntário nos membros pélvicos pós-operatório e o tempo até se tornar ambulatório também foi demonstrada (Schulz et al., 1998).
Em termos imagiológicos, uma hiperintensidade intraparenquimatosa T1w, hiperintensidade T2w e hipointensidade T2w foram associados com fraco prognóstico a longo termo em humanos com lesão espinhal traumática (Mascalchi et al., 1993).
Sinais residuais, tais como a incontinência urinária e fecal, leva a que os cães necessitem expressão manual da bexiga e possível cateterismo vesical em casos mais complicados. A evacuação incompleta da bexiga e utilização de cateteres urinários podem predispor cães a infeção do trato urinário (Platt e Garosi, 2012). Num estudo em que os cães incluídos recuperaram a sensibilidade à dor profunda após cirurgia, 41% dos 37 animais apresentavam incontinência fecal (Olby et al., 2003).
A precisão do prognóstico é importante para os donos visto que podem ficar um pouco relutantes em efetuar tratamentos de longo prazo em cães paraplégicos (Jeffery, 1988).
1.5. Mielopatia degenerativa
A mielopatia degenerativa é uma doença neurodegenerativa fatal de progressão lenta prevalente em várias raças. É também chamada a mielopatia do Pastor Alemão (Braund e Vandevelde, 1978), mas também ocorre em outras raças como Welsh Corgi e Boxer (Coates et al., 2007). É caracterizado por um início progressivo de sinais de MNS como ataxia proprioceptiva e espástica nos membros pélvicos. Aparece em cães com mais de 5 anos, sendo o intervalo de aparecimento dos 5 aos 14 anos de idade (Barclay e Haines, 1994), nos quais ocorre necrose axonal difusa, principalmente nos funículos laterais e ventrais dos segmentos espinhais toracolombares, estando assim restrito à substância branca (Braund e Vandevelde, 1978). A desmielinização secundária e astrogliose estão também associados a esta axonopatia (De Lahunta e Glass, 2009). Os sinais clínicos iniciais são confundidos com os de displasia de anca, podendo estar também presentes nestes casos. Passam por uma ataxia propriocetiva espástica e generalizada (Awano et al., 2009), enquanto a fraqueza