Universidade de Trás-os-Montes e Alto Douro
Determinação e Estabilidade do Lactato Sanguíneo de Cavalos em
Diversas Condições de Conservação
Dissertação de Mestrado em Medicina Veterinária
João Pedro Mendes de Oliveira
Orientador: Professor Doutor Mário Pedro Gonçalves Cotovio
Co-Orientador: Professora Doutora Maria João Miranda Pires
Universidade de Trás-os-Montes e Alto Douro
Determinação e Estabilidade do Lactato Sanguíneo de Cavalos em
Diversas Condições de Conservação
Dissertação de Mestrado em Medicina Veterinária
João Pedro Mendes de Oliveira
Orientador: Professor Doutor Mário Pedro Gonçalves Cotovio
Co-Orientador: Professora Doutora Maria João Miranda Pires
Composição do Júri:
I
AGRADECIMENTOS
Finalizo com este projeto o meu Mestrado Integrado em Medicina Veterinária. Um longo percurso que vai para além destes 6 anos de estudo. E é por isso, que em primeiro lugar quero dedicar esta minha pequena contribuição aos meus pais. Pela educação e valores morais que me ensinaram e que moldaram a pessoa que sou hoje. Ao incentivo e apoio incansáveis que me permitiram concretizar todos os sonhos e objetivos que surgiram durante estes e os anos anteriores. Ao carinho e à presença com que sempre me ajudaram a ultrapassar as dificuldades e momentos menos fáceis. Por sempre me terem apoiado nas escolhas que fiz mesmo que isso implicasse abdicarem de outras coisas.
Quero agradecer à minha irmã por ser uma das pessoas mais importantes da minha vida e melhor amiga. Pela alegria e eletricidade que sempre me contagiaram. Pela competição saudável que sempre existiu e me fez crescer dando sempre o meu melhor.
À minha avó Maria José, avô António e tia Luísa pelo carinho e ajuda que sempre me deram. A todos os meus familiares que sempre me desejaram o melhor e se orgulham daquilo que sou.
Ao Professor Mário Cotovio, por me ter sugerido este tema que tantas recordações me traz dos meus tempos como atleta. Ao seu apoio e disponibilidade que me ajudaram a ultrapassar os vários problemas que foram surgindo durante a execução do projeto.
À Professora Maria João Pires pela ajuda incansável dada no processamento das amostras no laboratório e pela ajuda e ideias que deu na elaboração deste projeto.
À direção do Hospital Veterinário da UTAD por ter permitido a recolha das amostras nos cavalos presentes nas instalações e por ter permitido o acesso ao Laboratório de Patologia Clínica onde estas foram processadas.
À Dona Ana Machado pela ajuda que nos deu no processamento das amostras e pela boa companhia que foi durante as horas passadas no laboratório.
Ao corpo clínico da Área Hospitalar de Animais de Produção e Equinos do Hospital Veterinário da UTAD: Quaresma, Triguinho, Joana Moreira, Pedro, Luís e Joana Devesa com quem realizei o meu estágio curricular. Pela ajuda que me deram, pelo que me ensinaram e principalmente pelas grandes amizades que criei. Pelos jantares e saídas, os infinitos
II momentos de boa disposição e partilha. Aos WildVets com quem partilhei algumas aventuras e momentos de descontração.
À Professora Paula Mota e ao Professor Jorge Campaniço do Departamento de Ciências do Desporto, Exercício e Saúde por terem gentilmente cedido o aparelho Accutrend
Plus.
A todos os meus colegas de ano que tornaram estes 6 anos tão especiais, mas em especial à Marta, à Mafalda e à Sara. Ao João, à Mariana e à Patricia, três grandes amigos que fiz no decorrer do curso e a quem tenho grande estima.
Um especial agradecimento ao Rezendes, quem lutou ao meu lado durante tantas horas na pista, na piscina e no pavilhão e a quem devo em parte a minha entrada neste curso. Uma pessoa a quem tenho enorme respeito e uma das minhas inspirações.
Aos meus eternos amigos Ricardo, Filipe, Alexandre e Hugo com quem partilhei e partilho momentos inesquecíveis de descontração e confissão e por olharem para mim com nada menos do que um grande orgulho por aquilo que sou e atingi.
III
RESUMO
O lactato sanguíneo é um dos parâmetros bioquímicos que pode ser avaliado pelo médico veterinário, auxiliando no diagnóstico, tratamento e prognóstico de diversas doenças. É também um parâmetro bastante utilizado na monitorização da fisiologia do exercício, auxiliando na caracterização da performance desportiva do cavalo. No que diz respeito à estabilidade do lactato em amostras de sangue de cavalo, não existem muitas publicações sobre este tema e, quando necessário, faz-se o paralelismo com os estudos que existem em medicina humana ou outras espécies animais. Assim, este trabalho pretendeu comparar o aparelho portátil Accutrend Plus da Roche® com o aparelho de bancada RX Daytona da Randox® na mensuração de lactato. Pretendeu ainda estudar o efeito de diferentes anticoagulantes (fluoreto de sódio/oxalato de potássio, heparina e EDTA), a ausência de anticoagulante, a temperatura, o tempo de armazenamento e a centrifugação na sua concentração.
Para este estudo foram utilizados 11 cavalos que se encontravam no Hospital Veterinário da Universidade de Trás-os-Montes e Alto Douro, 5 machos e 6 fêmeas, com idade média de 16 anos. Foram colhidas amostras de sangue da veia jugular para tubos contendo os anticoagulantes: fluoreto de sódio/oxalato de potássio, heparina e EDTA e tubos sem anticoagulante. Depois de centrifugadas, as amostras foram imediatamente processadas ou armazenadas a diferentes temperaturas (20ºC, 4ºC e -18ºC) durante 24 horas. As determinações da concentração de lactato foram realizadas nos aparelhos Accutrend Plus da Roche® e RX Daytona da Randox®.
Neste estudo, não foi possível fazer a comparação entre os valores de lactato obtidos com o aparelho Accutrend Plus e o aparelho RX Daytona. Não foram encontradas diferenças estatisticamente significativas para as concentrações de lactato obtidas no soro e nos plasmas obtidos com os diferentes anticoagulantes. No que diz respeito ao efeito da temperatura de armazenamento do soro e dos plasmas não foram encontradas diferenças estatisticamente significativas entre o tempo 0 horas e 24 horas. Foram encontradas diferenças estatisticamente muito significativas (p=0,000) quando as amostras de sangue no tubo sem anticoagulante e nos tubos com heparina ou EDTA foram centrifugadas 24 horas depois da amostra ser colhida.
Concluiu-se assim que o anticoagulante utilizado não influencia a concentração de lactato plasmático. A temperatura de armazenamento não tem influência na concentração de lactato às 24 horas pós recolha depois da fração celular ser separada da fração plasmática ou sérica. As amostras de sangue colhido para tubos sem anticoagulante ou com os anticoagulantes heparina ou EDTA devem ser centrifugadas em 30 minutos após a recolha, de forma a que não haja um erro laboratorial de determinação da concentração de lactato.
IV
Palavras-chave: Cavalo, Lactato, Aparelhos de Medição de Lactato, Conservação,
V
ABSTRACT
Blood lactate can be easily measured by the veterinarian and might be of great importance for the diagnosis, treatment and prognosis of certain diseases. It is also a parameter often used to monitor the exercise physiology and performance in horses. The lactate stability in blood samples from horses has not been thoroughly studied and it has been assumed that its stability is similar to the results found in studies performed in humans and other animal species. Therefore, the aim of this study was to compare the use of two lactate measuring devices: the Accutrend Plus from
Roche® (portable device) and the RX Daytona from Randox® (bench-top device). It was also
pretended to answer the questions of how the usage of different anticoagulants (sodium fluoride/potassium oxalate, heparin and EDTA) or no anticoagulant, the temperature and period of storage the centrifugation could affect the lactate concentration in blood samples.
In this study blood samples were taken from 11 horses presented at Trás-os-Montes and Alto Douro University Hospital, 5 males and 6 females, with a mean age of 16 years old. The samples were collected from the jugular vein into blood collecting tubes with the anticoagulants: sodium fluoride/potassium oxalate, heparin and EDTA, and blood collecting tubes with no anticoagulant. After centrifugation the samples were immediately analyzed or stored at different temperatures (20ºC, 4ºC e -18ºC) for a period of 24 hours. The lactate concentration analysis was performed using the devices Accutrend Plus from Roche® and RX Daytona from Randox®.
In this study it was not possible to compare the values for the lactate concentration obtained with the devices Accutrend Plus and RX Daytona. No statistically significant results were found in lactate concentrations from either serum or plasma obtained using the different anticoagulants. The temperature of storage of the serum and plasma did not seem to affect the lactate concentration from time 0 to 24 hours after sample collection. Mean lactate concentration was very highly significant (p=0,000) when the samples collected into the tubes with no anticoagulant and the tubes with the anticoagulants heparin or EDTA were only centrifuged 24 hours after sample collection.
In conclusion, the anticoagulant used does not affect plasma lactate concentration. The storage temperature has no influence in lactate concentration 24 hours after the sample is collected if the serum and plasma is separated from the cellular elements. The samples collected into blood collection tubes with no anticoagulant or the anticoagulants heparin and EDTA must be centrifuged within 30 minutes after collection to avoid a fictitious increasing in lactate concentration.
VI
ÍNDICE GERAL
1. Introdução ... 1
1.1. Fisiologia do lactato 1 1.1.1. Lactato no sangue total ... 4
1.1.2. Isómeros L- e D-lactato ... 5
1.1.3. Produção de L-lactato em caso de doença ... 5
1.1.3.1. Aumento da atividade da Na+/K+-ATPase em resposta aos mediadores inflamatórios ... 6
1.1.3.2. Inibição do complexo enzimático piruvato desidrogenase ... 7
1.1.3.3. Produção de lactato pelos leucócitos ... 7
1.1.3.4. Diminuição da metabolização hepática ... 7
1.2. Utilidade da concentração de lactato no diagnóstico e tratamento 8
1.2.1. Concentração de lactato na fluidoterapia e transfusões ... 8
1.2.2. Concentração de lactato no líquido peritoneal ... 9
1.2.3. Concentração de lactato em derrames séticos ... 9
1.2.4. Concentração de lactato no líquido pleural ... 10
1.2.5. Concentração de lactato no líquido sinovial ... 10
1.2.6. Concentração de lactato no líquido cefalorraquidiano ... 10
1.3. Utilidade da concentração de lactato no prognóstico 10 1.4. Utilidade do lactato na medicina desportiva 11 1.5. Mensuração da concentração de lactato 12 1.5.1. Metodologia para determinar a concentração de lactato ... 13
1.5.2. Efeito da conservação e armazenamento da amostra na concentração de lactato .. 16
2. Objetivos ... 18
3. Materiais e métodos ... 19
VII 3.1.1. Animais ... 19
3.2. Recolha das amostras de sangue 19
3.3. Medição do lactato 20
3.3.1. Estudo 1: comparação dos valores da concentração de lactato obtidos no Accutrend
Plus e no RX Daytona para o soro e plasmas obtidos dos diferentes anticoagulantes ... 20
3.3.2 Estudo 2: comparação dos valores da concentração de lactato entre o soro e os plasmas obtidos dos diferentes anticoagulantes utilizando o RX Daytona ... 21
3.3.3. Estudo 3: efeito da temperatura e tempo de armazenamento na concentração de lactato 24h após colheita das amostras utilizando o RX Daytona ... 21
3.3.4. Estudo 4: efeito da separação da fração celular da fração sérica ou plasmática na concentração de lactato utilizando o RX Daytona ... 21
3.4. Análise estatística 22
4. Resultados ... 23
4.1. Estudo 1: comparação dos valores da concentração de lactato obtidos no Accutrend
Plus e no RX Daytona para o soro e plasmas obtidos dos diferentes anticoagulantes 23
4.2 Estudo 2: comparação dos valores da concentração de lactato entre o soro e plasmas obtidos dos diferentes anticoagulantes utilizando o RX Daytona 24
4.3 Estudo 3: efeito da temperatura e tempo de armazenamento na concentração de lactato 24h após colheita das amostras utilizando o RX Daytona 25
4.4 Estudo 4: efeito da separação da fração celular da fração sérica ou plasmática na
concentração de lactato utilizando o RX Daytona 27
5. Discussão de resultados ... 30
6. Conclusões ... 36
VIII
ÍNDICE DE FIGURAS
Figura 1Isómeros de lactato ... 5 Figura 2 Ilustração de uma tira BM-Lactate ... 14
ÍNDICE DE TABELAS
Tabela 1 Causas de hiperlactatemia em equinos ... 6 Tabela 2 Concentrações de lactato em mmol/L obtidas utilizando o aparelho Accutrend Plus para o soro e plasmas obtidos dos diferentes anticoagulantes ... 23 Tabela 3 Concentrações de lactato em mmol/L obtidas com o aparelho RX Daytona para o soro e plasmas obtidos dos diferentes anticoagulantes ... 24 Tabela 4 Média, desvio padrão e erro padrão da média em mmol/L da concentração de lactato ao tempo 0 horas para o soro e plasmas obtidos dos diferentes anticoagulantes ... 24 Tabela 5 Média, desvio padrão e erro padrão da média em mmol/L da concentração de lactato dependendo do tipo e tempo em horas de armazenamento para o soro e plasmas obtidos dos diferentes anticoagulantes ... 26 Tabela 6 Média, desvio padrão e erro padrão da média em mmol/L da concentração de lactato das amostras de soro e plasmas obtidos dos diferentes anticoagulantes ao tempo 0 horas e depois de 24 horas sem serem centrifugadas ... 27 Tabela 7 Teste t para amostras emparelhadas para comparar as médias da [LA] ao tempo 0horas e 24h para o soro e plasmas obtidos dos diferentes anticoagulantes ... 29
ÍNDICE DE GRÁFICOS
Gráfico 1 Representação gráfica das médias da concentração de [LA] em mmol/L ao tempo 0 horas para o soro e plasmas obtidos dos diferentes anticoagulantes ... 25 Gráfico 2 Efeito da centrifugação na concentração do lactato em mmol/L para o soro e plasmas obtidos dos diferentes anticoagulantes ... 28
IX
LISTA DE ABREVIATURAS
[LA] – Concentração de lactato
Acetil-CoA – Acetil-Coenzima A
ADP – Adenosina difosfato
ATP – Adenosina trifosfato
C6H12O6 – Glicose
CH3CH(OH)COO- – Lactato
CH3COCOO- – Piruvato
CO2 – Dióxido de Carbono
Cong. 24h – Congelado durante 24 horas
H+ – Iões de hidrogénio
H2O – Água
H2O2 – Peroxido de hidrogénio
HEP – Heparina sódica
EDTA – Ácido etilenodiamino tetra-acético
LDH – Lactato desidrogenase
LOD – Lactato oxidase
mmol/L – milimole por litro
N – Tamanho da amostra
NAD+ – Dinucleotido de nicotinamida e adenina oxidado
NADH – Dinucleotido de nicotinamida e adenina reduzido
X NaF/Ox – Fluoreto de sódio / oxalato de potássio
nm – Nanómetros
PDH – Piruvato desidrogenase
Pi – Grupo fosfato
Re24 – Refrigerado durante 24 horas
rpm – Rotações por minuto
1
1. Introdução
1.1. Fisiologia do lactato
A principal fonte energética das células é obtida através da glicose na forma de adenosina 5’-trifosfato (ATP). Esta é gerada a partir de 3 processos: glicólise, ciclo do ácido cítrico (ou ciclo de Krebs) e fosforilação oxidativa (ou cadeia transportadora de eletrões) (Hughes, 2006). Apenas uma pequena quantidade de ATP é produzida durante a glicólise, sendo que a vasta maioria é obtida através da fosforilação oxidativa dos produtos intermediários do ciclo do ácido cítrico (Fall et al., 2005; Tennent-Brown, 2011).
A glicólise ocorre no citoplasma das células enquanto o ciclo do ácido cítrico e a fosforilação oxidativa ocorrem no interior da mitocôndria. Os últimos dois processos estão dependentes de condições de aerobiose, enquanto que a glicólise se processa mesmo na ausência de oxigénio. Isto permite que, mesmo em condições de hipóxia celular, se mantenha a produção de energia necessária à atividade das células (Hughes, 2006).
No citoplasma celular, a glicólise gera, por cada molécula de glicose, 2 moléculas de ATP e 2 moléculas de piruvato, havendo ainda libertação de iões de hidrogénio (H+), num processo que envolve uma série de 10 reações enzimáticas (Fall et al., 2005; Tennent-Brown, 2011). Numa destas reações ocorre a redução do dinucleótido de nicotinamida e adenina: NAD+ NADH, metabolito fundamental para que possa haver produção de ATP nas reações que se seguem (Hughes, 2006). Esquematicamente, na glicólise formam-se os seguintes produtos (1) (Allen et al., 2008):
C6H12O6 + NAD+ CH3COCOO- + NADH + 2ATP + 2H+ (1)
Glicose Piruvato
Na presença de oxigénio, o piruvato é transportado para a mitocôndria onde é convertido em acetil-Coenzima A (acetil-CoA). Esta segue o ciclo do ácido cítrico onde é transformada numa série de moléculas intermédias que serão utilizadas na fosforilação oxidativa para a síntese de ATP. Através da via aeróbia são sintetizadas 36 a 38 moléculas de ATP por cada molécula de glicose, sendo que 2 correspondem ao ATP produzido durante a glicólise e as restantes durante o ciclo do ácido cítrico e fosforilação oxidativa (Fall et al., 2005; Tennent-Brown, 2011). Os produtos finais da oxidação completa da glicose são: dióxido de carbono e
2 água (Hughes, 2006). A reação completa da glicose pela via aeróbia pode ser resumida no seguinte esquema (2) (Lagutchik et al., 1996):
C6H12O6 + 6 O2 + 36 ADP 6 CO2 + 36 ATP + 42 H2O (2) Glicose
Na ausência de oxigénio, o piruvato não é transportado para o interior da mitocôndria e a célula está exclusivamente dependente da glicólise para a obtenção de energia (Fall et al., 2005; Tennent-Brown, 2011). De maneira a manter a produção anaeróbia de ATP, o piruvato é reduzido em lactato e o NADH oxidado em NAD+ pela enzima lactato desidrogenase (LDH). O NAD+ regenerado desta forma, é essencial para que a glicólise se mantenha. Esquematicamente, a reação é a seguinte (3) (Allen et al., 2008):
CH3COCOO- + NADH + H+ CH3CH(OH)COO- + NAD+ (3) Piruvato LDH Lactato
A diminuição do pH está diretamente relacionada com um aumento da concentração de iões H+. Este aumento pode estar relacionado com um aumento da produção de iões H+; com a diminuição da capacidade de neutralização destes pelos diversos tampões fisiológicos; ou pela diminuição da capacidade destes iões serem excretados. Como pode ser verificado na reação (3), a redução do piruvato em lactato é conseguida com o consumo de dois iões H+, um proveniente do compartimento de iões H+ existentes no citosol e o outro proveniente do NADH. A produção de lactato funciona então como uma forma de manter o pH intracelular em níveis fisiológicos de maneira a manter a homeostasia celular quando a célula não tem capacidade de utilizar este iões na fosforilação oxidativa (Robergs et al., 2004).
Apesar do baixo rendimento energético desta reação, apenas 2 moléculas de ATP, a glicólise ocorre a um ritmo bastante superior ao da via aeróbia, o que compensa o reduzido número de moléculas de ATP produzidas por cada molécula de glicose (Hughes, 2006). A reação completa da glicose pela via anaeróbia pode ser resumida no seguinte esquema (4) (Lagutchik et al., 1996):
C6H12O6 + 2 ADP 2 CH3CH(OH)COO- + 2 ATP + 2 H2O (4)
3 Apesar de haver consumo de iões H+ aquando da conversão de piruvato em lactato e, os iões H+ libertados na glicólise serem consumidos, durante o processo de hidrólise do ATP, essencial ao metabolismo celular, ocorre a libertação de dois iões H+ levando a um aumento da concentração intracelular e extracelular destes (reação 5) (Robergs et al., 2004). Consequentemente, existe uma diminuição do pH fisiológico, ou seja, o desenvolvimento de a uma acidose metabólica (Lagutchik et al., 1996).
ATP + H2O ADP + Pi + H +
(5)
Quando o aporte de oxigénio é restabelecido, o lactato produzido no metabolismo anaeróbio da glicose é novamente convertido em piruvato que, por sua vez, entra no ciclo do ácido cítrico ou então é utilizado pelo fígado ou córtex renal como substrato para a produção de glicose através da gluconeogénese (Ciclo de Cori). A utilização do lactato leva ao consumo de iões H+ e libertação de dióxido de carbono que, por estar em equilíbrio com o sistema tampão de bicarbonato, leva à resolução da acidose metabólica gerada durante o metabolismo anaeróbio (Fall et al., 2005; Hughes, 2006).
A excreção do lactato para o exterior da célula é vital para a manutenção do pH intracelular. Um aumento na produção de lactato pela célula resulta, portanto, num aumento da concentração de lactato ([LA]) no espaço intersticial e no sangue. Ao aumento da [LA] no sangue acima dos valores basais dá-se o nome de hiperlactatemia (Hughes, 2006).
Em cavalos adultos, considera-se 1,5 mmol/L o limiar superior para a concentração lactato sanguíneo. A maioria dos animais saudáveis apresentam uma concentração inferior a 1 mmol/L. Em poldros neonatos, os níveis de lactato sanguíneo tendem a ser mais elevados nos primeiros dias de vida. A razão para este fenómeno não é totalmente conhecida mas pensa-se que esteja relacionada com a imaturidade do fígado ou com a possível utilização do lactato como substrato energético. É esperado que ao fim da primeira semana de vida este valor desça até atingir os valores basais de um cavalo adulto (Tennent-Brown, 2011).
O termo acidose láctica, geralmente associada a uma acidose metabólica, refere-se a um aumento persistente e acumulação de lactato no sangue com diminuição do pH sanguíneo, enquanto uma hiperlactatemia se refere apenas a um aumento da [LA] no sangue sem haver alteração do pH sanguíneo. Ou seja, uma acidose láctica está sempre associada a uma
4 hiperlactatemia, mas uma hiperlactatemia não tem que causar sempre uma acidose láctica (Lagutchik et al., 1996).
Em animais saudáveis, os principais tecidos responsáveis pelo valor basal de lactato são a pele, os eritrócitos, o músculo esquelético, os leucócitos, o cérebro e o córtex renal (Hughes, 2006; Allen et al., 2008; Tennent-Brown, 2011). Os eritrócitos, devido à ausência de mitocôndrias e enzimas que degradem o piruvato, não têm senão a opção de converter o piruvato em lactato (Kreisberg 1972 citado por Tennent-Brown, 2011). O consumo de lactato é maior ao nível do fígado e rins e, por ser uma importante fonte energética, não é excretado pelo rim até que exista um grau moderado de hiperlactatemia (Hughes, 2006; Allen et al., 2008). No Homem, apesar de livremente filtrado pelo rim, o lactato é reabsorvido ao nível dos túbulos contornados proximais e apenas 2% é excretado com a urina (Fall et al., 2005).
1.1.1. Lactato no sangue total
No sangue, o lactato está distribuído entre o plasma e os eritrócitos. Dependendo da espécie animal pode haver uma grande diferença entre o valor de lactato no plasma e no sangue total. No caso dos cavalos, a [LA] plasmático em animais saudáveis e em repouso é cerca de metade da do sangue total (Bayly et al., 2006 citado por Tennent-Brown, 2011). Mesmo entre indivíduos da mesma espécie este valor parece variar bastante (Pösö et al., 1995; Väihkönen et al., 1999).
O estado fisiológico do animal também é importante no que diz respeito às diferenças entre o valor de lactato sanguíneo e intraeritrocitário. Por exemplo, durante o exercício a [LA] sanguíneo e intraeritrocitário aumenta, mas a uma taxa diferente, o que faz com que a concentração no plasma seja superior à intraeritrocitária (Bayly et al., 2006 citado por Tennent-Brown, 2011). Apesar da concentração intraeritrocitária chegar a um equilíbrio com a do plasma, não reflete variações repentinas e, por este motivo, o plasma deve ser utilizado em detrimento do sangue total na clínica do dia a dia (Hughes, 2006).
5
1.1.2. Isómeros L- e D-lactato
O lactato existe nos isómeros L- e D- (Figura 1). As células dos mamíferos produzem quase exclusivamente L-lactato, enquanto as bactérias produzem D-lactato. Na maioria dos mamíferos saudáveis, o isómero L- existe em concentrações na ordem dos milimole, enquanto o isómero D- existe geralmente em concentrações na ordem dos
nanomole. Hiper-D-lactatemia é um fenómeno raramente observado em humanos. Já em ruminantes é relativamente comum e é consequente de uma fermentação excessiva de hidratos de carbono no intestino grosso com subsequente sobrecrescimento de bactérias produtoras de ácido láctico (Ewaschuk et al., 2005).
Os medidores de lactato portáteis utilizados no dia a dia apenas lêem o L-lactato, geralmente a partir do sangue total sendo que alguns aparelhos permitem efetuar a medição também em plasma. Para deteção de alterações da concentração de D-lactato é necessário recorrer a métodos como a cromatografia gasosa ou espetrofotometria gasosa (Allen et al., 2008).
1.1.3. Produção de L-lactato em caso de doença
O lactato foi, tradicionalmente, considerado como um biomarcador de hipoxia tecidular e um dos produtos finais do metabolismo dos hidratos de carbono. Na realidade, a reduzida distribuição de oxigénio e o metabolismo anaeróbio são as causas mais importantes para o aumento do lactato no sangue quer em humanos quer em animais e são referidas como causas de hiperlactatemia do tipo A. Em cavalos hospitalizados, a septicemia, a hipoperfusão tecidular por hipovolemia, a má distribuição dos fluidos corporais e, potencialmente, as lesões microvasculares são frequentes, e causas comuns de hiperlactatemia. Causas menos comuns que justificam um aumento na [LA] são: a diminuição da função cardíaca, a diminuição da capacidade de transporte de oxigénio e a hipoxemia secundária a doença pulmonar grave (Fall
et al., 2005 citado por Tennent-Brown, 2011).
Hoje sabe-se que o aumento do lactato sanguíneo pode ocorrer também em situações de oxigenação tecidular normal. As causas deste tipo de hiperlactatemia denominam-se de hiperlactatemia do tipo B. A tabela 1 apresenta algumas das causas de hiperlactatemia.
Figura 1Isómeros de lactato
6
Tabela 1 Causas de hiperlactatemia em equinos (Lagutchik et al., 1996; Hughes, 2006; Allen et al., 2008; Tennent-Brown, 2011)
Tipo A (sinais clínicos de hipoxia relativa ou absoluta)
Tipo B (sem sinais clínicos de hipoxia)
Diminuição da distribuição de oxigénio
Hipotensão Hipovolémia Perda de sangue Choque cardiogénico Choque sético Anemia grave Hipoxémia grave
Intoxicação por monóxido de carbono
Aumento do consumo de oxigénio
Exercício
Convulsões
Tremores
Inadequada utilização do oxigénio
Síndrome de Resposta Inflamatória Sistémica (SIRS)
Tumores malignos Administração parenteral de fluidos Deficiência em tiamina Disfunção mitocondrial Fármacos/toxinas Cianeto Catecolaminas Entre outros
1.1.3.1. Aumento da atividade da Na+/K+-ATPase em resposta aos mediadores inflamatórios
Como resultado de uma série de estudos in vitro e in vivo, uma importante correlação foi encontrada entre a concentração sanguínea de catecolaminas, a glicólise, a atividade da Na+/K+-ATPase e a produção de lactato pelo tecido muscular (James et al., 1999; McCarter et
al., 2001; Levy et al., 2005; Tennent-Brown, 2011). Os resultados destes trabalhos dão uma
explicação plausível para a causa de hiperlactatemia durante um aporte normal de oxigénio às células (Tennent-Brown, 2011).
A enzima Na+/K+-ATPase, também conhecida como bomba Na+/K+, responsável pela manutenção do potencial de repouso das membranas celulares, apresenta o seu próprio conjunto de enzimas glicolíticas responsáveis pela produção de ATP essencial ao seu funcionamento. Este conjunto de enzimas não está relacionado com a produção de energia para funcionamento da própria célula e serve exclusivamente a bomba de Na+/K+. O piruvato produzido desta maneira é preferencialmente convertido em lactato e excretado para o espaço intersticial, não entrando no ciclo do ácido cítrico da célula (McCarter et al., 2001; Levy et
7
al., 2005; Tennent-Brown, 2011). De maneira a assegurar a energia necessária ao aumento da
atividade da bomba de Na+/K+ em resposta ao aumento da concentração de epinefrina circulante, por exemplo em animais em choque, e ao aumento da adenosina difosfato (ADP), a taxa de glicólise por parte destas enzimas aumenta e, consequentemente, a eliminação do lactato para o exterior da célula também aumenta. Neste cenário, o músculo, por corresponder a uma grande parte da massa corporal é o principal responsável pela hiperlactatemia presente (McCarter et al., 2001; Levy et al., 2005; Tennent-Brown, 2011).
1.1.3.2. Inibição do complexo enzimático piruvato desidrogenase
O complexo enzimático piruvato desidrogenase (PDH), responsável pela ligação entre a glicólise e o ciclo do ácido cítrico, é um dos complexos mais importantes na regulação do metabolismo da glicose (Alamdari et al., 2008; Tennent-Brown, 2012). Este complexo é formado pelas enzimas piruvato desidrogenase, dihidrolipoil transacetilase e dihidrolipoil-desidrogenase, e é responsável pela conversão de piruvato em acetil-CoA.
A regulação da atividade deste complexo é feita por duas enzimas: a PDH fosfatase, responsável pela desfosforilação da PDH, promovendo a atividade do complexo, e a PDH cinase que ao fosforilar o complexo leva a que a sua atividade diminua (Tennent-Brown, 2012). O aumento da atividade da enzima PDH cinase ocorre secundariamente ao aumento de citocinas proinflamatórias, nomeadamente, o fator de necrose tumoral α e a interleucina-6 (Vary et al., 1999; Tennent-Brown, 2012). A diminuição da atividade do complexo PDH promove a conversão de piruvato em lactato em vez de acetil-CoA. Uma desregulação da atividade deste complexo ao nível das células musculares está implicado no desenvolvimento de hiperlactatemia durante uma septicemia (Vary et al., 1999; Tennent-Brown, 2012).
1.1.3.3. Produção de lactato pelos leucócitos
Aproximadamente 80% da glicose metabolizada pelos leucócitos é convertida em lactato, o que pode explicar parcialmente a razão porque num processo sético existe um aumento do lactato em resultado de um aumento da glicólise por parte das células inflamatórias sequestradas num local de infeção (Tennent-Brown, 2012).
1.1.3.4. Diminuição da metabolização hepática
Humanos com insuficiência hepática podem ser incapazes de metabolizar o lactato eficazmente, levando a um possível aumento na [LA] sanguíneo (Fall et al., 2005;
Tennent-8 Brown, 2012). O papel do fígado em animais septicémicos com hiperlactatemia não é claro mas parece provável que uma diminuição da função hepática contribua para um aumento da [LA] sanguíneo em animais com insuficiência hepática grave (Tennent-Brown, 2012).
1.2. Utilidade da concentração de lactato no diagnóstico e tratamento
Aquando da chegada e hospitalização de um cavalo, o lactato plasmático é um parâmetro bioquímico muitas vezes discriminado, mas que pode ter grande valor no diagnóstico, tratamento e prognóstico do animal (Tennent-Brown, 2012).
Em humanos, o tempo de semi-vida do lactato é de, aproximadamente, 20 minutos. Para os animais, pensa-se que este valor seja idêntico (Lagutchik et al., 1996 citado por Tennent-Brown, 2012). O seu reduzido tempo de semi-vida permite avaliar o metabolismo celular vinte minutos antes da recolha e, assim, orientar a fluidoterapia e terapia vasopressora ou inotrópica ideal (Prittie, 2006; Tennent-Brown, 2012).
A quantificação do lactato noutros fluidos corporais que não o sangue parece ter também grande importância na qualificação destes quanto à presença de bactérias no local de onde foi colhido (Hughes, 2006). Não só as bactérias são responsáveis pela produção de lactato nestes casos; 80% da glicose metabolizada pelos leucócitos é convertida em lactato como anteriormente foi referido (Tennent-Brown, 2011). A [LA] num fluido pode assim ser um bom indicador de um processo sético e, ainda mais, servir de indicador quanto à evolução e resposta à antibioterapia efetuada, bem como ao grau de lesão tecidular e respetivo prognóstico (Hughes, 2006).
1.2.1. Concentração de lactato na fluidoterapia e transfusões
Em situações de hipovolemia ou hipoxia, o lactato plasmático permite verificar se a terapia efetuada está a ser eficaz, isto é, se há diminuição dos valores de lactato para níveis basais ou se, pelo contrário, os valores de lactato permanecem elevados e a terapia não está a ter o efeito desejado (Tennent-Brown, 2012). Se a [LA] plasmático não voltar aos valores basais depois de uma correta administração de fluidos, torna-se necessário fazer uma melhor avaliação das possíveis causas da hiperlactatemia no animal (Hughes, 2006). Por exemplo, em humanos com septicemia os valores de lactato podem permanecer elevados mesmo depois da restauração dos níveis de oxigénio devido a outras causas de hiperlactatemia (Dellinger et al., 2008 citado por Tennent-Brown, 2012).
9 Em cavalos, a [LA] sanguíneo aparenta ser um bom indicador de perda de sangue, apesar de que a variação desta pode ser muito subtil em hemorragias ligeiras e moderadas (Magdesian et al., 2006; Tennent-Brown, 2012)
Um aumento da [LA] sanguíneo pode servir então de indicador para se iniciar uma transfusão sanguínea ou para monitorizar a eficácia da mesma, no sentido em que quando a perfusão tecidular volta ao normal também a [LA] sanguíneo desce para valores basais (Hurcombe et al., 2007; Tennent-Brown, 2012).
1.2.2. Concentração de lactato no líquido peritoneal
Moore et al. (1990) e Parry e Crisman (1991) definiram que para cavalos saudáveis, a [LA] no líquido peritoneal é de 0,7 ± 0,2 mmol/L e 0,66 ± 0,43 mmol/L, respetivamente, e que esta deve ser sempre inferior à do sangue (Latson et al., 2005; Tennent-Brown, 2012). Contudo, a [LA] no líquido peritoneal aumenta rapidamente em condições de isquemia intestinal e peritonite séptica. Num estudo realizado por Latson et al. em 2005, os autores verificaram que a [LA] no líquido peritoneal, em cavalos com obstruções intestinais estrangulativas, era estatisticamente superior à de cavalos com obstruções intestinais não estrangulativas: 8,45 ± 5,52 mmol/L e 2,09 ± 2,09 mmol/L, respectivamente. A isquémia intestinal tem um efeito negativo na permeabilidade da membrana celular, levando à saída do lactato para a circulação sistémica e cavidade peritoneal (Liao et al., 1995; Latson et al., 2005). A deteção do aumento deste parâmetro bioquímico no sangue e líquido peritoneal, ajuda na deteção precoce de lesões isquémicas intestinais e auxilia na tomada de decisão quanto à escolha do tratamento (médico ou cirúrgico), sendo que quanto mais elevada for a concentração de lactacto nestes fluidos maior será probabilidade do animal ter lesões isquémicas e ter que ser submetido a tratamento cirúrgico (Thoefner et al., 2000; Latson et al., 2005).
1.2.3. Concentração de lactato em derrames séticos
A presença de bactérias ou fungos numa cavidade corporal delimitada está associada com um aumento na [LA] e, geralmente, uma diminuição na concentração de glicose no líquido presente nessa cavidade. Nestes casos, a [LA] neste líquido aparenta ser independente da [LA] sanguíneo (Brook, 1981; Tennent-Brown, 2012). Assim, a [LA] e glicose pode ser útil na caracterização da natureza do fluido em causa, principalmente quando se esperam por outros resultados laboratoriais, ou estes tenham sido inconclusivos (Tennent-Brown, 2012).
10 A causa para o aumento da [LA] nestes fluidos é incerta mas pode estar relacionada com (Brook, 1981; Tennent-Brown, 2012):
a diminuição do aporte sanguíneo devido à presença de edema nos tecidos adjacentes;
o aumento do metabolismo da glicose, com consequente produção de lactato, pelas células inflamatórias presentes no local.
1.2.4. Concentração de lactato no líquido pleural
Num estudo realizado em 1990, Brambaugh e Benson verificaram que em cavalos com derrame pleural assético não existiam diferenças significativas na concentração média de lactato e glicose entre o sangue e o líquido pleural. Já em cavalos com derrames pleurais séticos foi observada uma maior [LA] (e menor concentração de glicose) no derrame pleural relativamente ao sangue (Tennent-Brown, 2012).
1.2.5. Concentração de lactato no líquido sinovial
Num estudo realizado em 6 cavalos com artrite sética induzida por inoculação de
Staphylococcus aureus intra-articular realizado por Tulamo et al. (1989) verificou-se que a
[LA] basal no líquido sinovial aumentou de 2,02 ± 0,76 mmol/L para valores superiores a 6,9 mmol/L nas primeiras 24 horas após inoculação do agente infecioso. Entre as 24 horas e o dia 8 após a inoculação houve uma variação considerável na [LA] no líquido sinovial (2,3 a 22,9 mmol/L). A [LA] no líquido sinovial pode ser então um bom auxiliar no diagnóstico de artrites sépticas numa fase aguda (Tennent-Brown, 2012).
1.2.6. Concentração de lactato no líquido cefalorraquidiano
O aumento da [LA] no líquido cefalorraquidiano foi verificado em cavalos com abcessos cerebrais, Eastern Equine Encephalomyelitis e após traumatismo craneoencefálico. Em cavalos com abcessos cerebrais, este parece ser o único parâmetro alterado no líquido cefalorraquidiano (Tennent-Brown, 2012).
1.3. Utilidade da concentração de lactato no prognóstico
Como Tennent-Brown (2012) refere, existem vários estudos que demonstram a correlação entre a concentração do lactato sanguíneo do doente à chegada ao hospital e o seu prognóstico quer em medicina humana quer em medicina veterinária. Contudo, a
11 concentração do lactato quando o doente é admitido no hospital nem sempre se correlaciona com um bom prognóstico, e existe muitas vezes sobreposição dos resultados nos doentes que sobreviveram e nos doentes que não sobreviveram. Isto deve-se ao facto desta correlação estar bastante dependente da doença em causa (Tennent-Brown, 2012).
Desta forma, a concentração sanguínea de lactato passou a ser mensurada em série desde a admissão do doente, com o objetivo de determinar a taxa a que a [LA] volta aos valores basais. Em medicina humana, este método aparenta ser mais fiável na tentativa de estabelecer um prognóstico do que uma mensuração única. Uma hiperlactatemia persistente, independentemente da terapêutica utilizada, está associada a menor taxa de sobrevivência e maior incidência de falha multiorgânica em pacientes humanos. Desta forma, uma mensuração seriada da concentração do lactato sanguíneo em medicina equina pode ser uma mais valia quando se tenta estabelecer o prognóstico para o animal (Tennent-Brown, 2012).
1.4. Utilidade do lactato na medicina desportiva
O stresse físico e fisiológico experienciados pelo cavalo durante o seu desempenho atlético desportivo são, de tal forma grandes, que a hipótese de se lesionar aumenta bastante num animal que é treinado de forma inapropriada. Uma das doutrinas básicas da fisiologia do exercício é a especificidade do treino, isto é, cada atleta deve ter o treino adaptado aos seus padrões fisiológicos e à modalidade que pratica. O conceito de treino físico para um atleta em particular deve refletir as exigências da atividade não só em intensidade e duração, mas também no modo de trabalho. A [LA] sanguíneo antes e após o exercício e a taxa a que esta desce para valores basais permitem-nos avaliar o tipo de esforço físico realizado pelo animal e o desempenho físico do animal quando associada a outros parâmetros fisiológicos (Sexton et
al., 1987).
Sabendo que o lactato é produzido em condições de reduzida perfusão tecidular através do metabolismo anaeróbio dos hidratos de carbono e que durante o exercício intenso o tecido muscular está sujeito a determinada hipoxia, é espectável que os valores basais de lactato sanguíneo aumentem (Campbell, 2011).
Existem vários programas/testes que permitem avaliar o desempenho físico em cavalos tendo em conta as concentrações de lactato sanguíneas. A maioria destes testes baseia-se na obtenção de um gráfico em que as concentrações de lactato são mensuradas
12 antes, durante e após o exercício. Com estes valores é possível obter uma curva representada pela [LA] e o tempo em que foi obtida (Campbell, 2011).
Como antes referido, a [LA] basal num cavalo em repouso deve ser inferior a 1,5 mmol/L (Tennent-Brown, 2011). Diferentes autores defendem diferentes valores, mas a opinião mais aceite e na qual se baseia a caracterização do tipo de esforço realizado pelo cavalo é a seguinte (Campbell, 2011):
[LA] = 2 mmol/L para o limiar superior de esforço aeróbio;
[LA] entre 2 e 4 mmol/L para a zona de transição entre esforço aeróbio e anaeróbio;
[LA] = 4 mmol/L para o limiar inferior de esforço anaeróbio.
Estes valores permitem identificar a intensidade de esforço realizado pelo animal, considerando que quanto maior o esforço realizado maior será a produção de lactato, e o momento do treino em que foi atingida determinada intensidade. Isto permite verificar a resposta metabólica do animal a diferentes intensidades de treino e ajustar o plano de treino consoante os resultados desejados (Campbell, 2011).
1.5. Mensuração da concentração de lactato
Em hospitais de referência, os aparelhos de bancada para medir o lactato são utilizados por rotina. Em clínica de ambulatório, a medição da [LA] sanguíneo tornou-se recentemente disponível com a introdução dos aparelhos de medição de lactato portáteis utilizados em medicina humana (Tennent-Brown, 2012). A precisão e confiança destes aparelhos foi testada em medicina equina, incluindo situações de emergência em cavalos admitidos nos hospitais e cavalos em esforço físico (Evans et al., 1996; Tennent‐Brown et al., 2010). A comparação dos resultados obtidos no sangue total e no plasma não teve uma correlação positiva. Ainda assim, a [LA] quando medida em sangue total parece ser suficiente para se traçar uma curva de concentrações ao longo do tempo (Tennent‐Brown et al., 2010). O Accusport e Accutrend da Roche®, o Lactate Pro da Arkray® ou o Lactate Plus da NOVA Biomedical® são alguns dos aparelhos portáteis frequentemente utilizados para a medir o lactato sanguíneo em cavalos (Kobayashi, 2007; Allen et al., 2008; Tennent-Brown, 2012).
Para a medição da [LA] no momento da colheita do sangue, os aparelhos portáteis são bastante úteis na medida em que necessitam apenas de uma pequena gota de sangue (Kobayashi, 2007).
13 Para a medição do lactato algum tempo após a colheita, o sangue deve ser conservado em tubos com anticoagulante ou tubos secos, para que posteriormente possam ser centrifugados e se obter plasma ou soro, respetivamente. Para obtenção de plasma podem ser utilizados tubos de colheita com heparina (HEP), ácido etilenodiamino tetra-acético (EDTA) ou fluoreto de sódio/oxalato de potássio (NaF/Ox), sendo este último o anticoagulante preferencialmente utilizado devido à sua atividade antiglicolítica (Astles et al., 1994; Gambino et al., 2009; Tennent-Brown, 2011).
Quando utilizados tubos de heparina ou EDTA as amostras devem ser analisadas nos primeiros cinco a dez minutos após a colheita ou o mais rapidamente centrifugadas e o plasma separado da fração celular. Isto deve-se ao facto da fração celular do sangue continuar a metabolizar a glicose presente no sangue e, consequentemente, haver produção de lactato após a colheita, o que leva a um aumento não real da [LA] (Ferrante et al., 1994; Tennent-Brown, 2011). Para medição do lactato no soro, os tubos devem ser mantidos à temperatura ambiente durante 15 a 30 minutos para permitir a formação do coágulo (O'Neill, 2000). Devem ser centrifugados para haver completa separação do soro e restantes constituintes sanguíneos e então medida a [LA] no soro.
Na incapacidade de analisar as amostras imediatamente após a colheita, o sangue deve ser armazenado em tubos com fluoreto de sódio e oxalato de potássio e refrigerado a temperaturas entre os 0 e os 4ºC. A combinação do fluoreto de sódio e do oxalato de potássio inibe grande parte das enzimas que catalisam a glicólise reduzindo portanto, a produção de lactato pelos eritrócitos após a colheita. No entanto, segundo um estudo realizado por Ferrante e Kronfeld (1994) a utilização de fluoreto de sódio pode alterar alguns parâmetros sanguíneos como o hematócrito e a concentração plasmática de glicose (Ferrante e Krinfeld, 1994; Tennent-Brown, 2011).
1.5.1. Metodologia para determinar a concentração de lactato
Na prática clínica, a determinação da [LA] pode ser feita através de dois métodos: colorimetria enzimática e amperimetria enzimática (Allen et al., 2008).
O aparelho Accutrend Plus da Roche®, um medidor portátil de lactato, determina a [LA] no sangue ou no plasma através do método de colorimetria enzimática. Para isso, o aparelho permite-nos selecionar qual o tipo de amostra a utilizar: sangue total ou plasma. O
14 intervalo de valores para o qual este aparelho é sensível em humanos é: 0,8-22mmol/L quando medido em sangue total e 0,7-26mmol/L quando medido no plasma. Para o efeito são utilizadas tiras BM-Lactate®, desenhadas com uma série de camadas que permitem a separação dos eritrócitos do plasma e assim a determinação da [LA] no plasma (Figura 2) (Gambke et al., 1997).
Figura 2 Ilustração de uma tira BM-Lactate (Adaptado de Gambke et al., 1997)
A primeira camada, uma rede amarela, representa o local onde o sangue/plasma é colocado. A segunda camada, de fibra de vidro, é responsável pela separação dos eritrócitos do plasma, em que os eritrócitos ficam aprisionados permitindo que o plasma passe para a seguinte camada. A terceira camada é onde ocorre a reação propriamente dita: o L-lactato é oxidado em piruvato pela enzima lactato oxidase (LOD). O mediador cloreto de amónio bis-(2-hidroxietil)-4-hidroxiiminociclohexa-2,5-dienilideno transfere os eletrões libertados pela oxidação do lactato para o ácido fosfomolíbdico. Ao receber os eletrões do mediador, o ácido fosfomolídbico é reduzido em azul de molibdeno que por fotometria de reflectância com radiações na gama dos 660 nm permite determinar a sua concentração em apenas 60 segundos. A concentração de azul molibdeno é proporcional à [LA] presente na amostra. As seguintes equações esquematizam a respetiva reação (Gambke et al., 1997):
Lactato + Mediador Piruvato + Mediadorreduzido
LOD
15 Outros medidores portáteis, como é o caso do iSTAT da Abbott®, do Lactate Pro® e do Lactate Scout®, determinam a [LA] por amperimetria enzimática (Karapinar et al., 2013). Neste método, a [LA] é determinada com base na quantidade de peróxido de hidrogénio (H2O2) produzido na oxidação do L-lactato pela enzima LOD presente na membrana. Através
da aplicação de um potencial elétrico o H2O2 é oxidado produzindo uma corrente de eletrões
num elétrodo de platina que é medida e é proporcional à [LA] da amostra. As seguintes equações esquematizam a respetiva reação (Allen et al., 2008):
Lactato + O2 => Piruvato+ H2O2 LOD
H2O2 => 2H+ + O2 + 2e Elétrodo de platina
Em situação hospitalar, podem ser utilizados aparelhos de bioquímica húmida e bioquímica seca de bancada. Estes, além de permitirem avaliar uma grande quantidade de parâmetros sanguíneos, permitem obter valores mais precisos. É o caso do aparelho RX
Daytona da Randox®, que através do método de colorimetria enzimática permite determinar a
[LA] no plasma. : o L-lactato é oxidado em piruvato e H2O2 pela enzima lactato oxidase
(LOD). O reagente 4-aminoantipirina e o mediador N-etil-N-(2 hidroxi-3-sufopropil)-m-toluidina na presença do H2O2 e da enzima peroxidase formam um composto de coloração
roxa que por fotometria de reflectância permite determinar a sua concentração. Esta é diretamente proporcional à [LA] presente na amostra. As seguintes reações esquematizam a respetiva reação:
Lactato + O2 Piruvato + H2O2
LOD
H2O2 + Mediador + 4-aminoantipirina Composto de coloração roxa + H2O
Peroxidase
No panfleto informativo fornecido pela Randox®, juntamente com os reagentes necessários para medir a [LA] no aparelho RX Daytona, a empresa refere que as medições devem ser realizadas apenas em amostras de plasma ou líquido cefalorraquidiano, não fazendo referência à utilização do soro. O plasma deve ser obtido de tubos contendo os anticoagulantes: heparina lítio-iodoacetato, EDTA-fluoreto, fluoreto-oxalato ou fluoreto de sódio.
16 No mesmo panfleto informativo, referem que o sangue deve ser colhido de uma veia sem ser feito garrote e a amostra mantida em gelo até ser processada. O plasma deve ser separado por centrifugação não mais que 30 minutos após a colheita de maneira a evitar um aumento não real [LA]. Depois de centrifugada, a [LA] da amostra deve ser imediatamente medida.
1.5.2. Efeito da conservação e armazenamento da amostra na concentração de lactato
O principal objetivo da análise bioquímica laboratorial é fornecer uma informação correta e precisa que permita auxiliar no diagnóstico e tratamento do doente. Os anticoagulantes são aditivos que impedem que o sangue ou plasma coagulem, assegurando assim que a concentração da substância a ser medida se altere o mínimo possível até ser analisada. A inibição da coagulação da amostra é conseguida através da ligação dos aditivos com o cálcio, por exemplo o EDTA, ou através da inibição da trombina, que é o caso da heparina.
O soro é a amostra ideal quando se pretendem realizar análises bioquímicas laboratoriais, mas o plasma, quando obtido com o anticoagulante apropriado, pode ter o mesmo valor e em certas condições ser preferido relativamente ao soro.
Para obter o soro é necessário um perído de espera de 15 a 30 minutos para que haja completa coagulação do sangue antes de ser feita a centrifugação da amostra. Este facto faz com que o plasma seja preferido em situações de emergência. Além disso, para um mesmo volume de sangue total, o volume de plasma obtido é sempre maior que o de soro (Mohri, M.
et al. 2007).
Num estudo realizado por Morris et al. em 2002, os autores avaliaram os efeitos do manuseamento, processamento e armazenamento, na medição de alguns parâmetros bioquímicos em sangue de ovinos. Um desses parâmetros foi o lactato sanguíneo. Os autores verificaram que a [LA] no soro é estatisticamente superior à do plasma obtido dos tubos com os anticoagulantes HEP, EDTA e NaF/Ox. Avaliaram também o efeito do congelamento/descongelamento repetido em amostras de plasma com o anticoagulante NaF/Ox verificando que a [LA] foi estatisticamente superior quando a amostra sofreu o processo congelar/descongelar duas vezes. Estudaram ainda o efeito do período de armazenamento de amostras não centrifugadas, em tubos de NaF/Ox e tubos sem
17 anticoagulante, na [LA] quando as amostras eram mantidas a uma temperatura de 4ºC durante 0, 1, 3 ou 7 dias e verificaram que a [LA] no soro foi, em média, superior em 101% quando comparada com a [LA] no plasma (NaF/Ox). Também foi possível identificar um aumento da [LA] com o aumento do período de armazenamento.
Muitos outros estudos foram realizados no que diz respeito à estabilidade do lactato após a colheita, e os resultados obtidos indicam que a [LA] varia bastante consoante o método utilizado para armazenar e conservar a amostra. Desta forma é de extrema importância ter em conta quais as variáveis que afetam a [LA] após a colheita da amostra para que os resultados possam ser interpretados de forma correta.
18
2. Objetivos
Com a realização deste trabalho foi pretendido comparar duas metodologias de determinação de lactato e avaliar a estabilidade do lactato sanguíneo de cavalos em diversas condições de conservação. Assim, os objetivos deste trabalho são:
Comparar os valores de lactato no soro e plasma quando medidos com o aparelho portátil Accutrend Plus da Roche® e com o aparelho de bancada RX Daytona da
Randox®;
Comparar a concentração de lactato sanguíneo entre amostras de soro e amostras de plasma obtidas de tubos com os anticoagulantes NaF/Ox, heparina e EDTA;
Avaliar o efeito da temperatura e tempo de armazenamento na [LA] no soro e plasma 24h após colheita das amostras;
Avaliar o efeito da separação da fração celular da fração sérica ou plasmática em amostras de sangue total 24 horas depois de serem colhidas.
19
3. Materiais e métodos
3.1. Caracterização da amostra 3.1.1. Animais
Para este estudo foi utilizado sangue de animais considerados saudáveis com base nos dados obtidos na anamnese e no exame físico realizados imediatamente antes da recolha de sangue. Todos os cavalos estavam vacinados contra as principais doenças infeciosas: tétano e influenza, e desparasitados internamente há menos de 6 meses. De maneira a aumentar a [LA] sanguíneo as amostras foram colhidas após uma sessão de treino mais intenso de aproximadamente 30 minutos. Os cavalos foram passados à guia no picadeiro da Universidade de Trás-os-Montes e Alto Douro. A intensidade de treino para cada animal variou consoante a sua preparação físíca, idade e problemas locomotores. De uma maneira geral, os animais tiveram um aquecimento de aproximadamente 10 minutos em que foram trabalhados para duas mãos a passo e trote, seguido de uma intensificação do ritmo de trabalho para trote e galope também para as duas mãos.
Foram utilizados 11 animais: 5 machos e 6 fêmeas, com idades compreendidas entre os 6 e os 22 anos. Dos 11 animais, 8 eram de raça Puro Sangue Lusitano, 1 Puro Sangue Árabe, 1 Trotador Francês e 1 cruzado Lusitano. Quanto à aptidão, 7 eram utilizados para reprodução, 1 para corridas de passo travado, 1 para hipoterapia e 2 mantidos em boxe por problemas locomotores. Todas as amostras foram recolhidas no Hospital Veterinário da Universidade de Trás-os-Montes e Alto Douro e analisadas no Laboratório de Patologia Clínica do mesmo Hospital.
3.2. Recolha das amostras de sangue
Após a sessão de treino, as recolhas de sangue foram realizadas na boxe de cada animal. Foram recolhidos 20 a 30 mililitro de sangue a cada animal. O sangue foi obtido por punção jugular, utilizando agulhas de 20G de uma polegada Sterican® da B.Braun® e seringas descartáveis esterilizadas de 20mL da B.Braun®.
Imediatamente após a colheita foi utilizada uma gota de sangue para ver qual a [LA] no sangue total com o aparelho Accutrend Plus.
20 O sangue, depois de colhido foi distribuído em tubos com ácido etilenodiamino tetra-acético (EDTA), heparina sódica (HEP), fluoreto de sódio/oxalato de potássio (NaF/Ox) e outro sem anticoagulante. Os tubos, devidamente identificados, foram colocados num recipiente refrigerado com acumuladores de frio até serem centrifugados. As amostras de sangue foram centrifugadas num espaço de 30 minutos após a recolha.
De forma a aumentar o número de amostras, o sangue foi colhido dos diversos animais, tendo em alguns casos sido feita mais que uma colheita. O número máximo de colheitas feitas num animal foram 6, tendo noutros 3 animais sido feitas 5, 4 e 2 colheitas, respectivamente. Nos restantes animais foram realizadas apenas 1 colheita. Nos animais em que foram feitas mais do que uma colheita, houve pelo menos uma semana de intervalo a separá-las.
3.3. Medição do lactato
Os tubos de EDTA e heparina foram centrifugados durante 10 minutos a 6000 rpm. Os tubos de fluoreto de sódio/oxalato de potássio e os tubos sem anticoagulante foram centrifugados durante 15 minutos a 3000 rpm.
O plasma obtido da centrifugação dos diferentes tubos foi pipetado em aliquotas de 1,5mL devidamente identificadas. Para cada anticoagulante, o plasma foi dividido em 4 aliquotas. O soro foi também separado em 4 aliquotas. As amostras hemolisadas foram excluídas do estudo.
De maneira a simplificar a metodologia do trabalho para cumprir os objetivos propostos, estes foram agrupados em 4 estudos. Alguns dados foram utilizados para mais do que um estudo.
3.3.1. Estudo 1: comparação dos valores da concentração de lactato obtidos no
Accutrend Plus e no RX Daytona para o soro e plasmas obtidos dos diferentes
anticoagulantes
No estudo 1 foram colhidas 13 amostras que foram centrifugadas como em cima descrito.
Uma das aliquotas de cada anticoagulante foi utilizada para medir a [LA] com o aparelho RX Daytona da Randox® e com o aparelho portátil Accutrend Plus da Roche®. Esta
21 medição foi considerada a [LA] ao tempo 0 horas para cada um dos anticoagulantes. Uma aliquota contendo soro foi utilizada para medir a [LA] no tempo 0 horas com o aparelho RX
Daytona e com o medidor portátil Accutrend Plus.
3.3.2 Estudo 2: comparação dos valores da concentração de lactato entre o soro e os plasmas obtidos dos diferentes anticoagulantes utilizando o RX Daytona
Para este estudo utilizou-se a mesma metodologia que foi utilizada no estudo 1, tendo sido incluído mais um animal, no qual foram feitas medições apenas com o aparelho RX Daytona.
3.3.3. Estudo 3: efeito da temperatura e tempo de armazenamento na concentração de lactato 24h após colheita das amostras utilizando o RX Daytona
No estudo 3 foram colhidas 13 amostras que foram centrifugadas como em cima descrito. Para estudar o efeito da temperatura de armazenamento na [LA] ao fim de 24 horas, as aliquotas foram colocadas em diferentes temperaturas durante 24 horas:
Temperatura ambiente (aproximadamente 20ºC);
Refrigerado (aproximadamente 4ºC);
Congelado (aproximadamente -18ºC).
Antes de ser medida a [LA] após o período de espera de 24 horas, todas as aliquotas foram agitadas num agitador de tipo vórtex.
Os resultados verificados após as 24 horas de armazenamento foram comparados com os resultados da [LA] no soro e plasmas obtidos ao tempo zero com o RX Daytona no estudo 1. Também foram comparados entre si de forma a estudar o efeito da temperatura de armazenamento na [LA] plasmático ao fim de 24 horas.
3.3.4. Estudo 4: efeito da separação da fração celular da fração sérica ou plasmática na concentração de lactato utilizando o RX Daytona
Foi colhido em duplicado, sangue de 10 animais em repouso, e colocado em tubos de EDTA, heparina, fluoreto de sódio/oxalato de potássio e sem anticoagulante. A [LA] ao tempo zero foi medida após centrifugação das amostras como em cima referido. Para este estudo, a [LA] foi mensurada utilizando apenas o aparelho RX Daytona.
22 Os duplicados de cada tubo foram armazenados a uma temperatura de aproximadamente 4ºC durante 24 horas. Após este período os tubos foram centrifugados como em cima descrito e mensurada a [LA] utilizando o aparelho RX Daytona. Para cada tubo os resultados foram comparados entre o tempo 0 e as 24 horas.
3.4. Análise estatística
Para proceder à análise estatística utilizou-se o programa IBM SPSS® Statistics versão 20. Com este programa aplicou-se o Teste T, Teste de T para comparação de grupos emparelhados, e ANOVA. Os graus de significância considerados foram: estatisticamente significativo para p<0,05, e estatisticamente muito significativo para p<0,01 e p<0,001.
23
4. Resultados
Com o aparelho RX Daytona obtivemos valores para a [LA] em mg/dL, pelo que, este valor foi multiplicado pelo fator de conversão: 0,111, para que os valores pudessem ser apresentados em unidades do Sistema Internacional: mmol/L.
4.1. Estudo 1: comparação dos valores da concentração de lactato obtidos no Accutrend
Plus e no RX Daytona para o soro e plasmas obtidos dos diferentes anticoagulantes Neste estudo partimos de uma amostragem de 13 amostras, nos quais os resultados obtidos com o Accutrend Plus podem ser observados na tabela 2. Devido à incapacidade de calibrarmos e obtermos controlos dentro de valores desejados com RX Daytona no dia em que algumas das amostras foram colhidas, o número de amostras analisadas com este aparelho foi de apenas 7 amostras (tabela 3).
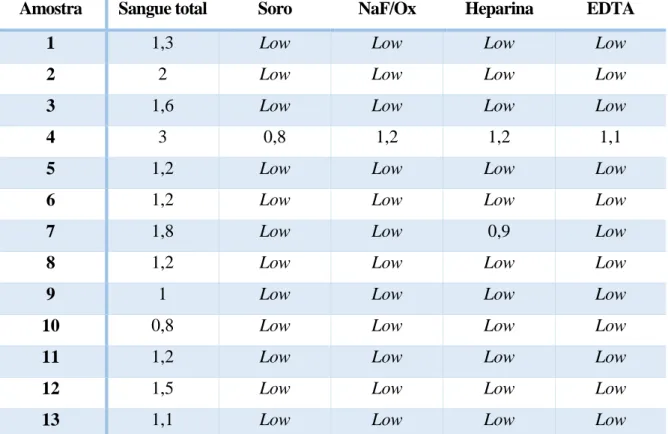
Na tabela 2 podem ser observados os valores da [LA] no sangue total logo após o exercício, e no soro ou plasma, obtidos após a centrifugação dos tubos, com o aparelho portátil
Accutrend Plus. Este aparelho tem um limiar inferior de deteção de 0,7 mmol/L no plasma pelo
que quando a [LA] não atinge este valor, no aparelho é visível a indicação: “Low”.
Tabela 2 Concentrações de lactato em mmol/L obtidas utilizando o aparelho Accutrend Plus em 13 amostras de soro e plasma obtido com os diferentes anticoagulantes
NaF/Ox: Fluoreto de Sódio/Oxalato de Potássio; EDTA: Ácido etilenodiamino tetra-acético; Low: <0,7mmol/L
Amostra Sangue total Soro NaF/Ox Heparina EDTA
1 1,3 Low Low Low Low
2 2 Low Low Low Low
3 1,6 Low Low Low Low
4 3 0,8 1,2 1,2 1,1
5 1,2 Low Low Low Low
6 1,2 Low Low Low Low
7 1,8 Low Low 0,9 Low
8 1,2 Low Low Low Low
9 1 Low Low Low Low
10 0,8 Low Low Low Low
11 1,2 Low Low Low Low
12 1,5 Low Low Low Low
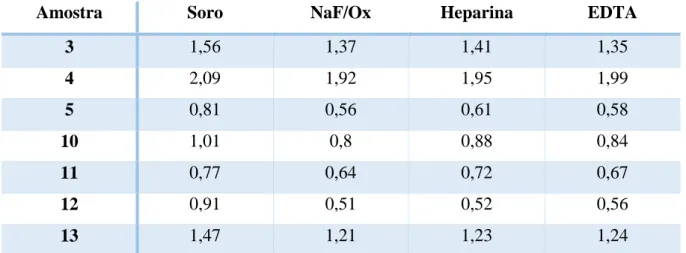
24 Na tabela 3 são visíveis os valores da [LA] obtidos com o aparelho RX Daytona para o soro e para o plasma obtido com os diferentes anticoagulantes.
Tabela 3 Concentrações de lactato em mmol/L obtidas com o aparelho RX Daytona em 7 amostras de soro e plasma obtido com os diferentes anticoagulantes
Amostra Soro NaF/Ox Heparina EDTA
3 1,56 1,37 1,41 1,35 4 2,09 1,92 1,95 1,99 5 0,81 0,56 0,61 0,58 10 1,01 0,8 0,88 0,84 11 0,77 0,64 0,72 0,67 12 0,91 0,51 0,52 0,56 13 1,47 1,21 1,23 1,24
NaF/Ox: Fluoreto de Sódio/Oxalato de Potássio; EDTA: Ácido Etilenodiamino tetra-acético
Não foi feita qualquer análise estatística comparando os valores obtidos entre o aparelho
RX Daytona e o Accutrend Plus pelo facto de não terem sido obtidos valores de concentrações
de lactato precisas para a maioria das amostras quando utilizado o Accutrend Plus.
4.2 Estudo 2: comparação dos valores da concentração de lactato entre o soro e plasmas obtidos dos diferentes anticoagulantes utilizando o RX Daytona
Na tabela 4 podem ser observadas a média, o desvio padrão e o erro padrão da média em mmol/L da [LA] ao tempo 0 horas para o soro e para o plasma obtido com os diferentes anticoagulantes. Para este estudo foram utilizadas amostras de 8 animais, 7 utilizadas no estudo anterior e mais uma que foi obtida posteriormente de maneira a aumentar a amostragem.
Tabela 4 Média, desvio padrão e erro padrão da média em mmol/L da concentração de lactato ao tempo 0 horas para o soro e plasma obtido com os diferentes anticoagulantes
Amostra N Média Desvio Padrão Erro Padrão da Média
Soro 8 1,22 0,46 0,16
NaF/Ox 8 1,00 0,48 0,17
Heparina 8 1,04 0,48 0,17
EDTA 8 1,03 0,49 0,17
N: tamanho da amostra; NaF/Ox: Fluoreto de Sódio/Oxalato de Potássio; EDTA: Ácido Etilenodiamino tetra-acético
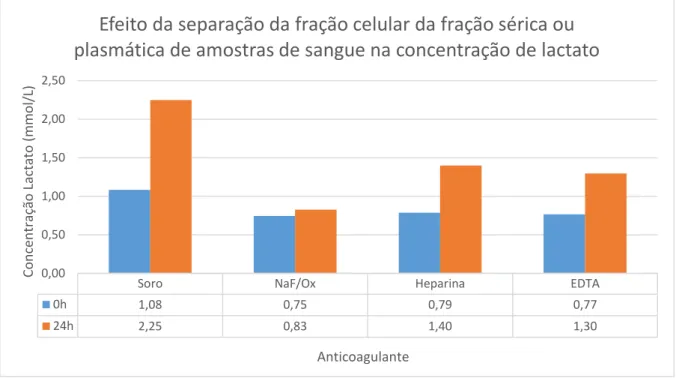
No gráfico 1 pode observar-se a representação gráfica das médias da [LA] no tempo 0 horas para o soro e para o plasma obtido com os diferentes anticoagulantes.
25
Gráfico 1 Representação gráfica das médias da concentração de [LA] em mmol/L ao tempo 0 horas para o soro e plasmas obtidos com os diferentes anticoagulantes
LA: lactato; NaF/Ox: Fluoreto de Sódio/Oxalato de Potássio; EDTA: Ácido Etilenodiamino tetra-acético
Neste estudo a hipótese nula (H0) era de que não existem diferenças estatisticamente
significativas para a [LA] ao tempo 0 horas entre o soro e plasma obtido com os diferentes anticoagulantes. A hipótese alternativa (Ha) era de que existem diferenças estatisticamente
significativas.
Utilizando a ferramenta de análise estatística ANOVA de fator único obtivemos um valor de significância estatística para a variância entre a média do soro e do plasma obtido com os diferentes anticoagulantes de 0,799, o que indica que não existem diferenças estatisticamente significativas, embora seja evidente que a [LA] média é mais elevada no soro comparativamente ao plasma.
4.3 Estudo 3: efeito da temperatura e tempo de armazenamento na concentração de lactato 24h após colheita das amostras utilizando o RX Daytona
Neste estudo, partimos de 13 amostras, no entanto, só foi possível medir a [LA] nos soros/plasmas de 5 animais devido à incapacidade de calibrarmos e controlarmos devidamente o RX Daytona no dia em que algumas das amostras foram colhidas. Além disso,
Soro NaF/Ox Heparina EDTA
Concentração LA 1,22 1 1,04 1,03 0 0,2 0,4 0,6 0,8 1 1,2 1,4 C o n ce n tr aç ão ( m m o l/L )


![Gráfico 1 Representação gráfica das médias da concentração de [LA] em mmol/L ao tempo 0 horas para o soro e plasmas obtidos com os diferentes anticoagulantes](https://thumb-eu.123doks.com/thumbv2/123dok_br/15818160.1081375/37.892.109.789.178.614/gráfico-representação-gráfica-médias-concentração-plasmas-diferentes-anticoagulantes.webp)


![Tabela 7 Teste t para amostras emparelhadas para comparar as médias da [LA] ao tempo 0horas e 24horas para o soro e plasma obtido com os diferentes anticoagulantes](https://thumb-eu.123doks.com/thumbv2/123dok_br/15818160.1081375/41.892.101.735.175.359/tabela-teste-amostras-emparelhadas-comparar-médias-diferentes-anticoagulantes.webp)