ESCOLA DE FARMÁCIA
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS - CIPHARMA
ISOLAMENTO BIOMONITORADO DE ATIVOS TÓXICOS DAS FOLHAS DE
Annona
crassiflora
Mart. E EFICÁCIA ANTIMALÁRICA DO ALCALOIDE
NORESTEFALAGINA EM NANOEMULSÕES
Bruno César de Albuquerque Ugoline
Bruno César de Albuquerque Ugoline
ISOLAMENTO BIOMONITORADO DE ATIVOS TÓXICOS DAS FOLHAS DE
Annona crassiflora Mart. E EFICÁCIA ANTIMALÁRICA DO ALCALOIDE
NORESTEFALAGINA EM NANOEMULSÕES
Dissertação apresentada ao Programa de Ciências
Farmacêuticas da Escola de Farmácia da
Universidade Federal de Ouro Preto, como requisito
parcial para obtenção do grau de Mestre em
Ciências Farmacêuticas.
Orientadora: Prof
aDr
aVanessa Carla Furtado
Mosqueira
Co-Orientadora: Prof
aDr
aLúcia Pinheiro Santos
Pimenta
Universidade Federal de Ouro Preto
Ouro Preto
Catalogação: sisbin@sisbin.ufop.br
U27i Ugoline, Bruno César de Albuquerque.Isolamento biomonitorado de ativos tóxicos das folhas de Annona crassiflora
Mart. e eficácia antimalárica do alcaloide norestefalagina em nanoemulsões
[manuscrito] / Bruno César de Albuquerque Ugoline – 2012.
v, 104 f.: il. color.; grafs., tabs.
Orientadora: Profª Drª Vanessa Carla Furtado Mosqueira.
Co-orientadora: Profª Drª Lúcia Pinheiro Santos Pimenta.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Escola de
Farmácia. Programa de Pós-Graduação em Ciências Farmacêuticas.
(...) E quando sentir que sua esperança se foi,
olhe dentro de si e seja forte.
E finalmente verá que na verdade
À Deus, Senhor de todas as coisas e ideias. Obrigado por me fazer crer quando
achei que não fosse capaz.
Aos meus Pais, Cida e Cláudio, pelos exemplos, pela sabedoria, pela confiança
nas minhas escolhas.
À minha orientadora Vanessa Carla Furtado Mosqueira, pela oportunidade e
ensinamentos imensuráveis que farão parte da minha história.
À minha co-orientadora Lúcia Pinheiro Santos Pimenta, que mesmo distante, se fez
presente.
Aos professores e grandes colaboradores, Dênia Saúde Guimarães, Carmem
Paula e Neila Barcellos.
Aos amigos do LDGNano Liliam Teixeira, Raquel Castanheira, Giani Garcia,
Alessandra Vidal e Carina pelos ensinamentos práticos e acadêmicos, pelos momentos
descontraídos que tanto fazeram a diferença.
À Gisele Lage do CerquiBio, pela ajuda em muitos experimentos e pela paciência.
Aos funcionários do Cipharma, Mirela e Leonardo, parabéns pelo profissionalismo.
Aos alunos de Iniciação Científica que me acompanharam e também possuem
mérito neste trabalho: Felipe Medeiros, Werônica Lima, Larissa Cotrin, Vanessa Braga e
Rubens Andrade.
Aos amigos da turma GEDUC – Pitágoras, pelas experiências compartilhadas e
pela preocupação de todos com meus resultados.
Aos meus grandes amigos Raphael Hoelzle, Sandra Ambrósio, Éder Siqueira,
Conceição Oliveira, Vânia Lúcia, Marina Pyramo, Leley Silva, Fernanda, Wesley, Welison
e Luiz Fernando pelo companheirismo e lealdade.
A todos meus familiares, que tem em mim um exemplo de batalha: Tios Sérgio,
Regiane, Zezé e Fátima. Às minhas grandes primas irmãs: Tatiane, Jéssica e Poliana
Ugoline. Obrigado por tantos incentivos minha família.
Ao Luciano Ramalho, companheiro de todos os momentos e cúmplice dos meus
fracassos e sucessos. Obrigado por me incentivar a ser melhor a cada dia.
Enfim, agradeço a todos que contribuíram com sua torcida e confiaram em mim.
À Universidade Federal de Ouro Preto e Universidade Federal de Minas Gerais, ao
CNPq, FAPEMIG e CAPES pelo apoio financeiro.
SUMÁRIO
ABSTRACT ... iii
LISTA DE FIGURAS ... ...iv
LISTA DE TABELAS... ...v
1 INTRODUÇÃO GERAL ... 1
2 REVISÃO DE LITERATURA ... 3
2.1 A família Annonaceae e seus principais metabólitos secundários ... 3
2.1.1 A família Annonaceae ... 3
2.2 A espécie Annona crassilfora Mart. - Taxonomia ... 3
2.2.1 Classificação botânica ... 3
2.2.2 Descrição botânica e aspectos econômicos ... 3
2.3 Fitoquímica da família Annonaceae ... 4
2.3.1 Polifenóis ... 6
2.3.2 Terpenos ... 7
2.3.3 Acetogeninas isoladas na família Annonaceae ... 8
2.3.4 Alcalóides ... 8
2.4 A malária e os desafios da terapêutica ... 10
2.4.1 A malária no mundo e no Brasil ... 10
2.4.2 Ciclo da doença e principais sintomas...11
2.4.3 Terapêutica antimalárica ... 12
2.4.4 Desafios e estudos de novos fármacos ... 13
2.4.5 Fármacos antimaláricos derivados de plantas ... 14
2.5 Nanotecnologia farmacêutica aplicada à terapêutica antimalárica ... 17
2.5.1 Nanotecnologia farmacêutica e sistemas vetorizados ... 17
2.5.2 Nanopartículas poliméricas...18
2.5.3 Nanoemulsões ... 18
2.5.4 Caracterização físico-química de sistemas vetorizados...19
2.5.4.1 Tamanho e distribuição...19
2.5.4.2 Potencial Zeta...20
3 OBJETIVOS...21
3.1 Objetivo Geral...21
3.2 Objetivos específicos...21
CAPÍTULO I
Extração e isolamento dos metabólitos secundários de
Annona crassiflora
Mart. . 22
1 MATERIAIS E MÉTODOS ... 22
1.1
Métodos cromatográficos ... 22
1.1.1 Cromatografia em camada delgada de sílica ... 22
1.1.2 Cromatografia líquida sob pressão ... 22
1.1.3 Cromatografia líquida de alta eficiência analítica ... 22
1.1.4 Cromatografia líquida de alta eficiência semi-preparativa ... 22
1.2 Reveladores cromatográficos ... 23
1.3 Métodos físico-químicos e espectrométricos ... 24
1.3.1 Análise do ponto de fusão ... 24
1.3.2 Infra-vermelho ... 24
1.3.3 Ressonância Magnética Nuclear ... 24
1.4 Coleta da A. crassiflora e preparo do material vegetal ... 25
1.4.1 Coleta e identificação botânica da espécie vegetal ... 25
1.4.2 Processamento do material vegetal ... 25
1.4.3 Obtenção do extrato bruto ... 25
1.4.4 Obtenção do perfil cromatográfico impressão digital do extrato etanólico
das folhas por CLAE ... 25
1.5 Obtenção das frações alcalóidicas...25
1.5.1 Marcha química para fracionamento de alcalóides ... 25
1.6 Prospecção química das frações ... 27
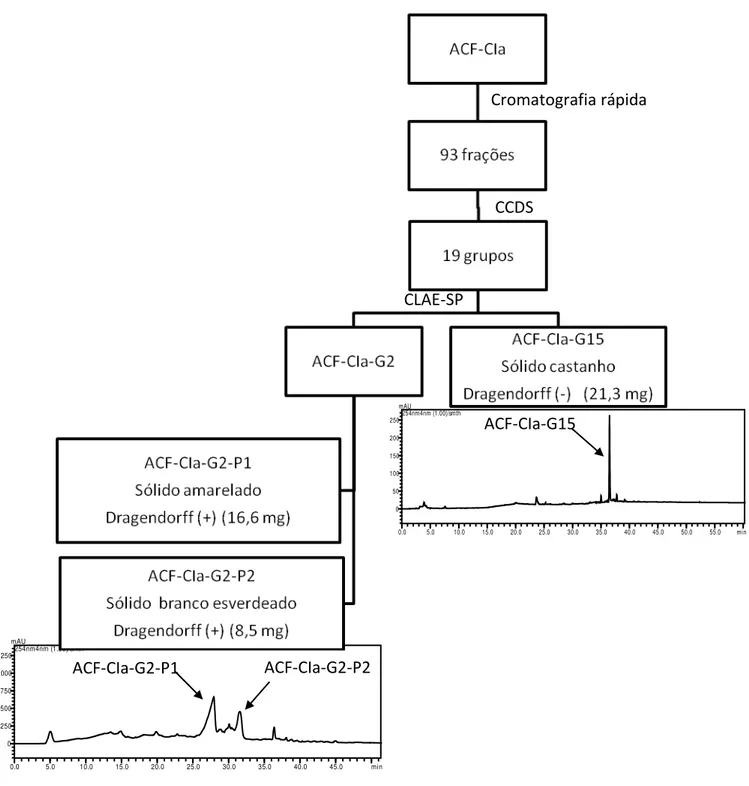
1.7 Purificação e isolamento de compostos da fração ACF-CI ... 29
2 RESULTADOS E DISCUSSÃO...30
2.1 Obtenção do perfil cromatográfico do extrato etanólico...30
2.4 Identificação e elucidação estrutural de CI-G2-P1, CI-G2-P2 E
ACF-CI-G15...50
CAPÍTULO II
Ensaio Biomonitorado de letalidade sobre a
Artemia
salina
...51
1
INTRODUÇÃO ... 51
2 MATERIAIS E MÉTODOS ... 51
2.1 Materiais...51
2.2 Eclosão das larvas...51
2.3 Aplicação das amostras...52
2.4 Determinação da dose letal 50% ...52
3 RESULTADOS E DISCUSSÃO...53
CAPÍTULO III
Desenvolvimento e validação de metodologia analítica para doseamento da
norestefalagina (NOR)...57
1 MATERIAIS E MÉTODOS ... 57
1.1 Desenvolvimento e validação de metodologia analítica...57
1.1.1 Materiais...57
1.1.2 Equipamentos ... 57
1.1.3 Metodologia ... 57
1.1.3.1 Condições analíticas...57
1.1.3.2 Parâmetros de validação ... 58
1.1.3.2.1 Linearidade...58
1.1.3.2.2 Precisão ... 58
1.1.3.2.3 Exatidão ... 58
1.1.3.2.4 Especificidade...59
2.1 Especificidade...60
2.2 Linearidade...60
2.3 Precisão...61
2.3.1 Repetibilidade...61
2.3.2 Precisão intermediária...62
2.3 Exatidão...62
2.4 Limites de detecção e de quantificação...63
CAPÍTULO IV
Desenvolvimento e caracterização das nanoemulsões contendo
Norestefalagina...65
1 MATERIAIS E MÉTODOS ... 65
1.1 Materiais ... 65
1.2 Preparo das nanoemulsões ... 65
1.3 Caracterização físico-química das nanoemulsões ... 66
1.3.1 Distribuição de tamanho ... 66
1.3.2 Potencial Zeta ... 66
1.3.3 Determinação do teor da NOR encapsulada...67
1.3.4 Porcentagem e eficiência de encapsulação ... 67
1.3.5 Avaliação da estabilidade das nanoemulsões...69
2 RESULTADOS E DISCUSSÃO ... 69
2.1 Desenvolvimento e preparo das nanoemulsões ... 69
2.2 Caracterização físico-química das nanoemulsões...71
2.2.1 Distribuição de tamanho ... 71
2.2.2 Potencial Zeta...72
2.2.3 Determinação do teor de NOR encapsulada (Eficiência e porcentagem de
encapsulação) ... 74
2.2.4 Avaliação da estabilidade das nanoemulsões...75
V.I Ensaio de atividade hemolítica in vitro da norestefalagina ... 78
1 INTRODUÇÃO ... 78
2 MATERIAIS E MÉTODOS ... 78
2.1 Materiais ... 78
2.2 Metodologia experimental ... 78
3 RESULTADOS E DISCUSSÃO ... 79
V.II Ensaio de atividade antimalárica em modelo murino ... 82
1 INTRODUÇÃO ... 82
2 MATERIAIS E MÉTODOS ... 82
2.1 Materiais ... 82
2.2 Animais ... 82
2.3 Cepas...83
2.4 Metodologia experimental...83
2.5 Monitoramento dos animais...84
3 RESULTADOS E DISCUSSÃO ... 84
DISCUSSÃO GERAL...92
CONCLUSÃO GERAL ... ...95
LISTA DE ABREVIATURAS, SIGLAS E SÍMBOLOS
λ
Comprimento de onda
δ
Deslocamento químico
ζ
Potencial Zeta
µg
Micrograma
µM
Micromolar
µm
Micrômetro
CCDS
Cromatografia em camada delgada de sílica
[(CD
3)
2SO]
Dimetilsulfóxido deuterado
CLAE
Cromatografia líquida de alta eficiência
CLAE-DAD
Cromatografia líquida de alta eficiência com detector de arranjo de diodos
CLAE-SP
Cromatografia líquida de alta eficiência semi-preparativa
COSY
Correlation Spectroscopy
CV
Coeficiente de variação
DAD
Detector com arranjo de diodos
DEPT-135
Distortionless Enhancement by Polarization Tranfer –
ângulo 135°
DL
50Dose mínima letal para 50% dos indivíduos
DP
Desvio padrão
ECF
Espectroscopia de correlação de fótons
HCl
Ácido clorídrico
HMBC
Heteronuclear Multiple Bond Correlation
HSQC
Heteronuclear Single Quantum Coherence
IC
50Concentração inibitória para 50% dos indivíduos
IP
Índice de polidispersão
IV
Infravermelho
J
Constante de acoplamento escalar
Mart.
Martius
NE
Nanoemulsão
NE-NOR
Nanoemulsão contendo norestefalagina
NH
4OH
Hidróxido de amônio
NOESY
Nuclear Overhauser Effect Spectroscopy
NOR
Norestefalagina
PEG
Polietilenoglicol
R
fFator de retenção
RMN de
13C
Ressonância Magnética Nuclear de Carbono 13
RMN de
1H
Ressonância Magnética Nuclear de Hidrogênio
TAS
Teste larvicida sobre
Artemia salina
t
RTempo de retenção
RESUMO
Neste trabalho foi realizado o estudo biomonitorado da toxicidade de frações e
metabólitos secundários isolados das folhas de
Annona crassiflora
Mart., planta
conhecida popularmente como araticum ou marolo. Além disso, foi investigada a atividade
antimalárica dos compostos isolados e veiculados em nanoemulsões. O fracionamento do
extrato etanólico, obtido de suas folhas, foi biomonitorado através do teste de letalidade
sobre as larvas de
Artemia
salina
, para a seleção de frações potenciais para obtenção de
substâncias bioativas. O fracionamento do extrato etanólico bruto foi realizado através de
extração ácida e métodos cromatográficos “
flash
” e CLAE-PDA. As frações obtidas foram
submetidas à prospecção fitoquímica, com reagentes e reveladores para identificação das
classes de metabólitos secundários, que levaram à detecção de alcaloides nas frações
clorofórmicas (ACF-CI e ACF-CII). Foi isolado o alcaloide majoritário norestefalagina
(NOR). Sua identificação foi realizada através de métodos espectrométricos como UV, IV,
RMN de
1H e de
13C, DEPT 135, mapas de contornos COSY, HSQC, HMBC e NOESY.
Foi também desenvolvido e validado um método CLAE-PDA para quantificação da NOR
em nanoemulsões, através da avaliação da linearidade, precisão, exatidão, seletividade e
limites de quantificação e detecção para a metodologia escolhida. Nanoemulsões
contendo NOR (NE-NOR) foram produzidas e apresentaram tamanho e índice de
polidispersão inferiores a 300nm nas concentrações entre 0,1 e 1,0 mg/mL. O potencial
zeta das NE foi determinado, mas não foram observadas diferenças significativas entre as
formulações testadas, estando todas em torno de -50 mV. A eficiência de encapsulação
determinada foi de 22,0; 45,6 e 44,9% nas concentrações de 1,0; 2,0 e 5,0 mg/mL,
respectivamente. As NE-NOR nas concentrações de 0,1 e 0,5 mg/mL apresentaram
estabilidade de nove meses considerando os parâmetros físico-químicos avaliados. Na
determinação da atividade hemolítica da NOR, foi constatado que esta foi inferior a 10%
nas concentrações de 0,5 e 2,0 µg/mL. No ensaio de atividade antimalárica, a NOR em
solução nas doses de 4,0; 8,0 e 20,0 mg/kg por via intraperitoneal reduziu
significativamente (68 a 83%) a parasitemia dos camundongos infectados
pelo
Plasmodium berghei
NK65 no quarto dia de infecção, quando comparada ao grupo
controle não tratado. A redução da parasitemia foi de 80 a 84% para a NOR encapsulada
nas nanoemulsões nas mesmas concentrações. A formulação de NE-NOR (4 mg/kg)
apresentou maior redução da parasitemia ao longo do estudo, revelando seu efeito
inibitório tardio sobre a carga parasitária dos animais.
ABSTRACT
This work reports the bioguided study of the toxicity of fractions and secondary
metabolites isolated from the leaves of
Annona
crassiflora
Mart. popularly known as
“araticum” or “marolo”, as well as the investigation of the antimalarial activity of isolated
substances loaded in nanoemulsions. Fractionation of leave’s ethanolic extract was
bioguided by the test of lethality using brine shrimp metanauplii. Itallows the selection of
potential fractions containing bioactive substances. The crude ethanol extract fractionation
was performed by acid-base extraction using flash chromatography and detected by
HPLC-PDA. Phytochemical screening of the fractions with reagents enables detection of
alkaloids from chloroform fractions (ACF and ACF-CI-CII) and isolation of the major
aporphine alkaloid norstephalagine (NOR). Its identification was performed by
spectrometric methods such as UV, IR,
1H NMR and
13C NMR, DEPT 135, contour maps
COSY, HSQC, HMBC and NOESY. It was developed and validated an HPLC-PDA
methodology for quantification of NOR in nanoemulsions, assessed by linearity, precision,
accuracy, selectivity and limits of quantification and detection determination of the method.
Nanoemulsions containing NOR were developed and presented suitable size distribution
and surface charge (-50mV) between 0,1 e 1,0 mg/mL. Encapsulation efficiency was 22,0;
45,6 e 44,9% for the concentrations of 1.0; 2.0 e 5.0 mg/mL respectively. NE-NOR at 0,1 e
0,5 mg/mL had shown good stability following 9 months in all physicochemical parameters
evaluated. The hemolytic activity of NOR was lower than 10% at concentrations of 0.5 e
2.0 µg/mL. The antimalarial activity of alkaloid in mice infected with
Plasmodium
berghei
NK65 was also performed. In 4
thand 7
thdays pos-infection, the parasitemia of
mice decreased in the range of 70 and 80% for the tested groups, similarly with
chloroquine group (90%). The NOR nanoemulsified treated group showed prolonged effect
of alkaloid on parasitemia reduction, indicating the maintenance of activity when this
substance was associated to nanostructures.
LISTA DE FIGURAS
Figura 1 - A espécie
Annona
crassiflora
Mart...4
Figura 2 - Esquema da extração ácido-base realizada com o extrato hidroalcoólico bruto
(95 g) das folhas de
Annona crassiflora
e obtenção das frações e sólidos...28
Figura 3 – A) Cromatograma do extrato etanólico bruto das folhas de
Annona crassiflora
e
espectros de absorção no UV (254 nm) dos principais constituintes. B) Estrutura química
básica de núcleos oxoaporfínicos e aporfínicos...31
Figura 4 – Cromatograma de ACF-CIa a 254nm...32
Figura 5 –
A) Cromatograma de ACF-CIa-G2 e perfil de absorção no UV a 254 nm de
ACF-CIa-G2-P1 e ACF-CIa-G2-P2 B) Núcleos químicos de alcaloides oxoaporfínicos e
aporfínicos...34
Figura 6 – Perfil cromatográfico e espectro no UV de ACF-CIa-G15 a 254nm...35
Figura 7 –
Esquema do fracionamento da CIa e isolamento dos precipitados
ACF-CIa-G2-P1 E ACF-CIa-G15...36
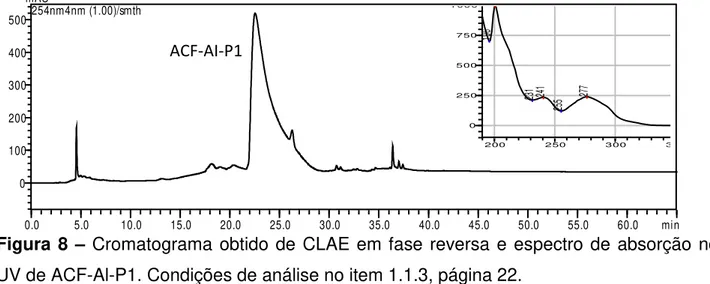
Figura 8 –
Cromatograma obtido de CLAE em fase reversa e espectro de absorção no
UV de ACF-Al-P1...37
Figura 9 - Espectro no IV de ACF-AI-P1...38
Figura 10 – Estrutura química de ACF-AI-P1 norestefalagina (NOR)...39
Figura 11 – Espectro de RMN de
1H de ACF-AI-P1 (400 MHz, DMSO-
d
6)...40
Figura 12 –
Espectro expandido de RMN de
1H de ACF-AI-P1 (400 MHz, DMSO-
d
6)
Expansão da região
de δ 2,4 a 3,8 (400 MHz, DMSO
-
d
6)...41
Figura 14 – Espectro de RMN de
13C e subespectro DEPT 135 de ACF-AI-P1 (100 MHz,
DMSO-
d
6)...43
Figura 15 - Mapa de contornos COSY de ACF-AI-P1 (400 MHz, DMSO-d
6)...46
Figura 16 – Expansão do mapa de contornos COSY de ACF-AI-P1 (400 MHz,
DMSO-d
6)
na região de δ 2,2 a 4,6...47
Figura 17 – Expansão do mapa de contornos HSQC de ACF-AI-P1 (400 MHz,
DMSO-d
6)...47
Figura 18 – Expansão do mapa de contornos HSQC de ACF-AI-P1 (400 MHz,
DMSO-d
6)...48
Figura 19 – Expansão do mapa de contornos HSQC de ACF-AI-P1 (400 MHz,
DMSO-d
6)...48
Figura 20 – Expansões do mapa de contornos HMBC de ACF-AI-P1 (400 MHz,
DMSO-d
6)...49
Figura 21 – Expansão do mapa de contornos HMBC de ACF-AI-P1 (400 MHz,
DMSO-d
6)...49
Figura 22 –
Esquema das frações obtidas do extrato hidroalcoólico bruto (95 g) de
A.
crassiflora
e respectivos valores de DL
50frente à TAS em µg/Ml...54
Figura 23 – Cromatogramas da norestefalagina a 25,0 µg/mL e da mistura de excipientes
da nanoemulsão obtidos em CLAE-PDA a 241 nm...59
Figura 24 – Curva de calibração do NOR no comprimento de onda de 241 nm;
R
2=
Figura 28 – Variação do tamanho das gotículas das NE-NOR em 9 meses a 8ºC...76
Figura 29 – Variação do IP das gotículas das NE-NOR em 9 meses a 8ºC...76
Figura 30 –
Curva de calibração de doseamento da hemoglobina liberada dos
eritrócitos...80
Figura 31 – Porcentagem de hemólise induzida pela NOR...80
Figura 32 – Parasitemia no quarto dia de infecção após tratamento com NOR
segundo o four-day-test...85
Figura 33 – Resultado do Four-day test no sétimo dia de infecção...87
Figura 34 – Parasitemia para os grupos NOR e NE-NOR na dose de 4 mg/kg...88
Figura 35 – Sobrevida dos grupos de animais infectados pelo
Plasmodium berghei
NK65...89
Figura 36 – Peso dos camundongos infectados pelo
P. berghei
NK65 e tratados com
NOR...90
Figura 37 – Peso dos camundongos infectados pelo
P. berghei
NK65 e tratados com
LISTA DE TABELAS
Tabela 1 -
Massas secas das frações obtidas após extração ácido-base do extrato
etanólico bruto (95 g) das folhas de
A. crassiflora
...27
Tabela 2 - Fracionamento cromatográfico da ACF-Cia...29
Tabela 3 – Grupos provenientes do fracionamento cromatográfico da ACF-Cia...33
Tabela 4 – Dados de RMN de
1H de ACF-AI-P1 e suas correlações...44
Tabela 5 - Dados de RMN de
1H e de
13C, δ em ppm, de ACF
-AI-P1 e norestefalagina
(NOR)...45
Tabela 6 – Concentrações do extrato etanólico e frações de
A. crassiflora
empreg
a
das no
teste larvicida TAS...52
Tabela 7 –
Resultados do teste de letalidade sobre
A. salina
dos extratos e frações
obtidas das folhas de
A. crassiflora
Mart...53
Tabela 8 –
Atividade no teste de letalidade sobre
A. salina
dos compostos isolados
obtidos das frações clorofórmicas ACF-CIa e ACF-AI das folhas de
A. crassiflora
Mart...54
Tabela 9 – Valores da área sob a curva da NOR em função de sua concentração...61
Tabela 10 – Resultados do teste de repetibilidade para validação do doseamento da NOR
a 241 nm...61
Tabela 11 –
Resultados do teste de precisão inter dia, em dois dias, para validação do
doseamento da NOR a 241 nm...62
Tabela 12 – Exatidão do método de doseamento da NOR...63
Tabela 13 – Composição e caracterização das NE brancas...70
Tabela 14 –
Comparação entre os parâmetros físico-químicos das NE-NOR de acordo
com a concentração de NOR e solventes utilizados...72
Tabela 16 – Porcentagem e eficiência de encapsulação de formulações de NE-NOR com
concentrações de 0,5 e 2,0 mg/mL de NOR...74
Tabela 17 – Delineamento experimental do
four-day-test
...83
Tabela 18 – Tratamento de camundongos Swiss infectados pelo
Plasmodium berghei
1
1 INTRODUÇÃO GERAL
A malária apresenta-se como a principal doença infecciosa prevalente no mundo,
afetando cerca de 250 milhões de pessoas (WHO, 2008). A infecção é causada por
protozoários unicelulares do gênero
Plasmodium
(PIMENTEL
et al
., 2007). No Brasil, as
infecções mais comuns são causadas pelas espécies
Plasmodium vivax
e
Plasmodium
falciparum
(BRASIL, 2006), sendo essas espécies as principais responsáveis pela
prevalência e mortalidade, respectivamente, na malária humana.
A terapêutica antimalárica atualmente empregada é eficaz, mas a adesão dos
pacientes à terapêutica ainda é insuficiente, ocasionada por complexos regimes
posológicos e por efeitos colaterais graves (CRAWLEY, 1999; WINSTANLEY, 2001).
Além disto, o aumento da incidência de resistência aos fármacos disponíveis,
principalmente à cloroquina, tornou-se um fator preocupante e que vem estimulando a
busca por novos compostos e regimes terapêuticos (PIMENTEL
et al
., 2007).
As plantas representam uma importante fonte de novos compostos antimaláricos,
(protótipos) como exemplo, os descobertos ao longo das últimas décadas, desde a
quinina em 1820 até a artemisinina e seus derivados em 1972 (OLIVEIRA
et al
., 2009),
reforçando a importância dessa fonte de fármacos (WRIGHT, 2005). A família
Annonaceae compreende cerca de 130 gêneros e mais de 2300 espécies (ARAYA, 2004).
A espécie
Annona
crassiflora
Mart. é característica do cerrado brasileiro e conhecida
como araticum, sendo utilizada tradicionalmente contra diarreia, reumatismo, infecções
helmínticas e doença de Chagas (TEMPONE, 2005). No entanto, o potencial da espécie é
vasto, sendo relatados estudos sobre as atividades leishmanicida, antimalárica, citotóxica
e antimutagênica (GONÇALVES
et al
., 2010; PIMENTA, 1995; SANTOS
et al
., 1999;
VILAR
et al
., 2008). Na espécie, há predominância de alcaloides; além de polifenóis,
óleos essenciais, terpenos e acetogeninas (PIMENTA, 1995; HOCQUEMILLER
et al
.,
1982).
Os alcaloides são metabólitos secundários que, geralmente, apresentam estrutura
orgânica nitrogenada derivada de aminoácidos (SIMÕES
et al.,
2004)
. Alguns alcaloides
do tipo isoquinolínicos apresentaram atividade antiplasmódica
in vitro
, indicando este
2
Formas farmacêuticas de liberação controlada de fármacos são capazes de manter
ou prolongar a ação de fármacos com potencial no combate e controle da malária,
podendo também permitir a administração de fármacos considerados potencialmente
tóxicos e que são pouco utilizados pela possibilidade de redução da dose
(SANTOS-MAGALHÃES e MOSQUEIRA, 2010); e ainda, melhorar e prolongar a resposta imune a
vacinas (ALVING, 2002; CARBOSO
et al
., 2003).
Os sistemas nanoestruturados são sistemas carreadores de fármacos com
diâmetro inferior a 1000 nm. Dentre os principais sistemas nanoestruturados
encontram-se os lipossomas, as nanopartículas (nanocápsulas e nanoesferas) e as nanoemulsões
(SCHAFFAZIK e GUTERRES, 2003). A principal propriedade dos nanocarreadores no
contexto da malária seria a habilidade de permanecer em circulação no sangue por um
longo período de tempo, liberando lentamente o fármaco, elevando a interação dos
fármacos com as hemácias infectadas (MOSQUEIRA
et al.
, 2004).
Diversos estudos realizados apontam a potencialidade da nanotecnologia na
terapêutica antimalárica. Mosqueira e colaboradores (2004, 2006) avaliaram a atividade
antimalárica de nanocápsulas furtivas de polímero de ácido lático contendo halofantrino,
em camundongos infectados pelo
Plasmodium berghei
, onde uma rápida supressão dos
parasitas foi obtida, além de melhorar o perfil farmacocinético e reduzir a cardiotoxicidade
(LEITE
et al
., 2001). O mesmo resultado foi obtido com a quinina veiculada em
nanocápsulas (HAAS
et al
., 2009).
A utilização de substâncias de origem natural e o desenvolvimento de
medicamentos com liberação controlada são alternativas importantes a serem
consideradas na terapêutica, não somente para melhorar a eficácia contra parasitas
resistentes, como para reduzir os efeitos adversos e melhorar a adesão dos pacientes ao
tratamento, gerando melhorias na eficácia no combate à malária, principalmente no Brasil.
Diante do exposto, este trabalho investigou o potencial antimalárico de um alcaloide
obtido das folhas de
Annona crassiflora
Mart., tanto na forma livre como na forma
3
2 REVISÃO DE LITERATURA
2.1 A Família Annonaceae e seus principais metabólitos secundários
2.1.1 A família Annonaceae
A Annonaceae representa uma família ampla da ordem Magnoliales, abrangendo
cerca de 130 gêneros e mais de 2300 espécies (ARAYA, 2004). Com distribuição tropical
e subtropical, ocorre principalmente como árvores, arbustos ou cipós (QUEIROZ
et al
.,
1996). Apresenta uniformidades anatômica e estrutural, de hábito e do “habitat”,
apresentando características marcantes (BARROSO, 1991). Os principais gêneros
pertencentes a essa família são
Guateria
(250),
Uvaria
(175),
Xylopia
(160),
Polyalthia
(150) e
Annona
(120).
No Brasil, já foram registrados 29 gêneros, compreendendo cerca de 260
espécies. O gênero
Annona
é cultivado e comercializado no Brasil, apresentando
importância econômica, como exemplos as espécies,
A. squamosa
(Fruta-do-conde),
A.
muricata
(graviola),
A. reticulata
(condessa) e
A. cherimola
(cherimoia); fonte de frutos
comestíveis e obtenção de óleos e madeira (LEBOEUF
et al
., 1982).
2.2 A Espécie
Annona crassiflora
Mart. - Taxonomia
2.2.1 Classificação botânica (BARROSO, 1991 e ANGIOSPERM PHILOGENY
GROUP, 2003)
Reino: Plantae
Divisão: Spermatophyta
Subdivisão: Angiospermae
Reino: Magnoliophyta
Classe: Magnolitae
Sub-classe: Magnoliidae
Ordem: Magnoliales
Família: Annonaceae
Subfamília: Annonoideae
Tribo: Unoneae
Gênero:
Annona
4
2.2.2 Descrição botânica e aspectos econômicos
A espécie
Annona crassiflora
Mart. (Figura 1) é conhecida popularmente como
araticum, pinha, marolo, cabeça-de-negro e pinha-do-cerrado. A planta é típica do cerrado
brasileiro, situando-se de forma mais específica no parque-cerrado ou campo de
murundus. Essa tipologia caracteriza-se por um grupamento de espécies sobre pequenos
murundus, formando ilhotas de vegetação arbóreo-arbustiva, distribuídas irregularmente
sobre uma superfície plana e com certo grau de umidade constante (MENDONÇA
et al.,
2000). A
Annona crassiflora
Mart. ocorre nos estados de Minas Gerais, Bahia, Ceará,
Goiás, Mato Grosso, Mato Grosso do Sul, São Paulo e Tocantins.
Figura 1 - A espécie
Annona
crassiflora
Mart.
A
Annona crassiflora
é uma espécie arbórea de até 8 m de altura, de tronco ereto
ou não, casca clara, fendida, descamada como cortiça. As folhas são simples, alternas e
elípticas; de haste curta, espessada, quase sem pelos na face superior e recoberta por
pelos cor de ferrugem na face inferior. Suas flores possuem cerca de 3 cm de diâmetro,
podendo estar isoladas ou agrupadas de 2 a 4. São grandes, com pétalas carnosas,
amarelo-avermelhadas (BRANDÃO
et al
., 1992).
Os frutos são utilizados na alimentação na sua forma inteira (
in natura
) ou na forma
5
(LORENZI
et al
., 2002). As sementes são achatadas e elípticas, apresentando
característica de dormência durante meses de estiagem (FONSECA e RIBEIRO, 1992).
2.3 Fitoquímica da família Annonaceae
A família Annonaceae apresentou até 1982, predominância de alcaloides dentre os
metabólitos secundários isolados das espécies pertencentes à família. Outros
constituintes foram relatados na família como polifenóis, óleos essenciais, terpenos e
substâncias aromáticas (LEBOEUF
et al.,
1982).
Estudos fitoquímicos das sementes conduziram ao isolamento de acetogeninas da
Annona crassiflora
, principais marcadores da família Annonaeae, como a araticulina (1).
As acetogeninas tetra-hidrofurânicas foram isoladas primeiramente por Jolad e
colaboradores (1982), sendo que tal descoberta foi importante no direcionamento dos
estudos fitoquímicos, devido às atividades citotóxica, antitumoral e pesticida apresentadas
por esses metabólitos (SANTOS
et al
., 1999; PIMENTA, 1995; SANTOS
et al
., 1994).
Além dessas, outros compostos como a N-trans-cafeoiltiramina (2) e a lignanamida
grossamida (3) foram relatados para a espécie (PIMENTA, 1995). Também foram
isolados das folhas, alcalóides do tipo benzilisoquinolínicos, como a liriodenina (4),
anonaína (5), asimilobina (6) e reticulina (7) (HOCQUEMILLER
et al
., 1982). Da madeira
de
Annona crassiflora
foram isolados os alcaloides oxoaporfínicos aterospermidina (8),
liriodenina (4) e duas acetogeninas (GONÇALVES
et al.,
2010).
(1)
O
O (CH2)7
O O
H3C(H2C)9
HO
6
Serão revisados a seguir os principais metabólitos produzidos pelas espécies da
família Annonaceae.
2.3.1 Polifenóis
Os polifenois são compostos redutores, que são oxidados facilmente gerando
produtos corados. A cor desses produtos de oxidação deve-se ao elevado grau de
conjugação (SIMÕES
et al
., 2004).
Os flavonoides são os principais polifenóis encontrados na família Annonaceae. A
catequina (9) foi relatada em
Annona cherimola
, enquanto a quercetina (10) ocorre em
Annona glabra
,
Annona senegalensis
,
Asimina triloba
e
Annona crassiflora
. Diversas
espécies de gênero
Uvaria
apresentaram o flavonoide pinocembrina (11). As classes mais
NH O HO OH OH HO N H O O O OH O HN O OH(3)
(2)
N O O O(
5
)
(
4
)
(
6
)
NH HO
O
(
7
)
N O HO CH 3 OH O CH3
H3C
(
8
)
7
abundantes de flavonoides no gênero são flavonóis e derivados glicosilados (
O
-glicosídeos e
C
-glicosídeos) (SANTOS e SALATINO, 2000).
(9)
(10)
(11)
2.3.2 Terpenos
Constituem uma classe de substâncias obtidas a partir de unidades C
5. Na família
Annonaceae, mono e sesquiterpenos foram relatados como constituintes de óleos
essenciais de inúmeras espécies. A atividade larvicida de uma mistura de sesquiterpenos
foi relatada por Leboeuf e colaboradores (1982). O ácido xilópico (12) isolado de espécies
do gênero
Xylopia
apresentou atividade antimicrobiana (TAKAHASHI
et al
., 2006). Dois
esteroides são comuns na família Annonaceae, o
β
-sitosterol (13) e o estigmasterol (14).
(12)
(13)
(14)
O HO
OH
OH
OH
O
OH
O HO
OH
OH
OH
OH
HO
OH O
O
OAc COOH
HO
H
HO
8
2.3.3 Acetogeninas isoladas da família Annonaceae
As acetogeninas constituem uma série de produtos naturais isolados quase que
exclusivamente de espécies da família Annonaceae. Esses metabólitos apresentam longa
cadeia carbônica C-35 ou C-37 sustentando um anel
γ
-lactônico terminal, podem conter
número variável de anéis tetra-hidrofurânicos, epóxidos ou ligações duplas, além de
vários substituintes oxigenados. A uvaricina (15) foi o primeiro constituinte isolado dessa
classe por Jolad e colaboradores (1982) das raízes de
Uvaria acuminata
, sendo que este
composto apresentou ação antitumoral no sistema de leucemia linfocítica em ratos (OS).
(15)
2.3.4 Alcaloides
Os alcaloides são substâncias nitrogenadas geralmente derivadas de aminoácidos,
sendo agentes potentes e que apresentam diversas propriedades farmacológicas. Dentre
as inúmeras classes de alcaloides relatadas na família, os alcaloides aporfínicos, que
constituem inúmeros compostos inseridos no grupo dos alcaloides isoquinolínicos, já
apresentaram atividades importantes, tais como, as atividades tripanosomicida e contra
espécies de
Leishmania
. Dentre eles destacam-se os compostos liriodenina (4) e
anonaina (5). Estes foram isolados das folhas de
Annona crassiflora
, sendo o primeiro o
principal alcaloide oxaporfínico de espécies da família Annonaceae, e o segundo, o
alcaloide aporfínico mais comum no gênero
Annona
.
A atividade antiplasmódica
in vitro
de alcaloides isoquinolínicos foi avaliada por
Wright e colaboradores (2000), onde o potencial antimalárico foi expresso pela IC
50frente
às cepas de
Plasmodium falciparum
, um parasita importante na malária humana. A
coridina (16) apresentou IC
50= 22,30 µM, enquanto a norcoridina (17), diferenciada da
anterior apenas pela ausência de um grupo metila ligado ao nitrogênio, exibiu IC
50= 3,08
µM. O difosfato de cloroquina foi a droga de referência utilizada e apresentou IC
50= 0,20
µM. Diversos estudos revelaram que a resistência à cloroquina por algumas cepas de
P.
O O
(CH2)10
O O
(CH2)9CH3
O O
9
falciparum
é o principal desafio da terapêutica, sendo necessário o desenvolvimento de
novos fármacos para o tratamento da malária. Os estudos realizados com alcaloides
isoquinolínicos indicam que este grupo de compostos pode se tornar uma fonte
interessante de novos fármacos e protótipos.
Chang e colaboradores (1998) constataram que alcaloides isoquinolínicos de
Annona purpurea
inibem a agregação plaquetária
in vitro
induzida por fatores como o
ácido araquidônico. A desidrotalicpureína (18) e 6a, 7-desidrolirinidina (19) inibem a ação
de enzimas ciclooxigenases que convertem o ácido araquidônico em tromboxana A2,
substância fundamental no processo de coagulação. A atividade anticancerígena do
alcaloide roemerina (20) isolado de folhas de
Annona senegalensis
foi demonstrada, onde
o acúmulo de fármaco intracelular foi favorecido pela administração de roemerina em
células de carcinoma de epiderme oral, que apresentavam resistência ao fármaco
tradicional vimblastina.
O alcaloide xilopina (21) apresentou atividade fungicida contra cepas de
Candida
albicans
, enquanto a tetraidroplamitina (22) apresentou atividade bactericida sobre cepas
de
Staphylococcus aureus
(SIMÉON
et al.,
1990). Alguns alcaloides são menos comuns
como a anomontina (23), isolada de
Annona montana
e a samoquasina-A (24), o primeiro
alcaloide benzoquinazolínico obtido, isolado e identificado da família Annonaceae.
(16)
(17)
(18)
(19)
N H3CO
HO CH
3
H3CO
H3CO
H
HN H3CO
HO
CH3
OCH3
H3CO
H3CO
OCH3
N H3CO
HO CH 3 H 6a 7 N H3CO
HO H
H3CO
H3CO
10
(20)
(21)
(22)
(23) (24)
2.4 A malária e os desafios da terapêutica
2.4.1 A malária no mundo e no Brasil
A malária é a doença parasitária mais prevalente no mundo, sendo causada por
protozoários do gênero
Plasmodium
. A doença está distribuída em regiões tropicais, nas
quais prevalecem as espécies
Plasmodium falciparum, Plasmodium vivax
,
Plasmodium
malarie
e
Plasmodium ovale
.
Os parasitas são transmitidos ao homem através da picada de fêmeas dos
mosquitos vetores do gênero
Anopheles
. Em 2008, 109 países foram focos endêmicos de
malária, sendo 45 somente na África (WHO, 2008). Foram estimados 247 milhões de
casos em todo mundo em 2006, dos quais 86% ocorreram na África, culminando em mais
de 1,25 milhão de mortes (GARDELLA
et al.,
2008), onde a letalidade da infecção pelo
P.
falciparum
torna-se uma das principais razões desses números. Após a África, Brasil e a
Índia são os principais países com elevada endemicidade no mundo, sendo afetados
também por outras espécies do
Plasmodium
. O parasita
P. vivax
, mesmo não
N H3CO
H3CO
OCH3
OCH3
HN CH3
O
O
OCH3
N CH3
O
O
H
N H
N
N
H2N
NH N
11
apresentando a mesma letalidade como nos casos de infecção pelo
P. falciparum
, causa
sérios impactos econômicos, encontrando-se distribuído a nível global como na América
do Sul, Ásia e Oceania.
Na América, o Brasil apresenta o maior número de casos, cerca de 300000
registros em 2009, dos quais 99,9% ocorrem principalmente na região da Amazônia Legal
brasileira, onde 10 a 15% da população está sob risco (BRASIL, 2010). No Brasil, as
infecções mais comuns são mais causadas pelas espécies
P. vivax
e
P. falciparum
, sendo
15% dos casos provocados pela segunda espécie
(BRASIL, 2010). Alguns fatores
dificultam o controle da doença nessa região, como a intensa migração, condições
inapropriadas de moradia e serviços de saúde inadequados (CHAVES e RODRIGUES,
2000; TAIUL, 2003).
2.4.2 Ciclo da doença e principais sintomas
O ciclo da malária no homem inicia quando um mosquito infectado pica o indivíduo,
inoculando os esporozoítos, que migram para o fígado e invadem os hepatócitos por
mecanismos ainda não totalmente esclarecidos. Cada esporozoíto pode gerar cerca de
30000 novos parasitas no caso do
P. falciparum
ou 10000 na infecção pelo
P. vivax
. Para
este os esporozoítos se desenvolvem mais lentamente nas células hepáticas, e são
conhecidos como hipnozoítos, e que podem permanecer por meses nesse tecido. Os
hipnozoítos induzem às recidivas da doença em até dois anos após a infecção inicial
(KRETTLI
et al
., 2001).
Os estágios assexuados sanguíneos do ciclo do parasita, como trofozoítos e
esquizontes, são os principais agentes etiológicos da infecção, provocando sintomas até
em duas semanas após a inoculação dos esporozoítos. Os estágios assexuados
intra-eritrocíticos são os principais alvos dos fármacos antimaláricos (WINSTANLEY
et al
.,
12
A lise dos eritrócitos desencadeia os principais sintomas da malária como a dor de
cabeça, mialgia, anemia, hepatite, esplenomegalia e períodos cíclicos de febre elevada
entre 48 ou 72 horas. Além desses, sintomas neurológicos graves podem ocorrer
principalmente pela infecção pelo
P. falciparum
, provocando a malária cerebral. Este
forma letal da infecção é causada por eventos de interrupção e bloqueio do fluxo
sanguíneo em pequenos vasos cerebrais devido às alterações nas membranas das
mesmas provocadas pela alta replicação do parasita.
As espécies
P. vivax
e
P. ovale
apresentam estágio dormente (hipnozoítos) no
fígado, que são responsáveis pelas recidivas da doença após o tratamento com
esquizonticidas sanguíneos. O parasita
P. malarie
produz infecções duradouras e que
podem ser assintomáticas no homem por anos ou durante toda a vida (KRETTLI
et al
.,
2001).
2.4.3 Terapêutica antimalárica
O tratamento da malária humana possui como estratégia a redução da morbidade e
mortalidade provocadas pela infecção. O tratamento imediato e eficaz é provavelmente o
principal método de controle da infecção. O tratamento oral interrompe a progressão para
estágios mais graves da doença que resultam em complicações.
Os fármacos antimaláricos utilizados correntemente na terapêutica pertencem a
inúmeras classes como as aminoquinolinas (cloroquina, amodiaquina, primaquina), os
derivados de quimolinometanol (quinina, mefloquina, halofantrino), diaminopiridinas
(pirimetamina), sulfonamidas (sulfadoxina, sulfadiazina), biguanidas (proguanil e
derivados), antibióticos (tetraciclina, doxiciclina, clindamicina), sesquiterpenos (artemisina,
dihidroartemisina, arteether, artemether, artesunato) e naftoquinonas (atovaquona)
(GUÉRIN
et al
., 2002).
A cloroquina (25) é o fármaco amplamente usado na terapêutica, com sua
descoberta e utilização relatadas na década de 40. Este fármaco, basicamente por
apresentar vantagens farmacocinéticas e farmacodinâmicas comparadas aos demais,
tornou-se padrão ouro na terapêutica antimalárica em associação com a
sulfadoxina-piridoxamina. No entanto, a resistência de algumas cepas de
P. falciparum
foi relatada já
13
(25)
A primaquina (26) é aplicada em casos de prevenção de recidivas em casos de
infecção das espécies que apresentam a forma hipnozoíta do parasita em seu ciclo. No
entanto, sua utilização é limitada devido à sua elevada toxicidade. Um análogo da
primaquina, a tafenoquina, tem apresentado elevada eficácia tanto na cura primária da
malária reincidente como na profilaxia das infecções causadas por
P. falciparum
e
P.
vivax
.
(26)
Em 2001, associações terapêuticas formadas pela artemisinina e seus derivados
com fármacos antimaláricos tradicionais foram propostas pela Organização Mundial da
Saúde (OMS), como a artesunato-amodioquina, artemether-lumefantrino (Coartem
®),
artesunato-mefloquina e dihidroartemisina-piperaquina (Artecom
®). A associação
artemether-lumefantrino é a terapêutica mais eficaz no tratamento da infecção provocada
por
P. falciparum
, tornando-se o tratamento de primeira ou segunda linha para casos não
graves da doença (WHO, 2005; 2008).
2.4.4 Desafios e os estudos de novos fármacos
Apesar da vasta gama de fármacos disponíveis, a quimioterapia da malária ainda
apresenta inconvenientes ligados principalmente ao seguimento da terapêutica, desde
complexos regimes posológicos até efeitos colaterais graves (CRAWLEY, 1999;
WINSTANLEY, 2001). Outra adversidade encontrada, até mesmo como consequência da
ineficácia da quimioterapia, seria a resistência do parasita aos antimaláricos, considerada
N
HN
N CH3
CH3
CH3
Cl
N O
HN
CH3
14
por Crawley (1999) o mais importante problema no controle da doença. A resistência do
P. falciparum
, segundo Wongsrichanalai e colaboradores (2002), se estende a muito
antimaláricos e associações, havendo assim, formação de áreas de multi-resistência.
Há uma urgente necessidade de desenvolvimento de novos fármacos antimaláricos
mais eficazes contra as variedades de cepas de
P. falciparum
. No entanto, deve-se
considerar outros fatores importantes como a facilidade de adesão ao tratamento,
segurança, custo e disponibilidade do tratamento por via oral (WRIGHT, 2005; FIDOCK
et
al
., 2004).
Diferentes abordagens de estudos sobre novos fármacos antimaláricos são visadas
atualmente como a otimização da terapia com fármacos já disponíveis e suas
associações; obtenção de análogos sintéticos; descoberta de agentes antimaláricos
naturais; pesquisas sobre substâncias utilizadas em outras doenças; descobertas de
agentes que inibam a resistência; e quimioterápicos atuantes em outros sítios moleculares
(ROSENTHAL, 2001; 2003).
Para combater os mecanismos de resistência aos fármacos na terapêutica
antimalárica, novas estratégias para a liberação intracelular dos fármacos também
possuem grande importância como em estudos utilizando nanosistemas que promovem o
transporte dos fármacos proporcionando uma fácil passagem pelas membranas celulares
(BAREFORD,
et al
., 2007).
2.4.5 Fármacos antimaláricos derivados de plantas
15
A quinina (27) foi o primeiro representante dos alcaloides antimaláricos, sendo
obtida em 1820 da casca da cinchona (
Cinchona ssp.
) e com estrutura química elucidada
em 1944. Sua síntese em larga escala, no entanto, era complexa e de elevado custo.
Diante disto, sua obtenção por extração é a forma mais utilizada atualmente, sendo o
cultivo realizado principalmente na América do Sul (BOULOS
et al
., 1997). A quinina foi
uma importante descoberta como protótipo para síntese da cloroquina (26) em 1940,
sendo este, até recentemente, o principal fármaco disponível para a terapia.
(27)
(28)
A descoberta da artemisinina (28) foi a contribuição mais recente dos produtos
derivados de plantas para a terapêutica antimalárica. Seu isolamento ocorreu a partir da
espécie
Artemisia annua
, prevalente na China e representou uma nova estrutura
farmacológica importante, uma lactona sesquiterpênica endoperóxido. A artemisinina
também foi protótipo para diferentes derivados como o artemeter (29), arteeter (30) e
artesunato sódico (31); que são atualmente mais empregados na terapêutica por
apresentarem uma farmacocinética mais adequada que a da artemisinina, além de
minimizar os riscos de recidivas e de desenvolvimento de resistência em associação com
uma segunda droga antimalária (OLIVEIRA
et al
., 2009).
(29)
(31)
(30)
O O CH3 H OH3C
O
O
CH3
H
O
OCOC2H4CO2Na
CH3 H O
H3C
O O CH3 H O O CH3 H O
H3C
O
O
CH3
H
R
Artemeter R = CH3
Arteeter R = CH2CH3
N H3CO
H
16
(32)
O mais recente fármaco antimalárico descoberto foi a atovaquona (32), um
derivado do lapachol (obtido das espécies
Tabebuia ssp.
), que vem norteando a
tendência das pesquisas. A associação da atovaquona com proguanil (Malarone
®)
relatada por Looareesuwan e colaboradores (1999) tem se apresentado muito eficaz
contra malária, entretanto, seu elevado custo de produção em larga escala impossibilita a
fabricação em países onde a doença é endêmica (FIDOCK
et al.,
2004).
O
O
OH