UNIVERSIDADE FEDERAL DE OURO PRETO
ESCOLA DE FARMÁCIA - CIPHARMA
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
SÍNTESE E ATIVIDADES
FARMACOLÓGICAS DE DERIVADOS DA
6-NITRO-2
H
-1,4-BENZOTIAZIN-3-ONA
JULIANA LUÍSA TEIXEIRA DE ANDRADE
OURO PRETO – MG – BRASIL
JULIANA LUÍSA TEIXEIRA DE ANDRADE
SÍNTESE E ATIVIDADES FARMACOLÓGICAS DE
DERIVADOS DA 6-NITRO-2
H
-1,4-BENZOTIAZIN-3-ONA
Dissertação apresentada ao Programa de Pós-Graduação em Ciências Farmacêuticas da Escola de Farmácia da Universidade Federal de Ouro Preto, como requisito parcial à obtenção do título de Mestre em Ciências Farmacêuticas.
Área de Concentração: Química Farmacêutica
Orientadora: Profª. Drª. Vera Lúcia de Miranda Guarda Co-orientadora: Profª. Drª. Andrea Grabe Guimarães
Ouro Preto
Catalogação: sisbin@sisbin.ufop.br A554s Andrade, Juliana Luísa Teixeira de.
Síntese e atividades farmacológicas de derivados da
6-nitro-2H-1,4-benzotiazin-3-ona [manuscrito] / Juliana Luísa Teixeira de Andrade – 2008.
xvii, 108 f.: il. color., grafs., tabs.
Orientadora: Profa. Dra. Vera Lúcia de Miranda Guarda. Co-orientadora: Profa. Dra. Andrea Grabe Guimarães.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Escola de Farmácia. Programa de Pós-Graduação em Ciências Farmacêuticas. Área de concentração: Química Farmacêutica
1. Benzotiazina - Teses. 2. Toxicidade aguda - Teses. 3. Atividade
antinociceptiva - Teses. 4. Atividade antifúngica - Teses. I. Universidade Federal de Ouro Preto. II. Título.
AGRADECIMENTOS
É imprescindível referir que a realização deste trabalho se deve a todos aqueles que, direta ou indiretamente, contribuíram para a realização do mesmo, incentivando e colaborando com amizade. Sei que palavras não quantificam a minha gratidão, mas ainda assim gostaria de demonstrar o meu imenso agradecimento:
À Deus, por tudo.
Aos meus pais, Tony e Ivy, exemplos de resiliência e amor. Aos meus irmãos Klaus e Danilo, pela presença sempre constante além do apoio, incentivo e amizade verdadeira.
Ao Renato, por encorajar-me a persistir nos ideais. Nele encontrei todo o amor e apoio necessário, renovando minha energia e confiança.
À Dadá, pela certeza de que minha filha estava sendo imensamente amada e bem cuidada.
Às queridas amigas Elenice e Júnia, por compreenderem a minha ausência e serem sempre um exemplo de força e dedicação.
À Tália, “Tia Ângela” e Ariadne, pela grande amizade, apoio, inúmeras ajudas, além do enorme carinho, hospitalidade e aconchego familiar.
À Nathália Duarte, pela dedicação imensurável. Muitas são as razões para agradecer, mas todas se resumem na certeza de que este trabalho não seria o mesmo sem ela.
À minha co-orientadora, Profª. Drª. Andrea Grabe, pelos ensinamentos, sugestões e dedicação, principalmente durante a finalização deste trabalho.
Ao Prof. Dr. Sidney Augusto, querido Bibo, pelos conselhos e incentivos para a conclusão desta pesquisa.
Ao Prof. Dr. Tanus Nagem, mais que ensinos teóricos, pela amizade, confiança e apoio em todos os momentos que a ele recorri.
Às Profªs. Drª. Neila Barcellos e Drª. Maria Elisabete Barros, pela colaboração, auxílio e ensinamentos, sempre com imensa presteza e dedicação.
Ao Fernando Armini pela ajuda, possibilitando a finalização deste trabalho em tempo hábil.
Ao Sr. José Maria, técnico do laboratório de Química Farmacêutica, por todo o apoio, disposição e presteza.
Aos funcionários do Biotério, especialmente Wilson e Cristina, por auxiliar-me nos procediauxiliar-mentos necessários e pelos cuidados com os animais.
À Luciana Guzzo, pela ajuda e valiosas informações.
À Eliane Stetler, pelo carinho e delicadeza em revisar esta dissertação. Aos professores e colegas do Programa de Pós-Graduação em Ciências Farmacêuticas – CiPharma, pelo engrandecimento deste curso. De forma especial, à Profª. Drª. Dênia Antunes e ao Prof. Dr. Jorge Humberto.
“O homem se torna muitas vezes o que ele próprio acredita que é. Se eu insisto em repetir para mim mesmo que não sou capaz de realizar alguma coisa, é possível que realmente seja incapaz de fazê-lo. Ao contrário, se tenho convicção de que posso fazê-la, certamente adquirirei capacidade de realizá-la, mesmo que não a tenha no começo.”
RESUMO
A necessidade de potencializar determinadas atividades farmacológicas e reduzir efeitos indesejáveis torna necessária a busca por novos fármacos. Utilizando técnicas de modificação molecular, cinco derivados da 2H-1,4-benzotiazin-3-ona foram sintetizados. Suas estruturas foram comprovadas por métodos espectroscópicos de infravermelho, RMN1H, RMN13C e espectrometria de massas. Estes compostos foram submetidos aos testes de toxicidade aguda, analgesia - pelo método da placa quente e das contorções abdominais induzidas pelo ácido acético - e atividade antifúngica. Foram observadas estereotipias e sinais qualitativos indicativos de toxicidade nos animais. Os resultados da Dose Letal Mediana revelaram que as modificações moleculares induziram uma maior toxicidade, principalmente nos compostos que sofreram a redução do grupo nitro a grupo amino. O derivado benzoilado induziu maior redução nas contorções abdominais e aumento no tempo de latência sobre a placa quente. Nos experimentos antifúngicos apenas o composto de partida induziu atividade.
ABSTRACT
The necessity to maximize some pharmacological activities and to reduce unwanted effects makes necessary the search for new therapeutic agents. By means of molecular modifications, five derivatives of 2H-1,4-benzothiazin-3-one had been synthesized. Their structures had been confirmed by infrared and mass spectrometry, RMN1H and RMN13C. These composites had been submitted to the tests of acute toxicity, analgesy – using the hot plate method and the acetic acid induced abdominal contortions method - and antifungal activity. Stereotypes and qualitative signals that indicate of toxicity in the animals had been observed. Medium Lethal Dose results had disclosed that the molecular modifications had induced to a bigger toxicity, mainly in the composites that had suffered to the reduction from the nitro group to the amino group. The benzoyl derivative induced greater reduction in the abdominal contortions and increase in the time latency on the hot plate. Only the departure composite induced activity in the antifungal experiments.
LISTA DE FIGURAS
Figura 1:Núcleo benzotiazínico e suas formas isoméricas 2H e 4H ...5
Figura 2:Estrutura molecular do antipsicótico Protipendil (Tiofenilpiridilamina)...6
Figura 3: Similaridade estrutural entre 1,4-benzotiazinas e fenotiazinas observadas ao longo do eixo nitrogênio-enxofre...6
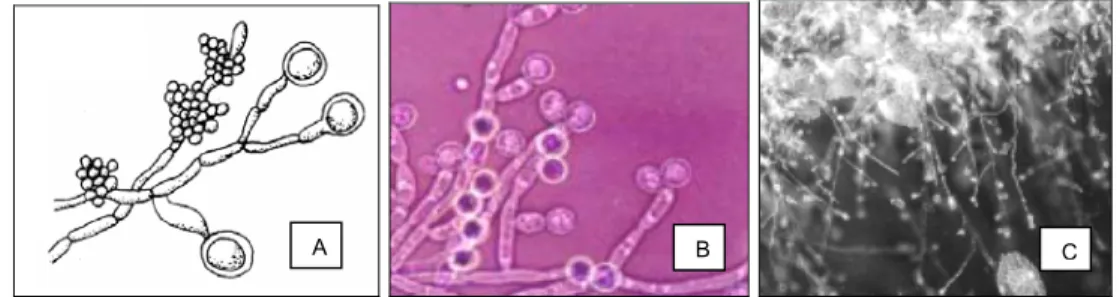
Figura 4: Morfologia de algumas das espécies de Candida: a) Candida albicans; t) Candida tropicalis; k) Candida krusei e p) Candida parapsilosis...19
Figura 5: Morfologia da Candida albicans: A) Representação esquemática; B e C) Aspecto microscópicos, visualizando os clamidosporos e as pseudohifas...20
Figura 6: Morfologia da Candida krusei: A) Representação esquemática; B e C) Aspecto microscópicos, visualizando os clamidosporos e as pseudohifas. ...20
Figura 7: Morfologia da Candida parapsilosis: A) Representação esquemática; B e C) Aspecto microscópicos, visualizando os clamidosporos e as pseudohifas. ...20
Figura 8: Morfologia da Candida tropicalis: A) Representação esquemática; B e C) Aspecto microscópicos, visualizando os clamidosporos e as pseudohifas. ... 20
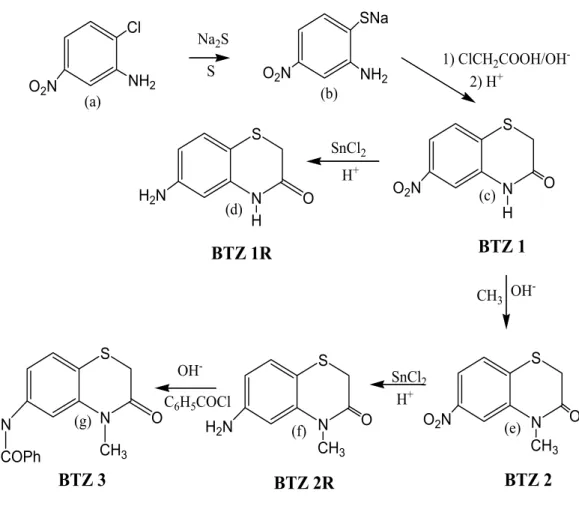
Figura 9: Representação esquemática da síntese dos derivados ... 33
Figura 10: Fórmula estrutural e tridimensional (modelo de bolas) do BTZ-1 ...38
Figura 11: Fórmula estrutural e tridimensional (modelo de bolas) do BTZ-1R ... 38
Figura 12: Fórmula estrutural e tridimensional (modelo de bolas) do BTZ-2 ... 38
Figura 13: Fórmula estrutural e tridimensional (modelo de bolas) do BTZ-2R ... 38
Figura 14: Fórmula estrutural e tridimensional (modelo de bolas) do BTZ-3...38
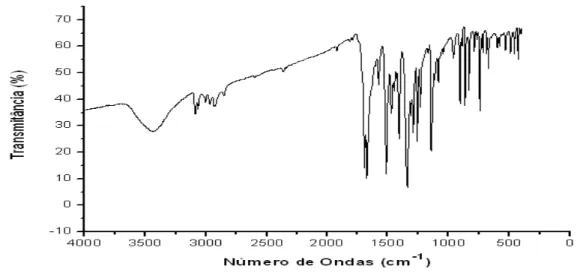
Figura 15: Espectro de absorção no Infravermelho da 6-nitro-2H-1,4-benzotiazin-3-ona...42
Figura 16: Espectro de absorção no Infravermelho da 6-amino-2H-1,4-benzotiazin-3-ona ...43
Figura 17: Espectro de absorção no Infravermelho da 6 – nitro – 4 – metil - 2H - 1,4 - benzotiazin-3-ona ... 44
Figura 18: Espectro de absorção no Infravermelho da 6 – amino – 4 – metil -2H -1,4-benzotiazin-3-ona...45
Figura 19: Deslocamentos registrados no espectro de RMN 1H para o BTZ-1...46
Figura 21: Espectro de RMN 1H para a 6-nitro-4-metil-2H-1,4-benzotiazin-3-ona...48
Figura 22: Espectro de RMN 1H para a 6-amino-4-metil-2H-1,4-benzotiazin-3-ona ... 49
Figura 23: Espectro de RMN1H para a 6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona ...51
Figura 24: Deslocamentos químicos de Carbono-13 registrados para a 6-nitro-2H -1,4-benzotiazin-3-ona ...53
Figura 25: Deslocamentos químicos de Carbono-13 registrados para a 6-amino-2H -1,4-benzotiazin-3-ona ...54
Figura 26: Deslocamentos químicos de Carbono-13 registrados para a 6-nitro-4-metil-2H -1,4-benzotiazin-3-ona... 55
Figura 27: Deslocamentos químicos de Carbono-13 registrados para a 6-amino-4-metil-2H -1,4-benzotiazin-3-ona ... 56
Figura 28: Deslocamentos químicos de Carbono-13 registrados para a 6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona ...58
Figura 29: Aparato utilizado no teste do campo aberto - Open-Field test ... 64
Figura 30: Determinação da DL50 para o composto BTZ-1... 70
Figura 31: Determinação da DL50 para o composto BTZ-1R ... 70
Figura 32: Determinação da DL50 para o composto BTZ-2... 70
Figura 33: Determinação da DL50 para o composto BTZ-2R ... 71
Figura 34: Determinação da DL50 para o composto BTZ-3 ... 71
Figura 35: Ensaio de contorções abdominais induzidas pelo ácido acético 0,6% ... 77
Figura 36: Aparatos utilizados no Método da Placa Quente. ... 78
Figura 37: Roteiro do método da placa quente na avaliação da atividade antinociceptiva... 79
Figura 38: Número total de contorções (em 30 minutos) induzidas pelo ácido acético 0,6% em camundongos tratados com os fármacos padrões e os derivados sintetizados... 83
Figura 39: Resultado da determinação da CIM para o 6-nitro-2H-1,4-benzotiazin-3-ona ... 91
Figura 40: Resultado da determinação da CIM para o 6-amino-2H-1,4-benzotiazin-3-ona; (A)-Fluconazol e (B) - Terbinafina ... 91
LISTA DE TABELAS
Tabela 1: Características físico-químicas da 6-nitro-2H-1,4-benzotiazin-3-ona. ... 28
Tabela 2: Características físico-químicas da 6-amino-2H-1,4-benzotiazin-3-ona... 29
Tabela 3: Características físico-químicas da 6-nitro-4-metil-2H-1,4benzotiazin-3-ona ... 30
Tabela 4: Características físico-químicas da 6-amino-4-metil-2H-1,4-benzotiazin-3-ona .. 31
Tabela 5: Características físico-químicas da 6-benzoilamino-4-metil-2H1,4 -benzotiazin-3-ona. ... 32
Tabela 6: Caracterização do composto 2-amino-4-nitrobenzenotiol pela espectrometria no IV e RMN 1H, segundo Guarda (1998) ... 35
Tabela 7: Propriedades físico-químicas dos derivado sintetizados... 40
Tabela 8: Características de infravermelho para o BTZ-1 (ν cm-1, KBr 1%) ... 41
Tabela 9: Características de infravermelho para o BTZ-1R (ν cm-1, KBr 1%)... 42
Tabela 10: Características de infravermelho para o BTZ-2 (ν cm-1, KBr 1%)... 43
Tabela 11: Característica de infravermelho para o BTZ-2R (ν cm-1, KBr 1%)... 44
Tabela 12: Características de infravermelho para o BTZ-3 (ν cm-1, KBr 1%)... 45
Tabela 13: Deslocamentos químicos de H registrados para a 6-nitro-2H -1,4-benzotiazin-3-ona ... 47
Tabela 14: Deslocamentos químicos de H registrados para a 6-amino-2H -1,4-benzotiazin-3-ona ... 48
Tabela 15: Deslocamentos químicos de H registrados para a 6-nitro-4-metil-2H -1,4-benzotiazin-3-ona ... 49
Tabela 16: Deslocamentos químicos de H registrados para o composto 6-amino-4-metil-2H-1,4-benzotiazin-3-ona ... 50
Tabela 17: Deslocamentos químicos de H registrados para o composto 6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona ... 51
Tabela 18: Características de RMN 13C da 6-nitro-2H-1,4-benzotiazin-3-ona ... 53
-nitro - 4-metil-2H-1,4-benzotiazin-3-ona ... 55 Tabela 21: Deslocamentos químicos de Carbono - 13 registrados para o composto
6-amino-4-metil-2H-1,4-benzotiazin-3-ona... 57 Tabela 22: Deslocamentos químicos de Carbono-13 registrados para o composto
6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona ... 59
Tabela 23: Número de animais mortos após a administração dos diferentes compostos
sintetizados (nº de mortos / nº de animais testados) ... 68
Tabela 24: Determinação dos valores da DL50 para os derivados benzotiazínicos
testados ... 69 Tabela 25: Sinais qualitativos indicativos de toxicidade, observados em um período de 6
horas após administração por via i.p. dos derivados benzotiazínicos sintetizados... 72 Tabela 26: Efeitos dos derivados benzotiazínicos sobre a motilidade dos camundongos,
analisada pelo número de quadrados percorridos em 01 min no ensaio do campo aberto 76 Tabela 27: Representação percentual da redução da motilidade dos animais, avaliadas
pelo número de quadrados invadidos no campo-aberto ... 77 Tabela 28: Número total de contorções em 30 minutos induzidas pelo ácido acético
0,6% em camundongos. ... 83 Tabela 29: Efeito dos derivados benzotiazínicos no tempo de latência sobre uma placa
aquecida a 50ºC. ... 84 Tabela 30: Registros da ATCC para os fungos leveduriformes utilizados neste estudo .... 85 Tabela 31:Concentração inibitória mínima (µg/ml) para os derivados da 6-nitro-2H
SUMÁRIO
AGRADECIMENTOS... V RESUMO ... VII ABSTRACT ...VIII LISTA DE FIGURAS ... IX LISTA DE TABELAS ... XII SUMÁRIO... XIV
1. INTRODUÇÃO ... 1
2. OBJETIVOS ... 4
2.1.OBJETIVOGERAL: ... 4
2.2.OBJETIVOSESPECÍFICOS:... 4
3. REVISÃO DA LITERATURA... 5
3.1. SÍNTESEEREATIVIDADEDOSDERIVADOSBENZOTIAZÍNICOS ... 5
3.1.1. Síntese a partir do 2-aminotiofenol ... 6
i. Reação com 1,2-dihaloetano... 7
ii. Reação com ácidos e ésteres α-halogenados ... 7
iii. Reação com ácidos e ésteres α,β-insaturados... 8
3.1.2. Síntese a partir do ácido 2-nitro- ou 2-amino-feniltioglicólico ... 8
i. A partir do 2-nitrotiofenol ... 8
ii. A partir da 2-cloroanilina... 9
iii. A partir do 2,4-dinitroclorobenzeno ... 9
3.1.3. Por extensão do ciclo ... 10
3.1.4. Síntese a partir de dissulfetos de bis(o-nitrofenil)... 10
3.2. AVALIAÇÃODATOXICIDADE... 11
3.3. ATIVIDADESFARMACOLÓGICASDOSDERIVADOSBENZOTIAZÍNICOS... 13
3.4. ATIVIDADEANTINOCICEPTIVA ... 17
3.5. ASCÉLULASFÚNGICAS ... 18
3.6. OSFÁRMACOSANTIFÚNGICOS ... 21
4. SÍNTESE DOS DERIVADOS DA 6-NITRO-2H-1,4- BENZOTIAZIN-3-ONA ... 25
4.1. METODOLOGIA ... 25
4.1.1. MATERIAIS ... 25
4.1.1.1 Equipamentos ... 25
4.1.1.2 Solventes e Reativos... 26
4.1.2. MÉTODOS ...27
4.1.2.1 Síntese do composto 6-nitro-2H-1,4-benzotiazin-3-ona ... 27
i. Síntese do 2-amino-4-nitrofenolato de sódio ... 27
ii. Síntese da 6-nitro-2H-1,4-benzotiazin-3-ona ... 28
4.1.2.2 Redução do grupo nitro: síntese da 6-amino-2H-1,4-benzotiazin-3-ona ... 29
4.1.2.3 N-metilação: síntese da 6-nitro-4-metil-2H-1,4-benzotiazin-3-ona ... 30
4.1.2.4 Redução do grupo nitro: síntese da 6-amino-4-metil-2H-1,4-benzotiazin-3-ona ... 31
4.1.2.5 Benzoilação da amina: síntese do 6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona. ... 32
4.2. RESULTADOSEDISCUSSÃO ... 33
4.2.1. Via Sintética ...33
4.2.2. Obtenção do composto de partida: 6-nitro-2H-1,4-benzotiazin-3-ona... 34
4.2.3. A metilação do nitrogênio da posição 4 ... 36
4.2.4. A redução do grupo nitro... 36
4.2.5. Acilação da amina primária. ... 37
4.3. ESTRUTURASEPROPRIEDADESFÍSICO-QUÍMICAS... 38
4.4. CARACTERIZAÇÃOPORESPECTROMETRIADEIV... 41
4.4.1. 6-nitro-2H-1,4-benzotiazin-3-ona ... 41
4.4.2. 6-amino-2H-1,4-benzotiazin-3-ona ... 42
4.4.3. 6-nitro-4-metil-2H-1,4-benzotiazin-3-ona ... 43
4.4.4. 6-amino-4-metil-2H-1,4-benzotiazin-3-ona ... 44
4.4.5. 6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona ... 45
4.5. CARACTERIZAÇÃOPORESPECTROMETRIADERMN1H. ... 46
4.5.1. 6-nitro-2H-1,4-benzotiazin-3-ona ... 46
4.5.2. 6-amino-2H-1,4-benzotiazin-3-ona ... 47
4.5.3. 6-nitro-4-metil-2H-1,4-benzotiazin-3-ona ... 48
4.5.4. 6-amino-4-metil-2H-1,4-benzotiazin-3-ona ... 49
4.5.5. 6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona ... 50
4.6. CARACTERIZAÇÃOPORESPECTROMETRIADERMN13C... 52
4.6.1. 6-nitro-2H-1,4-benzotiazin-3-ona ... 52
4.6.2. 6-amino-2H-1,4-benzotiazin-3-ona ... 54
4.6.3. 6-nitro-4-metil-2H-1,4-benzotiazin-3-ona ... 55
4.6.4. 6-amino-4-metil-2H-1,4-benzotiazin-3-ona ... 56
4.6.5. 6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona ... 57
4.7. CARACTERIZAÇÃOPORESPECTROMETRIADEMASSAS... 60
5. AVALIAÇÃO DAS ATIVIDADES FARMACOLÓGICAS IN VIVO... 65
5.1.1. Animais ... ... 65
5.1.2. Preparação e administração das soluções... 65
5.2. TOXICIDADEAGUDAEATIVIDADELOCOMOTORAESPONTÂNEA ... 65
5.2.1. METODOLOGIA... 65
5.2.1.1 Determinação da DL50... 65
5.2.1.2 Identificação de estereotipias e sinais de toxicidade ... 66
5.2.1.3 Método do Campo-Aberto - Open-Field... 66
5.2.1.4 Análise Estatística ... 67
5.2.2. RESULTADOS E DISCUSSÃO ... 67
5.2.2.1 Toxicidade Aguda ... 67
5.2.2.2 Atividade Locomotora Espontânea... 76
5.3. ATIVIDADEANTINOCICEPTIVA ... 80
5.3.1. METODOLOGIA... 80
5.3.1.1 Método das Contorções induzidas pelo Ácido Acético - Writhing Test... 80
5.3.1.2 Método da Placa Quente - Hot Plate Test... 81
5.3.1.3 Análise Estatística ... 82
5.3.2. RESULTADOS E DISCUSSÃO ... 82
6. AVALIAÇÃO DA ATIVIDADE ANTIFÚNGICA IN VITRO... 88
6.1. METODOLOGIA ... 88
6.1.1. Materiais ...88
6.1.2. Métodos... ... 88
6.1.2.1 Preparo da cultura de fungos... 88
6.1.2.2 Preparo do meio RPMI 1640 ... 89
6.1.2.3 Padrões antifúngicos ... 89
6.1.2.4 Soluções dos derivados benzotiazínicos ... 89
6.1.2.5 Padronização dos inóculos. ... 90
6.1.2.6 Determinação da concentração inibitória mínima. ... 90
6.1.2.7 Leitura dos resultados... 90
6.2. RESULTADOSEDISCUSSÃO ... 91
7. CONCLUSÕES ... 96
1. INTRODUÇÃO
A modificação molecular de um protótipo de fármaco pela introdução ou substituição de grupos e adição de moléculas a partir de uma estrutura primária, ainda constitui o meio principal na obtenção por novos princípios ativos. Estas variações estruturais conferem às moléculas novas propriedades físico-químicas e farmacocinéticas, tornando-as capazes de induzir respostas farmacológicas almejadas, com biodisponibilidade adequada ao seu emprego terapêutico (BARREIRO et. al., 2001; RATTI e TRIST, 2001;).
A síntese de fármacos é importante principalmente por permitir a construção de novas moléculas, em seus diversos níveis de complexidade. Sua aplicação na obtenção por novos protótipos representa uma grande parcela dos medicamentos disponíveis para uso clínico e movimenta elevadas cifras no mercado mundial (BARREIRO, 2002). Até 1991, entre os 866 fármacos usados na terapêutica, 680 (79%) eram de origem sintética. Os 186 restantes (21%) correspondiam àqueles de origem natural ou semi-sintética (VILELA et. al., 2007).
Observando a estrutura dos fármacos empregados na terapêutica, constata-se que 62% deles são heterocíclicos e nitrogenados. Adicionalmente, cerca de 30% dos fármacos de estrutura heterocíclica apresentam átomos de enxofre e 18% apresentam átomos de oxigênio (VILELA et. al., 2007). Estes valores ilustram a importância da química dos heterociclos, em que se incluem os compostos derivados da 6-nitro-2H-1,4-benzotiazin-3-ona, que têm sido foco de muitos estudos devido à grande variedade de atividades farmacológicas relatadas (GUPTA e OJHA, 1988).
FRINGUELLI et. al., 1998) , antiproliferativa (URAKAWA et. al., (a) 2000 e (b) 2002) e imunoestimulante (PITZURRA et. al., 1999; DEL CORONA et. al., 1992), eficiente atividade tranqüilizante (LAUBACH, 1962), importante atividade antitumoral (BRZOZOWSKI et. al., 2006; GUPTA et. al., 1993) atribuída à atividade citotóxica contra células neoplásicas (MARCHETTI et. al., 2002; INOUE et. al., 1998), eficácia anti-HIV (BRZOZOWSKI et. al., 2003), potente inibição da aldose-redutase - atividade hipoglicemiante (AOTSUKA et. al., 1994; TAWADA et. al., 1990), efeitos anti-reumáticos, atividade antialérgica (TAKIZAWA et. al., 2001), atividade vasorelaxante (TULLIO et. al., 2005; CECCHETTI et. al., 2003), efeitos antiarrítmicos (YOSHIKAWA et. al., 2003; HARA e NAKAYA, 1995) e antihipertensivos (CECCHETTI et. al., 2000). Uma potente atividade inibidora da 15-lipoxigenase também foi relatada, sendo atribuída a importância no uso para o tratamento de Doenças Pulmonares Obstrutivas Crônicas (BAKAVOLI et. al., 2007; SCHEWE, 2002). Estes derivados também induzem a efeitos neurotóxicos ou neuroprotetores (MARCHETTI et. al., 2002; SHEN e DRYHURST, 1996) e um possível efeito em doenças neurodegenerativas como Parkinson e Alzheimer está sendo investigado (OKUYAMA et. al., 2000; LI e DRYHURST, 1997; KOBAYASHI et. al., 1997).
N S
H O O2N
1
2
3
4 5
6 7
8 9
10
• Na posição 1, um átomo de enxofre;
• Na posição 2, um grupo metileno ativado pela presença da carbonila em C-3;
• Na posição 3, um grupo C = O que pode ser reduzido;
• Na posição 4, um grupo NH que pode ser alquilado;
• Na posição 6, um grupo nitro que pode ser reduzido a uma amina primária. Esta pode então ser substituída por grupos alquilas, lineares ou cíclicos.
2. OBJETIVOS
OBJETIVO GERAL:
Sintetizar e caracterizar os derivados da 6-nitro-2H-1,4-benzotiazin-3-ona e avaliar suas atividades farmacológicas.
OBJETIVOS ESPECÍFICOS:
1. Sintetizar os compostos 6-nitro-2H-1,4-benzotiazin-3-ona e seus derivados 4-metil-6-nitro-2H-1,4-benzotiazin-3-ona, amino-2H-1,4-benzotiazin-3-ona e amino-4-metil-2H-1,4-amino-2H-1,4-benzotiazin-3-ona e 6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona.
2. Caracterizar as propriedades físico-químicas e demonstrar as suas estruturas pelos métodos espectroscópicos de infravermelho, massas e ressonância magnética nuclear de H e do carbono 13. 3. Avaliar a toxicidade geral dos compostos sintetizados pela
determinação da Dose Letal Mediana (DL50) e atividade locomotora espontânea.
4. Realizar estudos farmacológicos para a avaliação dos efeitos antinociceptivos.
3. REVISÃO DA LITERATURA
3.1. SÍNTESE E REATIVIDADE DOS DERIVADOS BENZOTIAZÍNICOS
Dentre os compostos heterocíclicos, os benzotiazínicos apresentam um amplo espectro de atividade biológica. O núcleo benzotiazínico (Fig.1a) está presente em diversas moléculas biologicamente ativas, como no antipsicótico Protipendil (Fig. 2), comercializado principalmente na Alemanha (Dominal®) e no Reino Unido (Largophren®, Timoval®, Timovan® e Tolnate®).
As 1,4-benzotiazinas exibem um tipo de tautomerismo, pois existem nas formas isoméricas 2H e 4H, sendo o isômero 2H a forma predominante (Fig. 1b). Segundo Gupta e Ojha (1988), estes isômeros nunca foram isolados, mas observados como espécies transientes em solução, determinados por estudos de RMN 1H. A nomenclatura e o sistema de numeração para a 2H-1,4-benzotiazina e 4H-1,4-benzotiazina foram adotadas na edição de 1984 do Ring System Handbook (CHEMICAL ABSTRACTS PUBLICATION).
N S 1
2
3
4 5
6 7
8
N S 1
2
3
4 5
6 7
8
H
1 a 1 b
N S
N
N
Figura 2:Estrutura molecular do antipsicótico Protipendil (Tiofenilpiridilamina)
A 1,4 Benzotiazina (3a) é um análogo da fenotiazina (3b), resultante da troca do grupo o-fenileno por um grupo etilidênico (-CH=CH-) e possui algumas propriedades similares devido a características estruturais comuns.
N S
H
N S
H
3a 3b
Figura 3: Similaridade estrutural entre 1,4-benzotiazinas (3a) e fenotiazinas (3b) observadas ao longo do eixo nitrogênio-enxofre.
Vários métodos de obtenção das 2H-1,4-benzotiazinas e de seus derivados são descritos na literatura, sendo eles:
3.1.1. Síntese a partir do 2-aminotiofenol
i. Reação com 1,2-dihaloetano
SH
NH2 N
S
H
R + X - CH2 - CH2 - X R
X = Cl, Br R = H, substituintes
A condensação do 2-aminotiofenol com 1,2-dihaloetano em meio metanólico e em presença de metóxido de sódio conduz à formação da 2,3-diidro-1,4-benzotiazina (FLORIO et. al., 1982). WATANABE (1990) utilizou esse método em presença de iodetos e carbonatos de metais alcalinos obtendo o mesmo resultado.
ii. Reação com ácidos e ésteres α-halogenados
SH
NH2 N
S
H +
a) X = Br, R = Ph b) X = Cl, R = H
R
O
X R
COOH N
S
H R
LiAlH4
iii. Reação com ácidos e ésteres α,β-insaturados
SH
NH2
+
N S
H
CH2COOR CH - COOR
CH - COOR O
A reação do 2-aminotiofenol com ácidos e ésteres α,β-insaturados leva à formação das 1,4-benzotiazin-3-ona, substituídas na posição 2 (KIRCHNER e ALEXANDER, 1959; BOURDAIS, 1967).
3.1.2. Síntese a partir do ácido 2-nitro- ou 2-amino-feniltioglicólico
i. A partir do 2-nitrotiofenol
SH
NH2 NH2
SCH2COOR
+
N S
H O Cl - CH2 - COOR
R = H, C2H5
Redução
ii. A partir da 2-cloroanilina
Cl
NH2 NH2
SCH2COOH
+
N S
H O
HS - CH2 - COOH Sn + HCl
A ação do ácido tioglicólico sobre a 2-cloroanilina, em metanol sob refluxo e em presença de base, conduz ao ácido 2-aminofeniltioglicólico (IMPERIAL CHEMICAL INDUSTRIES LTDA., 1935). Esse ácido, quando tratado com ácido clorídrico concentrado, se desidrata conduzindo a 2H-1,4-benzotiazin-3-ona (MACKIE e RAEBURN, 1952).
iii. A partir do 2,4-dinitroclorobenzeno
Cl
NO2 NO2
SCH2COOH +
N S
H O HS - CH2 - COOH SnCl2 + HCl
O2N O2N H2N
3.1.3. Por extensão do ciclo
S
N NH2
SH
N S
H O
O2N O2N
NH2 - NH2, H2O ClCH2COOH
O2N CH
Diversos autores sintetizaram as benzotiazinas pela extensão do ciclo a partir de benzotiazóis substituídos. Pela ação da base, hidrato de hidrazina, o anel tiazólico se abre e forma o 2-aminotiofenol que, em presença do ácido monocloroacético, forma facilmente um anel tiazínico (MARTANI et. al., 1968).
3.1.4. Síntese a partir de dissulfetos de bis(o-nitrofenil)
N Y
O R2
R1
H
R1 NO
2
Y
SmI2/THF
R1 N(SmI
2)2
YSmI2
R2CH(X)Z
R1 = H, Cl; Y = S, Se; R2 = H, alquil, aril; Z = CO2H, COMe, CO2Et, CN
3.2. AVALIAÇÃO DA TOXICIDADE
A avaliação das possíveis propriedades tóxicas de quaisquer substâncias as quais o homem está exposto é de suma importância. No caso de substâncias de origem sintética, esta avaliação torna-se ainda mais necessária, pois o termo sintético normalmente é associado à efeitos adversos (PURCHASE et al, 1998; BLAAUBOER, 2003; COECKE et al, 2005; PRIETO et al, 2006).
O controle sobre a qualidade, segurança e eficácia dos medicamentos aumentou nas últimas décadas, impulsionado por trágicos episódios ocorridos no último século decorrentes dos efeitos indesejáveis atribuídos ao uso dos medicamentos. Episódios como o de 1937, que levou à morte dezenas de pessoas que utilizaram o Elixir de Sulfanilamida nos EUA, e o nascimento de crianças com focomelia no final da década de 50, pelo uso da Talidomida durante a gravidez, chamaram a atenção das autoridades regulatórias para a necessidade de se avaliar a segurança e a eficácia dos medicamentos liberados para o consumo humano (GOLDIM, 2007; GAVA, 2005; LIMA et. al., 2001)
A Lei de Alimentos, Medicamentos e Cosméticos dos Estados Unidos, aprovada em 1938, norteia as atividades de regulação da FDA - Food and Drug Administration (FDA, 1938), tendo sido aprovadas algumas emendas importantes a esta lei como a Emenda Kafauver-Harris, em 1962. Dentre as exigências estabelecidas pela referida Lei está a garantia de segurança dos medicamentos antes da comercialização. Os padrões de referência para a realização de ensaios clínicos foram estabelecidos pela FDA em 1970, sendo definidas exigências metodológicas como a necessidade de grupo controle e elaboração do protocolo de pesquisa permitindo proceder à análise quantitativa usando métodos estatísticos adequados (OLIVEIRA, 2001). A intervenção que se deseja avaliar é realizada em apenas um dos grupos (experimental) – o outro grupo (controle) é usado como padrão para a comparação dos resultados.
Segundo as legislações vigentes, um dos primeiros testes realizados para a avaliação do potencial tóxico de qualquer substância é o teste de toxicidade aguda. Através deste, a dose letal mediana (DL50) e outros efeitos tóxicos podem ser avaliados por diferentes vias em uma ou mais espécies, sendo os ratos e os camundongos usados com maior freqüência. (KRYSIAK e RYDZYNSKI, 1997; GUBBELS-VAN HAL et. al., 2005; STAMMATI et. al., 2005).
3.3. ATIVIDADES
FARMACOLÓGICAS DOS DERIVADOS
BENZOTIAZÍNICOS
Durante os últimos 25 anos observou-se um aumento progressivo de doenças invasivas e infecções sistêmicas causadas por fungos, sendo estas uma causa importante de letalidades, principalmente em pacientes imunodeprimidos (IMWIDTHAYA e POUNGVARIN, 2000; STEENBERGEN e CASADEVALL, 2000). Fatores iatrogênicos têm sido responsabilizados por este aumento na incidência de casos, tais como os tratamentos com fármacos imunossupressores em transplantados e doentes com câncer, a nutrição parental, o aumento do número de indivíduos com AIDS e o uso indiscriminado de antibióticos (ALVARADO et. al., 2002). A terapia atual utilizada contra essas infecções é afetada pela toxicidade relacionada aos medicamentos, interações medicamentosas, farmacocinética comprometida e ao desenvolvimento de resistências (MAERTENS e BOOGAERTS, 2000).
Estudos sobre relação estrutura-atividade para fármacos, realizados por Schiaffella e colaboradores (1999), demonstram que os derivados mais ativos para o tratamento de infecções causadas por fungos são aqueles que apresentam no núcleo benzotiazínico um grupo metila em N-4, uma cadeia lateral em C-6, C-7 ou C-8, e um grupo carbonila, enxofre como tioéter ou sulfóxido no C-3. A presença do substituinte azólico 1H-imidazol-1-il na cadeia lateral também influencia positivamente na atividade antifúngica (FRINGUELLI et. al., 2005).
para o tratamento é o metotrexato (GUBNER et. al., 1951), porém, este se acumula no interior das células como poliglutamato, ocasionando uma diminuição dos níveis de folatos, fator crucial para a ocorrência dos efeitos adversos. Para reduzir estes efeitos, Matsuoka e cols (1997), sintetizaram um novo derivado: N- {[4-[(2,4-diaminopteridin-6-il)metil]-3,4-dihidro-2H-1,4-benzotiazin-7-il]-Carbonil}-L-ácido homoglutâmico (MX-68). Este derivado foi criado focalizando a atividade antireumática, portanto, foi projetado para resistir à ação da folilpoliglutamato sintetase. A troca do resíduo glutamato do metotrexato por um homoglutamato e substituição do ácido aminobenzóico por um anel 1,4-benzotiazínico levou o composto a ser ativo (FRINGUELLI et. al., 2005).
confirmando a utilidade em tratamento de pacientes asmáticos (FRINGUELLI et. al., 2005).
Tawada e cols (1990) sintetizaram derivados tiolactâmicos das 1,4-benzotiazinas, possuindo grupos benzílicos em C-2. Esses compostos demonstraram potente atividade inibidora da enzima aldose redutase in vitro, porém não apresentaram atividades in vivo no princípio, sendo posteriormente notadas em compostos com substituintes ramificados em C-2 - como o grupo isopropílico (FRINGUELLI et. al., 2005). Em hiperglicemia, a enzima aldose redutase catalisa a conversão do excesso de glicose em sorbitol. O acúmulo intracelular de sorbitol causa o desenvolvimento de complicações do diabetes, tais como neuropatia, retinopatia, nefropatia e catarata (KADOR et. al.,1985).
Cecchetti e cols (1987) propuseram a troca da cadeia lateral na molécula de oxipropanolamina por um derivado da 1,4-benzotiazina para a obtenção de uma molécula que apresente propriedades β-bloqueadoras e diuréticas (GIFFORD e BORAZANIAN, 1989). Fringuelli e colaboradores (2005) introduziram a cadeia lateral 2-(4-cloro-3-sulfamoilbenzamido)-etil na molécula de oxipropanolamina modificada, mantendo a atividade β-bloqueadora (grupo 2-amidoetil) e acrescentando a atividade diurética pela molécula de o-clorobenzenosulfonamida. Estas modificações resultaram em uma eficácia no tratamento da hipertensão, que necessita de fármacos β-bloqueadores e diuréticos para um tratamento satisfatório.
como substituintes na posição N-4. Todos os compostos foram testados com o objetivo de avaliar a atividade vasodilatadora in vitro, comparando-se à levocromacalina, um enantiômero biologicamente ativo da cromacalina. A principal observação feita nesses estudos é que os compostos mais potentes são aqueles que possuem núcleo 1,4-benzotiazínico (FRINGUELLI et. al., 2005).
Com o objetivo de reduzir os efeitos adversos cardíacos, tais como falência cardíaca, bradicardia e assistolia, Fujita e cols (1990) mudaram o núcleo benzodiazepínico por um núcleo benzotiazínico nos medicamentos existentes no mercado utilizados para o tratamento de doenças como angina, hipertensão, doença cardíaca isquêmica e algumas arritmias (GIBSON et. al.,1986). Os compostos testados apresentaram potente atividade antagonista de canais de cálcio in vitro. Os íons cálcio são importantes componentes celulares, envolvidos na regulação de diversas funções das células e os níveis citosólicos de cálcio são controlados por diversos mecanismos. Em particular, os canais de cálcio voltagem-dependentes são importantes para regular o influxo de cálcio, fazendo com que os bloqueadores dos canais de cálcio sejam utilizados no tratamento para as doenças acima citadas.
3.4. ATIVIDADE ANTINOCICEPTIVA
Uma vez associada a diferentes condições patológicas, a dor representa o sintoma que mais causa sofrimentos aos pacientes, sendo também a principal razão pela procura do auxílio médico.
Pela dificuldade de um conceito definido e pelas muitas variações da dor, a IASP (International Association to Study of Pain) propôs o conceito sendo “uma experiência sensorial e emocional desagradável, relacionada com lesão tecidual real ou potencial, ou descrita em termos deste tipo de dano” (GAZDA, 2004; MERSKEY et al, 1979).
A dor, portanto, é composta por componentes dinamicamente articulados que, pela conceituação oficial, foram reconhecidos e devem sempre obedecer ao processo do movimento multifatorial e multidimensional, não devendo se acentuar a um único fator ou dimensão (PAUMGARTTEN, 2002).
Loeser e Black (1975) operacionalizaram a definição de dor em componentes: nocicepção, dor propriamente dita, sofrimento e comportamento doloroso. Segundo os autores, “nocicepção refere-se ao mecanismo pelo qual o dano tecidual, mecânico, térmico ou químico, excitando um nervo, inicia o processo que conduz a informação nociceptiva ao sistema nervoso central. Dor é a percepção do sinal no sistema nervoso”.
O cérebro modula a dor mediante vias eferentes inibitórias, de modo que a sensação dolorosa é a resultante dos processos antagônicos. Toda a atividade relaciona-se à presença de neurotransmissores e neuromoduladores, tanto nas vias aferentes (substância P, GABA, colecistocinina, somatostatina, encefalinas) quanto nas eferentes (acetilcolina, dopamina e encefalinas). Para dores leves e moderadas de natureza tegumentar e localização diversificada, associadas ou não a processo inflamatório periférico, são preferencialmente indicados os analgésicos não-opióides e, para as intensas, os opióides (WANNMACHER e FERREIRA, 1992).
3.5. AS CÉLULAS FÚNGICAS
Apenas uma minoria entre as 100.000 espécies de fungos existentes é patogênica ao homem. Um fungo é um eucariota definido pela ausência de organização tecidual e de clorofila. A célula fúngica é limitada por uma parede rígida de natureza celulósica ou quitinosa. As formas celulares esferoidais ou ovais são típicas dos fungos leveduriformes (leveduras) e possuem o diâmetro de 5 a 25 µm. As células tubulares ou filamentosas são características das hifas, que constituem os fungos filamentosos (bolores), podendo possuir o comprimento de 5 a 50 µm por um diâmetro de 2 a 5 µm. (MANUAL PRÁTICO DE MICROBIOLOGIA, 2006).
doença são as mais variadas, podendo ser subaguda, aguda ou crônica. O envolvimento pode ser localizado na boca, garganta, couro cabeludo, vagina, dedos, unhas, brônquios, pulmões, trato gastrointestinal ou generalizado, como na septicemia, endocardite e meningite (TEIXEIRA e MEZZARI, 2005).
Figura 4: Morfologia de algumas das espécies de Candida: a) Candida albicans; t) Candida tropicalis; k) Candida krusei e p) Candida parapsilosis.
Candida albicans é o patógeno mais comum nas candidíases cutâneas e da orofaringe, porém as espécies não-albicans têm aumentado em número e em importância nas candidíases vaginal e sistêmica (REX et al, 2000). A variabilidade comportamental das diferentes espécies de Candida criou a necessidade de desenvolvimento de métodos rápidos e fáceis para sua identificação, assim como no desenvolvimento de novos agentes antifúngicos. Muitas das espécies não albicans mais comumente isoladas são menos susceptíveis aos derivados azólicos, dificultando o tratamento dessas infecções.
Figura 5: Morfologia da Candida albicans: A) Representação esquemática; B e C) Aspecto microscópicos, visualizando os clamidosporos e as pseudohifas.
Figura 6: Morfologia da Candida krusei: A) Representação esquemática; B e C) Aspecto microscópicos, visualizando os clamidosporos e as pseudohifas.
Figura 7: Morfologia da Candida parapsilosis: A) Representação esquemática; B e C) Aspecto microscópicos, visualizando os clamidosporos e as pseudohifas.
Figura 8: Morfologia da Candida tropicalis: A) Representação esquemática; B e C) Aspecto microscópicos, visualizando os clamidosporos e as pseudohifas.
B
A C
B
A C
B
A C
B
A C
3.6. OS FÁRMACOS ANTIFÚNGICOS
Os fármacos antifúngicos disponíveis ainda são em número limitado, sendo que as principais famílias de antifúngicos compreendem os poliênicos, azólicos, tiocarbamatos, alilaminas, derivados morfolínicos, 5-fluorcitosina e griseofulvina. Os agentes antifúngicos, na sua maioria, produzem efeitos tóxicos devido aos fungos compartilharem o caráter eucariota com a célula do hospedeiro humano, com conseqüentes similaridades bioquímicas e fisiológicas que limitam ação terapêutica (CATALÁN e MONTEJO, 2006; ODDS, 2003). Os iodetos foram as primeiras substâncias utilizadas na terapia antifúngica, tanto nos homens quanto nos animais, especialmente no tratamento da esporotricose, representando uma alternativa eficaz e de baixo custo. Porém, os preparados contendo iodo tiveram seu uso limitado devido aos freqüentes efeitos tóxicos, especialmente na espécie felina (COSKUN et al., 2004).
O fluconazol, antifúngico do grupo dos triazóis, surgiu como uma alternativa terapêutica eficaz, com reduzidos efeitos colaterais em relação aos outros antifúngicos (PIERAD et al., 2000). As vantagens relacionadas ao fármaco levaram ao intenso uso para o tratamento da aspergilose, histoplasmose e blastomicose, ampliando, posteriormente, o seu espectro de ação frente a diversas espécies de fungos patogênicos (SCHUBACH et al., 2004; ROCHETTE et al., 2003). Atualmente o fluconazol é bastante utilizado, porém, devido ao uso indiscriminado, freqüentes relatos de fungos resistentes têm sido observados, ocasionando, em conseqüência, falhas terapêuticas e remissão de enfermidades micóticas (CATALÁN e MONTEJO, 2006; KAUFFMAN et al., 2000).
sistêmicas. O fármaco apresenta natureza lipofílica e queratofílica, levando ao seu acúmulo no tecido adiposo e queratinoso. Devido a essas características é considerado o antifúngico de eleição para o tratamento das dermatofitoses e onicomicoses (DARKES et al., 2003; JESSUP et al., 2000; HAY, 1999; PEREZ, 1999; RYDER, 1999).
O fluconazol e a terbinafina possuem entre si particularidades relacionadas ao mecanismo de ação e toxicidade que devem ser consideradas. Ambos agem inibindo enzimas envolvidas com a síntese do ergosterol, porém a terbinafina atua mais precocemente na cadeia da biossíntese tendo um efeito primário fungicida, enquanto o fluconazol provoca a inibição de enzimas dependentes do citocromo P-450, com efeito, primariamente fungistático (MEINERZ et. al., 2007).
3.7. MÉTODOS DE AVALIAÇÃO DA ATIVIDADE ANTIMICROBIANA
Uma variedade de métodos é empregada para avaliar, in vitro, compostos com potencial antimicrobiano. Os principais métodos encontrados na literatura, tanto para detecção da atividade de bactérias quanto para fungos e leveduras, são classificados por três tipos de ensaios: bioautográficos, de difusão e de diluição (RIOS et al, 1988).
Os ensaios de difusão fundamentam-se no transporte da substância-teste para um meio de cultura sólido e inoculado com o microrganismo desejado. Diferentes tipos de reservatórios podem ser empregados incluindo discos de papel, cilindros de porcelana ou de aço inoxidável e orifícios feitos no meio de cultura. Nestes reservatórios são formados halos, e o que não acusar o crescimento do microrganismo é denominado halo de inibição (VANDENBERGHE e VLIETINCK, 1991).
Os ensaios de diluição são aqueles nos quais os extratos ou substâncias a serem testadas são adicionados a um meio de cultura líquido, previamente inoculado com o microrganismo teste. Após incubação, o crescimento do microrganismo é determinado pela leitura visual direta ou pela leitura em espectrofotômetro, com λ apropriado (VANDENBERGHE e VLIETINCK, 1991).
O método de diluição em meio líquido é o que apresenta metodologia mais complicada, entretanto é o mais sensível. Esse método é recomendado na determinação da concentração inibitória mínima - CIM (RIOS et al., 1988). A CMI é a menor concentração do agente antimicrobiano capaz de inibir completamente o crescimento do microrganismo em tubos ou placas de microdiluição (NCCLS, 2003).
avaliada pelo diâmetro de crescimento das colônias de fungos. A porcentagem de inibição é calculada pela equação:
Sendo I = inibição, C = medida do diâmetro de crescimento do fungo no meio controle e T = medida do diâmetro de crescimento do fungo no meio contendo a substância (TUBEROSO et al., 2005).
Outro método descrito para avaliação da atividade antifúngica é a determinação da concentração fungicida mínima - CFM e diluição em caldo RPMI-1640 em placas de microtítulo para determinação da CMI (NCCLS, 2003).
Na determinação da CFM utiliza-se a técnica de filtração de membrana. O inóculo é adicionado à substância, e essa mistura é mantida à temperatura ambiente por um determinado tempo. Após este contato, a mistura é transferida para um aparelho de filtração esterilizado, lavado por duas vezes com solução neutralizante (água destilada e Tween). As membranas são transferidas para placas contendo ágar e, após incubação, as colônias são contadas. A CFM corresponde à menor concentração da substância capaz de inibir a multiplicação de fungos (MATSUMOTO, 2006).
4. SÍNTESE DOS DERIVADOS DA 6-NITRO-2
H
-1,4-
BENZOTIAZIN-3-ONA
4.1. METODOLOGIA
4.1.1. MATERIAIS
4.1.1.1 Equipamentos
A pureza dos compostos foi controlada por cromatografia em camada delgada (CCD), utilizando placas de vidro com 0,25 mm de espessura, revestida com o adsorvente sílica GF254. As placas foram reveladas em luz ultravioleta (254 nm) em um gabinete próprio para revelação e/ou em cuba saturada com vapor de iodo.
Os espectros de infravermelho foram obtidos em espectrofotômetro de absorção no infravermelho (FT-IR) Nicolet, modelo Impact 410, acoplado a um microcomputador Pentium 233 MHz, HD = 2,4 Gb, RAM = 32 Mb com software compatível, instalado no Departamento de Química da Universidade Federal de Ouro Preto.
Os espectros de ressonância magnética nuclear foram registrados por espectrômetros Bruker DPX 200 AVANCE, 200 MHz, do Laboratório de Ressonância Magnética Nuclear de Alta Resolução da Universidade Federal de Minas Gerais - UFMG, em Belo Horizonte, Minas Gerais.
A faixa correspondente à temperatura de fusão dos derivados foi determinada em tubos capilares no aparelho Buchi 510.
4.1.1.2 Solventes e Reativos
Foram utilizados os seguintes solventes e reagentes:
- 2-cloro-5-nitro-anilina - Aldrich - Acetato de etila: Merck
- Ácido acético glacial: Merck - Ácido clorídrico: Merck
- Ácido monocloroacético: Merck - Água destilada
- Álcool etílico (Etanol): Merck - Cloreto de benzoíla: Merck
- Cloreto de estanho dihidratado: Merck - Clorofórmio: Merck
- Dimetilsulfóxido (DMSO): Synth - Enxofre: Nuclear
- Éter etílico: Merck
- Hidróxido de potássio: Merck - Hidróxido de sódio: Nuclear - Iodeto de metila: Merck - Sílica gel GF254: Merck
4.1.2. MÉTODOS
4.1.2.1 Síntese do composto 6-nitro-2H-1,4-benzotiazin-3-ona
A obtenção do composto de partida, 6-nitro-2H-1,4-benzotiazin-3-ona foi realizada em três etapas: Inicialmente obteve-se o 2-amino-4-tiofenolato e, após reação com ácido monocloroacético em meio básico, formou o ácido feniltioglicólico, que em meio ácido perdeu água e ciclizou-se em 6-nitro-2H-1,4-benzotiazin-3-ona.
Cl
NH2
O2N
SNa
NH2 O2N
Na2S
S
1) ClCH2COOH/OH
-2) H+ N
S
O O2N
H
i. Síntese do 2-amino-4-nitrotiofenolato de sódio
(FRIES et al, 1927)
Cl
NH2
O2N
SNa
NH2
O2N
Na2S.9H2O + S
ii. Síntese da 6-nitro-2H-1,4-benzotiazin-3-ona
(GRANDOLINI et al, 1986)
SNa
NH2 O2N
1) ClCH2COOH/OH
-2) H+ N
S
O O2N
H
Em um balão de 50 mL adicionou-se, em pequenas quantidades, uma solução eqüimolar de ácido monocloroacético (0,95 g;10 mmol) e hidróxido de sódio (0,4 g; 10 mmol) em 40 mL de água destilada. A mistura foi mantida em reação por 30 min, sob agitação. Ao resfriar, tratou-se a solução com 1 mL de ácido clorídrico concentrado. Após 15 minutos à temperatura de 60°C, filtrou-se a mistura à quente.
O composto foi purificado por recristalização em etanol a 95%.
Tabela 1: Características físico-químicas da 6-nitro-2H-1,4-benzotiazin-3-ona.
6-nitro-2H-1,4-benzotiazin-3-ona
Fórmula molecular C8H6N2O3S
Massa Molecular 210,21
Faixa de Fusão (°C):
- Experimento 241-244
N S
O O2N
H
BTZ-1
- Literatura 243-244
4.1.2.2 Redução do grupo nitro: síntese da
6-amino-2H-1,4-benzotiazin-3-ona
(OKUJIMA et al, 1990)
N S
O O2N
H
N S
O H2N
H
SnCl2
HCl
Foram solubilizados, em um balão de 50 mL, 16 mmol (3,72 g) de cloreto de estanho dihidratado (SnCl2.2H2O) em 4 mL de ácido clorídrico concentrado. A mistura foi mantida em banho de gelo por 10 minutos. Foram adicionados 3,5 mmol (0,736 g) de 6-nitro-2H-1,4-benzotiazin-3-ona em pequenas partes, conservando constante a agitação por 15 minutos. Gradativamente, aumentou-se a temperatura ao refluxo (T≈90°C), sendo mantida por duas horas. Após resfriamento, a mistura foi filtrada. O precipitado obtido foi suspenso em água e alcalinizado a pH=10 pelo tratamento com NaOH 20%, que liberou a amina.
O composto foi purificado por recristalização em H2O.
Tabela 2: Características físico-químicas da 6-amino-2H-1,4-benzotiazin-3-ona.
6-amino-2H-1,4-benzotiazin-3-ona
Fórmula molecular C8H8N2OS
Massa Molecular 180,23
Faixa de Fusão do cloridrato:
- Experimental (°C): 228-230
N S
O H2N
H
4.1.2.3 N-metilação: síntese da 6-nitro-4-metil-2H-1,4-benzotiazin-3-ona
(NGADI et al, 1990)
N S
O O2N
H
N S
O O2N
CH3
CH3I
+ KOH
Uma solução contendo 5 mmol (1,05 g) de 6-nitro-2H-1,4-benzotiazinona em DMSO/EtOH (10/12,5 mL) foi mantida sob agitação à temperatura ambiente por 10 min em presença de 10mmol (0,56 g) de hidróxido de potássio. Gota a gota, adicionaram-se 10 mmol de iodeto de metila, mantendo a reação sob forte agitação a 50°C, por aproximadamente 17 h. Após resfriamento, o composto precipitou-se quando adicionado a gelo triturado. O derivado metilado foi separado por filtração.
O composto foi purificado por recristalização em etanol a 95%.
Tabela 3: Características físico-químicas da 6-nitro-4-metil-2H-,4benzotiazin-3-ona.
6-nitro-4-metil-2H-1,4-benzotiazin-3-ona.
Fórmula molecular C9H8N2O3S
Massa Molecular 224,23
Faixa de Fusão:
- Experimental (°C): 181-183 N
S
O O2N
CH3
BTZ-2
4.1.2.4 Redução do grupo nitro: síntese da
6-amino-4-metil-2H-1,4-benzotiazin-3-ona
(CECCHETTI et al, 1984)
N S
O O2N
H
N S
O H2N
CH3 SnCl2
HCl
Em um balão de 50 mL, foram solubilizados 16 mmol (3,72 g) de cloreto de estanho dihidratado (SnCl2.2H2O) em 4 mL de HCl concentrado. Após resfriamento, foram adicionados 3,5 mmol (0,785 g) de 6-nitro-4-metil-2H-1,4-benzotiazin-3-ona em pequenas porções, mantida a mistura sob agitação constante em banho de gelo por 15 min. Gradativamente, aumentou-se a temperatura até refluxo (T≈90°C), mantendo-a por duas horas e, após resfriamento, filtrou-se, o precipitado formado. O composto foi isolado sob a forma de cloridrato. A amina foi liberada pela suspensão em H2O e tratamento com NaOH 20% até pH=10. O precipitado foi lavado com água até neutralização do pH da água de lavagem.
O composto foi purificado por recristalização em H2O.
Tabela 4: Características Físico-Químicas da 6-amino-4-metil-2H-1,4-benzotiazin-3-ona.
6-amino-4-metil-2H-1,4-benzotiazin-3-ona
Fórmula molecular C9H10N2OS
Massa Molecular 194,25
Faixa de Fusão do cloridrato:
- Experimental (°C): 226- 227
N S
O H2N
CH3
4.1.2.5 Benzoilação da amina: síntese do
6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona.
(VOGEL, 1989)
N S
O H2N
CH3
N S
O HN
CH3 C
+
O Cl
NaOH
O C6H5
Uma suspensão de 5 mmol (0,971 g) de 6-amino-4-metil-2H-1,4-benzotiazin-3-ona em 10 mL de hidróxido de sódio a 5% p/v, foi tratada com 10 mL de cloreto de benzoila. A mistura foi agitada por 15 minutos à temperatura ambiente e, em seguida, foram adicionados 5 mL de água. O composto acilado precipitou-se e foi separado por filtração e lavado com água.
Purificou-se o composto por recristalização em etanol 95%.
Tabela 5: Características físico-químicas da 6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona.
6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona
Fórmula molecular C16H14N2O2S
Massa Molecular 298,36
Faixa de Fusão:
- Experimental (°C): 189-191 N
S
O HN
CH3 C
O C6H5
4.2. RESULTADOS E DISCUSSÃO
4.2.1. Via Sintética
O esquema geral de síntese dos derivados 2H-1,4-benzotiazínicos está apresentado abaixo:
Cl
NH2
O2N
SNa
NH2
O2N
Na2S
S 1) ClCH2COOH/OH
-2) H+
N S
O O2N
H N
S
O H2N
H
SnCl2
H+
CH3 OH
-N S
O O2N
CH3 N
S
O H2N
CH3
SnCl2
H+
OH
-C6H5COCl
N S O CH3 HN COPh
BTZ 1
BTZ 1R
BTZ 2
BTZ 2R
BTZ 3
(a) (b) (c) (d) (e) (f) (g)Figura 9: Representação esquemática da síntese dos derivados: (a) 2-cloro-5-nitroanilina; (b) 2-amino-4-nitrotiofenolato de sódio; (c) 6-nitro-2H-1,4-benzotiazin-3-ona; (d) 6-amino-2H -1,4-benzotiazin-3-ona; (e) 4-metil- 6-nitro-2H-1,4-benzotiazin-3-ona; (f) 4-amino-6-nitro-2H -1,4-benzotiazin-3-ona; (g) 4-benzoilamino-6-nitro-2H-1,4-benzotiazin-3-ona.
4.2.2. Obtenção do composto de partida: 6-nitro-2H
-1,4-benzotiazin-3-ona
A via sintética para esta reação compreendeu três etapas. Inicialmente obteve-se o 2-amino-4-nitrotiofenol (ou 2-amino-4-nitrobenzenotiol), pela reação entre a 2-cloro-5-nitroanilina e o sulfeto de sódio misturado com enxofre. Na segunda etapa, o 2-amino-4-nitrobenzenotiol em presença do ácido monocloroacético levou à formação do ácido feniltioglicólico. Este, em meio ácido, perdeu uma molécula de água e ciclizou-se originando o composto 6-nitro-2H-1,4-benzotiazin-3-ona, representado neste trabalho por BTZ-1.
Na primeira etapa da reação, a substituição do átomo de halogênio (cloro) no anel aromático se dificulta quando a molécula não se fecha com a função ativadora. Em contrapartida, esta substituição é favorecida pela presença de um grupo nitro em orto ou pára. O grupo nitro exerce um forte efeito desativante do anel. Assim, o cloro presente em 2-cloro-5-nitroanilina pôde ser substituído por um grupo SH, apesar da presença do grupo amina exercer um efeito doador de elétrons (GUARDA, 1998).
O2N
NH2
Cl
SH
NH
2O
2N
1
2
3 4 5
6
A caracterização do composto 2-amino-4-nitrobenzenotiol não foi realizada, visto que se realizou a reação sem a separação do mesmo. Mas, a caracterização através de espectrometria no infravermelho e pela espectrometria de ressonância magnética nuclear de H foi relatada por Guarda, 1998, durante a obtenção da 6-nitro-2H-1,4-benzotiazin-3-ona.
Tabela 6: Caracterização do composto 2-amino-4-nitrobenzenotiol pela espectrometria no IV e RMN 1H, segundo Guarda (1998).
2-amino-4-nitrobenzenotiol
IV (KBR 1%) RMN 1H (∆ PPM / DMSO-D6)
NH2 6.20 (S)
ν NH2 3400 E 3310 CM -1
H1 3.40 (S)
ν NO2 1500, 1340 E 740 CM -1
H3 7.56 (D)
ν SH 2540 CM-1 H5 7.26 (DD)
H6 7.34 (D)
4.2.3. A metilação do nitrogênio da posição 4
A síntese para esta reação ocorreu em aproximadamente 17 horas. O composto de partida, 6-nitro-2H-1,4-benzotiazin-3-ona, juntamente com KOH, reagiu com iodeto de metila (iodometano) em uma mistura de EtOH e DMSO. O iodeto de metila foi utilizado por ser um excelente reagente para metilação.
A base KOH utilizada atuou na remoção do próton ácido formando o ânion, que serviu como um nucleófilo na substituição SN2 e permitiu a posterior alquilação com iodeto de metila. O composto alquilado, 6-nitro-4-metil-2H-1,4-benzotiazin-3-ona, foi representado neste trabalho por BTZ-2.
N S
O O2N
H
N S
O O2N
CH3
N S
O O2N
K
N S
O O2N
K
+ KOH EtOH / DMSO
H2C IH
4.2.4. A redução do grupo nitro
amina segundo a reação de redução que utiliza o cloreto de estanho em meio ácido:
N S
O O2N
H
N S
O H2N
R
SnCl2
HCl
R = H, CH3
4.2.5. Acilação da amina primária.
O composto 6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona foi sintetizado através da reação de Schotten-Baumann, uma reação de benzoilação de aminas aromáticas. Quando benzoilado, o par de elétrons do nitrogênio fica deslocado entre os dois grupos aromáticos, tornando o hidrogênio mais ácido e permitindo dessa forma a sua substituição por grupos alquilas, por exemplo. O composto benzoilado foi representado neste trabalho por BTZ-3.
N S
O H2N
CH3 C Cl O N S O H2N
CH3 C Cl O N S O H2N
4.3. ESTRUTURAS E PROPRIEDADES FÍSICO-QUÍMICAS
Os derivados benzotiazínicos sintetizados, cujas fórmulas estruturais foram representadas nas figuras 10 a 14, foram previamente identificados devido às características físicas e químicas, como estado físico, coloração, faixa de fusão (ºC) e fator de retenção para CCD, confirmando suas purezas.
N S
O O2N
H
Figura 10: (a)Fórmula estrutural e (b) tridimensional (modelo de bolas) do BTZ-1
N S
O H2N
H
Figura 11: (a)Fórmula estrutural e (b) tridimensional (modelo de bolas) do BTZ-1R
N S
O O2N
CH3
Figura 12: (a)Fórmula estrutural e (b) tridimensional (modelo de bolas) do BTZ-2
N S
O H2N
CH3
Figura 13: (a)Fórmula estrutural e (b) tridimensional (modelo de bolas) do BTZ-2R
N S
O CH3 HN
COPh
Observando a tabela 7, verifica-se a influência do grupo nitro na coloração dos compostos obtidos que, devido à redução, passaram de amarelo a branco. Observa-se também uma influência da redução do grupo nitro na faixa de fusão e no fator de retenção cromatográfico.
4.4. CARACTERIZAÇÃO POR ESPECTROMETRIA DE IV
Evidenciaram-se, através da espectrometria no infravermelho, as bandas de absorção características dos grupos funcionais presentes nos compostos sintetizados.
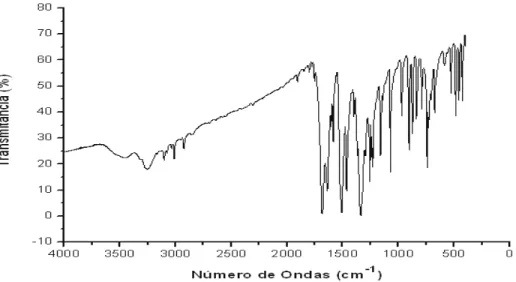
4.4.1. 6-nitro-2H-1,4-benzotiazin-3-ona
A análise das vibrações de deformação das carbonilas mostrou uma banda de absorção na região compreendida entre 1720 e 1690 cm-1. Observou-se uma freqüência de absorção entre 3180 e 3200 cm-1 referente à deformação axial N-H. Entre 1347 e 1510 cm-1, observou-se a absorção da vibração característica do grupo nitro. Os valores encontrados estão de acordo com os dados da literatura (tabela 8).
Tabela 8: Características de infravermelho para o BTZ-1 (ν cm-1, KBr 1%)
6-nitro-2h-1,4-benzotiazin-3-ona
EXPERIMENTAL LITERATURA*
ν 4-NH 3200 - 3180 3320
ν 3-CO 1720 - 1690 1680
ν 6-NO2 1510 E 1347 1510, 1340, 740
Figura 15: Espectro de absorção no Infravermelho da 6-nitro-2H-1,4-benzotiazin-3-ona
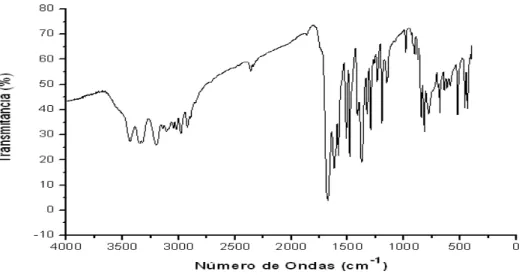
4.4.2. 6-amino-2H-1,4-benzotiazin-3-ona
A análise das vibrações de deformação das carbonilas mostrou uma banda de absorção na região compreendida entre 1720 e 1680 cm-1. Observou-se uma freqüência de absorção entre 3180 e 3200 cm-1 referente à deformação axial do N-H. As bandas características de NH2 aparecem em torno de 3400 a 3380 cm-1. Ao compararmos com o BTZ-1, observa-se o desaparecimento das bandas características do grupo nitro. Os dados da literatura confirmam as características obtidas (SOUZA et al.; 2006).
Tabela 9: Características de infravermelho para o BTZ-1R (ν cm-1, KBr 1%).
6-amino-2h-1,4-benzotiazin-3-ona.
EXPERIMENTAL LITERATURA*
ν 4-NH 3330 - 3250 3349 -3201
ν 3 - CO 1720 -1680 1678,1623
ν 6 –NH2 3430 - 3380 3442
Figura 16: Espectro de absorção no Infravermelho da 6-amino-2H-1,4-benzotiazin-3-ona
4.4.3. 6-nitro-4-metil-2H-1,4-benzotiazin-3-ona
Verificou-se a alquilação do BTZ-1 pelo desaparecimento das bandas características para a ligação N-H e pela presença da banda de absorção característica do grupo metila.
Tabela 60: Características de infravermelho para o BTZ-2 (ν cm-1, KBr 1%). 6-nitro-4-metil-2h-1,4-benzotiazin-3-ona.
EXPERIMENTAL LITERATURA*
ν 3-CO 1690 1690
ν 6 -NO2 1510, 1340, 745 1510, 1340, 745
ν4-N-CH3 2940 2940
Figura 17: Espectro de absorção no Infravermelho da 6-nitro-4-metil-2H-1,4-benzotiazin-3-ona
4.4.4. 6-amino-4-metil-2H-1,4-benzotiazin-3-ona
Nas características do infravermelho para a 6-amino-4-metil-2H-1,4-benzotiazin-3-ona, evidencia-se a redução do grupo nitro pelo desaparecimento de suas bandas características e o surgimento do grupo amino primário através das bandas entre de 3350-3450 cm-1.
Tabela 11: Característica de infravermelho para o BTZ-2R (ν cm-1, KBr 1%).
6-amino-4-metil-2h-1,4-benzotiazin-3-ona.
EXPERIMENTAL LITERATURA*
ν CH3 2900 2900
ν 3-CO 1655 1655
ν 6 -NH2 3430, 3340 3430, 3380
Figura 18: Espectro de absorção no Infravermelho da 6-amino-4-metil-2H-1,4-benzotiazin-3-ona
4.4.5. 6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona
Ao analisar o espectro de infravermelho da 6-benzoilamino-4-metil-2H-1,4-benzotiazin-3-ona observa-se o desaparecimento das bandas características de aminas primárias e o aparecimento de bandas características da carbonila da função acila e da função NH.
Tabela 12: Características de infravermelho para o BTZ-3 (ν cm-1, KBr 1%).
6-benzoilamino-4-metil-2h-1,4-benzotiazin-3-ona.
EXPERIMENTAL LITERATURA*
ν NH 3280 3300
ν CO ACILA 1690 1675
ν CO LACTAMA 1640 1645
ν CH3 2840 2800
4.5. CARACTERIZAÇÃO POR ESPECTROMETRIA DE RMN
1H.
Pela espectrometria de ressonância magnética nuclear protônica, verificaram-se os deslocamentos característicos referentes aos prótons presentes nas estruturas dos derivados da 6-nitro-2H-1,4-benzotiazin-3-ona, identificando as moléculas pela comparação com os dados publicados na literatura.
O espectro foi realizado em CDCl3 (BTZ-1) e DMSO-d6 (BTZ-1R, BTZ-2, BTZ-2R e BTZ-3). Os deslocamentos químicos foram expressos em ppm.
4.5.1. 6-nitro-2H-1,4-benzotiazin-3-ona
Os dados observados estão apresentados na tabela 13. Pela comparação destes dados com os relatados na literatura, espectrofotômetro Varian HA-100 por Martani e cols (1968), a estrutura do composto BTZ-1 pôde ser identificada.
Observa-se a influência do grupo nitro no deslocamento dos H das posições 5, 7 e 8.
N S
O O2N
H 3.72 8.0 7.83 7.41 8.47 N S O O2N
H 1 2 3 4 5 9 7 8 10 6 0 1 2 3 4 5 6 7 8 PPM
Tabela 13: Deslocamentos químicos de H registrados para a 6-nitro-2H-1,4-benzotiazin-3-ona. Prótons δ (ppm) experimental δ (ppm) literatura
H2 3,72 (s) 3,57
H4 8,0 (s) 10,88
H5 8,47 (d) J = 2,3 Hz 7,74
H7 7,83 (dd) J = 9,2 Hz e J = 2,3 Hz 7,78
H8 7,41 (d) J = 9,2 Hz 7,56
* MARTANI et al., 1968
4.5.2. 6-amino-2H-1,4-benzotiazin-3-ona
Para a 6-amino-2H-1,4-benzotiazin-3-ona observa-se que os prótons 5, 7 e 8 apresentam seus deslocamentos em campos mais altos, devido a ausência da influência do grupo nitro. Evidencia-se o aparecimento dos sinais para os prótons da amina primária (Tabela 14). A diferença entre os valores experimentais e da literatura para os hidrogênios ligados ao nitrogênio foi observada, mas os deslocamentos são coerentes.
N S O NH2 H 6.91 6.10 6,74 8.0 3,71 4.0 N S O NH2 H 1 2 3 4 5 9 7 8 10 6 0 1 2 3 4 5 6 7 8 PPM
Tabela 14: Deslocamentos químicos protônicos registrados para a 6-amino-2H-1,4-benzotiazin-3-ona
(δ ppm /DMSO-d6).
Prótons Experimental Literatura*
H2 3,71 (s) 3,30 (s)
H4 8,00 (s) 10,22(s)
H5 6,74 (d) J = 1,5Hz 6,23 (d)
NH2 4,00 (s) 5,14 (s)
H7 6,10 (dd) J = 9,3 e 2,7 Hz 6,21 (dd) H8 6,91 (d) J = 8,4 Hz 6,90 (d) *SOUZA et al. , 2006
4.5.3. 6-nitro-4-metil-2H-1,4-benzotiazin-3-ona
Para o 6-nitro-4-metil-2H-1,4-benzotiazin-3-ona observa-se que os prótons das posições 5, 7 e 8 sofreram a influência do grupo nitro e os seus deslocamentos se localizaram em campos mais baixos, próximos de 8,0 ppm. Os prótons do grupo metila em posição 4 foi evidenciado.
N S
O O2N
CH3
N S
O O2N
CH3 1 2 3 4 5 9 7 8 10 6 7.49 8.07 7.93 2.78 3.71 0 1 2 3 4 5 6 7 8 PPM