Recebido para publicação: Julho de 2009 • Aceite para publicação: Novembro de 2009 Received for publication: July 2009 • Accepted for publication: November 2009
1405
Terapêutica redutora intensiva do
colesterol: a certeza da segurança
[95]
PEDROMARQUES DASILVA
Consultor de Medicina Interna e Especialista de Farmacologia Clínica
Coordenador do Núcleo de Investigação Arterial e responsável da Consulta de Hipertensão Arterial e Dislipidemias da Unidade Funcional Medicina IV do Hospital de Santa Marta – Centro Hospitalar de Lisboa Central, EPE, Lisboa, Portugal
Rev Port Cardiol 2010; 29 (09): 1405-1418
RESUMO
A terapêutica antidislipidémica redutora do colesterol é um paradigma da melhor aplicação da evidência científica na prática clínica. Face às opções disponíveis, é fundamental que as estatinas tenham um perfil claro de segurança e tolerabilidade e uma relação de benefícios e risco favorável. A terapêutica intensiva do colesterol não está associada a consequências deletérias, dependentes da maior eficácia, ou a efeitos laterais graves. As estatinas não são hepatotóxicas. A
flutuação enzimática é um fenómeno corrente na dislipidemia. O risco de aumento das transamínases está directa e intimamente relacionada com a dose (e com o tipo de estatina usada). Alterações pouco importantes do perfil hepático basal não são uma contra-indicação ao seu uso (doentes com um risco cardiovascular justificável). A monitorização iterada do perfil hepático não está justificada. A causa da miotoxicidade com as estatinas não está devidamente esclarecida. O risco de miopatia ou rabdomiólise não tem relação com a redução percentual ou absoluta do LDL-C (nem com o valor de LDL-C alcançado). Os efeitos adversos das estatinas podem depender das características físico-químicas da molécula e das suas características
Intensive cholesterol drug lowering: how to be sure about their safety ABSTRACT
Cholesterol drug lowering is a paradigm on how to best apply clinical evidence to clini-cal practice. Considering the available options, it is essential that statins have a clear safety and tolerability profile and a favourable benefit/risk relationship. Intensive cholesterol drug lowering is not associated with deleterious consequences, dependent on a greater efficacy or on seri-ous side effects.
Statins are not hepatotoxic. Enzyme fluctua-tion is common in dyslipidemia. The risk of increased transaminases is directly and closely related to the dosage (and type of statin used). Minor changes in baseline liver profile are not regarded as contraindications to their use (in patients with a cardiovascu-lar justifiable risk). Iterative monitoring of the liver profile is not necessary. The etiolo-gy of miotoxicity with statins is not com-pletely clear. The risk of myopathy or rhab-domyolysis is not related to the absolute or percent change in the LDL-C (or with the achieved LDL-C value).
The adverse effects of statins may depend on the physical and chemical characteristics of the molecule and its pharmacokinetic characteristics. On a pharmacovigilance
A
terapêutica antidislipidémica redutora do colesterol e os benefícios clínicos resul-tantes são um paradigma da melhor aplicação da evidência científica na prática clínica. Assente em bases bioquímicas e experimen-tais, ajustada em certezas clínicas e genéticas, ajuizada em estudos epidemiológicos rele-vantes, a intervenção hipolipemiante viu con-firmada as suas convicções em dezenas de estudos aleatorizados de intervenção(1-3), que acolocaram, em definitivo, num lugar decisivo na medicina cardiovascular dos últimos anos. Intimamente relacionados, estes processos decorreram, em paralelo, com o desenvolvi-mento das estatinas (inibidoras da síntese endógena do colesterol), a estratégia compro-vadamente mais efectiva e capaz na aborda-gem terapêutica do doente com dislipidemia e risco cardiovascular comprovado(4).
Os estudos clínicos sublinharam a íntima relação entre a maior redução do colesterol das LDL (LDL-C), a não progressão/regressão
da doença aterosclerótica(5-7)e a superior
dimi-nuição do risco de eventos cardio e cerebro-vasculares(8-11). Uma meta-análise recente, com
mais de 90 000 indivíduos tratados com es-tatinas(12), mostrou que a redução de 40 mg/dl
de LDL-C, durante cinco anos, determina uma redução do risco relativo de mortalidade total (12%), com resultados comparáveis na mor-talidade coronária e enfarte do miocárdio (23%), revascularização coronária (24%), aci-dente cerebrovascular fatal e não fatal (17%) e qualquer evento maior cardiovascular (21%), sem diferenças na mortalidade por outras cau-sas (incluindo o cancro e o acidente vascular hemorrágico)(13).
Estes e outros resultados sustentaram que, em 2004, o National Cholesterol Education
Program Adult Treatment Panel (NCEP)
alvitrasse, como objectivo terapêutico nos doentes com risco cardiovascular muito elevado, um LDL-C < 70 mg/dl e considerasse como desejável, nos doentes com risco
ele-1406
Recebido para publicação: ????????????? • Aceite para publicação: ????????? Received for publication: ????????????? • Accepted for publication: ?????????
farmacocinéticas. Numa estratégia de farmacovigilância, o doente tem também uma palavra. A partilha de propósitos obriga o doente a responsabilidades partilhadas com a sua Equipa de Saúde, motivadoras de tratamentos mais seguros e de melhor prevenção cardiovascular. Aperfeiçoar o ingresso em programas de Saúde de qualidade e aprimorar o tratamento e os objectivos alcançados são as razões que devem fundamentar a terapêutica e a redução efectiva intensiva das dislipidemias. Palavras-chave:
Estatinas; LDL-colesterol; Efeitos adversos; Hepatotoxicidade; Miotoxicidade;
Proteinúria; Segurança.
strategy the patient also has his say. The sharing of a common goal makes the patient divide responsibilities with his Health Team, encouraging safer treatments and better cardiovascular prevention. The grounds for treatment and intensive effec-tive reduction of dyslipidemias must be made through a better adherence to quality Health Programs and through improving treatment and achieved goals.
Keywords:
Sstatins; LDL-cholesterol; Adverse effects; Hepatotoxicity; Myotoxicity; Proteinuria; Safety.
“Whenever science makes a discovery, the devil grabs it while the angels are debating the best way to use it”
vado, um LDL-C < 100 mg/dl(14). Estava
pres-suposto que diminuições efectivas e reitera-das do LDL-C na ordem dos 30 a 40% deter-minavam reduções significativas adicionais do risco cardiovascular.
Contudo, nas doses «habituais», as estati-nas raramente permitem almejar estes objecti-vos tendencialmente mais estritos, propostos pelo NCEP. Dessa forma, reduções mais mar-cadas do colesterol obrigam, por regra, à utili-zação de doses mais elevadas ou de estatinas (planos terapêuticos) mais eficazes(15).
Entretanto, no estudo IDEAL (Incremental
Decrease in End Points Trough Aggressive Lipid Lowering), o tratamento com atorvastatina (80
mg/dia) determinou um LDL-C médio final de 81 mg/dl (fazendo supor que o preceito de um LDL-C < 100 mg não foi alcançado de forma generalizada)(11); no TNT (Treating to New
Targets), cerca de 90% dos doentes alcançaram
valores inferiores a 100 mg/dl (valor médio final de LDL-C: 77 mg/dl)(10). No conjunto dos
dois estudos, menos de metade dos doentes obtiveram um LDL-C < 70 mg/dl(15). No estudo
ASTEROID (A Study to Evaluate the Effect of
Rosuvastatin on Intravascular Ultrasound-Derived Coronary Atheroma Burden) e no
METEOR (Measuring Effects on Intima-Media
Thickness: an Evaluation of Rosuvastatin), o
tratamento com rosuvastatina (40 mg/dl) esteve associado a reduções marcadas do LDL-C (53 e 49%, respectivamente), com valores médios finais de 61 e 76 mg/dl(6, 7); no entanto, pelo
menos 25% dos doentes não alcançaram um LDL-C < 70 mg/dl(6).
Por isso, face ao imperativo das opções tera-pêuticas disponíveis, é fundamental que as es-tatinas (especialmente as mais potentes: ator-vastatina, rosuvastatina e, mais secunda-riamente, sinvastatina), neste contexto e nestas dosagens, tenham um perfil claro de segurança e tolerabilidade e uma relação de benefícios e risco distintamente favorável (com o fim último
de maximizar os seus efeitos cardioprotectores e minimizar os seus potenciais efeitos adver-sos)(13, 15-28).
Efeitos adversos das estatinas.
Os dados epidemiológicos antropológicos, em populações saudáveis, sugerem que, na espécie humana, a concentração “normal”, fi-siológica, de colesterol, no plasma, aproxima-se dos 100 a 150 mg/dl. As populações caça-doras – colectoras tinham (e, em alguns casos exemplares, ainda têm) valores de LDL-C plasmático entre os 50 e os 75 mg/dl. Os recém-nascidos saudáveis têm um LDL-C na ordem dos 30 a 70 mg/dl e nos primatas adultos oscila entre os 40 e os 80 mg/dl. Recentemente, alvitrou-se que o nível de LDL-C que faria anular a taxa de eventos cardiovasculares era de 57 mg/dl, em preven-ção primária, e de 30 mg/dl, em prevenpreven-ção secundária(29).
Apesar dos múltiplos efeitos adversos que têm sido atribuídos às estatinas, a terapêutica intensiva redutora do colesterol não está as-sociada a consequências deletérias, depen-dentes da maior eficácia obtida, ou a efeitos laterais graves. Pelo contrário, globalmente, parece possível sublinhar que, nos doentes coronários com um risco elevado, reduções maiores do LDL-C são seguras e determinam uma diminuição superior de eventos cardio-vasculares subsequentes(13, 19, 30, 31), com uma
propensão para a ocorrência de menos eventos primários e laterais(32).
Uma meta-análise com mais de 70.000 in-divíduos arrolados em 18 estudos controlados (prevenção primária e secundária), contra pla-cebo, o número de doentes necessário tratar para ocorrer uma reacção adversa (NNH)1 foi
de 197, enquanto o número necessário tratar (NNT)2 para prevenir um evento
cardiovas-cular adicional foi de apenas 27; de outro mo-do, por cada 1000 doentes tratados evitamos 37
1407
Recebido para publicação: ????????????? • Aceite para publicação: ????????? Received for publication: ????????????? • Accepted for publication: ?????????
1 O número de doentes necessário tratar para ocorrer um evento adverso (number needed to cause harm) permite aquilatar os efeitos adversos de um
tratamento e é calculado como o inverso do aumento absoluto do risco (1/AAR). Num estudo, se a taxa de ocorrência de rabdomiólise for de 0.03% no grupo controlo e de 0.05% no grupo tratado com estatina o aumento absoluto de risco é 0.02%, o que corresponde a um NNH, ao fim de 5 anos (tempo de duração do estudo), de 5.000 (quer dizer que temos de tratar 5.000 doentes com estatinas durante 5 anos para termos 1 caso mais de rabdomiólise).
2Como se depreende, este conceito é em tudo semelhante ao anterior e é calculado da mesma forma, a partir da taxa de eventos finais no grupo de
intervenção e no grupo placebo. Como medida directa dos benefícios de um tratamento, é calculado como o inverso da redução absoluta do risco (NNT = 1/RAR)
eventos cardiovasculares e causamos cinco efeitos indesejáveis(20). A interrupção do
tra-tamento devido a eventos adversos, depen-dentes das estatinas, foi idêntica à registada no placebo(17, 23). A toxicidade muscular foi
uma ocorrência rara, com um NNH de 3 400 (aumento de CK > 10 vezes o limite superior do normal [LSN] e rabdomiólise) a 7 428 (rabdomiólise isolada)(22). Numa outra
meta-análise (> 74 000 doentes de 35 ensaios clí-nicos), a incidência de eventos adversos foi baixa e o tratamento com estatinas (à exce-pção da cerivastatina) não esteve associado a aumentos significativos do risco absoluto de mialgias, elevações da CK (creatinina cínase) ou rabdomiólise (mas, nesta última, a taxa de ocorrência, sempre em valores muito baixos, tendeu a aumentar com a continuação do tratamento)(17). Neste estudo, a terapêutica
com estatinas esteve associado a um aumento pequeno, mas significativo (4.3 por 1.000 doentes tratados), no risco absoluto de subida das transamínases(17).
No entanto, globalmente, a terapêutica in-tensiva com estatinas parece condicionar um aumento (previsível) no risco de eventos adver-sos de qualquer tipo (odds ratio, OR = 1,44; IC95%, 1,33-1,55; P <0.001), com um incre-mento mínimo do risco absoluto de 3.4% e um NNH de 30 (IC95%, 24-37), mas sem qualquer aumento particular no risco de rabdomiólise; o risco absoluto de elevação das transamínases aumenta em 1.2%, o que equivale a um NNH de 86 (IC95%, 72-106)(22). No conjunto, e por
cada 1 000 doentes, a terapêutica redutora in-tensiva do colesterol previne mais quatro mortes cardiovasculares, 10 enfartes do miocárdio e seis acidentes vasculares cerebrais e pode cau-sar mais 33 eventos adversos, 21 dos quais res-ponsáveis pela paragem do tratamento.
É, pois, importante analisar um pouco mais discriminada e contextualmente alguns dos principais efeitos adversos (porque mais comuns) das estatinas e destacar possíveis estratégias de evitação(15).
Efeitos das estatinas no fígado (hepatotoxicidade)
O desconforto gastrintestinal (náuseas,
dores abdominais, dispepsia, flatulência, obstipação ou diarreia), as cefaleias (1-3% dos doentes), a subida das transamínases (“transaminasite”) e as dores musculares es-tão entre os efeitos adversos mais frequente-mente apontados a estes fármacos(21, 33, 34).
As estatinas não são hepatotóxicas e eventuais alterações do perfil enzimático não são, necessariamente, indiciadoras de toxi-cidade hepática(27, 35). Nas doses “habituais”,
só muito raramente ocorrem elevações signi-ficativas das transamínases, da bilirrubina ou das outras enzimas hepáticas. Convém lembrar que a flutuação enzimática é um fenómeno corrente no doente com dislipide-mia, relacionada possivelmente com a esteatose hepática coexistente, com eventuais terapêuticas concomitantes ou como resultado da própria redução dos lípidos (e do reajuste metabólico consequente)(13).
A subida das aminotransferases é, normal-mente, assintomática e depende, larganormal-mente, da dose e da farmacodinamia do estatina. Ocorre, geralmente, nos primeiros seis meses de tratamento e melhora espontaneamente com a paragem ou com a suspensão temporária do fármaco, aliás obrigatória quando os valores de transamínases ultrapas-sam três vezes o LSN. Aparentemente, as maio-res “transaminasites” podem ocorrer quando há comorbilidades também favorecedoras de “toque hepático” (cerca de 50% dos doentes hiperlipidémicos têm esteatohepatite não al-coólica, situação muito comum nos doentes diabéticos, obesos e com síndrome meta-bólica), quando ou estão medicados com outros fármacos com risco potencial de interacções medicamentosas ou quando se recorre a doses maiores de estatinas(16, 36, 37).
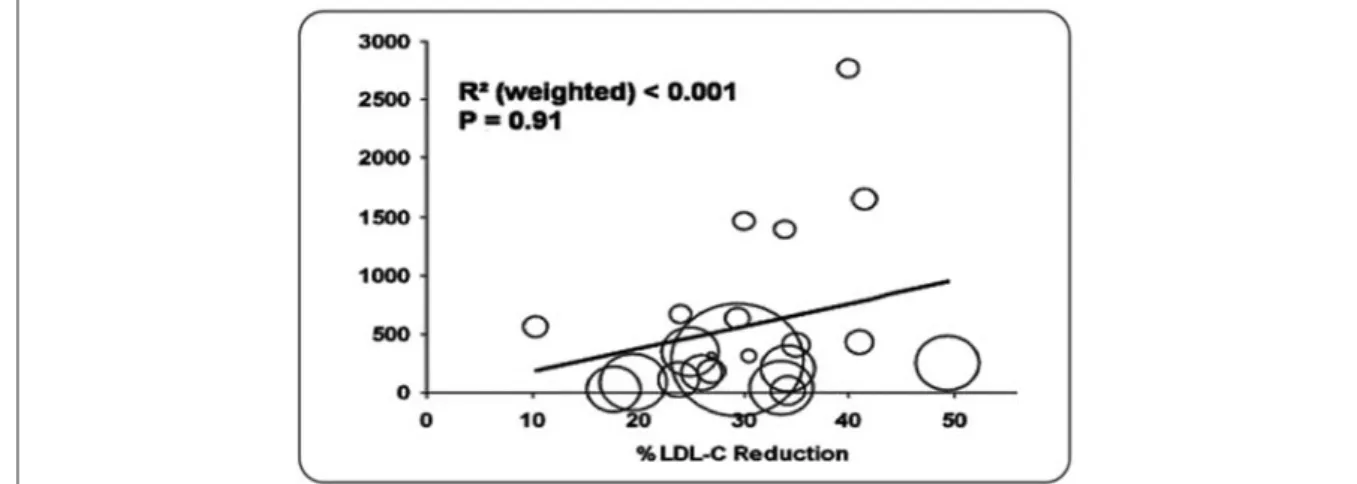
O risco de aumento das transamínases hepáticas (Figura 1) está directa e intimamente relacionada com a dose (por cada 10% de redução do LDL-C, a taxa de elevação das enzimas hepáticas é cerca de 2,5 vezes maior quando se usam doses mais elevadas de esta-tina) (24, 25, 28)e, possivelmente, com o tipo de
es-tatina usada (as eses-tatinas hidrofílicas parecem poder determinar um ligeiro acréscimo do risco absoluto de elevação das aminotransferases).(25)
Não há qualquer relação entre o grau de ele-vação das transamínases (da alanina amino-transferase, em particular) e a redução per-centual de LDL-C ou valor de LDL-C alcan-çado(16, 24, 28).
Ainda que seja habitual pedir o perfil hepático antes de iniciar o tratamento com estatinas (auxiliador de futuras valorizações diagnósticas), convém notar que os valores pré-tratamento não têm nenhum valor pro-gnóstico nem indiciam qualquer hepato-toxicidade futura. Além disso, alterações pou-co importantes do perfil hepátipou-co basal não devem ser consideradas uma contra-indicação ao seu uso em doentes com um risco cardio-vascular justificável.
A monitorização periódica iterada do perfil hepático não está justificada (em muitos casos, o aumento das transamínases com as estatinas não parece ter qualquer relevância ou significado clínico)(13, 16, 35), ainda que seja
razoável o seu pedido – eventualmente se-mestral – nos primeiros 12-15 meses de trata-mento ou quando há titulação sucessiva das doses.
Quando se suspeita de hepatotoxicidade relacionada com as estatinas (icterícia, mau estar, fadiga, letargia ou outros sintomas) torna-se, então, necessário avaliar ajuiza-damente o perfil hepático, em particular, a
bilirrubina directa (na ausência de colestase, a bilirrubina é o melhor indicador de hepato-toxicidade medicamentosa). Se, após uma cuidada avaliação clínica e laboratorial, não for possível excluir um provável nexo de cau-salidade com o fármaco, deve ser parada a estatina e proposta uma outra alternativa tera-pêutica(13, 35).
Efeitos das estatinas no músculo (miotoxicidade)
O espectro clínico dos efeitos das estatinas no músculo é muito variado e largamente he-terogéneo, podendo contemplar desde a sim-ples mialgia ou subida assintomática da CK até à rabdomiólise, potencialmente fatal. To-das as estatinas podem causar dores mus-culares, miopatia e rabdomiólise(13, 16, 31, 33, 38, 39),
mas muitos dos casos de mialgias que ocorrem durante o tratamento não têm qualquer re-lação com a medicação.
Do ponto de vista clínico, a definição de miotoxicidade não tem sido consistente e incor-re, por vezes, em discrepâncias pouco funda-mentadas(16, 26, 27, 39). Em 2002, o American College
of Cardiology, juntamente com a American Heart Association e o National Heart, Lung, and Blood Institute (ACC/AHA/NHLBI), procurou
harmo-nizar critérios e definiu miopatia como toda e qualquer manifestação de doença muscular e 1409
Figura 1. Relação entre a taxa de elevação de transamínases por 100.000 doentes/ano) e a redução percentual do colesterol das LDC
As dimensões dos círculos em aberto estão de acordo com as dimensões relativas do cada grupo de tratamento activo com estatinas Adaptado
mialgia como qualquer sensação dolorosa
(inespecífica), dor ou fraqueza muscular, acompanhada ou não de alteração da CK. Fala-se de miosite quando os sintomas musculares são acompanhados de subida da CK e de rabdomiólise quando, a par dos sin-tomas musculares, habitualmente expressivos, há uma subida substancial da CK (normal-mente ≥10 vezes LSN), acompanhada de au-mento da creatinina (disfunção renal) e poli-cromia urinária (mioglobinúria).
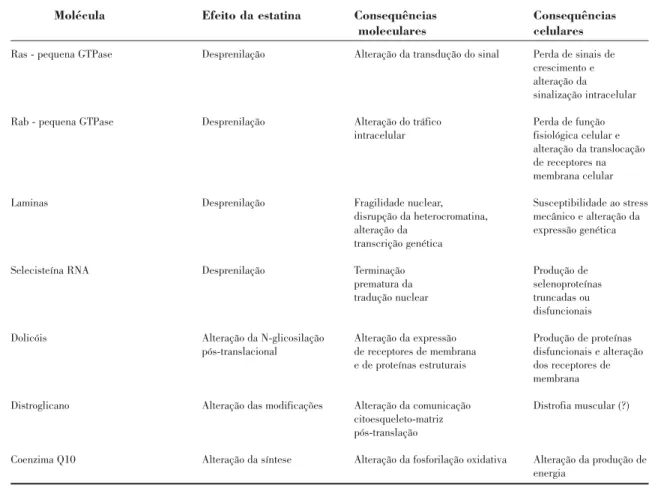
A causa da miotoxicidade (e da rabdomió-lise) relacionada com as estatinas não está ainda devidamente esclarecida(33, 38, 40, 41)
(Figura 2). Frequentemente, os efeitos adver-sos musculares têm sido atribuídos a defi-ciências, absolutas ou relativas, dos diversos compostos da via do mevalonato, com impli-cações moleculares, mais ou menos firmadas, de tipo fisiopatológico (Quadro I): redução do colesterol e perturbação do rácio coleste-rol/fosfolípidos, com alteração secundária da fluidez e comportamento funcional da mem-brana muscular (modificação do potencial eléctrico, perturbação da actividade das proteínas “de troca” Na+-K+ e na “bomba”
Ca2+-ATPase e acumulação de cálcio
intrace-lular); défice de ubiquinona (coenzima Q10) e
perturbação da fosforilação oxidativa mito-condrial; alteração da prenilação de proteínas, nomeadamente das proteínas ras e ras-depen-dente (ras, rho A e rho B), e da transdução de sinal intracelular; e indução da apoptose com inibição da proliferação da célula muscular esquelética (menos provável).
Se tivermos em conta a actividade meta-bólica, intensa, e o débito sanguíneo muscu-lar, facilmente apreendemos a importância da exposição total ao fármaco em circulação (concentração plasmática e biodisponibilida-de sistémica) no eventual biodisponibilida-desencabiodisponibilida-dear biodisponibilida-de efeitos musculares adversos. O risco de mio-patia ou rabdomiólise não tem relação com a redução percentual ou absoluta do LDL-C, nem com o valor de LDL-C alcançado(15, 24)
(Figura 3). Nas doses habituais, o risco de miopatia é extremamente baixo (habitualmen-te inferior a 0.01%). Uma revisão sis(habitualmen-temática recente de todos os estudos aleatorizados e
coortes diversos estimou o risco global de miopatia relacionada com o uso de estatinas em 11 casos por 100.000 doentes tratados ao ano e o de rabdomiólise foi três vezes menor (3 a 4 episódios por 100,000 doentes/ano)(42).
Uma análise retrospectiva de segurança do estudo PROVE IT-TIMI 22 (Pravastatin or
Atorvastatin Evaluation and Infection – Thrombolysis in Myocardial Infarction 22)
asseverou não haver qualquer relação entre o LDL-C obtido (mesmo quando o valor foi igual ou inferior a 60 e 40 mg/dl) e a eventualidade de efeitos adversos musculares (mas também hepáticos)(32). Tanto no TNT como no IDEAL,
as reduções maiores do LDL-C revelaram-se seguras e demarcadoras de superiores bene-fícios clínicos cardiovasculares. Apesar do risco acumulado de elevação das transamí-nases (dependente da dose e particularmente nítido com 80 mg de atorvastatina), a tera-pêutica intensiva do colesterol foi bem to-lerada e sem excesso de toxicidade muscular ou rabdomiólise(19, 30). No METEOR, com 40
mg/dia de rosuvastatina, a frequência de eventos adversos foi semelhante ao placebo (com mialgias em 12.7% no grupo da rosu-vastatina e 12.1% no placebo, sem casos de rabdomiólise ou miosite)(7).
No entanto, globalmente, a terapêutica intensiva redutora do colesterol pode, aparen-te e previsivelmenaparen-te, condicionar um incre-mento, discreto, na ocorrência de miopatia(13)
e um risco tendencialmente maior de elevação da CK(22, 25). O aumento de risco absoluto de
CK ≥10 vezes LSN é de 0.07%, correspon-dente a um NNH de 1,534 (IC95%, 890-5528). Curiosamente, o risco de rabdomiólise é idêntico ao arrolado à terapêutica habitual, hipolipemiante(22).
O perfil de efeitos adversos das estatinas pode, no entanto, variar e depender das carac-terísticas físico-químicas de cada molécula e das suas características farmacocinéticas. Alguns trabalhos sugerem que o risco de mio-patia (e de aumento da CK) possa variar com a lipofilia da molécula(25) (Figura 2). Numa
escala logarítmica, com um pH de 7.4, a ceri-vastatina e a sinceri-vastatina são mais lipofílicas, enquanto a rosuvastatina e a pravastatina são
1410
Recebido para publicação: ????????????? • Aceite para publicação: ????????? Received for publication: ????????????? • Accepted for publication: ?????????
relativamente hidrofílicas; a fluvastatina e a atorvastatina ocupam uma posição intermédia
(43-45).
Os eventos adversos graves musculares que levaram à suspensão da cerivastatina têm sido relacionados com a menor selectividade da molécula para o fígado e a maior possi-bilidade de penetração no músculo esque-lético(34). Os compostos lipofílicos são
rapida-mente captados pelo fígado (local de acção farmacológica), por difusão passiva; no entanto, esta característica pode facilitar a maior pene-tração das membranas das células periféricas e condicionar efeitos fortuitos menos desejá-veis. Pelo contrário, as estatinas predomi-nantemente hidrofílicas têm maior dificuldade em entrar nas células periféricas e são avi-damente captados pelos hepatócitos, via portadores activos, selectivos, tal como o trans-portador polipeptídico de aniões inorgânicos 1411
Recebido para publicação: ????????????? • Aceite para publicação: ????????? Received for publication: ????????????? • Accepted for publication: ?????????
Molécula Efeito da estatina Consequências Consequências moleculares celulares
Ras - pequena GTPase Desprenilação Alteração da transdução do sinal Perda de sinais de crescimento e alteração da sinalização intracelular Rab - pequena GTPase Desprenilação Alteração do tráfico Perda de função
intracelular fisiológica celular e alteração da translocação de receptores na membrana celular Laminas Desprenilação Fragilidade nuclear, Susceptibilidade ao stress
disrupção da heterocromatina, mecânico e alteração da alteração da expressão genética transcrição genética
Selecisteína RNA Desprenilação Terminação Produção de prematura da selenoproteínas tradução nuclear truncadas ou
disfuncionais Dolicóis Alteração da N-glicosilação Alteração da expressão Produção de proteínas
pós-translacional de receptores de membrana disfuncionais e alteração e de proteínas estruturais dos receptores de
membrana Distroglicano Alteração das modificações Alteração da comunicação Distrofia muscular (?)
citoesqueleto-matriz pós-translação
Coenzima Q10 Alteração da síntese Alteração da fosforilação oxidativa Alteração da produção de energia
Quadro I. Efeitos moleculares e celulares das estatinas potencialmente relacionados com os efeitos adversos no músculo (miopatia, adaptado de 41)
Notas: as proteínas Ras e Rab, da superfamília das GTPase, estão relacionadas com a manutenção e diferenciação funcional dos miócitos; as laminas estão associadas com a estrutura do esqueleto nuclear, sendo fulcrais à transdução mecânica e à activação de genes de transcrição; o distroglicano é uma glicoproteína do citoesqueleto, elaborada no retículo endoplásmico e no aparelho de Golgi.
Figura 2. Causas possíveis de miotoxicidade com as estatinas
Adaptado de Vaughan CJ et al. Circulation 2004; 110: 886-892
(OATP, organic anion transporting polypeptide) 1B1, expresso exclusivamente no fígado(45, 46).
O OATP1B1 facilita a captação hepática de muitas estatinas, mas é especialmente rele-vante para a pravastatina, atorvastatina e rosu-vastatina (esta última parece utilizar também outros transportadores celulares: OATP1B3, OATP2B1 e NTCP [polipeptídeo
cotranspor-tador do taurocolato dependente do sódio] ou
sofrer difusão passiva, quando em maiores concentrações)(34, 45).
O risco de problemas musculares procede também de diferenças na biodisponibilidade sistémica, parâmetro largamente influenciado pelo teor de eliminação renal (e grau de fun-ção renal) e pela maior ou menor possi-bilidade de ocorrência de interacções medi-camentosas. A biodisponibilidade da cerivas-tatina (60%) é comparativamente muito maior (e facilitadora de maior exposição sistémica) que a da rosuvastatina (20%), atorvastatina (14%), pravastatina (17%), fluvastatina (24%) ou sinvastatina e lovastatina (< 5%), factor que, associada à já referida lipofilia, pode ter actuado como potenciador na ocorrência de rabdomiólise.
A discussão das possíveis interacções medicamentosas com as estatinas está fora do âmbito deste artigo(36, 37, 44, 47, 48) (Figura 4). As
estatinas são metabolizadas de formas muito diversas (a lovastatina, a atorvastatina e a sinvastatina são metabolizadas, no fígado, primariamente pelo CYP3A4 e a fluvastatina e a rosuvastatina – numa muito pequena fracção [10%] – pelo CYP2C9; a pravastatina é transformada no citosol, por um processo enzimático não dependente do citocromo P450. A presença de outros medicamentos em concomitância (fibratos, ácido nicotínico, ci-closporina, macrólidos e antifúngicos azólicos) pode influir, de forma importante, no risco de miotoxicidade.
Por motivos compreensíveis a interacção com os fibratos, e em particular, com o gemfi-brozil, tem merecido uma atenção especial. O gemfibrozil (e, em particular, o seu metabolito glucuronado) é um inibidor potente do CYP2C8 e do CYP2C9 (mas não do CYP3A4). Este fibrato (e o seu metabolito) é também capaz de
inibir a captação hepática, mediada pelo OATP1B1, das formas ácidas das estatinas, de reduzir, pelo menos parcialmente, a depu-ração renal da pravastatina e de interferir no processo de lactonização e glucuronidação de algumas estatinas, via UGT (UDP glucuronil transferase), proporcionando um incremento da sua biodisponibilidade sistémica (Figura
4). Desse modo, a interacção entre o
gemfi-brozil e as estatinas (possivelmente menos claramente com a fluvastatina) parece reverter de vários mecanismos complementares: inter-ferência na captação hepática, interposição no metabolismo mediado pelo CYP2C8; e alte-ração no mecanismo de formação de glucuro-noconjugados (processo, aparentemente, me-nor na depuração das estatinas)(34, 45, 49-52). No
entanto, estas interacções parecem ser especí-ficas do gemfibrozil e não serem partilhadas pelo fenofibrato (ou pelo bezafibrato).
A monitorização rotineira da CK não ajuda a rastrear (ou a diagnosticar) eventuais casos de miopatia relacionados com as estatinas. É fundamental o médico estar atento às queixas musculares (mesmo as mais inespecíficas) nos doentes em tratamento; a par da terapêutica hipolipemiante, devem ser atentamente ava-liadas e excluídas outras causas potenciais: exercício ou actividade extenuante, traumatis-mo ou quedas, acidentes e convulsões, hipoti-reoidismo, processos infecciosos, etanolismo ou outros comportamentos aditivos e outras doenças musculares ou reumatológicas
(Qua-dro II).
A determinação basal e periódica da CK deve ser criteriosamente obtida em todos os doentes com queixas sugestivas ou com um risco maior de perturbações musculares (ida-de mais avançada, menor massa muscular, disfunção do rim ou da tireóide, terapêuticas concomitantes com risco potencial de interac-ções ou outras doenças coexistentes favorece-doras de miopatia). O surgimento de sintomas musculares, clinicamente importantes, mesmo sem subida das enzimas, deve obrigar a parar, ainda que temporariamente, o tratamento. A in-terrupção da estatina deve também ser con-siderada quando ocorrerem subidas muito marcadas da CK (cerca de 10 vezes LSN ou >
1412
Recebido para publicação: ????????????? • Aceite para publicação: ????????? Received for publication: ????????????? • Accepted for publication: ?????????
1413
Recebido para publicação: ????????????? • Aceite para publicação: ????????? Received for publication: ????????????? • Accepted for publication: ?????????
• Idade avançada • Sexo feminino • Insuficiência renal • Disfunção hepática • Hipotireoidismo • Polimedicação • Período perioperatório
• Doenças musculares metabólicas
- Deficiência da carnitina palmitil transferase II - Doença de McArdie
- Doença de mioadenilato deaminase • Polimialgia reumática
Quadro II. Factores predisponentes da miopatia relacionada com as estatinas (de acordo com 41)
Figura 3. Relação entre a taxa de rabdomiólise (por 100.000 doentes/ano) e a redução percentual do colesterol das LDC
As dimensões dos círculos em aberto estão de acordo com as dimensões relativas do cada grupo de tratamento activo com estatinas (isto é, o número de doentes por grupo).
Figura 4. AT = atorvaslatina: FV - fluvastina; OATP = polpéptido transportador de aniões orgânicos; P450 = citocromo e isoenzimas; PGP = glicoproteína P; PV = pravastattina; RS = rosuvaslatina; SV = sinvastatina
10,000 UI/litro), mesmo quando (raramente) assintomáticas, agravamento da função re-nal e/ou necessidade de hidratação intrave-nosa. (13, 15, 39)
Efeitos das estatinas no rim (proteinúria)
As estatinas também não são nefrotóxicas. Podem, inclusive, preservar ou favorecer a melhoria da função renal, retardando o declínio da taxa de filtração glomerular ou ajudando a reduzir a proteinúria, em especial nos doentes com maior excreção renal inicial de proteínas. Devem, por isso, ser prescritas com segurança nos doentes com alteração moderada da função renal(13, 53-57).
No entanto, vários estudos pré-clínicos, em modelos animais, sublinharam a ocorrência de degenerescência tubular e outros fenómenos de toxicidade renal com doses elevadas de estatinas. Por outro lado, foram descritos vá-rios casos de proteinúria tubular (não glomerular), transitória, não associada a agravamento da função renal, com as estatinas (num efeito comprovadamente de classe). Aparentemente, esta proteinúria (Figura 5) parece estar directamente relacionada com a inibição da síntese de mevalonato (e a interferência na formação de pirofosfatos iso-prenóides) no túbulo renal proximal e com a perturbação da endocitose mediada pelo complexo megalina/cubilina, clatrina depen-dente(55, 57)(as estatinas mais potentes são
ca-pazes de reduzir mais efectivamente o me-valonato e de provocar maior depleção nos precursores dos pirofosfatos isoprenóides).
A par da maior potência farmacológica, outros factores podem ter contribuído para o maior número de casos de proteinúria ini-cialmente apontados com a dose máxima, não aprovada, de rosuvastatina: a biodisponi-bilidade sistémica inabitual auferida com 80 mg, com concentrações máximas (Cmax) de 30
ng/ml muito superiores às obtidas com 40 mg/dia (10,3 ng/ml), passíveis de ultrapassar um possível limiar a partir do qual podia ocorrer o “toque” renal e a significativa taxa de excreção renal (10%)(55). De referir, que é,
igualmente possível que a acumulação de es-tatinas no túbulo renal possa perturbar os
pro-cessos de acidificação dos endossomas e de transferência das proteínas para lisossomas, facilitando, dessa forma, a sua não reabsorção tubular (especialmente as de menor peso mo-lecular)(55).
Independentemente de interpretações fi-siopatológicas mais ou menos mecanicistas, é importante salientar que não é, até ao mo-mento, reconhecido qualquer valor prognós-tico a esta proteinúria de origem tubular. A identificação dos doentes com doença renal e maior risco cardiovascular é fundamental assim como é importante incluir, na avaliação inicial do risco, a determinação da crea-tininemia e do rácio albumina/creatinina (na urina). O controlo efectivo de todos os factores de risco – e da dislipidemia em particular – é eticamente mandatório em todos os doentes com risco cardiovascular elevado, de que o doente renal é um paradigma, tantas vezes esquecido. No doente medicado com estati-nas, a monitorização periódica da função renal, como medida de segurança, não está indicada e não tem justificação(56); um
aumen-to eventual da creatinina deve fazer pensar numa rabdomiólise não diagnosticada e não numa qualquer remota disfunção renal iatro-génica.
Outros possíveis efeitos adversos das estatinas
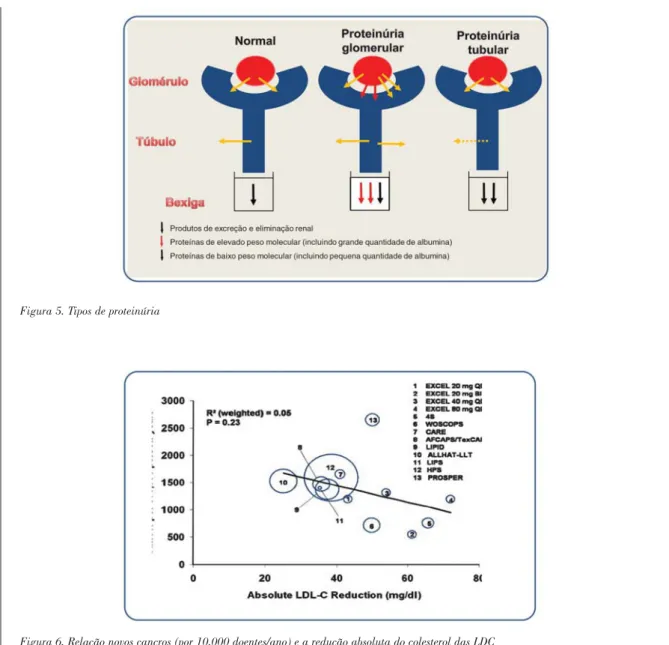
Recentemente um estudo sugeriu a exis-tência de uma relação discreta, mas significa-tiva, entre os níveis de LDL-C alcançado (ao contrário da redução percentual ou absoluta obtida) e o risco de diagnóstico de cancro(24, 28)
(Figura 6). Apesar das limitações do trabalho (os estudos recentes com terapêutica intensiva foram excluídos da análise, por exemplo), reconhecidas pelos autores(24, 58), anote-se que,
em meta-análises anteriores, a incidência de cancro, nos doentes tratados com estatinas durante mais de seis anos, foi idêntica ao pla-cebo(12), reiterando o aparente efeito neutro do
tratamento neste tipo de patologia (incidência ou morte por cancro)(28, 59). No estudo TNT, o
número de mortes por cancro foi menor nos doentes que atingiram valores de LDL-C mais baixos(60) e, no IDEAL, a taxa de cancros
1414
Recebido para publicação: ????????????? • Aceite para publicação: ????????? Received for publication: ????????????? • Accepted for publication: ?????????
diagnosticados foi ligeiramente menor (mas sem significado estatístico) nos doentes tratados com atorvastatina 80 mg/dia(11).
Sem relação aparente com a redução intensiva, absoluta ou percentual, do LDL-C, as estatinas não contribuem, de qualquer forma, para o risco de cancro(24, 28). Eventuais
associações estatísticas entre o LDL-C e o surgimento de novos casos de cancro parecem assentar em factores residuais de confundi-mento, impossíveis de mitigar por completo, nos estudos realizados (um valor “baixo” de colesterol, mais do que uma “causa”, pode ser
um «marcador» patológico a ter em conta ou estar em relação com eventuais processos meta-bólicos modelados, de forma diferencial, pelas estatinas)(28).
Finalmente, têm sido apontados muitos outros efeitos adversos às estatinas: perturba-ções do sono, alteraperturba-ções cognitivas e psiquiá-tricas, disfunção eréctil ou neuropatia perifé-rica, mas que não têm sido, específica ou particularmente, relacionados com a terapêu-tica intensiva redutora do colesterol, nem têm sido positivamente validados em estudos aleatorizados adequados. Naturalmente, que 1415
Recebido para publicação: ????????????? • Aceite para publicação: ????????? Received for publication: ????????????? • Accepted for publication: ?????????
Figura 5. Tipos de proteinúria
Figura 6. Relação novos cancros (por 10.000 doentes/ano) e a redução absoluta do colesterol das LDC
As dimensões dos círculos em aberto estão de acordo com as dimensões relativas do cada grupo de tratamento activo com estatinas (isto é, o número de doentes por grupo)
estamos cientes das limitações próprias destes estudos na completa compreensão do perfil de segurança de um medicamento ou de uma estratégia terapêutica, mas também sabemos as imprecisões e as subjectividades em que podem incorrer as bases de notificações espontâneas. No meio estará a virtude... Nada pode ou deve substituir o papel do médico informado e a sua centralidade na farmaco-vigilância e no reconhecimento da segurança de uma estratégia mais intensiva, porque mais efectiva, no controlo das dislipidemias.
Nesta estratégia, na melhor utilização das estatinas e superior concretização de objecti-vos terapêuticos, o doente tem também uma palavra. A partilha de propósitos obriga o doente a práticas e a responsabilidades que, quando partilhadas com a sua Equipa de
Saú-de, são elementos importantes na motivação e adesão a tratamentos mais seguros e na prossecução do acto médico e da prevenção cardiovascular. Melhorar o ingresso em pro-gramas de Saúde de qualidade e aprimorar o tratamento e os objectivos alcançados são as únicas razões que devem fundamentar a terapêutica e a redução efectiva intensiva (e renovada) das dislipidemias.
Pedido de separatas para: Adress for Reprints: Pedro Marques da Silva
Medicina - Hospital de Santa Marta Rua de Santa Marta
1169-024 Lisboa
e-mail: pedro.silva@hsmarta.min-saude.pt
1416
Recebido para publicação: ????????????? • Aceite para publicação: ????????? Received for publication: ????????????? • Accepted for publication: ?????????
1. Steinberg D. An interpretive history of the cholesterol con-troversy: part II: the early evidence linking hypercholes-terolemia to coronary disease in humans. J Lipid Res 2005; 46: 179-90
2. Steinberg D. An interpretive history of the cholesterol con-troversy, part V: the discovery of the statins and the end of the controversy. J Lipid Res 2006; 47: 1339-51
3. McKenney JM. Pharmacological options for aggressive low-density lipoprotein cholesterol lowering: benefit versus risks.
Am J Cardiol 2005; 96 [suppl]: 60E-66E
4. Marques da Silva P. 25 Perguntas em Dislipidemias (Parte I). Sociedade Portuguesa de Aterosclerose. Lisboa: Permaneyer, 2006
5. Nissen SE, Tuzcu EM, Schoenhagen P, Brown BG, Ganz P, Vogel RA, Crowe T, et al. Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis: a randomized controlled trial. JAMA 2004; 291: 1071-80
6. Nissen SE, Nicholls SJ, Sipahi I, Libby P, Raichlen JS, Ballantyne CM, Davignon J, Erbel R, Fruchart JC, Tardif JC, et al. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA 2006; 295: 1556-65
7. Crouse III JR, Raichlen JS, Riley WA, Evans GW, Palmer MK, et al. Effect of rosuvastatin on progression of carotid inti-ma-media thickness in low-risk individuals with subclinical atherosclerosis. The METEOR trial. JAMA 2007; 297: 1344-53
BIBLIOGRAFIA / REFERENCES
8. Cannon CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R, Joyal SV, et al. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J
Med 2004; 350: 1495-504 (Errata em: N Engl J Med 2006;
354 (7): 778)
9. de Lemos JA, Blazing MA, Wiviott SD, Lewis EF, Fox KA, White HD, Rouleau JL, Pedersen TR, Gardner LH, Mukherjee R, et al. Early intensive vs a delayed conservative simvastatin strategy in patients with acute coronary syndromes: phase Z of the A to Z trial. JAMA 2004; 292: 1307-16
10. LaRosa JC, Grundy SM, Waters DD, Shear C, Barter P, Fruchart JC, Gotto AM, et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J
Med 2005; 352: 1425-35
11. Pedersen TR, Faergeman O, Kastelein JJ, Olsson AG, Tikkanen MJ, Holme I, Larsen ML, Bendiksen FS, et al. High-dose atorvastatin vs usual-High-dose simvastatin for secondary pre-vention after myocardial infarction: the IDEAL study: a ran-domized controlled trial. JAMA 2005; 294: 2437-45
12. Baigent C, Keech A, Kearney PM, Blackwell L, Buck G, Pollicino C, Kirby A, Sourjina T, Peto R, Collins R, Simes R; Cholesterol Treatment Trialists' (CTT) Collaborators. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised tri-als of statins. Lancet 2005; 366: 1267-78 (Errata em: Lancet 2005; 366 (9494): 1358)
13. Armitage J. The safety of statins in clinical practice.
Lancet 2007; published on line June 7, 2007; DOI:
14. Grundy SM, Cleeman JI, Merz NB, Brewer, Jr HB, Clark LT et al. Implications of recent clinical trials for the National Education Program Adult Treatment Panel III guidelines.
Circulation 2004; 110: 227-39
15. Davidson MH, Robinson JG. Safety of aggressive lipid management. J Am Coll Cardiol 2007; 49: 1753-62
16. Bays H. Statin safety: an overview and assessment of the data – 2005. Am J Cardiol 2006; 97 [suppl]: 6C-26C 17. Kashani A, Philipd CO, Foody JM, Wang Y, Mangalmurti S, et al. Risks associated with statin therapy. A systematic overview of randomized clinical trials. Circulation 2006; 114: 2788-97
18. Jacobson TA. The safety of aggressive statin therapy: how much can low-density lipoprotein cholesterol be lowered?
Mayo Clin Proc 2006; 81: 1225-31
19. Wiviott SD, Cannon CP. The safety and efficacy of achiev-ing very low LDL-cholesterol concentrations with high dose statin therapy. Curr Opin Lipidol 2006; 17: 626-30
20. Silva MA, Swanson AC, Gandhi PJ, Tataronis GR. Statin-related adverse events: a meta-analysis. Clin Ther 2006; 28: 26-35
21. Kiortsis DN, Filippatos TD, Mikhailidis DP, Elisaf MS, Liberopoulos EN. Statin-associated adverse effects beyond muscle and liver toxicity. Atherosclerosis 2006, doi: 10.1016/j.atherosclerosis.2006.10.001
22. Silva M, Matthews ML, Jarvis C, Nolan NM, Belliveau P, et al. Meta-analysis of drug-induced adverse events associated with intensive-dose statin therapy. Clin Ther 2007; 29: 253-60 23. McClure DL, Valuck RJ, Glanz M, Hokanson JE. Systematic review and meta-analysis of clinically relevant adverse events from HMG CoA reductase inhibitor trials worldwide from 1982 to present. Pharmacoepidemiol Drug Saf 2007; 16: 132-43
24. Alsheikh-Ali AA, Maddukuri PV, Han H, Karas RH. Effect of the magnitude of lipid lowering on the risk of elevated liver enzymes, rhabdomyolysis, and cancer. Insights from large ran-domized statin trials. J Am Coll Cardiol 2007; 50: 409-18 25. Dale KM, White CM, Henyan NN, Kluger J, Coleman CI. Impact of statin dosing intensity on transaminase and creatine kinase. Am J Med 2007; 120: 706-12
26. Kapur NK, Musunuru K. Clinical efficacy and safety of statins in managing cardiovascular risk. Vascular Health and
Risk Management 2008; 4: 341-53
27. Escobar C, Echarri R, Barrios V. Relative safety profiles of high dose statin regimens. Vascular Health and Risk
Management 2008; 4: 525-33
28. Alsheikh-Ali AA, Karas RH. The relationship of statins to rhabdomyolysis, malignancy, and hepatic toxicity: evidence from clinical trials. Curr Atheroscl Rep 2009; 11: 100-4 29. O’ Keefe JH, Cordain L, Harris WH, Moe RM, Vogel R. Optimal low-density lipoprotein is 50 to 70 mg/dl. Lower is
better and physiologically normal. J Am Coll Cardiol 2004; 43: 2142-6
30. Sabharwal AK, Boord JB. Low-density lipoprotein reduc-tion: is the risk worth the benefit? Curr Atheroscler Rep 2006; 8: 19-25
31. Marques da Silva P. O doente com dislipidemia: a importân-cia particular da terapêutica intensiva. Carrageta MO, ed. Guia
Prático para a Prevenção da Doença Aterotrombótica. Lisboa:
Permanyer; in press.
32. Wiviott SD, Cannon CP, Morrow DA, Ray KK, Pfeffer MA, Braunwald E; PROVE IT-TIMI 22 Investigators. Can low-density lipoprotein be too low? The safety and efficacy of achieving very low low-density lipoprotein with intensive statin therapy: a PROVE IT-TIMI 22 substudy. J Am Coll
Cardiol 2005; 46: 1411-6 (Errata em: J Am Coll Cardiol
2006; 47 (2): 472)
33. Marques da Silva P. Temas Cardiológicos: Dislipidemias. Volume 5: Tratamento. Lisboa: Vale & Vale Editores, 2002 (acesso http://www.saude-cardio.net/index)
34. Tiwari A, Bansal V, Chugh A, Mookhtiar K. Satins and miotoxicity: a therapeutic limitation. Expert Opin Drug Saf 2006; 5: 651-66
35. Cohen DE, Anania FA, Chalasani N. An assessment of statin safety by hepatologists. Am J Cardiol 2006; 97 [suppl]: 77C-81C
36. Bottorff MB. Statin safety and drug interactions: clinical implications. Am J Cardiol 2006; 97 [suppl]: 27C-31C 37. Neuvonen PJ, Niemi M, Backman JT. Drug interactions with lipid-lowering drugs: mechanisms and clinical relevance.
Clin Pharmacol Ther 2006; 80: 565-81
38. Antons KA, Williams CD, Baker SK, Philips PS. Clinical perspectives of statin-induced rhabdomyolysis. Am J Med 2006; 119: 400-9
39. Thompson PD, Clarkson PM, Rosenson RS. An assessment of statin safety by muscle experts. Am J Cardiol 2006; 97[suppl]: 69C-76C
40. Schmitz G, Langmann T. Pharmacogenomics of choles-terol-lowering therapy. Vascular Pharmacol 2006; 44: 75-89 41. Vaklavas C, Chatzizisis YS, Ziakas A, Zamboulis C, Giannoglou GD. Molecular basis of statin-associated myopa-thy. Atherosclerosis 2009; 202: 18-28
42. Law M, Rudnicka AR. Statin safety: a systematic review.
Am J Cardiol 2006; 97: 52C-60C
43. García MJ, Reinoso RF, Navarro AS, Prous JR. Clinical pharmacokinetics of statins. Methods Find Exp Clin
Pharmacol 2003; 25: 457-81
44. Shitara Y, Sugiyama Y. Pharmacokinetic and pharmacody-namic alterations of 3-hidroxy-3-methylglutaril coenzyme A (HMG-CoA) reductase inhibitors: drug-drug interactions and interindividual differences in transporter and metabolic enzyme functions. Pharmacol Therap 2006; 112: 71-105 1417
Recebido para publicação: ????????????? • Aceite para publicação: ????????? Received for publication: ????????????? • Accepted for publication: ?????????
45. Neuvonen PJ, Niemi M, Backman JT. Drug interactions with lipid-lowering drugs: mechanisms and clinical relevance.
Clin Pharmacol Ther 2006; 80: 565-81
46. Shitara Y, Horie T, Sugiyama Y. Transporters as a determi-nant of drug clearance and tissue distribution. Eur J
Pharmaceutical Sci 2006; 27: 425-46
47. Williams D, Feely J. Pharmacokinetic-pharmacodynamic drug interactions with HMG-CoA reductase inhibitors. Clin
Pharmacokinet 2002; 41: 343-70
48. Leucuta SE, Vlase L. Pharmacokinetics and metabolic drug interactions. Curr Clin Pharmacol 2006; 1: 5-20 49. Prueksaritanont T, Subramanian R, Fang X, Ma B, Qiu Y, et al. Glucuronidation of statins in animals and humans: a novel mechanism of statin lactonization. Drug Metab Dispos 2002; 30: 505-12
50. Prueksaritanont T, Tang C, Qiu Y, Mu L, Subramanian R, Lin JH. Effects of fibrates on metabolism of statins in human hepatocytes. Drug Metab Dispos 2002; 30: 1280-7
51. Prueksaritanont T, Zhao JJ, Ma B, Roadcap BA, Tang C, Qiu Y, et al. Mechanistic studies on metabolic interactions between gemfibrozil and statins. J Pharmacol Experim Ther 2002; 301: 1042-51
52. Kyrklund C, Backman JT, Neuvonen M, Neuvonen PJ. Gemfibrozil increases plasma pravastatin concentrations and
reduces pravastatin renal clearance. Clin Pharmacol Ther 2003; 73: 538-44
53. Vidt DG. Statins and proteinuria. Curr Atheroscl Rep 2005; 7: 351-7
54. Agarwal R. Effects of statins on renal function. Am J
Cardiol 2006; 97: 748-55
55. Tiwari A. An overview of statin-associated proteinuria.
Drug Discovery Today 2006; 11: 458-64
56. Kasiske BL, Wanner C, O’Neill WC. An assessment of statin safety by nephrologists. Am J Cardiol 2006; 97[suppl]: 82C-85C
57. Pollock CA, Poronnik P. Albumin transport and processing by the proximal tubule: physiology and pathophysiology. Curr
Opin Nephrol Hypertens 2007; 16: 359-64
58. LaRosa JC. Means and ends of statins and low-density lipoprotein cholesterol lowering (Editorial comment). J Am
Coll Cardiol 2007; 50: 419-20)
59. Dale KM, Coleman CI, Henyan NN, Kluger J, White CM. Statins and cancer risk: a meta-analysis. JAMA 2006; 295: 74-80 60. LaRosa JC, Grundy SM, Kastelein JJ, Kostis JB, on behalf of the TNT Steering Committee and Investigators. Safety and effica-cy of atorvastatin at very low LDL-C levels. A post hoc analysis of the TNT study. Circulation 2005; 112 Suppl II: 662-3
1418
Recebido para publicação: ????????????? • Aceite para publicação: ????????? Received for publication: ????????????? • Accepted for publication: ?????????