UNIVERSIDADE FEDERAL DO CEARÁ INSTITUTO DE CIÊNCIAS DO MAR – LABOMAR
CURSO DE OCEANOGRAFIA
NAYANNA CRIS MAIA CHAVES
A PESCA COM ARMADILHAS ASSOCIADA A RECIFES NO NORDESTE DO BRASIL
FORTALEZA
NAYANNA CRIS MAIA CHAVES
A PESCA COM ARMADILHAS ASSOCIADA A RECIFES NO NORDESTE DO BRASIL
Monografia apresentada ao Curso de Oceanografia do Instituto de Ciências do Mar (LABOMAR) da Universidade Federal do Ceará, como requisito parcial para obtenção do Grau de Bacharel em Oceanografia.
Orientadora: Profª. Drª Caroline VieiraFeitosa
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca Rui Simões de Menezes
C439p Chaves, Nayanna Cris Maia.
A pesca com armadilhas associada a recifes no Nordeste do Brasil / Nayanna Cris Maia Chaves – 2016.
55 p. : il. color., enc. ; 30 cm.
Monografia (graduação) – Universidade Federal do Ceará, Instituto de Ciências do Mar, Curso Bacharelado em Oceanografia, 2016.
Orientação: Profª. Drª. Caroline Vieira Feitosa.
1. Pesca Artesanal. 2. Ambientes Recifais. I. Título.
NAYANNA CRIS MAIA CHAVES
A PESCA COM ARMADILHAS ASSOCIADA A RECIFES NO NORDESTE DO BRASIL
Monografia apresentada ao Curso de Oceanografia do Instituto de Ciências do Mar (LABOMAR) da Universidade Federal do Ceará, como requisito parcial para obtenção do Grau de Bacharel em Oceanografia.
Aprovada em: ___/___/______.
BANCA EXAMINADORA
________________________________________ Profª. Drª. Caroline Vieira Feitosa (Orientadora)
Universidade Federal do Ceará (UFC)
_________________________________________ Prof. Dr. Antonio Adauto Fonteles Filho
Universidade Federal do Ceará (UFC)
______________________________________ Prof. Dr. Vicente Vieira Faria Universidade Federal do Ceará (UFC)
AGRADECIMENTOS
Gostaria de agradecer primeira e principalmente aos meus pais, Maria do Carmo e José Crisógno, e a minha avó materna, Francisca Chaves, por todos os esforços e sacrifícios feitos por eles para que eu vivesse e concluísse esta etapa da minha vida da melhor maneira possível, e ao meu irmão, D’angels, pelo apoio e companheirismo. Nada disso existiria sem vocês.
À minha orientadora, professora Caroline Feitosa, por me aceitar como sua orientanda e acreditar na minha capacidade de realizar este trabalho. Agradeço também ao professor Geraldo, por sua eterna disponibilidade, seu bom humor incansável e sua vontade de ajudar a todos sempre que preciso.
Aos membros da banca avaliadora: Prof.Doutor Antonio Adauto Fonteles Filho, Prof. Doutor Vicente Vieira Faria e Doutor João Eduardo Pereira de Freitas
pelo tempo dedicado e pelas valiosas contribuições e sugestões. À todos os que fazem parte do LABOMAR, professores, bibliotecários,
funcionários da secretária, da coordenação, da limpeza e do restaurante universitário por todos estes anos de atenção e todos os ensinamentos transmitidos, tanto para a vida acadêmica quanto para a vida pessoal, e pelos momentos de descontração, fazendo com que eu me sentisse sempre em casa.
À vida pelo presente dado a mim, na forma de amigos, dos muitos amigos que fiz ao longo da graduação, de todas as turmas e de todas os cursos de Oceanografia do Brasil, aos amigos das minhas turmas, 2010.1, minha turma primeira e eterna, e 2011.1, que me acolheram tão bem.
Agradecimento especial à minhas amigas lindas e pacientes, que me aguentaram e me dividiram tanta felicidade e aflições comigo durante estes anos: Beatriz Rodrigues, Amanda Gonçalves, Suzana Sales, Gabriele Silva, Larissa Lima, Jéssyca Rios, Elissandra Cruz, Beatriz Lima, Olga Moara e Luanny Medeiros.
“Que inapropriado chamar este planeta de Terra, quando ele é claramente Oceano. ”
RESUMO
A pesca de peixes recifais com o uso de armadilhas (também chamadas de covos ou manzuás), tradicionalmente utilizadas na captura de lagostas, vem sendo amplamente praticada no litoral Nordeste do Brasil. Esta técnica surgiu como suplemento à demanda do mercado local e internacional por proteína de fonte marinha e como uma alternativa à pesca daquele crustáceo, em declínio na região. Embora possua grande importância para as comunidades que a exercem e para a economia destas localidades, existem poucas informações sobre os impactos que a execução desta prática causa sobre as espécies explotadas e nos recifes os quais habitam. Esta pesquisa teve como objetivo compilar informações disponíveis na literatura sobre as principais características dessa técnica, a partir da busca e revisão de artigos publicados até o momento, no que diz respeito às espécies capturadas (espécies alvo e também aquelas capturadas como fauna acompanhante), à posição ocupada por estas espécies na cadeia alimentar e ao nível de ameaça sob o qual cada uma se encontra, bem como às embarcações, às do petrecho utilizadas e ao beneficiamento e comercialização dos organismos, com a intenção de melhorar a disponibilidade de dados e gerar suporte para futuros estudos sobre o tema. Registrou-se 91 espécies, pertencentes a 29 famílias e a diversos níveis tróficos, como componentes da captura de peixes recifais nos estados do Rio Grande do Norte, da Paraíba e de Pernambuco, algumas delas classificadas em algum nível de vulnerabilidade à extinção. Pôde-se observar também a ausência de padronização da atividade e a necessidade de contínuas coleta e análisede dados sobre os fatores que influenciam sua efetividade e suas implicações sobre o meio, de forma a viabilizar seugerenciamento e monitoramento adequados e ao mesmo tempo promovera conservação dos recursos extraídos, permitindo que ocorra a recuperação e a manutenção dos estoques pesqueiros, condição essencial para o equilíbrio ambiental e para a continuidade da prática.
ABSTRACT
The activity of fishing reef fishes with the use of traps (also known as covos or manzuás), traditionally used to catch lobsters, has been widely practiced in the Northeastern coast of Brazil. This technique has emerged as a supplement to the demand of the local and international market for a marine source of protein and as an alternative to fishing that crustacean, facing a decline in the region. Although it has great significance for the communities that exercise and the economy of these locations, there is little information about the impactscaused by this practice on the exploited species and the reefs whichthey inhabit.This research aimed to compile information available in the literature on the main characteristics of this technique, based on search and review of articles published so far, with regard to the species caught (target species and also those captured as bycatch ), the position occupied by these species in the food chain and the threat level under which each one is, as well as the fleet, the used gears and the processing and the trade of organisms, with the intention of improving the availability of data and generate support for future studies on the subject .A total of 91 species was recorded, belonging to 29 families and diferente trophic levels, as components of the capture of reef fish in the states of Rio Grande do Norte, Paraiba and Pernambuco,some of which are classified at some level of vulnerability to extinction. It was also observed the lack of a pattern on this activity and the need for continuous data collection and analysis on the factors that influence its effectiveness and its implications on the environment, in order to facilitate the proper management and monitoring while promoting the conservation of exploited resources, allowing the fish stocks to recover and maintain itself, an essential condition for the environmental balance and to foster the existence of this practice.
LISTA DE GRÁFICOS
Gráfico 1 - Número de espécies por família (Classe Teleostei)...18
Gráfico 2 - Principais famílias capturadas no Rio Grande do Norte...20
Gráfico 3 - Principais famílias capturadas em Pernambuco...21
Gráfico 4 - Número de indivíduos capturados por espécie (Ornamentais)...21
Gráfico 5 - Representação das categorias dos níveis tróficos das espécies capturadas...22
Gráfico 6 - Estado de conservação das espécies segundo a Lista Vermelha da IUCN(ClasseTeleostei)...23
SUMÁRIO
1. INTRODUÇÃO...11
2. OBJETIVOS...14
2.1. Objetivo geral...14
2.2. Objetivos específicos...14
3. METODOLOGIA...15
3.1 Obtenção de dados...16
3.2 Análise de dados...16
4. RESULTADOS...18
4.1 Espécies Capturadas...18
4.2 Principais espécies...19
4.3 Categoria trófica e estado de conservação das espécies ...21
4.4 Características das embarcações e das armadilhas utilizadas e esforço de pesca aplicado na captura...33
4.5 Beneficiamento e comercialização dos organismos...35
5. DISCUSSÃO...37
6. CONCLUSÕES...41 REFERÊNCIAS
ANEXO A – IMAGENS DAS PRINCIPAIS ESPÉCIES CAPTURADAS NOS ESTADOS DO RIO GRANDE DO NORTE E DE PENAMBUCO
1. INTRODUÇÃO
Os recifes estão entre os ambientes de maior importância no planeta. Dentre os ecossistemas marinhos, são considerados os principais detentores de diversidade biológica, abrigando grande variedade de organismos, entre animais e algas. Apesar de representarem apenas cerca de 0,17% da superfície terrestre, acredita-se que 25% das espécies marinhas encontram – se nestes ecossistemas, incluindo 65% das espécies de peixes. As regiões onde essas formações ocorrem são essenciais à existência de inúmeras espécies, que usufruem do abrigo oferecido, de áreas favoráveis à sua reprodução e alimentação (BERTNESS; NYBAKKEN, 2004; MMA, 2010).
Por ter uma grande variedade de recursos disponíveis, o homem tem conseguido inúmeros benefícios a partir dos ecossistemas recifais. Pode-se citar, por exemplo, os animais e as algas, capturados para alimentação ou para a indústria farmacêutica. Sua beleza também é um atrativo, o qual fortalece o turismo nas localidades onde ocorrem (FERREIRA; MAIDA, 2006). O uso desses recursos representa importantes subsídios para a economia de regiões que abrigam recifes, com ênfasenas comunidades que dependem diretamente deles, as quais geralmente retiram daísua subsistência. Porém, esses ecossistemas estão ameaçados em escala local e global, devido a fatores como a grande quantidade de organismos extraídos pela pesca, aos efeitos das mudanças climáticas, da poluição, muitas vezes um produto do turismo, do uso inadequado do solo, entre outros (FERREIRA; MAIDA, 2006; RHODES et al, 2014; KITTINGER et al, 2015).
A pesca de peixes associados a recifes tem destaque entre as atividades causadoras de impactos nestes ambientes. Esta prática, que antigamente era em sua maioria realizada de forma artesanal, em grande parte para subsistência dos próprios pescadores, foi intensificada nos últimos anos, principalmente em países em desenvolvimento, devido ao aumento da demanda por proteína animal para o consumo humano. Ao mesmo tempo verifica-se o declínio nas populações de espécies capturadas tradicionalmente em mar aberto, devido aos esforços de pesca excessivos exercidos sobre elas, como identificado inicialmente nas décadas de 1980 e 1990 (PAULLY et al., 2002; BELWOOD et al., 2004; RIBEIRO, 2004;
CUNHA; CARVALHO; ARAÚJO, 2012; FAO, 2014).
Sabe–se que a remoção de peixes destes ambientes, juntamente com os efeitos das mudanças climáticas, causa alterações nas populações ali presentes.Estas espécies compõemgrupos funcionais, interagindo, positiva ou negativamente, com outras de diferentes níveis tróficose dando suporte a vários processos ecológicos nos recifes, além de interferir em sua estrutura e funcionamento (PAULLY et al., 2002; BELWOOD et al., 2004; GRAHAMet al., 2011;
MCCAULEY et al., 2014; BOADEN; KINGSFORD, 2015). As espécies predadoras,
por exemplo, são importantes para a manutenção do equilíbrio populacional em muitos ecossistemas, portanto, possuem posição determinante emambientes com representantes de diferentes níveis tróficos. A remoção de predadores de topopode causar o aumento de suas presas, o que pode comprometer a abundância das espécies de níveis tróficos inferiores das quais estes se alimentam, como macroalgas e corais (BOADEN; KINGSFORD, 2015).
Outro setor da pesca que vem afetando as populações de peixes recifais é acaptura de espécies ornamentais para a indústria aquariofilista. Essas espécies também são capturadas como fauna acompanhante na pesca com armadilhas e muitas vezes são descartadas pelos pescadores. Estes organismos são de grande interesse no comércio ornamental e como acontece com as espécies alvo, pouco se sabe sobre os impactos sobre estes organismos, uma vez que os países de onde são exportadas são aqueles em desenvolvimento, com esforços reduzidos no estudo e no gerenciamento desta atividade (LECCHINI, 2006; FEITOSA et al., 2008; FUJITA et al., 2014).
O Brasil é o único país banhado pelo oceano Atlântico Sul que apresenta formações de recifes coralíneos, as quais se estendem por cerca de três mil quilômetros de costa, tanto em águas rasas como profundas (MMA, 2009). Isto ocorre devido à presença de fatores favoráveis à sobrevivência dos organismos que os constituem (algas calcáreas, corais e zooxantelas), como águas claras, temperaturas entre 23 e 25ºC e salinidade entre 32-35 psu (BERTNESS; NYBAKKEN, 2004; GARRISON, 2010).
Assim como em diversos outros países, como algumas Ilhas do Caribe, Filipinas, Indonésia e Quênia, por exemplo, a pesca com armadilhas apresentou grande aumento no litoral brasileiro, primeiramente, como alternativa para os pescadores durante o período de defeso da lagosta, que ocorre de dezembro a maio, e posteriormente, durante a maior parte dos anos (IVO; VASCONCELOS; OSÓRIO, 2010). Espécies de peixes que até pouco tempo atrás eram associadas à captura daquele crustáceo e não possuíam valor comercial agora são explotadas em grandes quantidades, principalmente na região Nordeste, e exportadas para diversos países da América e da Europa (RIBEIRO, 2004; CARVALHO et al., 2013).
Além da alteração das espécies alvo, os pescadores adaptaram também a técnica utilizada em seu dia a dia. Armadilhas semelhantes àquelas tradicionalmente utilizadas na captura de lagostas (conhecidas também como cangalhas, covos ou manzuás) vêm sendo largamente utilizadas na pesca de peixes recifais. Esse tipo de arte de pesca, capaz de capturar diversas espécies de uma vez, representa o principal instrumento utilizado em recifes de diversas partes do mundo, funcionando como um falso abrigo e apresentando fácil acesso, porém, difícil saída (MAHON; HUNTE, 2001; MARQUES; FERREIRA, 2010; IVO; VASCONCELOS; OSÓRIO, 2010; MONTEALEGRE-QUIJANO et al., 2011). Há relatos de que a atividade foi inserida no Rio Grande do Norte através de pescadores do estado que tiveram contato com a mesma, enquanto trabalhavam em Pernambuco (CARVALHO et al., 2013). Neste estado, o uso das armadilhas existe desde a década de 70, para a pesca de lagostas, com a captura acidental de peixes desde então (MARQUES; FERREIRA, 2010).
inferiores, gerando desequilíbrio no ecossistema (FERREIRA et al., 2004; BURKEPILE; HAY, 2008).
Embora haja o reconhecimento da importância desta atividade, seja em relação à economia ou para as comunidades que dependem dela para sobreviver, não existem informações suficientes para delinear os impactos econômicos, sociais e ecológicos por ela causados (CUNHA; CARVALHO; ARAÚJO, 2012). As informações sobre as espécies explotadas, necessárias para o monitoramento adequado à prática e o acesso à situação das espécies, geralmente estão disponíveis apenas para aquelas que possuem alto valor comercial em países de primeiro mundo (CHEUNG; PITCHER; PAULY, 2005). Com base em informações disponíveis atualmente, algumas medidas vêm sendotomadas ao redor do globo, para tentar diminuir os impactos causados sobre as espécies capturadas em recifes e manter o equilíbrio nestes ecossistemas. Este é o caso da criação de áreas protegidas e de medidas para adequar a atividade pesqueira, como restrições nas artes de pesca, ao mesmo tempo em que é feita a avaliação de sua eficácia na preservação dos recursos naturais ((FLOETER; HALPERN; FERREIRA, 2006; GOMES; ERZINI; MCCLANAHAN, 2013; SCHIAVETTI et al., 2013).
2.OBJETIVOS
2.1 Objetivo geral
Compilar, revisar e analisar as principais características da pesca artesanal de peixes recifais com o uso de armadilhas no Nordeste do Brasil.
2.2 Objetivos específicos
Elaborar uma lista das espécies de peixes recifais capturadas por este petrecho, incluindo aquelas consideradas como by-catch;
Elencar as principais espécies desembarcadas nos estados do Rio Grande do Norte e de Pernambuco;
Acessar a categoria trófica das espécies identificadas e seu estado de conservação;
Identificar as principais características das embarcaçõese das armadilhas utilizadas na atividade;
Registrar o esforço de pesca aplicado na captura;
3.METODOLOGIA
3.1 Obtenção de dados
Os dados aqui apresentados foram obtidos através da leitura e compilação de informações disponíveis até o momento. A pesquisa dos artigos citados, bem como da literatura complementar, foi realizada na base de dados Web of Science, acessado através do Periódico Capes (www.periodicos.capes.gov.br) e
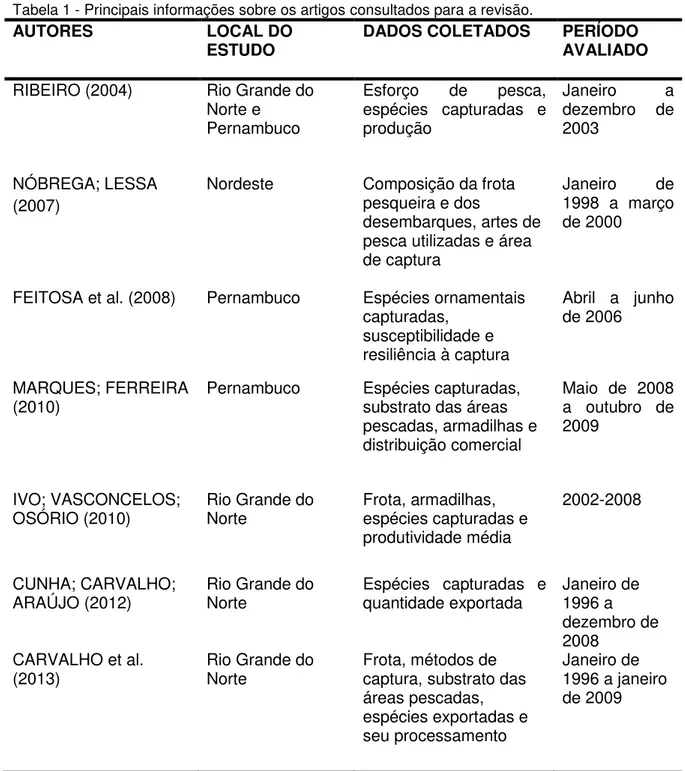
no portal de periódicos Scopus da Elsevier (www.scopus.com), entre os meses de fevereiro de 2015 e janeiro de 2016. As principais informaçõesreferentes aos artigos utilizados na revisão estão dispostas na tabela 1.
Tabela 1 - Principais informações sobre os artigos consultados para a revisão.
AUTORES LOCAL DO
ESTUDO DADOS COLETADOS PERÍODO AVALIADO
RIBEIRO (2004) Rio Grande do Norte e
Pernambuco
Esforço de pesca, espécies capturadas e produção
Janeiro a dezembro de 2003
NÓBREGA; LESSA (2007)
Nordeste Composição da frota pesqueira e dos
desembarques, artes de pesca utilizadas e área de captura
Janeiro de 1998 a março de 2000
FEITOSA et al. (2008) Pernambuco Espécies ornamentais capturadas,
susceptibilidade e resiliência à captura
Abril a junho de 2006
MARQUES; FERREIRA
(2010) Pernambuco Espécies capturadas, substrato das áreas pescadas, armadilhas e distribuição comercial
Maio de 2008 a outubro de 2009
IVO; VASCONCELOS;
OSÓRIO (2010) Rio Grande do Norte Frota, armadilhas, espécies capturadas e produtividade média
2002-2008
CUNHA; CARVALHO;
ARAÚJO (2012) Rio Grande do Norte Espécies capturadas e quantidade exportada Janeiro de 1996 a dezembro de 2008
CARVALHO et al.
(2013) Rio Grande do Norte Frota, métodos de captura, substrato das áreas pescadas, espécies exportadas e seu processamento
Janeiro de 1996 a janeiro de 2009
Os dados reunidos foram fruto de observações realizadas ao longo de 13 anos, coletadas por meio de acompanhamento de desembarques, de registro fotográfico, da análise de amostras compradas diretamente dos pescadores, da aplicação de questionários aos mesmos, da análise de certificados emitidos pelo Ministério da Agricultura, Agropecuária e Abastecimento (MAPA) para lotes comercializados pelas empresas exportadoras e pela realização de entrevistas com os funcionários destas.
3.2 Análise de dados
Os dados utilizados foram tratados através do programa Microsoft Excel®, para a unificação das informações disponíveis e para a elaboração das planilhas, gráficos e tabelas apresentados nos resultados.
Os nomes comuns foram retirados dos artigos consultados na revisão e dos registros feitos por Freire e Carvalho Filho (2009), na publicação que reúne a nomenclatura popular dos peixes que habitam os recifes brasileiros.
As espécies ornamentais observadas por Feitosa et al. (2008) foram
avaliadas quanto ao seu ciclo de vida, a partir de características como hábitos alimentares, maturação sexual e tamanho corporal, a partir das quais os autores iferiram sobre a vulnerabilidade e mortalidade dos organismos devido à captura e sua resiliência em relação aos esforços pesqueiros aplicados, a partir de indivíduos representantes de quatro espécies das famílias Pomacanthidae e Chaetodontidae.
A categoria trófica de cada espécie listada foi estimada de acordo com as informações sobre os itens alimentares preferidos pelos indivíduos adultos, obtidas nas bases da IUCN e FishBase. Ferreira et al. (2004) descrevem oito níveis tróficos
nos quais os peixes que habitam os recifes brasileiros são identificados, que variam desde planctívoros (PLK), até onívoros (OMN), incluindo herbívoros errantes (ROVH), herbívoros territoriais (TERH), piscívoros (PIS), carnívoros (CAR), comedores de invertebrados móveis (MIF) e comedores e invertebrados sésseis (SIF). As espécies sobre as quais não foram encontradas informações foram classificadas como não avaliadas (NE).
Para indicar a classificação das espécies quanto ao nível de ameaça de extinção sob o qual se encontram, foi consultada alista vermelha da International Union for Conservation of Nature ou IUCN (www.iucnredlist.org) eo site FishBase (www.fishbase.org), para avaliação a nível internacional.As duas bases foram utilizadas com o intuito de observar da forma mais abrangente possível os critérios de avaliação e inserção dos táxons em cada categoria, uma vez que cada uma tem como base diferentes critérios (STRONA, 2014).
tamanho da população de indivíduos maduros, valores menores, (D); análise quantitativa da probabilidade de extinção na natureza em determinados números de anos (E).
Os táxons sobre os quais não há dados foram considerados como não acessados (NA), que não representa uma categoria propriamente dita. Quando há um mínimo de informação disponível, porém, em quantidade inferior à necessáriapara a inserção da espécie em uma categoria, considera-se que os dados são insuficientes (DD). Espécies que foram avaliadas, mas não apresentam informações compatíveis com nenhum os critérios de avaliação foramconsideradas em situação pouco preocupante (LC). A categoria quase ameaçada (NT) englobou as espécies avaliadase que não se encontram ameaçadas no presente, porém podem vir a ser. Foram inseridas nas categorias vulnerável (VU), ameaçada (EN) e criticamente ameaçada (CR) as espécies que apresentavam risco alto, muito alto e extremamente alto de extinção, respectivamente. Os níveis mais altos de ameaça são os seguintes: extinta na natureza (EW), quando não for mais possível encontrar espécimes em seu habitat natural e extinta (EX), quando após determinados períodos de observação não se encontra nenhum indivíduo vivo.
As espécies listadas no FishBase, foram avaliadas por Cheung; Pitcher e Pauly (2005), os quais utilizamseu histórico de vida, juntamente com suas características ecológicas (comprimento máximo, idade de primeira maturidade sexual, distribuição geográfica, idade máxima, valor do fator de crescimento K, de Von Bertalanffy, fecundidade e comportamento no habitat) para estimar a relação destes fatores com sua vulnerabilidade em relação à pesca.
Foi determinada uma escala numérica variando de zero (menor vulnerabilidade) a cem (máxima vulnerabilidade), na qual os táxons analisados foram agrupados. De acordo com o valor atribuído a cada um, foi feita a classificação principalmente nas seguintes categorias: vulnerabilidade baixa, moderada, alta e muito alta. No entanto, algumas delas ocupavam uma posição entre duas das categorias. Este tipo de análise foi feito a partir da teoria dos conjuntos difusos (fuzzy set theory), desenvolvida por Zadeh (1965), o qual permitia
a inserção das espécies em mais de uma categoria, de acordo com a gradação de sua classificação. Os resultados da avaliação foram validados a partir de bases de dados que apresentavam informações sobre os atributos avaliados, dentre as quais estava a Lista Vermelha das espécies ameaçadas da IUCN (Hilton-Taylor, 2000). Para realizar a análise a nível regional, foi consultada a Portaria 445 do Ministério do Meio Ambiente (MMA), de 17 de dezembro de 2014, na qual constam as espécies de peixes ameaçadas de extinção no Brasil.
Juntamente com a pesquisa das informações de categoria trófica e estado de conservação de cada táxon foi feita a conferência de seu nome científico junto ao
4. RESULTADOS
4.1 Espécies Capturadas
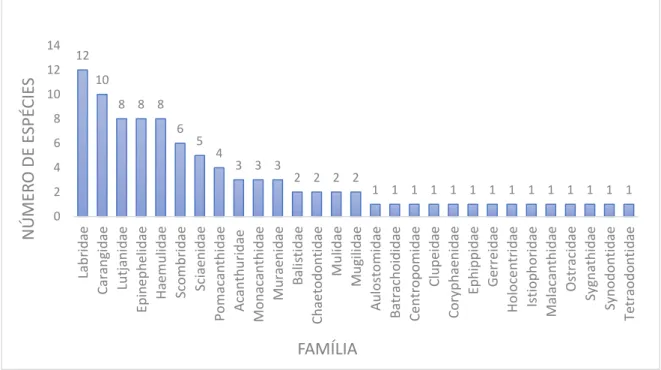
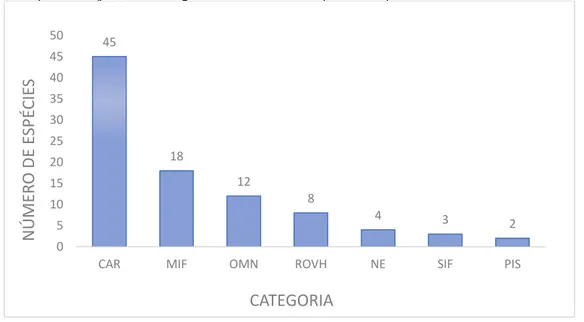
Foram identificadas, dentro da classe Teleostei, 91 espécies, pertencentes a 29 famílias, para as capturas com covos em ambientes recifais, realizadas nos estados do Rio grande do Norte, Pernambuco e Paraíba. Seus nomes científico e comum estão dispostos na. A família Labridae apresentou o maior número de táxons explotados, com 12 espécies, seguida de Carangidae, com 10, Lutjanidae, Epinephelidae e Haemulidae, com oito e Scombridae com seis. No outro extremo das capturas estava cerca de metade das famílias listadas, que contribuíam com apenas uma espécie cada (Gráfico 1).
Gráfico 1 - Número de espécies por família (Classe Teleostei).
Fonte: a autora, 2016.
Foi identificado, para o Rio Grande do Norte, que além das espécies declaradas nos certificados haviam mais nove. As espécies Achanthurus bahianus e Achanthurus coeruleus foram identificadas como Achanthurus chirurgus; a espécie Mulloidichthys martinicus, como Pseudupeneus maculatus e as espécies Scarus trispinosus, Scarus zelindae, Sparisoma amplum, Sparisoma frondosum, Sparisoma axillare, Sparisoma radians e Nicosina usta foram todas identificadas como Sparisoma sp (CUNHA; CARVALHO; ARAÚJO, 2012).
A espécie Chaetodipterus faber foi identificada por MARQUES;
FERREIRA (2010) como pertencente à família Carangidae, porém, segundo informações disponíveis nas bases de dados do FishBase e da IUCN, esta é
representante da família Ephippidae. As autoras citadas acima, identificaram ainda quatro espécies consideradas raras na pesca com armadilhas, Halichoeres dimidiatus, Bodianos rufus, Sparisoma amplum e Xanticthys ringens, o último tendo
sido relatado pela primeira vez para Pernambuco.
12
10
8 8 8
6 5
4
3 3 3
2 2 2 2
1 1 1 1 1 1 1 1 1 1 1 1 1 1
Dentre as espécies listadas, Feitosa et al. (2008) identificaram 19 como
produtos do mercado de peixes ornamentais e alvos de capturas acidentais (Tabela 1). Uma destas espécies, Equetus lanceolatus, tem o comércio proibido. Segundo os
autores, os táxons de ambas as famílias são vulneráveis à pesca, uma vez que seus hábitos alimentares estão restritos aos ambientes recifais. Em relação à resiliência,
Holacanthus tricolor e Chaetodon striatus apresentaram maior vulnerabilidade, pois
a maior parte dos organismos capturados ainda não havia atingido a maturidade sexual.
Holacanthus ciliares e Pomacanthus paru demonstraram menor
vulnerabilidade, devido ao fato de que mais da metade dos indivíduos haviam se reproduzido pelo menos uma vez. Os indivíduos da espécie Pomacanthus paru
apresentaram a maior resiliência, mesmo possuindo o segundo maior tamanho corporal, por estarem aptos à reprodução e por possuírem menor taxa de mortalidade. Holacanthus ciliaris teve a maior taxa de mortalidade, devido ao
pequeno tamanho médio de captura.
Para a classe Chondrichthyes foram observados registros de 14 famílias. No entanto, apenas dois registros a nível de espécie foram feitos: Ginglymostoma cirratum, da família Ginglymostomatidae e Aetobatus narinari, da família
Myliobatidae.
4.2 Principais espécies por estado
Para o Rio Grande do Norte, Ribeiro (2004) registrou a maior ocorrência de espécies entre os dois estados avaliados, com Sparisoma frondosum, da família
Labridae como a mais capturada. Os resultados encontrados por Cunha, Carvalho e Araújo (2012) e Carvalho et al (2013) são semelhantes, no que diz respeito às espécies identificadas, pois os dados avaliados eram de mesma origem (certificados emitidos para as exportadoras de Natal) e coincidem com os resultados de daquele autor, para família mais representada. Porém, a espécie com maior volume de captura individual foi Ocyurus chrysurus, seguida por Epinephelus niveatus (família
Epiniphelidae).
Ivo, Vasconcelos e Osório (2010) encontraram Haemulon plumierii,
representante da família Haemulidae, como principal captura, seguida por Ocyurus chrysurus, Lutjanus analis e Lutjanus synagris, representantes da família Lutjanidae.
Gráfico 2.Principais famílias capturadas no Rio Grande do Norte.
Fonte: a autora, 2016.
Dentre as espécies identificadas por Ribeiro (2004) e Marques e Ferreira (2010) nas capturas em Pernambuco, a de maior ocorrência foi Pseudupeneus maculatus, pertencente à família Mullidae. Esta espécie também foi citada por
Nóbrega e Lessa, (2007) como principal capturada. No estudo mais recente citado acima, as famílias Haemulidae, Acanthuridae, Labridae e Lutjanidae também tiveram volumes significativos nas pescarias do referido estado, representadas pelas espécies a seguir: Haemulon squamipinna; Acanthurus chirurgus; Sparisoma axillare e Sparisoma frondosum; Lutjanus synagris, respectivamente
(Gráfico 3).
As espécies da família Haemulidae, juntamente com as da família Epinephelidae, foram registradas como principais capturas acompanhantes nas pescarias do estado de Pernambuco (MARQUES; FERREIRA, 2010)
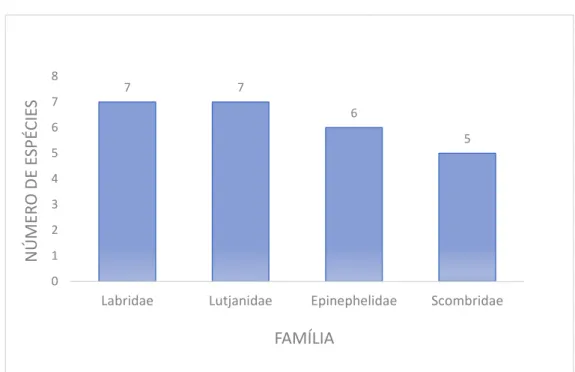
Em relação ao número de espécies para as famílias com maior número de táxons capturados, as principais foram: Labridae e Haemulidae, com sete e Lutjanidae, com cinco; (Gráfico 3), segundo Nóbrega e Lessa (2007) e Marques e Ferreira (2010). Não foi possível determinar as famílias com mais representantes a partir dos dados publicados por Ribeiro (2004), pois não foi apresentada uma divisão por estado.
7 7
6
5
0 1 2 3 4 5 6 7 8
Labridae Lutjanidae Epinephelidae Scombridae
N
ÚM
ER
O
D
E
ESP
ÉC
IE
S
Gráfico 3. Principais famílias capturadas em Pernambuco.
Fonte: a autora, 2016.
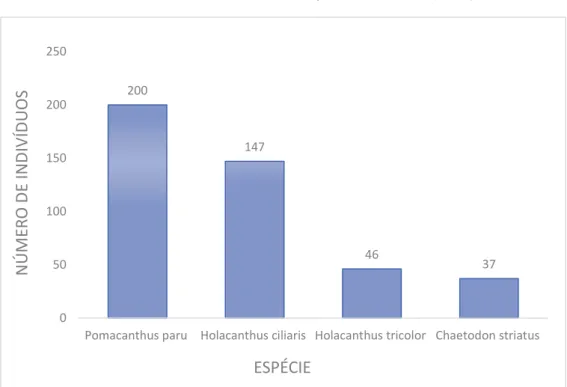
Em relação às espécies ornamentais avaliadas, o maior número de indivíduos capturados pertencia à família Pomacanthus paru, seguida por Holacanthus ciliaris e Holacanthus tricolor, todas da família Pomacanthidae. A de
menor número de indivíduos foi Chaetodon striatus, pertencente à família
Chaetodontidae (Gráfico 4).
Gráfico 4. Número de indivíduos ornamentais avaliados por Feitosa et al. (2008).
Fonte: a autora, 2016.
7 7 5 0 1 2 3 4 5 6 7 8
Labridae Haemulidae Lutjanidae
N ÚM ER O D E ESP ÉC IE S FAMÍLIA 200 147 46 37 0 50 100 150 200 250
Pomacanthus paru Holacanthus ciliaris Holacanthus tricolor Chaetodon striatus
4.3 Categoria trófica e estado de conservação das espécies
Os indivíduos classificados como carnívoros ocuparam a primeira posição na lista, com 45 espécies. A categoria comedores de invertebrados móveis foi a segunda mais numerosa para os estados avaliados, com 18 representantes Segundo Ferreira et al. (2004), esta categoria possui o maior número de
representantes e a maior distribuição ao longo do litoral do Brasil. Em terceiro lugar, estão os onívoros, com 12 espécies, seguidos pelos herbívoros errantes, com oito. Três espécies foram classificadas na categoria comedores e invertebrados sésseis e duas na categoria piscívoros (Gráfico 5). A descrição de todas as categorias está na disposta na Tabela 1.
Quatro espécies (Mugil incilis, Hippocampus reidi, Mycteroperca spp. e Sparisoma spp.) não puderam ser classificadas, devido à ausência de informações
nas fontes consultadas e à sua identificação a nível de gênero, respectivamente. Nenhum dos táxons identificados foi classificado nas categorias planctívoros ou herbívoros territoriais.
Gráfico 5. Representação das categorias tróficas das espécies capturadas.
Fonte: a autora, 2016.
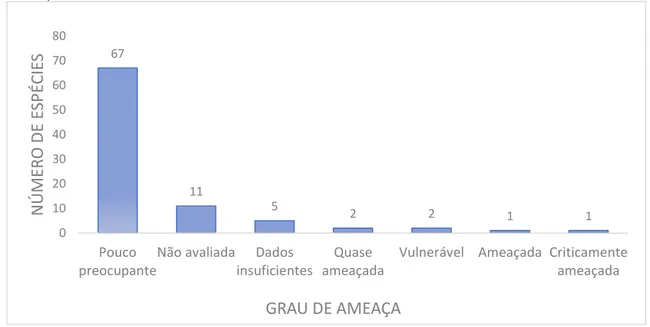
No conjunto de dados da IUCN, não constam informações referentes ao grau de ameaça de 11 das 91 espécies listadas, sendo elas as seguintes:Haemulon plumierii, Haemulon squamipinna, Istiophorus albicans, Lutjanus alexandrei, Lutjanus apodus (acredita-se que ocorreu um erro na identificação desta espécie e que, na
realidade, se trata de Lutjanus alexandrei), Lutjanus jocu, Lutjanus purpureus, Lutjanus synagris, Lutjanus vivanus, Ocyurus chrysurus e Auxis thazard thazard,
representando 11,95% do total. Outras cinco espécies (5,43% do total), não possuíam informações suficientes na basepara que pudesse ser realizada sua avaliação, as quais foram inseridas na categoria dados insuficientes. São as seguintes: Halichoeres brasiliensis, Scarus zelindae, Sparisoma axillare, Sparisoma frondosum e Hippocampus reidi.
45 18 12 8 4 3 2 0 5 10 15 20 25 30 35 40 45 50
CAR MIF OMN ROVH NE SIF PIS
Na categoria pouco preocupante, foram incluídas 67 espécies, representando 72,82% do total. Segundo as informações disponibilizadas no documento de categorias e critérios da Lista Vermelha da IUCN, as espécies que possuem larga distribuição e são abundantes no meio ambiente são classificadas nesta categoria.
As seis espécies que correm mais riscos são Balistes vetulae Mycteroperca bonaci, que se encontram nas categorias quase ameaçada; Epinephelus niveatus e Lutjanus analis que estão vulneráveis à sobrexplotação; Scarus trispinosus (pertencente ao gênero Scaurs, endêmico do Brasil) ameaçada
de extinção e Hyporthodus nigritus, criticamente ameaçada. O gráfico 6, apresenta
os dados descritos acima.
Gráfico 6. Estado de conservação das espécies segundo a Lista Vermelha da IUCN (Classe Teleostei).
Fonte: a autora, 2016.
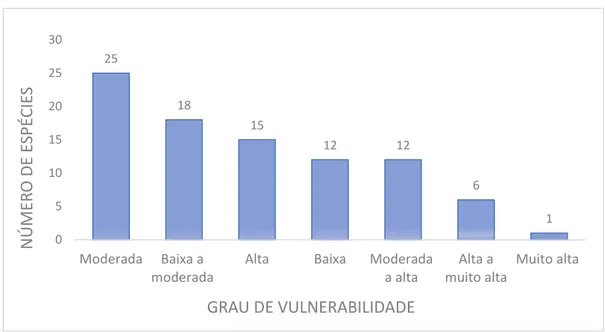
Com base nas informações disponíveis no FishBase, 12 taxóns
(Acanthurus bahianus, Acanthurus chirurgus, Chaetodon ocellatus, Chaetodon striatus, Opisthonema oglinum, Haemulon squamipinna, Sparisoma radians, Mugil incilis, Equetus lanceolatus, Pareques acuminatus, Hippocampus reidi e Canthigaster figueiredoi) foram classificados na categoria de baixo grau de
vulnerabilidade, 18 são considerados com vulnerabilidade baixa a moderada e 25 moderada.
Outras 12 espécies: Aulostomus maculatus, Balistes vetula, Carangoides bartholomaei, Elagatis bipinnulata, Seriola fasciata, Centropomus undecimalis, Cephalopholis fulva, Epinephelus adscensionis, Halichoeres brasiliensis, Cantherhines macrocerus, Lutjanus analise Pomacanthus arcuatus, estão na
categoria de vulnerabilidade moderada a alta.
Os táxons que apresentam alta vulnerabilidade segundo a base de dados são: Acanthurus coerulus, Caranx hippos, Caranx latus, Epinephelus morio, Epinephelus niveatus, Mycteroperca bonaci, Haemulon plumierii, Istiophorus
67
11
5
2 2 1 1
0 10 20 30 40 50 60 70 80 Pouco preocupante
Não avaliada Dados insuficientes
Quase ameaçada
Vulnerável Ameaçada Criticamente ameaçada N ÚM ER O D E ESP ÉC IE S
albicans, Lutjanus purpureus, Ocyurus chrysurus, Malacanthus plumieri, Mugil curema, Gymnothorax vicinus, Euthynnus alletteratus e Scomberomorus cavala.
As espécies Seriola lalandi, Epinephelus nigritus, Lutjanus jocu, Lutjanus vivanus, Gymnothorax funebris e Scomberomorus brasiliensis foram indicadas com
vulnerabilidade alta a muito alta e Gymnothorax moringa, se encontra na categoria
de vulnerabilidade muito alta.
Entre as bases de dados comparadas com os resultados, pela pesquisa de referência (CHEUNG; PITCHER; PAULY, 2005), houve considerável correspondência com os graus de ameaça com a base de dados da IUCN.
Gráfico 7. Estado de conservação das espécies segundo o FishBase (Classe Teleostei).
Fonte: a autora, 2016.
Segundo os dados da Portaria 445, 10 espécies se encontram entre alguma das categorias de ameaça. Das famílias Epinephelidae e Labridae,
Epinephelus nigritus e Scarus trispinosus, respectivamente, estão ameaçadas de
extinção. Além das citadas acima, as espécies Epinephelus morio, Epinephelus niveatus e Mycteroperca bonaci (Epinephelidae); Scarus zelindae, Sparisoma axillare e Sparisoma frondosum (Labridae); Lutjanus purpureus
(Lutjanidae) e Hippocampus reidi (Sygnathidae) se encontram em estado de
vulnerabilidade.
As duas espécies de peixes cartilaginosos registradas por Marques e Ferreira (2010), Ginglymostoma cirratum, e Aetobatus narinari, apresentam alto grau
de vulnerabilidade à extinção, segundo dados do FishBase. 25 18 15 12 12 6 1 0 5 10 15 20 25 30
Moderada Baixa a moderada
Alta Baixa Moderada
a alta Alta a muito alta Muito alta NÚME R O D E ESPÉ C IE S
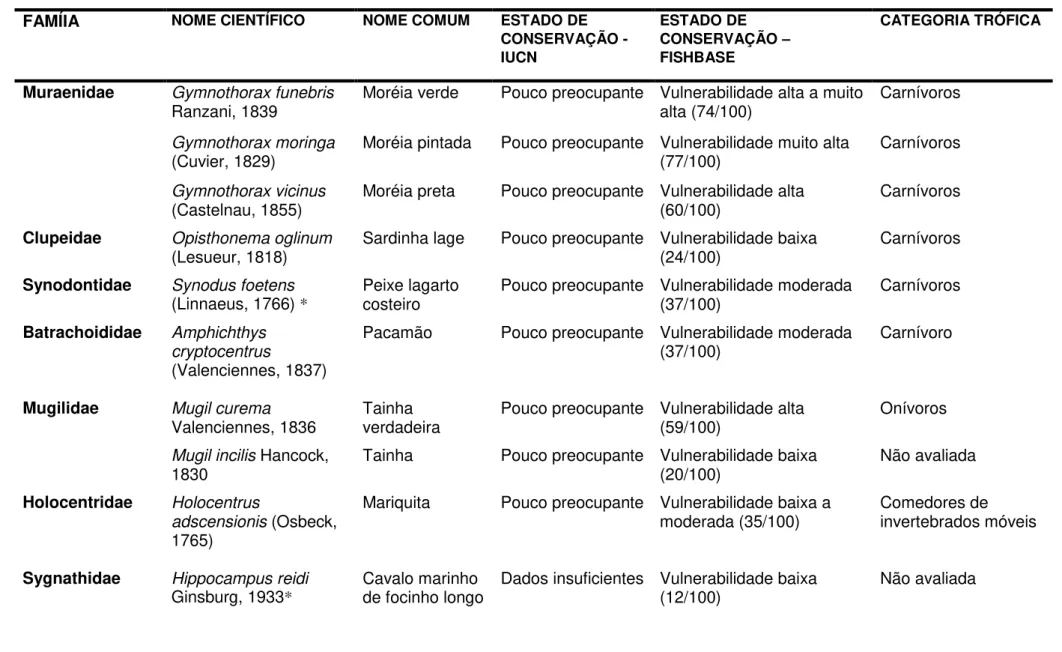
Tabela 1. Principais informações sobre as espécies capturadas com covos nos estados do Rio Grande do Norte e em Pernambuco.
FAMÍIA NOME CIENTÍFICO NOME COMUM ESTADO DE
CONSERVAÇÃO - IUCN
ESTADO DE CONSERVAÇÃO – FISHBASE
CATEGORIA TRÓFICA
Muraenidae Gymnothorax funebris
Ranzani, 1839 Moréia verde Pouco preocupante Vulnerabilidade alta a muito alta (74/100) Carnívoros
Gymnothorax moringa
(Cuvier, 1829) Moréia pintada Pouco preocupante Vulnerabilidade muito alta (77/100) Carnívoros
Gymnothorax vicinus
(Castelnau, 1855) Moréia preta Pouco preocupante Vulnerabilidade alta (60/100) Carnívoros
Clupeidae Opisthonema oglinum
(Lesueur, 1818) Sardinha lage Pouco preocupante Vulnerabilidade baixa (24/100) Carnívoros
Synodontidae Synodus foetens
(Linnaeus, 1766) *
Peixe lagarto
costeiro Pouco preocupante Vulnerabilidade moderada (37/100) Carnívoros
Batrachoididae Amphichthys
cryptocentrus
(Valenciennes, 1837)
Pacamão Pouco preocupante Vulnerabilidade moderada
(37/100) Carnívoro
Mugilidae Mugil curema
Valenciennes, 1836
Tainha verdadeira
Pouco preocupante Vulnerabilidade alta (59/100)
Onívoros
Mugil incilis Hancock,
1830 Tainha Pouco preocupante Vulnerabilidade baixa (20/100) Não avaliada
Holocentridae Holocentrus
adscensionis (Osbeck,
1765)
Mariquita Pouco preocupante Vulnerabilidade baixa a
moderada (35/100) Comedores de invertebrados móveis
Sygnathidae Hippocampus reidi
Ginsburg, 1933*
Cavalo marinho
Aulostomidae Aulostomus maculatus
(Valenciennes, 1841) *
Peixe trombeta Pouco preocupante Vulnerabilidade moderada
a alta (50/100) Carnívoros
Centropomidae Centropomus
undecimalis (Bloch,
1792)
Robalo Pouco preocupante Vulnerabilidade moderada
a alta (46/100) Carnívoros
Epinephelidae Alphestes afer (Bloch,
1793) Sapé Pouco preocupante Vulnerabilidade baixa a moderada (33/100) Carnívoros
Cephalopholis fulva
(Linnaeus, 1758) Piraúna Pouco preocupante Vulnerabilidade moderada a alta (51/100) Carnívoros
Epinephelus
adscensionis (Osbeck,
1765)
Garoupa gato Pouco preocupante Vulnerabilidade moderada
a alta (54/100) Carnívoros
Epinephelus morio
(Valenciennes, 1828) Garoupa verdadeira Quase ameaçada Vulnerabilidade alta (63/100) Carnívoros
Hyporthodus nigritus
(Holbrook 1855) Cherne/Mero negro Criticamente ameaçada Vulnerabilidade alta a muito alta (68/100) Carnívoros
Hyporthodus niveatus
(Valenciennes 1828) Cherne verdadeiro Vulnerável Vulnerabilidade alta (64/100) Carnívoros
Mycteroperca bonaci
(Poey, 1860) Badejo/Sirigado Quase ameaçada Vulnerabilidade alta (63/100) Piscívoros
Mycteroperca spp.
Malacanthidae Malacanthus plumierii
(Bloch, 1786) Pirá Pouco preocupante Vulnerabilidade alta (61/100) Carnívoros
Coryphaenidae Coryphaena hippurus
Linnaeus, 1758 Dourado Pouco preocupante Vulnerabilidade moderada (39/100) Carnívoros
Carangidae Carangoides
bartholomaei Cuvier,
1833
Guarajuba Pouco preocupante Vulnerabilidade moderada
Caranx crysos (Mitchill,
1815) Garajuba Pouco preocupante Vulnerabilidade baixa a moderada (34/100) Carnívoros
Caranx hippos
(Linnaeus, 1766) Xaréu verdadeiro Pouco preocupante Vulnerabilidade alta (58/100) Carnívoros
Caranx latus Agassiz,
1831 Guaracimbora/Xaréu Pouco preocupante Vulnerabilidade alta (57/100) Carnívoros
Elagatis bipinnulata
(Quoy & Gaimard, 1825)
Arabaiana azul Pouco preocupante Vulnerabilidade moderada
a alta (51/100) Carnívoros
Selene setapinnis
(Mitchill, 1815) Peixe galo Pouco preocupante Vulnerabilidade moderada (35/100) Carnívoros
Selene vomer
(Linnaeus, 1758) Peixe galo Pouco preocupante Vulnerabilidade baixa a moderada (31/100) Carnívoros
Seriola fasciata (Bloch,
1793) Arabaiana Pouco preocupante Vulnerabilidade moderada a alta (46/100) Carnívoros
Seriola lalandi
Valenciennes, 1833 Arabaiana Pouco preocupante Vulnerabilidade alta a muito alta (69/100) Carnívoros
Trachinotus carolinus
(Linnaeus, 1766) Pampo Pouco preocupante Vulnerabilidade moderada (37/100) Carnívoros
Lutjanidae Lutjanus alexandrei
Moura & Lindeman, 2007
Baúna/Vermelh
o Não acessada Vulnerabilidade moderada (36/100) Carnívoros
Lutjanus analis (Cuvier,
Lutjanus jocu (Bloch &
Schneider, 1801) Dentão Não acessada Vulnerabilidade alta a muito alta (66/100) Carnívoros
Lutjanus purpureus
(Poey, 1866) Pargo verdadeiro Não acessada Vulnerabilidade alta (60/100) Carnívoros
Lutjanus synagris
(Linnaeus, 1758) Ariacó/Ariocó Não acessada Vulnerabilidade moderada (38/100) Carnívoros
Lutjanus
vivanus (Cuvier, 1828)
Dentão/Pargo
olho de vidro Não acessada Vulnerabilidade alta a muito alta (68/100) Carnívoros
Ocyurus
chrysurus (Bloch, 1791)
Guaiúba Não acessada Vulnerabilidade alta
(65/100) Carnívoros
Gerreidae Diapterus auratus
Ranzani, 1842 Carapeba Pouco preocupante Vulnerabilidade baixa a moderada (26/100) Onívoros
Haemulidae Anisotremus virginicus
(Linnaeus, 1758) Salema Pouco preocupante Vulnerabilidade moderada (37/100) Comedores de invertebrados móveis
Haemulon aurolineatum
Cuvier, 1830 Xira dourada Pouco preocupante Vulnerabilidade moderada (37/100) Comedores de invertebrados móveis
Haemulon chrysargyreum Günther, 1859
Cocoroca
boquinha Pouco preocupante Vulnerabilidade baixa (27/100) Comedores de invertebrados móveis
Haemulon melanurum
(Linnaeus, 1758) Xirão/Sapuruna Pouco preocupante Vulnerabilidade baixa a moderada (33/100) Comedores de invertebrados móveis
Haemulon parra
(Desmarest, 1823)
Xira branca/ Biquara
Pouco preocupante Vulnerabilidade moderada (37/100)
Comedores de invertebrados móveis
Haemulon plumierii
Haemulon
squamipinna Rocha &
Rosa, 1999
Xira amarela Não avaliada Vulnerabilidade baixa
(20/100) Comedores de invertebrados móveis
Orthopristis ruber
(Cuvier, 1830) Xira/Cocoroca Pouco preocupante Vulnerabilidade baixa a moderada (33/100) Carnívoros
Sciaenidae Cynoscion acoupa
(Lacépède, 1801) Pescada amarela Pouco preocupante Vulnerabilidade moderada (45/100) Carnívoros
Cynoscion leiarchus
(Cuvier, 1830)
Pescada branca Não acessada Vulnerabilidade moderada
(37/100) Carnívoros
Equetus lanceolatus
(Linnaeus, 1758) * Maria nagô/ negra Pouco preocupante Vulnerabilidade baixa (22/100) Comedores de invertebrados móveis
Macrodon ancylodon
(Bloch & Schneider, 1801)
Pescada
foguete Pouco preocupante Vulnerabilidade moderada (36/100) Carnívoros
Pareques acuminatus
(Bloch & Schneider, 1801) *
Anteninha Pouco preocupante Vulnerabilidade baixa
(19/100) Carnívoros
Mulidae Mulloidichthys
martinicus (Cuvier,
1829)
Saramunete-Guaiúba Pouco preocupante Vulnerabilidade baixa a moderada (32/100) Comedores de invertebrados móveis
Pseudupeneus maculatus (Bloch,
1793)
Saramunete Pouco preocupante Vulnerabilidade moderada
Chaetodontidae Chaetodon ocellatus
Bloch, 1787 * Borboleta ocelado Pouco preocupante Vulnerabilidade baixa (15/100) Comedores de invertebrados móveis
Chaetodon striatus
Linnaeus, 1758 * Borboleta listrado Pouco preocupante Vulnerabilidade baixa (12/100) Onívoros
Pomacanthidae Holacanthus ciliaris
(Linnaeus, 1758) * Peixe anjo rainha Pouco preocupante Vulnerabilidade moderada (44/100) Onívoros
Holacanthus tricolor
(Bloch, 1795) * Peixe soldado/ Tricolor Pouco preocupante Vulnerabilidade moderada (35/100) Onívoros
Pomacanthus arcuatus
(Linnaeus, 1758) * Frade cinza/ Paru listrado Pouco preocupante Vulnerabilidade moderada a alta (51/100) Onívoros
Pomacanthus paru (Blo
ch, 1787) * Frade/Peixe anjo francês Pouco preocupante Vulnerabilidade moderada (39/100) Onívoros
Labridae Bodianus rufus
(Linnaeus, 1758) *
Budião
verdadeiro Pouco preocupante Vulnerabilidade moderada (39/100) Comedores de invertebrados móveis
Bodianus pulchellus
(Poey, 1860) *
Budião fogueira Pouco preocupante Vulnerabilidade baixa a
moderada (34/100) Carnívoros
Halichoeres brasiliensis
(Bloch, 1791) *
Budião
sipica/Sabonete brasileiro
Dados insuficientes Vulnerabilidade moderada
a alta (52/100) Comedores de invertebrados móveis
Halichoeres dimidiatus
(Agassiz, 1831) *
Budião azul Pouco preocupante Vulnerabilidade baixa a
moderada (30/100) Comedores de invertebrados móveis
Nicholsina usta
(Valenciennes, 1840) Budião sabonete/Papag aio esmeralda
Pouco preocupante Vulnerabilidade baixa a
Scarus trispinosus
Valenciennes, 1840 Papagaio azul Ameaçada Vulnerabilidade moderada (35/100) Comedor de invertebrados sesséis
Scarus zelindae
(Moura, Figueiredo & Sazima, 2001)
Papagaio
banana Dados insuficientes Vulnerabilidade baixa a moderada (32/100) Comedor de invertebrados sesséis
Sparisoma amplum
(Ranzani, 1841) Budião/Papagaio de recife Pouco preocupante Vulnerabilidade moderada (37/100) Herbívoros Errantes
Sparisoma axillare
(Steindachner, 1878) Budião/Papagaio cinza Dados insuficientes Vulnerabilidade moderada (35/100) Herbívoros Errantes
Sparisoma frondosum
(Agassiz, 1831) Budião verde Dados insuficientes Vulnerabilidade baixa a moderada (29/100) Herbívoros Errantes
Sparisoma
radians(Valenciennes,
1840)
Papagaio verde
dentuço Pouco preocupante Vulnerabilidade baixa (16/100) Herbívoros Errantes
Sparisoma spp.
Ephippidae Chaetodipterus faber
(Broussonet, 1782) Enxada Pouco preocupante Vulnerabilidade moderada (37/100) Comedores de invertebrado móveis
Acanthuridae Acanthurus bahianus
Castelnau, 1855 Acaraúna cinza Pouco preocupante Vulnerabilidade baixa (20/100) Herbívoros Errantes
Acanthurus chirurgus
(Bloch, 1787) Acaraúna preta Pouco preocupante Vulnerabilidade baixa (23/100)
Herbívoros Errantes
Acanthurus coerulus
Bloch & Schneider, 1801
Acaraúna azul Pouco preocupante Vulnerabilidade alta
(59/100) Herbívoros Errantes
Scombridae Acanthocybium solandri
Auxis thazard
(Lacépède, 1800) Bonito Não acessada Vulnerabilidade baixa a moderada (26/100) Carnívoros
Euthynnus alletteratus
(Rafinesque, 1810) Bonito Pouco preocupante Vulnerabilidade alta (57/100) Carnívoros
Scomberomorus brasiliensis Collette,
Russo & Zavala-Camin, 1978
Serra Pouco preocupante Vulnerabilidade alta a muito
alta (67/100) Carnívoros
Scomberomorus cavalla (Cuvier, 1829)
Cavala Pouco preocupante Vulnerabilidade alta
(69/100) Carnívoros
Thunnus atlanticus
(Lesson, 1831) Albacorinha Pouco preocupante Vulnerabilidade moderada (41/100) Carnívoros
Istiophoridae Istiophorus albicans
(Latreille, 1804) Agulhão de vela Não avaliada Vulnerabilidade alta (65/100) Carnívoros
Balistidae Balistes vetula
Linnaeus, 1758 Cangulo rei Quase ameaçada Vulnerabilidade moderada a alta (54/100) Onívoros
Xanthichthys ringens
(Linnaeus, 1758) Cangulo mirim Pouco preocupante Vulnerabilidade baixa a moderada (28/100) Comedores de invertebrados móveis
Monacanthidae Cantherhines
macrocerus (Hollard,
1855) *
Cangulo/Porqui nho pintado
Pouco preocupante Vulnerabilidade moderada a alta (46/100)
Onívoros
Cantherhines pullus
(Ranzani, 1842) Cangulo de pedra/Peixe porco
Pouco preocupante Vulnerabilidade baixa a
moderada (30/100) Onívoros
Stephanolepis hispidus
Ostracidae Lactophrys trigonus
(Linnaeus, 1758) * Baiacú cofre Pouco preocupante Vulnerabilidade baixa a moderada (32/100) Onívoros
Tetraodontidae Canthigaster figueiredoi
4.4 Características das embarcações e armadilhas utilizadas e esforço de pesca aplicado nas capturas
Na pesca de peixes em ambientes recifais foram utilizados barcosde madeira, motorizados e classificados, em relação ao tamanho como pequenas (comprimento inferior a oito metros), médias (comprimento entre oito e 12 metros) e grandes (comprimento superior a 12 metros) (IVO; VASCONCELOS; OSÓRIO, 2010; MARQUES; FERREIRA 2010; CARVALHO et al., 2013).
No estado de Pernambuco, embarcações de pequeno porte, com média de quatro pescadores a bordo, foram utilizadas por viagem (MARQUES; FERREIRA, 2010). Para o Rio Grande do Norte, foram utilizados barcos classificados nas três categorias, porém, com dominância daqueles de médio porte e com tripulação de quatro a seis homens por viagem (IVO; VASCONCELOS; OSÓRIO, 2010; CARVALHO et al. 2013). Algumas destas embarcações passaram a ser utilizadas
principalmente na pesca de peixes recifais neste estado (CUNHA; CARVALHO; ARAÚJO, 2012).
As armadilhas de formato retangular foram as únicas artes de pesca utilizadas nas pescarias realizadas em Pernambuco (NÓBREGA; LESSA, 2007). Utilizava-se Polietileno de Alta Densidade (PEAD) ou Policroleto de Polivinila (PVC) como material de revestimento dos petrechos, de acordo com Ribeiro (2004) e Marques e Ferreira (2010), respectivamente. No Rio Grande do Norte, foi observado tanto o uso de covos em forma de V quanto de covos retangulares, sendo o primeiro tipo o principal utilizado no estado. No entanto, em uma das embarcações observadas se utilizava anzóis associados ao segundo tipo de armadilhas nas capturas (RIBEIRO, 2004; IVO, VASCONCELOS; OSÓRIO, 2010; CARVALHO et al.2013). Foi registrada também a redução do uso daquelas em forma de V, devido
às suas grandes dimensões, fato considerado um empecilho em relação ao seu uso pelos pescadores e à maior resistência das armadilhas retangulares, uma vez que as primeiras são revestidas por parte de uma gramínea comum na região, conhecida como cana brava. (Figura 2).
Foram observadas variações no número de armadilhas utilizadas nas pescarias de ambos estados. No Rio Grande do norte, foi registrado o uso de 31 covos-dia para os do tipo retangular e 24 para o tipo V em média, por viagem por Ribeiro (2004) e de 63 covos-dia por Ivo, Vasconcelos e Osório (2010). Segundo Carvalho et al. (2013) o esforço de pesca aplicado era de 175 covos-dia em média,
com o uso de iscas (cabeças de camarão) e períodos de submersão variando entre 24 e 72 horas.
Para o Estado de Pernambuco, Ribeiro (2004) identificou média de 40 covos–dia, por barco, lançados três vezes por semana, com duas retiradas depois de 48 horas e uma após 72 horas, enquanto Feitosa et al. (2008) observaram a aplicação de 15
Figura 2. Armadilhas utilizadas na pesca de peixes recifais no Rio grande do Norte e em Pernambuco (A) Retangular e B) Em forma de V).
A)
B)
Fonte: José Airton de Vasconcelos (2010).
Observou-se também variações nos valores de abertura na malha das armadilhas utilizadas nos estados monitorados. Enquanto Ribeiro (2004) observou um espaço de três centímetros para os covos em formato de V, utilizados no Rio Grande do Norte, Feitosa et al. (2008) registraram intervalo de um a sete
centímetros, nas armadilhas de Pernambuco.
Todos os autores que realizaram observações no Rio Grande do Norte registraram os maiores valores de esforço de pesca aplicado entre os meses de dezembro e abril, período de estação seca. Os autores declararam que os meses chuvosos apresentavam menores valores de captura, devido às condições meteorológicas e oceanográficas da região, como por exemplo, ventos e correntes mais fortes, as quais afetam a eficiência dos covos. Para o estado de Pernambuco não foi feita nenhuma observação.
4.5 Beneficiamento e comercialização dos organismos
Durante os anos de 1996 e 2008, nos quais foram realizadas coletas de dados por Cunha, Carvalho e Araújo (2010) e Carvalho et al. (2013) no Rio Grande
do Norte, 10 empresas exportadoras estiveram ativas no mercado, com a entrada e saída de algumas do ramo. As informações apresentadas pelos autores foram obtidas por meio de visitas a três das firmas que operaram durante este período.
As fases do beneficiamento dos peixes exportados por empresas localizadas na capital do Rio Grande do Norte, Natal, foram descritas por Carvalho
et al. (2013). Cada exportadora seguia protocolos de avaliação da qualidade,
determinados pelo país de destino dos produtos. As exigências diziam respeito às espécies de interesse para o comércio, o tamanho e a aparência dos organismos, bem como do manuseio adequado dos mesmos, de forma que fosse evitada sua contaminação. No caso de algum indivíduo não apresentar as características exigidas pelo comprador, ou ter sido capturado acidentalmente o mesmo era devolvido ao pescador que o forneceu e, normalmente, vendido na mesma cidade.
As espécies eram classificadas em quatro produtos diferentes: peixe inteiro fresco (PIF), peixe eviscerado fresco (PEF), peixe inteiro congelado (PIC) e peixe eviscerado congelado (PEC). Após a avaliação, passavam por diversas etapas até seu envio ao vendedor final. Algumas espécies passavam por processo de descamação, em seguida, os organismos a serem exportados eviscerados, de todas as espécies, passavam por tal processo para, em seguida, serem lavados e classificados de acordo com seu peso, embalados e estocados em um ambiente climatizado até o momento de sua expedição, por via aérea ou marítima. A maior parte das exportações era feita com os organismos frescos, inteiros ou eviscerados.
porém, devido à abundância que apresentava na região e ao interesse do mercado exterior, foi a única desta categoria classificada como de primeira.
Segundo Cunha, Carvalho e Araújo (2012) e Carvalho et al. (2013), o
5. DISCUSSÃO
A pesca de peixes recifais com armadilhas no Nordeste do Brasil, bem como em outras regiões do mundo, é uma atividade que envolve uma considerável riqueza de organismos. No presente estudo 91 espécies e 29 famílias foram registradas nas observações realizadas ao longo dos últimos anos neste país. O total dos táxons identificados representa cerca de 20% das espécies recifais conhecidas para a costa brasileira, que são 437 (FLOETER et al., 2008).
Labridae, a principal família registrada nas capturas é citada por Price et al. (2015) como uma das famílias mais bem sucedidas na ocupação dos ambientes
recifais e também como estando entre as mais diversas. Esta família, assim como Carangidae, Lutjanidae, Epinephelidae, Haemulidae e Scombridae, as quais apresentaram os maiores números de táxons capturados, são também bastante valorizadastanto no mercado local quanto no internacional (JOHNSON, 2010). As famílias citadas representaram menos de um terço do total observado, porém, continham mais da metade das espécies desembarcadas.
Espécies, como as ornamentais das famílias Pomacanthidae e Chaetodontidae, por exemplo, ou aquelas pertencentes à família Labridae (Bodianus rufus e Halichoeres dimidiatus), apresentaram volumes pouco significantes nos
desembarques. A ocorrência de espécies pouco observadas nas capturas pode ser explicada pela baixa seletividade do petrecho utilizado, que culmina com a captura acidental de alguns organismos e seu respectivo descarte (MARQUES; FERREIRA, 2010). Este descarte ocorre, muitas vezes, pelo baixo valor comercial das espécies ou tamanho reduzido dos indivíduos, mesmo aqueles considerados importantespara a economia (FAO, 2014).
Organismos de interesse no mercado da aquariofilia são capturados comumente como fauna acompanhante nesse tipo de pescaria. As avaliações realizadas com indivíduos de quatro espécies capturadas em Pernambuco resultaram na classificação de todas como susceptíveis à captura e metade destas com baixa capacidade de recuperação em relação à pressão pesqueira exercida sobre as populações (FEITOSA et al., 2008).
Algumas espécies registradas como componentes da captura não são consideradas tipicamente recifais, como é o caso de alguns indivíduos das famílias Clupeidae, Centropomidae, Coryphaenidae, Istiophoridae, Mugilidae, Sciaenidae e Scombridae, presentes nos desembarques monitorados por Marques e Ferreira (2010) e Ivo, Vasconcelos e Osório (2010). Isto pode ser explicado pelo uso comum de outras artes de pesca simultaneamente às armadilhas, tal como anzol e linha e redes (MARIANO; ROSA, 2010; CARVALHO et al., 2013).
dos herbívoros, pode representar a ocorrência de efeito cascata nesses ecossistemas.
Em relação à classificação das espécies quanto ao seu grau de ameaça, os dados resultantes apresentaram diferenças significativas. A Lista Vermelha da IUCN, classificou apenas quatro espécies dentro das três categorias de maior ameaça, entre elas está Scarus trispinosus, endêmica para a costa brasileira e
identificada como ameaçada de extinção. Na classificação do FishBase, no entanto, 22 espécies estão nas categorias de maior vulnerabilidade. Dentre as espécies assim classificadas, metade diz respeito às famílias Muraenidae, com os três táxons observados nos desembarques estando sob algum grau de ameaça, Epinephelidae e Lutjanidae, cada uma com cinco espécies entre as mais vulneráveis.
A lista de espécies vulneráveis publicada na portaria 445 do MMA contém apenas 10 táxons entre os observados nas capturas. Dentre eles, Scarus zelindae, Sparisoma axillare, Sparisoma frondosume Hippocampus reidi não foram citados por
nenhuma das outras fontes consultadas.O documento citado acima indica 475 espécies de peixes e invertebrados aquáticos ameaçados de extinção no Brasil e propõe algumas medidas de conservação para estes, porém ainda não entrou em vigor, devido a uma liminar que suspende os efeitos de tal portaria e que não possui data estimada para julgamento (VALE, 2016).
Estas diferenças denotam a necessidade de se analisarem cuidadosamente os critérios aplicados na classificação das espécies (STRONA, 2014). A presença das espécies do gênero Scarus, endêmicas da costa brasileira
chama a atenção para a necessidade do monitoramento mais efetivo das capturas, uma vez que caso estas espécies sejam extintas, não será apenas a nível local, e sim global (FLOETER; HALPERN; FERREIRA, 2006).
Foi observado que os organismos classificados com maior grau de ameaça estão nos níveis superiores da cadeia trófica (principalmente carnívoros) (FLOETER et al., 2013). Estes animais são de grande importância econômica, pois
geralmente possuem o maior tamanho corporal e consequentemente, maior valor entre os indivíduos comercializados, como descrito por Marques e Ferreira (2010).
Quanto ao emprego desta arte de pesca, a preferência dos pescadores pelo uso de armadilhas de formato retangular foi justificada por estas serem mais compactas e pela maior resistência do material utilizado em sua composição (PEAD), em comparação às de formato V, que eram compostas por cana brava (RIBEIRO, 2004; IVO; VASCONCELOS; OSÓRIO, 2010). Pode-se afirmar que não existe padronização do esforço de pesca aplicado nos estados avaliados, com base nas variações observadas no uso das embarcações e armadilhas registradas em todos os estudos avaliados, como é o caso do tamanho das embarcações, da quantidade e tempo de submersão dos covos e da abertura da malha destes petrechos.
em sua maioria exportados para outros países. Apenas quando não cumpriam as exigências feitas pelos compradores eram devolvidos aos pescadores e vendidos localmente (CARVALHO et al., 2013). Em Pernambuco, no entanto, os peixes de
maior valor e maior tamanho eram vendidos no próprio estado, em peixarias ou feiras livres e, apenas os budiões, caraúnas e saramunetes eram exportados, sendo os saramunetes o principal alvo de captura e exportação (MARQUES; FERREIRA, 2010). Esta afirmação é justificada pela ocorrência das espécies componentes destas categorias junto com espécies de importância comercial, como os lutjanídeos e epinefelideos e pela consequente aprovação dos consumidores finais (Roberto A. A. de Carvalho, comunicação pessoal).
Os períodos de maior captura registrados por Ribeiro (2004), Cunha, Carvalho e Araújo (2012) Carvalho et al. (2013) se concentraram entre os meses de
dezembro e abril, dados que corroboram com a afirmação de que o uso das armadilhas na capturade peixes recifais ocorre durante o período dedefeso da lagosta e confirmam a efetividade da prática como uma alternativa de fonte renda para os pescadores. No que diz respeito às exportações, foi observada a relação entre os maiores e os períodos de melhor cotação do dólar, moeda utilizada no mercado (Roberto A. A. de Carvalho, comunicação pessoal).
Embora a exportação seja uma atividade com forte presença na região, pôde-se perceber a incapacidade das empresas em fornecer informações científicas adequadas sobre as espécies comercializadas, como foi observado para algumas famílias exportadas no Rio Grande do Norte. As falhas na fiscalização realizada pelos órgãos governamentais responsáveis (principalmente o MAPA), também é um obstáculo ao monitoramento adequado da atividade, como identificado por CUNHA, CARVALHO e ARAÚJO, (2012). No entanto, os autores citados acima justificam a dificuldade de identificação dos animais, em parte, com o argumento de que os indivíduos de uma mesma espécie podem apresentar padrões variados em sua coloração e que os compradores não exigem separação por espécie para algumas famílias, como ocorre com a família Labridae.
O conjunto de dados obtidos comprova o aumento indiscriminado do aumento nas capturas de fontes marinhas de proteína para consumo humano, uma vez que os estoques daquelas consideradas como principais alvos não conseguem suprir a demanda atual, como é o caso da lagosta (IVO; VASCONCELOS; OSÓRIO, 2010). Isto indica que os principais atores envolvidos nesta atividade, que são pescadores e os responsáveis pela comercialização dos produtos, aparentam interesse principalmente em suprir a demanda existente, sem considerar os diversos fatores que são intrínsecos ao equilíbrio ambiental, como por exemplo, a manutenção das populações explotadas e, por sua vez, influenciam diretamente a oferta dos produtos procurados.
reprodução destes animais ocorre entre os meses de julho e setembro) e aos custos da prática (no período de captura os esforços aplicados pode atingir altos valores, no intuito de gerar bons rendimentos) para as espécies capturadas (SILVA; FONTELES FILHO, 2011).
Estas informações podem ser utilizadas como exemplo na tomada de atitudes em relação à preservação de espécies de peixes recifais, antes que estas entrem em colapso, bem como demonstrar a necessidade de estudar profundamente o ciclo de vida das espécies as quais se deseja direcionar a medida de proteção, garantindoo cumprimento de seus objetivos.