SANDRA PIEDAD VELASQUEZ MEDINA
CRIOPRESERVAÇÃO DO SÊMEN DE PIRAPITINGA
Piaractus brachypomus (PISCES, CHARACIDAE)
Universidade Federal do Ceará
Instituto de Ciências do Mar
Sandra Piedad Velásquez Medina
CRIOPRESERVAÇÃO DO SÊMEN DE PIRAPITINGA
Piaractus brachypomus (PISCES, CHARACIDAE)
Dissertação apresentada à Coordenação do Curso de Ciências Marinhas Tropicais do Instituto de Ciências do Mar da Universidade Federal do Ceará, como requisito parcial para a obtenção do grau de Mestre em Ciências Marinhas.
Área de concentração: Utilização e Manejo de Ecossistemas Marinhos e Estuarinos
Orientador:Prof. Dr. Luiz Drude de Lacerda.
Co-orientadora: Dra. Cristiane Clemente de Mello Salgueiro.
Velásquez-Medina, Sandra P.
Criopreservação do sêmen de pirapitinga, Piaratus brachypomus (Pisces, Characidae)/ Sandra Velásquez Medina – Fortaleza, 2008.
96 f.
Dissertação (Mestrado em Ciências Marinhas
Tropicais) - Universidade Federal do Ceará, Instituto de Ciências do Mar.
D ed i co est e t r a ba j o a m i p a p á L u i s
F r a n ci sco, a m i h er m a n a V i ck y y a
Gu st a v o qu e son p a r a m i l a s
p er son a s m a s i m p or t a n t es en m i
“En el f on d o, l os ci en t í f i cos som os gen t e con su er t e:
p od em os j u ga r a l o qu e qu er a m os d u r a n t e t od a l a v i d a ” .
L ee Sm ol i n
“ Si n o con oz co u n a cosa , l a i n v est i ga r é” .
Meus agradecimentos a continuação são de todo coração, já que estas pessoas colocaram seu grãozinho de areia tanto de forma emocional, educativa ou laboral para a realização desta dissertação:
Ao professor Luiz Drude agradeço imensamente por ter-me apoiado neste projeto no ultimo momento e ter-me brindado sua orientação sabendo do pouco tempo que ele dispõe.
A minha família por estar sempre me ajudando e me animando em tudo o que eu preciso.
A Cristiane Mello por seu tempo e sugestões em cada uma das páginas deste trabalho.
Ao meu querido Gustavo, namorado, noivo, amigo, cúmplice, confidente e demais, que está todos os dias lutando do meu lado para conseguir as coisas “tavo, sin ti no se a donde mi mente hubiera vagado”.
À Pós-Graduação em Ciências Marinhas Tropicais da Universidade Federal do Ceará, pela oportunidade concedida.
À CAPES pela ajuda financeira para me manter no Brasil nestes anos.
Ao pessoal do Laboratório de Tecnologia de Sêmen Caprino e Ovino da UECE, em especial ao Marcelo e à Audália, sendo pessoas maravilhosas, ensinando-me os primeiros passos da criopreservação e ajudando-me nas minhas coletas.
Ao pessoal do DNOCS por permitir-me realizar minhas coletas nas suas instalações e em especial ao Pedro e ao Alexandre pela grande disposição em colaborar.
A meus amigos brasileiros Fredy, Luciano, Eduardo e Fabiano, que sempre me escutaram e me alegraram.
Ao pessoal dos Laboratórios de Ecologia Marina e Ecotoxicologia do LABOMAR, pessoas tão amáveis que sempre me abriram as portas para compartir com eles.
Ao professores e funcionários do LABOMAR nos momentos de gentileza para comigo, em especial à Maria Gomes por ser um tipo de pessoa de quem mais precisa o mundo, com seu bom dia e sorriso a cada dia.
Ao Frank pelas conversas e ajuda nas minhas dúvidas na língua inglesa.
A pirapitinga (Piaractus brachypomus) é uma espécie de peixe exótico introduzido no nordeste brasileiro, o qual tem grande importância comercial devido a seu hábito alimentar, excelente crescimento, resistência ao manejo em cativeiro e às enfermidades. A criopreservação de seu sêmen pode contribuir nos aspectos econômico, genético e meio ambiental da região e da espécie. O objetivo deste trabalho foi desenvolver um protocolo adequado de congelação seminal para poder obter motilidades próximas ao sêmen a fresco. Trabalhou-se com o sêmen de 19 machos maduros de dezembro de 2007 a março de 2008, determinando as características seminais; a toxicidade dos crioprotetores DMSO 10% e metilglicol 10%, diluídos em glicose 5%, ACP-104 e solução Ringer nas diluições de 1:3, 1:5 e 1:7, durante 15 minutos a 4°C; a criopreservação a -196°C com as mesmas criodiluições usando palhetas de 0,25 e 0,5 mL, congeladas em vapores de nitrogênio líquido em caixas de isopor ou em “dry shipper”, sendo depois transferidas para botijões criogênicos durante 15 dias. Foram avaliadas as motilidades e velocidades através da análise seminal auxiliado por computador (CASA) pós-descongelação; e a morfologia seminal a fresco e pós-descongelação. Os parâmetros seminais a fresco observados foram: motilidade objetiva média de 94%, concentração de 44 x 109 spzt/mL, volume de 7 mL, osmolaridade de 317 mOsm/Kg e pH de 8,4. Nos testes de toxicidade não foram encontradas diferenças significativas entre o T3 (Ringer+Metilglicol 10%) na diluição 1:3 comparado com o grupo controle (P=0.06), apresentando motilidade de 80% e VCL de 95 µm/s. O melhor método de congelamento foi o “dry shipper” utilizando palhetas de 0,5 mL, registrando motilidade de 62% para o T6 (Glicose+DMSO 10%) na diluição 1:7, entretanto, apresentaram baixas velocidades para todos os tratamentos, com melhores resultados de VCL, VSL e VAP para o T6. No sêmen fresco, a morfoanomalia mais encontrada foi a cauda dobrada (20%) e no sêmen pós-descongelação, a cauda enrolada (23%). Comparando-se os resultados de morfoanomalias antes e pós-descongelamento foram observadas diferenças significativas entre as amostras (P<0,05). Conclui-se que o sêmen de pirapitinga pode ser preservado em Ringer+Metilglicol 10% em 1:3, sem apresentar altas toxicidades, e criopreservado em Glicose+DMSO 10% utilizando o “dry shipper”.
The pirapitinga (Piaractus brachypomus) is a species of exotic fish introduced in the Brazilian north-eastern, with great commercial importance for its alimentary habit, excellent growth, handling resistance in captivity and against diseases. The cryopreservation of its semen can contribute in the economic, genetic and environment aspects of the region and the species. The objective of this work was to develop an adequate protocol of seminal frozen to be able to obtain motility closer to the fresh semen. It was worked with the semen of 19 mature males between December of 2007 and March of 2008, determining its seminal characteristics; the cryoprotectants toxicity DMSO 10% and methylglicol 10%, diluted in glucose 5%, ACP-104 and Ringer solution at 1:3, 1:5 and 1:7 dilutions, during 15 minutes at 4°C; the cryopreservation at -196°C with the same cryoextenders using 0,25 and 0,5 mL straws, frozen in nitrogen vapor inside styrofoam boxes or in dry shipper, being later transferred to cryogenic containers for 15 days. It was evaluated the motilities and speeds through the computer-assisted sperm analysis (CASA) post-thawed; and the morphology in fresh and post-thawed semen. The seminal parameters observed in fresh semen were: objective mean motility of 94%, concentration of 44 x 109 spzt/mL, semen volume of 7 mL, osmolarity of 317 mOsm/kg and pH of 8,4. In the toxicity tests weren’t find significant differences between T3 (Ringer+Methylglicol 10%) at 1:3 dilution compared with the control group (P=0.06), showing motility of 80% and VCL of 95 µm/s. The best frozen method was in dry shipper using 0.5 mL straws, registering motility of 62% for T6 (Glucose+DMSO 10%) at 1:7 dilution, however, showing low speeds for all treatments, with better results of VCL, VSL and VAP to T6. In fresh semen, the morpho anomalies most found was the tail doubled (20%) and in the post-thawed semen, the tail coiled (23%). Comparing the morpho anomalies results before and after frozen it was observed significant differences between samples (P<0.05). It was concluded that the pirapitinga semen can be preserved in Ringer+Methylglicol 10% in 1:3, without presenting high toxicities, and cryopreservated in Glucose+DMSO 10% using dry shipper.
Pág.
RESUMO... vii
ABSTRACT... viii
LISTA DE ABREVIATURAS E SÍMBOLOS... xi
LISTA DE FIGURAS... xii
LISTA DE TABELAS E QUADROS ... xvi
1. INTRODUÇÃO... 01
2. REVISÃO DE LITERATURA... 03
2.1. Descrição da espécie... 03
2.2. Características gerais do espermatozóide de teleósteos... 05
2.2.1. Motilidade... 06
2.2.2. Morfoanomalias... 08
2.3. Processo de Congelamento... 10
2.3.1. Agentes crioprotetores... 12
2.3.2. Meios diluentes... 13
2.4. Avaliação da cinética espermática através de análise seminal auxiliada por computador (CASA)... 14
3. JUSTIFICATIVA... 16
4. OBJETIVOS... 18
4.1. Objetivo Geral... 18
4.2. Objetivos Específicos... 18
5. MATERIAL E MÉTODOS... 19
5.1. Local do experimento e animais experimentais... 19
5.2. Hipofisação dos reprodutores... 20
5.3. Coleta de sêmen... 20
5.4. Teste de contaminação do sêmen... 21
5.5. Avaliação da motilidade... 21
5.6. Características seminais... 22
5.7. Estudo da toxicidade do crioprotetor... 23
5.8.Congelamento e descongelamento seminal... 24
Experimento 3: Congelamento em “dry shipper” em palhetas de 0,5 mL.. 27
5.9. Análise morfológica do sêmen... 28
5.10. Análises estatísticas... 29
6. RESULTADOS... 30
6.1. Características do sêmen... 30
6.2. Estudo da toxicidade dos crioprotetores... 31
6.2.1. Motilidade... 31
6.2.2. Velocidades... 32
6.3. Congelamento e descongelamento seminal... 37
Experimento 1: Congelamento em rampa em palheta de 0,25 mL... 37
Experimento 2: Congelamento em rampa em palheta de 0,5 mL... 40
Experimento 3: Congelamento em “dry shipper” em palhetas de 0,5 mL.. 43
6.4. Análise morfológica do sêmen... 50
7. DISCUSSÃO... 53
7.1. Características do sêmen... 53
7.2. Estudo da toxicidade de crioprotetores... 54
7.3. Testes de Criopreservação... 57
7.4. Análise morfológica do sêmen... 61
8. CONCLUSÕES... 64
LISTA DE ABREVIATURAS E SÍMBOLOS
% Porcentagem
ACP-104 Meio diluente à base de água de coco em pó para sêmen de peixes ATP Adenosina trifosfato
AMPc Adenosina monofosfato ciclico
°C Graus Celsius
CASA Computer Assisted Semen Analysis DMSO Dimetil sulfóxido
EP Erro padrão
LTSCO Laboratório de Tecnologia do Sêmen Caprino e Ovino
M Mol
mL Mililitro mOsm Miliosmoles N2L Nitrogênio líquido
pH Potencial hidrogeniônico
s Segundo
SCA Sperm Class Analyzer
T1 Tratamento 1 (Ringer + DMSO 10%) T2 Tratamento 2 (ACP-104 + DMSO 10%) T3 Tratamento 3 (Ringer + Metilglicol 10%) T4 Tratamento 4 (ACP-104 + Metilglicol 10%) T5 Tratamento 5 (Glicose 5% + Metilglicol 10%) T6 Tratamento 6 (Glicose 5% + DMSO 10%) µL Microlitros
µm Micrômetro
VAP Velocidade média
Pág.
Figura 1. Adulto de pirapitinga (Piaractus brachypomus)... 05
Figura 2. Espermatozóides de Piaractus brachypomus a 400X, corados com azul de bromofenol... 06
Figura 3. Dinâmica dos mecanismos de inibição e ativação espermática em peixes de água doce (Adaptado de Tabares et al.,2005)... 08
Figura 4. Equipamentos para congelamento de sêmen: (A) geladeira de poliestireno com rampa metálica, (B) “dry shipper”... 12
Figura 5. Representação esquemática das diferentes velocidades medidas pelo sistema de análise seminal (CASA). VCL= velocidade curvilinear; VSL= velocidade em linha reta; VAP = velocidade média... 15
Figura 6. Leitura da marcação eletrônica com chip das pirapitingas... 19
Figura 7. Coleta do sêmen de pirapitinga em Epperdorf... 20
Figura 8. Teste de toxicidade, criodiluições resfriadas a 4°C... 23
Figura 9. Preenchimento de palhetas com as criodiluções... 25
Figura 10. Raques com globetes para o armazenamento das palhetas... 25
Figura 11. Descongelamento das palhetas em banho-maria... 26
Figura 12.Página principal do resultado da avaliação de motilidade com o sistema CASA... 26
Figura 13. Representação dos movimentos dos espermatozóides de pirapitinga avaliados com o método CASA... 27
Figura 14. Congelamento em “dry shipper” a -170°C... 28
Figura 16. Média ± erro padrão das velocidades espermáticas, em µm/s, nas diferentes criodiluições avaliadas no teste da toxicidade. VCL = velocidade curvilinear; VSL = velocidade linear; VAP = velocidade média. T1 = Ringer+DMSO 10%; T2 = 104+DMSO 10%, T3 = Ringer+Metilglicol 10%; T4 = ACP-104+Metilglicol 10%; T5 = Glicose 5%+Metilglicol 10%; T6 = Glicose 5%+DMSO 10%. Letras diferentes são significativamente diferentes (P<0.05)... 34
Figura 17. Médias e intervalo de confiança da motilidade de espermatozóides progressivos, rápidos, médios e lentos nas criodiluições avaliadas no teste de toxicidade. T1 = Ringer+DMSO 10%; T2 = ACP-104+DMSO 10%, T3 = Ringer+Metilglicol 10%; T4 = ACP-104+Metilglicol 10%; T5 = Glicose 5%+Metilglicol 10%; T6 = Glicose 5%+DMSO 10%... 35
Figura 18. Médias e intervalo de confiança das velocidades espermáticas, em µm/s, nas diferentes criodiluições avaliadas no teste da toxicidade. VCL = velocidade curvilinear; VSL = velocidade linear; VAP = velocidade média. T1 = Ringer+DMSO 10%; T2 = 104+DMSO 10%, T3 = Ringer+Metilglicol 10%; T4 = ACP-104+Metilglicol 10%; T5 = Glicose 5%+Metilglicol 10%; T6 =
Glicose 5%+DMSO 10% 36
Figura 19. Curva de congelamento dos experimentos 1 e 2 utilizando o equipamento de geladeira de isopor com rampa durante 5 minutos... 37
Figura 21. Média e erro padrão das velocidades espermáticas, em µm/s, pós-descongelamento, em palheta de 0,25 mL e rampa de congelamento. T1 = Ringer+DMSO 10%; T2 = ACP-104+DMSO 10%, T3 = Ringer+Metilglicol 10% ; T4 = ACP-104+Metilglicol 10%; T5 = Glicose 5%+Metilglicol 10% ; T6 = Glicose 5%+DMSO 10%... 40
Figura 22. Média e erro padrão da motilidade de espermatozóides progressivos, rápidos, médios e lentos pós-descongelamento utilizando palheta de 0,50 mL e rampa de congelamento. T1 = Ringer+DMSO 10%; T2 = ACP-104+DMSO 10%, T3 = Ringer+Metilglicol 10%; T4 = ACP-104+Metilglicol 10%; T5 = Glicose 5%+Metilglicol 10%; T6 = Glicose 5%+DMSO 10%... 41
Figura 23. Média e erro padrão das velocidades espermáticas, em µm/s, pós-descongelamento, em palheta de 0,50 mL e rampa de congelamento. T1 = Ringer+DMSO 10%; T2 = ACP-104+DMSO 10%, T3 = Ringer+Metilglicol 10%; T4 = ACP-104+Metilglicol 10%; T5 = Glicose 5%+Metilglicol 10%; T6 = Glicose 5%+DMSO 10%... 43
Figura 24. Média e erro padrão da motilidade de espermatozóides progressivos, rápidos, médios e lentos pós-descongelamento utilizando palheta de 0,50 mL e “dry shipper”. T1 = Ringer+DMSO 10%; T2 = ACP-104+DMSO 10%, T3 = Ringer+Metilglicol 10% ; T4 = ACP-104+Metilglicol 10%; T5 = Glicose 5%+Metilglicol 10% ; T6 = Glicose 5%+DMSO 10%... 46
Figura 25. Média e erro padrão das velocidades espermáticas (curvilinear, linear e média) pós-descongelamento utilizando palheta de 0,50 mL e “dry shipper”. T1 = Ringer+DMSO 10%; T2 = 104+DMSO 10%, T3 = Ringer+Metilglicol 10% ; T4 = ACP-104+Metilglicol 10%; T5 = Glicose 5%+Metilglicol 10% ; T6 = Glicose 5%+DMSO 10%... 46
de Piaractus brachypomus a fresco... 51
Tabela 1. Diluentes e crioprotetores utilizados no teste de toxicidade e na criopreservação de sêmen de pirapitinga (Piaractus brachypomus) 24
Tabela 2. Morfoanomalias em espermatozóides de pirapitinga (Piaractus brachypomus)... 29
Tabela 3. Características seminais das pirapitingas, avaliadas durante o período de dezembro de 2007 a março de 2008... 30
Tabela 4. Características dos “pools” de sêmen de pirapitinga... 31
Tabela 5. Valores médios das porcentagens de motilidade total (MT), espermatozóides rápidos, médios e lentos, e velocidades curvilinear (VCL), linear (VSL) e média (VAP) (µm/s) nos testes de toxicidade... 33
Tabela 6. Média e erro padrão da motilidade, em porcentagem, de espermatozóides progressivos, rápidos, médios e lentos, e velocidades curvilinear (VCL), linear (VSL) e média (VAP), em µm/s, no teste de congelamento na geladeira de isopor, em palheta de 0,25 mL... 39
Tabela 7. Média e erro padrão da motilidade, em porcentagem, de espermatozóides progressivos, rápidos, médios e lentos, e velocidades curvilinear (VCL), linear (VSL) e média (VAP), em µm/s, no teste de congelamento na geladeira de isopor, em palheta de 0,50 mL... 42
Tabela 8. Média e erro padrão da motilidade, em porcentagem, de espermatozóides progressivos, rápidos, médios e lentos, e velocidades curvilinear (VCL), linear (VSL) e média (VAP), em µm/s, no teste de congelamento no “dry shipper”, em palheta de 0.50 mL... 45
Quadro 1. Análise subjetiva da motilidade (adaptado de Strussman et al.,1994)... 21
As populações naturais de peixes têm diminuído nas ultimas décadas devido à degradação ambiental e à pesca excessiva, fatores que aceleram a descaracterização e o desaparecimento do habitat aquático natural e dos organismos que nele vivem (Miliorini, 2006). Com o passar dos anos a demanda de pescado vem aumentando impulsionada principalmente pelo crescimento da população e a tendência mundial da procura de alimentos saudáveis indicados para a saúde humana, como o pescado, sendo este uma alternativa alimentar de alto valor nutritivo, baixo teor de gordura e alta digestabilidade (Andrade e Yusi, 2003).
Visando suprir este desequilíbrio ecológico e aumentar os benefícios econômicos, a piscicultura que produz 43 milhões de toneladas por ano (FAO, 2007) gera constantemente inúmeros trabalhos no âmbito de técnicas de cultivo, controle de doenças, avaliação dos gametas produzidos em cativeiro e técnicas para congelamento seminal, entre outras (Yao et al., 2000; Williot et al., 2000; Tvedt et al., 2001; Taddei et al., 2001; Tanaka et al., 2002).
O conhecimento e desenvolvimento de novos protocolos para o armazenamento de sêmen de peixes vêm avançando desde a última década, mostrando sempre a sua importância como ferramenta em programas de melhoramento genético de espécies de interesse econômico, em iniciativas de re-estabelecimento das populações de ambientes em recuperação, na criação de importantes bancos de sêmen de peixes nativos e no aumento das produções em cativeiro (Carneiro, 2007).
No Brasil, mais especificamente no Sudeste, várias espécies de peixes encontradas nos Estados de Santa Catarina, São Paulo e Minas Gerais, têm sido objetos de diversos estudos relacionados à criopreservação, destacando-se trabalhos com as espécies Pseudoplatystoma corruscans (pintado), os characideos curimba (Prochilodus lineatus), pacu (Piaractus mesopotamicus), piapara (Leporinus elongatus), dourado (Salminus maxillosus) (Carolsfeld et al., 2003), a falsa pirapitinga (Brycon nattereri) (Oliveira et al., 2006) e a piracanjuba (Brycon orbignyanus) (Bedore, 1999; Murgas et al., 2001, 2004, 2007; Carolsfeld et al., 2003; Maria et al., 2006). Nestes trabalhos vários tipos de crioprotetores e diluentes foram testados, dos quais o dimetilsulfóxido a 10%, combinado com a glicose a 5% e a gema de ovo mostraram motilidades espermáticas acima de 50%.
No Nordeste do Brasil, este tipo de pesquisa tem sido pouco abordada. No caso do Estado do Ceará só foram realizados dois trabalhos, um deles com a espécie Colossoma macropomum (tambaqui), realizado por Farias (1998) que utilizou a água de coco como ativador e como diluente do sêmen, em várias osmolaridades, conseguindo resultados promissórios. O outro trabalho realizado por Carvalho (1999), mostrou motilidades baixas dos espermatozóides ao criopreservar sêmen da espécie Ciprinus carpio (carpa) em água de coco acrescida de glicerol ou etileno-glicol como crioprotetores.
2.1. Descrição da espécie
A pirapitinga (Piaractus brachypomus) é uma espécie nativa dos rios Amazonas, Orinoco e seus afluentes. Foi introduzida no Ceará em 1972 pelo Departamento Nacional de Obras Contra as Secas (DNOCS). Os primeiros exemplares trazidos de Iquitos (Peru) foram com o objetivo de povoamento dos açudes e estocagem em viveiros para seu cultivo intensivo (Sobrinho et al., 1984). Hoje em dia o Centro de Pesquisas em Aqüicultura do DNOCS produz grandes quantidades de alevinos provenientes do cruzamento dos estoques originais.
A espécie apresenta de 33 a 37 rastros no primeiro arco branquial, 88 a 98 escamas na linha lateral e 1 a 3 dentes no maxilar. Atinge 79 cm de comprimento total e 11 kg de peso corporal. Sua cor é branco prateada, com nadadeiras peitorais de cor amarela, abdominais e anal vermelhas. A coloração vermelha vivo no peito aparece na época de desova e é muito acentuada (Fig. 1). A espécie é conhecida no mundo como cachama, cachama blanca, freshwater pompano, pacu, red pacu, redbellied pacu, morocoto, paco e caranha.
Classificação taxonômica (FISHBASE, 2008):
Reino Animália Filo Chordata Classe Teleostei Ordem Cypriniforme Família Characidae
Gênero Piaractus (Holmberg, 1887)
Espécie Piaractus brachypomus (Cuvier, 1818)
Sinônimos ambíguos (FISHBASE, 2008):
Piaractus mitrei (non Berg, 1895)
Sinônimos Unambíguos (FISHBASE, 2008):
Colossoma bidens (Spix e Agassiz, 1829) Colossoma brachypomum (Cuvier, 1818) Colossoma branchypomus (Cuvier, 1818) Colossoma paco (Humboldt, 1821)
Myletes bidens (Spix e Agassiz, 1829) Myletes brachypomus (Cuvier, 1818) Piaractus mesopotamicus (Cuvier, 1818) Piaractus brachipomus (Cuvier, 1818) Piaractus briachypumus (Cuvier, 1818)
Os indivíduos em cativeiro não conseguem desovar naturalmente porque nessas condições não encontram estímulos físico-químicos para completar seu ciclo de reprodução, sendo necessária a indução hormonal com hipófise de carpa e a fertilização artificial. Nas condições naturais, estes peixes migram rio acima no período entre junho/julho até outubro, quando os ovários das fêmeas ainda não estão desenvolvidos, por isso são chamadas de espécie de piracema. A desova ocorre no período de novembro a fevereiro quando as condições ambientais se tornam ideais, com temperatura media da água de 27°C após as primeiras chuvas.
As fêmeas de pirapitinga alcançam sua maturidade sexual ao cabo de três anos, enquanto que a dos machos ocorre ao final de dois anos. São espécies de fecundação externa as quais liberam seus gametas no meio ambiente (Almeida, 1997).
Figura 1. Adulto de pirapitinga (Piaractus brachypomus)
2.2. Características gerais do espermatozóide de teleósteos
O espermatozóide dos peixes com fecundação externa tem uma estrutura do tipo simples (Fig. 2), apresenta uma cabeça que mede entre 2-4 micrometros, sendo quase esférica e conformada por um núcleo no qual se encontra o DNA, um colar que forma a peça intermediária onde se encontram os centríolos e de 2 a 9 mitocôndrias, um flagelo que pode medir entre 20 e 100 mm constituído por um axonema com nove pares de microtubulos periféricos e um par central. A membrana que recobre o espermatozóide está composta de fosfolipídios, lipídios neutros e glicolipídios, sua função é fundamental para a regulação de diferentes atividades celulares e vias de sinalização que podem conduzir à motilidade espermática.
Figura 2. Espermatozóides de Piaractus brachypomusa 400X, corados com azul de bromofenol.
2.2.1. Motilidade
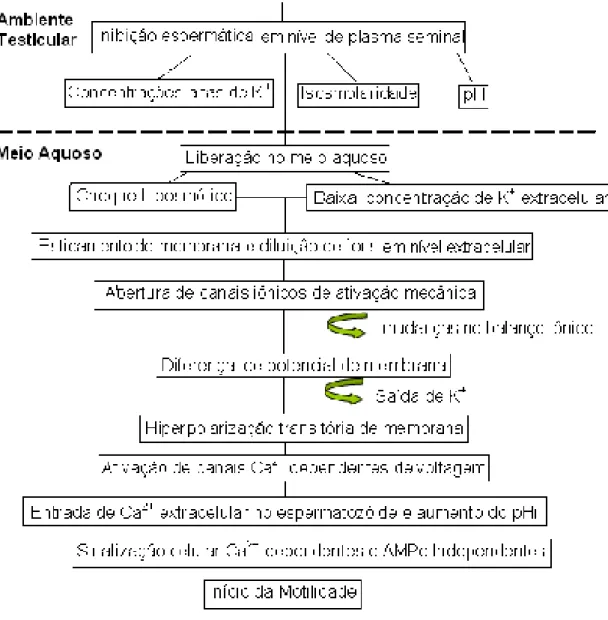
O sêmen de peixes se encontra inativo dentro dos testículos, ao entrar em contato com a água, contam com um breve período de ativação, que se expressa no movimento e velocidade para lograr a fertilização. Esta motilidade se deve a mudanças na pressão osmótica, balanço iônico e pH (Fig. 3).
Todo o processo começa quando os espermatozóides passam pelo conduto espermático, onde são banhados pelo fluido testicular ou plasma seminal, o qual tem pH básico e é rico em bicarbonato (HCO3), fazendo com que permaneçam imóveis e
com metabolismo reduzido, onde as mitocôndrias se encontram com baixo potencial de membrana a fim de preservar as poucas reservas energéticas e diminuir a formação de compostos de oxidação.
Quando ocorre a espermiação no meio aquoso, os fatores que suprimem a motilidade são neutralizados no momento pelas condições do meio ambiente e a motilidade espermática é parcialmente controlada pela pressão osmótica. Em peixes continentais, a água tem uma baixa osmolaridade em comparação com o plasma seminal, ocorrendo assim um choque hiposmótico que gera o sinal inicial para os eventos que conduzem à ativação e que, na maioria dos peixes de água doce, tem uma duração de 30 a 40 segundos. Com uma solução ativadora de qualquer composição iônica, entre a faixa de 100 a 200 miliosmoles (mOsm/kg), já é possível desencadear a ativação por abertura de canais iônicos ao provocar um estiramento das células por hiperpolarizando a membrana.
membrana, o qual leva a um desenvolvimento progressivo da ativação da motilidade flagelar e também a um incremento do pH intracelular, alterado pelo incremento ou diminuição da concentração iônica interna (Tabares et al., 2005).
Na carpa, os espermatozóides imóveis têm um potencial de membrana baixo, devido ao fato de que a carga é maior no plasma seminal (82.4 mM de K+) que em nível intracelular (60.5 mM de K+). Na iniciação da motilidade induzida por osmolaridade, diminui a pressão osmótica extracelular e a concentração de K+, resultando em uma hiperpolarização transitória da membrana (Krasznai et al., 1995).
O balanço iônico também tem papel na aquisição da capacidade para a ativação da motilidade e está relacionado com as mudanças nas concentrações extracelulares de K+, Na+, HCO3 e íons hidrogênio. A tensão de membrana modifica
a conformação de algumas proteínas membranais, permitindo o intercâmbio de íons com o meio extracelular, o Ca2+ ingressa no espermatozóide, e participa na regulação do início da ativação; desencadeando a transdução de sinais e atuando como enzima efetora através da adenilato ciclase, a qual regula o metabolismo do AMPc. Os íons K+ inibem a ativação dos espermatozóides a baixas concentrações. Devido a isso, se há reportado que a inibição da ação do K+ é regulada principalmente pelos íons Ca2+, possivelmente devido ao fluxo simultâneo de Ca2+ e K+. A saída de K+ favorece a abertura de canais de Ca2+e o ingresso do mesmo até o interior. O Ca2+ que ingressa, favorece a liberação de Ca2+ intracelular armazenado e modifica o pHi (pH intracelular) produzindo-se o primeiro sinal Ca2+ dependente e AMPc independente para o início da motilidade. No caso da truta, os íons Na+ e Mg2+ também participam no processo de ativação, reduzindo a ação inibitória dos íons K+ (Cosson et al., 1999).
Figura 3. Dinâmica dos mecanismos de inibição e ativação espermática em peixes de água doce (Adaptado de Tabares et al.,2005).
2.2.2. Morfoanomalias:
a) Anormalidades secundárias ou menores: espermatozóides que podem apresentar cabeça isolada, flagelo dobrado ou gotas citoplasmáticas no flagelo próximas à cabeça. Estas morfoanomalias não afetam significativamente a fertilidade.
b) Anormalidades primárias ou maiores: são todas as anormalidades de cabeça (macrocefalia, microcefalia, degenerada), gotas livres ou distais no flagelo, flagelos curvados, dobrados ou quebrados. Estas morfoanomalias podem afetar significativamente a fertilidade (Sierra, 2005).
Cada uma destas alterações se define da seguinte forma:
Anormalidades maiores:
a) Macrocefalia: se observa naqueles espermatozóides que apresentam cabeça gigante, com contorno e forma anormais, sem aparente degeneração cromatínica ou vacuolar.
b) Microcefalia: espermatozóides com cabeça de tamanho reduzido, com contorno e forma anormais, sem degeneração cromatínica ou vacuolar aparentes.
c) Cabeça degenerada: espermatozóides com cabeça de tamanho e forma normais, mas que apresentam contorno irregular e ou degenerações cromatínica ou vacuolar aparentes.
d) Peça intermediária degenerada (PID): alterações na espessura (terço médio da peça intermediária), densidade, difração e comprimento da peça intermediária, envolvendo seu contorno e sua inserção à cabeça (colo).
e) Cauda fraturada: células espermáticas com fratura e retenção da cauda. f) Cauda fortemente enrolada: consisti da dobradura e enovelamento da cauda sobre si mesma ou sobre a cabeça.
g) Cauda degenerada: espermatozóides que apresentam descontinuidade da cauda a partir da peça intermediária.
Anormalidades menores:
mesma ou a cabeça.
c) Gotas citoplasmáticas: gotas posicionadas ao longo do flagelo.
Quando os espermatozóides apresentam morfoanomalias maiores e menores simultaneamente, são consideradas as alterações maiores e, quando dois tipos de anormalidade da mesma categoria ocorreram simultaneamente, aquela de maior implicação sobre a fertilização é considerada.
2.3. Processo de congelamento
A técnica de congelamento celular basicamente resulta na transferência de temperatura e no transporte de água. Pode ser dividida em três etapas: (1) As células são submetidas a uma solução crioprotetora (metanol, etileno-glicol, glicerol, etc.), a qual penetra na célula e substitui a maior quantidade de água intracelular; (2) Posteriormente, a célula deve regular a osmolaridade, ficando isotônica com o meio extracelular, o que pode causar efeitos tóxicos e impactos osmóticos nas mesmas; (3) Na última etapa, se faz diminuir a temperatura passando pelo ponto de congelamento da água e da solução crioprotetora onde, segundo a curva de congelamento empregada, se realizará de maneira diferente a formação de cristais, os quais podem chegar a danificar a célula (Lezcano, 2001).
Se a taxa de resfriamento é baixa, há suficiente tempo para que as células percam a água necessária para permanecer em equilíbrio osmótico com a solução extracelular concentrada; embora uma exposição prolongada à solução concentrada seja geralmente letal. Por outra parte, se a taxa de resfriamento é alta, não há tempo suficiente para que a água se difunda fora das células formando cristal de gelo. As células se equilibrarão por congelamento intracelular iniciado por nucleação homogênea ou heterogênea, sendo o congelamento intracelular fatal.
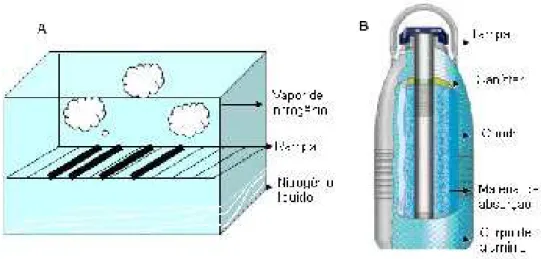
Existem vários utensílios e equipamentos para congelar as amostras de sêmen, sendo os mais utilizados as geladeiras de isopor, “dry shippers”, freezers reguláveis e botijões criogênicos, dentro dos quais são introduzidas palhetas francesas plásticas, cujo volume pode ser de 0,25 , 0,5 e 5 mL (Maisse et al., 1998).
A geladeira de isopor consiste em uma caixa de polietileno de 50x30x30 cm, dentro da qual é adaptada uma rampa metálica separada do fundo 10 cm, onde a temperatura desejada se consegue colocando o nitrogênio líquido a certa altura e as amostras são congeladas só com o vapor do nitrogênio (Fig. 4 A).
O “dry shipper” é um contêiner para transportar com segurança amostras em temperaturas criogênicas. Trata-se de um botijão em alumínio de 50 cm de altura x 30 cm de diâmetro, cujo interior está recoberto por um material de absorção e no meio possui um cilindro onde se suspende uma caneca onde são colocadas as amostras, as quais também são congeladas com os vapores do nitrogênio (Fig. 4 B) (www.taylorwharton.com).
Vários destes equipamentos foram testados em várias ocasiões, Riley et al. (2004) congelaram em câmaras frias a -140°C, com uma curva de -16°C/min, começando de -60°C, já que ao colocar as amostras a temperatura aumentou.
Cruz et al. (2004), usaram o vapor de nitrogênio líquido dentro de uma geladeira de isopor, colando uma rampa a 3 cm do fundo, estabilizando a temperatura a -76°C durante 15 minutos e Degraaf et al. (2004), colocando as amostras em palhetas de 0,5 mL congelou em um freezer programável a -10°C/min até -150°C, finalmente como a maioria de estudos depois de um tempo determinado as palhetas foram transferidas ao nitrogênio liquido a -196°C.
Figura 4. Equipamentos para congelamento de sêmen: (A) geladeira de poliestireno com rampa metálica, (B) “dry shipper” (www.taylorwharton.com).
2.3.1. Agentes crioprotetores
Os crioprotetores são empregados no congelamento para diminuir os danos celulares produzidos pelo processo de congelamento-descongelamento. Estas substâncias devem possuir como propriedades uma baixa toxicidade para as células e alta solubilidade em água (Miliorini, 2006). Podem ser classificadas como intracelulares ou permeáveis e extracelulares ou impermeáveis. O crioprotetor intracelular é uma substância química que retira a água da célula e diminui a temperatura em seu interior, interferindo na formação de cristais de gelo. Entre os crioprotetores intracelulares mais utilizados podem ser citados dimetilsulfóxido (DMSO), glicerol, metanol e etilenoglicol usados geralmente a uma concentração de 10% (Maria, 2005). Recentemente foi descrita a excelente ação do metilglicol como crioprotetor de sêmen de piracanjuba (Maria, 2005).
O DMSO tem mostrado bons resultados tanto para espécies de água doce como a truta arco-íris (Oncorrhynchus mykiss) e a piracanjuba (Brycon siebenthale) com taxas de motilidade de 60 a 80 % (Medina et al., 2005), como para espécies marinhas como o linguado e o pargo (Dreannoet al., 1997; Rileyet al., 2004).
seminal é naturalmente rico em glicerol como no peixe Coregonus muksun. E o metanol, que é altamente inflamável, em peixes tropicais como as tilápias (Oreochromis sp.) e o Zebrafish (Brachydanio rerio) apresentando altas taxas de motilidade (Maisseet al., 1998).
Os crioprotetores extracelulares funcionam de forma diferente; ao invés de entrarem na célula, eles recobrem a superfície celular e estabilizam a membrana, ajudando, portanto, a minimizar e reparar os possíveis danos celulares causados pelo processo de congelamento. Incluem açúcares (sacarose, glicose) sendo estes também considerados como diluentes, polímeros (dextrano, PVP) e proteínas (gema de ovo e leite em pó) (Sierra, 2005), a combinação de um crioprotetor intra e extracelular é muito empregada para os processos de criopreservação. Navarro et al. (2004) criopreservaram sêmen de cachama blanca (Piaractus brachypomus) em criosoluções contendo glicose, gema de ovo e leite em pó.
2.3.2. Meios diluentes
O sêmen puro é praticamente impossível de ser congelado, necessitando tanto da adição de crioprotetores como de meios diluentes. Sendo estes últimos soluções de sais ou de carboidratos, que adicionados ao sêmen, mantém a viabilidade das células espermáticas durante a redução da temperatura. As condições mínimas requeridas para um diluente adequado são: isotonicidade, para que não haja ativação prévia da motilidade espermática; estabilidade, pois suas características físico-químicas não devem ser alteradas durante o contato com o sêmen; condutividade térmica elevada, permitindo a rápida transferência de temperatura do meio externo para os espermatozóides; esterilidade, ou seja, não devem vincular microrganismos potencialmente nocivos às células espermáticas; e, finalmente, servir de carreador de crioprotetores. É importante que a motilidade dos espermatozóides não seja ativada antes do congelamento e nem durante o descongelamento, pois a mesma pode exaurir a reserva energética necessária à fertilização (Legendre e Billard, 1980).
2.4. Avaliação da cinética espermática através do sistema de análise seminal auxiliada por computador (CASA)
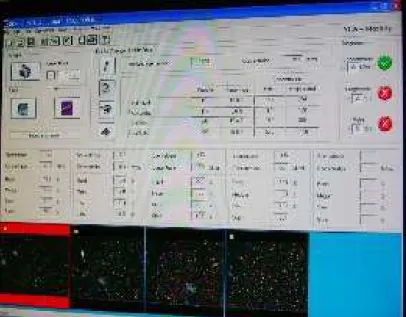
O sistema de análise seminal auxiliado por computador é formado por um microscópio ótico binocular com contraste de fase acoplado a uma câmera de vídeo e placa aquecedora, conectados a um computador que utiliza o software SCA. Este programa provê os meios para uma classificação objetiva e rápida, de uma determinada população de espermatozóides. Usando imagens digitais da trajetória de cada célula espermática, o CASA pode analisar, processando algoritmos, as propriedades de movimento dos espermatozóides (Verstegen et al., 2002).
O sistema é simples, envolve uma câmara filmadora que grava o movimento através do videomicroscópio e depois recomeça a seqüência quadro a quadro enquanto marca a posição de cada espermatozóide em um tempo determinado para assim poder calcular as velocidades e a motilidade. Este programa é muito utilizado para avaliação de sêmen humano em clínicas de fertilidade, também sendo muito utilizado para mamíferos, mas que para peixes teve que ser adaptado pelo tempo de movimento, que é de menos de 2 minutos, comparado às varias horas do sêmen de mamíferos (Kime et al., 2001).
Os parâmetros do CASA que são geralmente informados incluem:
MOT (%): percentual de espermatozóides móveis ou progressivos, determinando os que têm movimento rápido, movimento médio e os localmente móveis ou lentos.
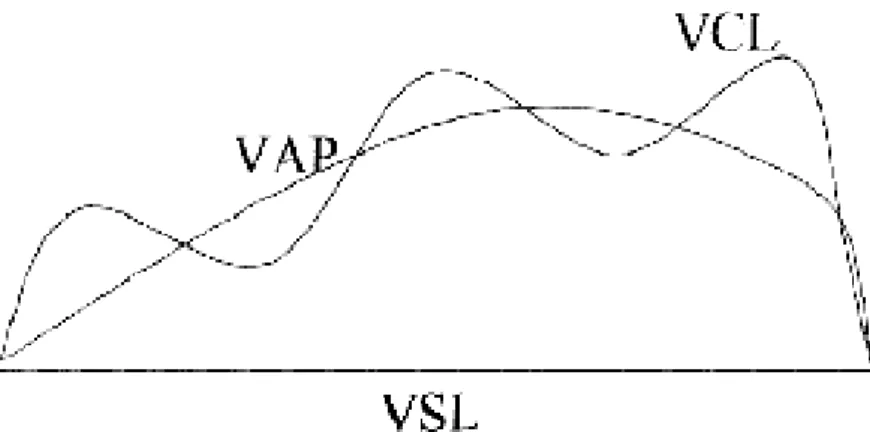
VCL (µm/seg): velocidade curvilinear, que é a velocidade do movimento ao longo da trajetória (Fig. 5).
VSL (µm/seg): velocidade em linha reta, velocidade do movimento a partir do ponto inicial até o ponto final ao longo de uma linha reta teórica unindo os dois pontos.
VAP (µm/seg): é a velocidade média do caminho.
LIN (%): linearidade, que é a proporção entre a VSL e a VCL (VSL/VCL) e indica que o maior valor da reta é o caminho mais linear dos espermatozóides.
STR (%) (straightness): índice de espermatozóides na reta.
ALH (µm/seg): deslocamento lateral da cabeça.
Figura 5. Representação esquemática das diferentes velocidades medidas pelo sistema de análise seminal (CASA). VCL= velocidade curvilinear; VSL= velocidade em linha reta; VAP = velocidade média.
Alguns estudos foram realizados em peixes utilizando o sistema CASA para registrar o movimento dos espermatozóides depois do processo de criopreservação, um destes é o de Liu et al. (2007), onde avaliaram a motilidade e a velocidade do sêmen fresco e descongelado do Pagrus major 10 segundos pós-ativação. Os autores encontraram 87% de motilidade no sêmen fresco e 82% no sêmen congelado com DMSO a 10%, não existindo diferença significativa entre a velocidade do sêmen descongelado e o sêmen fresco.
Dreando et al. (1997), analisaram no CASA a motilidade do sêmen pré e pós-descongelamento do peixe plano Scophthalmus maximus, onde os melhores resultados (60 e 80% de motilidade) foram obtidos quando se diluiu Mounib modificado (KHCO3, sacarose e glutationa) em BSA ou DMSO a 10%, enquanto a
velocidade permaneceu estável entre o sêmen puro e o descongelado.
Outros estudos se apóiam no programa para observar características do sêmen “in natura” ou para testar outros fatores que influenciam a velocidade e o movimento do sêmen. Dietrich et al. (2005), investigaram os efeitos seqüenciais do sêmen coletado post mortem e depois da anestesia da truta arco íris (Oncorhynchus mykiss), percebendo uma diminuição nos parâmetros de motilidade, velocidade e trajetória. Wilson e Ingerman (2007) obtiveram no peixe zebra (Danio rerio) motilidades de 83%, VCL de 104 µm/s, VAP de 77 µm/s, VSL de 77 µm/s e LIN de 84 µm/s ativado com água da torneira.
Cada processo de congelamento é espécie-específico, por isso é preciso ter informações sobre as particularidades do sêmen da espécie objetivo e de diversas espécies de peixes (volume coletado, motilidade, concentração de espermatozóides, pH e osmolaridade), o que permite padronizar as técnicas, definir os componentes crioprotetores e os meios diluentes a testar, bem como os procedimentos adequados para o congelamento e posterior descongelamento dos espermatozóides (Carneiro, 2007). Também é importante conhecer as morfoanomalias do sêmen antes e depois de ser congelado, já que estas representam o estado dos gametas no momento do congelamento e os criodanos causados por este processo.
Ainda existem muitas questões básicas a serem respondidas no tocante às técnicas de conservação de sêmen de muitas espécies tropicais de interesse econômico e ambiental. Alguns dos objetivos essenciais da criopreservação são alcançar taxas de fertilização próximas às obtidas com sêmen fresco, avaliar criodiluentes que diminuam os efeitos tóxicos, estresse osmótico e criodanos sobre a célula espermática (alterações na membrana do espermatozóide e em seu DNA) e conseguir curvas de congelamento e descongelamento benéficas para os espermatozóides (Deandro et al., 1997; Suquet et al., 2000; Medina et al., 2005). Portanto, é importante a continua e progressiva pesquisa com crioprotetores, já que eles são adicionados ao meio para proteger os gametas durante o processo de criopreservação e descongelamento, sendo fundamentais para evitar a formação de cristais de gelo intracelular que causariam o rompimento da célula (Medeiros et al., 2002). Entretanto, altas concentrações de crioprotetores são deletérias aos espermatozóides devido a sua toxicidade, o qual pode resultar na redução da motilidade. Igualmente os meios diluentes devem ser adicionados aos crioprotetores, já que os mesmos prolongam a vida dos espermatozóides in vitro, reduzindo a atividade metabólica, seja por inibidores químicos ou por redução de temperatura (Cloud, 2000).
4.1. Objetivo Geral
Desenvolver um protocolo adequado de criopreservação para o sêmen da pirapitinga, Piaractus brachypomus, testando diferentes crioprotetores e diluentes na qualidade “in vitro” dos espermatozóides.
4.2. Objetivos Específicos
Determinar as características seminais da pirapitinga como: volume, pH, concentração espermática e osmolaridade;
Avaliar a toxicidade dos crioprotetores DMSO e metilglicol a 10%, através do comportamento cinético espermático após 15 minutos resfriados a 4°C; Avaliar a cinética espermática em sêmen fresco e diluído em Ringer,
ACP-104 e glicose pós-descongelamento;
5.1. Local do experimento e animais experimentais
O estudo foi conduzido entre os meses de dezembro de 2007 e março de 2008. Foram utilizados 19 machos maduros de pirapitinga, os quais apresentaram a papila urogenital hiperêmica e liberaram sêmen sobre delicada pressão no abdômen. Estes peixes foram pesados e medidos usando uma balança analítica e fita métrica. Logo colocados em viveiros de terra de 350 m2, alimentados com rações balanceadas com 30% de proteína, fornecida diariamente a uma taxa de 3% do peso total dos indivíduos. Os 19 animais foram marcados com chip, sendo colocado na base da nadadeira dorsal para sua posterior identificação (Fig. 6).
Figura 6. Leitura da marcação eletrônica com chip das pirapitingas.
Os peixes foram divididos em dois grupos, um com 09 e outro com 10 animais. A indução hormonal se realizou a cada 20 dias, trocando sempre o grupo para que não fossem induzidos os mesmos peixes, ou seja, cada grupo foi induzido a cada 40 dias durante o período de amostragem. Para tanto, se estimou a média do peso de cada grupo de reprodutores e procedeu-se a tratamento hormonal com extrato bruto de hipófise de carpa (EBHC), em uma dosagem para indução à espermiação de 2 mg/kg de peso corporal médio, aplicada próxima à nadadeira dorsal. A coleta de sêmen foi realizada 12 horas após a injeção.
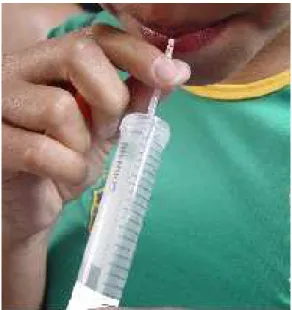
5.3. Coleta de sêmen
Antes de ser coletado o sêmen, foi realizada uma breve pressão celômica sobre os rins para eliminar a maior quantidade de urina possível. Seguidamente, a papila urogenital foi seca com papel toalha para reduzir o risco de possível
contaminação com água, fezes ou resquícios de urina. Em seguida, foram realizadas
massagens manuais leves sobre a parede celômica na área onde se localizam os testículos, no sentido ântero-posterior. O sêmen foi coletado em tubos Eppendorf de 2 mL e mantido em geladeira de isopor a 4°C (Fig. 7).
Imediatamente após a coleta, uma alíquota de 2 µL de sêmen fresco de cada
peixe foi colocada em uma lâmina histológica, coberta com lamínula e observada ao
microscópio ótico, sob aumento de 400x, onde foram avaliados três campos, calculando o porcentual médio de espermatozóides móveis, conforme Strussman et al. (1994) (Quadro 1). Tendo em vista que os espermatozóides no sêmen fresco,
sem contaminação são imóveis, se considerou adequado para os experimentos o
sêmen que exibiu taxas de motilidade espermática não superior a 5%. Amostras que
apresentaram motilidade foram descartadas dos testes de toxicidade e
criopreservação.
Quadro 1. Análise subjetiva da motilidade (adaptado de Strussman et al.,1994).
Porcentagem de
espermatozóides
móveis
Qualidade dos espermatozóides
0 - 20 Espermatozóides parados ou vibrando.
20 - 40 Espermatozóides vibrando e alguns com movimentos circulares no próprio
local.
40 - 60 Espermatozóides com movimentos circulares no próprio local e alguns com
movimento retilíneo de baixa freqüência.
60 - 80 A maior parte dos espermatozóides apresenta movimento retilíneo linear de
alta freqüência, uns poucos com velocidade retilínea de baixa freqüência e
uma pequena parte com movimento circular.
80 - 100 Espermatozóides móveis com movimento retilíneo de alta freqüência
(movimentos flechantes).
5.5. Avaliação da motilidade
A motilidade foi mensurada subjetivamente segundo o Quadro 1, para cada
peixe durante a coleta (visando formar os “pools” de sêmen) e objetivamente para
cada “pool” no programa SCA (SCA®2005, Microptics S.L., Espanha) usando o
sistema de analise CASA, no Laboratório de Tecnologia de Sêmen Caprino e Ovino
Foi colocado 1 µL de sêmen em uma lâmina e depois foram adicionados 50 µL
de solução ativadora (NaCl 50 mM; Mariaet al., 2006) misturando com a ponteira da
micropipeta durante 2 segundos. Finalmente a amostra foi observada em
microscópio ótico a 400x, sendo analisados três campos. A duração da motilidade
espermática foi estimada desde a homogeneização até que somente restassem 10%
de espermatozóides móveis.
Quadro 2. Parâmetros estabelecidos para a análise pelo sistema CASA do sêmen
de pirapitinga (Piaractus brachypomus).
Espécie Peixe
Número de quadros consecutivos a analisar 25
Estáticos <10 µm/seg
Motilidade Lenta 10 µm/seg
Motilidade Média 20 µm/seg
Motilidade Rápida >40 µm/seg
5.6. Características seminais
Amostras de sêmen de cada peixe por coleta foram avaliadas para determinar
suas características: aspecto (denso, semi-denso, ralo); cor (branco leitoso, branco
amarelado, amarelo, transparente); volume (mL; graduação nos Eppendorfs); osmolaridade (mOsm/Kg; osmômetro), pH (0-14; papel medidor de pH); e concentração espermática (x109 sptz/mL; câmara Neubauer).
Amostras de sêmen com motilidades maiores a 85% pós-ativação no teste da
motilidade foram selecionadas para os estudos de toxicidade, formando “pools” com
aproximadamente 2 mL de cada amostra e mantidas a 4°C.
Foram avaliados como crioprotetores:
Dimetil sulfóxido (DMSO) a 10%;
Metilglicol a 10%.
E como meios diluentes:
Glicose a 5%;
ACP-104 (meio diluente à base de água de coco em pó para peixes);
Solução Ringer (NaCl, KCl, NaHCO3 e CaCl2).
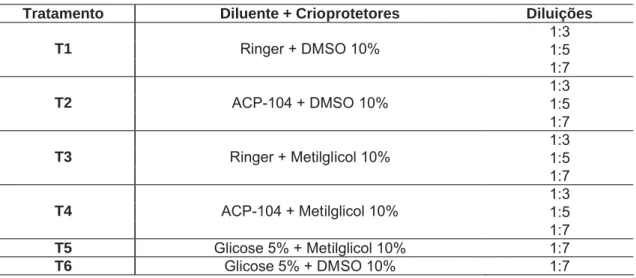
Nas diluições 1:3, 1:5 e 1:7 (sêmen:criodiluente), conforme Tabela 1.
Cada tratamento foi deixado em repouso por 15 minutos, à temperatura de 4°C
(Fig. 8) e depois analisado usando o método CASA, onde foram capturados e registrados os dados de cinética espermática pós-ativação com solução de NaCl a
50 mM, segundo Quadro 2.
Os resultados foram comparados com a motilidade calculada objetivamente dos
“pools” de sêmen fresco no teste da motilidade. Os tratamentos 5 e 6 só foram
avaliados a uma diluição de 1:7 por ser um criodiluente comumente usado em
peixes da mesma família.
Tabela 1. Diluentes e crioprotetores utilizados no teste de toxicidade e na criopreservação de sêmen de pirapitinga (Piaractus brachypomus).
Tratamento Diluente + Crioprotetores Diluições
1:3 1:5
T1 Ringer + DMSO 10%
1:7 1:3 1:5
T2 ACP-104 + DMSO 10%
1:7 1:3 1:5
T3 Ringer + Metilglicol 10%
1:7 1:3 1:5
T4 ACP-104 + Metilglicol 10%
1:7
T5 Glicose 5% + Metilglicol 10% 1:7
T6 Glicose 5% + DMSO 10% 1:7
5.8. Congelamento e descongelamento seminal
Experimento 1: Congelamento em rampa em palheta de 0,25 mL
Utilizou-se 3 “pools” de sêmen das amostras com motilidades pós-ativação
acima de 85%, para os tratamentos mencionados na Tabela 1.
As diluições dos criodiluentes foram realizadas em tubos de ensaio pequenos,
os quais permaneceram resfriados a 4°C durante 30 minutos antes de colocar as
amostras de sêmen correspondentes.
Após diluição, segundo cada tratamento, o sêmen+criodiluente foi envasado
em palhetas francesas de 0,25 mL (três palhetas por tratamento) (Fig. 9), vedadas
com álcool polivinílico e limpas com papel absorvente para evitar aderência de uma
Figura 9. Preenchimento de palhetas com as criodiluções.
Em seguida, foram dispostas em raques (suporte de alumínio) (Fig. 10)
marcadas e colocadas sobre rampa de congelamento a 5 cm do nitrogênio líquido
para obter a temperatura de -150ºC, recebendo somente os vapores. O controle da temperatura foi realizado através de um termômetro digital com sonda. Após 5 minutos, as raques foram transferidas para canecas identificadas dentro de botijão
criogênico a -196ºC, onde permaneceram submersas de 12 a 15 dias.
(Fig. 11), durante 8 segundos, retiradas com pinças, enxutas com papel toalha e
cortadas com tesoura uma das extremidades. O sêmen descongelado foi alocado em Eppendorfs de 2 mL a temperatura ambiente de 26ºC. Uma alíquota de 1 µL de sêmen descongelado homogeneizada com 50 µL de solução ativadora de NaCl foi colocada em câmara de Makler, sendo avaliada usando o CASA. Foram realizadas três leituras de campos diferentes para cada palheta (Fig. 12 e 13). Vale ressaltar que todo o procedimento de leitura foi realizado em menos 1 minuto.
Figura 11. Descongelamento das palhetas em banho-maria.
Figura 13. Representação dos movimentos dos espermatozóides de pirapitinga avaliados com o método CASA.
Experimento 2: Congelamento em rampa em palheta de 0,5 mL
Este experimento foi realizado com 3 “pools” com a mesma metodologia descrita no experimento 1, sendo que com palhetas francesa de 0,5 mL.
Experimento 3: Congelamento em “dry shipper” em palhetas de 0,5 mL
Neste caso foram realizadas 4 réplicas, ou seja, se formaram 4 “pools” de sêmen. Utilizaram-se palhetas de 0,5 mL e o congelamento foi realizado em um contêiner de vapor de nitrogênio (Taylor-Wharton, CX100 “dry shipper”) a -170ºC (Fig. 14), permanecendo as raques durante 5 horas e logo transferidas ao nitrogênio
Figura 14. Congelamento em “dry shipper” a -170°C.
5.9. Análise morfológica do sêmen
Com o sêmen de cada um dos 19 animais foram realizados esfregaços corados para calcular as morfoanomalias do sêmen fresco e pós-descongelação.
Uma alíquota de 1 μL de sêmen fresco ou descongelado foi diluída em 4 mL de solução formol-salina. A seguir, uma fração de 100 μL da amostra foi adicionada
com 2 μL do corante azul de bromofenol (1g azul de bromofenol; 4g citrato de sódio; 100 mL água destilada; pH 8.0) em um Eppendorf. Uma gota desta solução foi depositada em lâmina histológica, realizado um esfregaço e deixado secar a temperatura ambiente. As leituras foram realizadas no programa SCA em microscópio de contraste de fases e campo claro a 400x.
brachypomus).
Parte do espermatozóide Morfoanomalias
Macrocefalia
Microcefalia Cabeça
Degenerada
Peça intermediária Degenerada
Proximal
Gota citoplasmática Distal
Dobrada
Cauda Enrolada (levemente e fortemente)
5.10. Análises estatísticas
Para as características seminais foi utilizada a média dos dados do mesmo
peixe nas diferentes coletas, devido ao fato de que cada um deles foi induzido várias
vezes. As amostras com sêmen contaminado que apresentaram alto movimento no
teste de contaminação não foram usadas para as análises estatísticas de motilidade.
Finalmente foi calculada a média e erro padrão para todos os peixes do
experimento.
No caso da análise dos testes de toxicidade e descongelamento, os dados das
taxas de motilidades espermática e velocidades de cada experimento foram testados para distribuição normal. Os valores que não apresentaram essa distribuição foram transformados em Log x+1 para sua normalização. Então, os dados foram submetidos à análise de variância fatorial e as médias comparadas pelo teste de Duncan, com um nível de significância de 0.05% utilizando-se o pacote computacional Statistica 7, versão 2006.
Os machos da espécie Piaractus brachypomus mantidos em cativeiro apresentaram fácil liberação de sêmen quando massageados ventralmente, após o processo de indução hormonal e, em poucas ocasiões, o sêmen coletado foi contaminado com urina, fezes, sangue ou água, segundo o teste de contaminação.
6.1. Características do sêmen
As amostras de sêmen dos 19 exemplares de pirapitinga apresentaram coloração branca leitosa e aspecto semidenso. A maior quantidade de volume coletado nos indivíduos foi de 12,3 mL e a menor foi de 1,5 mL. O pH apresentou valores de 8,0 mínimo e 8,6 maximo. A osmolaridade registrou valores entre 272 e 400 miliosmoles (mOsm/kg) e a concentração espermática entre 11 a 70 x 109 espermatozóides/mL. Os espermatozóides não ficaram mais do que 60 segundos móveis. A média dos dados de cada peixe, a média geral e o erro padrão podem ser observados na Tabela 3.
Tabela 3. Características seminais das pirapitingas, avaliadas durante o período de dezembro de 2007 a março de 2008
PEIXE N° CHIP
VOL
(mL) pH
OSMOL
(mOsm/kg) CONC PESO (g) CT (cm) MOT-S (%)
1 2020 9,8 8,0 319,3 67,5 3616,7 59,3 91,7
2 3492 5,3 8,2 298,7 28,8 3380,0 57,7 86,7
3 8474 6,4 8,4 382,7 30,1 3126,7 56,0 90,0
4 3354 6,8 8,2 349,3 34,2 3400,0 59,0 93,3
5 6876 8,3 8,3 294,7 57,6 3540,0 59,0 80,0
6 3568 8,1 8,3 297,0 41,2 3453,3 58,0 92,5
7 9326 6,7 8,2 272,0 14,3 2466,7 53,3 85,0
8 4063 12,3 8,5 290,5 26,4 3110,0 58,5 80,0
9 0196 6,4 9,0 317,5 11,2 2900,0 56,5 90,0
10 6975 7,9 8,3 300,5 70,3 3570,0 60,5 87,5
11 8103 7,0 8,5 272,5 49,2 3160,0 62,5 87,5
12 0290 8,8 8,3 350,5 55,4 3690,0 59,5 85,0
13 7232 9,4 8,5 294,0 35,1 3340,0 58,0 70,0
14 2117 6,7 8,6 325,5 46,2 3550,0 59,5 85,0
15 0373 5,5 8,3 311,0 67,5 4290,0 60,5 82,5
16 5808 6,7 8,5 313,5 69,3 3510,0 58,5 80,0
17 5000 1,5 8,5 284,0 17,8 4100,0 63,0 95,0
18 4389 8,3 8,5 350,5 55,0 3410,0 60,0 92,5
19 2671 4,1 8,5 400,5 54,2 3320,0 58,5 90,0
Média ± EP 7,1±1,6 8,4 ±0,2 317 ± 27 43,7 ± 16,3 3417 ± 270 59±1,5 86,5±4,7
VOL = volume; OSMOL = osmolaridade; CONC = concentração espermática (x109/mL); CT =
As características dos “pools” formados com o sêmen dos 19 peixes são apresentados na Tabela 4. As motilidades subjetiva e objetiva não foram significativamente diferentes (P>0.05), embora seja mais precisa a objetiva por ser medida com maior acurácia.
Tabela 4. Características dos “pools” de sêmen de pirapitinga
“POOL” VOL (mL) pH OSMOL
(mOsm/kg) CONC MOT-S (%) MOT-O (%)
1 5,7 8,5 276 19,4 90 94
2 6,7 8,5 288 25,0 90 97
3 6,0 8,5 309 10,0 90 93
4 6,5 8,5 307 13,6 85 91
5 12,5 8,5 328 53,4 85 96
6 13,0 8,5 320 58,2 85 93
7 6,0 8,5 317 52,8 90 99
8 5,0 8,5 429 57,7 85 92
9 5,3 8,5 411 39,0 85 94
10 9,0 8,5 253 47,0 85 93
P>0.05; VOL = volume; OSMOL = osmolaridade; CONC = concentração espermática (x109/mL);
MOT-S = motilidade subjetiva; MOT-O = motilidade objetiva.
6.2. Estudo da toxicidade dos crioprotetores
6.2.1. Motilidade
registrou a maior motilidade do estudo (80%), com uma das maiores porcentagens de espermatozóides rápidos do experimento, sendo este resultado semelhante aos valores do grupo controle (P=0.06) (Fig. 17).
Por outro lado, ao comparar as criosoluções e suas respectivas diluições contra o grupo controle (“pools” a fresco) se verificou uma diminuição na motilidade de todas as criosoluções na diluição 1:7 (P<0.05), excetuando as do T3 (Ringer + Metilglicol 10%) (P= 0.07) e T6 (Glicose 5% + DMSO 10%) (P>0.05) (Fig. 17).
6.2.2. Velocidades
Foi observada uma interação significativa da velocidade curvilinear (VCL) de T2 (ACP-104 + DMSO 10%) e T6 (Glicose 5% + DMSO 10%) com T3 (Ringer + Metilglicol 10%) (P= 0.03), sendo este último quem apresenta os mais altos valores de VCL do estudo, estando muito próximos aos valores do grupo controle, porém não evidenciando diferenças estatísticas (P=0.12) (Fig. 16). O teste de Duncan revelou que todas as diluições do T2 (ACP-104 + DMSO 10%) e T6 (Glicose 5% + DMSO 10%) são diferentes ao controle, mas que só as diluições 1:5 e 1:7 do T3 (Ringer + Metilglicol 10%) diferem com a diluição 1:7 do T2 (ACP-104 + DMSO 10%) (P=0.04) (Fig. 18).
A velocidade linear (VSL) permaneceu sem variações consideráveis em todos os testes, apresentando uma rapidez similar ao sêmen fresco (P=0.37), embora pareça ser um pouco mais alta no T4 (ACP-104 + Metilglicol 10%) na diluição 1:7 com 55,7 µm/s (Fig. 18).
espermatozóides rápidos, médios e lentos, e velocidades curvilinear (VCL), linear (VSL) e média (VAP) (µm/s) nos testes de toxicidade
Tratamento Diluição MT (%) Rápidos (%)
Médios
(%)
Lentos
(%)
VCL
(µm/s)
VSL
(µm/s) VAP
(µm/s)
T1 1:3 75,5 45,8 9,6 20,1 85,7 49,0 72,7
T1 1:5 77,3 43,5 11,8 22,1 80,7 42,2 68,4
T1 1:7 58,5 34,7 10,1 13,7 76,1 43,2 67,4
T2 1:3 61,5 31,8 13,4 16,3 59,3 41,6 53,9
T2 1:5 65,0 26,9 15,6 22,5 50,8 34,3 44,9
T2 1:7 53,3 22,9 13,8 16,7 47,6 32,6 41,9
T3 1:3 80,1* 50,3 13,9 16,1 94,9* 48,4 75,3
T3 1:5 78,9 51,1* 12,0 15,9 93,2 49,3 78,0*
T3 1:7 70,0 42,4 10,7 16,8 87,7 48,2 73,7
T4 1:3 79,7 35,4 22,0* 22,3 82,1 42,4 62,5
T4 1:5 63,6 25,5 13,7 24,3* 71,6 43,4 60,8
T4 1:7 56,0 29,7 9,1 17,2 83,5 55,7* 75,1
T5 1:7 51,5 32,8 7,2 11,5 82,2 50,7 74,0
T6 1:7 61,8 27,5 14,3 20,0 56,5 34,4 50,0
Controle - 94,2 71,1 14,6 8,8 113,7 43,3 71,2
*Maiores valores obtidos entre tratamentos. T1 = Ringer+DMSO 10%; T2 = ACP-104+DMSO 10%, T3
Figura 15. Média ± erro padrão da motilidade de espermatozóides progressivos, rápidos, médios e lentos nas criodiluições avaliadas no teste da toxicidade. T1 = Ringer+DMSO 10%; T2 = ACP-104+DMSO 10%, T3 = Ringer+Metilglicol 10%; T4 = ACP-104+Metilglicol 10%; T5 = Glicose 5%+Metilglicol 10%; T6 = Glicose 5%+DMSO 10%. Letras diferentes são significativamente diferentes (P<0.05).
Experimento 1: Congelamento em rampa em palheta de 0,25 mL
Durante os congelamentos em vapores de nitrogênio líquido utilizando a
geladeira de isopor, a temperatura variou constantemente. Na curva de
congelamento apresentada na Figura 19, pode-se observar que nos 2 primeiros
minutos a temperatura aumentou entre 30 e 90°C, estabilizando entre o minuto 3 e 4
e começando a diminuir no quarto, levando aproximadamente 5 a 10 minutos para
retornar a temperatura inicial de -150°C, embora as amostras tenham sido retiradas
aos 5 minutos, para conservar um padrão.
-150 -140 -130 -120 -110 -100 -90 -80 -70 -60
0 1 2 3 4 5
Tempo (min) T e m p e ra tu ra ( °C ) Pool 1 Pool 2 Pool 3 Pool 4 Pool 5 Pool 6
Figura 19. Curva de congelamento dos experimentos 1 e 2 utilizando o equipamento de geladeira de isopor com rampa durante 5 minutos.
De maneira geral, todos os tratamentos congelados em palhetas de 0,25 mL
utilizando a técnica de congelamento sobre rampa na geladeira, apresentaram
valores de motilidade total baixos (aproximadamente de 12%) quando comparados
com o grupo controle (94%), apresentando diferença estatística altamente
significante (P<0.01).
Com 40% de motilidade, a criosolução T5 (Glicose 5% + Metilglicol 10%) foi a
única criosolução que se sobressaiu das outras (P<0.05). Foi ainda observado que
26% dos espermatozóides eram rápidos pós-descongelamento. Mesmo assim, estes
espermática muito semelhante à criosolução anterior (P= 0.1) com maior número de
espermatozóides médios e lentos (Fig. 20).
Progressivos Rápidos Médios Lentos
T1 T2 T3 T4 T5 T6 Controle
Tratamentos 0
20 40 60 80 100
M
o
ti
lid
a
d
e
(
%
)
Figura 20. Média e erro padrão da motilidade de espermatozóides progressivos, rápidos, médios e lentos pós-descongelamento utilizando palheta de 0,25 mL e rampa de congelamento. T1 = Ringer+DMSO 10%; T2 = ACP-104+DMSO 10%, T3 = Ringer+Metilglicol 10%; T4 = ACP-104+Metilglicol 10%; T5 = Glicose 5%+Metilglicol 10%; T6 = Glicose 5%+DMSO 10%.
Com relação à progressividade entre diluições, todas apresentaram diferença
dentro do mesmo tratamento (criosolução), exceto o T2 (ACP-104 + DMSO 10%)
cujas diluições não variam (P>0.05). Sendo as melhores diluições em relação a cada
criosolução as de 1:5 no T1 e T3, e 1:3 no T4 (Tab. 6), contendo estas também o
µm/s, sendo de 60 µm/s no T3 (Ringer + Metilglicol 10%) na diluição de 1:3, e de 85
µm/s no T5 (Glicose 5% + Metilglicol 10%) na diluição de 1:7, sendo as únicas
criodiluições cujas velocidades se aproximaram às velocidades do sêmen no meio
natural, mas mesmo assim diferentes tanto para o controle como para as outras
diluições (P<0.05) (Tab. 6). Ao contrário, estes tratamentos apresentaram VSL e
VAP semelhantes as do grupo controle (P>0.05) (Fig. 21).
Tabela 6.Média e erro padrão da motilidade, em porcentagem, de espermatozóides progressivos, rápidos, médios e lentos, e velocidades curvilinear (VCL), linear (VSL) e média (VAP), em µm/s, no teste de congelamento na geladeira de isopor, em palheta de 0,25 mL
Tratamento Diluição Progressivos Rápidos Médios Lentos VCL VSL VAP
T1 1:3 7±2ec 0,6±0,3d 1±0,5cd 5±1cd 33±3e 16±2c 24±3c T1 1:5 15±4d 2±1cd 4±1cd 9±2a 34±1e 19±2c 26±2c T1 1:7 5±2ec 0,7±0,3d 1±0,3cd 4±1c 32±4e 17±3c 23±4c T2 1:3 10±2cd 1±0,2d 2±0,7cd 7±1ad 30±3e 20±3c 25±4c T2 1:5 6±1ec 1±0,4d 1±0,3cd 3±0,7c 33±5e 23±6cb 27±6cb T2 1:7 8±2ec 1±0,2d 2±0,4cd 5±1cd 33±4e 23±4cb 27±4cb T3 1:3 6±2ec 2±1cd 1±0,3cd 3±0,7c 39±9ce 24±9cb 29±9cb T3 1:5 14±3d 7±2c 2±0,5cd 5±1cd 60±8d 38±7a 52±9a T3 1:7 3±0,5e 0,2±0,1d 1±0,2cd 2±0,3c 31±3e 13±3c 19±3c T4 1:3 10±2cd 2±0,5cd 1±0,3cd 7±1ad 39±5ce 23±4cb 30±5cb T4 1:5 3±1e 0,3±0,1d 0,4±0,2d 2±0,6c 30±3e 11±3c 17±3c T4 1:7 6±2ec 2±1cd 1±0,5cd 3±0,7c 52±9cd 36±9b 43±9b T5 1:7 40±4b* 26±4b* 5±0,4c 9±0,5a 85±5b* 56±4a* 78±5a*
T6 1:7 35±0,4b 7±0c 11±0,4b* 17±1b* 27±0,3e 17±0,2c 22±0,1c Controle - 94±1a 71±5a 15±3a 9±2a 114±7a 43±4a 71±6a *Maiores valores obtidos entre tratamentos. Letras diferentes entre linhas mostram médias
significativamente diferentes (P<0.05). T1 = Ringer+DMSO 10%; T2 = ACP-104+DMSO 10%, T3 =
VCL VSL VAP
T1 T2 T3 T4 T5 T6 Controle
Tratamentos
0 20 40 60 80 100 120
V
e
lo
c
id
a
d
e
(
µ
m
/s
)
Figura 21. Média e erro padrão das velocidades espermáticas, em µm/s, pós-descongelamento, em palheta de 0,25 mL e rampa de congelamento. T1 = Ringer+DMSO 10%; T2 = ACP-104+DMSO 10%, T3 = Ringer+Metilglicol 10% ; T4 = ACP-104+Metilglicol 10%; T5 = Glicose 5%+Metilglicol 10% ; T6 = Glicose 5%+DMSO 10%.
Experimento 2: Congelamento em rampa em palheta de 0,5 mL
As amostras de sêmen do T6 (Glicose 5% + DMSO 10%) apresentaram as taxas mais altas de motilidade de espermatozóides progressivos, médios e lentos pós-descongelamento dentre os outros tratamentos, mas não chegando a igualar ou se aproximar da motilidade dos espermatozóides progressivos à fresco (P<0.05) (Fig. 22). Entretanto, esta criosolução (T6) não apresenta diferença significativa com as diluições 1:5 de T1 e de T2, e de 1:3 de T4 (Tab. 7).