UNIVERSIDADE DA BEIRA INTERIOR
Ciências da Saúde
Ecografia das glândulas salivares major na
avaliação e seguimento dos doentes com
Síndrome de Sjögren Primária
Catarina Caldeira Roteia
Dissertação para obtenção do Grau de Mestre em
Medicina
(ciclo de estudos integrado)
Orientadora: Dr.ª Margarida Alexandre Oliveira
ii
Dedicatória
iii
Agradecimentos
Quero começar por agradecer à minha orientadora Dr.ª Margarida Oliveira pela sua disponibilidade, conselhos e indicações de ordem técnica, e estímulos que me deu durante a realização desta dissertação.
Agradeço ao meu pai Joaquim e à minha irmã Susana pelo enorme apoio que me deram neste ultimo ano, sendo decisivos nesta etapa da minha vida.
Agradeço à Joana por estar sempre ao meu lado.
Por fim, agradeço a todos que direta ou indiretamente contribuíram para a realização deste trabalho.
iv
Resumo
Título: Ecografia das Glândulas Salivares Major na Avaliação e Seguimentos dos doentes com
Síndrome de Sjӧgren Primária.
Introdução: A Síndrome de Sjögren Primária é uma doença reumática inflamatória crónica,
autoimune, que se manifesta clinicamente por xerostomia e xeroftalmia, devido à infiltração linfocitária das glândulas exócrinas, principalmente glândulas salivares e lacrimais. A ecografia tem sido cada vez mais utilizada na avaliação e seguimento destes doentes visto que é uma técnica imagiológica não invasiva, barata, isenta de radiações e bem aceite pelos doentes.
Objetivos: Revisão de literatura no sentido de avaliar a utilidade da ecografia das glândulas
salivares major na avaliação e seguimento dos doentes com Síndrome de Sjӧgren Primária.
Metodologia: As palavras-chave “Sjӧgren’s Syndrome” “Primary Sjӧgren’s Syndrome”,
“ultrasonography of the major salivary glands”, “color doppler sonography”, “classification
criteria”; “major salivary glands” e “ultrasonography” foram utilizadas para a pesquisa de
artigos científicos nas bases de dados PubMed e ResearchGate. Foi também realizada a leitura livros de texto onde este tema era abordado.
Resultados e Discussão: Vários estudos em relação à utilidade da ecografia das glândulas
salivares major na avaliação dos doentes com Síndrome de Sjӧgren Primária foram realizados e vários parâmetros ecográficos foram descritos como importantes, a saber: a ecogenicidade, a homogeneidade do parênquima glandular, o tamanho/volume, a definição dos bordos das glândulas e a vascularização. A homogeneidade do parênquima glandular é o achado ecográfico que reúne mais consenso entre a comunidade científica como sendo o mais característico de Síndrome de Sjӧgren Primária. A vascularização das glândulas salivares pode ser inferida pelo uso de Doppler Cor, que reflete de forma indireta o grau de inflamação. Estudos adicionais são necessários para incorporar esta técnica na prática clínica diária, sendo muito promissora no diagnóstico, na avaliação da progressão da atividade da doença e na monitorização clínica e terapêutica.
v
Palavras-chave
Síndrome de Sjӧgren, Síndrome de Sjӧgren Primária, Ecografia das Glândulas Salivares Major, Ecografia Doppler Cor, Critérios de Classificação, Glândulas Salivares Major, Ecografia
vi
Abstract
Title: Ultrasound of the Major Salivary Glands in the evaluation and follow-up of patients with
Sjӧgren Syndrome Primary.
Introduction: Primary Sjögren's Syndrome is an autoimmune inflammatory chronic rheumatic
disease, which is clinically manifested by xerostomia and xerophthalmia due to lymphocytic infiltration of the exocrine glands, mainly salivary and lacrimal glands. Ultrasound has been increasingly used in the evaluation and follow-up of these patients because it is a noninvasive imaging technique, inexpensive, free of radioation and well accepted by patients.
Objetives: Literature review to assess the usefulness of ultrasound of the major salivary
glands in the evaluation and follow up of patients with Sjӧgren Syndrome Primary.
Methodology: The keywords "Sjӧgren's Syndrome" "Primary Sjӧgren's Syndrome",
"ultrasonography of the major salivary glands", "color Doppler sonography," "classification criteria"; "major salivary glands" and "ultrasonography" were used for the research of scientific articles in PubMed and ResearchGate databases. Reading of text books where this
topic was discussed.
Results and Discussion: Several studies about the use of ultrasound in the assessment of the
salivary glands of patients with Primary Sjӧgren syndrome were performed and several ultrasound parameters were described as important, namely: echogenicity, homogeneity parenchyma, size / volume, definition of the edges of the salivary glands and vascularization. The homogeneity of the glandular parenchyma is the ultrasound finding which brings more consensus among the scientific community as being the most characteristic of Primary Sjӧgren syndrome. The vasculature of the glands can be inferred by the use of color Doppler, which also indirectly reflects the degree of inflammation. Additional studies are needed to incorporate this technique in clinical practice, being very promising in the diagnosis, assessment of the progression of disease activity and clinical and therapeutic monitoring.
vii
Keywords
Sjӧgren’s Syndrome; Primary Sjӧgren’s Syndrome; Ultrasonography of the Major Salivary Glands; Color Doppler Sonography; Classification Criteria; Major Salivary Glands; Ultrasonography
viii
Índice
1.Introdução ... 1 2.Síndrome de Sjӧgren ... 2 2.1.Definição ... 2 2.2.Epidemiologia... 2 2.3.Fisiopatologia ... 2 2.4.Manifestações Clínicas ... 3 2.5.Diagnóstico ... 7 2.6.Tratamento ... 113.Anatomia das Glândulas Salivares Major ... 13
3.1.Glândulas Parótidas ... 13
3.2.Glândulas Submandibulares ... 13
4.A Ecografia ... 14
4.1.Noções Básicas ... 14
4.2.Técnica de exploração ecográfica das glândulas salivares major ... 15
4.3.Anatomia ecográfica das glândulas salivares major ... 15
4.3.1.Glândulas Parótidas ... 15
4.3.2.Glândulas Submandibulares ... 16
4.4.Ecografia das glândulas salivares major em contexto de Síndrome de Sjӧgren Primária 16 5.A Ecografia Doppler ... 22
5.1.Noções Básicas ... 22
5.1.1.Ecografia Doppler Cor ... 22
5.2.Vascularização das glândulas salivares major ... 22
5.2.1.Glândulas Parótidas ... 22
5.2.2.Glândulas Submandibulares ... 23
5.3.Ecografia Doppler em contexto de Síndrome de Sjӧgren Primária ... 23
6.Utilidade da ecografia no seguimento dos doentes com Síndrome de Sjӧgren Primária . 25 7.Conclusão ... 26
ix
Lista de Tabelas
Tabela I – Manifestações Clínicas da Síndrome de Sjӧgren Primária ... 3
Tabela II – Questões específicas para a pesquisa de sintomas oculares e/ou orais ... 7
Tabela III – Testes oftalmológicos utilizados na avaliação dos doentes com Síndrome de Sjӧgren ... 8
Tabela IV – Critérios de Classificação ACR-SICCA da Síndrome de Sjӧgren ... 10
Tabela V – Critérios de Classificação AECG da Síndrome de Sjӧgren ... 11
Tabela VI – Opções terapêuticas para as manifestações clínicas sistémicas da Síndrome de Sjӧgren ... 12
Tabela VII – Valor diagnóstico das técnicas imagiológicas para as glândulas salivares major ... 17
Tabela VIII – Sistema de pontuação elaborado por Hočevar et al. ... 18
Tabela IX – Sistema de pontuação elaborado por Elke Theander et al ... 19
Tabela X – Sistema de pontuação elaborado por Wernicke et al ... 20
x
Lista de Acrónimos
ACR-SICCA - American College of Rheumatology-Sjögren’s International Collaborative Clinical
Alliance
AECG – American – European Consensus Group
Anti-Ro/SSA – Anticorpos contra os antigénios Ro ou SSA Anti-La/SSB – Anticorpos contra os antigénios La ou SSB ANA – Anticorpos Antinucleares
AR - Artrite Reumatoide ED – Ecografia Doppler
EGSM – Ecografia das Glândulas Salivares Major FR - Fator Reumatoide
FS - Focus Score
IgM – Imunoglobulinas M
LES – Lúpus Eritematoso Sistémico LNH – Linfoma Não Hodgking MHz – Milhões de Hertz OSS – Ocular Stainning Score PI – Índice de Pulsatilidade RI – Índice de Resistência
RMN – Ressonância Magnética Nuclear SS – Síndrome de Sjӧgren
SSP – Síndrome de Sjӧgren Primária SSS - Síndrome de Sjӧgren Secundária TC – Tomografia Computorizada US – Ultrassons
VHC – Vírus da hepatite C
VIH – Vírus da imunodeficiência humana VS - Velocidade de Sedimentação Z – Impedância Acústica
1
Introdução
A Síndrome de Sjögren (SS) é uma doença reumática inflamatória crónica, de causa autoimune, que afeta tipicamente mulheres da meia-idade(1). A sua prevalência varia de 0,1% a 4,8% na população em geral, sendo claramente superior nas mulheres em relação aos homens (ratio 9:1)(2, 3).
Nesta síndrome ocorre infiltração linfocítica das glândulas exócrinas e hiperatividade marcada das células B, com consequente hipergamaglobulinémia e presença de anticorpos no soro, incluindo anticorpos antinucleares (ANA), fator reumatoide (FR), crioglobulinémia e anticorpos contra os antigénios Ro ou SSA Ro/SSA) e contra os antigénios La ou SSB (anti-La/SSB)(3).
A SS manifesta-se clinicamente por xerostomia e xeroftalmia, podendo ainda apresentar diversas manifestações clínicas sistémicas. Estas manifestações podem estar relacionadas com o infiltrado periepitelial dos órgãos parenquimatosos ou com a deposição de imunocomplexos. Embora a SS seja considerado uma doença benigna, cerca 5-10 % dos pacientes podem desenvolver Linfoma Não Hodgkin (LNH), sendo esta a complicação mais séria(3, 4).
A SS pode ser primária (SSP), ou seja, não associada a outras doenças ou pode aparecer associada a outras doenças autoimunes, como a artrite reumatoide (AR), lúpus eritematoso sistémico (LES), polimiosite, esclerodermia, tiroidite ou outras, sendo então designada Síndrome de Sjögren Secundária (SSS)(5).
Existem vários critérios de classificação da doença, sendo os critérios ACR-SICCA (American College of Rheumatology- Sjögren’s International Collaborative Clinical Alliance), de 2012, os de publicação mais recente(6). Dada a utilidade evidente da ecografia, como método de imagem na avaliação dos doentes com doenças reumáticas, nomeadamente na avaliação e seguimento dos doentes com SSP, várias alterações têm sido propostas aos critérios de classificação ACR-SICCA, visando incluir os achados ecográficos, habitualmente encontrados nas diferentes fases de evolução desta doença, como parte integrante dos critérios de classificação da SS.
A ecografia das glândulas salivares major (EGSM) revela-se uma ferramenta de imagem não invasiva, barata e isenta de radiações, que demonstrou utilidade na discriminação de pacientes com e sem SS(7). Vários estudos demonstraram que é possível propor a EGSM como um item adicional aos critérios de classificação da doença já existentes.
Assim, a noção da utilidade da EGSM na avaliação e seguimento dos doentes com SSP e o saber interpretar os achados ecográficos presentes nas diferentes fases da evolução da doença, mostram-se cada vez mais importantes na prática clínica do reumatologista.
2
Síndrome de Sjögren
Definição
A SS é uma doença inflamatória crónica autoimune, com manifestações clínicas diversas. Caracteriza-se por uma infiltração linfocitária das glândulas exócrinas (principalmente glândulas salivares e lacrimais) e por hiperatividade marcada das células B(3).
A SS pode ocorrer na forma primária, não associada a outras doenças, sendo dominada SSP ou pode aparecer associada a outras doenças reumáticas autoimunes, como a AR, LES, polimiosite, esclerodermia, tiroidite ou outras, sendo designada SSS(5).
Epidemiologia
As estimativas da incidência e prevalência da SS são variáveis, visto que dependem dos critérios de inclusão usados, do desenho do estudo, do tamanho da amostra e da população examinada (etnia, sexo). No entanto, estudos recentes sugerem que a prevalência varia entre 0,1% e 4,8%, na população em geral, com as taxas a aumentar à medida que a idade avança. A SS é nove vezes mais comum nas mulheres do que nos homens, com um pico de incidência por volta da idade da menopausa(3, 5). A prevalência da SSP é aproximadamente 0,5%-1% e a da SSS é de cerca de 30%(8).
Fisiopatologia
A SS é uma exocrinopatia crónica e progressiva onde existe proliferação de linfócitos e infiltração nas glândulas afetadas. Existe uma resposta autoimune dirigida contra as glândulas exócrinas. Estas apresentam progressivos e persistentes infiltrados focais mononucleares. Com o tempo ocorre a atrofia das células do epitélio acinar e posterior progressão para fibrose(9).
A etiopatogenia não é conhecida, mas atualmente considera-se que na génese desta doença possa existir uma interação entre diversos fatores, nomeadamente ambientais, epigenéticos, hormonais, genéticos e neuropsicológicos(10).
Pensa-se que após um estímulo por um fator exógeno, ocorra dano das células epiteliais das glândulas salivares. Consequentemente ocorre migração dos linfócitos T e infiltração linfocítica das glândulas exócrinas, com marcada hiperatividade dos linfócitos B e produção do FR, dos anti-Ro/SSA, dos anti-La/SSB e do crioprecipitado de imunoglobulinas(2, 3).
3
Manifestações Clínicas
As manifestações clínicas da SS podem ser divididas naquelas que estão relacionadas com a disfunção exócrina (glandular) e naquelas que afetam outros órgãos (extraglandulares ou sistémicas). As principais manifestações clínicas glandulares e extraglandulares são as seguintes:
Tabela I (parte I de II): Manifestações Clínicas da Síndrome de Sjӧgren Primária
Manifestação Clínica Prevalência (%) Caraterísticas clínicas e laboratoriais
Glandulares Destruição do epitélio glandular, anticorpos contra
recetores muscarínicos, diminuição da
neurotransmissão.
Xerostomia 90
Dificuldade na mastigação e deglutição; úlceras orais; Infeções orais e cáries dentárias, infeções por fungos (lesões mucosas eritematosas ou pseudomembranosas, língua fissurada, atrofia das papilas filiformes e queilite angular).
Aumento das glândulas
parótidas 50 Usualmente bilateral, firme à palpação, assintomática e preditor de risco para linfoma.
Xeroftalmia 95
Sensação de “areia” ou prurido ocular;
Diminuição das secreções lacrimais, irritação da córnea e destruição do epitélio da conjuntiva bulbar e da córnea (queratoconjuntivite seca).
Pele seca ~10 Pele seca, acompanhada por prurido.
Secura do trato
respiratório superior 20 Mucosa nasal seca, xerotraqueia, bronquite seca. Tosse seca crónica. Dispareunia 40 Frequentemente observada nas mulheres em pré-menopausa (por disfunção das glândulas vaginais
lubrificantes).
Adaptada de:Mavragani CP, Moutsopoulos HM. Sjӧgren syndrome. CMAJ. 186. Canada2014. p. E579-86 (3)
Tabela I (parte II de II): Manifestações Clínicas da Síndrome de Sjӧgren Primária
Manifestação Clínica Prevalência (%) Caraterísticas clínicas e laboratoriais Extraglandulares
(sistémicas) Não específicas
Musculosquelética 70
Artropatia de Jaccoud (deformidades reversíveis nas mãos, ausência de lesões erosivas);
Na radiografia das mãos podem objetivar-se
calcificações dos tecidos moles (associadas sobretudo a Fenómeno de Raynaud).
Fenómeno de Raynaud 30 Moderado em comparação com outras doenças autoimunes; não associado a complicações vasculares.
Fadiga 70 Aumento da necessidade de repouso, associada com incapacidade funcional.
Periepitelial
Brônquicas 20
Inflamação mononuclear peribrônquica e/ou
peribronquiolar;
Tosse seca e encurtamento da respiração durante o esforço;
Testes de função pulmonar: predomina o padrão obstrutivo das pequenas vias respiratórias;
Radiografia do tórax: habitualmente normal ou infiltrados pulmonares;
TC (Tomografia computorizada): espessamento das paredes brônquicas; o envolvimento intersticial puro é menos frequente (tipos comuns: pneumonia linfocítica
4
intersticial caraterizada por quistos de parede fina, bronquiolite linfocítica).
Fígado
Hepatomegalia
Presença de anticorpos antimitocondriais
Infiltração linfocítica à volta das células colangiais. 25 Anticorpos anti mitocondriais e SS: 2/3 dos pacientes demonstram anormalidades enzimáticas;
Histopatologia do fígado: inflamação ligeira do ducto biliar intra-hepático; cirrose biliar primária (estadio I); Progressão do SS-associado a cirrose biliar primária: muito lenta em termos clínicos, serológicos e histopatológicos.
5
Rim 2.5
Nefrite intersticial: Infiltração linfocítica em torno das células tubulares renais;
Curso subclínico;
Acidose tubular renal distal (hipocalémia, pH alcalino da urina, nefrocalcinose. Compromisso crónico renal moderado.
Glândulas endócrinas Infiltrados linfocíticos periepiteliais na tiroide, glândulas suprarrenais e ovários. Doença da Tiroide Autoimune Anticorpos contra os antigénios da tiroide Hipotiroidismo clínico
Sugere um subtipo de SS com curso ligeiro e normocomplementémia C4 10-20 1.5-16.5 Doença autoimune da glândula suprarrenal Anticorpos contra os antigénios da glândula suprarrenal (21-hidroxilase)
17 Associada à ativação das células B pelas citoquinas e à diminuição da resposta da glândula suprarrenal.
Doença autoimune dos ovários
Anticorpos contra os
antigénios dos ovários 27 Doença associada a
imunocomplexos Deposição dos imunocomplexos nos pequenos vasos da pele, nos nervos, nos rins e no cérebro como resultado da hiperatividade das células B
Vasculite cutânea
Púrpura palpável 10
A manifestação mais comum de vasculite;
Confere um risco aumentado de desenvolvimento de linfoma, quando associada a hipocomplementémia e crioglobulinémia;
Púrpura não palpável pode também ocorrer em contexto de hipergamaglobulinémia. Neuropatia periférica Neuropatia axonal sensitiva Neuropatia de pequenas fibras Neuropatia sensitivo-motora 2-10
Distribuição em luva e meia.
Parestesia dolorosa ou em queimadura.
Preditor adverso de linfoma, quando associada com hipocomplementemia, crioglobulinemia e lesões vasculíticas.
Glomerulonefrite
~2 Fator de risco adverso para linfoma e sobrevida, quando associada a vasculite sistémica, hipocomplementémia e crioglobulinémia;
5
Glomerulonefrite membranosa e membranoproliferativa são os subtipos histológicos mais frequentes;
Deposição de IgM (Imunoglobulinas M) e complemento, documentada por imunofluorescência nos tecidos renais; Hipertensão, proteinúria ligeira e hematúria, são as manifestações clínicas mais comuns.
Vasculopatia do sistema nervoso central
3-20
Associada a anti-Ro/SSA;
Manifestações clínicas semelhantes às da esclerose múltipla;
Anticorpos detetados contra as aquaporinas-4 foram detetados em pacientes com LES e SS com evidência de mielite transversa extensa longitudinal ou neurite ótica. Linfoma
Tecido linfoide associado a mucosas (o mais comum)
Linfoma nodal da zona marginal
Linfoma difuso das células B
Estimulação antigénica crónica, aberrações genéticas; Os locais de envolvimento: glândulas salivares minor e/ou major, estômago, pulmões, gânglios linfáticos; o envolvimento da medula óssea é raro;
Os fatores de risco para o desenvolvimento de linfoma incluem: neuropatia periférica, glomerulonefrite, linfopenia, lesões purpúricas ou vasculíticas, baixos níveis de C4, crioglobulinémia e centros germinativos na biópsia das glândulas salivares minor.
Adaptada de: Mavragani CP, Moutsopoulos HM. Sjӧgren syndrome. CMAJ. 186. Canada2014. p. E579-86 (3)
Carateristicamente os pacientes com SS apresentam diminuição da função das glândulas exócrinas, com consequente xeroftalmia e xerostomia.
Os pacientes descrevem sensação de “areia” nos olhos, ardor, diminuição do lacrimejar, “incapacidade de chorar”, rubor ocular, prurido e fotofobia, devidos à queratoconjuntivite seca. Podem aparecer filamentos de muco no canto interno do olho, sendo visíveis principalmente ao acordar. A ulceração da córnea e a blefarite podem também ser complicações desta afeção.
A secura oral conduz muitas vezes à dificuldade em engolir comida seca, à incapacidade de ter um discurso fluído, a cáries dentárias (65%), a sensação de ardor, a diminuição do paladar, a atrofia gengival, a candidíase oral (33%), a esofagite crónica e a perda ponderal(1, 8, 11).
A fadiga é também um dos sintomas mais comuns, ocorrendo em cerca de 70% dos pacientes com SSP, que frequentemente descrevem uma crescente necessidade de repouso(3).
O aumento das glândulas parótidas, submandibulares e de outras glândulas salivares ocorre em cerca de 2/3 dos pacientes com SSP, sendo incomum nos doentes com SSS. Este alargamento glandular pode ser episódico ou crónico, com tumefação frequentemente seguida de diminuição do tamanho glandular, em poucas semanas.
A secura vaginal associada a dispareunia é um sintoma comum nas mulheres com SS, podendo complicar-se com infeções bacterianas ou por candidíase. Outras manifestações geniturinárias podem ser: amenorreia, menorragias ou metrorragias, endometriose e cistite intersticial(8, 11).
O envolvimento extraglandular pode comprometer a pele, as articulações, os músculos, o trato respiratório, a tiroide, o coração, o trato gastrointestinal, o fígado, os rins,
6 a bexiga, o pâncreas, o sistema nervoso periférico, o cérebro, os gânglios linfáticos e a própria medula óssea(12).
Artrite e/ou artralgias são diagnosticadas em cerca de 50 % dos pacientes e tendem a ser poliarticulares, bilaterais e simétricas. As articulações mais afetadas são os tornozelos, as articulações metacarpofalângicas, as articulações metatarsofalângicas e os punhos. O envolvimento muscular ocorre em cerca de 27% dos pacientes com SSP.
A xerose (mais comum), a vasculite cutânea, o fenómeno de Raynaud e o eritema anular encontram-se entre as síndromes cutâneas associadas a SS(12). A vasculite afeta vasos de pequeno e médio calibre, tendo como manifestações clínicas: púrpura, urticária, ulcerações da pele, glomerulonefrite e mononeurite múltipla.
O envolvimento glandular do trato respiratório superior compromete a mucosa do nariz, dos seios nasais e da faringe posterior, pelo que estes doentes sofrem frequentemente de rinite não alérgica e sinusite. A tosse seca persistente decorre do envolvimento da laringe, traqueia e brônquios. A secura brônquica contribui para a ocorrência de infeções do trato respiratório superior, devido à tendência para a formação de rolhões mucosos espessos(11).
O envolvimento pulmonar é frequentemente comprovado histologicamente, mas raramente os doentes têm sintomatologia clínica. A doença pulmonar intersticial é a doença pulmonar mais comum e responsável pelo aumento da taxa de mortalidade(1, 8). Por outro lado, a pericardite aguda é uma complicação rara da SS(12). Sintomas endocrinológicos são também documentados em 15% dos pacientes com SSP e estão sobretudo relacionados com a disfunção tiroidea.
A disfagia é o sintoma gastrointestinal mais comum, mas náuseas, dor epigástrica e dispepsia podem ocorrer(1). Foram descritos casos de pancreatite autoimune esclerosante. Existe uma possível associação entre SS e a presença de anomalias hepáticas: anomalias bioquímicas ou alterações histológicas na biópsia hepática compatíveis com cirrose biliar primária, fibrose do trato portal ou hepatite crónica ativa são encontradas nestes pacientes(12).
A ocorrência de glomerulonefrite é rara e surge associada a crioglobulinémia. A nefrite intersticial e disfunção tubular renal, com ou sem acidose podem estar associadas a SSP(8).
O envolvimento do sistema nervoso pode ser multifocal, recorrente e progressivo, causando hemiparesias, mielite transversa, defeitos hemisensoriais, convulsões e anormalidades do movimento, como neuropatia não-atáxica sensorial (67%), neuropatia sensoriomotora (23%) e neuropatia sensorial atáxica (10%). A perda auditiva neurosensitiva ocorre em 50% dos casos. Casos de meningite asséptica e esclerose múltipla também foram reportados(1, 8).
Um aumento nas taxas de neuroticismo, psicose, obsessividade, hipocondria, ideação paranoide, somatização, sintomas obsessivo-compulsivos, distúrbios do sono e defeitos nas estratégias de copping tem sido reportado(3).
7 O LNH é a complicação mais séria do SSP. Pode surgir em aproximadamente 5-10% dos casos, sendo a glândula parótida a origem mais comum(8, 11, 13). Os achados que nos devem fazer pensar em linfoma são aumento glandular unilateral e persistente (especialmente quando o aumento anterior foi transitório ou intermitente), textura dura e nodular da glândula, a presença de vasculite cutânea ou púrpura palpável, leucopenia, crioglobulinémia, baixos níveis de C4, linfopenia, neuropatia periférica, glomerulonefrite e sintomas como perda de peso, febre e mal-estar(3, 8).Em média, o LNH aparece 7 anos após o diagnóstico de SSP(12). Apesar do risco de 5-10% do aparecimento de linfoma, a maioria dos pacientes com SS (≈ 90 %) tem um curso indolente e benigno(3, 11).
Diagnóstico
Em face da multiplicidade de sintomas clínicos e potenciais complicações desta doença, o diagnóstico precoce da SS é fundamental(14). No entanto, a diversidade das manifestações clínicas iniciais e a ausência de qualquer sinal, sintoma ou teste patognomónico da SS que permitam o reconhecimento precoce da doença, tornam por vezes o diagnóstico difícil(1, 7).
A chave para o diagnóstico desta entidade nosológica é a avaliação clínica cuidada de doentes que apresentem sintomas persistentes de olhos secos e boca seca, aumento recorrente das glândulas parótidas, um aumento inexplicado das cáries dentárias ou resultados anormais de testes serológicos específicos [por exemplo: Ro/SSA e/ou anti-La/SSB, FR, hipergamaglobulinémia e aumento da velocidade de sedimentação (VS)]. Esta avaliação deve incluir uma história clínica completa e uma revisão de todos os órgãos e sistemas, incluindo questões específicas para avaliar a secura oral e/ou ocular, exames clínicos para avaliar o grau de disfunção glandular e a pesquisa de anormalidades imunológicas(3, 5).
Perante um doente com sintomas de secura ocular e/ou oral, que persistem há 3 meses ou mais, devemos colocar a hipótese de SS, pelo que certas questões específicas devem ser colocadas ao paciente, nomeadamente:
Tabela II. Questões específicas para a pesquisa de sintomas oculares e/ou orais
Sintomas Oculares
Tem apresentado diariamente olhos secos (por mais de 3 meses)?
Tem sensação recorrente de “areia” nos olhos? Usa substitutos de lágrima mais de 3 vezes por dia?
Sintomas Orais
Tem apresentado diariamente sensação de boca seca (desde há mais de 3 meses)?
Tem apresentado aumento das glândulas salivares recorrente ou persistente, quando adulto?
Bebe líquidos frequentemente para o ajudar a engolir alimentos secos?
Acorda à noite para beber água porque tem a boca demasiado seca?
Adaptada de: Torres SLdC. Síndrome de Sjögren Artigo de Revisão Bibliográfica. Porto: Instituto de Ciências Biomédicas Abel Salazar - Universidade do Porto; 2013(9)
8 Ao exame físico, deve-se ter particular atenção à presença do aumento das glândulas lacrimais ou salivares e aos sinais de hipofunção salivar, incluindo a existência de cáries nas porções cervicais e incisionais dos dentes, língua hiperlobulada, com perda das papilas filiformes e ausência de saliva no pavilhão bucal. Lesões de queratite filamentares ou ulcerações puntiformes na córnea podem ser detetadas com a coloração de Rosa Bengala, lissamina verde ou fluoresceína. Por sua vez, a objetivação de alterações na produção de lágrimas pode ser feita pelo Teste de Schirmer I e pelo Tempo de Rutura da Lágrima. Todos os pacientes devem ser examinados por um oftalmologista(2, 3, 5, 8, 9, 11).
Tabela III. Testes Oftalmológicos utilizados na avaliação de pacientes com Síndrome de Sjӧgren
Teste de Schirmer I
Um pequeno pedaço de papel de filtro estéril é colocado na junção entre o terço lateral e o terço médio da pálpebra inferior, sem anestesia. Se após 5 minutos o humedecimento do papel de filtro for inferior a 5 mm é considerado anormal, ou seja, indicativo de deficiência na produção de lágrimas. Os resultados frequentemente são semelhantes em ambos os olhos.
Tempo de Rutura da Lágrima (Tear Break-up time – TBUT)
Permite a avaliação global da função lacrimal. Mede-se o tempo de rutura e a osmolalidade da lágrima após a instilação de fluoresceína. A visualização com uma lâmpada de fenda e uma luz de cobalto azul são necessárias. Um tempo de rutura da lágrima inferior ou igual a 10 s é anormal e indicativo de deficiência ou anormalidade na qualidade da camada mucosa mais externa do filme lacrimal. A sua correlação com a gravidade dos sintomas oculares e doenças do epitélio da córnea é melhor do que a do teste de Schirmer I, no entanto pacientes com produção normal de lágrimas podem ter resultados anormais, devido por exemplo a disfunção das glândulas meibomianas.
Coloração da Superfície Ocular (Rosa Bengala e Lissamina Verde)
Os danos das células epiteliais da córnea e conjuntiva podem ser avaliados por corantes vitais que mancham as áreas de tecidos desvitalizados. A coloração Rosa Bengala cora tecidos desvitalizados da córnea e da conjuntiva, no entanto, visto que o seu uso é doloroso em pacientes com olhos secos, esta tem vindo a ser substituída pela fluoresceína (para coloração da córnea) e Lissamina verde (para coloração da conjuntiva). Com a coloração fluoresceína e Lissamina verde podemos então calcular o Ocular
Stainning Score (OSS), criado pelo SICCA, cujo score varia de 0 a 12. Se OSS≥3 é sugestivo de SS.
Adaptada de: Torres SLdC. Síndrome de Sjögren Artigo de Revisão Bibliográfica. Porto: Instituto de Ciências Biomédicas Abel Salazar - Universidade do Porto; 2013(9)
Testes laboratoriais básicos devem ser realizados, de modo a procurar anormalidades que possam ser observadas na SS, nomeadamente leucopenia, trombocitopenia, anemia, hipergamaglobulinémia, elevação da VS. Podem também estar presentes proteinúria e/ou hematúria, que refletem a rara ocorrência de glomerulonefrite e achados indicativos de acidose tubular renal, incluindo proteinúria moderada, hipoestenúria e pH urinário> 7, na presença de acidose metabólica. A pesquisa dos ANA, anti-Ro/SSA, anti La/SSB e FR, deve ser
9 sempre realizada em caso de suspeita clínica de SS(2, 5). Os doentes com SSP possuem anti-Ro/SSA (70%-100%) e/ou anti-La/SSB (35-70%), sendo os últimos altamente específicos(3). Estas percentagens variam com o tipo de exame laboratorial, mas geralmente 60-80% dos pacientes com SSP exibem um ou ambos os anticorpos. Favorece assim o diagnóstico de SS um teste positivo para os anti-Ro/SSA e/ou anti-La/SSBA, combinado com os títulos de ANA ≥1:320 e a presença de FR.
A cintigrafia das glândulas salivares, a sialometria completa, a sialografia com contraste, a TC, a ressonância magnética nuclear (RMN) e a EGSM são exames diagnósticos importantes na avaliação dos doentes com SS.
A cintigrafia permite realizar uma avaliação funcional das glândulas salivares major. A descoberta de uma captação muito baixa do radionuclídeo tecnécio Tc99m através da cintigrafia é pouco sensível, mas altamente específica de SS.
A sialografia com contraste permite avaliar alterações anatómicas, permitindo uma excelente visualização dos ductos. No entanto, o seu uso é limitado pelo risco de rutura e por estar contraindicado na presença de parotidite aguda.
A sialometria completa permite quantificar a taxa de produção da saliva. A taxa total de fluxo salivar não estimulado é um teste relativamente simples que avalia a produção de saliva, principalmente das glândulas submandibulares e sublinguais. Pede-se ao doente para cuspir uma vez; após 15 minutos, o volume de saliva é coletado num recipiente e medido. Um valor coletado≤1,5 ml durante este tempo indica hipoprodução salivar. A sialometria completa também pode ser realizada com a estimulação da secreção da saliva, através da mastigação ou com o uso de sialagogos (como o ácido cítrico ou a pilocarpina), medindo a produção estimulada da glândula parótida. No teste Saxon, um método de sialometria completa, o doente mastiga uma esponja durante dois minutos. A diferença no peso da esponja antes e depois de a mastigar representa a quantidade de saliva produzida, pelo que a acumulação <2,75g de saliva na esponja ao longo de um período de dois minutos é sugestivo de SS. Mede predominantemente a produção de saliva das glândulas parótidas(5, 7, 9).
Na RMN das glândulas parótidas em doentes com SS observa-se heterogeneidade do parênquima nas sequências T1 e T2, existindo um típico padrão nodular caraterizado por áreas de tamanho variável hipo/hiperintensas. Este padrão em “favos de mel” ou “sal e pimenta” deve-se à infiltração linfocítica, infiltração gorda, fibrose e dilatação ductal.
O uso da EGSM na avaliação dos doentes com SS tem sido muito estudado e debatido. Esta é usada para detetar anormalidades ao nível da ecogenicidade, da homogeneidade do parênquima glandular, do tamanho/volume e dos bordos das glândulas salivares. A presença de inflamação ductal, associada à dilatação intraductal e a um aumento do fluxo sanguíneo, traduz-se na ecografia por múltiplas áreas dispersas habitualmente hipoecogénicas ou anecogénicas bem definidas, pequenas e ovais. À medida que a doença progride, numerosos espaços quísticos podem aparecer, que representam a progressiva destruição das glândulas salivares e uma sialectasia proeminente(7, 15). Este método possui o mesmo valor diagnóstico
10 para SS que a cintigrafia e a biópsia das glândulas salivares minor, além de que é mais barata e acessível que a RMN.
A TC das glândulas parótidas pode revelar heterogeneidade do parênquima, padrão nodular, acumulação anormal de gordura, alterações do tamanho da glândula e quistos. A presença de calcificações puntiformes difusas é altamente específica de SS. No entanto, como a TC envolve radiação ionizante, esta não é tao usada como a RMN ou a EGSM.
A biópsia das glândulas salivares minor tem um papel fundamental no diagnóstico dos doentes com suspeita clínica de SS. As indicações para a biópsia são as seguintes: confirmação de uma suspeita de SS e exclusão de outras condições que possam causar xerostomia e aumento bilateral das glândulas salivares. A classificação histológica mais aceite regista o número de focos de tecido linfoide (definido como agregado de 50 ou mais linfócitos) por 4 mm2, pelo que um focus score (FS)≥1 é considerado indicativo de SS. As células T CD4+ predominam em lesões ligeiras e as células B predominam em lesões de estadios mais avançado. Os centros germinativos podem ainda estar presentes em 20% dos pacientes, sendo a sua presença um fator preditivo adverso para linfoma(3, 5, 9).
Foram elaborados recentemente critérios de classificação de SS para uniformizar as populações nos estudos epidemiológicos e clínicos: os critérios de classificação ACR-SICCA. Estes critérios não diferenciam a forma primária da forma secundária e não incluem os sintomas relacionados com as glândulas exócrinas(5, 6). A seguinte tabela resume os critérios ACR-SICCA:
Tabela IV. Critérios de Classificação ACR-SICCA da Síndrome de Sjӧgren
A classificação de SS, que se aplica a indivíduos com sinais/sintomas que possam sugerir SS, pode ser realizada em pacientes que têm pelo menos 2 das 3 seguintes manifestações objetivas:
Anti-Ro/SSA e/ou anti-La/SSB presentes no soro ou a presença de FR e títulos de ANA≥ 1:320;
Biópsia das glândulas salivares minor que revele sialadenite focal linfocítica com um FS≥1;
Queratoconjuntivite seca com OSS ≥3 (assumindo que os indivíduos não usam correntemente gotas diárias para glaucoma, e não tiveram cirurgia à córnea ou cirurgia cosmética à pálpebra nos últimos 5 anos).
Um diagnóstico prévio a qualquer uma das seguintes condições deve excluir a participação nos estudos de Síndrome de Sjӧgren ou ensaios terapêuticos, porque pode ocorrer sobreposição de manifestações clinicas ou interferências com os testes critério:
História de radiação à cabeça ou pescoço;
Vírus da hepatite C (VHC);
Vírus da imunodeficiência humana (VIH);
Sarcoidose;
Amiloidose;
Doença enxerto-vs-hospedeiro;
Doença relacionada com IgG4.
Tabela adaptada de: Shiboski SC, Shiboski CH, Criswell L, Baer A, Challacombe S, Lanfranchi H, et al. American College of Rheumatology classification criteria for Sjӧgren's syndrome: a data-driven, expert consensus approach in the Sjogren's International Collaborative Clinical Alliance cohort. Arthritis Care Res (Hoboken). 2012;64(4):475-87(6)
Os critérios de classificação do AECG (American-European Consensus Group) elaborados em 2002 são os mais utilizados e os mais amplamente aceites. Estes critérios não foram desenvolvidos para a prática clínica e nem todos os pacientes com diagnóstico de SS
11 preenchem os critérios propostos. Diferencia SSP de SSS. Os diagnósticos de exclusão também são descritos(5, 16).
Tabela V. Critérios de Classificação AECG da Síndrome de Sjӧgren
Sintomas oculares (resposta positiva a pelo menos uma das seguintes questões):
Tem apresentado diariamente olhos secos, por mais de 3 meses?
Tem uma sensação recorrente de areia nos olhos?
Usa substitutos de lágrima mais de 3 vezes por dia?
Sintomas orais (resposta positiva a pelo menos uma das seguintes questões):
Tem apresentado diariamente sensação de boca seca, por mais de 3 meses?
Tem apresentado aumento das glândulas salivares recorrente ou persistente quando adulto?
Bebe frequentemente líquidos para ajudar a engolir alimentos secos?
Sinais de comprometimento ocular (resultado positivo para um dos seguintes testes):
Teste de Schirmer I ≤5 mm após 5 minutos;
Van Bijsterveld score≥ 4 (depois da coloração lissamina verde). Histopatologia
Biópsia das glândulas salivares minor positiva quando FS≥1, ou seja, presença de 1 ou mais focos (aglomerados de 50 ou mais linfócitos) por 4mm2 de tecido glandular
Envolvimento da glândula salivar (resultado positivo para um dos seguintes testes diagnósticos):
Sialometria com fluxo salivar total não-estimulado≤1,5ml aos 15 min;
Sialografia da parótida mostrando sialectasias difusas, sem evidência de obstrução dos ductos maiores;
Cintigrafia salivar com atraso na captação, redução na concentração e/ou atraso na secreção do radionuclídeo.
Autoanticorpos (a presença de um ou ambos):
Anti-Ro/SSA e/ou anti-La/SSB. Classificação
O diagnóstico de SSP requere a presença de 4 dos 6 critérios, incluindo uma amostra de biópsia das glândulas salivares minor positiva ou anti-Ro/SSA ou anti-La/SSB, ou 3 dos 4 critérios objetivos;
O diagnóstico de SSS requere a presença de uma doença do tecido conetivo estabelecida e um sintoma seco mais qualquer um dos 3 dos 4 critérios objetivos;
Exclusão: radioterapia prévia à cabeça e pescoço, linfoma, sarcoidose, doença enxerto-vs-hospedeiro, infeção com o VHC ou VIH ou o uso de medicação anticolinérgica.
Adaptada de: Vitali C, Bombardieri S, Jonsson R, Moutsopoulos HM, Alexander EL, Carsons SE, et al. Classification criteria for Sjӧgren's syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann Rheum Dis. 2002;61(6):554-8(16)
Tratamento
Todos os pacientes com SS e xerostomia devem cumprir algumas medidas básicas tais como a evicção de álcool, tabaco e a ingestão de sumos e água com aditivos. Devem ainda evitar ambientes com ar condicionado e alguns fármacos como diuréticos, antidepressivos, anti-histamínicos que podem piorar a secura oral. A vigilância em consultas de estomatologia é aconselhada, visto que a higiene oral é uma boa medida de prevenção de complicações dentárias. A estimulação do fluxo salivar consegue-se através do uso de chicletes sem açúcar e do uso de citrinos. O uso de saliva artificial (preparações de substitutos de saliva) é aconselhada para alívio sintomático temporário em doentes que não beneficiam de estimulantes do fluxo salivar e/ou que bebam água abundantemente. Por sua vez, para aqueles que não têm benefício com estimulantes tópicos e substitutos da saliva e ainda possuem função residual glandular, é sugerido o uso de agonistas muscarínicos. Atualmente existem dois agonistas muscarínicos de uso clínico: pilocarpina (10-30 mg/dia via oral) e cevimelina (30 mg 3x/dia meia hora antes das refeições).
12 O tratamento da xerolftalmia deve basear-se na gravidade da doença e na resposta à terapia. Inicialmente, devem ser usadas lágrimas artificiais ou lubrificantes oculares, sem conservantes que contenham ou hialuronato de sódio ou hidroxipropilmetilcelulose. Em pacientes com doença moderada a grave, estão indicadas medidas adicionais tais como a utilização de ciclosporina tópica (0.05%) durante 6 meses. Geralmente não se usam glucocorticoides ou outras terapias sistémicas anti-inflamatórias ou imunossupressoras para o tratamento dos sintomas relacionados com secura oral e/ou ocular(3, 9, 17).
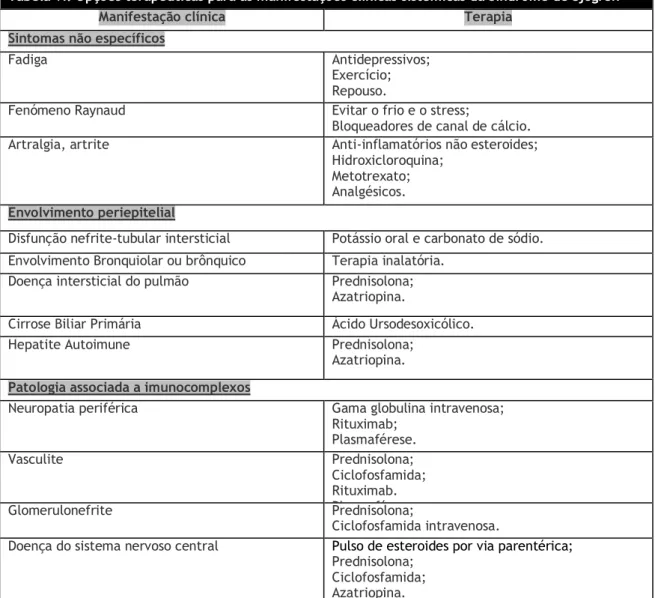
A terapia sistémica deve ser considerada para os pacientes que apresentem manifestações clínicas sistémicas. As opções terapêuticas encontram-se resumidas na seguinte tabela:
Tabela VI. Opções terapêuticas para as manifestações clínicas sistémicas da Síndrome de Sjӧgren
Manifestação clínica Terapia
Sintomas não específicos
Fadiga Antidepressivos;
Exercício; Repouso.
Fenómeno Raynaud Evitar o frio e o stress;
Bloqueadores de canal de cálcio.
Artralgia, artrite Anti-inflamatórios não esteroides;
Hidroxicloroquina; Metotrexato; Analgésicos. Envolvimento periepitelial
Disfunção nefrite-tubular intersticial Potássio oral e carbonato de sódio. Envolvimento Bronquiolar ou brônquico Terapia inalatória.
Doença intersticial do pulmão Prednisolona;
Azatriopina.
Cirrose Biliar Primária Ácido Ursodesoxicólico.
Hepatite Autoimune Prednisolona;
Azatriopina. Patologia associada a imunocomplexos
Neuropatia periférica Gama globulina intravenosa;
Rituximab; Plasmaférese. Vasculite Prednisolona; Ciclofosfamida; Rituximab. Plasmaférese Glomerulonefrite Prednisolona; Ciclofosfamida intravenosa.
Doença do sistema nervoso central Pulso de esteroides por via parentérica;
Prednisolona; Ciclofosfamida; Azatriopina.
13
Anatomia das Glândulas Salivares Major
Glândulas Parótidas
As glândulas parótidas encontram-se localizadas bilateralmente na fossa retromandibular, anteriormente à orelha e ao músculo esternocleidomastóideo. Parte do lobo superficial cobre o ramo da mandíbula e a parte posterior do músculo masséter. O seu tamanho normal é de cerca de 35 mm na horizontal e 45 mm na vertical, com uma espessura de cerca de 7 mm na parte anterior e de 22 mm na parte posterior. O tamanho da glândula é proporcional ao peso corporal, mas em média o peso ronda os 14 g. São as maiores glândulas salivares do corpo humano.
Normalmente, a glândula parótida é gordurosa, irregular, cuneiforme e unilobular. É vascularizada pela artéria facial transversa, ramo da artéria temporal superficial. A artéria facial transversa pode ser visualizada perto do côndilo temporomandibular.
Carateriza-se por uma parte superficial ao plano principal do nervo facial e uma parte localizada profundamente a este plano(15, 18, 19).
Glândulas Submandibulares
As glândulas submandibulares encontram-se caudal e anteriormente à glândula parótida. Tem a forma de U e dimensões médias de 30x35x15mm. São rodeadas pelas seguintes estruturas: músculo milohióideo, mandíbula, ventre anterior do músculo digástrico e vasos faciais, que normalmente se encontram posteriormente ou dentro da glândula. As glândulas submandibulares possuem menos tecido adiposo que as glândulas parótidas.
A vascularização é providenciada pelo ramo submentoniano da artéria facial. A artéria facial está localizada posteriormente à glândula submandibular ou mesmo dentro desta(15, 18, 19).
14
A Ecografia
Noções básicas
A ecografia tem sido cada vez mais usada na prática diária dos reumatologistas. Esta técnica permite obter imagens de alta resolução, em tempo real e de forma dinâmica, de estruturas articulares e periarticulares. Tem a vantagem de ser isenta de radiação, barata, portável, bem aceite pelos pacientes e repetível (20). Ao mesmo tempo, a ecografia é um procedimento imagiológico com grande capacidade de contribuir para o diagnóstico das doenças relacionadas com as glândulas salivares. A localização anatómica relativamente superficial, a clara distinção dos tecidos circundantes e a ecogenicidade típica das glândulas salivares, permitem que o reumatologista tenha uma rápida visão da anatomia normal e patológica das glândulas salivares(18).
A ecografia é um método de diagnóstico imagiológico que se baseia no fenómeno de interação dos ultrassons (US) com os tecidos. Os US são gerados por dispositivos denominados transdutores (ou sondas) constituídos por cristais piezoelétricos, que são sólidos com retículo cristalino, que transformam um pulso elétrico em mecânico e vice-versa. A corrente elétrica passa através do cristal e isto ativa-o; a vibração do cristal cria ondas sonoras que penetram nos tecidos. Estas ondas sonoras movem-se a uma frequência extremamente elevada. É a espessura dos cristais piezoelétricos que determina a frequência emitida(21-23). Os materiais mais utilizados nos transdutores dos equipamentos de ecografia são as cerâmicas de titanato-zirconato de chumbo. O formato da sonda varia de acordo com a utilização prevista (linear, convexa, intracavitária). Sondas de alta frequência são utilizadas para o estudo das partes moles e regiões superficiais e as de baixa frequência para estudos de órgãos mais profundos. A frequência da onda sonora determina a resolução espacial do método: quanto maior a frequência, maior será a resolução espacial, ou seja, pequenos detalhes podem ser visualizados. Por sua vez, altas frequências implicam menor poder de penetração, o que quer dizer que só se podem visualizar estruturas superficiais. Estas noções são importantes para a seleção da frequência sonda. As frequências médicas são medidas em milhões de Hertz (MHz)(21, 23, 24).
Como os tecidos têm uma constituição molecular variada, a velocidade de propagação dos US também vai ser variável com o meio. Cada meio tem a sua própria impedância acústica (Z) que é o produto da velocidade do som pela densidade do meio. Meios que possuam diferentes densidades têm impedâncias acústicas diferentes(24). Assim, após a emissão dos US pelo transdutor, diferentes respostas são geradas em tecidos diferentes. Cada tecido origina um eco específico. Estes ecos retornam ao transdutor e o cristal piezoelétrico converte esta energia mecânica em energia elétrica, que depois é traduzida no monitor do ecógrafo em “pontos”, numa escala de cinzentos. A cor e o brilho desse “ponto” é proporcional à intensidade dos ecos recebidos e a sua localização depende do tempo
15 decorrido da sua emissão até à receção. O transdutor revela-se emissor e recetor ao mesmo tempo. A imagem ecográfica obtida depende então da capacidade de reflexão dos US pelos tecidos com impedâncias acústicas diferentes. Interfaces com impedâncias acústicas elevadas produzem ecos de amplitude elevada, sendo denominadas ecogénicas ou hiperecogénicas, em relação a um referencial de comparação. Por outro lado, as que possuem valores intermediários de amplitude de eco são hipoecogénicas e aquelas com refletividade pouco significativa são anecogénicas. Não foram confirmados quaisquer efeitos biológicos dos US nos doentes ou operadores.
A análise da imagem ecográfica obtida baseia-se nas informações relacionadas com a deteção, caracterização e interpretação dos sinais ecográficos obtidos no momento do exame. Primeiro, detetamos uma imagem ecográfica que difere da normalidade. Posteriormente, descrevemo-la utilizando a seguinte nomenclatura: topografia, morfologia, dimensões, ecogenicidade (isoecogénica, hiperecogénica, hipoecogénica, anecogénica) e ecoestrutura (homogénea, perda ligeira da homogeneidade ou heterogénea)(21-24).
Técnica ecográfica de exploração das glândulas salivares major
Os ecógrafos usados para o estudo das glândulas salivares utilizam transdutores lineares de alta frequência (10 a 18 MHz). Os pacientes devem estar em posição supina ou deitados com o pescoço em hiperextensão e a cabeça virada para o lado contrário ao que está a ser examinado. As glândulas parótidas são analisadas nos planos axial e coronal, com o ecógrafo em modo B. Por sua vez, as glândulas submandibulares são examinadas essencialmente nos planos coronários. As glândulas salivares devem ser avaliadas bilateralmente (4, 15, 25-30).
Anatomia ecográfica das glândulas salivares major
Glândulas parótidas
As glândulas parótidas são habitualmente homogéneas e com ecogenicidade comparável à da tiroide, mas superior à do músculo adjacente. Normalmente, os lobos profundos das glândulas parótidas dificilmente são visualizados(7, 15, 18, 19).
O ducto principal (ducto Stenton) e os ductos intraglandulares habitualmente não são visualizados na ecografia, mesmo com os transdutores de alta frequência. No entanto, podem ser por vezes visualizados como estruturas lineares altamente refletivas.
Na maioria dos casos, a veia retromandibular pode ser visualizada ecograficamente, encontrando-se profundamente ao nervo facial, junto com a artéria carótida externa. Em relação ao nervo facial, este não é rotineiramente visualizado com a ecografia, embora a sua
16 posição possa ser inferida visto que este se encontra lateralmente aos principais vasos intraglandulares, que podem ser visualizados(13, 19).
Por vezes, podem ser encontrados alguns gânglios linfáticos no parênquima das glândulas parótidas, com localização pré-auricular ou na parte caudal da glândula. Quando são benignos aparecem elípticos e hipoecogénicos com uma zona central hiperecogénica. É possível visualizar com a ecografia Doppler (ED) Cor os vasos centrais dos gânglios linfáticos nas glândulas parótidas normais(13, 15).
Glândulas Submandibulares
As glândulas submandibulares têm um padrão homogéneo, com ecogenicidade superior à das glândulas parótidas. A sua forma normal é triangular, encapsulada, com uma base posterior. Encontram-se inferiormente à mandíbula.
O ducto principal (ducto de Wharton) é melhor visualizado quando se encontra patologicamente dilatado, embora possa ser visto em sujeitos normais como uma estrutura tubular de parede fina. A sua diferenciação dos vasos da língua pode ser feita usando Doppler Cor. Os ductos intraglandulares raramente são visualizados, mas quando observados assemelham-se a estruturas lineares hiperecogénicas.
A tortuosa artéria facial pode ser visualizada a atravessar o parênquima e o nervo facial pode ser observado posteriormente e fora da glândula(15, 19, 29).
Ecografia das glândulas salivares major em contexto de
Síndrome de Sjögren Primária
A ecografia é uma técnica imagiológica não invasiva e barata, que deteta várias anormalidades nas glândulas salivares major e não causa transtorno aos doentes. Em modo B, os seguintes parâmetros podem ser avaliados: ecogenicidade (avaliada em comparação com a da glândula tiroide ou, no caso de patologia tiroidea concomitante, com as estruturas anatómicas à volta, músculo e gordura subcutânea), homogeneidade (homogénea, perda ligeira da homogeneidade e heterogénea), tamanho/volume (menos estudado; as metodologias variam nos diferentes estudos) e definição dos bordos glandulares (de bem definidos a bordos não visíveis).
Numerosos estudos usando a EGSM na avaliação dos doentes com SSP foram publicados e vários conjuntos de critérios de classificação foram sugeridos e usados para diagnóstico de SSP(7, 15, 25). A maioria dos investigadores reportou a perda da homogeneidade do parênquima das glândulas salivares como o sinal ecográfico mais indicativo de estarmos perante um doente com SSP. Wakefield et al.(15) afirmam ainda que apenas uma perda elevada de homogeneidade pode ser considerada como tendo verdadeiro valor diagnóstico da doença, pois reduções ligeira da homogeneidade também pode estar presente noutras patologias com xerostomia subjetiva(13, 15, 19, 25, 31). O conhecimento da evolução das alterações
17 patológicas que ocorrem nas glândulas salivares em doentes com SS revela-se fundamental para a correta interpretação das imagens ecográficas obtidas, apesar de que uma correlação direta entre estas alterações e o que se observa ainda não ter sido demonstrada claramente(7). No estadio inicial da SSP as glândulas salivares podem apresentar aspeto normal. À medida que a doença progride, estas aumentam de tamanho e ficam mais heterogéneas, devido à inflamação, alargamento dos gânglios linfáticos e hiperplasia mioepitelial(13, 15, 32, 33). Na doença de longa duração, as glândulas salivares tornam-se mais pequenas, hipoecogénicas e pobremente definidas (devido à atrofia e fibrose das glândulas nos estadios finais traduzida por mais heterogeneidade)(13, 15, 19, 25).
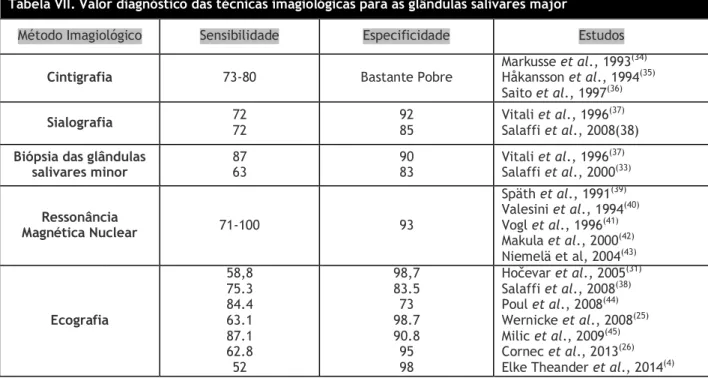
A capacidade da ecografia detetar anormalidades nas glândulas salivares foi avaliada em vários estudos. A acurácia diagnóstica da EGSM varia nos diferentes estudos, devido ao uso diferentes critérios de classificação, ao número limitado de pacientes e ao uso diferentes equipamentos ecográficos. Além disso, há ainda outra variável a não esquecer para estas acurácias díspares: a subjetividade na avaliação das alterações ecográficas. Verificou-se que a sensibilidade é baixa quando comparada com outras técnicas imagiológicas, apesar de a especificidade ser muito boa(15, 31).
Tabela VII. Valor diagnóstico das técnicas imagiológicas para as glândulas salivares major
Método Imagiológico Sensibilidade Especificidade Estudos
Cintigrafia 73-80 Bastante Pobre Markusse et al., 1993
(34)
Håkansson et al., 1994(35)
Saito et al., 1997(36)
Sialografia 72 72 92 85 Vitali et al., 1996Salaffi et al., 2008(38) (37) Biópsia das glândulas
salivares minor 87 63 90 83 Vitali et al., 1996
(37) Salaffi et al., 2000(33) Ressonância Magnética Nuclear 71-100 93 Späth et al., 1991(39) Valesini et al., 1994(40) Vogl et al., 1996(41) Makula et al., 2000(42) Niemelä et al, 2004(43) Ecografia 58,8 75.3 84.4 63.1 87.1 62.8 52 98,7 83.5 73 98.7 90.8 95 98 Hočevar et al., 2005(31) Salaffi et al., 2008(38) Poul et al., 2008(44) Wernicke et al., 2008(25) Milic et al., 2009(45) Cornec et al., 2013(26)
Elke Theander et al., 2014(4)
Hočevar et al. (31) realizaram um estudo cujo objetivo era pesquisar achados ecográficos típicos de SSP nas glândulas parótidas e submandibulares. Elaboraram um sistema de pontuação semiquantitativo e determinaram o seu valor diagnóstico para SSP. Foram realizadas EGSM em 218 pacientes consecutivos com suspeita de SS e o diagnóstico de SS foi estabelecido segundo os critérios AECG. Cinco parâmetros foram avaliados: ecogenicidade, homogeneidade (homogénea, perda ligeira e heterogénea), número de áreas hipoecogénicas, bandas hiperecogénicas e definição dos bordos das glândulas salivares. Os graus dos cinco parâmetros foram somados para as quatro glândulas salivares, sendo que uma pontuação igual ou superior a 17 possuía uma sensibilidade diagnóstica de aproximadamente 58.8% e
18 especificidade 98.7%. Concluíram então que a EGSM não era apropriada como teste de rastreio, visto que os resultados negativos não excluíam SS. Apesar disso, as alterações ecográficas visualizadas, nas quais se baseou o sistema de pontuação, eram tipicamente encontradas dos doentes com SS e a sua presença representava invariavelmente o envolvimento das glândulas salivares major pela doença.
Num estudo mais recente, Hočevar et al.(30) estudaram a reprodutibilidade do sistema de pontuação semiquantitativo baseado nos parâmetros acima citados. A concordância interobservador foi elevada em relação à homogeneidade (0,90), à ecogenicidade (0,88), à presença de áreas hipoecogénicas (0,88) e à pontuação final calculada (0,90). No entanto, a confiabilidade interobservador na quantificação da definição dos bordos das glândulas salivares e na presença de zonas hiperecogénicas intraglandulares não foi satisfatória. Apesar disso, a utilização da EGSM e o cálculo com base no sistema de pontuação criado demonstraram uma boa reprodutibilidade.
Tabela VIII. Sistema de pontuação elaborado por Hočevar et al.
Ecogenicidade do parênquima
(avaliada em comparação com a da glândula tiroide ou, no caso de patologia tiroidea concomitante, com as estruturas anatómicas à volta, músculo e gordura subcutânea)
Grau 0: igual à da tiroide
Grau 1: diminuída em relação à tiroide
Homogeneidade
Grau 0: Homogénea
Grau 1: Perda ligeira da homogeneidade Grau 2: Evidência de heterogeneidade Grau 3: Heterogeneidade marcada Presença de áreas hipoecogénicas
Grau 0: Ausência
Grau 1: Poucas e dispersas Grau 2: Várias
Grau 3: Numerosas Bandas hiperecogénicas
Grau 0: Ausência
Grau 1: Poucas e dispersas Grau 2: Várias
Grau 3: Numerosas Delineação das glândulas salivares dos tecidos
circundantes
(visibilidade dos bordos das glândulas salivares)
Grau 0: Evidência de bordos regulares e bem definidos
Grau 1: Bordos parcialmente bem definidos Grau 2: Bordos mal definidos
Grau 3: Bordos não visíveis
Adaptada de: Hočevar A, Rainer S, Rozman B, Zor P, Tomsic M. Ultrasonographic changes of major
salivary glands in primary Sjӧgren's syndrome. Evaluation of a novel scoring system. Eur J Radiol.
2007;63(3):379-83(30) e Hočevar A, Ambrozic A, Rozman B, Kveder T, Tomsic M. Ultrasonographic
changes of major salivary glands in primary Sjӧgren's syndrome. Diagnostic value of a novel scoring
19 Elke Theander et al.(4) estudaram a utilidade e o valor prognóstico de um sistema de pontuação simplificado. Este sistema baseava-se apenas no estudo ecográfico da homogeneidade das glândulas parótidas e submandibulares nos doentes com SSP. Este sistema baseou-se no proposto por Hočevar et al.(30, 31)
Tabela IX. Sistema de pontuação elaborado por Elke Theander et al. Grau
0 Parênquima homogéneo Normal
1 Perda ligeira da homogeneidade Mudanças ligeiras inespecíficas 2 Várias lesões hipoecogénicas arredondadas Anormal e típico SS 3 Várias lesões hipoecogénicas arredondadas e confluentes Anormal e típico SS
Adaptada de: Theander E. et al; Primary Sjӧgren's syndrome: diagnostic and prognostic value of salivary gland ultrasonography using a simplified scoring system; Arthritis Care Res (Hoboken); 2014; 66(7):1102-7 (4)
A idade e a duração da doença não influenciaram os resultados. A especificidade e o valor preditivo positivo para as alterações observadas na ecografia nos doentes com SSP foram ambas de 98%, ao passo que a sensibilidade e o valor preditivo negativo foram 52% e 53% respetivamente. Concluíram, então, que apesar deste sistema de pontuação ser altamente específico para SSP, este não parece ser útil na identificação da doença nos seus estadios iniciais. Segundo os autores, a sua baixa sensibilidade devia-se ao fato de os achados ecográficos anormais serem ligeiramente menos prevalentes entre pacientes com doença de início recente ou naqueles examinados à altura do diagnóstico. Afirmam que para que seja possível utilizar a EGSM para a deteção precoce de SSP ainda são necessários mais ensaios clínicos.
Estes autores também concluíram que pacientes com alterações patológicas na EGSM possuíam significativamente mais sinais e sintomas de doença sistémica, maior atividade da doença e desenvolvimento mais frequente de preditores adversos de linfoma, como aumento das glândulas salivares, vasculite cutânea, centros germinativos nos achados da biópsia das glândulas salivares minor e linfopenia de células TCD4+. Assim chegaram à conclusão que este sistema de pontuação pode ser utilizado na identificação de pacientes com doença grave e em risco de desenvolver linfoma.
É ainda colocada a hipótese da integração de um sistema semiquantitativo com base na homogeneidade glandular como item adicional num possível novo conjunto de critérios de classificação, devido à sua alta especificidade e valor preditivo positivo para SSP. Este sistema de pontuação semiquantitativo é fácil de aprender e rápido de executar. Pode ser usado em consultas de ambulatório, podendo ser apropriado para análises longitudinais.
No passado, não existiam dados sobre a utilidade do tamanho/volume das glândulas salivares major como parâmetro ecográfico a ser inferido para o diagnóstico de SSP(15). Num estudo de Wernicke et al.(25), os autores analisaram o tamanho e a ecogenicidade do parênquima das glândulas salivares major por ecografia na avaliação de doentes com SSP e SSS. A ecogenicidade foi avaliada comparativamente à da tiroide e dos tecidos moles circundantes.
20 Tabela X. Sistema de pontuação elaborado por Wernicke et al.
Grau Achados ecográficos
0 Parênquima homogéneo normal
I Perda ligeira da homogeneidade do parênquima observada com lesões hipoecogénicas difusas <2 mm
II Parênquima heterogéneo observado com lesões hipoecogénicas difusas> 2mm Adaptada de: Wernicke D, Hess H, Gromnica-Ihle E, Krause A, Schmidt WA. Ultrasonography of salivary glands - a highly specific imaging procedure for diagnosis of Sjӧgren's syndrome. J Rheumatol. 2008;35(2):285-93(25)
O diagnóstico da SSP e da SSS era estabelecido quando pelo menos duas glândulas salivares major mostravam evidência de grau II, com uma sensibilidade de 63,1% e 63,6%, respetivamente. A especificidade da ecografia foi de 98,7%. Assim propõem a EGSM como exame de primeira linha na avaliação destes doentes e a sua possível inclusão nos critérios de classificação AECG. Neste trabalho, a média de duração da doença nos pacientes com SSP que demonstravam grau II era de 7.8 anos, enquanto que a duração da doença nos pacientes com grau 0 era de 4.2 anos. Tais dados sugerem que as alterações na homogeneidade do parênquima das glândulas aparecem vários anos após o início da doença.
Os volumes das glândulas salivares foram calculados com a seguinte fórmula:
Volume (ml) = diâmetro longitudinal (mm) x diâmetro transverso (mm) x diâmetro sagital (mm) x 0,5
A deteção de volumes diminuídos e iguais a 3.0 ml em ambas as glândulas submandibulares nos pacientes com SS estava associada a uma especificidade de 93% e a uma sensibilidade de 48%, com um valor preditivo positivo de 77% e valor preditivo negativo de 80%. O volume das glândulas parótidas não era muito diferente entre os grupos de pacientes versus controlos(15, 25).
Cornec et al.(26) determinaram a acurácia da EGSM no diagnóstico da SSP. A ecoestrutura de cada uma das 4 glândulas salivares major foi graduada de 0 a 4 de acordo com as alterações observadas nas imagens ecográficas. Se o grau mais elevado, encontrado entre as 4 glândulas, fosse superior ou igual a 2, possuía uma sensibilidade de 62.8% e uma especificidade de 95.0% para o diagnóstico de SSP.
Tabela XI. Sistema de pontuação elaborado por Cornec et al.
Grau Achados ecográficos
0 Parênquima homogéneo normal
1 Pequenas áreas hipoecogénicas sem bandas ecogénicas
2 Múltiplas áreas hipoecogénicas <2 mm com bandas ecogénicas 3 Múltiplas áreas hipoecogénias 2-6 mm com bandas hiperecogénicas 4 Mútilplas áreas hipoecogénicas> 6mm ou múltiplas calcificações com bandas ecogénicas Adaptada de: Cornec D. et al.; “Contribution of salivary gland ultrasonography to the diagnosis of Sjӧgren’s syndrome: toward new diagnostic criteria?”; Arthritis Rheum; 2013; 65(1):216-25(26)
21 Num estudo mais recente, Cornec et al. (28) avaliaram se a introdução do sistema de pontuação semiquantitativo anterior nos critérios de classificação ACR-SICCA aumentava a sua performance diagnóstica. De fato, a sua adição aumentava a sensibilidade dos critérios de classificação ACR-SICCA para diagnóstico de SS de 64.4% para 84.4% e apenas diminuía ligeiramente a especificidade, de 91.1% para 89.3%.
Já Takagi et al.(27) chegaram à conclusão que a EGSM podia substituir qualquer um dos três itens dos critérios de classificação ACR-SICCA sem a sensibilidade, a especificidade e a acurácia destes critérios variar significativamente.