Autores
Rodrigo Fontanive Franco 1
Rosangela Munhoz Montenegro 1
Alice Beatriz Mombach Pinheiro Machado 1
Fernanda de Paris 1 Denise Silva Menezes 1 Roberto Ceratti Manfro 1
1 Hospital de Clínicas de Porto Alegre.
Data de submissão: 29/5/2016. Data de aprovação: 2/12/2016.
Correspondência para:
Roberto Ceratti Manfro. Hospital de Clínicas of Porto Alegre.
Avenida Ramiro Barcelos, nº 2350, Porto Alegre, RS, Brasil. CEP: 90035-003
E-mail: rmanfro@hcpa.edu.br
Avaliação de métodos diagnósticos para infecção ativa por
citomegalovírus em receptores de transplante renal
Evaluation of diagnostic tests for cytomegalovirus active infection in
renal transplant recipients
Introdução: Citomegalovírus (CMV) é uma
importante causa de infecção viral após o transplante renal. Os métodos diagnósticos presentemente utilizados são a antigenemia pp-65 e os métodos que utilizam a amplifica-ção de ácidos nucléicos pela reaamplifica-ção em cadeia da polimerase (PCR) e visam à detecção da replicação viral. Objetivo: O objetivo deste
estudo foi avaliar e comparar a incidência de infecção ativa por CMV em pacientes trans-plantados renais pelos dois métodos e estabe-lecer a melhor correlação clínico-laboratorial.
Métodos: Trinta pacientes transplantados
re-nais seqüenciais em um único centro foram in-cluídos em um estudo de coorte prospectiva. Amostras de sangue periférico foram coleta-das a partir do 15º dia até o 6º mês
pós-trans-plante e avaliadas para replicação de CMV por Antigenemia pp-65 e PCR quantitativo (qPCR). Resultados: Foram analisadas 240
amostras e a incidência de infecção ativa foi similar pelos dois métodos. O tempo médio transcorrido desde o transplante até o primei-ro teste com resultado positivo foi quase idên-tico entretanto mais amostras tiveram resul-tado positivo por qPCR do que antigenemia, um comportamento que se manteve quase uniforme ao longo do tempo. Concordância entre os testes foi observada em 217 amostras (90,4%; kappa = 0,529; p < 0,001) e em 25 pacientes (83,3%; kappa = 0,667; p < 0,001). A avaliação dos parâmetros diagnósticos para replicação de CMV revelaram maior sensibi-lidade para qPCR (82,1%) contra antigene-mia (59,0%). PCR quantitativo também foi levemente mais preciso do que antigenemia.
Conclusão: Nossos dados demonstram que
ambos os métodos são adequados e tem pre-cisão quase equivalente para a detecção da replicação do CMV após otransplante renal. A escolha entre um ou outro deve levar em consideração a demanda, capacidade de exe-cução e custo-efetividade em cada instituição.
R
ESUMOIntroduction: Cytomegalovirus (CMV)
in-fection is a main viral inin-fection after kid-ney transplantation. The diagnostic meth-ods currently employed are pp65 antigen-emia and nucleic acid amplification by polymerase chain reaction (PCR) and aim at detecting viral replication. Objective:
The goal of this study was to evaluate and compare by both methods the incidence of CMV active infection in kidney transplant patients and to establishthe best clinical-laboratory correlation. Methods: Thirty
sequential kidney transplant recipients were enrolled in a single center prospec-tive cohort study. Peripheral blood sam-ples were drawn from day 15 until the 6th
month after transplantation and tested for CMV replication by pp65 antigenemia and quantitative PCR assays (qPCR). Results:
Two hundred forty samples were analyzed and the incidence of active infection was similar by both methods. Time elapsed to the first positive test was almost iden-tical but more samples tested positive by qPCR than by antigenemia in a behavior that was almost evenly distributed over-time. Agreement between tests was ob-served in 217 samples (90.4%; kappa = 0.529; p < 0.001) and in 25 patients the tests were concordant (83.3%; kappa = 0.667; p < 0.001). The evaluation of the diagnostic parameters for CMV replication revealed higher sensitivity for the qPCR test (82.1%) against antigenemia (59.0%). Quantitative PCR was also slightly more accurate than antigenemia. Conclusion:
Our data demonstrate that both methods are suitable and have almost equivalent ac-curacy for the detection of post-transplant cytomegalovirus replication. The choice for either test must take in consideration the demand, execution capability and cost-effectiveness at each institution.
A
BSTRACTimmuno-I
NTRODUÇÃOO citomegalovírus (CMV) pertence à família
herpesviridae, e a infecção por este patógeno tem elevada prevalência em todo o mundo. Embora a infecção seja geralmente inofensiva em hospedeiros imunocompetentes, ela pode ser uma das principais causas de morbidade e mortalidade em receptores de transplante de órgãos.1 As taxas relatadas de infecção
ativa variam entre 40-100% em diferentes casuísticas de receptores de transplante renal.2,3
Infecção e doença por CMV são mais comuns em pacientes sem exposição prévia ao vírus que receberam órgãos de doadores com infecção latente ou em receptores com exposição prévia que tenham recebido intensa terapia imunossupressora, especialmente as que empregam anticorpos depletores de linfócitos T, como a imunoglobulina antitimócito.2-5
A fim de obter melhores resultados nas populações de transplantes de órgãos, o tratamento eficaz da infecção ativa ou doença e o uso de estratégias preventivas requerem um diagnóstico preciso e precoce. Portanto, métodos diagnósticos rápidos e precisos são necessários e devem ser utilizados.6-8
Os testes atualmente disponíveis na prática clínica para monitorizar a infecção ativa por CMV são a antigenemia pp65, que detecta a presença da fosfoproteína pp65 nos leucócitos do sangue periférico, e a detecção de DNA viral por métodos de amplificação de ácidos nucleicos, tais como a reação em cadeia da polimerase (PCR), que podem ser qualitativos ou quantitativos.9-17 Métodos
sorológicos para detectar imunoglobulinas das classes IgM e IgG e culturas virais não são adequados para uso na prática clínica por conta de sua baixa precisão e demora excessiva para a obtenção de resultados.11-13
Estudos anteriores demonstraram a existência de uma boa correlação entre os ensaios quantitativos de PCR (qPCR) e a antigenemia pp65 para detecção de replicação viral.6,10,18-25 Atualmente, as recomendações
ditam que tanto a antigenemia como o qPCR podem ser utilizados para monitorizar a replicação viral e a resposta à terapia antiviral. A escolha de um ou outro método depende basicamente da disponibilidade de pessoal e recursos econômicos nas instituições de saúde em questão.11,18,20,26,27
O objetivo do presente artigo foi avaliar a precisão desses testes através de um estudo longitudinal que incluiu pacientes receptores de transplantes renais de nossa instituição.
M
ATERIAISE MÉTODOSPACIENTES
Duzentas e quarenta amostras de sangue periférico foram colhidas prospectivamente entre abril de 2012 e fevereiro de 2013, de trinta de cada cem pacientes submetidos a transplante renal em nossa instituição no decurso desse período. Foram considerados a aceitação dos pacientes em participar e respeitar a programação do estudo, bem como o orçamento alocado ao mesmo. Os pacientes que concordaram em participar foram incluídos independentemente de sua condição em relação à dosagem de IgG para CMV ou da terapia de indução. As amostras foram colhidas sequencialmente 15, 30, 45, 60, 75, 90, 120, 150 e 180 dias após o transplante. A replicação viral foi avaliada por meio do exame para detecção da antigenemia pp65 e por amplificação do DNA viral por qPCR.
O regime imunossupressor ministrado a todos os pacientes consistiu da combinação de tacrolimus, micofenolato sódico e prednisona. Os pacientes que receberam rins de doadores falecidos foram submetidos a terapia de indução com Basiliximab ou anticorpos policlonais depletores de linfócitos T. Além das amostras do protocolo, foram colhidas amostras adicionais de antigenemia conforme as necessidades relativas ao manejo clínico.
Sempre que possível, antes dos transplantes foram realizados testes serológicos de IgM e IgG específicos para CMV nos doadores e receptores. As doses intravenosas e orais de ganciclovir foram ajustadas segundo a TFG estimada pela equação do MDRD.
M
ÉTODOSANTIGENEMIAPP65
Depois de extraídos do sangue periférico, os leucócitos foram incubados com anticorpos monoclonais C10/ C11 e outros reagentes do CMV Brite Turbo de acordo com as recomendações do fabricante (IQ®
Products, Groningen, Holanda). Os leucócitos com antigenemia positiva exibiram padrão nuclear homogêneo amarelo-esverdeado quando observados por microscopia de fluorescência. O resultado da antigenemia pp65 foi considerado diagnóstico para replicação viral quando houve uma ou mais células positivas por 200.000 analisadas.21
REAÇÃOEMCADEIADAPOLIMERASEQUANTITATIVA
A quantificação de ácidos nucleicos foi realizada utilizando o CMVQ - PCR Alert Kit (Nanogen Advanced Diagnostics, Turim, Itália) em amostras de DNA extraídas de plasma coletado em tubos contendo EDTA, de acordo com as instruções do fabricante. Cinco microlitros de DNA foram transferidos para uma microplaca de amplificação contendo uma mistura de reagentes que incluía iniciadores e sondas específicas para CMV, além de um controle interno e Taq polimerase.
O procedimento consiste em uma reação de amplificação em tempo real em uma microplaca com variação e controle de temperatura programável e um sistema de detecção de fluorescência óptica utilizado simultaneamente à reação em um termociclador. O sistema foi padronizado em torno de equipamentos Applied Biosystems ABI PRISM 7000. O resultado do PCR foi considerado diagnóstico para replicação quando a carga viral foi de pelo menos 1250 cópias/ mL.21
A
NÁLISE ESTATÍSTICAA ocorrência de infecção ativa foi verificada pelos métodos de antigenemia e qPCR. A concordância entre os testes foi avaliada por meio do coeficiente Kappa. O teste t de Student para amostras independentes foi utilizado na avaliação das diferenças entre pacientes infectados e não infectados, pelos dois métodos, para as seguintes variáveis: idade do doador; idade do receptor; e creatinina e taxa de filtração glomerular estimada pela equação do MDRD28 no início do
estudo e no sexto e décimo-segundo meses após o
transplante. O nível de significância foi estabelecido em 5% (p < 0,05). As análises foram realizadas por meio do software estatístico SPSS, versão 20.
Para estabelecer os parâmetros diagnósticos dos dois ensaios, a replicação viral foi considerada presente quando o resultado de qualquer teste fosse positivo e ausente quando os resultados de ambos os ensaios fossem negativos. O estudo foi aprovado em seus aspectos técnicos e metodológicos pelo Comitê de Ética em Pesquisa do Hospital de Clínicas de Porto Alegre de acordo com os preceitos da Declaração de Helsinque. Os pacientes incluídos no estudo concordaram em participar e assinaram termos de consentimento livre e esclarecido.
R
ESULTADOSOs dados demográficos da amostra estudada são apresentados na Tabela 1. O número médio de amostras por paciente foi de 8 ± 1. Na análise, 23 amostras (9,6%) foram positivas pela pesquisa de antigenemia e 32 (13,3%) foram positivas pelo teste qPCR. Não houve diferença no tempo médio transcorrido desde o transplante até o primeiro resultado positivo, que foi de 64 ± 23 dias para a antigenemia e 62 ± 21 dias para o qPCR (p = 1,0).
Receptores Frequência %
Idade média
(anos, média ± DP) 42 ± 12
(intervalo: 14 - 64)
Raça branca/não-branca 25/5 (83,3/16,7)
Sexo masculino/feminino 18/12 (60/40)
CMV IgG + 30 (100)
CMV IgG - 0 (0)
Diabetes pré-transplante 3 (10)
Doadores
Vivos/falecidos 3/27 (10/90)
CMV IgG + 16 (53,3)
CMV IgG - 7 (23,3)
CMV IgG desconhecido 7 (23,3)
Imunossupressão inicial*
Sem indução com
anticorpos 3 (10)
Indução com Basiliximab 16 (53,3)
Indução com ATG 11 (36,7)
CMV: citomegalovírus; indução com ATG: terapia de indução com anticorpos depletores de linfócitos.* Todos os pacientes receberam inibidores da calcineurina, micofenolato sódico e prednisona.
TABELA 1 DADOSDEMOGRÁFICOSESOBRE
Figura 1. Número de testes positivos por antigenemia pp65 e qPCR em cada momento de amostragem do estudo.
Muitas amostras deram resultado positivo ao mesmo tempo. Contudo, uma amostra foi positiva apenas no qPCR quinze dias após o transplante e em cada ponto da análise temporal. A exceção foram as amostras do trigésimo e sexagésimo dias, em que houve mais amostras positivas no qPCR do que na pesquisa de antigenemia. Além disso, não houve amostras positivas 180 dias após o transplante (Figura 1). Dentre as amostras positivas pela pesquisa de antigenemia, o número médio de células positivas foi de 5 ± 6/200.000, enquanto que nos testes positivos de qPCR a média foi de 5987 ± 10.623 cópias virais/ mL.
Devido ao pequeno número de amostras positivas, nenhum dos testes levou à identificação de um padrão de proliferação viral.
D
ETECÇÃO DE INFECÇÃOATIVA POR ANTIGENEMIASegundo a pesquisa de antigenemia, 16 pacientes (53,3%) desenvolveram infecção ativa. Em 11 indivíduos a sorologia IgG foi positiva tanto para
doadores como para receptores, e em dois casos apenas o receptor tinha anticorpos. A sorologia do doador era desconhecida em três transplantes. Não houve associação estatisticamente significativa entre sorologia pré-transplante de doadores e receptores e ocorrência de infecção ativa diagnosticada por este método (p = 0,169). Não foi observado nenhum caso de citomegalovírus.
D
ETECÇÃODE INFECÇÃO ATIVA PORQPCR
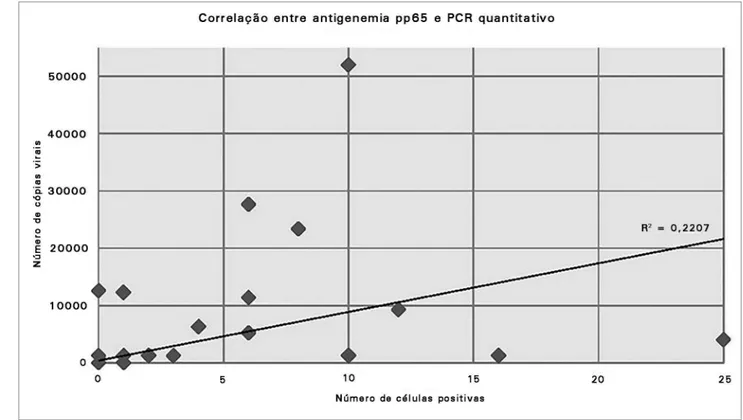
Figura 2. Coeficiente de correlação de Pearson entre ensaios de CMV por antigenemia pp65 e qPCR. Obs.: (1) Para valores de cópias de DNA no PCR inferiores a 1250 cópias/ml mas com sinal de amplificação foi atribuído o valor de 1250 cópias/ml; (2) Considerando os 480 testes, 88,5% dos resultados foram iguais a zero.
C
ONCORDÂNCIA ENTRE ENSAIOS E PARÂMETROS DIAGNÓSTICOSConcordância entre os dois testes foi observada em 217 amostras (90,4%), com ambas positivas em 16 (6,7%) e negativas em 201 (83,7%) casos. Sete amostras (2,9%) apresentaram resultado positivo para antigenemia e negativo para qPCR. Dezesseis (7,4%) testaram negativas por antigenemia e positivas por qPCR. Dessas 16 amostras, apenas duas (12,5%) pertenciam a pacientes com baixas contagens de leucócitos (< 4000/μL).
O coeficiente Kappa entre os testes de antigenemia e qPCR foi de 0,529 (p < 0,001), indicando concordância moderada entre os testes. Ao longo do período de observação, 25 pacientes apresentaram resultados concordantes para antigenemia e qPCR. Três pacientes testaram positivo por antigenemia e negativo por qPCR, enquanto dois pacientes testaram positivo por qPCR e negativo por antigenemia. O coeficiente Kappa para a observação entre pacientes foi de 0,667 (p < 0,001), indicando boa concordância. A Figura 2 exibe o gráfico de dispersão para os valores obtidos nos dois testes.
O coeficiente de correlação de Pearson foi de 0,47 (r² = 0,22, p < 0,001), demonstrando uma
correlação regular entre as variáveis. Os parâmetros diagnósticos de cada ensaio, comparados ao padrão ouro estabelecido, constam na Tabela 2.
E
FEITODATERAPIADEINDUÇÃOCOMANTICORPOS E PROFILAXIATerapia de indução foi utilizada em 27 (90%) pacientes; 16 (53,3%) receberam anticorpos anti-receptores de interleucina-2 (Basiliximab®) e 11
(36,6%) receberam anticorpos depletores de linfócitos T (Thymoglobulin®). Segundo os critérios
de antigenemia, infecção ativa ocorreu em 13 (81,3%) dos pacientes que receberam terapia de indução com Basiliximab e em apenas um (9,1%) dos indivíduos em que a indução foi feita com Thymoglobulin (p <
0,001).
De acordo com os critérios do qPCR, infecção ativa ocorreu em 11 (68,8%) dos 16 pacientes que receberam terapia de indução com Basiliximab® e em
dois (18,2%) dos 11 pacientes que fizeram indução com Thymoglobulin®. Três pacientes que receberam
Teste/Parâmetro Sensibilidade Especificidade VPP VPN Precisão
antigenemia pp65 59,0% 100% 100% 92,6% 93,3%
Quantitative PCR 82,1% 100% 100% 96,6% 97,1%
TABELA 2 PARÂMETROSDIAGNÓSTICOSDOSENSAIOSDEREPLICAÇÃODECITOMEGALOVÍRUS
PCR: reação em cadeia da polimerase; VPP: valor preditivo positivo; VPN: valor preditivo negativo.
Antigenemia pp65 PCR quantitativo
Teste
Variável Infecção Sem infecção p Infecção Sem infecção p
Idade (anos) 42,3 42,1 0,982 39,2 45,2 0,200
Sexo (M/F) 10/6 8/6 0,765 8/7 10/5 0,456
Raça (B/N) 14/2 11/3 0,642 11/4 14/1 0,330
Pré-TxDM (Y/N) 2/14 1/13 1,0 0/15 3/12 0,224
D+R+/D-R+ 11/2 5/5 0,169 9/3 7/4 0,667
Profilaxia (Y/N) 3/13 12/2 < 0,001 4/11 11/4 0,011
Indução (Y/N) 14/2 13/1 1,0 13/2 14/1 1,0
Rejeição (Y/N) 6/10 3/11 0,440 7/8 2/13 0,109
M: Masculino; F: Feminino; B: Branco; N: Negro; DM: diabetes mellitus.
TABELA 3 FATORESDERISCOPARADESENVOLVIMENTODEINFECÇÃOATIVAPORCITOMEGALOVÍRUS
Figura 3. Taxa de filtração glomerular estimada pela equação do MDRD em pacientes com ou sem infecção ativa avaliados por antigenemia pp65 (painel A) e qPCR (painel B). Diferenças não estatisticamente significativas.
mL/min e a dose profilática de ganciclovir foi de 1 g três vezes ao dia.
A profilaxia com ganciclovir foi ministrada a 15 pacientes. Pelo critério de antigenemia, três pacientes (20%) que receberam tratamento profilático desenvolveram infecção ativa, comparado
Não foram identificadas diferenças significativas entre os pacientes que desenvolveram infecção ativa e os que não o fizeram para os parâmetros idade de doadores e receptores, sexo, raça, presença de diabetes mellitus antes ou após o transplante, distribuição de sorologias anti-CMV, terapia de indução com anticorpos ou ocorrência de rejeição (Tabela 3).
A TFG estimada pela equação do MDRD não revelou diferenças estatisticamente significativas entre os grupos de pacientes com e sem infecção ativa por CMV no sexto e décimo-segundo meses ou tampouco na última avaliação, por qualquer método diagnóstico (Figura 3). A terapia profilática com ganciclovir oral evitou o desenvolvimento de infecção ativa segundo os critérios diagnósticos por antigenemia (RR: 0,22; IC 95% 0,07-0,62; p < 0,001) e qPCR (RR: 0,36; IC 95%: 0,15-0,88; p = 0,026).
D
ISCUSSÃONo presente estudo, a amostra de pacientes é representativa da população atual de receptores de transplante na região sul do Brasil. Os pacientes são predominantemente jovens caucasianos do sexo masculino submetidos a terapia de indução com anticorpos, que receberam rins de doadores falecidos. As variáveis envolvidas na replicação viral e relacionadas aos desfechos dos enxertos foram analisadas em relação aos métodos diagnósticos, e não foram estabelecidas correlações entre estas e o desenvolvimento de infecção ativa.
Avaliamos os dois métodos diagnósticos atualmente recomendados para o diagnóstico de infecção ativa por CMV, antigenemia pp65 e qPCR. A comparação entre os dois revela vantagens e desvantagens de um em relação ao outro.
O teste de PCR não exige equipe altamente treinada, pode ser realizado em pacientes com leucopenia, é automatizado, permite o processamento simultâneo de várias amostras e não requer materiais biológicos frescos. Entretanto, são necessários equipamentos e reagentes mais caros, especialmente no PCR quantitativo (qPCR), que é mais preciso. Os testes de qPCR foram padronizados em 2010 pela Organização Mundial da Saúde (OMS), por meio de um padrão de referência produzido no National Institutes of Biological Standards and Controls do Reino Unido. A titulação padrão é de 5 x 106 UI/
mL. Os testes comerciais e laboratoriais devem ser recalibrados de forma a mostrar colinearidade
em relação a esta Referência.8,29. Em função de
sua baixa especificidade, o PCR qualitativo não é atualmente utilizado para o diagnóstico de infecção por CMV.9,11,18,30
A antigenemia pp65 é um método semi-quantitativo que detecta, através de técnicas de imunoistoquímica ou imunofluorescência, a presença da fosfoproteína 65 expressa em leucócitos do sangue periférico infectado por CMV.11-13,18,31
Dentre suas vantagens destacam-se a elevada sensibilidade e especificidade, o baixo custo e a facilidade de execução, que não requer equipamentos sofisticados. Contudo, a execução do método exige pessoal treinado, a amostra de sangue total deve ser processada dentro de seis a oito horas, e a sensibilidade do teste é perdida na presença de neutropenia. Além disso, a antigenemia pode ser negativa ou apresentar contagens baixas em casos de patologia invasiva tecidual. Enfim, este método consome bastante tempo e exige trabalho intensivo da parte do pessoal do laboratório.2,3,11,13
A avaliação do objetivo principal deste estudo - analisar a correlação entre os dois métodos diagnósticos - revelou que ambos apresentam boa correlação. Este achado está de acordo com os dados da literatura para os métodos de antigenemia pp65 e qPCR para o diagnóstico de infecção ativa por CMV.12,18-20,25,32 Rhee et al.18 analisaram resultados
de antigenemia pp65 e qPCR para 899 amostras de 111 pacientes de transplante renal no período pós-transplante recente, em grupo que apresentava perfil demográfico semelhante ao da população do nosso estudo. Os autores apontaram concordância entre 84% das amostras e indicaram correlação estatisticamente significativa entre os métodos diagnósticos.
Cariani et al.19 compararam 475 amostras
consecutivas obtidas de 156 pacientes de transplante (rim e medula óssea), indivíduos com infecção por HIV e pacientes com neoplasias malignas hematológicas, e observaram uma correlação significativa entre os testes com concordância em 77% das amostras. Gouarin et al.22 analisaram 248 peças
Piiparinen et al.24 encontraram uma correlação
quase linear entre os resultados dos dois testes em 253 amostras consecutivas de sangue de pacientes submetidos a transplantes de rim ou fígado. Mengelle
et al.25 relataram uma boa correlação entre qPCR com
o DNA extraído de leucócitos e antigenemia pp65 a partir de 198 amostras de sangue de 14 pacientes submetidos a transplantes de rim, fígado ou coração, considerando o qPCR uma boa alternativa ao ensaio de antigenemia pp65.
Em nosso estudo, possivelmente por conta dos critérios do padrão-ouro para o diagnóstico de replicação viral, o qPCR apresentou maior sensibilidade para a identificação da replicação viral; porém, todos os demais parâmetros diagnósticos foram semelhantes. Em corroboração a esta ideia, devemos ressaltar que o qPCR revelou mais amostras positivas do que a antigenemia na maior parte da amostragem programada para o estudo.
O presente estudo apresenta algumas limitações. Em primeiro lugar, o tamanho da amostra é limitado e um percentual considerável dos doadores não tinha sorologia IgG disponível para avaliação, o que prejudicou a análise deste fator de risco. Além disso, o tempo de seguimento poderia ter sido mais longo e não houve casos de patologia invasiva tecidual. Apesar destas limitações, os resultados mostraram que o tamanho da amostra foi adequado para a avaliação dos métodos diagnósticos testados.
Concluímos que antigenemia pp65 e qPCR são métodos comparáveis para a detecção de replicação viral. A escolha de um método em detrimento do outro deve levar em conta os fatores locais, a presença de conhecimento especializado, os custos e o número necessário de exames a serem realizados em um programa de transplante específico, além da estratégia adotada pelo programa de transplante para monitorizar infecção ativa e doença por CMV. No entanto, o qPCR é um teste provavelmente mais sensível e ligeiramente mais preciso para a detecção de replicação viral, podendo substituir a antigenemia pp65 à medida em que se avoluma a necessidade de executar testes em programas de transplante.
R
EFERÊNCIAS1. Landolfo S, Gariglio M, Gribaudo G, Lembo D. The hu-man cytomegalovirus. Pharmacol Ther 2003;98:269-97. PMID: 12782241 DOI: http://dx.doi.org/10.1016/S0163-7258(03)00034-2
2. Aguado JM, Navarro D, San Juan R, Castón JJ. Cytomegalovi-rus infection in solid organ transplantation. Enferm Infecc Mi-crobiol Clin 2012;30:57-62. DOI: http://dx.doi.org/10.1016/ S0213-005X(12)70083-6
3. Brennan DC. Cytomegalovirus in renal transplantation. J Am Soc Nephrol 2001;12:848-55.
4. Browne BJ, Young JA, Dunn TB, Matas AJ. The impact of cytomegalovirus infection ≥ 1 year after primary renal trans-plantation. Clin Transplant 2010;24:572-7. DOI: http://dx.doi. org/10.1111/j.1399-0012.2010.01208.x
5. Kotton CN, Fishman JA. Viral infection in the renal transplant recipient. J Am Soc Nephrol 2005;16:1758-74. DOI: http:// dx.doi.org/10.1681/ASN.2004121113
6. Camargo LF, Uip DE, Simpson AA, Caballero O, Stolf NA, Vilas-Boas LS, et al. Comparison between antigenemia and a quantitative-competitive polymerase chain reaction for the diagnosis of cytomegalovirus infection after heart transplan-tation. Transplantation 2001;71:412-7. DOI: http://dx.doi. org/10.1097/00007890-200102150-00013
7. Hoffmann TW, Halimi JM, Büchler M, Velge-Roussel F, Goudeau A, Al-Najjar A, et al. Association between a poly-morphism in the human programmed death-1 (PD-1) gene and cytomegalovirus infection after kidney transplantation. J Med Genet 2010;47:54-8. DOI: http://dx.doi.org/10.1136/ jmg.2009.068841
8. Koetz AC, Delbrück R, Furtwangler A, Hufert FT, Neumann--Haefelin D, Kirste G, et al. Cytomegalovirus pp65 antigen-gui-ded preemptive therapy with ganciclovir in solid organ trans-plant recipients: a prospective, double-blind, placebo-control-led study. Transplantation 2001;72:1325-7. PMID: 11602864 DOI: http://dx.doi.org/10.1097/00007890-200110150-00025 9. de Keyzer K, van Laecke S, Peeters P, Vanholder R. Human
cytomegalovirus and kidney transplantation: a clinician’s upda-te. Am J Kidney Dis 2011;58:118-26.
10. Caliendo AM, St George K, Kao SY, Allega J, Tan BH, LaFontaine R, et al. Comparison of quantitative cytomegalovirus (CMV) PCR in plasma and CMV antigenemia assay: clinical utility of the proto-type AMPLICOR CMV MONITOR test in transplant recipients. J Clin Microbiol 2000;38:2122-7. PMID: 10834964
11. Kotton CN, Kumar D, Caliendo AM, Asberg A, Chou S, Danzi-ger-Isakov L, et al.; Transplantation Society International CMV Consensus Group. Updated international consensus guidelines on the management of cytomegalovirus in solid-organ trans-plantation. Transplantation 2013;96:333-60. PMID: 23896556 DOI: http://dx.doi.org/10.1097/TP.0b013e31829df29d 12. Tanabe K, Todumoto T, Ishikawa N, Koyama I, Takahashi
K, Fuchinoue S, et al. Comparative study of cytomegalovirus (CMV) antigenemia assay, polymerase chain reaction, serolo-gy, and shell vial assay in the early diagnosis and monitoring of CMV infection after renal transplantation. Transplantation 1997;64:1721-5. DOI: http://dx.doi.org/10.1097/00007890-199712270-00016
13. van der Bij W, Schirm J, Torensma R, van Son WJ, Teqzess AM, The TH. Comparison between viremia and antigenemia for detection of cytomegalovirus in blood. J Clin Microbiol 1988;26:2531-5.
14. Wolf DG, Spector SA. Early diagnosis of human cytomegalovi-rus disease in transplant recipients by dna amplification in plas-ma. Transplantation 1993;56:330-4. PMID: 8395098 DOI: http://dx.doi.org/10.1097/00007890-199308000-00014 15. Gerna G, Lilleri D, Chiesa A, Zelini P, Furione M, Comolli G,
et al. Virologic and Immunologic Monitoring of Cytomegalo-virus to Guide Preemptive Therapy in Solid-Organ Transplan-tation. Am J Transplant 2011;11:2463-71. DOI: http://dx.doi. org/10.1111/j.1600-6143.2011.03636.x
17. Emery VC, Sabin CA, Cope AV, Gor D, Hassan-Walker AF, Griffiths PD. Application of viral-load kinetics to identify pa-tients who develop cytomegalovirus disease after transplanta-tion. Lancet 2000;355:2032-6. PMID: 10885354 DOI: http:// dx.doi.org/10.1016/S0140-6736(00)02350-3
18. Rhee JY, Peck KR, Lee NY, Song JH. Clinical usefulness of plasma quantitative polymerase chain reaction assay: diag-nosis of cytomegalovirus infection in kidney transplant reci-pients. Transplant Proc 2011;43:2624-9. DOI: http://dx.doi. org/10.1016/j.transproceed.2011.05.054
19. Cariani E, Pollara CP, Valloncini B, Perandin F, Bonfanti C, Man-ca N. Relationship between pp65 antigenemia levels and real-time quantitative DNA PCR for Human Cytomegalovirus (HCMV) management in immunocompromised patients. BMC Infect Dis 2007;7:138. DOI: http://dx.doi.org/10.1186/1471-2334-7-138 20. Meyer-Koenig U, Weidmann M, Kirste G, Hufert FT.
Cytomega-lovirus infection in organ-transplant recipients: diagnostic value of pp65 antigen test, qualitative polymerase chain reaction (PCR) and quantitative Taqman PCR. Transplantation 2004;77:1692-8. DOI: http://dx.doi.org/10.1097/01.tp.0000133992.89191.52 21. Boeckh M, Boivin G. Quantitation of cytomegalovirus:
metho-dologic aspects and clinical applications. Clin Microbiol Rev 1998;11:533-54.
22. Gouarin S, Vabret A, Gault E, Petitjean J, Regeasse A, Hurault de Ligny B, et al. Quantitative analysis of HCMV DNA load in whole blood of renal transplant patients using real-time PCR assay. J Clin Virol 2004;29:194-201. DOI: http://dx.doi. org/10.1016/S1386-6532(03)00124-0
23. Tong CY, Cuevas L, Williams H, Bakran A. Use of laboratory assays to predict cytomegalovirus disease in renal transplant recipients. J Clin Microbiol 1998;36:2681-5.
24. Piiparinen H, Höckerstedt K, Grönhagen-Riska C, Lappalainen M, Suni J, Lautenschlager I. Comparison of plasma polymerase chain reaction and pp65-antigenemia assay in the quantification of cytomegalovirus in liver and kidney transplant patients. J Clin Virol 2001;22:111-6. DOI: http://dx.doi.org/10.1016/S1386-6532(01)00173-1
25. Mengelle C, Pasquier C, Rostaing L, Sandres-Sauné K, Puel J, Berges L, et al. Quantitation of human cytomegalovirus in reci-pients of solid organ transplants by real-time quantitative PCR and pp65 antigenemia. J Med Virol 2003;69:225-231. DOI: http://dx.doi.org/10.1002/jmv.10277
26. Roberts TC, Brennan DC, Buller RS, Gaudreault-Keener M, Schnitzler MA, Sternhell KE, et al. Quantitative polymerase chain reaction to predict occurrence of symptomatic cytome-galovirus infection and assess response to ganciclovir therapy in renal transplant recipients. J Infect Dis 1998;178:626-35. PMID: 9728529 DOI: http://dx.doi.org/10.1086/515383 27. David-Neto E, Triboni AH, Paula FJ, Vilas Boas LS,
Macha-do CM, Agena F, et al. A Macha-double-blinded, prospective study to define antigenemia and quantitative real-time polymera-se chain reaction cutoffs to start preemptive therapy in low--risk, seropositive, renal transplanted recipients. Transplanta-tion 2014;98:1077-81. PMID: 24839894 DOI: http://dx.doi. org/10.1097/TP.0000000000000189
28. Pierrat A, Gravier E, Saunders C, Caira MV, Aït-Djafer Z, Le-gras B, et al. Predicting GFR in children and adults: a compari-son of the Cockcroft-Gault, Schwartz, and modification of diet in renal disease formulas. Kidney Int 2003;64:1425-36. DOI: http://dx.doi.org/10.1046/j.1523-1755.2003.00208.x
29. Hayden RT, Gu Z, Sam SS, Sun Y, Tang L, Pounds S, et al. Comparative evaluation of three commercial quantitati-ve cytomegalovirus standards by use of digital and real-time PCR. J Clin Microbiol 2015;53:1500-5. DOI: http://dx.doi. org/10.1128/JCM.03375-14
30. Kanaan A, Cour I, Alvarez-Lafuente R, Benedicto M, Culebras E, Prats D, et al. Significance of nested PCR and quantitative real time PCR for cytomegalovirus detection in renal transplant recipients. Int J Antimicrob Agents 2004;24:455-62. DOI: http://dx.doi.org/10.1016/j.ijantimi-cag.2004.06.012
31. Wirgart BZ, Claesson K, Eriksson BM, Brundin M, Tufveson G, Tötterman T, et al. Cytomegalovirus (CMV) DNA am-plification from plasma compared with CMV pp65 antigen (ppUL83) detection in leukocytes for early diagnosis of sympto-matic CMV infection in kidney transplant patients. Clin Diagn Virol 1996;7:99-110. DOI: http://dx.doi.org/10.1016/S0928-0197(96)00258-9