U minho | 20 1 3 outubro de 2013
Rita Sá Ribeiro
Aplicação de Nanomateriais na Oxidação
Avançada de Poluentes Orgânicos
Rit a Sá Ribeir o Aplicação de N anomateriais na Oxidação Av ançada de P oluentes Orgânicos
Escola de Engenharia
outubro de 2013
Dissertação de Mestrado
Mestrado Integrado em Engenharia Civil
Trabalho efetuado sob a orientação do
Escola de Engenharia
Professor Doutor António Armando de Lima
Sampaio Duar te
e da
Professora Doutora Maria Teresa Sousa
Pessoa Amorim
Rita Sá Ribeiro
Aplicação de Nanomateriais na Oxidação
Avançada de Poluentes Orgânicos
Rita Sá Ribeiro iii O desenvolvimento desta dissertação teve marcos humanos essenciais. Não são exatamente agradecimentos. Não poderia nem saberia. São referências profundamente sentidas. A todos deixo aqui o meu sincero e humilde agradecimento.
Aos meus orientadores científicos, Professor Doutor António Aramando de Lima Sampaio Duarte e Professora Doutora Maria Teresa Pessoa Amorim que sempre me souberam ouvir e apoiar em todos os passos da realização deste trabalho. A eles o meu sincero obrigado pela partilha de conhecimentos, tempo e dedicação demonstrados.
Ao Professor Doutor Carlos José Tavares do Departamento de Física da Universidade do Minho pela sua colaboração e apoio na disposição das nanopartículas de TiO2em suporte fixo.
À Universidade do Minho e aos Departamentos de Engenharia Civil e Engenharia Têxtil pelo material disponibilizado e colaboração dos respetivos técnicos de laboratório, Rui Oliveira e Anabela Pereira. Um especial agradecimento ao Sr. Rui que sempre me soube motivar com a sua alegria e simpatia tão características.
À Teresa Linhares, Mónica Pereira, Francisco Oliveira e Daniela Fernandes pela companhia e alegria ao longo de todo o trabalho laboratorial. Um carinho especial à Daniela Fernandes por todo o apoio na introdução ao “mundo experimental”.
À Marta Pereira pelo incansável apoio, por todo o carinho e paciência ao longo destes cinco anos. É com um carinho muito especial que guardo comigo esta verdadeira amizade que nos une.
À Ana João pelo “remate final” e pela disponibilidade demonstrada.
À Teresa Matos pelas infindáveis conversas que, com o seu jeito perfeitamente imperfeito, me soube ensinar a arte do saber ouvir e que em muito me ajudou na realização deste projeto. À Ana Carolina Costa pelos almoços, pela constante presença mesmo que em sonhos, pela amizade e por todo o apoio em todos os meus momentos.
À Maria Inês Machado um carinho especial pela maravilhosa surpresa que foi. Por me ter ensinado a crescer, a lutar e sobretudo a ter sempre vontade de sorrir. Pelas manhãs mal dormidas, por todas as “birras” que soube segurar e por nunca me ter deixado cair, fica aqui o
iv Mestrado Integrado em Engenharia Civil meu sincero e sentido agradecimento. É o seu sorriso que levo e por ele vou sempre lutar. Obrigada.
Aos meus pais, Olindina e José, e irmã, Margarida, pela companhia que não lhes fiz fora das “horas de expediente”. Apesar disso, souberam sempre estar presentes e nunca falhou um sorriso, compreensão, carinho e o amor de uma verdadeira família.
Rita Sá Ribeiro vii A constante preocupação com a preservação da saúde humana impulsiona o necessário desenvolvimento de novos e mais sustentáveis processos de tratamento para remoção de micropoluentes das águas, dado que alguns deles, como é o caso da matéria orgânica natural (MON), podem ser percussores de substâncias potencialmente cancerígenas e apresentar comportamento refratário às tecnologias convencionais instaladas na grande maioria das estações de tratamento de água (ETA).
Estudos científicos recentes têm vindo a evidenciar a potencialidade da fotocatálise heterogénea (FH) e do efeito catalítico do dióxido de titânio (TiO2), na remoção eficaz de
MON e outros micropoluentes orgânicos, assumindo-se como alternativa viável a outras formas de oxidação mais dispendiosas.
O presente trabalho de investigação tem como objetivo principal o desenvolvimento e avaliação da eficiência da aplicação de técnicas de oxidação avançada na remoção de constituintes orgânicos (MON), baseada na utilização de nanopartículas de TiO2 suspensas na
água. Neste documento são apresentadas as metodologias utilizadas na investigação efetuada, nomeadamente a definição da relação entre a concentração de ácido húmico (AH) e a absorvância, bem como a análise dos resultados (absorvância a 254 nm, pH, CQO, cloro livre e total) obtidos em ensaios de degradação de MON sob incidência de radiação solar e UV (TNN 15/32), com e sem o contributo catalítico das nanopartículas de TiO2. A eficiência e
cinética de degradação foram estudadas considerando diferentes concentrações iniciais de MON, resultantes das diferentes matrizes aquosas utilizadas: água sintética, obtida por diluição de ácido húmico; água superficial natural, recolhida em dois pontos (com diferentes graus de poluição) da ribeira de Couros, em Guimarães; e água da rede pública de abastecimento à qual se adicionou uma solução com igual concentração inicial de AH. A melhor eficiência de degradação de MON foi de 99% tendo sido obtida sob incidência de radiação UV, numa água sintética com uma concentração inicial de AH igual a 8 mg/L e uma concentração de TiO2 de 5 mg/L.
No sentido de avaliar se a oxidação efetuada conduz a águas tratadas ecotoxicologicamente mais seguras, este trabalho contempla ainda uma análise toxicológica dos subprodutos de oxidação da MON. Os testes de toxicidade realizados mostraram que o AH inicial e a solução
viii Mestrado Integrado em Engenharia Civil resultante do tratamento fotocatalítico com TiO2 não induzem toxicidade nas matrizes de água
estudadas.
PALAVRAS-CHAVE: tratamento de águas; remoção de MON; oxidação avançada com TiO2
Rita Sá Ribeiro ix Preservation of human health has always been a main concern for society, drives the development required of new and more sustainable treatment processes for the removal of micropolluants of water, as somo of them, such as the natural organic matter (NOM), may be precursors of potentially carcinogenic substances and present refractory behavior to conventional technologies installed in most water treatment plants (WTP).
Given the growing interest in solving this problem, this investigation has as its main goal the development and evaluation of the efficiency of the application of advanced oxidation techniques in the removal of organic constituents (NOM), which is based on the use of titanium dioxide that is suspended in water, assuming as a viable alternative to other forms of more expensive oxidation.
This paper presents the methodologies used in research conducted, in particular the definition of the relationship between absorbance and concentration of humic acid (HA), as well as the analysis of the results (absorbance at 254 nm, pH, COD, free and total chlorine) of the trials made, which are based on the degradation of NOM under the incidence of solar radiation and UV (TNN 15/32), with and without the catalytic contribution of titanium dioxide nanosized particles. The efficiency and kinetics of degradation were studied considering different initial concentrations of MON. These different concentrations were the result of different types of water matrices used such as: synthetic water obtained by dilution of humic acid (HA); natural surface water samples collected at two points (with different degrees of pollution) in the Couros stream (Guimarães); and water of supply network with a solution of the same initial concentration of HA. The highest efficiency degradation of NOM recorded was 99%. This value was obtained under UV radiation , in a synthetic water with an initial concentration of HA equal to 8 mg / L and a TiO2 concentration of 5 mg/L.
In order to assess if performed oxidation leads to safest ecotoxicological treates waters, this work also addresses a toxicological analysis of the byproducts of oxidation da MON. Toxicity tests have shown that initial HA and the resulting solution of the photocatalytic treatment with TiO2 do not induce toxicity in the water matrices studied.
KEYWORDS: water treatment; NOM removal; advanced oxidation with suspended TiO2;
Rita Sá Ribeiro xi
1. INTRODUÇÃO ... 1
1.1. Enquadramento e relevância do tema ... 1
1.2. Objetivos ... 2
1.3. Organização da dissertação ... 3
2. REVISÃO DO ESTADO DA ARTE ... 5
2.1. Enquadramento do tema ... 5
2.2. Nanotecnologia: um desafio do século XXI ... 9
2.3. Fotólise ... 11
2.4. Fotocatálise ... 14
2.4.1. Características relevantes do dióxido de titânio ... 19
2.4.2. Eficiência da fotocatálise ... 24
2.4.3. Fatores que influenciam a fotocatálise ... 25
2.4.3.1 Dosagem de catalisador (TiO2) ... 26
2.4.3.2. Parâmetros físico-químicos... 26
2.4.3.3. Comprimento de onda e intensidade da luz ... 29
2.4.3.4. Características da superfície de imobilização ... 30
2.5. Efeitos na saúde da exposição às nanopartículas de TiO2 ... 31
3. METODOLOGIA DE INVESTIGAÇÃO ... 33
3.1. Materiais e equipamentos laboratoriais ... 33
3.1.1 Materiais ... 33
3.1.2 Equipamento laboratorial ... 37
3.2. Concentração inicial de MON ... 43
3.3. Ensaios de degradação de MON ... 47
3.4. Avaliação da toxicidade dos subprodutos da oxidação ... 53
3.5. Avaliação da carência química de oxigénio (CQO) ... 54
xii Mestrado Integrado em Engenharia Civil
4.1. Concentração inicial de MON ... 57
4.2. Estudo da degradação da MON por fotocatálise sob a incidência da luz solar ... 60
4.2.1. Degradação da MON ... 60
4.2.2. Quantidade de energia solar acumulada ... 64
4.3. Estudo da degradação da MON por fotocatálise no reator UV ... 64
4.4. Comparação da cinética de degradação para os ensaios com maior eficiência de remoção ... 71
4.5. Análise dos resultados obtidos para os diferentes processos de degradação de MON por fotocatálise com TiO2 suspenso ... 73
4.6. Avaliação do cloro livre e total ... 75
4.7. Avaliação da carência química de oxigénio (CQO) ... 77
4.8. Toxicidade dos subprodutos de oxidação ... 78
5. CONCLUSÕES E DESENVOLVIMENTOS FUTUROS ... 81
5.1. Conclusões ... 81
5.2. Desenvolvimentos futuros ... 83
xiv Mestrado Integrado em Engenharia Civil
ÍNDICE DE FIGURAS
Figura 1. Esquema das técnicas de produção de estruturas à escala nanométrica, bottom-up e
top-down ... 10
Figura 2. Espectro eletromagnético. ... 12
Figura 3. Espectro ultravioleta e seus comprimentos de onda ... 13
Figura 4. Processo de fotocatálise ... 15
Figura 5. Esquema de degradação de matéria orgânica ... 17
Figura 6. Estruturas cristalinas do TiO2:rutilo e anatase ... 21
Figura 7. Representação esquemática de uma superfície com caráter hidrofóbico e hidrofílico (imagem da esquerda e da direita respetivamente) ... 25
Figura 8. Ponto de recolha de água natural na Ribeira de Couros em Guimarães – P1 ... 34
Figura 9. Ponto de recolha de água natural na Ribeira de Couros em Guimarães – P2 ... 34
Figura 10. Reator UV da Heraeus ... 37
Figura 11. Caixa opaca que contém o reator UV ... 38
Figura 12. Agitador magnético contido no reator UV ... 39
Figura 13. Espectrofotómetro UV-visível, modelo Unicam serie UV2 ... 40
Figura 14. Medidor de pH micropH 2000 da Crison ... 40
Figura 15. Fotómetro HI 83200 da Hanna ... 41
Figura 16. Radiómetro OHM – HD 9021 ... 42
Figura 17. Balança analítica da Radwag ... 42
Figura 18. Digestor para reagentes de CQO da Büchi 471 ... 43
Figura 19. Diluições de AH, desde C1 (solução-mãe) até à C6 (da esquerda para a direita) . 45 Figura 20. Representação esquemática dos ensaios realizados para a elaboração da curva de calibração “absorvância vs. concentração de MON” ... 46
Figura 21. Sistema fotocatalítico usado nos ensaios à luz solar ... 47
Figura 22. Representação esquemática das características dos ensaios de degradação de MON no reator UV ... 49
Figura 23. Representação esquemática das características dos ensaios de degradação de MON sob a incidência da luz solar ... 49
Figura 24. Filtro usado na filtração das amostras retiradas dos ensaios de degradação de MON ... 51
Figura 25. Procedimento de preparação do bioensaio para avaliação da toxicidade ... 53
Rita Sá Ribeiro xv
Figura 28. Curva de calibração média final em função do tempo (CCfinal) ... 60
Figura 29. Controlo da absorvância em função do tempo – água sintética ... 61
Figura 30. Controlo da absorvância em função do tempo – água natural ... 61
Figura 31. Valores observados nos ensaios sob a incidência da luz solar ... 62
Figura 32. Degradação de AH no reator UV – água sintética ... 65
Figura 33. Degradação de AH no reator UV – água natural (P1) ... 66
Figura 34. Degradação de AH no reator UV – água natural (P2) ... 66
Figura 35. Degradação de AH no reator UV – água da rede de abastecimento ... 67
Figura 36. Valores observados nos ensaios com água sintética no reator UV ... 68
Figura 37. Valores observados nos ensaios com água natural no reator UV - P1 ... 69
Figura 38. Valores observados nos ensaios com água natural no reator UV - P2 ... 69
Figura 39. Valores observados nos ensaios com água da rede de abastecimento no reator UV ... 70
Figura 40. Cinética de decaimento de AH (linhas a tracejado – curvas teóricas de decaimento; símbolos – resultados experimentais) ... 73
Figura 41. Evolução do cloro livre e total ao longo do tempo de ensaio ... 76
xvi Mestrado Integrado em Engenharia Civil
ÍNDICE DE TABELAS
Tabela 1. Classes de radiação UV segundo a norma ISO-DIS-21438 ... 14
Tabela 2. Energia característica de diferentes semicondutores numa solução aquosa (pH=1) ... 15
Tabela 3. Vantagens da aplicação do processo de fotocatálise heterogénea e da utilização do TiO2. ... 18
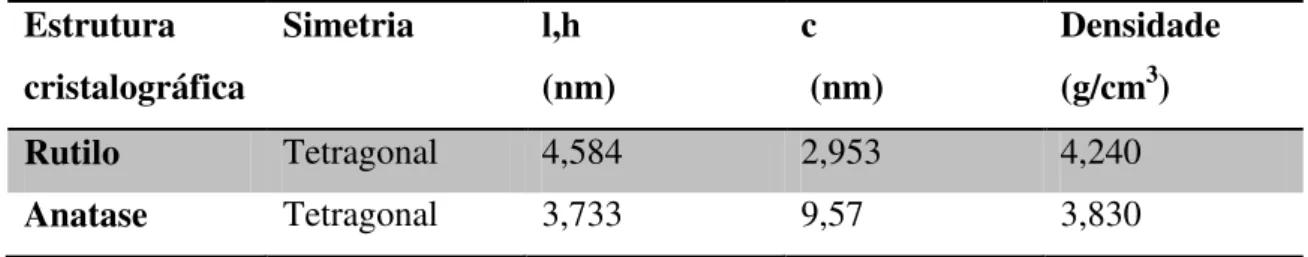
Tabela 4. Dados da estrutura cristalográfica do rutilo e da anatase ... 20
Tabela 5. Variação de cor nas amostras de titânio e seus processos. ... 22
Tabela 6. Algumas propriedades do TiO2 na fase anatase e rutilo ... 22
Tabela 7. Composição elementar média do AH da Aldrich e do AH em meio aquático ... 33
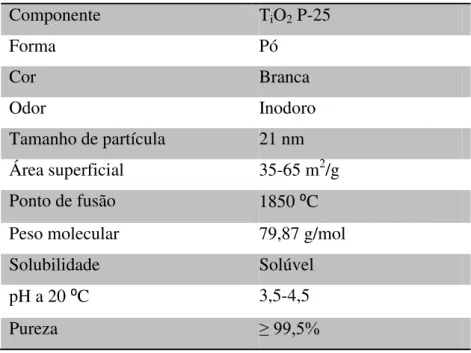
Tabela 8. Características físicas e químicas do TiO2 P-25 Degussa ... 35
Tabela 9. Características físicas e químicas dos reagentes de cloro livre e total da Hanna .... 36
Tabela 10. Características físicas e químicas dos reagentes para teste de CQO de gama baixa ... 36
Tabela 11. Dados técnicos do reator UV da Heraeus ... 39
Tabela 12. Concentrações de AH utilizadas na curva de calibração ... 44
Tabela 13. Designação dos cenários (condições dos ensaios) de degradação de MON ... 50
Tabela 14. Parâmetros medidos e respetivos tempos de recolha de amostras ... 51
Tabela 15. Diluições da solução de ácido de fetalato em 200 mL de água e correspondentes valores de CQO ... 55
Tabela 16. Variação da absorvância para as concentrações C1 a C6, a pH neutro (CC1) ... 57
Tabela 17. Valores da absorvância médios das concentrações C1 a C6 a pH neutro num período de quatro horas (240 min.) ... 58
Tabela 18. Eficiência e cinéticas de degradação nos ensaios sob incidência da luz solar ... 63
Tabela 19. Quantidade de energia solar (450-950 nm) acumulada por litro de água ... 64
Tabela 20. Eficiência e cinéticas de degradação no reator UV com água sintética ... 68
Tabela 21. Eficiência e cinéticas de degradação no reator UV com água natural – P1 ... 69
Tabela 22. Eficiência e cinéticas de degradação no reator UV com água natural – P2 ... 70
Tabela 23. Eficiência e cinéticas de degradação no reator UV com água da rede de abastecimento ... 70
Tabela 24. Valores da absorvância para o intervalo de tempo efetivo de degradação (1 h) ... 72
Tabela 25. Variação das características entre os ensaios realizados sob a incidência de luz solar e sob a radiação UV ... 74
Rita Sá Ribeiro xvii ao longo dos ensaios de fotocatálise com TiO2 no reator UV ... 75 Tabela 27. Valores de absorvância medidos para a curva de calibração de CQO ... 77 Tabela 28. Valores de CQO das águas naturais – P1 e P2 ... 78
Tabela 29. Percentagem de inibição antes e após o tratamento de fotocatálise com TiO2 e radiação UV para águas sintética e natural ... 79
Rita Sá Ribeiro xix
AH – ácido húmico FH – fotocatálise heterogénea
AN – água natural Kaap – constante da cinética de decaimento
AA – água da rede pública de abastecimento LS – luz solar
AS – água sintética MON – matéria orgânica natural
C0 – concentração inicial OD – oxigénio dissolvido
Cx – concentração da diluição x pH – concentração hidrogeniónica
CCx – curva de calibração média do ensaio x POA – processos de oxidação avançada
CCfinal – curva de calibração média final r0 – taxa inicial de foto-oxidação
CL – cloro livre SR – sem radiação
CQO – carência química de oxigénio THM – trihalometanos
CT – cloro total TiO2– dióxido de titânio
Ex – ensaio x t – tempo
ECx– ensaio de medição de cloro x U. a. – unidades de absorvância
eV – eletrão volt UV – ultra-violeta
ETA – estação de tratamento de água UV254– absorvância UV no comprimento de onda de 254 nm
ETAR – estação de tratamento de água residual λ – comprimento de onda
GLOSSÁRIO
Adsorção – adesão de moléculas de um fluído a uma superfície sólida (adsorvente) Água sintética – água destilada
Catalisador – substância que acelera a velocidade de reação
Cloração – processo de adição de cloro à água como método de desinfeção
Fotocatálise heterogénea – processo de oxidação avançada que tem por base o uso de um fotocatalisador de forma a aumentar a velocidade da reação
Hidrofobicidade – repulsão da água Hidrofilicidade – afinidade com a água
Rita Sá Ribeiro 1
1.
INTRODUÇÃO
1.1.
Enquadramento e relevância do tema
Desde sempre se disputa o alcance de novos métodos e tecnologias com o único objetivo de melhorar a saúde e consequente força do ser humano. É no âmbito da preservação da saúde pública que surge este projeto de dissertação, pois, através de processos de oxidação avançada, procura obter-se a degradação/remoção de substâncias presentes na água prejudiciais ao organismo do Homem.
As águas naturais possuem na sua composição matéria orgânica natural (MON) que é em parte constituída por compostos pouco biodegradáveis e precursores de subprodutos de oxidação química, como é o caso do ácido húmico e ácido fúlvico, de elevada toxicidade para o ser humano, pois são conhecidos percursores de trihalometanos e ácidos halogénicos, resultantes da reação com subprodutos da desinfeção por cloração. A crescente inovação tecnológica das sociedades modernas e a contínua produção de substâncias sintéticas fazem surgir novos micropoluentes refratários, cada vez mais difíceis de serem removidos por processos convencionais de tratamento de água. A MON e os outros micropoluentes emergentes podem ser eficazmente removidos em operações ou processos avançados de tratamento, substancialmente mais caros que os convencionais, de operação mais complexa e/ou passíveis de gerar subprodutos tóxicos (cancerígenos, mutanogénicos, resistentes a antibióticos e outros).
Visto que a remoção da MON e dos micropoluentes refratários são de elevada importância para o aumento da qualidade de vida do ser humano é de elevada importância e pertinência o desenvolvimento de novas e sustentáveis soluções e tecnologias de tratamento avançado de águas (naturais e residuais).
A presente dissertação procura avaliar experimentalmente as potencialidade e eficiência de um processo de oxidação avançada (POA), a fotocatálise heterogénea (FH), na remoção de MON presente na água, utilizando para tal um reator tipo batch sujeito a radiação UV (solar e por lâmpada), com e sem a presença de nanopartículas de TiO2 suspensas. Para avaliar o
contributo das nanopartículas de TiO2 na oxidação de MON foram realizados ensaios de
2 Mestrado Integrado em Engenharia Civil medidos vários parâmetros físico-químicos da água (absorvância, pH, cloro livre e total, CQO), e de parâmetros ambientais (intensidade da luz solar, temperatura). Nos ensaios laboratoriais, foram usadas diferentes matrizes aquosas: uma água sintética, concebida em laboratório, sendo a MON simulada pela adição do ácido húmico (AH), duas amostras de água superficial natural recolhidas em pontos estratégicos da ribeira de Couros e água da rede pública de abastecimento. A relação entre a concentração de AH e a absorvância medida foi obtido através de curvas de calibração estabelecidas para este propósito.
Para além da análise da eficiência de degradação é essencial e fundamental averiguar a toxicidade dos subprodutos da FH com o TiO2. A realização destes testes procurou avaliar se
os POA em análise produzem ou não substâncias tóxicas prejudiciais à água para consumo humano.
A presença crescente de compostos orgânicos percursores e/ou micropoluentes orgânicos emergentes implica que algumas das estações de tratamento existentes necessitem de ser adaptadas e ampliadas de modo a garantir uma água de qualidade e segura para o consumo humano. Na atual conjuntura económica mundial, é particularmente relevante o desenvolvimento de alternativas aos processos convencionais de oxidação destes poluentes que proporcionem metodologias de tratamento, igualmente eficientes mas, no entanto, económica e ambientalmente sustentáveis.
1.2.
Objetivos
A presente dissertação tem como objetivo geral avaliação da eficiência da aplicação de técnicas de oxidação avançada na remoção de MON, baseadas na fotocatálise heterogénea com utilização de nanopartículas de TiO2.
Para a prossecução desse propósito, foram definidos os seguintes objetivos específicos:
Identificação de possíveis impactos ambientais e na saúde pública consequentes da exposição à água tratada com TiO2;
Otimização de processos de tratamento tendo em conta parâmetros que influenciam a eficiência de remoção de constituintes orgânicos;
Rita Sá Ribeiro 3 Análise da degradação da MON à escala laboratorial resultante da exposição às
radiações solar e UV, com e sem o contributo catalisador das nanopartículas de TiO2;
Identificação e avaliação de parâmetros abióticos que influenciam o processo de oxidação de MON (concentração de catalisador, intensidade da radiação e concentração inicial de MON);
Estudo da evolução de parâmetros da qualidade da água (absorvância, pH, CQO, cloro livre e residual) no decorrer do processo de FH com TiO2;
Caracterização da cinética de degradação de MON por meio da FH com TiO2;
Comparação da eficiência da fotólise e fotocatálise na remoção de MON; Comparação de comportamentos de remoção de poluentes orgânicos usando
água sintética, da rede pública de abastecimento e amostras de água superficial natural;
Modelação das cinéticas de remoção de percursores de trihalometanos;
Avaliar o impacto da remoção de AH nas concentrações de cloro livre e total na água da rede pública de abastecimento;
Estudar o efeito da fotocatálise heterogénea com TiO2 na carência química de
oxigénio em duas amostras de água superficial natural;
Averiguar a toxicidade induzida pelo simulador de MON e pela FH com TiO2
através de ensaios aos subprodutos dos processos avançados de oxidação;
1.3.
Organização da dissertação
A dissertação encontra-se organizada em cinco capítulos. No presente capítulo insere-se uma curta exposição da relevância da problemática em estudo, a descrição da estrutura da dissertação e uma síntese dos objetivos gerais e específicos.
No segundo capítulo é realizada uma síntese de pesquisa bibliográfica que visa compreender o estado de conhecimento nesta temática. São referidos alguns conceitos base dos POA, descritos sumariamente os processos de FH bem como os fatores que os influenciam. Por fim, surge a identificação e caracterização dos seus potenciais efeitos nocivos, que já conhecemos, quer a nível ecológico, quer a nível da saúde humana, decorrentes da exposição da água às partículas de TiO2.
4 Mestrado Integrado em Engenharia Civil O capítulo três foca-se na exposição dos procedimentos e meios necessários para a execução dos trabalhos laboratoriais. Desta forma, descrevem-se as metodologias utilizadas nos ensaios realizados para a elaboração das curvas de calibração “absorvância vs. concentração de MON”, na determinação da CQO, nos ensaios de degradação de MON (fotocatálise sob incidência da luz solar e fotocatálise sob radiação UV) e nos ensaios de toxicidade aos subprodutos da oxidação. São ainda indentificados e sumariamente descritos os equipamentos laboratoriais que se utilizam na realização dos ensaios e na medição de parâmetros de qualidade da água, bem como os reagentes utilizados.
A apresentação sistematizada dos resultados experimentais e sua análise crítica surgem no capítulo quatro, estando este dividido em seis subcapítulos. O primeiro subcapítulo corresponde aos resultados obtidos para a elaboração das curvas de calibração “absorvância
vs. concentração de MON”. Os dois subcapítulos subsequentes correspondem à análise dos
resultados dos ensaios de degradação de MON por fotocatálise, sob incidência de luz solar e no reator UV, com nanopartículas de TiO2 suspenso. Os subcapítulos quatro e cinco
correspondem à avaliação das concentrações de cloro livre e residual e carência química de oxigénio, respetivamente. No último subcapítulo apresentam-se os resultados obtidos nos ensaios efetuados para análise da toxicidade induzida pelo simulador de MON (inicial) e pelos subprodutos da fotocatálise com TiO2 suspenso.
No Capítulo 5 são apresentadas as principais conclusões retiradas da análise dos resultados do estudo experimental efetuado e propostos alguns tópicos sobre estudos, julgados pertinentes, a desenvolver em trabalhos de investigação futuros que poderão constituir um contributo importante para o avanço do conhecimento nesta promissora área científica.
Rita Sá Ribeiro 5
2.
REVISÃO DO ESTADO DA ARTE
2.1.
Enquadramento do tema
A água tem sido um fator extremamente importante no desenvolvimento das sociedades humanas, pois a sua disponibilidade, além de essencial à sobrevivência dos seres vivos, está diretamente ligada à produção de alimentos e energia renovável, que são essenciais a muitas das atividades humanos promotoras da qualidade de vida das populações.
À medida que os aglomerados populacionais se desenvolviam, crescia a necessidade de água potável para o seu abastecimento e aumentavam os riscos de contaminação fecal das águas provocando assim problemas de saúde pública que, em várias ocasiões, adquiriram proporções catastróficas (Duarte, 2010), como foi o caso do surto de cólera em Londres (1855) e que permitiu a John Snow relacionar essa epidemia com o consumo de água de abastecimento contaminada com bactérias fecais. Mais tarde, em 1863, Louis Pasteur
identificou o microrganismo responsável por essa doença e, em 1883, Robert Cock
desenvolveu métodos de deteção dos mesmos (Vieira & Morais, 2005)
Nos últimos anos, várias investigações foram desenvolvidas no âmbito do tratamento de água para consumo humano, com o intuito de identificar a presença de poluentes emergentes e seus efeitos na saúde pública. Estes estudos visam obter os conhecimentos indispensáveis à implantação de práticas e protocolos de controlo da qualidade da água nas origens, de modo a promover a obtenção de água segura para consumo humano.
A qualidade da água é um fator importantíssimo para a saúde pública e, como tal, foram fixados valores paramétricos que se encontram estabelecidos no Decreto-Lei 306/2007 e definem valores limites dos parâmetros de qualidade microbiológicos e físico-químicos a observar na água destinada a consumo humano. Salvo raras exceções, o cumprimento dessas normas de qualidade implica que a água captada (bruta) seja submetida a um processo de tratamento adequado. As estações de tratamento de água (ETA) são instalações que, através de processos e operações unitárias de tratamento, melhoram a qualidade de águas destinadas aos mais diversos usos (Rosa et al., 2009).
O aumento populacional, a escassez de água associada a longos períodos de seca, a crescente poluição das massas de água (superficiais e subterrâneas) e as alterações climáticas são
6 Mestrado Integrado em Engenharia Civil parâmetros que influenciam a qualidade da água. É de salientar que mais de 25% da população mundial sofre de problemas de saúde, ou de higiene, relacionados com a água e, apesar dos esforços institucionais para a melhoria da qualidade da água e da infraestrutura sanitária, cerca de 1,1 biliões de pessoas não têm acesso a um serviço adequado de abastecimento de água e saneamento, especialmente em países da África, Ásia e América Latina (Britto & Rangel, 2008).
Com a progressiva industrialização das sociedades mais desenvolvidas surgiram novos desafios tanto na gestão da qualidade da água como na eficiência dos sistemas de tratamento de águas. De facto, as tecnologias de tratamento convencionais presentes em grande parte das ETA não permite uma remoção adequada da maioria dos micropoluentes orgânicos com presença crescente nas origens de água de abastecimento (Chong et al., 2009), devido a descargas de águas residuais com níveis de tratamento insuficiente. O aumento da presença destes compostos orgânicos refratários nas águas, tem vindo a conferir um carácter urgente na procura e desenvolvimento de novas e mais avançadas soluções de tratamento.
No que concerne ao reaproveitamento das águas residuais, este caracterizam-se pela presença de grandes concentrações de sólidos suspensos e compostos orgânicos. Em Portugal Continental, todos os sistemas de abastecimento distribuem água captada de albufeiras, rios ou aquíferos, não existindo ainda sistemas de reutilização das águas residuais ou das águas das chuvas (Vieira et al., 2007) para consumo humano.
Existem várias soluções para o problema de escassez de água, tanto a curto como a longo prazo. Estas podem passar pelo armazenamento das águas das chuvas ou a reutilização de águas residuais, tanto para consumo humano, uso industrial como para uso comercial. Em ambas as soluções estão associados problemas de qualidade de água. No que respeita ao armazenamento de água das chuvas, para além das dificuldades naturais de captação, antecipa-se um agravamento na qualidade da mesma devido a descargas de contaminantes e micropoluentes para o ciclo natural desta (Wintgens et al., 2008).
Os compostos de desregulação endócrina, compostos farmacologicamente ativos e pesticidas são alguns dos micropoluentes orgânicos emergentes com um comportamento refratário aos processos de tratamento existentes na maioria das ETA. A nanofiltração é uma das técnicas emergentes aplicáveis na remoção destes micropoluentes, embora com custos que podem comprometer a sustentabilidade de pequenos e médios sistemas de tratamento. Esta tecnologia
Rita Sá Ribeiro 7 foi estudada em comparação com a osmose inversa e apresenta resultados de remoção entre 1,9 e 99,7% para os compostos de desregulação endócrina, entre os 69 e 91% para os compostos farmacologicamente ativos e 59% e 80% para os pesticidas (Wintgens et al., 2008). Um exemplo desses micropoluentes emergentes é a atrazina, classificada como um pesticida/herbicida, sendo o seu valor paramétrico, fixado no Decreto-Lei 306/2007 de 0,1 µg/L. A ingestão deste composto orgânico pode provocar graves e irreversíveis alterações no sistema endócrino e no sistema neurológico dos seres vivos (WHO, 2011). Outra característica indesejável destes poluentes é o facto de que, no processo de cloração da água potável, a sua reação com o cloro poder originar produtos prejudiciais à saúde humana (Britto & Rangel, 2008).
Não sendo possível a remoção dos micropoluentes orgânicos através de tratamentos convencionais, torna-se premente o desenvolvimento novas técnicas e processos avançados de tratamento ou a melhoria dos já existentes, o que pode ser substancialmente mais oneroso e/ou passíveis de gerar subprodutos tóxicos (Gaya & Abdullah, 2008). A adoção de processos avançados de pós-oxidação pode assumir-se como uma alternativa interessante de remoção de micropoluentes orgânicos refratários, isto é, que permanecem após o tratamento convencional instalado, cuja viabilidade urge estudar.
Outro desafio relevante no tratamento de água para consumo humano consiste no desenvolvimento de novas e mais sustentáveis técnicas de remoção da matéria orgânica natural. Por se encontrar sempre presente em maior ou menor concentração na água, é importante a remoção da MON, pelo facto de possuir na sua composição precursores de subprodutos da desinfeção com compostos clorados com elevada toxidade para o ser humano (no caso de formação de trihalometanos (THM). A MON pode ser caracterizada pelo carbono orgânico total, carbono orgânico solúvel e absorvância UV com um comprimento de onda de 254nm (UV2540nm). O UV254nm é um indicador da matéria orgânica mais aromática, hidrófoba
e de maior peso molecular (Rosa et al., 2009).
A água bruta pode conter ácidos fúlvicos e húmicos resultantes da decomposição de vegetação. Estes contêm radicais cetona que podem causar a formação de halofórmios após a reação com o cloro. Os ácidos húmicos e fúlvicos são os já referidos “precursores” dos trihalometanos. A reação de formação dos THM inicia-se quando há contato entre os reagentes (cloro e precursores) e pode ocorrer durante por muito tempo, enquanto houver cloro livre disponível (Meyer, 1994).
8 Mestrado Integrado em Engenharia Civil O uso de agentes oxidantes, capazes de oxidar os precursores de THM, tem como objetivo a diminuição do potencial de formação de trihalometanos pela ação de produtos químicos (alterando os precursores) promotores duma completa oxidação química dos precursores (até à forma de dióxido de carbono) (Meyer, 1994).
Hoje em dia, os sistemas de tratamento de maior dimensão recorrem à pré-ozonização, pois o ozono alia um elevado potencial oxidante com uma eficaz ação bactericida e viricida no decorrer do tratamento da água. No entanto, este processo apresenta elevados custos operacionais (Andrade, 2011), fator que pode comprometer a sustentabilidade de sistemas de tratamento de água de pequenos e médios aglomerados populacionais.
Num estudo efetuado em 2007 (Vieira et al., 2007), constatou-se que 17% das ETA de Portugal Continental apresentavam a etapa de pré-oxidação no seu esquema de tratamento, sendo estas ETA de pequena, média e grande dimensão. Esta etapa encontra-se em maior percentagem nas ETA com captação em albufeira, perfazendo um valor de 50%. Neste tratamento, os reagentes utilizados são o cloro-gasoso, dióxido de cloro hipoclorito de sódio, ozono e permanganato de potássio (37%) e o ozono (30%). Devido ao aparecimento de novos contaminantes e micropoluentes, tais como cianobactérias, cianotoxinas, microrganismos persistentes à desinfeção, pesticidas, produtos farmacêuticos, produtos de higiene, fragâncias e desreguladores endócrinos, a oxidação com ozono, ou seja, a pré-ozonização é um processo de tratamento capaz de fazer face a muitos destes agentes, mas implica custos de exploração elevados e uma maior complexidade na operação desses sistemas de tratamento.
É de salientar que as captações de água em Portugal Continental se realizam em grande parte em mananciais de águas superficiais, como os rios e albufeiras (Vieira et al., 2007). Estes meios hídricos, sendo superficiais, são mais suscetíveis às descargas poluentes que, ao diminuir a qualidade da água nas origens, põe em causa o cumprimento de valores paramétricos, pondo em risco a saúde pública e a preservação de ecossistemas aquáticos. A pré-oxidação, coagulação-floculação, sedimentação, filtração e desinfeção constituem processos e operações unitárias que permitem delinear o esquema de tratamento típico em origens de águas superficiais. Face ao aparecimento de contaminantes emergentes e altos custos associados às novas tecnologias de remoção dos mesmos, é necessário e essencial a evolução no esquema de tratamento convencional, incluindo novas técnicas e processos mais sustentáveis, amigas do ambiente, eficientes e de custo reduzido. Os processos de oxidação
Rita Sá Ribeiro 9 avançada são empregues com diversos sistemas reacionais, mas em todos eles se produzem radicais livres hidroxilas (OH-). Estas espécies ativas reagem com as moléculas orgânicas rápida e indiscriminadamente, seja por adição à dupla ligação ou por abstração do átomo de hidrogénio em moléculas orgânicas alifáticas. O resultado é a formação de radicais orgânicos que reagem com oxigênio, dando início a uma série de reações de degradação que podem culminar em espécies inócuas, tipicamente dióxido de carbono e água (Britto & Rangel, 2008). Assim, os processos de oxidação avançada consistem em novas tecnologias a aplicar em estações de tratamento capazes de remover cianotoxinas, matéria orgânica natural, controlo de subprodutos de desinfeção e remoção de pesticidas (Vieira et al., 2007).
2.2.
Nanotecnologia: um desafio do século XXI
Foi em 1959, no Instituto de Tecnologia da Califórnia, que Richard P. Feynman (Prémio Nobel) fala pela primeira vez em nanotecnologia, numa palestra intitulada “There is plenty of
room at the bottom” (“Há muito espaço no fundo”). A ideia de ser possível manipular uma
escala demasiado pequena, neste caso à escala dos átomos e moléculas, veio fascinar quem pela primeira vez ouviu falar em tal assunto.
Segundo Whatemore e Corbertt (2000), a nanotecnologia inclui “quase todos os materiais ou dispositivos que estão estruturados na escala nanométrica, a fim de se obter funções que outrora não poderiam ser alcançadas” (Sobolev & Ferrada Gutiérrez, 2005).
A produção de estruturas à escala nanométrica tem sido desenvolvida utilizando duas abordagens nanotecnológicas distintas (Figura 1): de cima para baixo (top-down) e de baixo para cima (bottom-up). A técnica top-down socorre-se de uma estrutura de maiores dimensões que vai ser reduzida à escala nanométrica permitindo, deste modo, manter as propriedades originais sem nível de controlo de disposição dos átomos. Já na técnica bottom-up há uma manipulação á escala dos átomos ou componentes moleculares (developerWorks, 2013).
10 Mestrado Integrado em Engenharia Civil
Figura 1. Esquema das técnicas de produção de estruturas à escala nanométrica (bottom-up e
top-down)
Apesar dos avanços que a nanotecnologia tem atingido, verifica-se que há uma enorme desigualdade entre as potencialidades da aplicação de nanomateriais em áreas como a medicina, biotecnologia e engenharia civil onde muito mais pode ser feito e constitui um desafio importante à investigação neste domínio.
Contudo, existem já diversos estudos, a decorrer em vários centros de investigação e desenvolvimento, cujos principais objetivos se focam na obtenção de superfícies com propriedades fotocatalíticas a fim de permitirem a redução da presença de microrganismos nas superfícies funcionalizadas. Na presença de ações combinadas do sol e da chuva o vidro funcionalizado torna a sua superfície hidrofílica promovendo, desta forma, a sua autolimpeza. Este comportamento do vidro resulta de ser depositado na sua superfície um semicondutor com capacidade fotocatalítica. O semicondutor mais utilizado neste tipo de funcionalização é o dióxido de titânio (TiO2), aplicado pela técnica de deposição física de vapor, também
designada de pulverização catódica em magnetrão, alterando a tensão superficial da superfície funcionalizada de modo a torná-la hidrofílica. Esta técnica dispende muita energia e envolve uma tecnologia sofisticada o que pode onerar o valor do produto final em cerca de 40% (Gobain, 2013). Mesmo assim, já existem algumas aplicações deste material em vários suportes físicos (e.g. placas de vidro) visando a oxidação avançada de poluentes orgânicos. (Ferreira & Daniel, 2004).
Rita Sá Ribeiro 11 Os processos de oxidação avançada são tecnologias emergentes no tratamento de águas, pois têm a capacidade de mineralizar vários compostos orgânicos e inorgânicos, produzindo água, dióxido de carbono e outros compostos inorgânicos mais simples (Andrade, 2011). Estes processos consistem na geração in situ de espécies altamente reativas como o superóxido (O2), peróxido de hidrogénio (H2O2), radical hidróxido (●OH) e o ozono (O3) (Espulgas et al.,
2003).
2.3.
Fotólise
A fotólise é um processo de dissociação de moléculas orgânicas por meio de radiação eletromagnética. Este processo abrange normalmente os radicais livres que dão início ao rompimento das ligações químicas de uma molécula, originando a formação de iões.
Um bom exemplo de ocorrência de fotólise é a fotossíntese, processo físico-químico realizado pelos vegetais a fim de produzir energia. A reação mais importante da fotossíntese é a fotólise da água, que ocorre na fase clara.
O termo fotólise refere-se à interação da radiação luminosa com as moléculas, provocando rutura das ligações químicas, fragmentando-as. As modificações fotoquímicas ocorrem comumente associadas às radiações com comprimento de onda entre 1200 e 200 nm (Oliveira, 2003).
Por ação da radiação ultravioleta dá-se a dissociação da molécula de oxigénio e, a recombinação dos átomos, dá origem à molécula de ozono (Eq. 1 e 2).
O ●O ●O (1)
O ●O O (2)
A radiação é a emissão de partículas ou energia sob a forma de ondas. A radiação pode ser gerada por meio de excitação térmica, por processos nucleares, por bombardeamento, ou então, por meio de outra radiação. A radiação eletromagnética não necessita de um meio para se propagar e varia em comprimento de onda e frequência de oscilação (Alves et al., 2005). Assim, o espectro eletromagnético é dividido em regiões em função do comprimento de onda e frequência da radiação, como mostra a Figura 2 (Alves & Bermann, 2004).
12 Mestrado Integrado em Engenharia Civil
Figura 2. Espectro eletromagnético
A radiação pode ser dividida em dois tipos: a radiação ionizante e a radiação não ionizante. A diferença entre os dois tipos está no nível de energia de cada radiação. A radiação não ionizante é definida como uma radiação com energia suficiente para causar excitação dos eletrões dos átomos, ou das moléculas, mas insuficiente para causar a formação de iões (ionização). A radiação ionizante possui uma quantidade de energia muito superior à energia da radiação não ionizante (Chronakis, 2005).
Para comprimentos de onda curtos, como luz ultravioleta, a radiação eletromagnética tende a um comportamento corpuscular governado pela física quântica. A quantidade de energia que os fotões concentram é inversamente proporcional ao comprimento de onda de luz, de acordo com a equação 3.
h c
(3) Onde,
E é a energia associada a um determinado comprimento de onda; h é a constante de Planck;
c é a velocidade da radiação eletromagnética no vácuo; é o comprimento de onda da radiação eletromagnética.
Rita Sá Ribeiro 13 As radiações ultravioletas (UV) foram descobertas em 1801 pelo físico alemão John Wilhelm Ritter. O sol é a mais poderosa fonte natural de produção de raios UV e, até alguns séculos atrás, era a única fonte de exposição humana a este tipo de radiação. Somente em 1901, o norte-americano Peter Hewit as produziu artificialmente (Chen et al., 2003).
O espectro ultravioleta pode ser dividido, de uma maneira geral, em quatro partes como mostra a Figura 3 (Alves & Bermann, 2004).
Figura 3. Espectro ultravioleta e seus comprimentos de onda
A norma ISO de determinação da irradiação solar (ISO-DIS-21438) descreve diferentes classes no espectro ultravioleta, conforme explicitado na Tabela 1.
14 Mestrado Integrado em Engenharia Civil
Tabela 1. Classes de radiação UV segundo a norma ISO-DIS-21438
Nome Abreviação Compirmento de onda Energia do fotão
Ultravioleta A, onda longa ou luz
negra
UVA 400 nm – 315 nm 3,10 – 3,94 eV
Próximo NUV 400 nm – 300 nm 3,10 – 4,13 eV
Ultravioleta B ou
onda média UVB 315 nm -280 nm 3,94 – 4,43 eV
Médio MUV 300 nm – 200 nm 4,13 – 12, 4 eV Ultravioleta C, onda curta ou germicida UVC 280 nm – 100 nm 4,43 -12,4 eV Distante FUV 200 nm -122 nm 6,20 – 10,2 eV Vácuo VUV 200 nm – 100 nm 6,20 – 12,4 eV Extremo EUV 121 nm – 100 nm 10,2 – 12,4 eV
2.4.
Fotocatálise
Em 1972, o investigador Honda e o seu aluno Fujishima descobriram, através de trabalho experimental, que alguns semicondutores são capazes de reduzir a água em hidroxilas (•OH) e superóxidos (O2•) através da incidência da radiação ultravioleta (UV), tendo como agente
fotocatalisador o dióxido de titânio. A fotocatálise pode ser utilizada em diversas aplicações como, por exemplo, no tratamento de águas residuais (Ziolli & Jardim, 1998)
O processo de fotocatálise esta diretamente relacionado com as características do agente fotocatalisador. A fotocatálise consiste na quebra de uma molécula quando o agente fotocatalisador é irradiado por uma fonte luminosa capaz de criar um par eletrão-lacuna, ou seja, energia suficiente para vencer o hiato de energia. Os semicondutores possuem uma banda de valência cheia (de eletrões) e uma banda de condução vazia, tal como se pode verificar na Figura 4 (Nogueira & Jardim, 1998).
Rita Sá Ribeiro 15
Figura 4. Processo de fotocatálise
Na presença de radiação o eletrão é excitado e, vencido o hiato energético, o eletrão passa da banda de valência para a banda de condução, formando, desta forma, um par eletrão-lacuna. Quando o eletrão passa para a banda de condução, na presença de uma molécula de H2O
(água) esta reage com o catalisador para formar radicais OH• (muito reativos) a partir da molécula de H2O adsorvida na banda de valência, o eletrão da banda de condução reage com
o O2 (oxigénio) resultando daí peróxidos e aniões super-peróxido.
Na comunidade científica não existe ainda um consenso quando se pretende identificar a espécie iniciadora do processo de oxidação, ou seja, se a etapa inicial ocorre através da lacuna ou via radical hidroxila OH• (Ziolli & Jardim, 1998).
Diferentes semicondutores distinguem-se pelas diferenças entre as suas atividades fotocatalíticas que advém da diferença entre os seus hiatos de energia, como se pode verificar na Tabela 2 (Linsebigler et al., 1995).
Tabela 2. Energia característica de diferentes semicondutores numa solução aquosa (pH=1) Semicondutor Hiato de energia (eV)
GaAs 1,4 GaP 2,25 CaSe 1,7 CdS 2,5 ZnO 3,2 WO3 3,2 TiO2 3,2 SiC 3,0
16 Mestrado Integrado em Engenharia Civil Pode afirmar-se que por cada duas moléculas de água e oxigénio que entram em contacto com o fotocatalisador são gerados quatro radicais hidroxilos e duas moléculas de oxigénio reativo. A eficiência deste processo está intrinsecamente relacionado com a probabilidade de recombinação do par eletrão-lacuna. Quanto menor a recombinação do par eletrão-lacuna, maior a eficiência deste processo (Lacey & Shirmer, 2008).
Existem dois tipos de fotocatálise, nomeadamente a homogénea e a heterogénea. A fotocatálise homogénea caracteriza-se por um agente catalisador que se encontra na mesma fase dos compostos que, assim, serão à posteriori degradados. No caso da fotocatálise heterogénea, o catalisador é colocado num substrato e só mais tarde colocado no meio onde atuará como fotocatalisador (Lacey & Shirmer, 2008). São inúmeros os trabalhos que reportam alguns exemplos de compostos orgânicos que sofrem degradação como corantes (Nogueira & Jardim, 1998), fenóis (Nogueira & Jardim, 1998), polímeros (Hoffmann, 1995), ácidos carboxilos (Nogueira & Jardim, 1998), entre outros.
O mecanismo geral da fotocatálise pode ser descrito através das seguintes equações (Eq. 4, 5 e 6):
iO hv iO e - h (4)
h H O HO. H (5)
h OHads HO. (6)
Tal como foi mencionado anteriormente o mecanismo de degradação não se dá unicamente através do radical hidroxilo mas também através de espécies radicalares que derivam do oxigénio que se forma pela captura de eletrões (Eq. 7 e 8).
e O O (7)
O H H O O (8)
A fotocatálise heterogénea dá origem a duas espécies oxidantes que são responsáveis pela degradação da matéria orgânica, ou seja, os radicais existentes na água reagem com os poluentes produzindo compostos de degradação conforme a natureza do poluente (Friedmann
et al., 2010). O número de compostos intermédios decorrentes da degradação e facilidade do
processo são dependentes da complexidade da matéria orgânica (Gaya & Abdullah, 2008). Na Figura 5 representa-se um esquema de degradação da matéria orgânica onde AH corresponde a um ácido não-metálico derivado do processo de degradação.
Rita Sá Ribeiro 17
Figura 5. Esquema de degradação de matéria orgânica
A cinética subjacente á degradação da matéria orgânica pode ser representada pela equação proposta por Langmuir-Hinshelwood (Eq. 9) (Mills & Hunte, 1998).
r dcdt (9)
No caso da concentração de matéria orgânica ser bastante reduzida a concentração final de matéria orgânica pode ser encontrada através de uma cinética de decaimento de primeira ordem (Eq. 10) (Chong et al., 2009).
t e aap t (10)
Em que Kaap é a constante de velocidade aparente de primeira ordem e C0 a concentração
inicial de matéria orgânica poluente. Desta forma, a taxa inicial de foto-oxidação é obtida considerando uma reduzida quantidade de matéria orgânica através da seguinte equação (Eq. 11) (Gaya & Abdullah, 2008).
r aap (11)
A fotocatálise heterogénea com dióxido de titânio é a mais utilizada devido à sua estabilidade química e térmica e à resistência à degradação química e mecânica (Malato et al., 2009). É ainda o catalisador mais ativo, permanecendo estável após os ciclos catalíticos. O TiO2 pode
ser utilizado como fotocatalisador em suspensão ou imobilizado no reator, sendo necessário uma unidade de remoção das partículas de TiO2 após a oxidação da matéria orgânica ou um
suporte inerte que permite a sua imobilização, respetivamente.
Constata-se que as nanopartículas de TiO2 são essencialmente adicionadas em pó sendo
18 Mestrado Integrado em Engenharia Civil remoção são igualmente numerosos. Como as partículas de TiO2 adicionadas são de pequenas
dimensões (nanopartículas) são necessárias novas técnicas de tratamento pois, com os esquemas de tratamento convencional, as nanopartículas não são removidas nas ETA.
A fotocatálise heterogénea e o TiO2 consistem no processo e no material de aplicação mais
promissores a serem aplicados numa ETA, pois são dotados de uma série de vantagens apresentadas na Tabela 3 (Chong et al., 2009), (Friedmann et al., 2010), (Almquist & Biswas, 2011), (Gaya & Abdullah, 2008).
Tabela 3. Vantagens da aplicação do processo de fotocatálise heterogénea e da utilização do
TiO2
Processo de fotocatálise heterogénea Utilização do TiO2 Operação a temperatura ambiente e pressão
atmosférica
Elevada foto-reatividade após a excitação do eletrão
Mineralização completa de matéria orgânica
(incluindo fenóis e hidrocarbonetos clorados) Baixo custo
Sem poluição secundária Não tóxico
Tecnologia de baixo custo e sustentável Quimicamente e biologicamente inerte
Amiga do ambiente Foto-estável
A grande maioria das experiências realizadas utiliza o TiO2 suspenso por proporcionar maior
área de contacto e por ser possível a sua recuperação após o tratamento. A utilização de reatores de TiO2 imobilizado elimina a existência de sistemas de remoção de partículas de
TiO2 tornando este sistema mais económico. No entanto, estes reatores com TiO2 imobilizado
apresentam em geral, menor eficiência fotocatalítica, podendo essa redução chegar a cerca de 60%. Porém, estudos recentes demonstram a existência de reatores com eficiências de remoção superiores no caso da utilização de TiO2 imobilizado (Gumy et al., 2006).
Existem atualmente estudos que demonstram a eficiência deste processo na inativação de bactérias como a Escherichia coli, Bacilus Pumilus, entre outras (Gumy et al., 2006). Foi demonstrado também que semicondutores fotocatalíticos como o TiO2, CdS, ZnS e ZnO,
assim como o carvão ativado, conseguem degradar eficientemente os clorofenóis originando produtos inócuos em termos de saúde pública, como, por exemplo, dióxido de carbono e água (Sivlim et al., 2012). Alguns investigadores observaram ainda que, com o passar do tempo, a
Rita Sá Ribeiro 19 superfície reativa do fotocatalisador diminui, as características de absorvância da radiação alteram-se e, mais surpreendentemente, o desempenho fotocatalítico aumenta, ou seja, evolui para uma maior eficiência de remoção (EPA, 2010).
2.4.1. Características relevantes do dióxido de titânio
O dióxido de titânio é um semicondutor muito utilizado, tanto na sua utilização como no estudo das suas características, devido essencialmente às suas excelentes propriedades óticas e elétricas. É de notar também que o TiO2 é um material transparente, de baixo custo,
quimicamente estável, muito foto-ativo e com um elevado índice refrativo, o que o torna num material de elevada aplicação na indústria.
Existem variadas aplicações para o TiO2, como, por exemplo, nas indústrias cosmética e
farmacêutica, com produtos como os protetores solares que absorvem a radiação UV (Kwon, 2002). Atualmente, uma das aplicações mais importante do TiO2 é na área da oncologia
médica (tratamento do cancro). Por decomposição das moléculas orgânicas, a fotocatálise contribui para que a membrana citoplasmática seja quebrada, evitando assim tratamentos fatigantes como a quimioterapia ou radioterapia (Fujishima et al., 2000).
As propriedades óticas e elétricas do TiO2 variam consoante as condições atmosféricas e, por
este motivo, este catalisador pode ser utilizado como detetor de gás sob a forma de filme fino. Neste sentido, existe a promoção da interação do gás com os defeitos na superfície do material alterando a condução elétrica deste. Além disso, os filmes finos de TiO2 promovem
também características anti-reflexo e de transparência, podendo assim ser utilizados como espelhos dielétricos para lasers e filtros (Langelt et al., 2003), baseando o seu funcionamento na interferência entre as ondas refletidas na superfície.
20 Mestrado Integrado em Engenharia Civil A forma mais comum na utilização de TiO2 é a que envolve reações assistidas por radiação
solar, ocorrendo excitação de um eletrão que salta da banda de valência para a banda de condução resultando num par eletrão-lacuna. As reações mais comuns podem ser descritas da seguinte forma (Eq. 12, 13 e 14):
H O h H OH. (12)
O e O (13)
O H e H O (14)
Através de radiação UV sobre uma partícula de TiO2 é criado um par eletrão-lacuna e o
radical hidroxilo. Desta forma, os eletrões que se encontram na superfície do filme reduzem o oxigénio do ar ou da água em superóxidos ( ) ou peróxido de hidrogénio (H2O2) (Mills et al., 2003. A quebra de ligações de cadeias de carbono pode ser apresentada através da Eq. 15 (Mills et al., 2003):
omposto Orgânico O hv O H ácidos miner (15)
As estruturas cristalinas mais conhecidas do TiO2 são o rutilo, a anatase e a broquite. O rutilo
é a fase termodinamicamente mais estável a temperaturas elevadas, enquanto a anatase e a broquite são as mais estáveis, a temperaturas reduzidas. Em termos específicos, o que as distingue é o facto de a broquite ser mais estável em condições específicas de pressão, enquanto a anatase é mais estável a uma escala nanométrica.
As estruturas cristalinas mais comuns na aplicação de TiO2 são o rutilo e a anatase. Acima
dos 8 ◦ a transformação de fase anatase para rutilo torna-se irreversível pois esta transformação é afetada por diversos fatores tais como, concentração de defeitos, tamanho da partícula e pressão. As estruturas do rutilo e anatase diferem ainda na deformação/distorção provocada pelos átomos de oxigénio, onde os cristais têm simetria tetragonal e são descritos pelos eixos cristalográficos a e c, como se pode observar na Tabela 4.
Tabela 4. Dados da estrutura cristalográfica do rutilo e da anatase Estrutura cristalográfica Simetria l,h (nm) c (nm) Densidade (g/cm3) Rutilo Tetragonal 4,584 2,953 4,240 Anatase Tetragonal 3,733 9,57 3,830
Rita Sá Ribeiro 21 O TiO2 é constituído por iões de Ti4+ e seis iões de O2- situados no centro de um octaedro.
Cada átomo de oxigénio é rodeado de três vizinhos representativos de três octaedros distintos. Os raios iónicos variam das fases de rutilo para as de anatase sendo 0,146 A e 0,66 A respetivamente (Diebold, 2003). Por cada célula unitária a anatase contém quatro moléculas de TiO2, no caso do rutilo existem apenas duas moléculas, daí a sua estrutura cristalina ser
mais alongada que a do rutilo, tal como se pode verificar na Figura 6.
Figura 6. Estruturas cristalinas do TiO2: rutilo e anatase
Quanto às suas propriedades elétricas os semicondutores podem ser do tipo p ou do tipo n, tendo sido mais aprofundado o estudo em cristais de rutilo, visto os cristais de anatase serem muito difíceis de encontrar na natureza e sintetizar em laboratório.
No que concerne à condução elétrica, comparando o rutilo e a anatase, verifica-se que existe uma menor mobilidade de eletrões no rutilo do que na anatase, na ordem dos 1 e 10 cm2/VS, respetivamente (Kavan et al., 1996).
Recentemente, um grupo de investigadores, conseguiu produzir cristais de anatase por
Chemical Vapor Transport (CVT), onde foi também possível medir a absorção em cristais
tratados em diferentes atmosferas de deposição, pois até então unicamente as propriedades óticas do rutilo tinham sido estudadas (Sekiya et al., 2004). Neste estudo foi demonstrado que o TiO2 é um material com um hiato de energia indireto cujo valor ronda 3,20eV (anatase) e
3,02eV (rutilo), o que corrobora a transparência destes materiais quando no estado puro e estequiométrico.
Como o dióxido de titânio possui uma maior eficiência na faixa de comprimento de onda próximo do ultra violeta, procede-se à sua dopagem por forma a deslocar este comprimento de onda para mais perto do visível (Kuo et al. 2007). Existem estudos no sentido de mostrar
22 Mestrado Integrado em Engenharia Civil que a adição de um corante ao material gera uma nova classe de células solares eletrolíticas, promovendo reações de oxidação-redução na geração de energia (Nature, 2010).
Como se pode verificar na Tabela 5, é também possível variar a cor do TiO2 através da
dopagem com metais de transição e introdução de defeitos intrínsecos com recurso a tratamentos térmicos.
Tabela 5. Variação de cor nas amostras de titânio e seus processos
Cor Método de Obtenção
Amarelo Dopagem com crómio
Vermelho Dopagem com ferro
Verde Ultra-alto-vácuo árgon (atmosfera redutora)
Azul Ultra-alto-vácuo hidrogénio (atmosfera redutora)
É ainda possível produzir-se cristais negros aumentando o grau de redução, mas mais significante que a mudança de cor é o facto de este processo ser totalmente reversível (tanto na anatase como no rutilo), para tal, a transparência é novamente obtida pela oxidação das amostras anteriormente reduzidas (Sekiya et al., 2004).
Uma das propriedades de relevo do dióxido de titânio é o índice de refração que o material possui. Este consiste na razão entre a velocidade de propagação da luz no vazio (c) e a velocidade de propagação da luz nesse material, variando conforme o comprimento de onda de radiação incidente, temperatura e pressão (Tabela 6) (Szczyrbowski et al., 1999).
Tabela 6. Algumas propriedades do TiO2 na fase anatase e rutilo
Fase Anatase Rutilo
Estrutura Cristalina Tetragonal Tetragonal
Densidade (g/cm-3) 3,90 4,24
Dimensão dos eixos (A⁰) a 3,73 c 9,37 a 4,59 c 2,92
Índice de refração 2,53 2,49 2,62 2,90
Transição de fase (⁰C) 642 1855
Rita Sá Ribeiro 23 Existe já no mercado o vidro ActiveTM da Pilkington aplicado no ramo automóvel que possui características de autolimpeza devido exclusivamente à camada de dióxido de titânio de 15nm de espessura depositado na última etapa de fabrico (Mills et al., 2003). Esta camada sob a ação da radiação ultravioleta age de duas formas distintas, ou seja, quebra moléculas orgânicas (à base de carbono) e elimina a poeira inorgânica.
Nos hospitais e em edifícios cujo risco de infeção é elevado existe uma crescente preocupação em eliminar ou reduzir os microrganismos responsáveis pelo fenómeno. Desta forma, são já usadas tintas com incorporação de prata, cobre e dióxido de titânio. A prata e o cobre não necessitam da radiação UV, ou seja, são elementos organometálicos pois o verniz envolve totalmente os organismos e estes ficam impedidos de atuar.
A aplicação de TiO2 revela maior eficiência visto que no caso da prata e do cobre é necessário
polir a superfície com a finalidade de permitir que alguns cristais fiquem expostos à superfície, enquanto, no caso do TiO2, já não é necessário pois estes ficam totalmente
expostos.
Em 1997, Kikushi constatou a capacidade antibacteriana do TiO2 em relação à inativação da
Escherichia.Coli (bactéria). Os resultados foram bastante positivos pois, quer por oxidação,
que por redução se obteve a destruição das mesmas. Nesse estudo, foi comprovado que o oxigénio reativo e o ião hidroxilo, em conjunto com o peróxido de oxigénio, foram fundamentais para a eliminação destas bactérias. A ação destrutiva deste material manifestou-se de tal forma que as bactérias em estudo , mesmo distantes do filme fino de TiO2, separadas
por uma membrana de PTFE (politetrafluoretileno), eram mesmo assim destruídas.
Os microrganismos presentes na água e submetidos a tratamento não apresentam todos a mesma resistência, desta forma, uma classificação possível dos mesmos, em termos de resistência crescente é a seguinte: esporos, bactérias, vírus, bactérias formadoras de esporos, helmintos e protozoários (o-ocistos) (Herrmann, 2005). Estudos efetuados (Friedmann et al., 2010; Lonnen et al., 2005) conseguiram demonstrar o potencial fotocatalítico do TiO2 na
inativação de alguns microrganismos, nomeadamente as bactérias coliformes e Escherichia
coli (E. coli). De acordo com a lei em vigor (Decreto-Lei 306-2007), estes parâmetros
microbiológicos devem estar ausentes da água para consumo humano.
A reação fotocatalítica de inativação dos microrganismos está sujeita ao tamanho das partículas do TiO2, pois as bactérias tendem a absorver estas partículas sendo dessa forma