Influência colorimétrica em surimis de tambaqui submetidos a diferentes
crioprotetores
Colorimetric influence in tambaqui surimis submitted to different
cryoprotectors
DOI:10.34117/bjdv6n5-034
Recebimento dos originais: 08/04/2020 Aceitação para publicação: 04/05/2020
Jonatã Henrique Rezende-de-Souza
Cientista de Alimentos pela Universidade Federal de Mato Grosso Mestrando em Tecnologia de Alimentos (PPGTA)
Instituição: Universidade Estadual de Campinas
Endereço:Rua Monteiro Lobato, 80 – Cidade Universitária, Campinas, São Paulo, Brasil – 13083- 862
E-mail: jonatarezendesouza@gmail.com
Cleise de Oliveira Sigarini Sander de Souza
Doutora em Zootecnia pela Universidade Estadual Paulista Julio de Mesquita Filho Professora no Curso de Ciência e Tecnologia de Alimentos
Instituição:Universidade Federal de Mato Grosso
Endereço:Avenida Fernando Correa da Costa, 2367 –Boa Esperança, Cuiabá, Mato Grosso, Brasil – 78060-900
E-mail: csouza0503@gmail.com
Marcio Aquio Hoshiba
Doutor em Zootecnia pela Universidade Estadual Paulista Julio de Mesquita Filho Professor do Curso de Zootecnia
Instituição:Universidade Federal de Mato Grosso
Endereço:Avenida Fernando Correa da Costa, 2367 –Boa Esperança, Cuiabá, Mato Grosso, Brasil – 78060-900
E-mail: tokudazoo@gmail.com
Janessa Sampaio de Abreu
Doutora em Aquicultura pela Universidade Estadual Paulista Julio de Mesquita Filho Professora do Curso de Zootecnia
Instituição:Universidade Federal de Mato Grosso
Endereço:Avenida Fernando Correa da Costa, 2367 –Boa Esperança, Cuiabá, Mato Grosso, Brasil – 78060-900
E-mail: janessabreu@yahoo.com.br
Luciana Kimie Savay-da-Silva
Doutora em Química na Agricultura e Ambiente pela Universidade de São Paulo Professora no Curso de Ciência e Tecnologia de Alimentos e Programas de Pós-graduação em
Nutrição, Alimentos e Metabolismo (PPGNAM) e Ciência Animal (PPGCA) Instituição:Universidade Federal de Mato Grosso
Endereço: Avenida Fernando Correa da Costa, 2367 –Boa Esperança, Cuiabá, Mato Grosso, Brasil – 78060-900
RESUMO
A composição proteica dos peixes é baseada em alto teor de proteínas miofibrilares, sendo estas responsáveis pela formação de géis e emulsões. Um ingrediente rico destas características é o
surimi. Este trata-se de uma pasta de pescado oriunda de carne de peixe moída ou separada
mecanicamente (CMS), devidamente lavada em água potável e fria, para remoção de sujidades como gordura e pigmentos. Em seguida, adiciona-se agentes crioprotetores (ACPs) para contribuição na formação de gel. Porém, isto pode influenciar diretamente na cor do produto. Pensando nisso, este estudo teve por objetivo produzir surimis de tambaqui e avaliar a influência de diferentes formulações de ACPs na cor dos produtos finais. Para isto, utilizou-se filés de tambaqui (Colossoma macropomum) devidamente triturados, lavados e exsudados. Em seguida, adicionou-se ACPs, formando os seguintes tratamentos: SP - surimi padrão sem adição de ACPs; S1 - surimi com 1% de sacarose e 2% de cloreto de sódio; S2 - surimi com 5% de sorbitol e 0,3% de tripolifosfato de sódio; S3 - surimi com 6% de sacarose, 6% de sorbitol e 0,5% de tripolifosfato de sódio. Para avaliação da cor final dos surimis realizou-se um estudo colorimétrico, pelo sistema CIElab, analisando os parâmetros de luminosidade (L*), coordenada vermelha/verde (a*), coordenada amarela/azul (b*), cromaticidade (C*) e ângulo de tonalidade (h*). Ainda, para cada tratamento, foi calculado suas diferenças colorimétricas quando comparado ao surimi padrão (SP). Os dados de cor de L*, a*, b*, C* e h* foram analisados estatisticamente em Sigma Stat, pelo t de
student (p <0,05), e os resultados de diferença de parâmetros de cor (∆L*, ∆a*, ∆b*, ∆C*, ∆h* e
∆E) foram expressos em valor médio. Os valores de L* diminuíram (p <0,05) em S2 e S3 quando comparados ao SP, indicando um escurecimento após a adição dos ACPs. Para os demais parâmetros, não houve diferenças significativas. Os surimis apresentaram os valores de a*, b*, e C* próximos a zero. Apenas os S2 e S3 expressaram valores de ∆E acima de 5, indicando uma diferença perceptível de cor total em relação ao padrão. Conclui-se que a adição dos agentes crioprotetores contendo o tripolifosfato de sódio promoveu escurecimento significativo nos surimis de filé de tambaqui. Independente da adição de agentes crioprotetores, os surimis apresentaram baixos índices de tonalidade e cromaticidade, destacando a intensidade de cor branca.
Palavras-Chave: Colossoma macropomum; peixe nativo; tecnologia de pescado; cor instrumental; colorimetria; gel proteico; proteína miofibrilar.
ABSTRACT
The protein composition of fish is based on a high content of myofibrillar proteins, which are responsible for the formation of gels and emulsions. A rich ingredient of these characteristics is
surimi. It’s a fish paste from ground or mechanically separated fish meat (CMS), properly washed
in cold and drinking water, to remove dirt such as grease and pigments. Then, cryoprotective agents (ACPs) are added to contribute to gel formation. However, this can directly influence the color of the product. With this in mind, this study aimed to produce tambaqui surimis and evaluate the influence of different ACP formulations on the color of the final products. For this, we used tambaqui fillets (Colossoma macropomum) properly crushed, washed and exudated. Then, ACPs were added, forming the following treatments: SP - standard surimi without adding ACPs; S1 -
surimi with 1% sucrose and 2% sodium chloride; S2 - surimi with 5% sorbitol and 0.3% sodium
tripolyphosphate; S3 - surimi with 6% sucrose, 6% sorbitol and 0.5% sodium tripolyphosphate. A colorimetric study was carried out using the CIElab system, analyzing the parameters of luminosity (L*), red/green coordinate (a*), yellow/blue coordinate (b*), chromaticity (C*) and tint angle (h*). Also, for each treatment, their colorimetric differences were calculated when compared to the standard surimi (SP). The color data of L*, a*, b*, C* and h* were analyzed statistically in Sigma Stat, by the student's t (p <0.05), and the results of difference in color parameters (∆L*, ∆a*, ∆b*, ∆C*, ∆h* and ∆E) were expressed in average value. L* values decreased (p <0.05) in S2 and S3 when compared to SP, indicating a darkening after the addition of ACPs. For the other parameters, there were no significant differences. The surimis presented the values of a*, b*, and C* close to
zero. Only S2 and S3 expressed values of ∆E above 5, indicating a noticeable difference in total color compared to the standard. It is concluded that the addition of cryoprotective agents containing sodium tripolyphosphate promoted significant darkening in tambaqui fillet surimis. Regardless of the addition of cryoprotective agents, surimis showed low levels of hue and chromaticity, highlighting the intensity of white color.
Keywords: Colossoma macropomum; native fish; fish technology; instrumental color; colorimetry; protein gel; myofibrillar protein.
Dados parciais deste estudo foram utilizados em resumo publicado no 13º Simpósio Latino Americano de Ciência dos Alimentos (https://proceedings.science/slaca/slaca- 2019/papers/colorimetric-study-of-tambaqui-surimis-under-different-cryprotector-formulations).
1 INTRODUÇÃO
Peixes, de acordo com o Regulamento de Inspeção Industrial e Sanitária de Produtos de Origem Animal (RIISPOA), são animais aquáticos utilizados na alimentação humana e animal, e pertencentes ao grupo de pescado (BRASIL, 2017). De forma geral, são bem aceitos, principalmente devido seus parâmetros nutricionais e sensoriais.
Na composição bromatológica dos peixes observa-se a presença de: proteínas de alta digestibilidade e elevado valor biológico; aminoácidos essenciais, como a metionina e a lisina; lipídios poli-insaturados, e em algumas espécies nota-se a presença significativa de ácidos graxos insaturados da família ômega 3; vitaminas lipossolúveis A e D; as hidrossolúveis do complexo B; e ainda, minerais como sódio, potássio, fósforo, cálcio, selênio, magnésio, zinco e ferro (OGAWA; MAIA, 1999; OETTERER et al., 2006; SARTORI; AMANCIO, 2012; TACON; METIAN, 2013; FAO, 2016).
A composição proteica dos peixes consiste em proteínas sarcoplasmáticas (mioglobina e hemoglobina) e as miofibrilares (actina e miosina) que possuem excelente atributo funcional dentro da tecnologia de pescado, uma vez que estas possibilitam a formação de géis e emulsões, essenciais para a produção de alimentos formatados, reestruturados e emulsionados (GONÇALVES, 2011). Neste sentido, um coproduto que vem ganhando espaço na indústria pesqueira por sua elevada concentração de proteínas miofibrilares é o surimi, cujo pacote tecnológico originou-se no Japão, durante o século XII, mas somente no ano de 1910 houve o crescimento significativo de sua produção industrial (CABRAL et al., 2008).
É caracterizado como surimi, o produto congelado obtido a partir de carne mecanicamente separada de peixe, submetida a lavagens sucessivas, drenagem e refino, com adição de aditivos (BRASIL, 2017). Estas etapas têm como finalidade, promover a eliminação de sujidades macroscópicas (restos do aparelho digestivo, escamas, pele), excesso de gordura, e ainda, de
compostos solúveis em água, como sais, minerais, e proteínas sarcoplasmáticas (LEE, 1984; GOMES et al., 1994).
No processo de elaboração do surimi, após as etapas de obtenção da matéria prima (CMS), lavagem e remoção do excesso de umidade, são adicionadas moléculas de baixo peso molecular, conhecidas como agentes crioprotetores (ACPs), que possuem a função de preservar as proteínas miofibrilares durante o processo de congelamento e também promover o início da formação de gel proteico (HUIDOBRO et al., 1998; VASCONCELOS et al., 2016).
Após adição dos ACPs, o surimi sofre o processo de congelamento rápido e permanece sob baixas temperaturas por aproximadamente 30 dias, a fim de intensificar a formação de gel (VASCONCELOS et al., 2016) e quando descongelado, passa a ser utilizado como ingrediente na formulação de produtos alimentícios, como kani-kana, kamaboko, análogos de peixe, hambúrgueres, empanados, entre outros (PARK, 2005).
A produção desses derivados de pescado permite a agregação de valor a espécies consideradas de baixo valor comercial bem como o desenvolvimento de produtos mais elaborados, de maior conveniência ou prontos para consumo, favorecendo o aumento do consumo do pescado, podendo desempenhar um papel fundamental no desenvolvimento da cadeia produtiva do mesmo (CASSOL et al., 2019).
A cor, como atributo sensorial, é um dos principais parâmetros de qualidade avaliados durante a aquisição de um produto alimentício, por ser o primeiro contato do consumidor com o produto. Wozny et al. (2008), afirmam que a percepção visual é modulada quanto ao brilho, luminosidade, detecção visual, processo temporal, atenção, e percepção de movimento, demostrando então que estes parâmetros induzem a ilusões visuais e, consequentemente, ao desejo de aquisição/consumo de um produto. Segundo Atkins et al. (2018), a adição de ingredientes em qualquer nova matriz promove rearranjos moleculares dos constituintes ali presentes, influenciando em diferentes condições na absorção e reflecção de luz, resultando diretamente na percepção de cor final do produto.
Sendo assim, é interessante para a indústria de alimentos, que o surimi possua elevados valores de luminosidade, com maior tendência possível para cor branca, no que diz respeito a padrões de cor instrumental, pois assim, facilita sua aplicação no desenvolvimento de diversos produtos, sem que a sua característica colorimétrica possa interferir na aceitação dos mesmos. Com isso, objetivou-se, nesta pesquisa, produzir surimis de tambaqui e avaliar a influência de diferentes formulações de agentes crioprotetores na cor dos produtos finais.
2 METODOLOGIA
Para realização deste estudo, foram utilizados aproximadamente 10 kg de peixes da espécie tambaqui (Colossoma macropomum), provenientes da Fazenda Experimental da Universidade Federal de Mato Grosso, localizada no município de Santo Antônio do Leverger, MT. Imediatamente após a despesca, os animais foram insensibilizados por hipotermia, na proporção de água e gelo de 1:1, abatidos por corte nas guelras e deixados sangrar por 3 minutos. Em seguida, foram executadas as etapas de evisceração, remoção de pele e filetagem, sendo utilizados apenas os filés para a realização deste estudo.
Os filés foram transportados em caixas térmicas com gelo, até o laboratório de Tecnologia de Carnes e Pescado (LabCarPesc), localizado na Faculdade de Nutrição, da Universidade Federal de Mato Grosso (UFMT), campus Cuiabá, MT. Em seguida, deu-se início ao processo de elaboração dos surimis, conforme pode ser observado na Figura 1.
Os filés foram triturados e homogeneizados, durante 150 segundos, em Cutter (Metvisa Cut.4) e, posteriormente, submetidos a 5 ciclos de lavagem em água potável à 5±2 ºC, na proporção de 3 litros de água para 1 quilo de filé triturado (3:1). Em todos os ciclos de lavagem, houve o momento de homogeneização por 5 minutos, seguido ao processo de decantação por 10 minutos (CENTENARO et al., 2007, modificado). Durante a finalização de cada ciclo de lavagem, o excesso de água foi removido com auxílio de prensa semimanual adaptada ao estudo.
necessária para neutralização da água de lavagem, pois, de acordo com Neiva e Gonçalves (2011), faixas de pH próximas a sete promovem maior solubilidade das proteínas sarcoplasmáticas. Para o 5º ciclo de lavagem, utilizou-se 1% de cloreto de sódio à água de lavagem, pois, segundo a literatura (VAZ, 2005; FOGAÇA, 2009; SÃO MARTINHO, 2011), este sal favorece o processo de reação osmótica das proteínas sarcoplasmáticas, contribuindo então para um surimi com maior concentração de proteínas miofibrilares.
Ao final dos processos de lavagem, as amostras foram divididas em quatro tratamentos, que diferiram com relação aos ACPs a eles adicionados. A determinação das formulações de ACPs deu- se de acordo com referências presentes na literatura, a saber: S1 - surimi acrescido com 1% de sacarose e 2% de cloreto de sódio (FOGAÇA, 2009); S2 - surimi acrescido com 5% de sorbitol e 0,3% de tripolifosfato de sódio (OLIVEIRA, 2015); S3 - surimi acrescido com 6% de sacarose, 6% de sorbitol e 0,5% de tripolifosfato de sódio (VASCONCELOS et al., 2016). Como controle foi realizado um surimi padrão - SP, sem adição de crioprotetores.
O estudo de cor instrumental foi realizado nos surimis antes e depois de acrescido os ACPs, com auxílio de Colorímetro Konica Minolta CR-400, à observador padrão 10º, iluminante D65 e sistema de cor CIELab. Com os resultados de L* (luminosidade), a* (coordenada vermelha/verde) e b* (coordenada amarela/azul) de todos os tratamentos, foram calculados os valores de C* (cromaticidade) e h* (ângulo de tonalidade), de acordo com as seguintes equações: 𝑪∗ = (𝒂∗)𝟐 +
(𝒃∗)𝟐, onde, C* = cromaticidade, a* = coordenada vermelha/verde, e b* = coordenada
amarela/azul; e 𝒉∗ = 𝟑𝟔𝟎 + [𝒕𝒂𝒏−𝟏 (𝒃∗
)], onde, h* = ângulo de tonalidade, 360 = é o valor total de
𝒂∗
circunferência; tan-1 = tangente, b* = coordenada amarela/azul, e a* = coordenada vermelha/verde. Através dos resultados obtidos, comparou-se o surimi padrão (SP) com cada tratamento, individualmente, por meio de cálculos de diferenças totais de luminosidade (∆L*), dos valores das coordenadas vermelha/verde (∆a*) e amarela/azul (∆b*), cromaticidade (∆C*), tonalidade (∆h*), e ainda, de cor total dos produtos (∆E). Para isso, com exceção ∆h* e ∆E, o cálculo padrão de diferença deu-se pela equação ∆𝑿∗ = 𝑿∗ − 𝑿∗ , onde, ∆X* é a diferença total da variável desejada,
𝑺 𝑺𝑷
X*S é o valor de da variável desejada obtido em tratamento de surimi a ser calculado; XSP é o valor
de variável desejada obtido no surimi padrão.
Para a determinação da diferença de tonalidade e da cor total, respectivamente, utilizou-se as equações ∆𝒉∗ = √[(∆𝒂∗)𝟐 + (∆𝒃∗)𝟐 − (∆𝑪∗)𝟐), e ∆𝑬 = √(∆𝑳∗)𝟐 + (∆𝒂∗)𝟐 + (∆𝒃∗)𝟐, onde, ∆h*
= diferença total de tonalidade, ∆E* é a diferença de cor total; ∆L* é a diferença de luminosidade; ∆a* é a diferença total da coordenada vermelha/verde; ∆b* é a diferença total da coordenada amarela/azul; ∆C* é a diferença total de cromaticidade.
Sigma Stat, versão 3.2. Os resultados que apresentaram distribuição normal foram submetidos ao teste t de student, com um nível de significância estabelecido em p <0,05. Os resultados de diferença de parâmetros de cor (∆L*, ∆a*, ∆b*, ∆C*, ∆h* e ∆E) foram expressos em valor médio.
3 RESULTADOS E DISCUSSÃO
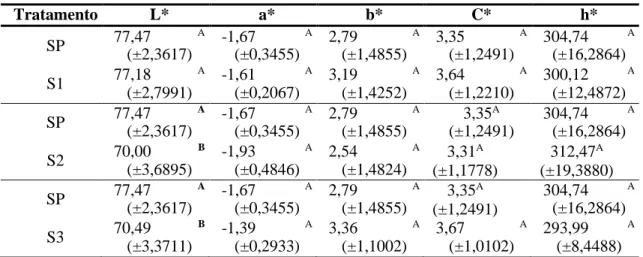
As análises de cor instrumental dos surimis submetidos à diferentes crioprotetores estão apresentados na Tabela 1. Os surimis acrescidos com 5% de sorbitol e 0,3% de tripolifosfato de sódio (S2) e com 6% de sacarose, 6% de sorbitol e 0,5% de tripolifosfato de sódio (S3) apresentaram luminosidade (L*) significativamente menor (p <0,05) em relação ao surimi padrão (SP), indicando um escurecimento das amostras após a adição dos ACPs presentes nessas formulações.
Tabela 1: Valores médios (± desvio padrão) dos parâmetros colorimétricos de surimis de filé de tambaqui (Colossoma
macropomum) acrescidos com diferentes formulações de agentes crioprotetores.
Tratamento L* a* b* C* h* SP 77,47 A (±2,3617) -1,67 A (±0,3455) 2,79 A (±1,4855) 3,35 A (±1,2491) 304,74 A (±16,2864) S1 77,18 A (±2,7991) -1,61 A (±0,2067) 3,19 A (±1,4252) 3,64 A (±1,2210) 300,12 A (±12,4872) SP 77,47 A (±2,3617) -1,67 A (±0,3455) 2,79 A (±1,4855) 3,35A (±1,2491) 304,74 A (±16,2864) S2 70,00 B (±3,6895) -1,93 A (±0,4846) 2,54 A (±1,4824) 3,31A (±1,1778) 312,47A (±19,3880) SP 77,47 A (±2,3617) -1,67 A (±0,3455) 2,79 A (±1,4855) 3,35A (±1,2491) 304,74 A (±16,2864) S3 70,49 B (±3,3711) -1,39 A (±0,2933) 3,36 A (±1,1002) 3,67 A (±1,0102) 293,99 A (±8,4488)
SP = surimi padrão, sem adição de crioprotetores; S1 = surimi com 1% de sacarose e 2% de cloreto de sódio; S2 =
surimi com 5% de sorbitol e 0,3% de tripolifosfato de sódio; S3 = surimi com 6% de sacarose, 6% de sorbitol e 0,5% de
tripolifosfato de sódio; L* = luminosidade; a* = tonalidade vermelha/verde; b* = tonalidade amarelo/azul; C* = cromaticidade; h* = ângulo de tonalidade. Letras diferentes nas colunas indicam diferenças significativas entre tratamentos e o surimi padrão pelo teste t de student (p<0,05).
Tal escurecimento nas amostras podem estar relacionados a quantidade e ao tipo de ACPs adicionados. Tratando-se desta última hipótese, quando observado os tratamentos S2 e S3, verifica- se que ambos contêm em suas composições, o tripolifosfato de sódio, composto químico este que possui em sua estrutura molecular, cinco átomos de oxigênio contendo um íon monovalente negativo cada (O-). Isto é, dentre os compostos utilizados, apenas o tripolifosfato de sódio possui cargas em sua estrutura molecular, sendo consideradas neutras as demais moléculas, o que corrobora com a afirmação de Atkins et al. (2018), que justificam que os íons podem se mover, influenciando na diferença de absorção de luz e, consequentemente, no comprimento de luz absorvida e refletida, alterando então a cor do produto final.
Não se encontra na literatura, e nem na legislação brasileira vigente, um padrão colorimétrico específico e definido para elaboração de surimis. Sendo assim, os parâmetros de qualidade desse produto ficam indefinidos, podendo variar conforme o método de produção (quantidade de lavagens, principalmente), espécie de peixe utilizada e tipo e quantidade de agentes crioprotetores, influenciando, principalmente, na cor do produto final.
Fogaça (2009) desenvolveu surimi com tilápia do Nilo (Oreochromis niloticus), utilizando 2% de cloreto de sódio e 1% de sacarose como ACPs, e encontrou valor de L* de 58,75; enquanto Libardi (2015), utilizando a mesma espécie de peixe, porém, com 5% de sacarose e 0,3% de tripolifosfato de sódio como ACPs, encontrou valor de L* de 64,46. Velazquez et al. (2007), por sua vez, encontraram valor de L* de 64,8 em surimi de Polaca do Alasca (Theragra chalcogramma) sem adição de ACPs. Nota-se que todos os valores observados neste presente estudo para L*, foram maiores que os apresentados nos trabalhos citados, indicando que o surimi de tambaqui deste trabalho se mostrou mais claro, facilitando sua maior versatilidade para uso em relação a cor e, confirmando novamente, que questões como espécie e tipo de processamento podem interferir na cor final do surimi.
Os demais parâmetros de cor não diferiram entre as formulações de surimi adicionada com ACPs e o surimi padrão (p <0,05) porém, verificou-se que em todos os tratamentos, os parâmetros a* e b* tenderam suas coordenadas a verde e amarelo, respectivamente. Esta característica também foi expressa em outros trabalhos. Uresti et al. (2003), desenvolveram surimi de Linguado Mexicano (Pleuronectiformes spp.), e obtiveram valores de -2,91 e 12,0 para as coordenadas a* e b*, respectivamente. Outros surimis, agora desenvolvidos com Pescada (Cynoscion spp.) (RAMÍREZ et al., 2007) e Polaco do Alasca (Theragra chalcogramma) (VELAZQUEZ et al., 2007), obtiveram, respectivamente, valores de -1,70 e -2,44 para a*, e 7,60 e 8,60 para b*.
Estes resultados demonstram maiores valores de b* do que a*, indicando surimis de tom amarelo e subtom verde pela escala CIELab. Outra observação relevante deste estudo é que, em ambas as coordenadas (a* e b*), os valores foram próximos a zero, indicando a quase ausência de pigmentação, fator este conhecido como baixa saturação ou baixa cromaticidade, o que nesse caso também é desejável, pois favorece uma coloração mais clara ao produto final.
Esta relação entre tom e saturação é observada numericamente neste estudo. Os surimis expressaram pequenos valores de cromaticidade (C*), indicando baixa concentração de compostos pigmentosos, isto pois, conforme Soares (2017), valores de C* próximos a zero possuem elevada concentração de gris em sua formação, o que torna a cor dos produtos, pouco saturadas. Em outras palavras, pode-se dizer que a real cor do produto, oriunda através da tonalidade (h*) obtida pelas coordenadas a* e b*, é fraca, novamente indicando pouca pigmentação e uma tonalidade clara, ou seja, sem cor, podendo ser considerada a amostra como branca.
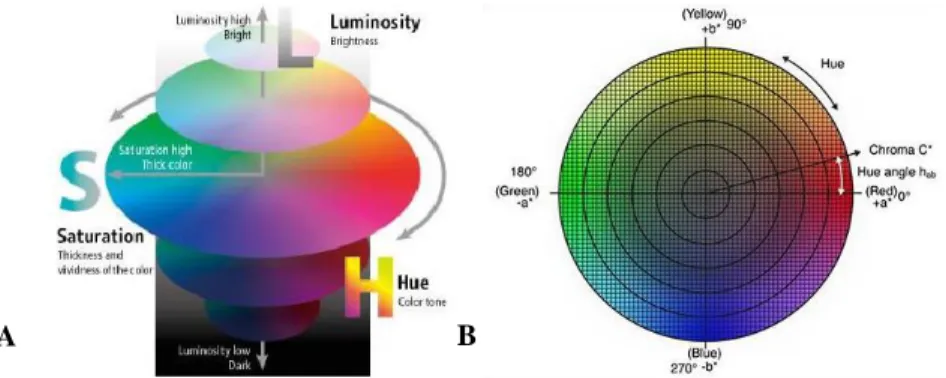
Tratando-se então da tonalidade dos surimis, em todos os tratamentos, os valores de h* variaram entre 293,99 a 312,47. Sabendo que h* é o ângulo de tonalidade e, considerando que uma circunferência possui ângulo de 360º, pode-se dizer que todos os surimis, seja o padrão ou aqueles acrescidos com ACPs, expressaram cor púrpura (Figura 2). Porém, quando analisado todas as variáveis colorimétricas em conjunto, é possível dizer que para todos os tratamentos, os surimis expressaram ausência de pigmentação, logo, são de cor branca, principalmente devido à alta concentração de gris.
Figura 2: Visões tridimensional (A) e bidimensional (B) do sistema colorimétrico CIE.
A
Fonte: https://www.maujor.com/tutorial/css3-modulo-para-cores.php (A); https://sensing.konicaminolta.us/blog/understanding-the-cie-lch-color-space/ (B).
Isto é facilmente observado nos gráficos do sistema colorimétrico presentes na Figura 2. Ou seja, foram quase nulos os valores de a* e b*, estando mais próximos ao ponto central dos gráficos (Figura 2). Então não se tem intensidade de tom, mesmo que a tonalidade (h*) real seja púrpura.
Como a cromaticidade (C*) é muito baixa, ou seja, a distância do valor de h* está próxima ao centro da figura, comprova-se que as amostras não têm pigmentação, sendo possível definir os
surimis elaborados como de cor branca. Por outro lado, o que influencia a intensidade do branco é a
luminosidade, e no caso desta pesquisa observou-se valores elevados de L* nos surimis de filé de tambaqui, sendo então considerados mais brancos em relação ao verificado em demais trabalhos da literatura (VELAZQUEZ et al., 2007; FOGAÇA, 2009; LIBARDI, 2015).
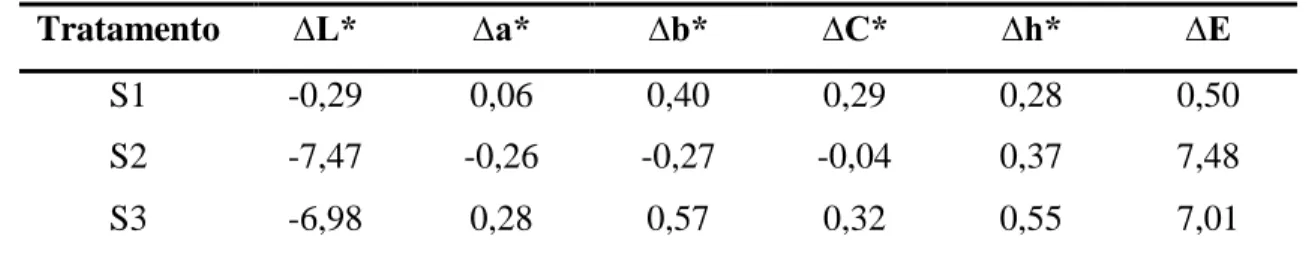
Cálculos de diferença dos parâmetros de cor entre as formulações de surimi estudadas são apresentados na Tabela 2.
Tabela 2: Valores de diferença de cor dos parâmetros colorimétricos de surimis de filé de tambaqui (Colossoma
macropomum).
Tratamento ∆L* ∆a* ∆b* ∆C* ∆h* ∆E
S1 -0,29 0,06 0,40 0,29 0,28 0,50
S2 -7,47 -0,26 -0,27 -0,04 0,37 7,48
S3 -6,98 0,28 0,57 0,32 0,55 7,01
SP = surimi padrão, sem adição de crioprotetores; S1 = surimi com 1% de sacarose e 2% de cloreto de sódio; S2 =
surimi com 5% de sorbitol e 0,3% de tripolifosfato de sódio; S3 = surimi com 6% de sacarose, 6% de sorbitol e 0,5% de
tripolifosfato de sódio; ∆L* = diferença na luminosidade; ∆a* = diferença no tom vermelho/verde; ∆b* = diferença no tom amarelo/azul; ∆C* = diferença de cromaticidade; ∆h* = diferença de ângulo de tonalidade; ∆E = diferença total de cor.
Poucos trabalhos trazem informações de diferença dos parâmetros colorimétricos em surimi. Uma justificativa para isso, é que esses parâmetros, de acordo com Soares (2017), são limites estabelecidos pelos próprios pesquisadores ou indústrias processadoras, como padrões de qualidade interno, e específicos para cada empresa. Todavia, este tipo de análise pode ser uma alternativa interessante, pois com ela é possível verificar pequenas variações nas cores apresentadas pelos produtos analisados, mesmo quando estas não apresentam diferenças estatísticas significativas, sendo uma forma de diferenciação da empresa no mercado, já que poderá haver um padrão de qualidade interno.
Em se tratando da diferença de luminosidade (∆L*), pode-se dizer que todos os surimis acrescidos de ACPs (S1, S2 e S3), escureceram quando comparado ao surimi padrão, uma vez que se observa valores negativos nos resultados de delta (Tabela 2). Porém, tanto para o S2 quanto para o S3, o escurecimento foi muito maior do que para S1. E isto pode estar relacionado diretamente com a diferença estatística das médias de L*, já discutida anteriormente neste trabalho.
Para ∆a*, ∆b* e ∆C*, podem ser observados que apenas para o S2 houve diminuição de intensidade colorimétrica. Isto indica que este surimi (S2) se expressou menos esverdeado, menos amarelo, e com menor cromaticidade, quando em relação ao surimi padrão (SP), devido aos seus valores negativos. Sobre a diferença de tonalidade (∆h*), todos os tratamentos de surimis apresentaram baixos valores positivos, expressando então o pouco aumento da tonalidade púrpura após a adição das formulações de ACPs.
Em todos os tratamentos houve diferença total de cor (∆E) após a adição dos ACPs, porém, os S2 e S3 foram aqueles que obtiveram as maiores diferenças, que pode ser explicado pela diferença significativa (p <0,05) obtida no parâmetro L*. De acordo com Soares (2017), de modo geral, valores de ∆E até ±1 são consideradas diferenças de cores imperceptíveis ao olho humano; enquanto ∆E maiores que 1 ou menores que -1 começam a serem perceptíveis. Com base nisto, pode-se dizer que para os tratamentos S2 e S3, há uma percepção visual aparente da diferença de cor, devido à adição dos ACPs.
Estes dados mostram a importância do estudo colorimétrico na qualidade dos alimentos, principalmente se tratando de pescado e seus derivados pois, este grupo alimentício, atualmente, não possui escalas de variações colorimétricas mediadas como limites de qualidade, nem pela literatura, nem pela legislação nacional.
6 CONCLUSÃO
A adição de formulações de agentes crioprotetores contendo o tripolifosfato de sódio promoveu escurecimento significativo nos surimis de filé de tambaqui. Independente da adição de agentes crioprotetores, os surimis apresentaram baixos índices de tonalidade e cromaticidade, destacando a intensidade de cor branca.
AGRADECIMENTOS
Universidade Federal de Mato Grosso (UFMT); Laboratório de Tecnologia em Carnes, Pescado e Derivados (LABCARPESC); Núcleo de Estudos em Pescado (NEPES); Daxia Ingredientes e Aditivos.
REFERÊNCIAS
ATKINS, P. W.; JONES, L.; LAVERMAN, L. Princípios de química: questionando a vida moderna e o meio ambiente. 7 ed. Porto Alegre: Bookman, 2018. 830 p.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Regulamento de Inspeção de Industrial e Sanitária de Produtos de Origem Animal. Decreto nº 9.013 de 29 de março de 2017. Brasília, MAPA, 2017.
CABRAL, I.S.R.; ROSSI, A.C.R.; WATANUKI, M.M.; SAVAY-DA-SILVA, L.K.; OETTERER, M. Processo tecnológico de industrialização do surimi. Série Produtor Rural. Piracicaba, n. 41, 31 p, 2008.
CASSOL, G. Z.; ABREU, M. C. C.; TEIXEIRA, J. S.; LARA, J. A. F.; FILHO, E. S. A.; SAVAY- DA-SILVA, L. K. Tecnologia de processamento e qualidade microbiológica de formatados elaborados com peixes de baixo valor comercial. In: ANDRADE, D. F. (Org.). Ciência e Tecnologia dos Alimentos, Belo Horizonte: Poisson, v. 5, 2019, p. 16-25.
CENTENARO, G.S.; FEDDERN, V.; BONOW, E.T.; SALAS-MELLADO, M. Enriquecimento de pão com proteínas de pescado. Ciência e Tecnologia de Alimentos, v. 27, n. 3, p. 663-668, 2007.
FAO. The State of World Fisheries and Aquaculture: Contributing to food security and nutrition for all. Rome. 200 p. 2016.
FOGAÇA, F.H.S. Caracterização de surimi de tilápia do Nilo: morfologia e propriedades físicas, químicas e sensoriais. 2009. 73 p. Tese de (Doutorado em Aquicultura) – Universidade Estadual Paulista. Jaboticabal, 2009.
GOMES, J. C.; BIANCHINI, M. G. A.; PEREIRA, C. A. S.; COELHO, D. T.; COSTA, P. M. A. Processamento e caracterização do surimi de peixe de água doce. Ciência e Tecnologia de Peixe de Água Doce, Campinas, v. 14, n. 2, p. 226-237, 1994.
GONÇALVES, A. A. Aspectos gerais do pescado. In: GONÇALVES, A. A. Tecnologia do pescado: ciência, tecnologia, inovação e legislação. São Paulo: Atheneu, p. 2-9, 2011.
HUIDOBRO, A.; ALVAREZ, C.; TEJADA, M. Muscle Altered by Frozen Storage as Affected by Added Ingredients. Journal of Food Science, v.63, n.4, p.638-643, 1998.
LIBARDI, M. C. Processamento de empanado de frango adicionado de surimi e inulina e reduzido de sódio. 2015. 238 p. Dissertação de (Mestrado em Ciência e Tecnologia de Alimentos) – Universidade Federal do Espírito Santo. Alegre, 2015.
NEIVA, C. R. P.; GONÇALVES, A. A. Carne mecanicamente separada (CMS) de pescado e surimi. In: GONÇALVES, A. A. Tecnologia do pescado: ciência, tecnologia, inovação e legislação. São Paulo: Atheneu, 2011, p. 197-208.
OETTERER, M.; D'ARCE, M.A.B.R.; SPOTO, M. Fundamentos de ciência e tecnologia de alimentos. Manole, 2006.
OGAWA, M.; MAIA, E. L. Manual da Pesca: ciência e tecnologia do pescado. São Paulo: Varela, 1999, 430 p.
OLIVEIRA, D. L. Influência dos processos de lavagens e tipos de crioprotetores na produção de surimi de tilápia. 2015. 70 p. Dissertação de (Mestrado em Nutrição) – Universidade Estadual Paulista. Araçatuba. 2015.
PARK, J. W. Surimi and surimi seafood. 2 ed. New York: Marcel Dekker, 2005. 923p.
RAMÍREZ, J. A.; VELÁSQUEZ, G.; LÓPEZ-ECHEVARRIA, G; TORRES, J. A. Effect of adding insoluble solids from surimi wash water on the functional and mechanical properties of pacific whiting grade A surimi. Bioresource Technology, v. 98, p. 2148-2153, 2007.
SÃO MARTINHO, H. C. R. P. Produção de surimi e derivados em comunidade pesqueira desfavorecida do Rio de Janeiro. 2011. 57 p. Dissertação de (Mestrado em Engenharia Alimentar) – Universidade Técnica de Lisboa, Lisboa, 2011.
SARTORI, A. G. O.; AMANCIO, R. D. Pescado: importância nutricional e consumo no Brasil. Segurança Alimentar e Nutricional, Campinas, v.19, n.2, p.83-93, 2012.
SOARES, R.V. Gerenciamento de cores: fundamentos. São Paulo: SENAI-SP, 2017, 120p.
TACON, A. G. J.; METIAN, M. Fish Matters: Importance of Aquatic Foods in Human Nutrition and Global Food Supply. Reviews in Fisheries Science, v. 21, n. 1, p. 22–38, 2013.
URESTI, R. M.; LÓPEZ-ARIAS, N.; RAMÍREZ, J. A.; VÁSQUEZ, M. Effect of amidated low methoxyl pectin on the mechanical properties and colour attributes of fish mince. Food Technology and Biotechnology, v. 41, p. 131-136, 2003.
VASCONCELOS, E.L.Q.; ANDRADE, E.G.; ROCHA, M.P.S.; TAVEIRA, I.S.; INHAMUNS, A.J.; OLOVEIRA, P.R.; UCHÔA, N.M.; SOUZA, A.L. Crioprotetores na estabilidade de surimi de
Matrinxã (Brycon amazonicus Spix e Agassix 1819) sob congelamento. PUBVET. Londrina, v. 10, n. 4, p. 352-355, 2016.
VAZ, S. K. Elaboração e caracterização de linguiça fresca “tipo toscana” de tilápia (Oreochromis niloticus). 2005. 97 p. Dissertação de (Mestrado em Tecnologia de Alimentos) - Universidade Federal do Paraná, Curitiba, 2005.
VELAZQUEZ, G.; MIRANDA-LUNA, P.; LÓPEZ-ECHEVARRIA, G.; VÁSQUEZ, M.;
TORRES, J. A.; RAMÍREZ, J. A. Effect of recovered soluble proteins from pacific whiting surimi wash water on the functional and mechanical properties of alaska pollock surimi grade fa efecto de la adición de proteínas solubles recuperadas del agua de lavado de surimi de pacific whiting sobre las propiedades funcionales y mecánicas de surimi de alaska pollock grado fa. Ciencia y Tecnologia Alimentaria, v. 5, n. 5, p. 340-345, 2007.
WOZNY, D.; BEIERHOLM, U.; SHAMS, L. Human trimodal perception follows optimal statistical inference. Journal of Vision, v.8, n.3, p.1-11, 2008.
ÓRGÃO FINANCIADOR