UNIVERSIDADE DE LISBOA
FACULDADE DE CIÊNCIAS
DEPARTAMENTO DE BIOLOGIA ANIMAL
ESTUDO COMPARATIVO DAS DEFESAS QUÍMICAS DO PAR PREDADOR‐
PRESA HYPSELODORIS CANTABRICA E DYSIDEA FRAGILIS DO ESTUÁRIO DO
SADO E DA RIA FORMOSA
JOÃO FILIPE CHAVEIRO LOPES DA CRUZ
MESTRADO EM ECOLOGIA MARINHA
2009
UNIVERSIDADE DE LISBOA
FACULDADE DE CIÊNCIAS
DEPARTAMENTO DE BIOLOGIA ANIMAL
ESTUDO COMPARATIVO DAS DEFESAS QUÍMICAS DO PAR PREDADOR‐
PRESA HYPSELODORIS CANTABRICA E DYSIDEA FRAGILIS DO ESTUÁRIO DO
SADO E DA RIA FORMOSA
ORIENTADORES CIENTÍFICOS:
PROF. DR. HENRIQUE CABRAL
PROF. DR. GONÇALO CALADO
JOÃO FILIPE CHAVEIRO LOPES DA CRUZ
DISSERTAÇÃO PARA OBTENÇÃO DO GRAU DE MESTRE EM ECOLOGIA
MARINHA
2009
Índice
Agradecimentos ... ii Resumo e palavras‐chave ... iv Abstract and key‐words ... v 1. Introdução ... 1 2. Materiais e métodos ... 11 2.1. Recolha de exemplares ... 11 2.2. Extracção química ... 12 2.2.1. Extracção dos químicos de Dysidea fragilis ... 12 2.2.2. Extracção dos químicos de Hypselodoris cantabrica ... 12 2.3. Análise dos extractos ... 13 2.4. Testes de palatabilidade ... 14 2.4.1. Preparação das pellets ... 14 2.4.2. Realização dos testes de palatabilidade ... 14 3. Resultados ... 16 3.1. Concentrações naturais dos extractos brutos ... 16 3.2. Análise dos Extractos ... 16 3.2.1. TLC ... 16 3.2.2. 1H‐NMR ... 17 3.2.3. GC ... 18 3.3. Testes de palatabilidade ... 19 4. Discussão ... 21 5. Referências ... 26Agradecimentos
Este trabalho foi realizado numa parceria entre o Instituto Português de Malacologia, o INETI e a Universidade Lusófona de Humanidades e Tecnologias, no âmbito do projecto FCT PTDC/MAR/65854/2006 “Testando a hipótese de Vermeij: comparação das defesas das comunidades litorais em ilhas oceânicas e continentes”.
Em primeiro lugar quero agradecer às pessoas sem as quais esta tese seria impossível de se realizar. Assim, quero agradecer ao Prof. Dr. Gonçalo Calado, por ter acreditado e confiado no meu trabalho e me ter aberto novas portas no mundo da Ciência. Agradeço também ao Prof. Dr. Henrique Cabral, que teve uma paciência infinda para aturar um orientando desnaturado e um aluno não muito aplicado. Deixo também o meu agradecimento à Dra. Helena Gaspar, por todo o apoio e orientação na componente química do trabalho. Menos envolvido na tese, mas porque me pôs em contacto com as pessoas certas e me foi, ao longo dos anos, mostrando o que é isto de ser cientista, tenho de deixar o meu agradecimento ao Dr. Bruno Jesus (ainda me deve umas cervejas, mas fora isso…). Parte desta tese foi realizada no INETI e há várias pessoas a quem tenho de agradecer todo o tipo de auxílio no campo das químicas: Dra. Cristina Moiteiro, Dra. Maria João Curto, Eng. Ana Isabel Rodrigues e Dra. Fátima Justino. Também os doutorandos João, Miguel, Ana e Maria João foram um apoio sempre presente, para além de óptima companhia para o almoço. Seria injusto deixar de fora os estagiários do curso de Técnico de Laboratório que me acompanharam ao longo de várias semanas, a Vanda e, especialmente, ao “mano” José, a quem devo não só momentos de fortes gargalhadas como também o apoio directo na extracção e análise química dos “librânquios”. Outra parte da tese foi realizada na Universidade Lusófona e tenho de agradecer a todas as pessoas que, entre arranjando‐me espaço e garrafas de mergulho, foram gozando com os camarões em copos do Burger King: Fred Almada, Stephane, Luís, Mónica, Pedro e Joana. Deixo também o meu agradecimento à Rita Coelho, doutoranda do IPM, que contribuiu não só nos mergulhos na Ria Formosa como também na recolha bibliográfica.
Embora o trabalho desta tese tenha sido desenvolvido fora da FCUL, foram vários os professores desta casa que me foram apoiando e ensinando, especialmente nos últimos anos do curso. Assim, entre muitos, tenho de agradecer ao Prof. Ricardo Melo (não estive muito atento nas aulas de Botânica Marinha, mas foi a primeira cadeira em que tive uma amostra do
que é fazer ciência), ao Prof. Francisco Petrucci‐Fonseca (um lado mais terrestre, mas nem por isso menos divertido, da Biologia), ao Prof. Carlos Assis (sempre pronto para dois dedos de conversa e para o esclarecimento qualquer dúvida) e ao Prof. Francisco Andrade.
Tenho também de agradecer aos meus colegas de curso, particularmente áquelas mais ou menos 20 pessoas e à única suazi que conheço, pelo apoio linguístico. Mais do que colegas, tenho que destacar os Pastores Tigaz, Mika, Fox e Johns, pela força e incentivo que sempre me deram, mas também (e especialmente) pelas futeboladas, noites de copos, guitarradas, palhaçadas, nhecus e teorias do comportamento de animais muito… peculiares. Não falar da meia‐leca da Vânia seria ridículo, portanto já está!
Poderia ter feito o curso sem a Repro2000? Podia, mas não era a mesma coisa! Por isso, agradeço ao Zé Manel, à Paula e, claro, à Tia Mena, pelos pedidos fora de horas realizados em tempos impossíveis, pelas horas de descontracção passadas à conversa e por uma ou outra cerveja paga no Mocho. Fora da faculdade, são muitas as pessoas que “estiveram lá”, sempre. E porque esta é uma palavra que significa muito, Shalom: Cláudia, Carlos, Sérgio, Ana, Joe, Janito Pina, David, Tony, Cátia, Kinder, Zézinha, Fi, Lígia, Marta, João de SDR, Coelhinho e, claro, Vítor e Afonso. Ainda nesta listagem, tenho de agradecer ao Bugs, pelo apoio logístico “não‐oficial” do Burger King.
A minha família, a quem roubei muito do pouco tempo que tínhamos, merece aquele agradecimento. Para além do suporte financeiro, são o suporte humano. Sem vocês ao meu lado não seria quem sou hoje. Obrigado, muito obrigado, Mãe, Pai, Pedro e Nuno! Os meus avós, tios e primos, também têm de figurar nesta lista. E claro, os tios Nuno e Isabel, por terem contribuído de uma forma tão importante para o meu trabalho.
Resumo e palavras‐chave
No decurso da evolução dos opistobrânquios houve uma progressiva perda da concha que obrigou à aquisição de novas estratégias defensivas, entre as quais o recurso a defesas químicas. A maioria dessas estratégias passa pela utilização de compostos tóxicos ou dissuasores, em muitos casos obtidos através da dieta, bastante específica. O nudibrânquio Hypselodoris cantabrica retém e acumula metabolitos secundários dissuasores (furanosesquiterpenos) existentes na sua presa, a esponja Dysidea fragilis. Neste trabalho comparou‐se as defesas químicas deste par predador presa de duas regiões portuguesas: Setúbal e Ria Formosa. Para tal, recolheram‐se exemplares de esponjas e nudibrânquios de ambas as áreas, dos quais foram extraídos e analisados os compostos defensivos, tendo sido depois realizados testes de palatabilidade com os extractos obtidos. Nas duas espécies observou‐se alguma variedade na concentração dos extractos brutos obtidos, tendo revelado os nudibrânquios uma maior concentração, que pode ser resultado de acumularem progressivamente os compostos e/ou da esponja ter emitido fluidos com compostos dissuasores quando recolhida. Verificou‐se que os furanosesquiterpenos existentes nos nudibrânquios estavam também presentes nas esponjas, o que comprovou a sua origem alimentar. Concluiu‐se haver diferenças regionais nos compostos maioritários identificados nos nudibrânquios e nas esponjas. Os exemplares de H. cantabrica provenientes de Setúbal apresentaram dois compostos maioritários e nos de D. fragilis, apenas um estava em maior concentração, inferindo‐se assim uma retenção selectiva dos compostos pelo nudibrânquio. Os testes de palatabilidade não revelaram diferenças significativas na capacidade dissuasora, na comparação entre áreas geográficas, quer entre extractos de esponjas quer entre extractos de nudibrânquios. Nas comparações predador‐presa, os testes de palatabilidade revelaram uma maior actividade dissuasora dos extractos dos nudibrânquios, conseguindo taxas de rejeição significativas a concentrações inferiores às necessárias para os extractos de esponja obterem o mesmo efeito. Assim conclui‐se que o predador está quimicamente mais protegido que a sua presa, da qual obtém as defesas.
Palavras‐chave – Defesas químicas, dissuasão, testes de palatabilidade, Hypselodoris cantabrica, Dysidea fragilis.
Abstract and key‐words
As they evolved, opistobranchs underwent progressive shell loss, which made it necessary for them to acquire new defensive strategies, such as chemical defenses. The majority of these strategies consist in using toxic or deterrent compounds, mostly obtained through their diet which is very specific. The nudibranch Hypselodoris cantabrica retains and accumulates deterrent secondary metabolites (furanosesquiterpenes) which are present in its prey, the sponge Dysidea fragilis. In this study, the chemical defenses of this predator and its prey were compared in two Portuguese regions: Setúbal and Ria Formosa. Sponge and nudibranch specimens were collected from both areas. Their defensive compounds were extracted and analyzed and then utilized in palatability tests. Some variability in the concentration of the obtained brute extracts was observed in both species. The nudibranchs revealed a larger concentration, which could be due to a progressive accumulation of the compounds and/or as a result of the sponges having expelled fluids containing deterrent compounds when collected. The furanosesquiterpenes in the nudibranchs were also found to be present in the sponges,
which confirmed their dietary origin. There were regional differences between the main compounds identified in the nudibranchs and sponges. The H. cantabrica specimens from Setúbal displayed two main compounds whilst the D. fragilis specimens displayed only one, which could be indicative of a selective retention of the compounds by the nudibranchs. The palatability tests did not reveal significant differences in the deterrent capacity neither between sponge extracts nor between nudibranch extracts from different regions. In the predator‐prey comparisons, the palatability tests revealed a more effective deterrent activity in the nudibranchs’ extracts, having obtained significative rejection rates at lower concentrations than necessary for the sponge extracts to have the same effect. Thus, it was concluded that the predator is chemically better protected than its prey, from which it obtains its defenses. Key‐words: Chemical defenses, deterrence, palatability tests, Hypselodoris cantabrica, Dysidea fragilis.
1.
Introdução
A enorme variedade de formas de vida encontrada na Natureza é, desde há muito, motivo de reflexão. Há 150 anos, Darwin abalou o mundo ao afirmar que tal variedade poderia ser explicada através de um processo evolutivo por ele denominado Selecção Natural [1]. Se esta teoria abalou o mundo, revolucionou por completo a Biologia.
Alguns autores consideram a relação predador‐presa como um dos factores mais importantes na Selecção Natural e, por conseguinte, na evolução das espécies. Vermeij, por exemplo, definiu esta relação como uma arms race [2], uma dinâmica corrida ao armamento em que presas e predadores co‐evoluem, surgindo novas formas (espécies) de presas mais protegidas e novas formas (espécies) de predadores mais armados. Esta corrida ao armamento é notória na evolução dos opistobrânquios.
Ao contrário da maioria dos gastrópodes, na generalidade dos opistobrânquios a concha é reduzida, interna ou mesmo ausente [3]. Tal característica, associada à lentidão de movimentos, deu às espécies desta sub‐classe (calcula‐se que sejam entre 5000 e 6000 [3]) o nome de lesmas do mar. A perda da concha, que deverá ter ocorrido independentemente em diversas linhagens de opistobrânquios [4], foi um passo evolutivo que trouxe diversas vantagens a estes animais: maior facilidade de locomoção [3, 5]; maior facilidade na exploração e procura de alimento em novos habitats [3]; possibilidade de evolução de novas estruturas físicas, processos fisiológicos e comportamentos [3]; eliminação do custo energético necessário ao desenvolvimento da concha [5]. Contudo, há uma enorme, e óbvia, desvantagem associada à perda da concha: perda de defesas e consequente aumento provável da predação. Faulkner e Ghiselin (1983) analisaram esta situação de um ponto de vista económico, em termos de perdas e ganhos, e concluíram que os benefícios do desaparecimento da concha seriam maximizados se se encontrassem formas de defesa alternativas menos dispendiosas [5]. Tais alternativas devem ter sido encontradas, já que são poucos os predadores de opistobrânquios conhecidos [6].
Assim, desprovidos de concha (em parte ou na totalidade), os opistobrânquios desenvolveram um variado leque de estratégias defensivas para as quais Ros (1977) propôs uma classificação [7]. Contudo, o próprio autor refere que esta divisão visa apenas facilitar a compreensão dos diversos mecanismos defensivos porque, como se verá, os animais não utilizam apenas uma estratégia defensiva. As estratégias defensivas dos opistobrânquios foram então classificadas, por este autor, em: estruturais, comportamentais, cleptodefesas (do grego kleptos – roubar) e químicas [7].
As estratégias estruturais consideram a utilização de elementos anatómicos dos animais, como conchas vestigiais, existência de espículas calcárias dorsais, autotomatismo ou coloração (críptica ou de aviso)[7].
As estratégias comportamentais passam, por exemplo, por situações de fuga ou evitamento de predadores, anacorese ou anacorese trófica (quando o animal se esconde no próprio alimento), comportamentos deimáticos (com o objectivo de assustar potenciais predadores), exibição individual (normalmente de órgãos protegidos física ou quimicamente) ou defesa agressiva [7].
As cleptodefesas, como o nome indica, são defesas roubadas. É o caso das defesas de alguns nudibrânquios da família Aeolidiidae, que adoptaram uma estratégia única entre os animais : o armazenamento de cnidócitos funcionais, provenientes dos cnidários de que se alimentam [8]. Outros opistobrânquios adquirem pigmentos das suas presas, o que permite que se camuflem nelas (homocromia). Um caso que vale a pena referir é o de alguns opistobrânquios da ordem Sacoglossa, como Elysia chlorotica que, além da cor ganham também os mecanismos de produção de energia da alga de que se alimentam, uma vez que retêm os cloroplastos, perfeitamente funcionais, no seu organismo [9].
As defesas químicas, que como cerne deste trabalho serão apresentadas em maior detalhe, são estudadas em opistobrânquios desde 1960, altura em que Thompson verificou a secreção de ácido sulfúrico e ácido clorídrico por alguns destes animais quando perturbados
[10]. Contudo, a maioria dos químicos de defesa de opistobrânquios são dissuasores e/ou
tóxicos [11]. Os compostos tóxicos “atacam” directamente os predadores, provocando mal‐ estar ou mesmo morte, ao passo que os compostos dissuasores indicam que o animal é não‐ palatável, isto é, tem um sabor desagradável. Claro que, como frisaram Faulkner e Ghiselin (1983), as defesas não são igualmente eficientes contra todos os predadores e podem ser sempre superadas por especialistas [5].
Existem dois tipos de testes para verificar a capacidade anti‐predatória dos químicos isolados dos opistobrânquios, que podem ser realizados em laboratório ou no campo: ictiotoxicidade e palatabilidade [12]. Nos primeiros, os compostos são lançados na água, por vezes com um solvente orgânico (como a acetona), e observa‐se as consequências nos peixes. Os segundos consistem normalmente na apresentação a potenciais predadores de comidas preparadas em laboratório com ou sem compostos extraídos dos organismos em estudo, tentando perceber se há diferenças na aceitação de controlos e tratamentos.
As defesas químicas, consideradas como a força motriz da evolução dos opistobrânquios [13], estão presentes em vários grupos de lesmas do mar, inclusivamente na
ordem Cephalaspidea [14], cujas espécies mantêm uma concha reduzida (disco cefálico). Este facto parece indicar que o desenvolvimento das defesas químicas foi pré‐adaptativo, ou seja, ter‐se‐á iniciado antes da perda da concha [5].
Sabe‐se que grande parte dos produtos químicos de defesa são metabolitos secundários. Estes são derivados de metabolitos primários e não estão envolvidos na manutenção básica do indivíduo [15]. Os metabolitos secundários podem ser divididos em alomonas (quando em interacção com outras espécies beneficiam o produtor – metabolitos de defesa, por exemplo), cairomonas (pelo contrário, beneficiam o receptor – em situações de mutualismo, por exemplo) e feromonas (comunicação inter‐específica – reprodução e desenvolvimento) [16]. Foi Burreson, em 1975, o primeiro a caracterizar uma alomona num nudibrânquio, Phyllidia varicosa [17].
A maioria dos metabolitos secundários utilizados pelos opistobrânquios pertencem ao grupo dos terpenos e provêm da sua dieta [11], sendo que nalguns casos os compostos são bio‐ transformados, o que acontece no nudibrânquio Hypselodoris orsini [18]. Na perspectiva económica de Faulkner e Ghiselin (1983), o uso de químicos provenientes da dieta permite uma protecção sem gastos na produção, com custos apenas no armazenamento e mobilização
[5]. Os mesmos autores defendem que os metabolitos derivados da alimentação devem ser :
retidos selectivamente, com os compostos mais eficientes a serem acumulados e os menos válidos descartados; distribuídos no corpo de maneira a maximizar o efeito; mobilizados quando necessário (por exemplo, excretados quando o predador ataca); eficientes perante predadores [5].
Menos frequente é a biossíntese de metabolitos pelos próprios opistobrânquios (chamada biossíntese de novo), fenómeno provado por Cimino et al. (1983) ao estudarem um composto segregado pelo nudibrânquio Dendrodoris limbata [19]. Tendo isto em conta, Cimino e Ghiselin (2001) propuseram um “cenário de elaboração gradual de metabolitos” para os opistobrânquios [15]. Para se alimentarem de organismos com elevadas concentrações de alomonas, os opistobrânquios tiveram de desenvolver métodos de excreção ou destoxificação, visto que os metabolitos secundários provenientes da dieta seriam nocivos ao seu organismo, o que levou a uma especialização alimentar. O passo seguinte terá sido então utilizar esses compostos para defesa (o que se encaixa numa estratégia de cleptodefesa). No entanto, a especialização alimentar e a necessidade dos compostos para fins defensivos levou a uma dependência de determinado tipo de presas. A solução evolutiva para este problema terá sido a biossíntese de metabolitos de novo [15, 20]. Portanto, a evolução dos opistobrânquios pode ser considerada como uma radiação adaptativa [15]: as espécies
ancestrais alimentar‐se‐iam de um grupo estrito de presas com defesas químicas, que se foi alargando à medida que os opistobrânquios se diversificaram, tornando‐se predadores especializados [15]. Os nudibrânquios doridáceos são um óptimo exemplo disso mesmo.
A maioria dos doridáceos são espongívoros [13, 21] e, para além de alimento, encontraram nas suas presas uma fonte de metabolitos defensivos [5, 11, 13], sendo os mais abundantes os diterpenos e os furanosesquiterpenos [11], compostos que estão relacionados com os químicos dissuasores encontrados em plantas para fazer face aos insectos [22].
É importante realçar que as esponjas têm poucos predadores e que, em águas temperadas, os mais relevantes são, além de opistobrânquios, equinodermes e alguns pequenos crustáceos, que ainda assim não influenciam grandemente a estrutura das comunidades [23]. Essa diminuta predação dever‐se‐á em grande parte às capacidades defensivas físicas (espículas) e químicas (metabolitos secundários) das esponjas. Segundo Faulkner e Ghiselin (1983), há uma relação directa entre a perda de espículas e o aumento de metabolitos secundários nos Porífera [5]. O aparecimento dos metabolitos secundários nas esponjas pode ter surgido inicialmente para impedir o estabelecimento de organismos epífitos e parasitas, acabando por revelar um também um papel defensivo [15]. Como tal, os opistobrânquios que se alimentavam de esponjas tiveram de se adaptar, arranjando novas formas de contornar as defesas das suas presas [5]. Com base nisto, Faulkner e Ghiselin (1983) sugeriram que tenha existido uma evolução paralela entre esponjas e os opistobrânquios que exercem predação sobre elas, tendo as esponjas perdido as espículas e os opistobrânquios as conchas [5]. Assim teria havido uma alteração na corrida ao armamento, passando das defesas estruturais para as defesas químicas [24]. Também Cimino e Ghiselin (1999) destacaram a relevância desta relação predador‐presa, considerando haver uma correlação entre a filogenia das esponjas e a dos nudibrânquios que delas se alimentam [13].
Os doridáceos (e as suas presas) têm sido, portanto, um grupo muito estudado no que respeita às suas defesas químicas [24], especialmente os pertencentes à família Chromodorididae. Thompson (1960), dividiu os opistobrânquios entre os que se esforçavam por passar despercebidos e os que pareciam não se preocupar com isso [6], que é o caso desta família que, como o nome indica, se destaca pela sua coloração. Mesmo possuindo defesas químicas, a maioria dos opistobrânquios são também crípticos [5] e muitos dos que pelos padrões de coloração nos parecem conspícuos estão, no seu meio, em homocromia [7, 25]. Contudo, há opistobrânquios que são, efectivamente, conspícuos, como é o caso destes nudibrânquios. Como é evidente, cores conspícuas despertam a atenção de predadores, o que só se torna uma vantagem se o predador associar as cores a algo que lhe desagrade [26]. A este
tipo de utilização de cores é dado o nome de aposematismo (do grego apo – afastar e semat – sinal). Nas espécies aposemática as defesas tiveram de ser, provavelmente, desenvolvidas antes dos padrões conspícuos de cores [25], o que as coloca num ramo mais recente na filogenia dos opistobrânquios. De acordo com Edmunds (1987), para uma espécie ser considerada aposemática terá de ser suficientemente nociva, ter cor conspícua, ser evitada por predadores e a sua coloração terá de conferir maior protecção ao indivíduo ou aos seus genes que outra cor (críptica)[4]. No entanto, para um predador evitar uma presa terá de saber que ela lhe é nociva ou desagradável, a não ser que o animal evite determinados padrões de cores de forma inata. Contudo, para tal acontecer é necessário um longo processo evolutivo [25] pelo que, na maioria dos casos, o predador terá de aprender a evitar as presas. Claro que esta aprendizagem poderá provocar danos graves ou mesmo morte dos indivíduos predados. Por este motivo, a evolução do aposematismo nos nudibrânquios é uma questão que tem suscitado o interesse de muitos autores. A teoria mais aceite prende‐se com o chamado mimetismo Mulleriano [11, 25, 26]: diferentes espécies não‐palatáveis desenvolvem aparências semelhantes, dividindo assim o custo relacionado com a aprendizagem dos predadores [27]. De entre os cromodorídeos que parecem apresentar este tipo de mimetismo, estão as espécies atlânticas do género Hypselodoris, que constituem um círculo mimético de animais de cor azul com bordo do manto e manchas dorsais amarelas [7].
No Atlântico nordeste, é possível encontrar 6 espécies de Hypselodoris: H. bilineata, H. cantabrica, H. fontandraui, H. picta, H. tricolor e H. villafranca. A figura 1 mostra bem a semelhança dos padrões de coloração destes animais. Contudo, não é apenas na cor que estes animais se assemelham, também recorrem aos mesmos químicos defensivos e de maneira semelhante.
Figura 1 – Hypselodoris do Atlântico Nordeste. A – H. bilineata*; B – H. cantabrica; C – H. fontandraui*; D – H. tricolor*; E – H. picta*; F – H. villafranca*. * ‐ fotografias obtidas em www.seaslugforum.net
Nos Hypselodoris spp., a maioria dos metabolitos secundários existentes são furanosesquiterpenos com capacidade dissuasora [11, 15] que são, normalmente, armazenados em glândulas dérmicas distribuídas no bordo do manto a que se dá o nome de mantal dermal formations (MDF) [28, 29]. As MDF (figura 2) são estruturas globulares de tonalidade branca opaca que estão embebidas no tecido conectivo subepidermal e são constituídas por células vacuolares largas [30]. Figura 2 – MDF posteriores de H. cantabrica (indicados com a seta). Apesar de internos, estes órgãos são visíveis devido à transparência do manto.
Uma vez que as MDF são órgãos internos e não abrem para o manto [29], o efeito dissuasor das substâncias que acumula só se faz sentir quando o predador morde o nudibrânquio e rompe as glândulas [30]. A distribuição das MDF é, portanto, essencial para a sobrevivência dos Hypselodoris. Assim, as MDF estão posicionadas em torno de áreas vitais para o organismo na parte anterior (protegendo a cabeça e os rinóforos) e na parte posterior do indivíduo (salvaguardando as brânquias). A distribuição e o número de MDF varia de espécie para espécie (estando mesmo ausentes em H. fontandraui), sendo que algumas apenas os possuem na região posterior do corpo [29]. H. cantabrica Bouchet e Ortea, 1980, o predador do par estudado neste trabalho, possui 7 MDF na região posterior do corpo e entre 3 e 4 na região anterior [30], conforme se pode ver na figura 3. A disposição das MDF no bordo do manto e a cor amarela deste não são coincidência e está relacionada com o aspecto aposemático. Em experiências com cromodorídeos de outro género, Glossodoris, cujo bordo do manto também se destaca do resto do corpo, concluiu‐se que os peixes apresentam mais atracção por um nudibrânquio sem bordo do manto do que por um com bordo do manto mas sem MDF [31].
Figura 3 – Esquema representativo da distribuição das MDF em H. cantabrica. a – rinóforos; b – brânquias; c – MDF. Adaptado de Garcia‐Gomez et al. (1990) [30].
Embora no manto destes nudibrânquios os furanosesquiterpenos só se encontrem nas MDF, Avila et al. (1991) identificaram‐nos também no muco segregado por Hypselodoris picta e H. villafranca quando perturbados [32]. Assim, se apesar da sua coloração aposemática (primeira linha de defesa [33]) os predadores se aproximassem destes animais seria segregado um muco repelente (segunda linha de defesa) e se ainda assim os predadores mordessem os indivíduos, rebentariam as MDF que libertariam directamente na sua boca compostos não‐ palatáveis (terceira linha de defesa)[32].
Os compostos dissuasores utilizados pelos nudibrânquios Hypselodoris spp. são provenientes das suas presas, esponjas pertencentes ao género Dysidea, normalmente ricas em furanosesquiterpenos [11]. Contudo, em laboratório, Fontana et al. (1994) verificaram que H. picta também se alimentava de esponjas Pleraplysilla spinifera, igualmente ricas no mesmo tipo de compostos. Estes dados apoiam a hipótese de Cimino e Sodano (1994), de que a especialização alimentar dos nudibrânquios pode ser relativa e estar mais relacionada com a disponibilidade dos compostos necessários à sua defesa do que da existência de determinada espécie [12]. Porém, fora do laboratório, só se verificou o consumo de espécies de Dysidea sp., D. avara e D. fragilis. Esta última é tida como a presa de H. cantabrica [11, 21] e é um dos objectos de estudo deste trabalho, merecendo por isso destaque.
Dysidea fragilis (Montagu, 1818) (figura 4) é uma esponja de superfície conulosa, coberta por uma camada fina de pinacócitos e que possui fibras frágeis de espongina enroladas em torno de resíduos externos (como areia, por exemplo) [34].
Figura 4 – Dysidea fragilis
Marin et al. (1998), verificaram que esta esponja emite um fluido defensivo esbranquiçado quando perturbada, que é composto maioritariamente por células esféricas com numerosas vesículas [34]. Estas células apresentam um complexo de Golgi e um retículo endoplasmático rugoso bastante desenvolvidos, indicadores de produção e armazenamento de materiais para secreção. Estes autores confirmaram a existência de furanosesquiterpenos unicamente nessas células, sugerindo estarem aí compartimentados, e testaram‐nos positivamente quanto à sua capacidade dissuasora [34].
Como noutras esponjas, existe uma variação geográfica dos compostos químicos de Dysidea fragilis, sendo que esponjas de diferentes zonas apresentam diferentes tipos de furanosesquiterpenos, como verificada por Molinski (1988) [35]. Como tal, é natural que também consoante a área em que se encontram haja uma variação nos compostos dos nudibrânquios que as sobre elas exercem predação. Fontana et al. (1993) verificaram esse fenómeno em H. cantabrica de duas zonas do mar Cantábrico [36]. Do mesmo modo, diferentes espécies de Hypselodoris que se alimentem da mesma esponja apresentam os mesmos compostos [32] embora os possam apresentar em proporções diferentes [36].
Não é por mera curiosidade científica que tem havido tanto interesse pelas defesas químicas dos nudibrânquios e das suas presas, mas pelas possíveis aplicações dos compostos químicos descobertos. Estima‐se que 80% dos fármacos actualmente utilizados são ou têm por base produtos naturais, a maioria deles de origem terrestre, já que, fruto do desenvolvimento tecnológico (especialmente no campo do mergulho) só na segunda metade do século XX houve capacidade para uma maior e melhor exploração do meio marinho [37]. Os produtos daí obtidos têm grandes potencialidades de aplicação no campo da medicina, mas também da cosmética
[38] e da indústria (por exemplo, a actividade anti‐incrustante de compostos de Dysidea spp. [39]). A revisão feita por Blunt et al. (2009) [40] permite perceber que desde a década de setenta
se tem registado um aumento muito significativo na descoberta de novos compostos derivados de produtos marinhos (figura 5). . Figura 5 ‐ Média de compostos descobertos por ano entre 1965 e 2007. O período entre 1965 e 2005 está agrupado de 5 em 5 anos. Adaptado de Blunt et al. 2009[40]
Os mesmos autores indicaram também que o Atlântico oriental tem sido das zonas menos produtivas no que concerne à identificação de novos compostos e que os animais pertencentes ao filo Porífera têm sido a maior fonte de produtos naturais. Já os moluscos, dentre os quais os opistobrânquios são o grupo quimicamente mais estudado [41], são neste aspecto menos relevantes. Contudo, é conveniente referir que um dos mais poderosos compostos anti‐cancerígenos conhecidos é a dolastatina‐10, composto isolado do opistobrânquio Dolabella auricularia, muito embora, como todos os outros produtos de origem marinha, ainda não tenha passado a fase de ensaios clínicos [42]. Nas esponjas da ordem Dysidea têm também sido encontrados compostos bioactivos com potencialidade terapêutica, como o furanosesquiterpeno avarol (proveniente de D. avara) que tem propriedades anti‐ tumorais [43].
As defesas químicas do par predador‐presa Hypselodoris cantabrica e Dysidea fragilis nunca foram comparadas. Será então objectivo deste estudo fazê‐lo, usando para tal exemplares do estuário do Sado e da Ria Formosa, duas áreas da costa portuguesa. Procurar‐ se‐á perceber se há diferenças ao nível da capacidade dissuasora entre predador e presa e se esta é afectada por possíveis variações geográficas de compostos defensivos. Isto será feito testando a palatabilidade dos extractos brutos, sendo que em Hypselodoris cantabrica, até agora, só foram testados compostos puros [36].
Tendo em conta a literatura, exemplares de Hypselodoris cantabrica e Dysidea fragilis da costa portuguesa nunca foram analisados do ponto de vista químico. Assim, considerando‐
se a variação geográfica dos compostos e a pouca exploração química do Atlântico Oriental, este tipo de investigação, mesmo que direccionada para a ecologia, poderá abrir novas perspectivas num futuro próximo.
2. Materiais e métodos
2.1. Recolha de exemplares
Para a realização deste estudo foram recolhidos exemplares do nudibrânquio Hypselodoris cantabrica e da esponja Dysidea fragilis, entre os 5 e os 9 metros de profundidade, em mergulho com escafandro autónomo. As recolhas foram feitas entre Abril e Junho (época de reprodução e, consequentemente, de maior proliferação de nudibrânquios) de 2009, na embocadura da Ria Formosa, junto à Ilha do Farol (36°58’N 7°52’W), e na embocadura do estuário do Sado, na rampa da Secil (38°30’N 8°55’W). Em ambas as áreas existe um forte movimento de correntes, o que faz delas zonas propícias a organismos filtradores, como as esponjas.
Procurou‐se, sempre que possível, capturar pares predador‐presa (ou grupos predador‐ presa, quando havia mais que um predador a alimentar‐se da mesma presa), ou seja, nudibrânquios e as esponjas de que se estivessem a alimentar. Os animais recolhidos foram mantidos em água do mar até serem congelados em laboratório. De modo a facilitar os procedimentos de extracção, os exemplares de Hypselodoris cantabrica foram congelados em água do mar, evitando assim uma reacção de stress que levaria não só a uma libertação de muco, possivelmente com químicos dissuasores como também a um enrolamento do animal. Na rampa da Secil (Fig. 6A) recolheram‐se 4 grupos predador‐presa, num total de 4 exemplares de Dysidea fragilis e 8 exemplares de Hypselodoris cantabrica.
Na Ria Formosa foram recolhidos 11 grupos predador‐presa (Fig.6B), num total de 11 exemplares de Dysidea fragilis e 14 exemplares de Hypselodoris cantabrica. Foram ainda capturados 11 nudibrânquios sem esponja associada. Figura 6 – Pares predador‐presa H. cantabrica e D. fragilis de Setúbal (A) e da Ria Formosa (B).
2.2. Extracção química
2.2.1. Extracção dos químicos de Dysidea fragilis
Em laboratório, mediu‐se a massa e volume de cada um dos exemplares de Dysidea fragilis, após se ter retirado os organismos epífitos existentes.
Cada esponja foi depois cortada em pedaços e submersa em acetona, para ser exposta a ultra‐sons durante 10 minutos, sendo o extracto de acetona filtrado para um balão após este período de tempo. Este procedimento foi repetido 2 vezes para cada exemplar.
A solução final obtida, o extracto de acetona de cada uma das esponjas, foi levada ao evaporador rotativo, a uma temperatura de 30ºC, até ser evaporada toda a acetona e na solução restar apenas, para além dos químicos, a água existente na esponja. Uma vez que os compostos em estudo são muito voláteis e facilmente degradáveis, não era plausível evaporar a água, pelo que foi então adicionado éter etílico para extrair os compostos químicos em solução. Porque o éter etílico é imiscível com a água, da sua adição resultou a formação de duas fases (a fase aquosa e a fase de éter), tendo sido estas separadas por extracção líquido/líquido. De seguida, a fase de éter foi ainda filtrada por uma pipeta com algodão e sulfato de magnésio anidro, para garantir a remoção da água. Após este procedimento, evaporou‐se o éter, obtendo‐se desta forma o extracto bruto da esponja, cuja massa foi medida, de forma a calcular‐se a concentração natural (massa/volume) do extracto. Através do teste de Mann‐Whitney, e considerando‐se um nível de significância de 0,05, testou‐se a existência de diferenças significativas nas concentrações naturais obtidas das amostras dos dois locais de estudo.
2.2.2. Extracção dos químicos de Hypselodoris cantabrica
Uma vez que os químicos de defesa do nudibrânquio Hypselodoris cantabrica se encontram essencialmente no manto, destacou‐se este órgão dos animais congelados (figura 7), tendo sido medido a sua massa e volume.
Todo o procedimento de extracção subsequente, bem como os cálculos da concentração natural e a aferição de diferenças significativas, foi análogo ao realizado para os exemplares de Dysidea fragilis.
Figura 7 – Parte exterior (A) e interior (B) do manto de Hypselodoris cantabrica.
2.3. Análise dos extractos
Para todos os extractos obtidos, foram efectuadas cromatografias de camada fina (TLC – thin layer chromatography) e cromatografias gasosas (GC – gasose cromatography). Realizaram‐se ainda espectros de ressonância magnética nuclear de protão (1HNMR – nuclear magnetic resonance) para alguns extractos de D. fragilis e H. cantabrica.
As TLC realizaram‐se dissolvendo‐se os extractos em acetona e utilizando como eluentes éter de petróleo (menos polar) e uma mistura de éter de petróleo e éter etílico na razão de 1:1 (mais polar). Foram usadas placas de TLC de alumínio com sílica‐gel Merck 60 F254.
Após a eluição, as placas de TLC foram visualizadas por irradiação de luz U.V. (λ=254 nm) e reveladas por pulverização de 4‐dimetilaminobenzaldaído em ácido clorídrico concentrado e etanol (reagente de Ehrlich)[44] seguida de aquecimento numa placa a 100 °C. Esta técnica de revelação permite identificar a presença de compostos que tenham na sua estrutura anéis furano pelo aparecimento nas placas de manchas de cor rosa e/ou azulada.
Os cromatogramas de GC foram obtidos através dum aparelho GC Agilent Technologies série 7683‐B [68]. Os extractos foram dissolvidos em n‐hexano e preparados a concentrações de 1 mgmL‐1 e 3 mgmL‐1. Foi utilizada uma coluna DB‐1 (30 m x 0,32 mm; 0,25 µm de espessura de filme), com um fluxo de hélio de 1 mLmin‐1. O programa de temperatura do forno consistiu em 5 minutos a 70 °C, subindo depois 5 °Cmin‐1 até aos 150 °C onde se mantinha 5 minutos antes de se iniciar nova subida (15 °Cmin‐1) até chegar aos 320 °C, patamar em que ficava durante 20 minutos. A temperatura no detector e no injector foi de 320 °C.
Os espectros de 1H‐NMR foram registados num espectrofotómetro Bruker AMX 300, que opera a 300 MHz para protão. O solvente utilizado foi o benzeno e como padrão interno utilizou‐se o tetrametilsilano.
2.4. Testes de palatabilidade 2.4.1. Preparação das pellets
Para realizar os testes de palatabilidade adaptou‐se o protocolo de Mollo et al. (2008)[45].
Neste trabalho, as comidas de teste (pellets) foram preparadas utilizando‐se 10 mg de manto de lula liofilizado, 6 mg de alginato (para gelificar a comida) e 6 mg de areia do mar purificada com tamanho do grão entre 0,1 mm e 0,3 mm (para que a pellet não flutuasse quando apresentada aos animais). A esta mistura era adicionado o extracto químico, dissolvido em acetona, na quantidade necessária para a concentração final desejada. Esta mistura era, em seguida, levada a um exsicador, de modo a evaporar a acetona. Acrescentava‐se depois uma gota de corante alimentar vermelho (para facilitar a identificação do consumo das pellets) e água destilada de modo a perfazer um volume final de 0,2 mL. A solução obtida era homogeneizada e, seguidamente, colocada numa seringa de 1,0 mL. O conteúdo da seringa era então despejado, como um fio, para uma solução de cloreto de cálcio 0,25 M, na qual ficava banhado durante dois minutos, para enrijecer (figura 8). Eram depois cortadas 10 pellets de aproximadamente 0,4 cm cada. A comida de controlo foi preparada do mesmo modo, mas colocando‐se acetona pura, em vez do extracto químico dos animais. Figura 8 – Preparação de pellets. A comida “fabricada” é despejada para uma solução de CaCl2 para enrijecer. 2.4.2. Realização dos testes de palatabilidade Para a realização dos testes de palatabilidade, foram capturados camarões da espécie Palaemon elegans, na zona intermareal do Cabo Raso (38º42’31’’N 9º22’10’’W). Estes
camarões foram mantidos em laboratório, individualizados em copos com 300mL de água do mar. Para se habituarem à comida artificial (numa tentativa de reduzir enviesamentos de resultados), após um dia de jejum foi‐lhes apresentada, uma vez por dia durante 3 dias, uma pellet semelhante às utilizadas como controlo. Os testes foram realizados ao quarto dia. Para cada teste foram escolhidos aleatoriamente 10 camarões, que funcionaram como replicados, aos quais era apresentada uma pellet. Considerou‐se como aceitação do alimento o consumo total da pellet ao fim de um período máximo de 30 minutos (figura 9). As diferenças no consumo das pellets nas experiências foram avaliadas através do teste do Qui‐quadrado, considerando‐se um nível de significância de 0,05.
As concentrações dos extractos das esponjas utilizadas nos testes foram definidas em função das concentrações naturais obtidas. Assim, para os testes realizados com o extracto bruto dos exemplares de Dysidea fragilis de Setúbal, foram utilizadas concentrações de 0,5 mgmL‐1, 2,0 mgmL‐1, 4,0 mgmL‐1, 6,0 mgmL‐1, 8,6 mgmL‐1 e 10,0 mgmL‐1, as mesmas utilizadas para os extractos da esponja da Ria Formosa, exceptuando 0,5 mgmL‐1. Os extractos dos exemplares de Hypselodoris cantabrica da Ria Formosa e de Setúbal foram testados a concentrações de 0,3 mgmL‐1, 0,5 mgmL‐1, 1,0 mgmL‐1, 1,5 mgmL‐1 e 2,0 mgmL‐1.
Com base nos resultados obtidos, foram construídas rectas de regressão para a relação entre a concentração dos extractos e a taxa de rejeição das pellets, tendo sido para tal logaritmizados os valores da concentração, utilizando log10 (concentração+1). As diferenças
entre as rectas de regressão foram testadas com recurso ao teste t de Student para comparação de declives de recta [46], com um nível de significância de 0,05. Figura 9 – Camarão que não consumiu (A) e que consumiu (B) a comida apresentada. A coloração das pellets possibilitou uma percepção mais simples de quais os animais que as ingeriam, pela cor vermelha na base do cefalotórax.
3. Resultados
3.1. Concentrações naturais dos extractos brutos
Os exemplares de Dysidea fragilis recolhidos em Setúbal apresentaram concentrações entre os 0,48 mgmL‐1 e os 8,60 mgmL‐1 e uma média de 3,86 mgmL‐1. Já para as esponjas algarvias obtiveram‐se valores entre 1,45 mgmL‐1 e 6,10 mgmL‐1, com uma média de 2,87 mgmL‐1 (Fig. 10 A).
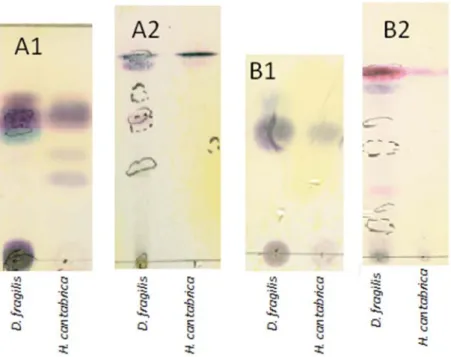
Para os nudibrânquios, a amplitude de valores de concentração foi maior. Os exemplares recolhidos na rampa da Secil apresentaram concentrações de extracto bruto entre os 9,50 mgmL‐1 e os 42,00 mgmL‐1, com uma média de 22,07 mgmL‐1, enquanto para os da Ria Formosa foram calculados valores entre os 8,70 mgmL‐1 e os 74,00 mgmL‐1, com uma média de 34,28 mgmL‐1 (figura 10 B). Na comparação entre as concentrações naturais de extractos brutos das amostras de Setúbal e da Ria Formosa, não foram encontradas diferenças significativas quer entre as esponjas quer entre os nudibrânquios (U=16, p >0,05, U=66, p >0,05). Figura 10 – Boxplot das concentrações naturais dos extractos brutos das amostras de Dysidea fragilis (A) e Hypselodoris cantabrica (B). 3.2. Análise dos Extractos 3.2.1. TLC A revelação das placas de TLC com reagente de Ehrlich, permitiu identificar a existência de compostos com anéis furano em todos os extractos de esponjas e nudibrânquios.
Nas TLC dos extractos dos animais eluídas em éter de petróleo, as esponjas apresentaram manchas inexistentes nos nudibrânquios (figura 11 A1, 11 B1). Em todas as TLC eluídas com a solução de éter de petróleo e éter etílico (1:1) (figura 11 A2, 11 B2), verificou‐se nas esponjas também um maior número de manchas que nos nudibrânquios, o que indica uma maior diversidade de compostos furanosesquiterpenos. Com este eluente, mais polar, foram também detectados compostos por irradiação de luz U.V., mas apenas nas esponjas. Figura 11 – TLC de extractos brutos de Dysidea fragilis e Hypselodoris cantabrica de Setúbal (A) e da Ria Formosa (B), reveladas com reagente de Ehrlich e eluídas em éter de petróleo (A1 e B1) e em éter de petróleo e éter etílico 1:1 (A2 e B2). Os tracejados indicam compostos visualizados por irradiação de luz U.V. (λ=240 nm). 3.2.2. 1H‐NMR
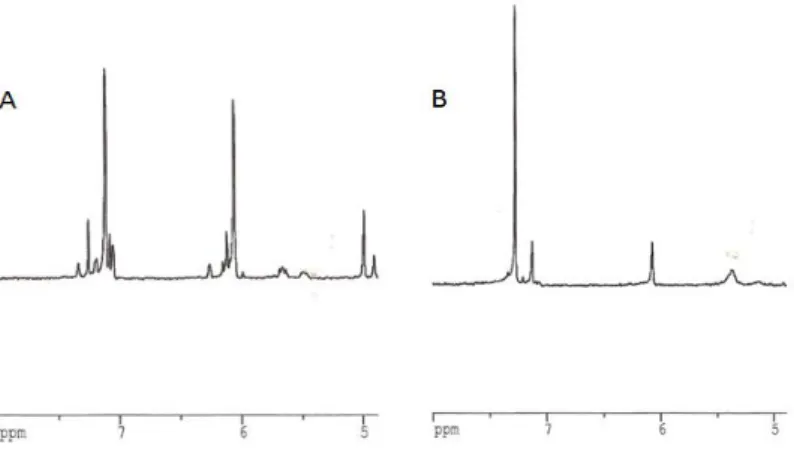
Foi possível identificar, para os extractos químicos de D. fragilis e H. cantabrica, um conjunto de sinais no espectro de ressonância magnética nuclear entre 5,5 e 7,5 ppm, atribuíveis a diferentes compostos furanosesquiterpenos, já que esta zona do espectro é característica dos protões de anéis furano. No entanto, não foi possível, com base na literatura identificar qualquer composto. Na figura 12 é possível observar‐se os espectros de 1HNMR de uma esponja (fig. 12 A) e de um nudibrânquio (fig. 12 B), ambos da Ria Formosa.
Figura 12 – Espectros de 1HNMR de Dysidea fragilis (A) e Hypselodoris cantabrica (B) da Ria Formosa. Os sinais entre 5,5 e 7,5 ppm são característicos de furanosesquiterpenos.
3.2.3. GC
A realização de cromatografias gasosas permitiu perceber a existência de vários compostos nas esponjas e nudibrânquios (identificados através de picos nos cromatogramas) correspondentes aos furanosesquiterpenos detectados nas TLC.
Todos os exemplares de Dysidea fragilis da rampa da Secil apresentaram cromatogramas semelhantes (figura 13 A1), estando o composto com tempo de retenção de ≈28,4 minutos (composto A) presente em maior concentração (composto maioritário).
No que concerne aos GC das esponjas da Ria Formosa, dois exemplares perderam os compostos ao longo do processo de extracção e 3 exemplares apresentaram cromatogramas com diferentes compostos maioritários. Todos os outros espécimes apresentaram cromatogramas semelhantes e com o composto com tempo de retenção ≈27,0 minutos (composto B) como composto maioritário (Figura 13 B1).
À excepção de um exemplar, os nudibrânquios recolhidos em Setúbal apresentaram cromatogramas semelhantes, com dois compostos maioritários, o composto A e o composto B (Figura 13 A2).
Dos exemplares de Hypselodoris cantabrica da Ria Formosa apenas dois não apresentaram cromatogramas com o composto B como composto maioritário, tendo todos os outros cromatogramas semelhantes (figura 13 B2).
É relevante referir que, embora não maioritário, o composto A também foi encontrado nas esponjas e nudibrânquios da Ria Formosa. De igual modo, os extractos de Dysidea fragilis de Setúbal também continham o composto B.
Na análise dos cromatogramas de GC, não foram encontrados compostos nos nudibrânquios que não tivessem correspondência nas esponjas. Como a figura 13 permite
verificar, nudibrânquios e esponjas apresentaram picos no GC em regiões semelhantes (embora com intensidades diferentes), o que permite perceber a existência dos mesmos compostos furanosesquiterpenos em H. cantabrica e D. fragilis, embora em diferentes percentagens relativas. Figura 13 – Cromatogramas de GC de Dysidea fragilis (A1 e B1) e de Hypselodoris cantabrica (A2 e B2) de Setúbal (A) e da Ria Formosa (B). 3.3. Testes de palatabilidade
Para todos os extractos testados, a um aumento da sua concentração nas pellets correspondeu um aumento da rejeição das mesmas por parte dos camarões.
No que concerne aos testes efectuados com o extracto bruto de Dysidea fragilis de Setúbal, registou‐se uma rejeição significativa para concentrações a partir dos 4 mgmL‐1
(χ2=0,0191, p <0,05), sendo que foi obtida uma taxa de rejeição de 100% para uma concentração de 10 mgmL‐1.
Nos testes realizados com o extracto bruto de esponjas recolhidas na Ria Formosa obteve‐se resultados significativos para concentrações a partir dos 6 mgmL‐1 (χ2=0,0003, p <0,05), sendo que com uma concentração de 8 mgmL‐1 se obteve uma rejeição total da comida de teste.
Ao testar‐se os extractos provenientes dos nudibrânquios de Setúbal, obteve‐se taxas de rejeição significativas para concentrações desde 0,5 mgmL‐1 (χ2=0,0191, p <0,05), sendo que se obteve uma rejeição total com uma concentração de 2,0 mgmL‐1.
O teste de extractos brutos de H. cantabrica da Ria Formosa revelou também uma rejeição significativa das pellets para concentrações a partir dos 0,5 mgmL‐1 (χ2=0,0062, p <0,05), obtendo‐se uma rejeição total ao apresentar‐se pellets com extracto numa concentração de 1,5 mgmL‐1.
As curvas‐resposta da figura 14 traduzem o efeito dissuasor de diferentes concentrações dos extractos de Dysidea fragilis e Hypselodoris cantabrica de ambas as regiões de recolha.
Figura 14 ‐ Curva‐resposta do efeito dissuasor dos extractos brutos de D. fragilis (A) e H. cantabrica (B) de Setúbal e da Ria Formosa em Palaemon elegans. Dez camarões aleatoriamente escolhidos foram testados para cada concentração. Diferenças entre o controlo (concentração do extracto = 0) e tratamentos foram testadas com recurso ao teste do Qui‐quadrado e estão assinaladas por pontos (• P < 0,05).
Através da aplicação do teste t de Student para identificar diferenças nos declives das rectas de regressão dos testes de palatabilidade, concluiu‐se não existir diferenças significativas nem entre esponjas nem entre nudibrânquios de Setúbal e da Ria Formosa (t=‐ 0,57, p> 0,05; t=‐1,43, p> 0,05).
4. Discussão
Antes de se avançar na discussão deste trabalho, alguns aspectos metodológicos merecem ser considerados.
O primeiro prende‐se com o tamanho da amostragem. O número de amostras das duas áreas foi muito díspar, tendo sido recolhidos mais exemplares de esponjas e, especialmente, de nudibrânquios no Algarve do que em Setúbal. Isso deveu‐se, em parte, à grande abundância de D. fragilis e, consequentemente, do seu predador H. cantabrica, na embocadura da Ria Formosa. Nos mergulhos aí efectuados não foi sequer encontrada qualquer outra espécie de porífero. Já em Setúbal, a abundância do par predador‐presa era muito baixa, tendo sido até encontradas outras esponjas, como Cliona celata. Porém, os exemplares de Hypselodoris de Setúbal eram maiores e a quantidade extracto bruto obtido era também maior. Isto está de acordo com Fontana et al. (1993), que sugeriram haver uma relação directa entre a quantidade de metabolitos e o tamanho do animal [36], uma vez que o nudibrânquio vai progressivamente acumulando mais compostos. Assim, para se obter massa de extractos suficiente para o trabalho, foi necessário recolher‐se mais indivíduos do Algarve.
Será também importante referir o porquê de se ter extraído o manto dos Hypselodoris. Extrair a totalidade do organismo não faria muito sentido, já que o manto é a área mais exposta aos predadores e é nele que se encontram os furanosesquiterpenos dissuasores. Contudo, como foi referido na introdução deste trabalho, estes encontram‐se armazenados em locais específicos no bordo do manto: as MDF. No entanto, destacar de Hypselodoris cantabrica congelados o bordo do manto ou as MDF sem serem danificados e sem perder compostos é uma tarefa complicada, daí que se tenha optado por fazer a extracção de todo o manto, conservando‐se os compostos.
No que concerne à análise química, convém referir que os resultados não foram inteiramente homogéneos, ou seja, nem todos os extractos apresentaram os mesmos compostos maioritários. Contudo, esses desvios foram muito pontuais e por isso, e porque a massa desses extractos era bastante reduzida, não foram considerados nos testes de palatabilidade.
Há também algumas considerações a fazer aos testes de palatabilidade. A metodologia seguida neste projecto foi uma adaptação da utilizada por Mollo et al. (2008)
[45]que, por sua vez, foi baseada no trabalho de Pawlik et al. (1995) [47]. A principal alteração
ser reduzido uma vez que, após os 3 dias de jejum propostos por Mollo et al., os camarões tornavam‐se bastante vorazes, comendo imediatamente todo o controlo. Ora, uma das preocupações nestes testes era precisamente que houvesse alguma rejeição (baixa) da comida de controlo. Não se pretendia que a comida fosse demasiado boa nem que os camarões tivessem demasiada fome, por forma a que o potencial efeito dissuasor dos extractos não fosse mascarado.
Como complemento a estes testes, poderiam ter sido realizados testes no habitat dos organismos em estudo, apresentando‐se a comida tratada a predadores (conhecidos ou potenciais) dos animais. No entanto, este tipo de experimentação exige mais tempo e uma logística mais complexa, para além de que, no Atlântico Nordeste, não há muitos predadores de nudibrânquios e esponjas conhecidos [6, 7, 23]. Embora este tipo de testes não seja necessariamente melhor que os testes de laboratório, poderão ser, contudo, um complemento no desenvolvimento futuro deste estudo.
O predador utilizado nos testes, Palaemon elegans, é um predador generalista (que se sabe poder comer moluscos) de fácil recolha e manutenção em laboratório, exigindo uma logística mais simples que, por exemplo, peixes. Embora não haja relatos deste animal exercer predação sobre nudibrânquios, sabe‐se que os crustáceos são dos seus poucos predadores [48] e que, em águas temperadas, são também dos poucos animais a alimentarem‐se de esponjas
[23]. De qualquer forma, para este trabalho não interessava utilizar um animal especializado
nestes nudibrânquios ou nas esponjas, uma vez que conseguiria contornar as suas defesas químicas.
Ainda em relação aos testes de palatabilidade, é importante justificar a escolha dos valores de concentração para os testes com os extractos de nudibrânquios. Testes preliminares com as concentrações naturais mais baixas resultaram em rejeição total das pellets. Foi‐se testando concentrações cada vez mais reduzidas, de modo a conseguir obter‐se, nalgum ponto, alguma aceitação das pellets. Tal só foi alcançado com concentrações de 1,5 mgmL‐1 para os extractos de H. cantabrica de Setúbal e 1 mgmL‐1 para os extractos dos opistobrânquios provenientes da Ria Formosa, que representam menos de 20% das concentrações mínimas naturais calculadas.
No cerne deste trabalho estava a comparação das defesas químicas do par predador‐ presa Hypselodoris cantabrica e Dysidea fragilis. A análise química dos extractos destes animais comprovou a existência de compostos furanosesquiterpenos, descritos na literatura como os compostos dissuasores característicos destas espécies [34, 36]. A análise por GC e TLC
confirmou que os compostos detectados nos extractos dos nudibrânquios se encontram presentes também na esponja, de onde se comprova a proveniência alimentar das defesas químicas de Hypselodoris cantabrica, conforme referido por outros autores [11]. Estas metodologias permitiram também detectar uma maior diversidade de compostos nas esponjas, o que parece sugerir uma retenção selectiva de compostos.
Verificou‐se que os extractos brutos existiam em maior concentração nos nudibrânquios do que nas esponjas, o que parece ser um indicador de uma maior capacidade defensiva dos predadores que, progressivamente, acumulam compostos nas MDF à medida que se alimentam de D. fragilis [28, 30]. Contudo, de acordo com alguns autores, a esponja em estudo liberta um fluido com compostos dissuasores quando perturbada [34]. Assim, durante o processo de recolha das esponjas, é possível que tenha sido emitido algum fluido, o que iria diminuir a concentração do extracto destes animais. Porém, não é possível aferir em que quantidade os químicos terão sido libertados, nem tão pouco se tal fenómeno ocorreu, já que tal não foi evidente nos mergulhos de recolha. As diferenças na concentração do extracto bruto têm por isso de ser consideradas com reserva quando utilizadas como indicador de uma maior capacidade dissuasora dos nudibrânquios.
No entanto, os testes de palatabilidade confirmaram que os extractos dos nudibrânquios são mais dissuasores que os extractos das esponjas, já que se obtiveram rejeições significativas com concentrações bastante inferiores. Ora, sendo os furanosesquiterpenos detectados em H. cantabrica idênticos (e provenientes) aos detectados em D. fragilis, como se explica esta maior capacidade dissuasora? Provavelmente, dada a capacidade do nudibrânquio de reter metabolitos selectivamente, os compostos dissuasores maioritários estão em maior concentração em H. cantabrica do que em D. fragilis. Porém, para comprovar esta teoria será necessário quantificar os compostos existentes nos extractos. É necessário ter também em conta o maior número de compostos existentes nas esponjas e a possibilidade de haver interacções entre eles que diminuam a capacidade dissuasora.
Ecologicamente, o facto de H. cantabrica estar melhor protegido que D. fragilis deverá significar uma maior pressão predatória sobre os nudibrânquios (pelo menos nalgum momento da sua história evolutiva). Estudos com esponjas [49] e nudibrânquios [50] em que foram testados alimentos de diferente valor energético com os mesmos químicos defensivos, parecem indicar que a baixa qualidade nutricional pode funcionar com um factor de dissuasão. Uriz et al. (1996), comparando duas esponjas simpátricas quimicamente defendidas, concluiu que a de maior valor energético estava mais protegida [51]. Assim, o menor valor nutricional de
![Figura 3 – Esquema representativo da distribuição das MDF em H. cantabrica. a – rinóforos; b – brânquias; c – MDF. Adaptado de Garcia‐Gomez et al. (1990) [30] .](https://thumb-eu.123doks.com/thumbv2/123dok_br/19214339.959737/14.892.131.622.137.248/figura-esquema-representativo-distribuição-cantabrica-rinóforos-brânquias-adaptado.webp)