Isabel Soares I.pdf
Texto
Imagem

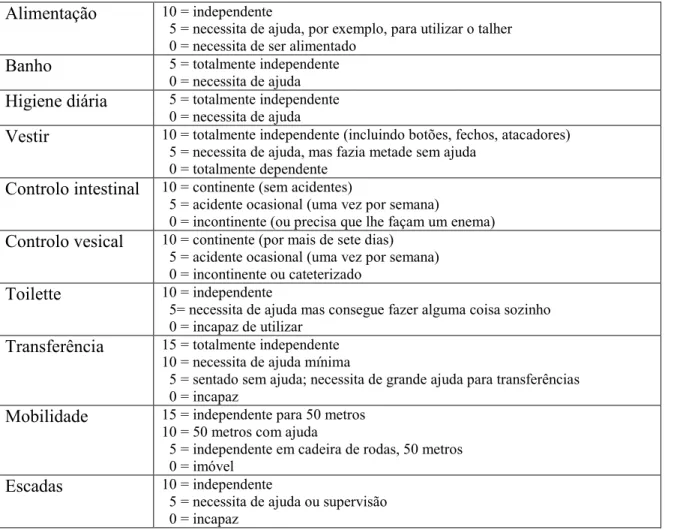
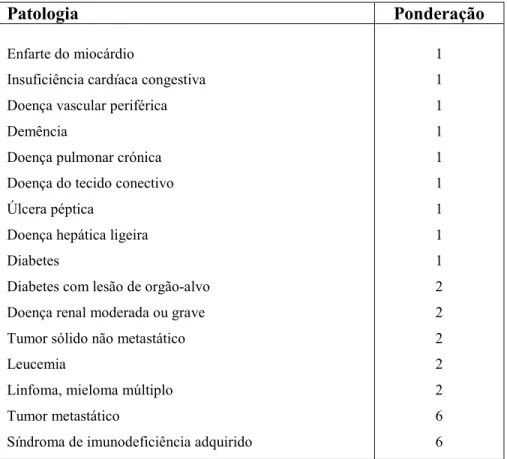
Outline
Documentos relacionados
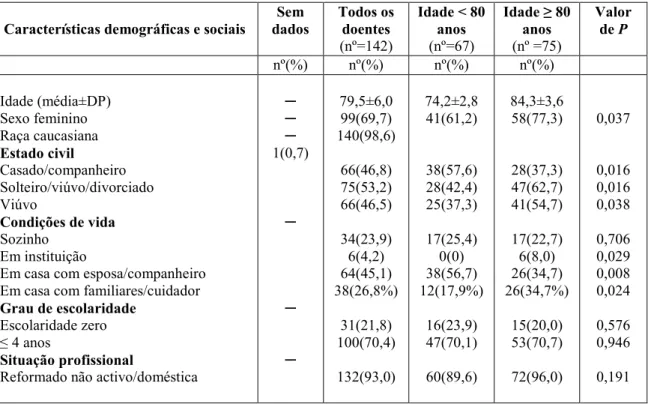
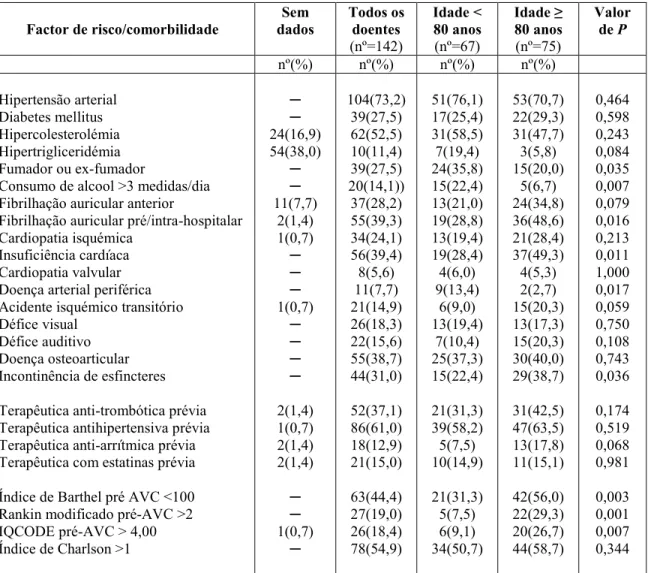
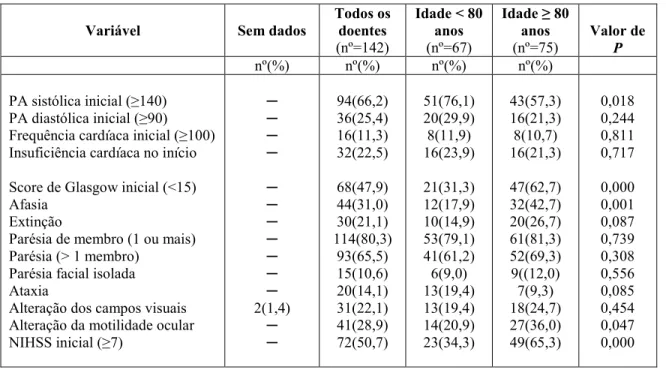
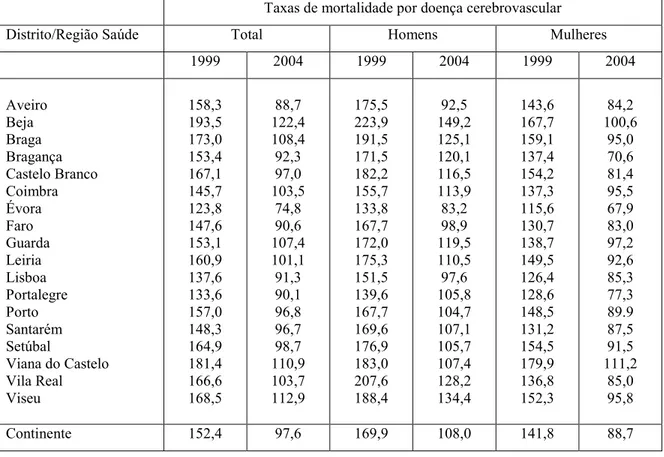
Naquela época, assim como agora, o longo processo implicava numa variedade de providências, perícias e participantes: promoção da causa, levantamento de fundos,
Nessa situação temos claramente a relação de tecnovívio apresentado por Dubatti (2012) operando, visto que nessa experiência ambos os atores tra- çam um diálogo que não se dá
O presente edital tem por objeto a seleção de expositores para participarem da 2ª Feira do Livro de Mondaí, na utilização de Box durante a feira do livro em espaço público,
robustus by having ground of body yellow or yellowish brown, absence of any red iridescence on flank, dorsal-fin ground colouration yellow to yellowish brown and anal fin with
esta espécie foi encontrada em borda de mata ciliar, savana graminosa, savana parque e área de transição mata ciliar e savana.. Observações: Esta espécie ocorre
O valor da reputação dos pseudônimos é igual a 0,8 devido aos fal- sos positivos do mecanismo auxiliar, que acabam por fazer com que a reputação mesmo dos usuários que enviam
4 RESULTADOS E ANÁLISE A proposta de organização para as práticas de EA no município de Novo Hamburgo/RS, por meio do Coletivo Educador Ambiental desenvolvido pela Secretaria
Altera dispositivos do Projeto Pedagógico do Curso Superior em Tecnologia em Gestão Pública, modalidade de Educação a Distância, da UNICENTRO, Campus Santa Cruz e