1
UNIVERSIDADE FEDERAL DA PARAÍBA CENTRO DE CIÊNCIAS EXATAS E DA NATUREZA
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA CELULAR E MOLECULAR
EMANUELLE BATISTA FELISMINO DA SILVA
EFEITOS DE FUROCUMARINAS ASSOCIADAS À LUZ ULTRAVIOLETA B
(312 nm) EM STAPHYLOCOCCUS AUREUS
João pessoa – PB 2013
2
UNIVERSIDADE FEDERAL DA PARAÍBA CENTRO DE CIÊNCIAS EXATAS E DA NATUREZA
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA CELULAR E MOLECULAR
EMANUELLE BATISTA FELISMINO DA SILVA
EFEITOS DE FUROCUMARINAS ASSOCIADAS À LUZ ULTRAVIOLETA B
(312 nm) EM STAPHYLOCOCCUS AUREUS
Dissertação de mestrado apresentada ao programa de Pós-Graduação em Biologia Celular e Molecular da Universidade Federal da Paraíba, como parte integrante dos pré-requisitos para obtenção do título de Mestre em Biologia Celular e Molecular.
Orientador: Prof. Dr. José Pinto de Siqueira Júnior
João pessoa – PB 2013
3
Pós Graduação em Biologia Celular e Molecular
Centro de Ciências Exatas e da Natureza ǀ Universidade Federal da Paraíba Cidade Universitária – João Pessoa – PB – Brasil – CEP 58051-900 Telefone: (83) 32167407 – Fax: (83) 32167787 – e-mail: pgbcm@dbm.ufpb.br
Emanuelle Batista Felismino da Silva
Dissertação de Mestrado avaliada em ___/___/_____
BANCA EXAMINADORA
Prof. Dr. José Pinto de Siqueira Júnior
Programa de Pós-Graduação em Biologia Celular e Molecular - UFPB Orientador
Prof. Dr. Ideltônio José Feitosa Barbosa Graduação em Ciências Biológicas - UFPB
Examinador/a Externo/a
Profa. Dra. Naila Francis Paulo de Oliveira
Programa de Pós-Graduação em Biologia Celular e Molecular - UFPB Examinador/a Interno/a
Profa. Dra. Edeltrudes de Oliveira Lima
Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos - UFPB Suplente
4
“Penso noventa e nove vezes e nada descubro; deixo de pensar, mergulho em profundo silêncio
–e eis que a verdade se me revela” (Albert Einstein)
5
Dedico a Deus, aos meus pais Aldecina e Manoel, ao meu irmão Emerson e ao meu
querido Aldemir.
6
AGRADECIMENTOS
Ao Prof. Dr. José Pinto de Siqueira Júnior, pelo incentivo e confiança com que nos orientou, e pelos conselhos e explicações que foram muito importantes para a execução desta pesquisa;
Ao professor Humberto Medeiros Barreto (UFPI) pelo auxílio imprescindível prestado para conclusão deste trabalho;
A banca examinadora nas pessoas do Prof. Dr. Ideltônio José Feitosa Barbosa, Profa. Dra. Naila Francis Paulo de Oliveira e Profa. Dra. Edeltrudes de Oliveira Lima, pela disponibilidade e enriquecimento deste trabalho;
Aos Professores do PPBCM pelos ensinamentos prestados ao longo do curso; A secretária do PPBCM, Ludmilla Maul, pelo incentivo e convívio amigo;
Aos Funcionários do Departamento de Biologia Molecular, em especial a Severina Ramos e Antônio Bosco Carlos pela amizade e disposição de sempre ajudar;
Aos colegas do Laboratório de Genética de Microorganismos, pelo convívio amigo, pelos momentos alegres e apoio constante;
A Jocelmo do LABID pela disposição de compartilhar seus conhecimentos comigo quando precisei;
Aos meus colegas de turma pela amizade construída ao longo do curso, nossas brincadeiras e conversas;
Ao CNPq pelo apoio financeiro prestado durante todo o desenvolvimento desse trabalho e a CAPES pela bolsa;
A todos que direta ou indiretamente contribuíram para a realização deste trabalho.
7
RESUMO
As furocumarinas (FCs) são uma importante classe de compostos fotoativos que potencialmente podem se ligar ao DNA formando complexos intermoleculares, e uma vez excitados por luz UVA (~365 nm) são capazes de formar fotoadições, que podem resultar em mutagênese e letalidade. Porém, quando a 8-metoxipsoraleína (8-MOP) está adicionada ao meio de plaqueamento pós-irradiação aumenta a sensibilidade provavelmente por inibir reparo de lesões no DNA. As FCs também possuem efeito protetor contra UVC (~254 nm) atribuído à inibição da formação de dímeros de pirimidina. As FCs associadas à UVB (312 nm) permanecem pouco conhecidas. O objetivo do presente estudo foi investigar o efeito da luz UVB, e combinada com soluções de 8-MOP, 4,5’,8 -trimetilpsoraleína (TMP) e 3-carbetoxipsoraleína (3-CPs) em diferentes concentrações, sobre o crescimento de Staphylococcus aureus. Avaliamos também o efeito destas FCs em meio de
plaqueamento. O tratamento com 8-MOP-UVB e TMP-UVB foram mais eficazes em induzir letalidade do que o tratamento apenas com UVB. O aumento da concentração de 8-MOP resultou em mortalidade mais elevada enquanto que o aumento na concentração de TMP levou a redução na mortalidade. Por outro lado, 3-CPs exibiu efeito fotoprotetor contra danos causados por UVB em todas as concentrações testadas. Os resultados com FCs no meio de plaqueamento mostraram que a 8-MOP induziu o maior efeito letal e também aumentou a mortalidade da cepa bacteriana tratada por FC-UVB. Os diferentes efeitos apresentados pelas FCs podem estar relacionados com diferenças na especificidade por seqüência de ligação e fotorreação, a inibição da formação de dímeros de pirimidina por moléculas intercaladas e eficácia de sistemas de reparo. Esses resultados reforçam a necessidade de mais estudos para elucidar a participação das FCs como agentes fotossensibilizantes e fotoprotetores em sistemas biológicos, quando combinadas com UVB.
PALAVRAS-CHAVE: Furocumarinas; 8-metoxipsoraleína; 4,5’,8-trimetilpsoraleína;
3-carbetoxipsoraleína; UVB; S. aureus.
8
ABSTRACT
Furocoumarins (FCs) are an important class of photoactive compounds which may potentially
bind to DNA forming intermolecular complexes, and once excited by UVA light (~ 365 nm) they’re
able to form photoadducts, which may result in mutagenicity and lethality. However, when the 8-methoxypsoralen (8-MOP) is added to the post-irradiation plating medium increases the sensitization probably by inhibiting repairs in damaged DNA. The FCs also have a protective effect against UVC (~254 nm) attributed to the inhibition of pyrimidine dimers. FCs associated with UVB light (312 nm), remain few known. The aim of the present study was to investigate the lethal effect of UVB light alone, and combined with solutions of 8-MOP, 4,5',8-trimethylpsoralen (TMP) and 3-carbetoxypsoralen (3-CPs) at different concentrations on Staphylococcus aureus growth. We also
evaluated the effect of these FCs in the plating medium. Treatment with 8-MOP-UVB and TMP-UVB were more effective in inducing lethality than the UVB treatment alone. Increasing the solution concentration of 8-MOP resulted in a higher mortality while the increase in the concentration of the TMP led to a reduction in the lethality. For other hand, 3-CPs displayed a photoprotective effect against UVB damage in all concentrations tested. The results of FCs in the plating medium showed that the 8-MOP induzed a higher lethal effect and also increased mortality from bacterial strain treated by FC-UVB. The different behaviors shown by FCs may be related with differences in the sequence specificity of binding and photoreaction, inhibition of pyrimidine dimers formation by intercalated molecules and efficacy of repair systems. These results emphasize the need for further studies to elucidate the participation of FCs as photosensitizing and photoprotective agents in biological systems, when combined with UVB.
KEY-WORDS: Furocoumarin; 8-methoxypsoralen; 4,5’,8-trimetilpsoralen;
3-carbethoxypsoralen; UVB; S. aureus.
9
LISTA DE FIGURAS
10
LISTA DE GRÁFICOS
Gráfico 1. Curvas de sobrevivência obtidas após tratamento da cepa ISP255 com diferentes concentrações de 8-MOP (mM, millimolar) em diferentes tempos de exposição à luz UVB de 312 nm (seg, segundos) ... 34 Gráfico 2. Curvas de sobrevivência obtidas após tratamento da cepa ISP255 com diferentes concentrações de TMP (mM, millimolar) em diferentes tempos de exposição à luz UVB de 312 nm (seg, segundos) ... 35 Gráfico 3. Curvas de sobrevivência obtidas após tratamento da cepa ISP255 com diferentes concentrações de 3-CPs (mM, millimolar) em diferentes tempos de exposição à luz UVB de 312 nm (seg, segundos) ... 35 Gráfico 4. Curvas de sobrevivência obtidas após tratamento da cepa ISP255 com diferentes tempos de exposição à luz UVB de 312 nm (seg, segundos) e plaqueamento em meio de cultura com e sem FCs: 8-MOP; TMP ou 3-CPs ... 38 Gráfico 5. Curvas de sobrevivência obtidas após tratamento da cepa ISP255 com 8-MOP, TMP ou 3-CPs em diferentes tempos de exposição à luz UVB de 312 nm (seg, segundos) e plaqueamento em meio de cultura com e sem 8-MOP ... 39
11
LISTA DE ABREVIATURAS
ANG _ Angelicina BA _ Biadições
BAB _ Blood Agar Base
BER _ Base Excision Repair (Reparo por Excisão de Base) BHI _ Brain Hearth Infusion
CAT _ Catalase
3-CPs _ 3-Carbetoxipsoraleína
CPD _ Cyclobutane Pyrimidine Dimer (Dímero de Pirimidina Ciclobutano) 5,7-DMC _ 5,7-Dimetoxicumarina
DSB _ Double Strand Break (Quebra de Dupla Fita) FC _ Furocumarina
H2O2_ Peróxido de hidrogênio MA _ Monoadições
5-MOP _ 5-Metoxipsoraleína 8-MOP _ 8-Metoxipsoraleína mM _ millimolar
NER _ Nucleotide Excision Repair (Reparo por Excisão de Nucleotídeo) ¹O2 _ Oxigênio Singlete
O2•_ Ânion superóxido •OH _ Radical hidroxila
8-oxodGuo _ 8-Oxo-7,8-dihidro-2´deoxiguanosine
6-4PPs _ Pyrimidine 6-4 Pyrimidone Photoproducts (Fotoprodutos de 6-4 Pirimidina Pirimidona)
PUVA _ Psoraleína-UVA
ROS _ Reactive Oxygen Species (Espécies Reativas de Oxigênio) S1 _ estado excitado Singlete
seg _ segundos
SOD _ Superóxido dimutase T1 _ estado excitado Triplete TMP _ 4,5,8-Trimetilpsoraleína ufc _ unidade formadora de colônia
UV _ Ultraviolet Radiation (Radição Ultravioleta)
12
SUMÁRIO
1. INTRODUÇÃO ... 2. OBJETIVOS ...
2.1 Objetivo Geral ... 2.2 Objetivos Específicos ... 3. FUNDAMENTAÇÃO TEÓRICA ... 3.1 Radiação Ultravioleta ... 3.1.1 Reparo de Danos da Radiação Ultravioleta no DNA ... 3.2 Furocumarinas ... 3.2.1 Fotoquímica das Furocumarinas ... 3.2.2 Efeito Fotodinâmico ... 3.2.3 Adições de Furocumarinas no DNA ... 3.2.4 Adições de Furocumarinas e seu reparo ... 3.2.5 Efeito Fotoprotetor da Furocumarina ... 3.2.6 Furocumarina em Meio de Plaqueamento Pós-Irradiação ... 3.2.7 Potencial Terapêutico da Furocumarina ... 4. MATERIAIS E MÉTODOS ... 4.1 Linhagem Bacteriana ... 4.2 Meios de Cultivo ... 4.3 Soluções de Furocumarinas ... 4.4 Tratamento com Furocumarina e UVB ... 4.5 Plaqueamento Pós-Irradiação e Determinação da Sobrevivência ... 4.6 Análise Estatística ... 5. RESULTADOS E DISCUSSÃO ...
13
1. INTRODUÇÃO
As furocumarinas (FCs) são compostos tricíclicos, naturais ou sintéticos, formados pela fusão linear (psoraleína) ou angular (isopsoraleína) de um anel furano com a cumarina (1,2-benzopirona) e representam uma importante classe de compostos fotoativos. FCs naturais têm sido isoladas de representantes de pelo menos cinco famílias de plantas, Leguminosae, Umbelliferae, Rutaceae, Moraceae e Orchidaceae, e de microrganismos, incluindo fungos (SCOTT et al., 1976; ARABZADEH et al., 2002).
As FCs, na presença de radição ultravioleta A (UVA) causam letalidade e uma série de outros efeitos biológicos devido a sua (foto)reatividade com o DNA e outras macromoléculas e componentes celulares (SCOTT et al., 1976; AVERBECK, 1989; BARRETO e SIQUEIRA-JUNIOR, 1998). Na ausência de luz, DNA e FC formam complexos intermoleculares através da intercalação deste composto entre os pares de bases do DNA, após UVA, FC liga-se a uma base pirimídica, formando monoadição (MA), a FC pode se ligar a uma segunda base pirimídica localizada na fita oposta e formar biadição (BA) (KITAMURA et al., 2005). Efeitos letais mutagênicos e recombinogênicos têm sido atribuídos primordialmente à formação de BA, no entanto, certas FCs, sob UVA, podem ainda fotoinduzir danos oxidativos no DNA (DE MOL et al., 1981). Já foi também reportado que as FC, sob UVA, podem induzir a formação de biadições DNA-proteina (BORDIN et al., 1993).
Pelo fato de, uma vez excitadas, poderem reagir fotoquimicamente com uma ampla variedade de biomoléculas, as FCs são amplamente utilizadas como sondas moleculares no estudo da estrutura e função de ácidos nucléicos “in situ” (CIMINO et al.,1985; KITAMURA et al., 2005) e como drogas na fotoquimioterapia de certas doenças de pele, como vitiligo e psoríase (GIA et al.,1992; VEDALDI et al.,1992).
A associação FC-UVA tem sido empregada no estudo de mutação, recombinação e reparo de DNA em vírus, bactérias e microrganismos eucarióticos (SCOTT et al., 1976; AVERBECK, 1989). Por outro lado, os efeitos de FC em combinação com a UVC têm sido bem menos estudados. Igali et al. (1970) evidenciaram que tratamento por 8MOP
(8-EFEITOS DE FUROCUMARINAS ASSOCIADAS A UVB (312 nm) EM S. AUREUS
14
Metoxipsoraleína) e UVC reduzia o aparecimento de mutantes auxotróficos em E. coli. Bridges (1971), Hass e Webb (1979) mostraram que o pré-tratamento com 8-MOP protege as células de E. coli contra os efeitos letais da UVC, um efeito similar àquele que já era conhecido para os corantes de acridina. No trabalho pioneiro de Bridges (1971), foi também relatado que, da mesma forma que a acriflavina, o 8-MOP também aumenta a sensibilidade à UVC quando presente no meio de plaqueamento pós-irradiação (BRIDGES e MOTTERSHEAD, 1979). Muito tempo depois, tais efeitos fotobiológicos de FCs começaram a ser relatados em Staphylococcus aureus (BARROS e SIQUEIRA-JUNIOR, 2002; BARRETO e SIQUEIRA-JUNIOR, 2006).
Mesmo assim, comparando com outros microrganismos, tais como: Escherichiacoli e Saccharomyces cerevisiae, estudos sobre efeitos biológicos de FCs são escassos e pouco documentados em S. aureus, o que motiva e justifica a continuidade de estudos sobre essa importante bactéria patogênica.
Além disso, o nosso envolvimento, especificamente, com o estudo de propriedades fotobiológicas de FCs que vão além de sua capacidade fotossensibilizante (BARROS e SIQUEIRA-JUNIOR, 2002; BARRETO e SIQUEIRA-JUNIOR, 2006), está a resgatar um importante campo de estudo que não tem merecido a devida atenção na literatura científica internacional.
15
2. OBJETIVO
2.1 Objetivo Geral
O presente trabalho visa investigar os efeitos biológicos de furocumarinas associados à UV em S. aureus e suas propriedades fotobiológicas.
2.2 Objetivos Específicos
Avaliar o efeito de furocumarinas mono e bifuncionais em associação com a luz UVB (312nm) em S. aureus;
Investigar a influência da variação na concentração das soluções de furocumarinas na sobrevivência de S. aureus, na presença de luz UVB (312nm);
Avaliar o efeito das furocumarinas no meio de plaqueamento após irradiação com UVB (312nm).
EFEITOS DE FUROCUMARINAS ASSOCIADAS A UVB (312 nm) EM S. AUREUS
16
3. FUNDAMENTAÇÃO TEÓRICA
3.1 Radiação Ultravioleta
Em todos os grupos de radiação ultravioleta (UV), isto é, UVA (400-315 nm), UVB (315-280 nm) e UVC (280-100 nm), a UVB produz efeitos adversos sobre diversos habitats, embora a maior parte seja absorvida pelo ozônio estratosférico e a UVC é quantitativamente absorvida pelo oxigênio e o ozônio na atmosfera da Terra, portanto, não ocasiona efeitos nocivos na biota (MCKENZIE et al., 2003).
Um dos mais proeminentes alvos da radiação solar é o DNA celular. A radiação UVA tem uma baixa eficiência na indução de danos no DNA. Ela é capaz de gerar principalmente espécies reativas de oxigênio (ROS), como radicais reativos de ânions superóxido (O2•),
peróxido de hidrogênio (H2O2), radical hidroxila (•OH) e o oxigênio singlete (¹O2), que podem
danificar o DNA através de reações indiretas de fotossensibilização (ALSCHER et al., 1997; MUELA et al., 2002). Certas enzimas, como superóxido dimutase (SOD), catalase (CAT) e peroxidases são consideradas como a primeira linha de defesa das células contra ROS. SOD converte ânions superóxido em H2O2, CAT e as peroxidases convertem o H2O2 em água
(APEL e HIRT, 2004; DANTUR e PIZARRO, 2004; CADET et al., 2005; SANTOS et al., 2012).
Embora a UVB componha menos de 1% do total da radiação solar, ela é uma componente altamente ativo que provoca modificações químicas no DNA e muda a sua estrutura molecular pela formação de três principais classes de lesões no DNA, tais como dímeros de pirimidina ciclobutano (CPD) (Fig. 1 (B)), fotoprodutos de 6-4 pirimidina pirimidona (6-4PPs) (Fig. 1 (C)), e seus Dewar isômeros (DOUKI e CADET, 2001; LIMA-BESSA et al., 2008; RAVANAT et al., 2001). CPDs correspondem à formação de uma estrutura de anel de quatro membros que envolvem C5 e C6 de ambas as bases vizinhas. Os fotoprodutos 6-4PPs são formados por uma ligação não cíclica entre C6 (do terminal 5’) e C4 (do terminal 3’) das pirimidinas envolvidas via rearranjo espontâneo do intermediário oxetano (quando o terminal 3’ é uma timina) (Fig. 2 (a)) ou azetidina (quando o terminal 3’ é uma citosina) (Fig. 2 (b)). As 6-4PPs são avidamente convertidos no seu Dewar isômero após a
EFEITOS DE FUROCUMARINAS ASSOCIADAS A UVB (312 nm) EM S. AUREUS
17
exposição à radiação UVB ou radiação UVA (TAYLOR et al., 1990; RASTOGI et al., 2010). Verificou-se que CPDs são produzidos preferencialmente em sequências T-T e T-C que são mais fotorreativas, enquanto que a C-T e seqüências C-C são menos fotorreativas (DOUKI et al., 2000; DOUKI e CADET, 2001).
18
19
3.1.1 Reparo de Danos da Radiação Ultravioleta no DNA
Estudos bioquímicos e moleculares em vias de reparo têm sido extensivamente investigados em alguns organismos modelo tais como E. coli, S. cerevisiae e humanos, onde as proteínas de reparo altamente conservadas escaneam o genoma continuamente e encontram as lesões no DNA, desencadeando vários mecanismos de reparo como fotorreativação, reparo por excisão (BER e NER) e reparo recombinacional (RASTOGI et al., 2010).
O processo de fotorreativação é executado por meio de uma enzima conhecida como fotoliase que se liga especificamente aos CPDs e diretamente monomeriza o anel ciclobutano, usando a energia visível (luz azul) e protege o genoma dos efeitos deletérios da radiação (ESSEN e KLAR, 2006). Fotoliases têm sido relatados em diversos grupos como archaea, bactérias, fungos, vírus, plantas, invertebrados, e muitos vertebrados, incluindo mamíferos sem placenta. Elas são ausentes ou não-funcionais em mamíferos placentários como os humanos (YASUI, 1994; TODO, 1999).
No reparo por excisão de base (BER) a eficiência e especificidade da via de reparação são determinadas por várias formas de glicosilases de DNA que removem diferentes tipos de bases modificadas, por clivagem da ligação N-glicosídica entre a base anormal e a desoxirribose, deixando intacta a estrutura helicoidal açúcar-fosfato. Uma endonuclease corta a ligação fosfodiester e a DNA polimerase-I simultaneamente realiza a remoção dos nucleotídeos e faz a correta polimerização para substituir o nucleotídeo errado, junto com alguns poucos nucleotídeos adjacentes (BARNES E LINDAHL, 2004). BER é a via de reparo predominante contra lesões indiretas no DNA causadas pela radiação UVA através da geração de ROS (LAN et al., 2004).
20
O reparo recombinacional é um dos mecanismos que eficientemente reparam quebras de dupla fita (DSBs) e lacunas em fita única do DNA. Entre todos, o gene de E. coli recA e seus homólogos eucarióticos RAD51s são os principais genes de recombinação (THACKER,
2005). O gene recA codifica uma ATPase dependente de DNA que promove o pareamento homólogo entre duas moléculas de DNA, isto é, posiciona corretamente e alinha regiões de seqüências de bases complementares, para que se efetue uma mudança de fragmentos de fita simples e o resultado são dois heteroduplex, nos quais cada duplex apresenta um segmento com as informações corretas, seguido por extensão da fita lesionada pela DNA polimerase levando à recuperação da informação genética (PÂQUES e HABER, 1999; CROMIE, et al., 2001).
A acumulação de uma quantidade enorme de lesões no DNA pode levar à ocorrência do sistema de reparação SOS, bem descrito em E. coli, em que o envolvimento de mais de 40 genes foram encontrados. O sistema SOS é iniciado pela interação de duas proteínas cruciais a RecA e o repressor LexA, que inibe a expressão de genes SOS se ligando aos seus promotores. A atividade proteolítica da proteína RecA inativa o repressor LexA e induz a expressão de todos os genes aos quais LexA está associado. Um certo número de genes, tais como uvrA, uvrB, cho (homólogo de uvrC) e uvrD de E. coli participam da resposta SOS (COURCELLE et al., 2001; VAN HOUTEN et al., 2002).
3.2 Furocumarinas
21
nitro, nestas mesmas posições. Alguns destes compostos, tais como a psoraleína, a 8-MOP e a ANG, tem sido isolados de representantes de pelo menos cinco famílias de plantas Leguminosae, Umbelliferae, Rutaceae, Moraceae e Orchidaceae, e de microrganismos, incluindo fungos (Fig. 3) (SCOTT et al., 1976; ARABZADEH et al., 2002).
Por outro lado, duas áreas de interesse particular têm promovido a síntese laboratorial de novos compostos: a aplicação de FCs na fotoquimiterapia e a utilização de FCs como sondas moleculares (GIA et al.,1992; VEDALDI et al.,1992 ; BISAGNI, 1992; BORDIN et al.,1993). A 4,5’,8-Trimetilpsoraleína (TMP), um dos compostos mais fotorreativos, 5,7-Dimetoxicumarina (5,7-DMC) e o 3-Carbetoxipsoraleína (3-CPs) são exemplos de derivados sintéticos (KITAMURA et al., 2005).
3.2.1 Fotoquímica das Furocumarinas
As reações fotoquímicas das FCs podem ser classificadas em duas categorias, uma dependente de oxigênio (tipo I e II) e outra independente (tipo III). Em todas as reações, os compostos intercalantes são excitados pela UVA, passando para os estados excitados singlete (S1) e/ou triplete (T1), o qual possui um tempo de vida mais longo (LLANO et al., 2003).
No tipo I, temos a redução do estado triplete da FC por um doador de elétron, como uma base de DNA, seguida de uma transferência de elétron desta FC para moléculas de oxigênio, resultando na formação de O2• (LLANO et al., 2003).
No tipo II, ocorre a transferência energética das FCs em estado excitado triplete para moléculas de oxigênio, gerando o ¹O2, sendo este capaz de reagir diretamente com as
biomoléculas. É importante relatar que nas reações dependente de oxigênio ocorre maior geração de ¹O2 em detrimento ao O2-, o qual apresenta uma produção de menos que 1% do
total de ROS formadas (LLANO et al., 2003).
22
eletrônicas (CIMINO et al., 1985; CADET et al.,1990; KANG et al., 1992; LLANO et al., 2003; KITAMURA et al., 2005).
Figura 3. Estrutura molecular de algumas furocumarinas e do derivado cumarínico 5,7-Dimetoxicumarina (BOYER et. al.,1988; LLANO et al., 2003; KITAMURA et al.,2005).
3.2.2 Efeito Fotodinâmico
Inúmeras reações metabólicas podem originar normalmente pequenas quantidades de ROS, como o 1O2, O2-, radical hidroxila (OH-) e peróxido de hidrogênio (H2O2), porém, o
23
(i) Formação do estado excitado:
Ps(S0) Ps(S1) (Excitação)
Ps(S1) Ps(T1) (Cruzamento interesistema)
(ii) Vias de Fotossensibilização:
Tipo I. Mecanismo de transferência de elétron: Fotossensibilizador no estado triplete reage com um doador de elétron D.
Ps(T1) + D Ps• + D•+ (Redução)
Ps• + 3O2 Ps + O2• (Transferência de elétron)
D•+ + O2• D(O2) (Retorno do elétron)
Tipo II. Mecanismo de troca de elétron. Ps(T1) + 3O2 Ps(S0) + 1O2
Tipo III. Fotoligação ao DNA.
Ps(S1) + DNA(S0) Ps = DNA (C4-cicloadição)
Figura 4. Possíveis reações da furocumarina (Ps – Psoraleína) após excitação com UVA (LLANO et al, 2003).
Da mesma forma que os corantes de acridina (WEBB e PETRUSEK, 1966), as FCs se intercalam entre os pares de bases do DNA e quando excitadas pela UVA, transferem essa energia para a molécula de oxigênio, originando ROS, através do efeito fotodinâmico. Estas moléculas reativas, principalmente o 1O2, reagem rapidamente e indiscriminadamente com
uma enorme variedade de compostos moleculares, como ácidos nucléicos, através da oxidação das bases púricas, proteínas e lipídeos insaturados, causando inúmeros danos celulares. Inúmeras evidências sugerem que o 1O2 é o principal mediador dos danos oxidativos do DNA,
agindo predominantemente na base guanina. O resultado deste dano é a modificação desta
24
base para o composto 8-Oxo-7,8-dihidro-2´deoxiguanosine (8-oxodGuo). Além disso, outras mutações e lesões letais podem ser originadas. Sabe-se que todas as porções do espectro UV (UVA, UVB e UVC) também são capazes de induzir a formação da 8-oxodGuo (ZHANG et al., 1997; CAVALCANTE et al., 2002; BECERRA et al., 2004).
3.2.3 Adições de Furocumarinas no DNA
DNA e FC formam complexos intermoleculares através da intercalação deste composto entre os pares de bases do DNA, o que é considerado um pré-requisito para uma subseqüente reação fotoquímica entre as FCs e as bases pirimídicas (KITAMURA et al., 2005). FCs bifuncionais, como 8-MOP e o TMP, fotorreagem com as pirimidinas, formando monoadições (MA) com o anel furano (4',5'-MA) ou com o anel cumarínico (3’,4’-MA). Uma segunda reação fotoquímica, envolvendo uma pirimidina convenientemente localizada na fita oposta, converte 4',5'-monoadições em biadições (BA) (Fig. 5). FC monofuncionais, como a ANG, pela sua estrutura angular e o 3-CPs, pela disponibilidade de apenas um sítio reativo na molécula, são capazes de formar apenas monoadições. O agente monofuncional 5,7-dimetoxicumarina (5,7-DMC), devido à ausência do anel furano (Fig. 3), é capaz de induzir apenas monoadições piranosídicas (CIMINO et al., 1985, LLANO et al., 2003; KITAMURA et al., 2005).
As reações fotoquímicas das FCs com o DNA já estão bem estabelecidas, porém, para entender melhor a relação entre a formação de fotoadições e a indução de modificações genéticas, e ser capaz de interpretar as mutações induzidas pelas FCs, é preciso conhecer a especificidade de ligação destes compostos no DNA (KITTLER e LOBER, 1995).
25
fotoadição por todos os derivados inclusive pela 3-CPs que tem uma baixa afinidade por DNA e os sítios fracos, que são alvos apenas para derivados com alta afinidade por DNA (BOYER et al., 1988; KITAMURA et al., 2005).
Figura 5. Ilustração da formação das ligações químicas entre a 8-MOP e as bases pirimídicas no dúplex de DNA (KITAMURA et al.,2005).
26
3.2.4 Adições de Furocumarinas e seu reparo
A sensibilidade aos efeitos letais de FC-UVA foi bastante estudada em linhagens deficientes em mecanismo de reparo e suas respectivas proficientes, em bacteriófagos (ZERLER e WALLACE, 1979), bactérias (IGALI et al.,1970) e microrganismos eucarióticos (HENRIQUES e MOUSTACCHI, 1980; MURONETS et al., 1980; GRAETZER e MORRISON, 1985). No geral, as linhagens deficientes em reparo são mais sensíveis do que as proficientes, e a comparação dos dados de sobrevivência tem permitido melhor entendimento dos mecanismos.
Em Staphylococcus aureus, experimentos conduzidos com linhagens Uvrˉ, Recˉ e selvagem, tanto em temperatura ambiente como em temperatura baixa (4 °C), e o emprego do protocolo de irradiação repetida mostraram que o reparo por excisão atua ou se inicia rápida e eficientemente e é mais importante que o da via recombinacional para o reparo de fotoprodutos de 8-MOP (CALVACANTI e SIQUEIRA-JUNIOR, 1995). Utilizando especificamente FC monofuncionais, Barreto (1997) verificou que a via de reparo por excisão é de fato mais importante do que a via recombinacional para o reparo dos dois tipos de monoadições (4’, 5’ MA e 3’, 4’ MA).
27
de DNA contendo a BA. A lacuna resultante é preenchida por DNA-polimerase I e ligado pela DNA ligase (Fig. 6 (6))(DRONKERT e KANAAR, 2001).
3.2.5 Efeito Fotoprotetor da Furocumarina
Quando Igali et al. (1970) evidenciaram pela primeira vez que as lesões letais e mutagênicas causadas pela 8-MOP-UVA não sofriam fotorreativação, mas eram sujeitas a reparo por excisão e reparo recombinacional, evidenciaram também que tratamento por 8-MOP-UVC reduzia o aparecimento de mutantes auxotróficos em E. coli. Trabalho posterior (BRIDGES, 1971) mostrou que a 8-MOP, da mesma forma que corantes de acridina (WEEB e PETRUSEK, 1966), protegia células de E. coli contra os efeitos letais da UVC. No caso dos corantes de acridina, já estava bem estabelecido que o efeito fotoprotetor era devido à redução na formação de CPDs (BEUKERS, 1965; SETLOW e CARRIER,1967) e o mesmo foi admitido por Bridges (1971) para o caso da 8-MOP.
Em S. aureus a 8-MOP também exerce tal efeito protetor. Barreto (1997) e posteriormente, Barreto e Siqueira-Júnior (2006), investigaram diversos derivados mono e binfuncionais. Os resultados mostraram que o efeito protetor de FC contra a letalidade da UVC em S. aureus foi evidente tanto em linhagens deficientes em reparo (RN981rec- e RN972uvr-) como na parental selvagem (RN1349) na seguinte ordem de eficiência: TMP <
8-MOP ANG < 3-CPs. No entanto, a eficiência do efeito protetor foi maior na linhagem parental, indicando que, apesar do efeito protetor, certo número de lesões letais é ainda produzido, as quais são reparadas com maior eficiência nessa linhagem do que nas deficientes. Como os experimentos foram feitos na presença de ar, foi sugerido que tais lesões eram produzidas por um processo semelhante ao fotodinâmico (envolvimento de 1O2). Para melhor
avaliar essa idéia, os experimentos foram repetidos, mas na presença de azida de sódio (seqüestrador de 1O2). Realmente, quando azida de sódio foi adicionada na suspensão
28
29
Embora o conceito de transferência de energia possa explicar a inibição da formação de CPDs, e assim o efeito protetor, os autores não descartaram a possibilidade de que os diferentes níveis de fotoproteção apresentados pelas FCs estejam relacionados a uma complexa mistura de fatores e eventos: eficiência do mecanismo de transferência de energia, geometria da intercalação, especificidade por seqüências definidas de nucleotídeos e formação de complexo FC-proteínas no escuro (BARRETO e SIQUEIRA-JUNIOR, 2006).
No que concerne a esse último ponto, embora a concentração de FC usada em todos os experimentos tenha sido tão alta quanto 0,115 mM, foi considerado a possibilidade da ligação a proteínas influenciar a biodisponibilidade de FC para intercalação no DNA. Apenas nas concentrações 0,23 mM e 0,46 mM de TMP foi observado um efeito protetor da referida FC, indicando que tal efeito está relacionado com a biodisponibilidade de moléculas para intercalação no DNA, só conseguida com elevadas concentrações, já que alta é sua constante de formação de complexo com proteínas no escuro (VERONESE, 1979; LIRA, 2006).
3.2.6 Furocumarina em Meio de Plaqueamento Pós-Irradiação
A 8-MOP, assim como acriflavina, quando presente no meio de plaqueamento pós-irradiação aumenta a sensibilidade da bactéria ao efeito letal da UVC (BRIDGES, 1971). Para explicar os resultados, foi sugerido que acriflavina se combina às regiões lesadas do DNA, inibindo, dessa forma, o funcionamento dos mecanismos de reparo (VECHET, 1967). Witkin (1963) também já havia mencionado que a acriflavina se combina com o DNA lesado ou modifica-o, de tal modo que reduz a acessibilidade da lesão às enzimas de reparo.
30
No caso da linhagem B/r proficiente em mecanismo de reparo de E. coli, foi observado um aumento da sensibilidade à UVC, quando a 8-MOP estava presente no meio de plaqueamento (BRIDGES e MOTTERSHEAD, 1979). Este efeito não foi observado em linhagens K12, o que é consistente com a menor capacidade de interação da 8-MOP com o DNA da K12. Além disso, também foi observado que linhagens B/r são muito mais sensíveis que as K12 ao efeito letal da associação 8-MOP-UVA. Também foi verificado que a acriflavina, quando está no meio de plaqueamento pós-irradiação, inibe reparo de danos causados pelo tratamento combinado de 8-MOP-UVA (BRIDGES,1984).
Experimentos conduzidos com S. aureus plaqueado em meio com 8-MOP, após irradiação com UVC, mostrou aumento tanto da sensibilidade da linhagem parental proficiente em reparo quanto das linhagens deficientes (Rec¯ > Uvr¯ ), indicando que 8-MOP é mais eficiente em inibir reparo por excisão do que inibir reparo recombinacional. As linhagens também foram tratadas com 8-MOP-UVA e plaqueadas em meio com 8-MOP e os resultados mostraram que houve aumento da sensibilidade da linhagem parental, porém, houve pouco efeito sobre as linhagens deficientes Rec¯ e Uvr¯ (BARROS e SIQUEIRA-JUNIOR, 2002).
São poucos os trabalhos a respeito dessa interessante propriedade biológica da 8-MOP, e não conhecemos resultados para outras FCs. Isto nos motivou a verificar se ocorre aumento da letalidade à UVB em S. aureus, quando adicionamos diferentes FCs ao meio de cultura.
3.2.7 Potencial Terapêutico da Furocumarina
O fato das FCs excitadas poderem reagir fotoquimicamente com uma ampla variedade de biomoléculas faz com que elas sejam amplamente utilizadas como drogas na fotoquimioterapia (GIA et al.,1992; VEDALDI et al.,1992 ; BISAGNI, 1992; BORDIN et al.,1993).
31
líquen planus e erupção polimórfica à luz (TATCHEN et al., 2004). Atualmente, além do uso na fotoquimioterapia, as FCs estão sendo aplicadas como agentes capazes de inativar o Trypanosoma cruzi e certos vírus, como o da hepatite e HIV em derivados sanguíneos e como moduladores imunológicos no tratamento do Linfoma cutâneo das células T e algumas doenças autoimunes, através da irradiação do sangue contendo a FC apropriada durante circulação extracorpórea (PATHAK e FITZPATRICK, 1992; BEN-HUR, 1993; GOTTLIEB et al., 1996; BEER e ZMUDZKA, 1996; GASPARRO, 1996).
Apesar dos resultados promissores, alguns efeitos colaterais indesejáveis, como eritematogênese, mutagênese, recombinogênese e carcinogênese têm sido associados à fotoquimioterapia com FC (YOUNG, 1990). Kitamura (2005) relatou que a formação de biadições covalentes entre as FCs e o DNA pode ser o responsável por tais efeitos indesejáveis. Por este motivo, têm-se aumentado os estudos com novas FC que possuem comportamento de agentes monofuncionais na sua ligação com o DNA, tais como, a ANG e seu derivado 4,5-Dimetilangelicina. Uma outra alternativa para minimizar tais efeitos é inibir a capacidade fotorreativa de um dos dois sítios ativos da FC (dupla ligação entre os carbonos 3 e 4 da cumarina ou 4 e 5 do anel furano) através da adição de grupos aceptores ou doadores de elétrons. Um exemplo é o composto 3-CPs que fotoreage com o DNA apenas com a dupla ligação do furano (AVERBECK et al., 1978).
Estudos sobre os efeitos da combinação de FC e UVB são limitados principalmente aos efeitos de 8-MOP-UVB no tratamento da psoríase, e a maioria dos resultados sugere que o número de sessões de tratamento e doses cumulativas foram menores com a terapia combinada (ASAWANONDA et al., 2008; SECKIN et al., 2009; ÖZKAN et al., 2012). No entanto, o mecanismo de ação do psoraleno em adição a radiação UVB não foi completamente elucidado (AGGARWAL et al., 2010; EHSANI et al., 2011).
32
4. MATERIAIS E MÉTODOS
4.1 Linhagem Bacteriana
Foi utilizada a linhagem de Staphylococcus aureus ISP255, caracterizada fenotipicamente como proficiente em reparo de DNA (GOERING e PATTEE, 1971).
4.2 Meios de Cultivo
- Agar infusão – Blood Agar Base (BAB, Difco), 40 g/L; - Caldo infusão - Brain Hearth Infusion (BHI, Difco), 37 g/L; - Diluente - Cloreto de sódio 0,89% (salina).
4.3 Soluções de Furocumarinas
- 8-Metoxipsoraleína (8MOP, Sigma); - 4,5’,8-Trimetilpsoraleína (TMP, Aldrich);
- 3-Carbetoxipsoraleína (3-CPs, sintetizado pelo Dr. E. Bisagni - Institut Curie, Orsay, França - e gentilmente cedida pelo Dr. J. A. P. Henriques - Universidade Federal do Rio Grande do Sul, Brasil);
Soluções de estoque de FCs (2,3 mM) foram preparadas em etanol a 40% (8-MOP), em etanol a 50% (3-CPS), ou em etanol absoluto (TMP) e armazenadas no escuro a 4 °C.
4.4 Tratamento com Furocumarina e UVB
A bactéria foi cultivada em meio BHI até atingir a fase estacionária (de 18 a 24 horas a 37 °C), e foi suspensa em solução salina, a uma densidade de 108 ufc mL-1. A FC foi
adicionada à suspensão e incubada por 20 minutos no escuro a temperatura ambiente, em seguida foi submetida tempos crescentes de exposição à UVB (312nm) em uma placa de Petri aberta com suave agitação em um ambiente com luz amarela usando duas lâmpadas Philips
EFEITOS DE FUROCUMARINAS ASSOCIADAS A UVB (312 nm) EM S. AUREUS
33
TL20W/12RS. O fluxo de dose era 13,3 J/m²/s, monitorados com um radiômetro Vilber Lourmat VLX-3W equipado com sensor para 312 nm. Suspensão não tratada também foi irradiada para comparação. As doses de irradiação foram dadas cumulativamente usando a mesma suspensão bacteriana.
As FCs foram utilizadas em experimentos independentes nas concentrações finais de: 0,02875 mM, 0,0575 mM, 0,115 mM e 0,23 mM (BARROS E SIQUEIRA-JUNIOR, 2002; BARRETO e SIQUEIRA-JUNIOR, 2006).
4.5 Plaqueamento Pós-Irradiação e Determinação da Sobrevivência
Após cada dose de irradiação, alíquotas de 0,1 mL eram diluídas em solução salina e plaqueadas em duplicata em BAB com e sem FC.
FCs testadas no escuro também foram diluídas e plaqueadas. Após incubação por 24 h a 37 C, as colônias eram contadas e a sobrevivência calculada (título bacteriano no tempo de irradiação administrado x 100 / título bacteriano no tempo 0).
As soluções de FCs eram adicionadas ao BAB, a uma concentração final de 0,23 mM (BARROS E SIQUEIRA-JUNIOR, 2002).
4.6 Análise Estatística
34
5. RESULTADOS E DISCUSSÃO
5.1 Tratamentos com Diferentes Concentrações de Furocumarinas
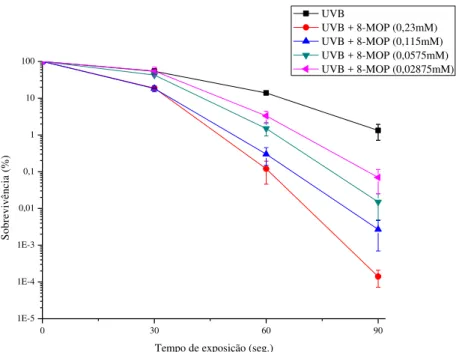
As curvas de sobrevivência obtidas após tratamento da bactéria com soluções de 8-MOP, TMP e 3-CPs a diferentes concentrações, seguido de irradiação com doses crescentes de UVB, são mostradas nos gráficos 1, 2 e 3, respectivamente. O efeito letal provocado pelas associações 8MOP-UVB, TMP-UVB e 3-CPs-UVB mostrou dependente tanto da concentração da FC quanto da dose de irradiação.
No caso da 8-MOP, concentrações crescentes causaram aumento da sensibilidade bacteriana a UVB. Em contraste, no caso da TMP, a cepa bacteriana apresentou maior sensibilidade a UVB na menor concentração, com uma redução gradual da sensibilidade à medida que a concentração desta FC aumentou. O aumento na concentração de 3-CPs conferiu maior resistência aos danos induzidos por UVB.
0 30 60 90
1E-5 1E-4 1E-3 0,01 0,1 1 10 100 S ob re vi vê nc ia ( % )
Tempo de exposição (seg.)
UVB
UVB + 8-MOP (0,23mM) UVB + 8-MOP (0,115mM) UVB + 8-MOP (0,0575mM) UVB + 8-MOP (0,02875mM)
Gráfico 1. Curvas de sobrevivência obtidas após tratamento da cepa ISP255 com diferentes concentrações de 8-MOP (mM, millimolar) em diferentes tempos de exposição à luz UVB de 312 nm (seg, segundos).
EFEITOS DE FUROCUMARINAS ASSOCIADAS A UVB (312 nm) EM S. AUREUS
35
0 15 30 45 60
1E-5 1E-4 1E-3 0,01 0,1 1 10 100 S ob re vi vê nc ia ( % )
Tempo de exposição (seg.)
UVB
UVB + TMP (0,23mM) UVB + TMP (0,115mM) UVB + TMP (0,0575mM) UVB + TMP (0,02875mM)
Gráfico 2. Curvas de sobrevivência obtidas após tratamento da cepa ISP255 com diferentes concentrações de TMP (mM, millimolar) em diferentes tempos de exposição à luz UVB de 312 nm (seg, segundos).
0 30 60 90 120 150
1E-3 0,01 0,1 1 10 100 S ob re vi vê nc ia ( % )
Tempo de exposição (seg.)
UVB
UVB + 3-CPs (0,23mM) UVB + 3-CPs (0,115mM) UVB + 3-CPs (0,0575mM) UVB + 3-CPs (0,02875mM)
36
Os resultados obtidos indicaram que a 8-MOP e a TMP atuam como agente fotossensibilizante para UVB. Comparando-se os resultados aqui apresentados com os anteriormente obtidos com UVA (BARROS e SIQUEIRA-JUNIOR, 2002), pode-se perceber que ambas FCs são mais eficientes como agentes fotosssensibilizante para UVB do que para UVA. Na ausência de FC (ou algum outro xenobiótico excitável por UV), UVA e UVB apresentam diferentes efeitos em sistemas celulares. A UVB tem como alvo primário o DNA, enquanto que a UVA pode causar danos no DNA através de reações indiretas de fotooxidação (CADET et al.,2003; BRENDLER-SCHWAAB et al.,2004; RASTOGI et al.,2010). Destarte, FCs-UVA e FCs-UVB provavelmente poderiam afetar a célula de diferentes maneiras, mas sem descartar algum mecanismo em comum para a inativação celular (SCHEINFELD e DELEO, 2003). As FCs podem se ligar de forma reversível no escuro e formar MA e BA no DNA após exposição a radiações com comprimento de onda maior que 300 nm (HASS E WEBB, 1979; JAMES e COOHILL, 1979; RONTÓ et al., 1989). Deste modo, o efeito fotossensibilizante demonstrado pelas associações 8-MOP-UVB e TMP-UVB pode ser atribuído ao acúmulo de MA e BA formadas no DNA.
A UVB, da mesma forma que a UVC, causa principalmente formação de CPDs (RAVANAT et al., 2001; SCHUCH e MENCK, 2010), cuja formação, pode ser inibida por FCs intercaladas, o que pode ser explicado pelo conceito de transferência de energia, resultando em um efeito fotoprotetor (BARRETO e SIQUEIRA-JUNIOR, 2006). Deste modo, é possível que uma curva de sobrevivência obtida após tratamento com 8MOP-UVB ou TMP-UVB seja o reflexo de dois efeitos provocados pela FC: fotossensibilização, decorrente da formação de MA e BA e fotoproteção, como consequência da inibição de CPDs. No entanto, os resultados contrastantes entre 8MOP-UVB e TMP-UVB verificados quando a cepa foi tratada com diferentes concentrações de cada FC poderiam ser explicados pela especificidade diferencial de intercalação das duas FCs por certas sequências de nucleotídeos.
A 8-MOP exibe uma forte especificidade por sequencias (AT)n, ligando-se
37
promotoras (BOYER et al., 1988; SAGE et al., 1988). Assim, a intercalação preferencial da 8-MOP nestas sequências biologicamente importantes pode levar a formação de BA, as quais, juntamente com as MA e CPDs contribuem para o efeito fotossensibilizante observado. Uma possível explicação para a maior sensibilização da cepa com o aumento da concentração de 8-MOP poderia ser a de que o processo de reparo deste conjunto de lesões se tornaria mais lento e complexo, resultando em maior mortalidade (CALSOU et al., 1996; KLEINAU et al., 1997).
O aumento na concentração de TMP resultou em uma redução da sensibilidade da bactéria à UVB. A TMP, assim como outros compostos metilados, apresenta alta reatividade com o DNA e baixa especificidade pelos sítios fortes (AT)n, sendo capazes de se ligar em
sítios contendo timinas adjacentes ou isoladas, os quais são considerados sítios fracos ou sítios não preferenciais para a fotorreação de diferentes FCs com o DNA (KRAMER e PATHAK, 1970; SAGE et al., 1988; MIOLO et al.,1989). Neste caso, é possível que a redução da sensibilidade em função do aumento da concentração tenha ocorrido devido a uma maior disponibilidade de moléculas para intercalação no DNA, levando a inibição de um maior número de CPDs. Apesar da maior disponibilidade de moléculas para intercalação, um número menor de BA serão formadas em razão da baixa especificidade da TMP por sítios (AT)n
(SMITH e BRODBELT, 2010).
Por outro lado, não podemos descartar a possibilidade de ligação a proteínas no escuro influenciar na biodisponibilidade de uma dada FC para intercalação no DNA. A constante de associação com proteína no escuro é 15 vezes mais alta para TMP do que para 8-MOP (VERONESE, 1979). Na verdade, é digno de nota que TMP protege contra UVC apenas em concentrações ≥ 0,23 mM (LIRA, 2007).
38
a viabilidade celular, à sua incapacidade de formar BA, ao baixo número de MA induzidas e ao reparo eficiente de MA e CPDs remanescentes.
5.2 Plaqueamento Pós-Irradiação em Meio de Cultura com Furocumarina
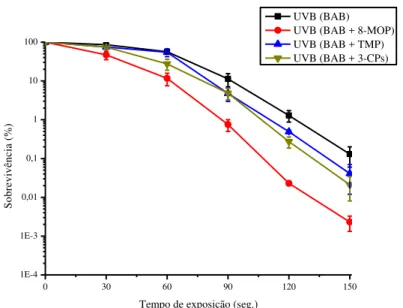
Para avaliarmos o efeito das FCs no meio de plaqueamento pós-irradiação UVB, plaqueamos a bactéria, em meio de cultura BAB com e sem solução de 8-MOP, TMP, ou 3-CPs. Em um segundo momento, tratamos a cepa bacteriana com 8-MOP, TMP e 3-CPs em combinação à UVB e depois plaqueamos em meio com e sem 8-MOP. As curvas de sobrevivência obtidas são mostradas nos gráficos 4 e 5, respectivamente.
Todas as FC adicionadas ao meio de plaqueamento aumentaram a letalidade a UVB, sendo que o tratamento pós-irradiação com a 8-MOP apresentou o maior efeito letal (Graf. 4).
0 30 60 90 120 150
1E-4 1E-3 0,01 0,1 1 10 100 S ob re vi vê nc ia ( % )
Tempo de exposição (seg.)
UVB (BAB) UVB (BAB + 8-MOP) UVB (BAB + TMP) UVB (BAB + 3-CPs)
39
A habilidade de uma FC se intercalar e interagir com o DNA, via atração eletrostática, depende da solubilidade. A 8-MOP é significantemente mais solúvel que as outras FCs (ISAACS et al., 1977; SMITH e BRODBELT, 2010). Isso pode estar possibilitando a 8-MOP ser mais capaz em inibir reparo por diminuir o acesso das enzimas de reparo às lesões.
Quanto aos dados de sobrevivência para os danos de 8-MOP-UVB, TMP-UVB e 3-CPs-UVB, os resultados mostraram pouco aumento na letalidade quando a 8-MOP encontra-se presente no meio de plaqueamento para todos os tratamentos utilizados (Graf. 5).
0 30 60 90 120
1E-5 1E-4 1E-3 0,01 0,1 1 10 100 S ob re vi vê nc ia ( % )
Tempo de exposição (seg.)
UVB + 8-MOP (BAB) UVB + 8-MOP (BAB + 8-MOP) UVB + TMP (BAB)
UVB + TMP (BAB + 8-MOP) UVB + 3-CPs (BAB) UVB + 3-CPs (BAB + 8-MOP)
40
Já foi visto que a 8-MOP, assim como a acriflavina, inibe reparo de danos 8-MOP-UVA. Por ser um pós-tratamento, a 8-MOP ou a acriflavina em meio de plaqueamento não altera a acessibilidade e a permeabilidade no tratamento da 8-MOP ao DNA, contudo, esses compostos próximos a adições de 8-MOP poderiam desestabilizar a dupla fita e impedir o reconhecimento dos danos pelas enzimas de reparação adequada (BRIDGES, 1984; BARROS E SIQUEIRA-JUNIOR, 2002).
Comparando os resultados para a cepa tratada apenas com UVB (Graf. 4) e tratada com FC-UVB (Graf. 5), observamos que a 8-MOP no meio de plaqueamento foi mais capaz em aumentar a letalidade da cepa tratada apenas com UVB.
41
6. CONCLUSÕES
Os resultados evidenciam que o aumento na concentração de 8MOP e TMP confere efeitos diferentes na sobrevivência da cepa. Contudo, ambas as FCs atuam como fortes agentes fotossensibilizantes para UVB, o que provavelmente está relacionado com a sua capacidade de formar BA. Por outro lado, 3-CPs, uma furocumarina mofuncional, exibiu efeito fotoprotetor contra os danos induzidos por UVB em S. aureus.
Seria interessante a realização de estudos utilizando outros sistemas biológicos, incluindo estudos in vitro, para elucidar a participação das FCs como agentes fotossensibilizantes e fotoprotetores quando combinadas com UVB.
Os resultados também mostraram o aumento da sensibilização da cepa por tratamento pós-irradiação, sendo o maior efeito com 8-MOP-BAB. Esses resultados reforçam a necessidade de mais estudos para elucidar a participação das FCs como putativos inibidores de reparo de lesões no DNA causadas por UVB e FC-UVB.
EFEITOS DE FUROCUMARINAS ASSOCIADAS A UVB (312 nm) EM S. AUREUS
42
7. PERSPECTIVAS
Esperamos que esse trabalho seja uma referência útil para outros trabalhos que visem um melhor entendimento dos:
Efeitos de sobrevivência e letalidade de FCs em associação a UVB em cepas bacterianas;
Mecanismos de reparo que se operam em S. aureus e do real papel das FCs na sua inibição.
EFEITOS DE FUROCUMARINAS ASSOCIADAS A UVB (312 nm) EM S. AUREUS
43
REFERÊNCIAS
AGGARWAL, K. JAIN, V. JANGRA, S. Comparative efficacy of narrowband ultraviolet B phototherapy alone and its combination with topical 8-methoxypsoralen in psoriasis. Indian J.
Dermatol. Venereol. Leprol. v.76, p.666–670, 2010.
ALSCHER, R.G. DONAHUE, J.L. CRAMER, C.L. Reactive oxygen species and antioxidants: relationships in green cells. Physiologia Plantarum, v. 100, n. 2, p. 224–233, 1997.
APEL, K. HIRT, H. REACTIVE OXYGEN SPECIES: Metabolism, Oxidative Stress, and Signal Transduction.Annu. Rev. Plant Biol. v.55, p.373–99, 2004.
ARABZADEH, A. BATHAIE, S.Z. FARSAM, H. AMANLOU, M. SABOURY, A.A. SHOCKRAVI, A. MOOOSAVI – MOVAHEDI, A.A. Studies on mechanism of 8-methoxypsoralen – DNA interaction in the dark. International Journal of Pharmaceutics, v. 237, p. 47-55, 2002.
ASAWANONDA, P. AMOMPINYOKEIT, N. NIMNUAN, C. Topical 8-methoxypsoralen enhances the therapeutic results of targeted narrowband ultraviolet B phototherapy for plaque-type psoriasis, J.
Eur. Acad. Dermatol. Venereol, v.22, p.50–55, 2008.
AVERBECK, D. Resent advances in psoralen phototoxicity mechanism. Photochemistry and
Photobiology, v.50, p.859-882, 1989.
AVERBECK, D. MOUSTACCHI, E. BISAGNI, E. Biological effects and repair of damage photoinduced by a derivative of psoralen substituted at the 3,4 reaction site. Photoreactivity of this compound and lethal effect in yeast. Biochim. Biophys. Acta, v.518, p.464–481, 1978.
AVERBECK, D. PAPADOPOULO, D. MOUSTACCHI, E. Repair of 4,5_,8-trimethylpsoralen plus light-induced DNA damage in normal and Fanconi’s anemia cell lines, Cancer Res. v.48, p.2015–
2020, 1988.
BARNES, D.E. LINDAHL, T. Repair and genetic consequences of endogenous DNA base damage in mammalian cells. Annual Review of Genetics, v.38, p.445–476, 2004.
EFEITOS DE FUROCUMARINAS ASSOCIADAS A UVB (312 nm) EM S. AUREUS
44
BARRETO, H.M. Efeitos biológicos fotoinduzidos por derivados monofuncionais da cumarina em
Staphylococcus aureus (Dissertação de Mestrado). Universidade federal da Paraíba, João Pessoa, 1997.
BARRETO, H.M. SIQUEIRA-JUNIOR, J.P. Uma breve revisão sobre a reação das furocumarinas com o DNA na presença de luz ultravioleta longa. Paradigmas, v. 11, p.25-43, 1998.
BARRETO, H.M. SIQUEIRA-JUNIOR, J.P. Protective effect of furocoumarins against 254 nm UV in
Staphylococcusaureus. Current Microbiology, v.52, p.40-44, 2006.
BARROS, S.M.D. SIQUEIRA-JUNIOR, J.P. Decreased survival of UV-irradiated Staphylococcus
aureus in the presence of 8-methoxypsoralem in the post-irradiation plating medium. Journal of
Photochemical and Photobiology B, v.66, p.153-156, 2002.
BECERRA, M.C. SARMIENTO, M. PÁEZ, P.L. ARGUELLO, G. ALBESA, I. Light effect and reactive oxygen species in the action of ciprofloxacin on Staphylococcus aureus. Journal of
Photochemistry and Photobiology B, v.76, p.13-18, 2004.
BEER, J.Z. ZMUDZKA, B.Z. Effects of UV on HIV and other infecctions introduction. Journal of Photochemistry and Photobiology, v.64, p.231-233, 1996.
BEN-HUR, E. Photosensitized virus decontamination of blood. The Spectrum, v.4, p.11-13, 1993.
BEUKERS, R. The effect of proflavine on UV-induced dimerization of thymine in DNA. Journal of Photochemistry and Photobiology, v.4, p.935-937, 1965.
BISAGNI, E. Synthesis of psoralens and analogues. Journal of Photochemistry and Photobiology B, v.14, p.23-46, 1992.
45
BOYER, V., MOUSTACCHI, E. SAGE, E. Sequence specificity in photoreaction of various psoralen derivatives with DNA: role in biological activity. Biochemistry, v.27, p.3011-3018, 1988.
BRENDLER-SCHWAAB, A. CZICH, B. EPE, E. GOCKE, B. KAINA, L. MÜLLER, D. POLET, D. UTESCH, Photochemical genotoxicity: principles and test methods. Report of a GUM task force. Mutation Research, v.566, p.65-91, 2004.
BRIDGES, B. A. Genetic damage induced by 254nm ultraviolet light in Escherichia coli:
8-Metoxypsoralen as protective agent and repair inhibitor. Photochemistry and Photobiology, v.14, p.659-662, 1971.
BRIDGES, B.A. Further characterization of repair of 8-Metoxypsoralen crosslinks in UV-excision-detective Escherichia coli. Mutation Research, v.132, p.153-160, 1984.
BRIDGES, B.A. MOTTERSHEAD, R.P. Inactivation of Escherichia coli by near ultravioleta light and
8-methoxypsoralen: different responses of strains B/r and K-12. Journal of Bacteriology, v.139, n.2, p.454-459, 1979.
CADET, J. DOUKI, T. GASPARUTTO, D. RAVANAT, J.-L. Oxidative damage to DNA: formation, measurement and biochemical features. Mutation Research. v.531, p.5–23, 2003.
CADET, J. SAGE, E. DOUKI,T. Ultraviolet radiation-mediated damage to cellular DNA. Mutation Research, v.571, p.3-17, 2005.
CADET, J. VIGNY, P. MIDDEN, W.R. Photoreactions of furocoumarins with biomolecules. Journal of Photochemistry and Photobiology B, v.6, p.197-206, 1990.
46
CASSIER, C. CHANET, R. MOUSTACCHI, E. Mutagenic and recombinogenic effects of DNA cross-links induced in yeast by 8-methoxypsoralen photoaddition, Journal of Photochemistry and
Photobiology, v.39, p.799–803, 1984.
CAVALCANTE, A.K.D. MARTINEZ, G.R. MASCIO, P.D. MENCK, C.F.M. AGNEZ-LIMA, L.F. Cytotoxicity and mutagenesis induced by singlet oxygen in wild type and DNA repair deficient
Escherichia coli strains. DNA Repair, v.1, p.1051-1056. 2002.
CAVALCANTI, S.M.F. SIQUEIRA-JUNIOR, J.P. Cure of prophage in Staphylococcus aureus by
furocumarin photoadtions. Microbios, v. 81, p.85-91, 1995.
CIMINO, G.D., GAMPER, H.B., ISAACS, S.T. HEARST, J.E. Psoralens as photoactive probes of nucleic acid struture and function: Organic Chemistry, photochemistry and biochemistry. Annual Review of Biochemistry, v. 54, p.1151-1193, 1985.
COLE, R.S. Repair of DNA containing interstrand cross-links in Escherichia coli: sequential excision and recombination. Proc. Natl. Acad. Sci. U.S.A., v.70, p.1064–1068, 1973.
COSTA, R.M.A. CHIGANÇAS, V. GALHARDO, R.D.S. CARVALHO, H. MENCK, C.F.M. The eukaryotic nucleotide excision repair pathway. Biochimie, v.85, n.11, p.1083–1099, 2003.
CROMIE, G.A. CONNELLY, J.C. LEACH, D. R. F. Recombination at double-strand breaks and DNA ends: conserved mechanisms from phage to humans. Molecular Cell, v.8, n.6, p.1163–1174, 2001.
COURCELLE, J. KHODURSKY, A. PETER, B. BROWN, P. O. HANAWALT, P. C. Comparative gene expression profiles following UV exposure in wild-type and SOS-deficient Escherichia coli.
Genetics, v. 58, p. 41–64, 2001.
DALL’ACQUA, F. VEDALDI, D. RECHER, M. The phtotoreaction between furocoumarins and
47
DANTUR, K.I. PIZARRO, R.A. Effect of growth phase on the Escherichia coli response to
ultraviolet-A radiation: influence of conditioned media, hydrogen peroxide and acetate. Journal of
Photochemistry and Photobiology: B, v.75, p.33–39, 2004.
DOUKI, T. CADET, J. Individual Determination of the Yield of the Main UV-Induced Dimeric
Pyrimidine Photoproducts in DNA Suggests a High Mutagenicity of CC Photolesions†. Biochemistry,
v.40, n.8, p.2495-2501, 2001.
DOUKI, T. COURT, M. SAUVAIGO, S. ODIN, F. CADET, J. Formation of the Main UV-induced Thymine Dimeric Lesions within Isolated and Cellular DNA as Measured by High Performance Liquid Chromatography-Tandem Mass Spectrometry. Journal of Biological Chemistry, v.275, n.16, p.11678–11685, 2000.
DRONKERT, M.L.G. KANAAR, R. Repair of DNA interstrand cross-links. Mutation Research, v.486, p.217–247, 2001.
EHSANI, A.H. GHANINEJAD, H. KIANI, A. DANESHPAZHOOH, M. HOSSEINI, S.H. NOORMOHAMMADPOOR, P. Comparison of topical 8-methoxypsoralen and narrowband ultraviolet B with narrowband ultraviolet B alone in treatment-resistant sites in plaque-type psoriasis: a placebo-controlled study, Photodermatol. Photoimmunol. Photomed.,v.27, p.294–296, 2011.
ESSEN, L.O. KLAR, T. Light-driven DNA repair by photolyases. Cellular and Molecular Life
Sciences, v.63, n.11, p.1266–1277, 2006.
FONG, K. BOCKRATH, R.C. Inhibition of deoxyribonucleic-acid repair in Escherichia coli by
caffeine and acriflavine after ultravioletirradiation, Journal of Bacteriology, v.139, p.671–674, 1979.
GASPARRO, F.P. Psoralen photobiology: recent advances. Journal of Photochemistry and Photobiology, v.5, p.553-557, 1996.
48
GOERING, R.V. PATTEE, P.A. Mutants of Staphylococcus aureus with increased sensitivity to
ultraviolet radiation. Journal of Bacteriology, v.106, p.157–161, 1971.
GOMES, A. FERNANDES, E. LIMA, J.L.F.C. Fluorescente probes used for detection of reative oxygen species. Journal of Biochemical and Biophysical Methods, v.65, p.45-80, 2005.
GOTTLIEB, P. MARGOLIS-NUNNO, H. ROBINSON, R. SHEN, L-G. CHIMEZIE, E. HOROWITZ, B. BEN-HUR, E. Inactivation of Trypanossoma cruzi trymastigote forms in blood components with a
psoralen and ultraviolet a light. Journal of Photochemistry and Photobiology, v.5, p.562-565, 1996.
GRAETZER, R. MORRISSON, T.W. Effects of 8-methoxypsoralen and near ultraviolet radiadion on the lower eukaryote D. discoideum. Journal of Photochemistry and Photobiology, v.42, p.275-279. 1985.
HASS, B.S. WEBB, R.B. 8-methoxypsoralen effects on survival and repair of Escherichia coli after
ultraviolet irradiation: action spectra. Radiation Research, v.80, n.1, p.170-185, 1979.
HENRIQUES, J.A.P. MOUSTACCHI, E. Isolation and characterization of pso mutants sensitive to photoaddition of psoralen derivatives in Sacharomyces cerevisiae. Genetics, v.95, p.273-288, 1980.
ISAACS, S.T. SHEN, C.J. HEARST, J.E. RAPOPORT, H. Synthesis and Characterization of New Psoralen Derivatives with Superior Photoreactivity with DNA and RNA. Biochemistry, n.6, p.1058-1064, 1977.
IGALI, S., BRIDGES, B.A. ASHWOOD-SMITH, M.J. SCOTT, B.R. Mutagenesis in Escherichia coli
IV. Photosensitization to near ultraviolet ligth by 8-methoxypsoralen. Mutation Research, v. 9, p.21-30, 1970.
JAMES, L.C. COOHILL, T.P. The wavelength dependence of 8-methoxypsoralen photosensitization of radiation-enhanced reactivation in a mammalian cell-virus system, Mutation Research, v.62, p. 407-415, 1979.
49
KITAMURA, N., KOHTANI, S., NAKAGAKI, R. Molecular aspects of furocoumarin reactions: Photophysics, photochemistry, photobiology, and strural analysis. Journal of Photochemistry and Photobiology C, v.6, p. 168-185, 2005.
KLEINAU, O. BÖHM, F. LANTO, B. Different DNA repair time courses in human lymphoid cells after UVA, UVAI, UVB and PUVA in vitro. Journal of Photochemistry and Photobiology B, v.41, p.103–108, 1997.
KRAMER, D.M. PATHAK, M.A. Photoaddition of psoralen and of 4,5’,8-trimethylpsoralen to DNA. Journal of Photochemical and Photobiological, v.12, p.333-337, 1970.
LAGE, C. PÁDULA, M. ALENCAR, T.A.M. GONÇALVES, S.R.F. VIDAL, L.S. CABRAL-NETO, J. LEITÃO, A.C. New insights on how nucleotide excision repair could remove DNA adducts induced by chemotherapeutic agents and psoralens plus UV-A (PUVA) in Escherichia coli cells. Mutation
Research, v.544, p.143–157, 2003.
LAN, L. NAKAJIMA, S. OOHATA Y. In situ analysis of repair processes for oxidative DNA damage in mammalian cells. Proceedings of the National Academy of Sciences of the United States of
America, v.101, n.38, p.13738–13743, 2004.
LIMA-BESSA, K.M.D. ARMELINI, M.G. CHIGANCAS, V. CPDs and 6–4PPs play different roles in UV-induced cell death in normal and NER-deficient human cells. DNA Repair, v.7, n.2, p.303–312, 2008.
LIN, J.-J. SANCAR, A. Reconstitution of nucleotide excision nuclease with UvrA and UvrB proteins from Escherichia coli and UvrC protein from Bacillus subtilis. Journal of Biological Chemistry,
v.265, n.34, p.21337–21341, 1990.
LIRA, R.C. Proteção contra UV curta pelos derivados cumarínicos em Staphylococcus aureus. Efeito
50
LIRA, R.C. Proteção contra UV curta pelos derivados cumarínicos em Staphylococcus aureus. Efeito
da Concentração (Relatório PIBIC). Universidade Federal da Paraíba, João Pessoa, 2007.
LLANO, J., RABER, J., ERIKSSON, L.A. Theoretical study of phototoxic reaction of psoralen. Journal of Photochemistry and Photobiology C, v.154, p.235-243. 2003.
MAVERAKIS, E. MIYAMURA, Y. BOWEN, M.P. CORREA, G. ONO, Y. GOODARZI, H. Light, including ultraviolet. Journal of Autoimmunity, v.34, p.J247-J257, 2010.
MCKENZIE, R.L. BJÖRN, L.O. BAIS, A. ILYASD, M. Changes in biologically active ultraviolet
radiation reaching the Earth’s surface. Journal of Photochemical and Photobiological C, v.2, n. 1, p. 5–15, 2003.
MIOLO. G. DALL’ACQUA, F. MOUSTACCHI, E. SAGE. E. Monofunctional angular
furocoumarins: sequence specificity in DNA photobinding of 6,4,4’-trimethylangelicin and other angelicin. Journal of Photochemical and Photobiological, v.50, p.75-84, 1989.
MUELA, A. GARCÍA-BRINGAS, J.M. SECO, C. ARANA, I. BARCINA, I. Participation of Oxygen and Role of Exogenous and Endogenous Sensitizers in the Photoinactivation of Escherichia coli by Photosynthetically Active Radiation, UV-A and UV-B. Microbial Ecology, v.44, p.354-364, 2002.
ORREN, D.K. SELBY, P. HEARST, J.E. SANCAR, A. Postincision steps of nucleotide excision repair in Escherichia coli. Disassembly of the UvrBC-DNA complex by helicase II and DNA
polymerase I. The Journal of Biological Chemistry, v.267, p.780–788, 1992.
ÖZKAN, I. KÖSE, O.M.D. ÖZMEN, I. ARCA, E., Efficacy and safety of non-laser, targeted UVB phototherapy alone and in combination with psoralen gel or calcipotriol ointment in the treatment of localized, chronic, plaque-type psoriasis. Internat. J. of Dermatol., v.51, p.609–613, 2012.
PÂQUES, F. HABER, J.E. Multiple pathways of recombination induced by double-strand breaks in
Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews, v.63, n.2, p.349–404,
51
PATHAK, M.A. FITZPATRICK, T.B. The evolution of photochemotherapy with psoralens and UVA (PUVA). Journal of Photochemistry and Photobiology, v.14, p.2-22, 1992.
RASTOGI, R.P. RICHA, KUMAR, A. TYAGI, M. B. SINHA, R.P. Molecular Mechanisms of Ultraviolet Radiation-Induced DNA Damage and Repair. Journal of Nucleic Acids, v.2010, p.1-32, 2010.
RAVANAT, J.L. DOUKI, T. CADET, J. Direct and indirect effects of UV radiation on DNA and its components. Journal of Photochemical and Photobiology B, v.63, n.1-3, p.88–102, 2001.
RONTÓ, G. FEKETE, A. GÁSPÁR, S. MÓDOS, K. Action spectra for photoinduzed inactivation of bacteriophage T7 sensitized by 8-Methoxypsoralen and Angelicin, Journal of Photochemical and Photobiology B, v.3, p.497-507, 1989.
SAGE, E. BOYER, V. MOUSTACCHI, E. Sequence specificity in psoralen-DNA photobinding. Biochemical Pharmacol. v.37, p.1829-1830, 1988.
SAGE, E. MOUSTACCHI, E. Sequence context effects on 8-methoxypsoralen photobinding to defined DNA fragments. Biochemistry, v.26, p.3307-3314. 1987.
SANTOS, A.L. GOMES, N.C.M. HENRIQUES, I. ALMEIDA, A. CORREIA, A. CUNHA, A. Contribution of reactive oxygen species to UV-B-induced damage in bactéria. Journal of Photochemistry
and Photobiology B, v.117, p.40–46, 2012.
SCHEINFELD, N. DELEO, V. A review of studies that have utilized different combinations of psoralen and ultraviolet B phototherapy and ultraviolet A phototherapy. Dermatol. Online Journal, v.9, p.5-7, 2003.
SCHUCH, A.P. MENCK, C.F.M. The genotoxic effects of DNA lesions induced by artificial UV-radiation and sunlight. Journal of Photochemistry and Photobiology B, v.99, p.111-116, 2010.