UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE FARMÁCIA, ODONTOLOGIA E ENFERMAGEM PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
TICIANA PRACIANO PEREIRA
ESTUDO DOS EFEITOS RENAIS E VASCULARES DO VENENO DA SERPENTE
Crotalus durissus cumanensis E CROTOXINA
TICIANA PRACIANO PEREIRA
ESTUDO DOS EFEITOS RENAIS E VASCULARES DO VENENO DA SERPENTE
Crotalus durissus cumanensis E CROTOXINA
Dissertação de Mestrado submetida à Coordenação do Programa de Pós-Graduação em Ciências Farmacêuticas da Faculdade de Farmácia, Odontologia e Enfermagem, como requisito para obtenção do título de Mestre em Ciências Farmacêuticas.
Orientador (a): Profª Drª Alice Maria Costa Martins
TICIANA PRACIANO PEREIRA
P496e Pereira, Ticiana Praciano
Estudo dos efeitos renais e vasculares do veneno da serpente Crotalus durissus cumanensis e crotoxina / Ticiana Praciano Pereira, 2009. 99 f ; il. color. enc.
Orientadora: Profa. Dra. Alice Maria Costa Martins Área de concentração: Experimental e Tecnológica
Dissertação (mestrado) - Universidade Federal do Ceará, Centro de Ciências da Saúde. Depto. de Farmacia, Fortaleza, 2009
1. Crotalus durissus cumanensis. 2. Crotoxina. 3. Perfusão renal. I. Martins, Alice Maria Costa (orieta.). II. Universidade Federal do Ceará – Programa de Pós-Graduação em Ciências Farmacêuticas. III. Título.
CDD 615.1
ESTUDO DOS EFEITOS RENAIS E VASCULARES DO VENENO DA SERPENTE
Crotalus durissus cumanensis E CROTOXINA
Dissertação de Mestrado submetida à Coordenação do Programa de Pós-Graduação em Ciências Farmacêuticas da Faculdade de Farmácia, Odontologia e Enfermagem, como requisito para obtenção do título de Mestre em Ciências Farmacêuticas
BANCA EXAMINADORA
_____________________________________ Profª Drª Arlândia Cristina Lima Nobre de Morais
Universidade de Fortaleza (UNIFOR)
_______________________________________ Profª Drª Janaína Serra Azul Monteiro Evangelista
Universidade Estadual do Ceará (UECE)
_______________________________________ Profª Drª Alice Maria Costa Martins (orientadora)
AGRADECIMENTOS
Aos meus pais e irmãs, sempre ao meu lado me incentivando e me tolerando nos momentos de impaciência.
Á Profª. Drª. Alice Maria C. Martins que me orientou e apoiou durante o curso.
Ao Prof. Dr. Pedro Jorge Caldas Magalhães pela prestatividade colaborando com os experimentos no Laboratório de Fisiologia do Músculo Liso.
À Dra. Helena Serra Azul Monteiro pela disponibilização de sua equipe para a realização dos experimentos no Laboratório de Farmacologia de Venenos e Toxinas.
Ao Prof. Marcus H. Toyama e Eduardo Britto Diz Filho, por ceder o veneno e fração em estudo.
Aos meus inúmeros e queridos amigos pela amizade demonstrada nos meus momentos de angústia. Especialmente á amiga e mestranda Suzana Bezerra, que participou de todas as etapas.
A todos os colegas do Laboratório de Fisiologia do Músculo Liso, especialmente aos alunos de Iniciação Científica, Teresinha de Jesus e Franzé por toda ajuda nos experimentos em aorta.
Aos alunos do LAFAVET, principalmente ao Daniel Freire e Rafael Ximenes pela prestatividade e amizade.
Aos colegas do curso de mestrado em Ciências Farmacêuticas e demais professores do Departamento de Farmácia.
Aos alunos de Iniciação científica do LAFAVET e do Departamento de Farmácia.
À Raimundinha, secretária do mestrado, por todos os favores prestados.
Aos técnicos e demais colaboradores do Instituto de Biomedicina.
RESUMO
ESTUDO DOS EFEITOS RENAIS E VASCULARES DO VENENO DA SERPENTE
Crotalus durissus cumanensis E CROTOXINA
Os acidentes ofídicos envolvendo o gênero Crotalus, são graves e frequentemente fatais devido à freqüência que evolui para a falência renal aguda. Considerando a insuficiência de esclarecimentos dos efeitos toxinológicos do veneno da Crotalus. durissus cumanensis teve-se a necessidade de conduzir um estudo dos efeitos renais e vasculares ocasionados pelo veneno total e fração crotoxina. Os efeitos renais foram avaliados através da perfusão de rim isolado. A infusão do veneno na concentração de 10µg/mL produziu um aumento na pressão de perfusão (PP), na resistência vascular renal (RVR) e uma diminuição do ritmo de filtração glomerular (RFG) e no fluxo urinário (FU). O veneno foi causou ainda redução nos transportes tubulares de sódio (%TNa+) e cloreto (%TCl-). No grupo perfundido com crotoxina (10µg/mL), não foi observada alterações significativas na PP e RVR. Porém, o RFG foi diminuído enquanto que o FU aumentou. A crotoxina reduziu ainda os transportes tubulares de sódio, potássio e cloreto. Na avaliação da citotoxicidade em células tubulares renais MDCK pelo método MTT, o veneno total da C. d. cumanensis causou um efeito citotóxico direto dependente da concentração com um valor de CI50 de
5,38µg/mL. O presente estudo avaliou os efeitos vasculares do veneno total e crotoxina em ensaios com aorta isolada. Em anéis de aorta pré-contraídas com fenilefrina (Phe 0,1 µM) com endotélio intacto, o veneno da C. d. cumanensis (0,1 – 30,0µg/mL) produziu um aumento máximo da contração para 130,0 ± 6,6% na concentração de 30,0µg/mL. Em contraste, em anéis ausentes de endotélio, a vasoconstrição foi reduzida para 66,7 ± 6,6% (50,0 µg/mL). Efeito similar observados nas preparações pré-contraídas com potássio (K+ 40mM), em que ocorreu um aumento das contrações em anéis com endotélio intacto para 115,6 ± 4,9% (30,0µg/mL) e um efeito vasorelaxante (70,9 ± 4,9%) na concentração de 50,0µg/mL, após a remoção do endotélio. Nos ensaios com anéis pré contraídos com fenilefrina e potássio a adição cumulativa de crotoxina (0,1 – 30,0µg/mL) não modificou a contratilidade aórtica. Em conclusão, o veneno total e a fração crotoxina causam toxicidade em rins isolados, entretanto, somente o veneno total possui um efeito citotóxico direto nas células tubulares renais. Em anéis de aorta o veneno total produz um efeito vasoconstritor dependente da integridade do endotélio. Sugere-se que os efeitos tóxicos produzidos pelo veneno da Crotalus durissus cumanensis em rim e aorta isolada, provavelmente deve-se a participação de outras frações ou a um sinergismo dos componentes que compõe o veneno total.
ABSTRACT
RENAL AND VASCULAR EFFECTS FROM Crotalus durissus cumanensis VENOM AND CROTOXIN.
Ophidian accidents involving species of the genus Crotalus, are usually serious and frequently fatal due to the frequency of acute renal failure. Unfortunately, there have been few studies of the toxinologic effects of Crotalus durissus cumanensis venom. The renal effects of the venom used in this study were observed by perfusion of isolated kidneys. Infusion of C. d. cumanensis venom (10 µg/mL) produced an increase in perfusion pressure (PP) and renal vascular resistance (RVR). Urinary flow (UF) and glomerular filtration rate (GFR) were reduced. The venom was able to decrease the percentage of sodium tubular transport (%TNa+) and the percentage of chloride tubular transport (%TCl-). In kidneys perfused with (10 µg/mL) crotoxin, there were no significant changes in PP or RVR. The GFR decreased, while the UF increased. In contrast with whole venom, crotoxin reduced %TNa+, %TK and %TCl-. Analysis of the cytotoxic effects of Crotalus durissus cumanensis venom and crotoxin on renal tubular MDCK cells was performed by the MTT method. The venom promoted a concentration-dependent cytotoxic effect with an IC50 valueof 5.38 µg/mL.
In aortic rings precontracted by phenylephrine (Phe; 0.1 µM) with intact endothelium, C. d. cumanensis venom (0.1–30.0 µg/mL) resulted in an increased maximal contraction up to 130.0 ± 6.6% at a concentration of 30.0 µg/mL. In contrast, in endothelium denuded rings, vasocontraction was reduced in a concentration-dependent manner to 66.7 ± 4.9% (50.0 µg/mL). The effect was similar in the case of potassium-induced contraction (K+; 40 mM), in which there was a significant increase in the contraction of endothelium intact rings up to 115.6 ± 4.9% (30.0 µg/Ml) and a vasorelaxant effect (70.9 ± 4.7%) at a dose of 50.0 µg/mL after removal of the endothelium. In conclusion, C. d. cumanensis venom and crotoxin cause toxicity in isolated kidneys, however, only the whole venom has a cytotoxic effect on renal tubular cells. In aortic ring assays, whole venom causes endothelium dependent vasoconstriction. It is suggested that the toxic effects produced by the venom of Crotalus durissus cumanensis in kidney and isolated aorta, probably due to the participation of other fractions or a synergism of the components that make up the total venom.
LISTA DE FIGURAS
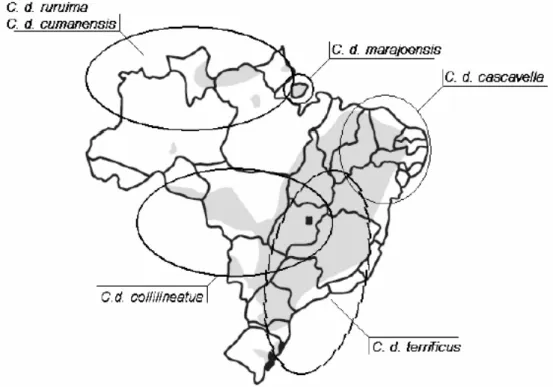
Figura 1. Distribuição geográfica das subespécies da Crotalus durissus no Brasil.
19
Figura 2. Crotalus durissus cumanensis. 21
Figura 3. a) Perfil cromatográfico do fracionamento do veneno total da C. d. cumanensis em HPLC de exclusão molecular; b) Análise do veneno total (WV), crotoxina (Crtx), Convulxina (CVX) e Crotamina (Crot) em Tricine PAGE-SDS.
37
Figura 4. Desenho esquemático do sistema de perfusão de rim isolado. 39
Figura 5. Esquema simplificado do cultivo das culturas de células MDCK 44
Figura 6. Esquema simplificado dos ensaios de viabilidade celular. 45
Figura 7. Desenho esquemático do sistema utilizado para o registro de contrações de órgãos isolados.
47
Figura 8. Efeito do veneno total da C. d. cumanensis (10µg/mL) na pressão de perfusão.
54
Figura 9. Efeito do veneno total C.d.cumanensis (10µg/ml) na resistência vascular renal.
55
Figura 10. Efeito do veneno total C.d.cumanensis (10µg/mL) no fluxo urinário. 56
Figura 11. Efeito do veneno total C.d.cumanensis (10µg/mL) no ritmo de filtração glomerular.
57
Figura 12. Efeito do veneno total C.d.cumanensis (10µg/mL) no percentual de transporte tubular de sódio (%TNa+).
58
Figura 13. Efeito do veneno total da C.d.cumanensis (10µg/mL) no percentual de transporte tubular de cloreto (%TCl-).
59
Figura 14. Efeito da crotoxina isolada do veneno da C.d.cumanensis (10µg/mL) no ritmo de filtração glomerular.
61
Figura 15. Efeito da crotoxina isolada do veneno da C.d.cumanensis (10µg/mL) no fluxo urinário.
Figura 16. Efeito da crotoxina isolada do veneno da C.d.cumanensis (10µg/mL) no percentual de transporte tubular de sódio (%TNa+).
63
Figura 17. Efeito da crotoxina isolada do veneno da C.d.cumanensis (10µg/mL) no percentual de transporte tubular de potássio (%TK+).
64
Figura 18. Efeito da crotoxina isolada do veneno da C.d.cumanensis (10µg/mL) no percentual de transporte tubular de cloreto (%TCl-).
65
Figura 19. Efeito do veneno da C.d.cumanensis em células tubulares renais MDCK.
67
Figura 20. Fotomicrografia das células tubulares renais MDCK após exposição com veneno da C. d. cumanensis. A: controle; B:25 µg/mL.
68
Figura 21. Fotomicrografia das células tubulares renais MDCK após exposição com veneno da C. d. cumanensis. A: controle; B: 50 µg/mL.
69
Figura 22. Fotomicrografia das células tubulares renais MDCK após exposição com veneno da C. d. cumanensis. A: controle; B: 100 µg/mL.
70
Figura 23. Efeito do veneno total da C.d.cumanensis (0,1 – 30 µg/mL) no tônus basal em aorta isolada de ratos (●; n = 4).
71
Figura 24. Curva concentração – resposta do veneno da C.d.cumanensis em aorta com o endotélio intacto (●, n = 4; 0,1 – 30 µg/mL) ou sem endotélio (●, n = 4; 0,1 – 50 µg/mL) após pré-contração do tecido com Phe (1µM).
73
Figura 25. Curva concentração – resposta do veneno da C.d.cumanensis em aorta com o endotélio intacto (●, n = 4; 0,1 – 30 µg/mL) ou sem endotélio (●, n = 4; 0,1 – 50 µg/mL) após pré-contração do tecido com Phe (1µM).
75
Figura 26. Efeito do veneno total da C.d.cumanensis (30µg/mL) em anéis de aorta pré-contraídos por fenilefrina (Phe 0,1µM) em meio ausente de cálcio..
77
Figura 27. Curva concentração – resposta da crotoxina isolada do veneno da C.d.cumanensis em aorta com o endotélio intacto (●, n = 4; 0,1 – 30 µg/mL) tecido com Phe 0,1µM.
79
Figura 28. Curva concentração – resposta da crotoxina isolada do veneno da C.d.cumanensis em aorta com o endotélio intacto (●, n = 4; 0,1 – 30 µg/mL) tecido com K + 40 mM.
LISTAS DE TABELAS E QUADROS
Tabela 1. Substâncias utilizadas em tratamentos e diagnósticos laboratoriais originados de venenos de serpentes.
17
Tabela 2. Distribuição de casos e óbitos de acidentes crotálicos por região no Brasil. Dados referentes ao ano de 2005.
18
Tabela 3. Fórmulas utilizadas para determinação dos parâmetros renais. 42
Tabela 4. Parâmetros de função renal do grupo tratado com veneno da C.d.cumanensis (0,3µg/mL).
53
Quadro 1. Principais frações dos venenos crotálicos e seus respectivos efeitos.
LISTA DE ABREVIATURAS
BPPs Peptídeos potenciadores de angiotensina
CA
CB
CI50
Crotapotina
Fosfolipase A2
Concentração para inibir 50% de um parâmetro
ECA Enzima conversora de angiotensina
EDTA Ácido etilenodiamino tetra-acético
EGTA Etileno-glicol bi(2-amino etil éter)-N,N,N’N-tetra acetil ácido
FU Fluxo urinário
HPLC High performencer liquid chromatography
IRA Insuficiência renal aguda
L-NAME Nitro-L-arginine methyl ester
MDCK Madin-Darby canine kidney
MTT 3-(4,5-dimetilazil-2-il)-2,5 difenil tetrazólico
PLA2 Fosfolipase A2
PP Pressão de perfusão
PBS Solução salina tamponada com fosfato
RFG Ritmo de filtração glomerular
RVR Resistência vascular renal
SBF Soro bovino fetal
SUMÁRIO
Resumo 07
Abstract 08
Lista de Figuras 09
Lista de Tabelas e Quadros 11
Lista de Abreviaturas 12
1 INTRODUÇÃO 15
1.1 Aspectos epidemiológicos 17
1.2 O gênero Crotalus 18 1.2.1 Crotalus durissus cumanensis 20 1.3 Características gerais dos envenenamentos crotálicos 21
1.4 O veneno crotálico 22
1.4.1 Componentes 22
1.4.2 Atividades biológicas 26
1.5 Efeitos renais dos venenos de serpentes 26
1.6 Efeitos vasculares dos venenos de serpentes 29
2 JUSTIFICATIVA 31
3 OBJETIVOS 33
3.1 Objetivos Gerais 34
3.2 Objetivos específicos 34
4 MATERIAIS E MÉTODOS 36
4.1 Veneno 36
4.1.1 Isolamento e purificação da crotoxina da Crotalus durissus cumanensis
36
4.2 Animais 37
4.3 Estudos dos efeitos renais do veneno da Crotalus durissus cumanensis e crotoxina.
38
4.3.1 Perfusão de Rim Isolado 38
4.3.1.1 Preparo da solução perfusora 39
4.3.1.3 Grupos Experimentais 40
4.3.1.4 Protocolo Experimental 41
4.3.1.5 Análises bioquímicas dos perfusatos e urinas 41
4.3.1.6 Cálculo dos parâmetros funcionais renais 41
4.3.2 Ensaios com células tubulares renais 43
4.3.2.1 Cultivo e tratamento das células tubulares renais MDCK (Madin-Darby Canine Kidney)
43
4.3.2.2 Ensaios de viabilidade e citotoxicidade celular 44 4.4 Estudos dos efeitos vasculares do veneno da Crotalus durissus
cumanensis e crotoxina
46
4.4.1 Ensaios em anel de aorta 46
4.4.1.1 Protocolos Experimentais 47
4.5 Análises Estatísticas 49
4.6 Aspectos éticos 50
5 RESULTADOS 52
5.1 Perfusões em rim isolado 52
5.2 Efeitos do veneno da Crotalus durissus cumanensis e crotoxina sobre células MDCK (Madin-Darby Canine Kiney)
66
5.3 Ensaios em anel de aorta 71
6 DISCUSSÃO 82
7 CONCLUSÃO 89
8 REFERÊNCIAS BIBLIOGRÁFICAS 91
1 INTRODUÇÃO
O Brasil possui uma vasta e diversificada fauna e flora, podendo servir de fonte de novos compostos terapêuticos. Estudos com substâncias de origem natural possuem hoje uma grande importância no entendimento dos processos fisiopatológicos de doenças e na descoberta de moléculas com potencial farmacológico. Nesse contexto, os venenos ofídicos e suas toxinas têm servido como ferramentas nos estudos bioquímicos, fisiológicos e patológicos (FARSKY et al., 2005).
Os venenos são substâncias produzidas pelo animal com função de defesa contra o predador e no auxílio da digestão. São constituídos por componentes de diferente natureza, incluindo proteínas citotóxicas e polipeptídios biologicamente ativos, compreendendo cerca de 90 a 95% do peso seco do veneno. Devido a sua ação altamente específica para as células, as toxinas animais têm sido utilizadas na elucidação de mecanismos celulares e em pesquisas farmacológicas, in vivo e in vitro, para o tratamento da dor, diabetes, esclerose múltipla, câncer,
problemas cardiovasculares entre outras (LEWIS e GARCIA, 2003). A seletividade destas moléculas bioativas vem atraindo o interesse de pesquisadores há várias décadas em estudos com diferentes espécies de animais, sobretudo as serpentes.
encontrar no mercado farmacêutico produtos originados de componentes de venenos de diversas espécies de serpentes (Tabela 1).
Tabela 1: Substâncias utilizadas em tratamentos e diagnósticos laboratoriais originados de
venenos de serpentes.
Droga / nome comercial
Ação / tratamento Origem
Captopril®; Enalapril®
Inibidor da ECA/ Hipertensão Bothrops jararaca
Defibrase Inibidor da trombina e protrombina
Bothrops moojeni
Ancrod (Viprinex) Inibidor de fibrinogênio Agkistrodon rhodostoma
Hemocoagulase
Efeito trombina-like e atividade tromboplastina/ prevenção e tratamento de hemorragia
Bothrops atrox
Protac Ativador da proteína C /
diagnósticos clínicos de desordens hemostáticas
Agkistrodon contortix contortix
Reptilase Diagnósticos para desordens
de coagulação
Bothrops jararaca
Fonte: KOH et al., 2006.
1.1 Aspectos epidemiológicos
Os acidentes ofídicos no Brasil ao longo de décadas continuam demonstrando uma alta freqüência com graves conseqüências. Dados do Ministério da Saúde relatam que ocorrem aproximadamente cerca de 27.000 acidentes ofídicos por ano, com uma mortalidade de 0,45% (BRASIL, 2001).
produzem toxinas em glândulas especializadas e têm aparelhos apropriados para inoculá-las (INSTITUTO BUTANTAN, 2008). O grupo mais importante para a saúde pública é o da família Viperidae, que inclui os gêneros Crotalus, Bothrops e Lachesis (MELGAREJO, 2003).
Dos 28.597 casos de acidentes ofídicos ocorridos em 2005, o ocasionado pelo gênero Bothrops foi o responsável pela maioria dos acidentes, correspondendo a 87,5% dos casos, seguido pelo acidentes causados pelo gênero Crotalus com 9,2% (ARAUJO et al., 2008). Contudo, o envenenamento crotálico apresenta maior letalidade, aproximadamente 1,8%, devido à freqüência com que evolui para a insuficiência renal aguda, ocorrendo uma variação do número de óbitos de acordo com a região do país (BRASIL, 2001) (Tabela 2).
Tabela 2- Distribuição de casos e óbitos de acidentes crotálicos por região no Brasil.
Dados referentes ao ano de 2005.
REGIÃO N° de casos N° de óbitos
Norte 168 1
Nordeste 554 11
Sudeste 763 5
Sul 115 0
Centro-Oeste 285 2
Brasil 1.885 19
Fonte: Ministério da Saúde, Fundação Nacional de Saúde, Acidentes por animais
peçonhentos - Ofidismo. (adaptado por FERNANDES et al., 2008).
1.2 O gênero Crotalus
espécie, a Crotalus durissus (Figura 1). São popularmente conhecidas como cascavéis, maracambóia e maracá, não possuindo o hábito de atacar, mas quando ameaçadas emitem o som característico de seu “chocalho”. Em nosso país já foram identificadas as seguintes subespécies:
- Crotalus durissus terrificus: Minas Gerais até Rio Grande do Sul (DIZ FILHO, 2007)
- Crotalus durissus cascavella: Região da caatinga (PINHO e PEREIRA, 2001);
-Crotalus durissus collilineatus: São Paulo, Mato Grosso, Minas Gerais, Distrito Federal e Goiás (PINHO, 2000; PINHO e PEREIRA, 2001);
- Crotalus durissus ruruima: Roraima, Amapá, Pará e Amazonas (PINHO et al., 2000);
- Crotalus durissus marajoensis: Ilha de Marajó, Pará (PINHO e PEREIRA, 2001);
- Crotalus durissus cumanensis: Norte do Brasil (PONCE-SOTO et al., 2007)
Figura 1.Distribuição geográfica das subespécies da Crotalus durissus no Brasil.
1.2.1 Crotalus durissus cumanensis
A serpente Crotalus durissus cumanensis (Figura 2) é uma subespécie distribuída na Venezuela e no Norte do Brasil em áreas de contato com a subespécie C. d. ruruima no estado de Roraima (DIZ FILHO, 2007; PONCE-SOTO et al., 2007).
Seu veneno possui poderosa atividade neurotóxica, porém, tem sido descrito baixa atividade proteolítica (PONCE-SOTO, 2007). A composição pode variar de acordo com a região geográfica em que o animal habita, apresentando diferentes níveis de toxicidade. O componente predominante é a crotoxina, fração responsável pelos principais efeitos causadores das mortes por falência cardíaca aguda e paralisia respiratória (DE LA SALAS et al., 2006; HERNÁNDEZ et al., 2007). Sua atividade cardiotóxica é proveniente da ação direta no músculo cardíaco ou através de liberação de mediadores.
Figura 2: Crotalus durissus cumanensis
Fonte: www.venomousreptiles.org
1.3 Características gerais dos envenenamentos crotálicos
• Ação neurotóxica: Ocasiona bloqueio neuromuscular e conseqüentemente paralisia motora e respiratória e até convulsões. Normalmente está relacionada com a fração crotoxina que age nas terminações nervosas;
• Ação miotóxica: Causa lesões nas fibras musculares esqueléticas (rabdomiólise) ocasionando liberação de mioglobina na urina;
• Ação coagulante: Altera a coagulação sanguínea convertendo o fibrinogênio em fibrina através da atividade enzimática similar a trombina (trombina-like).
1.4 O veneno crotálico
1.4.1 Componentes
A composição dos venenos crotálicos é complexa, incluindo proteínas, enzimas e peptídeos. Apresenta uma ampla variabilidade intraespecífica de seus constituintes que pode estar associada a diversos fatores como idade, localização geográfica, sexo e hábitos alimentares do animal (RANGEL-SANTOS et al., 2004; DOS-SANTOS et al., 2005; AGUILAR et al., 2007). Estas variações bioquímicas e biológicas geram diferentes conseqüências clínicas e implicações terapêuticas (PONCE-SOTO et al., 2007).
Crotoxina
A crotoxina é a fração predominante no veneno crotálico correspondendo a 50 a 60% do veneno total, sendo responsável pelo efeito neurotóxico e miotóxico (SOARES et al, 2001; PONCE-SOTO et al., 2002). A toxicidade mediada pela crotoxina apresenta similaridade nas diferentes espécies do gênero Crotalus.
É uma potente β-neurotoxina com ação pré-sináptica inibindo a liberação de acetilcolina nos nervos terminais produzindo bloqueio neuromuscular. É constituída de crotapotina (uma subunidade protéica, ácida e não tóxica), e fosfolipase A2 (subunidade básica com alta atividade enzimática)(SOARES et al.,
2001). A fosfolipase A2 (PLA2) exibe uma variedade de efeitos e pode interferir em
diferentes processos fisiológicos, sendo classificadas em citosólica, de alto peso molecular (31-110 KDa) e secretórias, com menor peso molecular (14-18 KDa) (AMORA, 2008). As subunidades crotapotina (CA) e fosfolipase A2 agem de forma
sinérgica de modo que, uma variação em alguns aminoácidos na estrutura primária da subunidade PLA2, resulta em ações distintas, o que talvez possa explicar a
diversidade de atividades farmacológicas e fisiológicas desta proteína (PERALES et al., 1995). Alguns autores sugerem que a CA atue como carreador da fosfolipase A2
evitando sua ligação a sítios não específicos e, portanto, potencializando sua toxicidade (PERALES et al., 1995; SOARES et al., 2001; RANGEL-SANTOS et al., 2004; BEGHINI et al., 2008).
Rangel-Santos e colaboradores (2004) em estudo comparativo com venenos da C. d. cascavella, C. d. terrificus e C. d. collilineatus, demonstraram que a PLA2 mantém o mesmo perfil de atividade miotóxica nos três venenos, porém,
menor atividade que aos efeitos desempenhados pela crotoxina. Estes achados reforçam a idéia de que a toxicidade do complexo crotoxina é mediada pela interação das duas subunidades. A imunização com a PLA2 pode desempenhar um
Crotamina
O componente crotamina, isolado primeiramente do veneno da C.d.terrificus, constitui 17% (p/p) do peso total do veneno seco. É denominada como
sendo um polipeptídio de baixo peso molecular, básico, mionecrótico, ausente de atividade enzimática e pertencente à família das miotoxinas (OLIVEIRA e SILVA, 2005).Sua ação tóxica é caracterizada por agir nas células musculares esqueléticas ocasionando paralisia muscular, devido a despolarização da membrana, afetando o influxo de cálcio e interagindo com os canais de sódio. Sua presença é observada nas demais subespécies do gênero Crotalus, mostrando um polimorfismo dependendo da localização geográfica em que a serpente habita. Essa variação ocorre no conteúdo, seqüência e principalmente na atividade biológica dessa toxina, como relatado por Ponce-Soto e colaboradores (2007), que isolaram e seqüenciaram duas novas isoformas da crotamina no veneno da C.d. cumanensis.
Convulxina e Giroxina
A convulxina, uma glicoproteína pertencente à família das Lectina tipo C de alto peso molecular (72-kDa), liga-se fortemente aos receptores de glicoproteínas tipo VI provocando alterações da hemostasia através da indução da agregação plaquetária (BARRAVIEIRA, 1994; POLGAR, 1997; JANDROT-PERRUS, et al., 1998). De modo semelhante, a fração giroxina presente na Crotalus durissus terrificus, interfere no sistema hematológico e cardiovascular (MAGRO et al., 2001;
SANTORO, 1999).
Trombina-símile
A seguir, quadro resumo com os principais componentes e suas respectivas ações biológicas (Quadro 1).
Quadro 1. Principais frações dos venenos crotálicos e seus respectivos efeitos
COMPONENTES CARACTERÍSTICAS / AÇÕES
Crotoxina
Constitui 50 - 60% do veneno total (SOARES et al., 2001; PONCE-SOTO et al., 2002); Ação neurotóxica;
Nefrotoxicidade (MARTINS et al,2002) Composta por crotapotina e Fosfolipase A2
Crotamina
Pertencente a família das miotoxinas; Indutora de espasmos musculares; Descrito como peptídeo com ação analgésica (MANCINI et al., 1998).
Convulxina
Pertence a família das Lectinas com alto peso molecular; Causadora de alterações na hemostasia
(BARRAVIEIRA, 1994; POLGAR,
1997; JANDROT-PERRUS, et al., 1998).
Giroxina
Interferem no sistema hematológico e cardiovascular (MAGRO et al., 2001; SANTORO, 1999).
Trombina-símile
1.4.2 Atividades biológicas
Os venenos de serpentes são recursos naturais que contém diversos componentes com valor terapêutico, assim, suas toxinas podem desempenhar diferentes funções biológicas.
O efeito analgésico dos venenos crotálicos tem sido demonstrado em humanos e em modelos animais (PICOLO et al., 1998; BRIGATTE et al., 2001). Vítimas de acidentes com Crotalus durissus terrificus relatam uma sensação de analgesia na área afetada que tem sido relacionada ás miotoxinas e aos constituintes não tóxicos dos venenos (MANCINI et al., 1998; CURY, 2007). Estudos indicam que a atividade antinociceptiva ocorre provavelmente a uma resposta supra-espinhal com envolvimento dos receptores opióides e do óxido nítrico (GIORGI et al., 1993; PICOLO et al., 1998, 2000). Por outro lado, segundo Zhang e colaboradores (2006), a ação analgésica da fração crotoxina da mesma serpente apresenta mecanismos diferentes, mas ainda não esclarecidos.
Moreira (2007) comparou o efeito analgésico dos venenos da C. d. collilineatus com presença e ausência de crotamina, observando que ambas as
amostras apresentavam um efeito antinociceptivo, porém, o veneno crotamino positivo demonstrou mecanismos periféricos, central espinhal e supra-espinhal, enquanto que, o crotamino negativo apenas periférico, sugerindo que outras substâncias presentes no veneno atuem na analgesia periférica.
resposta inflamatória aguda induzida por carragenina (edema de pata). O pré-tratamento dos animais com o veneno da C. d. terrificus diminuiu a formação de edema com efeito de longa duração (7 dias) e com maior efetividade quando comparado com indometacina, dexametasona e L-NAME, mostrando assim, elevado potencial terapêutico.
Outros efeitos estão descrito tais como, atividade dos venenos da C. d. terrificus e C. d. collilineatus contra o parasita da leishmaniose (PASSERO et al., 2007) e atividade antifúngica do veneno da C. d. cumanensis (MAGALDI et al., 2002).
1.5 Efeitos renais dos venenos de serpentes
As injúrias renais têm sido relatadas em diversos casos associados aos envenenamentos ofídicos de diferentes gêneros sendo predominante, na América do Sul, nos acidentes pelos gêneros Bothrops e Crotalus, (PINHO et al., 2000) com maior prevalência nos causados por venenos crotálicos (CASTRO, 2006).
O rim, por ser um órgão altamente vascularizado, está propenso aos efeitos tóxicos gerados pelos venenos. A insuficiência renal aguda (IRA) é a principal complicação e causa primária de morte dos envenenamentos. A patogênese da IRA devido ao envenenamento ofídico, não está bem elucidada, mas estudos demonstram que o comprometimento renal pode variar, entretanto, envolvem todas as estruturas, apresentando geralmente necrose tubular, provocada por isquemia e/ou ação nefrotóxica direta e glomerulonefrite. É evidenciado clinicamente um decréscimo abrupto do ritmo de filtração glomerular, diurese e fluxo renal (KOHLI e SAKHUJA, 2003). Outras alterações também são observadas como, hematúria, mioglobinúria, proteinúria, choque e coagulação intravascular (CASTRO, 2006; SITPRIJA, 2006).
túbulos dilatados, necrose celular, edema intersticial e infiltração de células inflamatórias (KOHLI e SAKHUJA, 2003).
Esses achados fisiológicos são conseqüências de falência renal que muitas vezes não são evitados pelo tratamento com o soro antiofídico (BOER-LIMA et al., 1999; EVANGELISTA, 2008; PINHO e PEREIRA, 2001; SITPRIJA, 2006). Estudos prévios sugerem uma correlação entre a ocorrência da injúria renal e o intervalo de tempo em que ocorreu a inoculação do veneno e a administração do soro antiofídico específico (PINHO et al., 2008).
Estudos com os venenos das serpentes C. d. cascavella, C. d. terrificus, C. d. collilineatus e suas frações têm sido realizados em rim isolado demonstrando alterações renais significativas. Martins e colaboradores (1998) em estudo com o veneno da C. d. cascavella, observaram um aumento da pressão de perfusão (PP), fluxo urinário (FU) e diminuição do ritmo de filtração glomerular (RFG), sugerindo um efeito nefrotóxico decorrente da ação direta do veneno nas células tubulares e glomerulares e indiretamente por liberação de mediadores das células endoteliais. Essas mudanças nos parâmetros de função renal foram relacionadas com o componente crotoxina, que alterou todos os parâmetros analisados diferentemente dos outros componentes avaliados, giroxina e convulxina (MARTINS et al., 2002).
sugerem que ambos componentes estão envolvidos na toxicidade renal, provavelmente devido ao sinergismo de diferentes componentes do veneno (AMORA et al., 2006).
Essa diferença nos efeitos renais indica a existência de variabilidade dos componentes dos venenos de serpentes dentro da mesma espécie, sendo observações importantes para um diagnóstico e terapia precisa.
1.6 Efeitos vasculares dos venenos de serpentes
O isolamento dos inibidores da enzima conversora de angiotensina (ECA) do veneno da serpente Bothrops jararaca por Ferreira em 1965, proporcionou uma intensificação nas pesquisas nas ações vasculares ocasionados por envenenamento de serpentes. As toxinas de origem ofídica podem produzir profundos efeitos cardiovasculares ocasionando alterações na permeabilidade vascular por interações com canais iônicos ou por receptores específicos e através de liberação de mediadores proporcionando injúrias teciduais (JOSEPH et al., 2004).
A cardiotoxina presente no veneno da Naja naja atra é descrita por afetar a excitabilidade das células, causando despolarização e contração do músculo cardíaco, esquelético e liso (KOH et al., 2006). Os estudos com músculo liso vascular demonstraram que a contração induzida pela cardiotoxina está associada com o influxo de cálcio e o bloqueio desses canais proporciona uma inibição da contração (KWAN et al., 2002).
Diferentes componentes dos venenos podem ter implicações na terapêutica ou contribuir no entendimento dos mecanismos cardiovasculares. O isopeptídeo sarafotoxina, isolado no veneno do gênero Atractaspis, é utilizado como agonista seletivo dos receptores das endotelinas de mamíferos. A atividade vasoconstrictora desses peptídeos ocasiona espasmos coronários pela interação com seus receptores específicos ET(A) e ET(B) (DUCANCEL, 2005). Nos venenos de três espécies de serpentes da subfamília Crotalinae, Agkistrodon bilineatus, Crotalus viridis e Lanchesis muta, foram identificados peptídeos de baixo peso molecular exercendo efeito antagonista na vasodilatação induzida por bradicinina nos receptores B2 em artérias de ratos. O componente, denominado peptídeo inibidor de
bradicinina (BIP), não fornece um potente efeito vasoconstritor como a sarafotoxina, mas pode constituir ferramenta como protótipo de novas moléculas de antagonista. (GRAHAM et al., 2005).
2 JUSTIFICATIVA
Os venenos de animais são constituídos por um grande número de toxinas que são capazes de agir nos tecidos e nos componentes do plasma com conseqüências tóxicas e efeitos farmacológicos. Os venenos das serpentes da espécie Crotalus durissus apresentam variações intraespecíficas, levando a diferentes implicações fisiopatológicas (SARAIVA et al., 2002; AGUILAR et al., 2007) que podem estar relacionadas com a idade, o sexo e, principalmente, com o ambiente geográfico em que o animal habita. Esses fatos possuem fundamental importância na sintomatologia do envenenamento e no seu respectivo tratamento.
Os envenenamentos crotálicos podem ocasionar diferentes manifestações nos diversos sistemas do organismo. Alguns dos componentes destes venenos são responsáveis por uma ação direta no músculo cardíaco, renal, vascular e nos capilares (HERNÁNDEZ et al., 2007). Possuem poderosa atividade neurotóxica causando paralisia respiratória (PONCE-SOTO et al., 2007) e insuficiência renal aguda podendo conduzir a morte.
Os mecanismos desencadeadores da IRA por envenenamentos ofídicos possuem algumas divergências, necessitando de maiores esclarecimentos. Alguns autores atribuem sua ocorrência ás trocas hemodinâmicas e isquemia renal, outros propõe uma ação citotóxica direta dos componentes dos venenos em células epiteliais renais (COLLARES-BUZATO, 2002). Experimentos com culturas de células representam uma importante ferramenta para a elucidação dos eventos celulares, assim, a utilização de células tubulares renais MDCK (Madin-Darby Canine Kidney) pode possibilitar uma caracterização mais específica das alterações renais auxiliando na prevenção da IRA.
3 OBJETIVOS
3.1 Objetivo Geral
Estudar os efeitos renais e vasculares do veneno total da serpente Crotalus durissus cumanensis e fração crotoxina.
3.2 Objetivos específicos
Avaliar o efeito do veneno e crotoxina da Crotalus durissus cumanensis em perfusão de rim isolado.
Avaliar o efeito do veneno e crotoxina da Crotalus durissus cumanensis sobre as células tubulares renais MDCK.
Estudar o efeito do veneno e crotoxina da Crotalus durissus cumanensis em aorta isolada.
4 MATERIAIS E MÉTODOS
Os experimentos foram realizados nos Laboratórios de Farmacologia de Venenos e Toxinas (LAFAVET) e de Fisiologia do Músculo Liso do Instituto de Biomedicina (IBIMED), Faculdade de Medicina e no Laboratório de Cultivo Celular do Departamento de Análises Clínicas e Toxicológicas, Faculdade de Farmácia. Universidade Federal do Ceará.
4.1 Veneno
O veneno total da serpente Crotalus durissus cumanensis e a crotoxina foram gentilmente cedidas pelo Prof. Marcos H. Toyama (Universidade Estadual Paulista, Campus do Litoral Paulista).
4.1.1 Isolamento e purificação da crotoxina da Crotalus durissus cumanensis
A crotoxina do veneno da C. d. cumanensis foi isolada e purificada pelo professor Marcus Hikari Toyama.
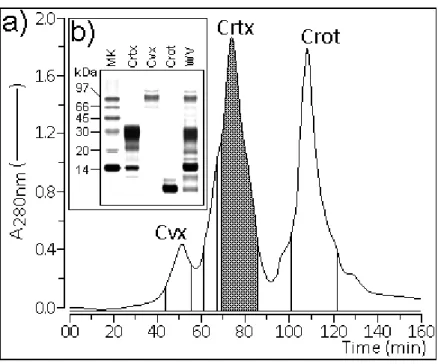
O veneno total foi primeiramente fracionado como descrito por Diz Filho e colaboradores (2007), onde o veneno seco (45 mg) foi completamente dissolvido em bicarbonato de amônio (0.2 M; pH 8.0), seguido por clarificação e centrifugação (4500 g for 1 min). O sobrenadante obtido foi recuperado e analisada em HPLC com coluna de exclusão molecular (Superdex 75, 1 x 60 cm, Pharmacia) previamente equilibrado com mesmo tampão usado para dissolver o veneno total. A velocidade de eluição da fração foi de 0.2 mL/min. A cromatografia foi realizada a 280 nm e fração a semelhante à crotoxina foi imediatamente liofilizada. A purificação resultante da crotoxina foi avaliada por Tricine SDS-PAGE (TOYAMA et al., 2005).
Figura 3: a) Perfil cromatográfico do fracionamento do veneno total da C. d. cumanensis em
HPLC de exclusão molecular; b) Análise do veneno total (WV), crotoxina (Crtx), Convulxina
(CVX) e Crotamina (Crot) em Tricine PAGE-SDS. Fonte: Professor Marcus Hikari Toyama.
4.2 Animais
4.3 Estudos dos efeitos renais do veneno da Crotalus durissus cumanensis e crotoxina
4.3.1 Perfusão de Rim Isolado
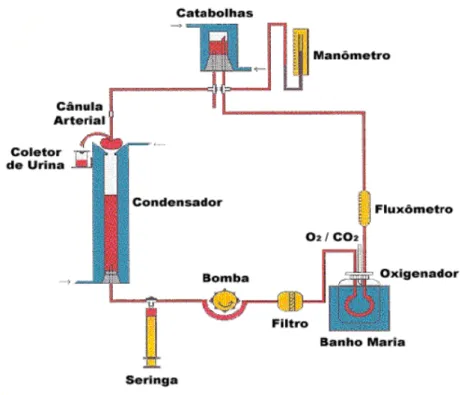
A necessidade do conhecimento dos mecanismos de controle da função renal levou inúmeros pesquisadores a desenvolverem a técnica de perfusão de rim isolado. O sistema utilizado consiste na perfusão de rim isolado com recirculação (FONTELES et al., 1983; MONTEIRO & FONTELES, 1999) em circuito fechado, para perfusão in vitro, mantidos à mesma temperatura de 37 ºC. Este sistema apresenta a vantagem da manutenção constante de parâmetros funcionais renais com utilização de albumina na solução perfusora, em menor volume, mantendo constantes as substâncias dialisáveis com oxigenação (95% O2/ 5% CO2) adaptada
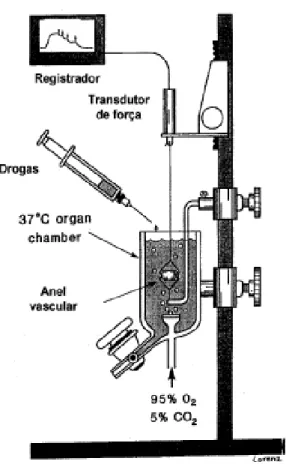
ao próprio sistema de acordo com Fonteles e colaboradores (1983). O sistema é constituído pelos seguintes componentes (Figura 3):
- Banho-maria: para a manutenção da temperatura constante do pulmão tipo silástico entre 36 e 37 °C ;
- Bomba aquecedora com termostato: para manutenção de uma temperatura constante no sistema entre 36 e 37 °C ;
- Bomba de perfusão de Watson: bombeia a solução de perfusão ao longo do sistema;
- Catabolhas: evita a entrada de bolhas nos rins;
- Coletor de urina;
- Condensador;
- Filtro Millipore 5 µm: filtração da solução perfusora;
- Fluxômetro: medição de fluxo de perfusão (mL/hora);
- Manômetro de mercúrio: medição da pressão de perfusão (mmHg);
- Pulmão tipo silástico: promove trocas gasosas (95% O2 e 5%CO2 );
Figura 4. Desenho esquemático do sistema de perfusão de rim isolado.
Fonte: Manoel Odorico de Morais Filho
4.3.1.1 Preparo da solução perfusora
A solução perfusora empregada foi de Krebs-Henseleit modificada, concentrada a 20% e contendo 6% de albumina bovina. A solução continha a seguinte composição para 2L: NaCl = 138g, KCl = 7g, NaH2PO4 . H2O = 3,2g,
MgSO4 . 7H2O = 5,8g, NaHCO3 = 4,2g, CaCl2 . 2H2O = 0,74g, glicose = 2g e uréia =
4.3.1.2 Técnica cirúrgica
Ratos Wistar machos pesando entre 250 e 300g foram anestesiados com pentobarbital sódico (50mg/kg, i.p.) e submetidos à cirurgia para retirada do rim direito. Foi realizada a administração de 3 mL de manitol (20%) pela veia femoral, a fim de melhorar o acesso ao ureter, que em seguida foi canulado, através de um tubo de polietileno, para a coleta de urina. A artéria renal foi isolada e canulada através da artéria mesentérica superior. Em seguida, o órgão foi retirado juntamente com o ureter e fixado a cânula perfusora, sem interrupção do fluxo (NISHIITSUTSUJI-UWO et al., 1967).
4.3.1.3 Grupos Experimentais
- Grupo controle: Rins perfundidos somente com solução de Krebs-Henseleit modificada.
- Grupo tratado com veneno da C. d. cumanensis na concentração 3µg/mL.
- Grupo tratado com veneno da C. d. cumanensis na concentração 10µg/mL.
4.3.1.4 Protocolo Experimental
Inicialmente foi realizada a calibração do sistema utilizando solução fisiológica 0,9%. A cada unidade da bomba de perfusão (1, 2, 3, 4 e 5), foi coletada a solução por 1 minuto em proveta milimetrada e anotada a medida do fluxômetro e a pressão de perfusão, através do manômetro de mercúrio ligado ao sistema.
Os experimentos foram iniciados após a estabilização e adaptação do órgão às novas condições. Os 30 minutos iniciais foram utilizados como controle interno. Após este período o veneno ou crotoxina foram adicionados de acordo com grupos pré-estabelecidos para avaliação dos efeitos sobre a pressão de perfusão (PP), resistência vascular renal (RVR), ritmo de filtração glomerular (RFG), fluxo urinário (FU) e transporte tubular de sódio, potássio e cloreto. Para tanto, a cada cinco minutos foram registrados a pressão de perfusão e o fluxo de perfusão em manômetro e fluxômetro, respectivamente, em um período total de 120 min. A coleta do perfusato e da urina foram realizadas a cada dez minutos, de maneira intercalada, para posteriores dosagens de sódio, potássio, cloreto, inulina e determinação da osmolaridade.
4.3.1.5 Análises bioquímicas dos perfusatos e urinas
As dosagens de sódio, potássio e cloreto foram analisadas utilizando aparelho de íons eletrodos seletivos (Rapidchem 744, Bayer diagnostic, Reino Unido); a inulina determinada por leituras fotométricas em espectrofotômetro de chama (Flame Photometer) seguindo método descrito por Fonteles e Leibach (1982); a osmolaridade através de osmômetro (Vapor pressure osmometer – modelo 5520 WESCOR).
4.3.1.6 Cálculo dos parâmetros funcionais renais
Tabela 3. Fórmulas utilizadas para determinação dos parâmetros renais
(MARTINEZ-MALDONADO e OPAVA-STITZER, 1978).
Parâmetros renais Fórmula
PP (mmHg)- Pressão de Perfusão Leitura em manômetro
FU (mL.g-1 . min-1 ) – Fluxo Urinário FU = Peso do volume urinário/ peso do rim
esquerdo x 10
RFG (mL.g-1.min-1 ) – Ritmo de
Filtração Glomerular
RFG = (DOUin / DOPin x FU) sendo DOUin = densidade ótica da inulina na urina e DOPin = densidade ótica da inulina no perfusato.
FPR (mL.g-1.min-1 ) – Fluxo de perfusão renal Registrado a cada 10 min/peso do
rim/intervalo de tempo
RVR (mmHg/mL.g-1.min-1) –
Resistência vascular renal.
RVR = PP (mmHg) / FPR
FNa+ (µEq.g-1 . min-1 ) – Sódio filtrado FNa+ =RFG x PNa+
ENa+(µEq.g-1 . min-1 ) – Sódio excretado ENa+= FU x UNa+
TNa+ (µEq.g-1 . min-1 ) - Sódio transportado TNa+ = FNa+ - ENa+
%TNa+ - Percentual de sódio transportado %TNa+ = TNa+ x 100/ FNa+
FKa+ (µEq.g-1 . min-1 ) – Potássio filtrado FKa+ =RFG x PKa+
EK+(µEq.g-1 . min-1 ) – Potássio excretado EK+= FU x UKa+
TK+ (µEq.g-1 . min-1 ) – Potássio transportado TK+ = FK+ - EK+
%TK+ - Percentual de potássio transportado %TK+ = TK+ x 100/ FK+
TCl- (µEq.g-1 . min-1 ) – Cloreto transportado
TCl-= FCl- - ECl-
%TCl- - Percentual de cloreto transportado %TCl- = TCl- x 100/ FCl
-FCl- (µEq.g-1 . min-1 ) – Cloreto filtrado FCl- =RFG x PCl-
4.3.2 Ensaios com células tubulares renais
4.3.2.1 Cultivo e tratamento das células tubulares renais MDCK (Mardin-Daby Canine Kidney)
O cultivo das células foi realizado em meio RPMI 1640 (Gibco), suplementado com 10% v/v de soro bovino fetal (SBF), penicilina (100U/mL) e estreptomicina (100µg/mL). As células foram incubadas a 37ºC, em atmosfera com 95% de umidade e 5% de CO2 a 37ºC. Antes de cada experimento as células foram
armazenadas em meio sem SBF por 24h para a obtenção de células na fase G0 do
RPMI + SBF
Susp. celular RPMI 1640;
10% v/v SBF; Penicilina
incubação
FASE G0
Ø SBF;24h Incubação/Tripsina-EDTA(10min) sobrenadante Re-susp. RPMI quantificação Câmara Neubauer 37ºC;atm.úmida;
5% CO2
RPMI
105céls/poço
2h
RPMI + SBF
Susp. celular RPMI 1640;
10% v/v SBF; Penicilina
incubação
FASE G0
Ø SBF;24h Incubação/Tripsina-EDTA(10min) sobrenadante Re-susp. RPMI quantificação Câmara Neubauer 37ºC;atm.úmida;
5% CO2
RPMI
105céls/poço
2h
Figura 5: Esquema simplificado do cultivo das culturas de células tubulares renais
MDCK.
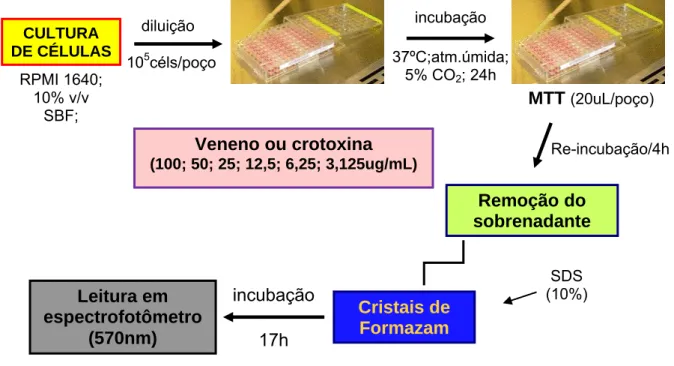
4.3.2.2 Ensaios de viabilidade e citotoxicidade celular
Ensaio com MTT
As células MDCK foram adicionadas às placas de 96 poços com densidade de 1 x 105 e tratadas com diferentes concentrações do veneno e crotoxina descrita anteriormente, em estudo por 24 horas. Após o tratamento das células o substrato de cultura foi retirado e então adicionado 3-(4,5-dimetilazil-2-il)-2,5 difenil tetrazólico (MTT; Sigma) dissolvido em PBS. Este método baseia-se na atividade mitocondrial das células viáveis que são capazes de reduzir o MTT e formar um produto colorido insolúvel em água, o sal formazan (LIU, et al., 1997). Após incubação por 4 horas à 37ºC em estufa com 5% de CO2, o sobrenadante foi removido e então adicionado
As placas foram incubadas por 17h e em seguida realizadas a leitura em espectrofotômetro (570nm) (Figura 6). Os ensaios foram realizados em três experimentos independentes em triplicata. A viabilidade celular foi determinada por comparação entre os percentuais médios de células sobreviventes e a concentração de veneno ou crotoxina e calculada a CI50. Controle negativo correspondeu como
100% de sobrevivência.
Figura 6. Esquema simplificado dos ensaios de viabilidade celular.
MTT(20uL/poço)
Re-incubação/4h CULTURA
DE CÉLULAS
RPMI 1640; 10% v/v
SBF;
diluição 105céls/poço
Veneno ou crotoxina (100; 50; 25; 12,5; 6,25; 3,125ug/mL)
incubação 37ºC;atm.úmida;
5% CO2; 24h
Remoção do sobrenadante
Cristais de Formazam
incubação
17h Leitura em
espectrofotômetro (570nm)
4.4 Estudos dos efeitos vasculares do veneno da Crotalus durissus
cumanensis e crotoxina
4.4.1 Ensaios em anel de aorta
A avaliação dos efeitos vasculares do veneno e crotoxina da Crotalus durissus cumanensis foi realizada através dos ensaios em aorta isolada de ratos. Inicialmente,
aortas torácicas foram removidas e imersas em meio de solução perfusora, cortadas transversalmente em segmentos cilíndricos como anéis (1mm x 5mm), acoplados em peças triangulares de aço ligadas a um fio e suspensas horizontalmente em câmaras para órgãos isolados contendo 5mL de solução de Tyrode modificada com a seguinte composição em mM: NaCl 136,0; KCl 5,0; MgCl2 0,98; CaCl2 2,0; NaH2PO4 0,36;
NaHCO3 11,9 e glicose 5,5(pH 7,4, 37°C, aerada, tensão basal = 1g). As contrações
foram registradas isometricamente por transdutores de força, conectados a sistema de aquisição de dados (Dataq PM-1000, EUA, vide Figura 7). Após período de equilíbrio do tecido no sistema, aproximadamente 60 minutos, contrações controles foram induzidas por adição de cloreto de potássio (60 mM) em três curvas controles. As preparações do veneno ou crotoxina isolada da serpente Crotalus durissus cumanensis (0,1; 0,3; 1,0; 3,0; 10,0; 30,0 e 50,0 µg/mL) foram adicionadas ao banho
Figura 7: Representação esquemática do sistema de banhos orgânicos para órgãos
isolados.Fonte: EVORA et al., 1999.
4.4.1.1 Protocolos Experimentais
¾ Efeito do veneno total da Crotalus durissus cumanensis na Tensão basal
¾ Efeito do veneno da Crotalus durissus cumanensis e fração crotoxina na contração induzida por Fenilefrina ou Potássio em preparações com endotélio intacto.
A avaliação do efeito vasorelaxante do veneno e crotoxina foi realizada a partir da pré-contração das aortas com fenilefrina (0,1µM), um agonista α
1-adrenérgico, e com potássio (40 mM), que induz uma contração mediada por canais operados por voltagem (VOC). Após se observar o total equilíbrio das preparações de anéis de aortas com endotélio intacto, a fenilefrina ou potássio foram adicionados ao banho. Em seguida, o veneno ou crotoxina foram adicionados de forma cumulativa respeitando os intervalos de 5 minutos entre as concentrações. Concentrações induzidas por fenilefrina e potássio foram tidas como 100%.
¾ Efeito do veneno da Crotalus durissus cumanensis e fração crotoxina na contração induzida por Fenilefrina ou Potássio em preparações sem endotélio
¾ Efeito do veneno total da Crotalus durissus cumanensis na contração induzida por Fenilefrina em meio livre de cálcio na presença de EGTA
Buscando analisar o envolvimento do cálcio extracelular no efeito contrátil do veneno sobre os anéis de aorta, foram realizadas ensaios em meio ausente de cálcio. Após período de equilíbrio do tecido com endotélio intacto, em meio com solução de Tyrode normal, contrações foram induzidas por adição de fenilefrina (0,1µM). Em seguida, as preparações de aorta com endotélio intacto foram lavadas três vezes com solução de Tyrode ausente de CaCl2 e adicionado o agente quelante
etileno-glicol bi(2-amino etil éter)-N,N,N’N-tetra acetil ácidoEGTA (1mM), garantindo a total retirada de cálcio do meio. Após três minutos foi novamente acrescentada fenilefrina 0,1 µM que forneceu uma contração pequena e transitória. Os estoques de cálcio intracelulares foram então reposto com lavagens de solução de Tyrode normal seguida pela adição de fenilefrina0,1 µM. As preparações foram lavadas três vezes com solução livre de cálcio seguida da adição do veneno (30µg/mL) e uma segunda contração induzida por fenilefrina 0,1 µM foi obtida.
4.5 Análises estatísticas
Os resultados foram expressos como média ± erro padrão da média (E.P.M.), onde n representa o número de experimentos. Para as comparações estatísticas entre dois grupos utilizou-se teste t-Student pareado ou não pareado. Para análise de mais de dois grupos, análise de variância (ANOVA), com pós-teste de Bonferroni, Holm-Sidak ou Tukey, quando necessário. As diferenças foram consideradas estatisticamente significativas quando *p<0,05 e *p<0,01. A CI50 foi
4.6 Aspectos éticos
5 RESULTADOS
5.1 Perfusão em rim isolado
O grupo tratado com a solução perfusora Krebs-Henseleit modificada não apresentou alterações significativas nos parâmetros de função renal durante os 120 min do experimento (Apêndice 1).
O veneno total de C. d. cumanensis (0,3µg/mL e 10µg/mL) e crotoxina (10µg/mL) foram adicionados ao sistema de perfusão após 30 minutos do início de cada experimento, período estabelecido como controle interno.
Nos ensaios realizados com o veneno total na concentração 0,3µg/mL (n=3) não foram observadas alterações significativas dos parâmetros de função renal quando comparado ao controle interno (Tabela 4).
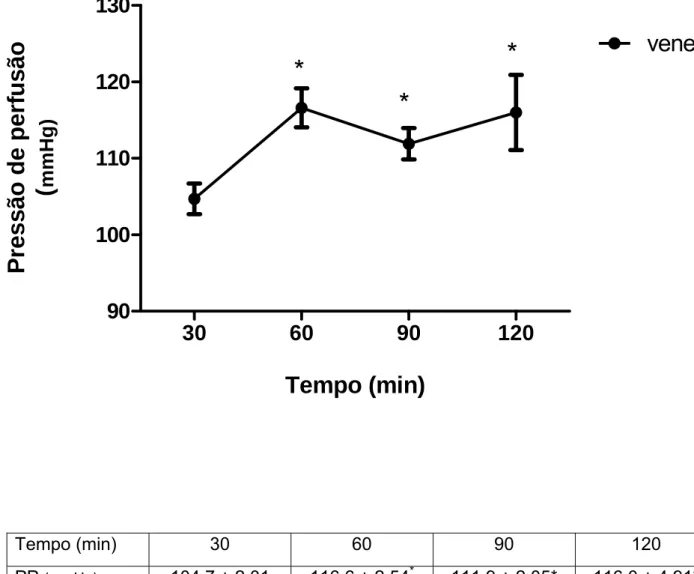
A infusão do veneno da C. d. cumanensis (10µg/mL; n=4) causou um aumento significativo na pressão de perfusão (Figura 8) e na resistência renal vascular (Figura 9) aos 60, 90 e 120 min de perfusão. As figuras 10 e 11 mostram, respectivamente, a redução gradativa do ritmo de filtração glomerular e do fluxo urinário dos 60 min aos 120 min. O veneno foi capaz de diminuir o percentual de transporte tubular de sódio (%TNa+, Figuras 12) e de cloreto (%TCl-, Figuras 13), mas somente aos 90min da perfusão. No entanto, não foram observadas alterações significativas no percentual de transporte tubular de potássio (%TK+controle =79,35 ±
2,17; %TK+60= 76,57 ± 3,18;%TK+90 = 76,18 ± 1,64; %TK+120 = 81,22 ± 1,52), quando
Tabela 4- Parâmetros de função renal do grupo tratado com veneno da C. d. cumanensis
(3µg/mL).
PP = pressão de perfusão; RVR = resistência vascular renal; RFG = ritmo de filtração
glomerular; FU = fluxo urinário; %TNa+ = percentual de transporte tubular de sódio; %TK+ = percentual de transporte de potássio; %TCl -= percentual de transporte tubular de cloreto. Os 30 minutos iniciais foram considerados como controle interno.
Tempo (min)/
Parâmetros renais
30 60 90 120
PP (mmHg) 102,6 ± 2,82 99,93 ± 1,37 97,26 ± 2,14 95,26 ± 3,51
RVR (mmHg/mL.g-1. min-1)
3,97 ± 0,26 3,85 ± 0,19 3,76 ± 0,23 3,68 ± 0,28
RFG (mL.g-1 . min-1) 0,87 ± 0,22 1,01 ± 0,19 1,45 ± 0,31 0,79 ± 0,15
FU (mL.g-1 . min-1) 0,10 ± 0,008 0,10 ± 0,007 0,12 ± 0,009 0,12 ± 0,016
%TNa+ 88,22 ± 1,83 90,48 ± 1,96 92,00 ± 1,70 82,88 ± 5,60
%TK+ 79,34 ± 1,98 78,82 ± 2,74 82,08 ± 2,89 69,33 ± 5,85
Tempo (min) 30 60 90 120 PP (mmHg) 104,7 ± 2,01 116,6 ± 2,54* 111,9 ± 2,05* 116,0 ± 4,91*
Figura 8. Efeito do veneno total da C. d. cumanensis (10µg/mL) na pressão de perfusão. Os
30 min iniciais foram considerados como controle interno. Valores expressos em média ±
E.P.M. Para análise estatística utilizou-se teste “t” de Student, *p< 0,05.
30
60
90
120
90
100
110
120
130
veneno
*
*
*
Tempo (min)
Pr
essão
de
per
fusão
(
mmH
g
Tempo (min) 30 60 90 120
RVR(mmHg/mL.g-1.min-1) 4,13 ± 0,14 4,59 ± 0,14* 4,41 ± 0,13* 4,57 ± 0,22*
Figura 9. Efeito do veneno total da C. d. cumanensis (10µg/mL) na resistência vascular
renal. Os 30 min iniciais foram considerados como controle interno. Valores expressos em
média ± E.P.M. Para análise estatística utilizou-se teste “t” de Student, *p< 0,05.
30
60
90
120
3.5
4.0
4.5
5.0
5.5
*
*
*
veneno
Tempo (min)
R
e
si
st
ên
ci
a vascul
a
r
re
n
a
l
(
mm H g /m L . g-1 . m
in
Tempo (min) 30 60 90 120
RFG (mL.g-1 . min-1) 0,67 ± 0,06 0,41 ± 0,04* 0,23 ± 0,02* 0,25 ± 0,02*
Figura 10. Efeito do veneno total C. d. cumanensis (10µg/mL) no ritmo de filtração
glomerular. Os 30 min iniciais foram considerados como controle interno. Valores expressos
em média ± E.P.M. Para análise estatística utilizou-se teste “t” de Student, *p< 0,05.
30
60
90
120
0.0
0.2
0.4
0.6
0.8
veneno
*
*
*
Tempo (min)
R
it
m
o de f
Tempo (min) 30 60 90 120
FU (mL.g-1 . min-1) 0,09 ± 0,006 0,07 ±0,006* 0,04 ± 0,003* 0,04 ± 0,004*
Figura 11. Efeito do veneno total C. d. cumanensis (10µg/mL) no fluxo urinário. Os 30 min
iniciais foram considerados como controle interno. Valores expressos em média ± E.P.M.
Para análise estatística utilizou-se teste “t” de Student, *p< 0,05.
30
60
90
120
0.00
0.05
0.10
0.15
*
*
*
veneno
Tempo (min)
Fl
u
x
o u
ri
n
ár
io
(
mL
.g
-1 .
m
in
Tempo (min) 30 60 90 120
%TNa+ 86,43 ± 1,83 83,14 ± 1,42 80,42 ± 1,10* 83,79 ± 1,50
Figura 12. Efeito do veneno total C. d. cumanensis (10µg/mL) no percentual de transporte
tubular de sódio (%TNa+). Os 30 min iniciais foram considerados como controle interno. Valores expressos em média ± E.P.M. Para análise estatística utilizou-se teste “t” de
Student, *p< 0,05.
30
60
90
120
75
80
85
90
95
*
veneno
Tempo (min)
%T
N
a
Tempo (min) 30 60 90 120
%TCl- 84,05 ± 1,76 81,67 ± 1,65 79,29 ± 1,38* 81,89 ± 1,51
Figura 13. Efeito do veneno total C. d. cumanensis (10µg/mL) no percentual de transporte
tubular de cloreto (%TCl-). Os 30 min iniciais foram considerados como controle interno. Valores expressos em média ± E.P.M. Para análise estatística utilizou-se teste “t” de
Student, *p< 0,05.
30
60
90
120
70
75
80
85
90
95
veneno
*
Tempo (min)
%T
C
l
-No estudo dos efeitos renais com a crotoxina (10µg/mL; n=3) isolada do veneno da serpente Crotalus durissus cumanensis, não foi observada alterações significativas na pressão de perfusão (PPcontrole = 107,2 ± 2,52 mmHg; PP60 = 112,7 ±
4,48 mmHg; PP90 = 115,7 ± 6,21 mmHg; PP120 = 115,7 ± 7,00 mmHg ) e na
resistência vascular renal (RVRcontrole = 4,65 ± 0,21 mmHg/mL.g-1min-1; RVR60 =4,63
± 0,31 mmHg/mL.g-1min-1 ; RVR90 = 4,78 ± 0,42 mmHg/mL.g-1min-1; RVR120 = 4,79 ±
0,46 mmHg/mL.g-1min-1). Entretanto, a fração ocasionou um decréscimo no ritmo de filtração glomerular aos 60 e 90 min de perfusão (Figura 14) e um aumento no fluxo urinário aos 90 e 120 min (Figura 15).
Tempo (min) 30 60 90 120
RFG (mL.g-1 . min-1) 0,50 ± 0,034 0,31 ± 0,047* 0,29 ± 0,046* 0,42 ± 0,11*
Figura 14. Efeito da crotoxina isolada do veneno da C. d. cumanensis (10µg/mL) no ritmo de
filtração glomerular. Os 30 min iniciais foram considerados como controle interno. Valores
expressos em média ± E.P.M. Para análise estatística utilizou-se teste “t” de Student, *p<
0,05.
30 60 90 120
Tempo (min) 30 60 90 120
FU (mL.g-1 . min-1) 0,09 ± 0,01 0,10 ± 0,01 0,12 ± 0,02* 0,16 ± 0,03*
Figura 15. Efeito da crotoxina isolada do veneno da C. d. cumanensis (10µg/mL) no fluxo
urinário. Os 30 min iniciais foram considerados como controle interno. Valores expressos em
média ± E.P.M. Para análise estatística utilizou-se teste “t” de Student, *p< 0,05.
30
60
90
120
0.00
0.05
0.10
0.15
0.20
crotoxina
*
*
Tempo (min)
Fl
u
x
o u
ri
n
á
ri
o
(
mL.g
-1 .
m
in
Tempo (min) 30 60 90 120
%TNa+ 83,47 ± 2,28 69,85 ± 2,28* 59,21 ± 1,48* 60,0 ± 3,44*
Figura 16. Efeito da crotoxina isolada do veneno da C. d. cumanensis (10µg/mL) no
percentual de transporte tubular de sódio (%TNa+). Os 30 min iniciais foram considerados como controle interno. Valores expressos em média ± E.P.M. Para análise estatística
utilizou-se teste “t” de Student, *p< 0,05.
30
60
90
120
50
60
70
80
90
100
*
*
*
crotoxina
Tempo (min)
%T
N
a
Tempo (min) 30 60 90 120
%TK+ 72,14 ± 5,26 58,20 ± 1,89* 47,84 ± 3,84* 50,60 ± 4,23*
Figura 17. Efeito da crotoxina isolada do veneno da C. d. cumanensis (10µg/mL) no
percentual de transporte tubular de potássio (%TK+). Os 30 min iniciais foram considerados como controle interno. Valores expressos em média ± E.P.M. Para análise estatística
utilizou-se teste “t” de Student, *p< 0,05.
30
60
90
120
40
50
60
70
80
90
*
*
*
crotoxina
Tempo (min)
%T
K
Tempo (min) 30 60 90 120
%TCl- 81,52 ± 2,97 67,02 ± 1,77* 56,40 ± 3,08* 57,34 ± 3,21*
Figura 18. Efeito da crotoxina isolada do veneno da C. d. cumanensis (10µg/mL) no
percentual de transporte tubular de cloreto (%TCl-). Os 30 min iniciais foram considerados como controle interno. Valores expressos em média ± E.P.M. Para análise estatística
utilizou-se teste “t” de Student, *p< 0,05.
30
60
90
120
50
60
70
80
90
crotoxina
*
*
*
Tempo (min)
%T
C
l
-5.2 Efeitos do veneno da Crotalus durissus cumanensis e crotoxina sobre células tubulares renais MDCK (Madin-Daby Canine Kidney)
O efeito do veneno total e crotoxina isolada da C. d. cumanensis nas células tubulares renais foi avaliada através de culturas de células MDCK. A viabilidade das culturas tratadas (1,0 x 105 / poço) com o veneno ou crotoxina (3,125; 6,25; 12,5; 25; 50 e 100 µg/mL) foi analisada pelo método MTT após 24h de incubação. Os resultados demonstraram um efeito citotóxico dependente da concentração do veneno, com valor da CI50 5,38 µg/mL (Figura 19) e visíveis
Figura 19. Efeito do veneno da C. d. cumanensis em células tubulares renais MDCK.
Valores expressos em média ± E.P.M. Para análise estatística utilizou-se análise de
variância (ANOVA) com pós-teste de Bonferroni, *p< 0,05.
A B
0.0
3.12
6.25
12.5
25
50
100
0
10
20
30
40
50
60
70
80
90
100
110
*
*
*
*
*
Veneno (
µ
g/mL)
%
V
ia
bi
li
dade
cel
ul
a
Figura 20: Fotomicrografia das células tubulares renais MDCK após exposição com veneno
da C. d. cumanensis com visíveis alterações morfológicas, tais como agregados celulares e
Figura 21: Fotomicrografia das células tubulares renais MDCK após exposição com veneno
da C. d. cumanensis com visíveis alterações morfológicas, tais como agregados celulares e citoplasma granuloso A: controle; B: 50 µg/mL.
Figura 22: Fotomicrografia das células tubulares renais MDCK após exposição com veneno
da C. d. cumanensis com visíveis alterações morfológicas, tais como agregados celulares e citoplasma granuloso A: controle; B: 100 µg/mL.