UNIVERSIDADE TÉCNICA DE LISBOA
Faculdade de Medicina Veterinária
ANESTESIA DE ANIMAIS SELVAGENS EM CATIVEIRO – CARNÍVOROS E UNGULADOS
MARTA MORAIS MIRANDA DE OLIVEIRA HORTA
CONSTITUIÇÃO DO JÚRI ORIENTADOR Doutor Luís Manuel Madeira de Carvalho Dr. Benjamín E. Alcántar Hernández Doutora Berta Maria Fernandes Ferreira São Braz
Doutora Sandra de Oliveira Tavares de Sousa Jesus CO-ORIENTADORA Dr. Benjamín E. Alcántar Hernández Doutora Sandra de Oliveira
Tavares de Sousa Jesus
2012 LISBOA
UNIVERSIDADE TÉCNICA DE LISBOA
Faculdade de Medicina Veterinária
ANESTESIA DE ANIMAIS SELVAGENS EM CATIVEIRO – CARNÍVOROS E UNGULADOS
MARTA MORAIS MIRANDA DE OLIVEIRA HORTA
DISSERTAÇÃO DE MESTRADO INTEGRADO EM MEDICINA VETERINÁRIA
CONSTITUIÇÃO DO JÚRI ORIENTADOR Doutor Luís Manuel Madeira de Carvalho Dr. Benjamín E. Alcántar Hernández Doutora Berta Maria Fernandes Ferreira São Braz
Doutora Sandra de Oliveira Tavares de Sousa Jesus CO-ORIENTADORA Dr. Benjamín E. Alcántar Hernández Doutora Sandra de Oliveira
Tavares de Sousa Jesus
2012 LISBOA
AGRADECIMENTOS
À Doutora Sandra Jesus, pela disponibilidade, a dedicação e o rigor na orientação desta dissertação.
Ao Dr. Benjamín Alcántar, pela inestimável oportunidade de estágio, pela hospitalidade e por tudo o que tão apaixonadamente me ensinou sobre o seu trabalho.
A toda a equipa do Wildlife Safari, pelo fantástico ambiente de trabalho que promovem e pela disponibilidade com que recebem os estagiários e com eles partilham os seus conhecimentos.
Ao Dr. Rui Patrício, que em boa hora me deu a conhecer essa instituição.
À minha querida família, pelo apoio incondicional durante a realização desta dissertação e do restante curso. Em particular aos meus pais, que me transmitiram o seu gosto pela Medicina e, cada um à sua maneira, me ajudaram e motivaram ao longo da vida e possibilitaram a realização deste meu sonho.
Aos meus colegas e amigos, por tempos bem passados ao longo destes anos académicos, entre Évora, Lisboa, Barcelona e Winston, e em especial à Tânia Tomé pela forte amizade com que acompanhou todas essas etapas.
ANESTESIA DE ANIMAIS SELVAGENS EM CATIVEIRO – CARNÍVOROS E UNGULADOS
RESUMO
De forma a examinar, diagnosticar e tratar adequadamente qualquer animal selvagem, é necessário aplicar métodos apropriados de contenção. A contenção química tem vindo a substituir os vários métodos de contenção física, sendo eficaz, fácil de aplicar, e muitas vezes mais rápida e eficiente. Assim, a anestesia constitui uma ferramenta essencial no maneio de animais selvagens, usada principalmente com vista à sua captura/imobilização. Neste contexto, o objectivo deste trabalho foi avaliar a eficácia de um conjunto de procedimentos anestésicos na imobilização de animais selvagens em cativeiro. Foram avaliadas as metodologias utilizadas em 34 animais mamíferos de 14 espécies diferentes, reunidos genericamente em dois grupos – Carnívoros (6 espécies) e Ungulados (8 espécies). Assim, dois animais foram imobilizados através de anestesia por inalação (com isoflurano), ao passo que para os restantes se recorreu à anestesia injectável, através de combinações anestésicas constituídas por dois ou mais fármacos (entre ciclohexaminas, opióides, agonistas α2-adrenérgicos e benzodiazepinas).
Todos os carnívoros foram eficazmente imobilizados com os protocolos anestésicos seleccionados, mas, entre os ungulados, as combinações anestésicas usadas em algumas espécies revelaram-se inadequadas, designadamente em muflões africanos (Ammotragus lervia), guanacos (Lama guanicoe) e zebras da planície (Equus burchelli). Mesmo assim, não se observaram efeitos adversos graves decorrentes do procedimento anestésico (ou do processo de captura) em nenhum dos animais.
Palavras-chave: anestesia, animais selvagens, mamíferos, captura, imobilização, carnívoros, ungulados.
ANESTHESIA OF WILD ANIMALS IN CAPTIVITY – CARNIVORES AND UNGULATES
ABSTRACT
In order to adequately examine, diagnose and treat any wild animal, it’s imperative to apply suitable restraint methods. Chemical restraint has been replacing the several existing methods of physical restraint, as it is effective, easy to apply, and often faster and more efficient. Therefore, anesthesia stands as an essential tool in wild animal management, mainly used with capture/immobilization purposes.
In this context, the goal of this study was to evaluate the effectiveness of a number of anesthetic procedures on the immobilization of wild animals in captivity. The methodologies used in 34 mammals belonging to 14 different species were evaluated. These animals were generically assembled in two groups – Carnivores (6 species) and Ungulates (8 species). Two animals were immobilized by inhalation anesthesia (with isoflurane), while the remaining were immobilized by injectable anesthesia, with anesthetic combinations of two or more drugs (amongst cyclohexamines, opioids, α2-adrenergic agonists and benzodiazepines). All of the carnivores were effectively immobilized with the selected anesthetic protocols, but the anesthetic combinations used in some ungulate species proved inadequate, particularly in aoudads (Ammotragus lervia), guanacos (Lama guanicoe) and plains zebras (Equus burchelli). Nevertheless, no animal suffered serious anesthesia-related (or capture-related) adverse effects.
Keywords: anesthesia, wild animals, mammals, immobilization, capture, carnivores, ungulates.
ÍNDICE GERAL AGRADECIMENTOS ... iii RESUMO ... v ABSTRACT ... vii ÍNDICE DE GRÁFICOS ... xi ÍNDICE DE TABELAS ... xi
LISTA DE ABREVIATURAS ... xii
1. DESCRIÇÃO DAS ACTIVIDADES DO ESTÁGIO ... 1
2. REVISÃO BIBLIOGRÁFICA ... 3
2.1. Introdução ... 3
2.2. Métodos de contenção química ... 4
2.2.1. Introdução ... 4
2.2.2. Administração oral ... 5
2.2.3. Administração injectável ... 6
2.2.3.1. Treino comportamental para injecções manuais ... 6
2.2.3.2. Seringa extensível ... 7
2.2.3.3. Sistemas de injecção remota ... 7
2.2.3.3.1. Zarabatana ... 8
2.2.3.3.2. Sistemas de projecção com carga ... 8
2.2.3.3.3. Dardos ... 9 2.2.3.3.4. Considerações práticas ... 9 2.3. Farmacologia aplicada ... 11 2.3.1. Introdução ... 11 2.3.2. Agentes imobilizadores ... 14 2.3.2.1. Opióides ... 14 2.3.2.1.1. Carfentanil ... 15 2.3.2.1.2. Etorfina ... 16 2.3.2.1.3. Butorfanol ... 17 2.3.2.2. Antagonistas opióides ... 18 2.3.2.2.1. Naltrexona ... 19 2.3.2.3. Ciclohexaminas ... 20 2.3.2.3.1. Quetamina ... 21 2.3.2.3.2. Tiletamina ... 22 2.3.3. Sedativos ... 24 2.3.3.1. Agonistas α2-adrenérgicos ... 24 2.3.3.1.1. Xilazina ... 26 2.3.3.1.2. Medetomidina ... 27 2.3.3.1.3. Detomidina ... 27 2.3.3.2. Antagonistas α2-adrenérgicos ... 28 2.3.3.2.1. Atipamezol ... 29 2.3.3.3. Benzodiazepinas ... 30 2.3.3.3.1. Midazolam ... 30 2.3.4. Tranquilizantes ... 31 2.3.4.1. Acepromazina ... 32 2.3.5. Propofol ... 33
2.3.6. Anestesia por inalação ... 33
2.4. O evento de captura ... 34 2.4.1. Planeamento ... 34 2.4.2. Indução ... 35 2.4.3. Monitorização ... 39 2.4.4. Recuperação ... 41 2.4.5. Complicações ... 41 2.4.5.1. Stress ... 42 2.4.5.2. Hipertermia ... 44
2.4.5.3. Depressão respiratória e hipoxémia ...45 2.4.5.4. Miopatia de captura ...47 2.4.5.5. Hipotermia ...51 2.4.5.6. Vómito/regurgitação ...51 2.4.5.7. Timpanismo ruminal ...52 2.4.5.8. Trauma físico ...53 2.4.5.9. Renarcotização ...54 2.4.6. Mortalidade...54 2.4.7. Segurança humana ...55 3. ESTUDO DE CASOS ...57 3.1. Introdução ...57 3.2. Métodos e resultados ...58 3.2.1. Carnívoros ...58 3.2.1.1. Chitas ...58 3.2.1.2. Puma ...61 3.2.1.3. Leão africano ...61 3.2.1.4. Tigre da Sibéria ...61
3.2.1.5. Urso pardo grizzly ...62
3.2.1.6. Gato-de-cauda-anelada ...62 3.2.2. Ungulados ...63 3.2.2.1. Muflões africanos ...63 3.2.2.2. Cabra-anã ...65 3.2.2.3. Antílope-negro ...65 3.2.2.4. Gamos ...66 3.2.2.5. Uapitis ...68 3.2.2.6. Guanacos ...68 3.2.2.7. Zebras da planície ...69 3.2.2.8. Rinoceronte branco ...70 4. DISCUSSÃO ...71 4.1. Considerações gerais ...71 4.2. Felinos ...74
4.3. Urso pardo grizzly ...82
4.4. Gato-de-cauda-anelada ...84 4.5. Caprinos ...85 4.6. Antílope-negro ...88 4.7. Cervídeos ...90 4.8. Guanacos ...92 4.9. Zebras da planície ...94 4.10. Rinoceronte branco ...97 5. CONCLUSÕES ...99 6. BIBLIOGRAFIA ... 101
ÍNDICE DE GRÁFICOS
Gráfico 1 – Estatística dos diferentes tipos de procedimentos veterinários efectuados durante o estágio. ... 1 Gráfico 2 – Relação entre o número de animais seguidos durante o estágio e as suas espécies. ... 2
ÍNDICE DE TABELAS
Tabela 1 – Motivo da anestesia, protocolo anestésico utilizado, sexo, idade, pesos estimado e efectivo, tempos de indução, anestesia e recuperação, fármacos de manutenção anestésica e tempo após a indução da primeira suplementação anestésica de cada chita/procedimento anestésico. ... 59 Tabela 2 – Motivo da anestesia, sexo, idade, peso estimado, tempos de indução, de anestesia e de recuperação, fármacos de manutenção anestésica e tempo após indução da primeira suplementação anestésica dos muflões africanos. ... 64 Tabela 3 – Motivo da anestesia, sexo, idade, peso estimado, tempos de indução e de anestesia, suplementação anestésica e respectivo tempo após indução e rácio medetomidina/atipamezol de cada gamo/procedimento anestésico. ... 67 Tabela 4 – Motivo da anestesia, sexo, idade, peso estimado e tempos de indução, de anestesia e de recuperação dos uapitis. ... 68
LISTA DE ABREVIATURAS + – Mais ≈ – Aproximadamente igual a > – Maior que < – Menor que ≤ – Menor ou igual a # – Número % – Percentagem ½ – Metade ¼ – Um quarto ¾ – Três quartos α – Alfa β – Beta δ – Delta κ – Kappa μ – Mu μg – Micrograma
AST – Aspartato aminotransferase bpm – Batimentos por minuto BUN – Ureia
ºC – Graus Celsius
CO2 – Dióxido de carbono CPK – Creatinina fosfoquinase EUA – Estados Unidos da América FC – Frequência cardíaca FR – Frequência respiratória g – Grama h – Hora IM – Intramuscular IV – Intravenoso/a kg – Quilograma LDH – Lactato desidrogenase L – Litro MBM – Medetomidina-butorfanol-midazolam mg – Miligrama min – Minuto mL – Mililitro MTZ – Medetomidina-tiletamina-zolazepam nº – Número
p. ex. – Por exemplo PO – Per os
SC – Subcutâneo/a
SNC – Sistema nervoso central SNS – Sistema nervoso simpático TZ – Tiletamina-zolazepam
1. DESCRIÇÃO DAS ACTIVIDADES DO ESTÁGIO
O estágio curricular que originou o desenvolvimento desta dissertação foi realizado no parque zoológico Wildlife Safari (Oregon, EUA), na área de Medicina e Conservação de Animais Selvagens, sob a orientação do Dr. Benjamín Alcántar. O estágio teve início no dia 17 de Janeiro de 2011 e terminou no dia 13 de Junho de 2011, com duração total de 712 horas.
Durante esse período foi possível aprofundar e aplicar conhecimentos previamente adquiridos, principalmente nas áreas da medicina preventiva, da anestesiologia e dos exames complementares de diagnóstico, que se destacam nesta área da Medicina Veterinária. Uma vez que a colecção de animais é inteiramente conhecida e de valor conservativo elevado, a profilaxia torna-se muito importante. Os conhecimentos de anestesia tomam também um lugar de destaque, pois a maioria dos animais selvagens tem de ser imobilizada quimicamente para a sua observação e tratamento. De modo a evitar anestesias desnecessárias, aproveita-se cada episódio anestésico para recolher a máxima informação possível sobre o animal imobilizado, através dos mais completos e variados exames de diagnóstico disponíveis.
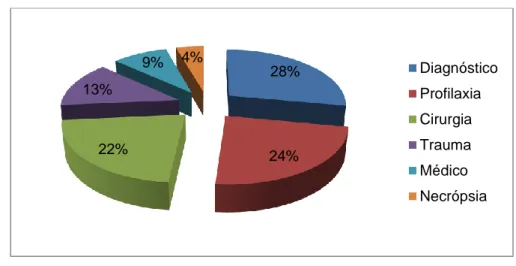
Nas actividades desenvolvidas durante o estágio incluíram-se: o acompanhamento e o auxílio do médico veterinário em todas as acções médicas, cirúrgicas e profilácticas; a colaboração com os tratadores dos animais no maneio nutricional e reprodutivo, nos treinos comportamentais e no enriquecimento ambiental; o treino prático de disparo de dardos como método de captura dos animais. O gráfico 1 mostra a estatística dos diferentes tipos de procedimentos veterinários efectuados ao longo do estágio.
Gráfico 1 – Estatística dos diferentes tipos de procedimentos veterinários efectuados durante o estágio.
As funções exercidas como estudante passaram por: monitorização e manutenção das anestesias, ajuda cirúrgica, administração de medicação, colheita de material para análises
28% 24% 22% 13% 9% 4% Diagnóstico Profilaxia Cirurgia Trauma Médico Necrópsia
diagnósticas, realização de exames coprológicos e radiográficos, vacinação e desparasitação e realização de necrópsias.
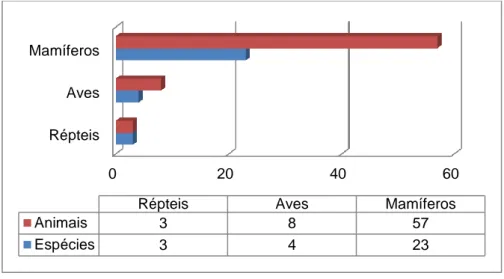
Há que referir que o trabalho veterinário num parque zoológico, em comparação com outras áreas da Medicina Veterinária, incide numa grande variedade de espécies animais. Ao longo do estágio foram seguidos animais de 30 espécies distintas, entre mamíferos, aves e répteis, como mostra o gráfico 2. Esta diversidade proporcionou a aquisição de muitos e novos conhecimentos e permitiu abrir horizontes nas possibilidades de actuação do médico veterinário.
Gráfico 2 – Relação entre o número de animais seguidos durante o estágio e as suas espécies.
Outra grande diferença em relação às áreas médico-veterinárias convencionais é a necessidade de, na grande maioria das situações, recorrer à anestesia geral como única forma segura e eficaz de imobilização. Assim, a anestesiologia reveste-se de grande importância, daí a eleição do tema desta dissertação.
0 20 40 60
Répteis Aves Mamíferos
Répteis Aves Mamíferos
Animais 3 8 57
2. REVISÃO BIBLIOGRÁFICA 2.1. INTRODUÇÃO
O termo “anestesia”, derivado do grego anaisthaesia, que significa “insensibilidade”, é usado para descrever a perda de sensibilidade na totalidade ou em parte do corpo. Em Medicina Veterinária de animais domésticos, a anestesia usa-se maioritariamente para a imobilização, a analgesia e o relaxamento muscular necessários à prática cirúrgica, mas é também usada para a realização de vários procedimentos diagnósticos e terapêuticos, bem como para a eutanásia ou o abate de animais de produção. Assim, dependendo do objectivo da anestesia, esta pode ser local, regional ou geral (Thurmon & Short, 2007).
Pelo contrário, em animais selvagens, por serem agressivos e/ou não estarem domesticados, o recurso à anestesia é necessário principalmente com vista à imobilização (não necessariamente para cirurgia) e, neste contexto, a anestesia geral reveste-se da maior importância como método de contenção química destes animais, sendo uma ferramenta essencial no seu maneio. Em cativeiro, a imobilização de animais selvagens é muitas vezes necessária para exames de saúde e de estado geral e para o diagnóstico e tratamento de doenças (Fahlman, 2008). Felizmente, e apesar de o médico veterinário de zoológico ter de lidar com uma grande diversidade de espécies exóticas, os princípios e técnicas de contenção e anestesia usados em animais domésticos aplicam-se muitas vezes a essas espécies (West, 2011).
No entanto, a natureza dos procedimentos de imobilização química de animais selvagens dita que o médico veterinário não possa cumprir muitos dos princípios que regem a boa prática anestésica em situações mais convencionais (Caulkett & Arnemo, 2007). A história clínica de um animal selvagem só está completa se ele tiver sido sempre propriedade de uma instalação zoológica e geralmente não é possível aceder aos pacientes para realizar um exame físico pré-anestésico ou colher amostras para exames laboratoriais (Caulkett & Arnemo, 2007; Mosley & Gunkel, 2007). Até a determinação precisa do peso de um animal é muitas vezes impossível antes da imobilização, devendo o médico veterinário conhecer a gama de valores padrão do peso da espécie e sexo do animal a imobilizar (Fowler, 2008). Devido a esta incapacidade de realizar uma avaliação pré-anestésica meticulosa, a resposta de cada animal aos fármacos, bem como a sua recuperação, podem decorrer de forma imprevisível ou mesmo resultar em complicações inesperadas (Epstein, White, Horowitz, Kass & Ofri, 2002).
O evento de captura e os fármacos imobilizadores podem influenciar o bem-estar do animal ao alterar variáveis fisiológicas e bioquímicas (Fahlman, 2008). Os padrões de perturbação fisiológica variam com o método de captura, os fármacos e a espécie (Kock, Jessup, Clark & Franti, 1987; Marco & Lavín, 1999; Epstein et al., 2002; Cattet, Caulkett & Stenhouse, 2003; Cattet, Christison, Caulkett & Stenhouse, 2003). Além disso, para várias espécies selvagens existe pouca ou nenhuma informação sobre a sua fisiologia e sobre os protocolos
anestésicos para a sua imobilização, e a extrapolação entre espécies pode resultar em complicações inesperadas, pelo que é imperativo avaliar o uso de diferentes fármacos e doses em cada espécie (Caulkett & Arnemo, 2007; Fahlman, 2008).
Assim, é conveniente fazer o registo de todo e qualquer procedimento anestésico, bem como da sua monitorização, incluindo:
espécie, idade, sexo, peso e estado físico do animal;
motivo da anestesia;
agentes pré-anestésicos e anestésicos usados e respectivos métodos de administração;
a pessoa encarregue da administração e monitorização da anestesia;
duração da anestesia;
valores dos parâmetros fisiológicos monitorizados;
medidas de suporte;
dificuldades encontradas e respectivos métodos de correcção (Heard, 2007; Muir, 2007).
Provavelmente não existem métodos de captura ou combinações de fármacos para animais selvagens completamente seguros, mas, se os seus efeitos fisiológicos forem quantificados, documentados e publicados, então a segurança dos animais pode ser melhorada pela prevenção ou tratamento de potenciais alterações fisiológicas (Fahlman et al., 2011).
Dados os inúmeros problemas encontrados durante a captura e a imobilização de animais selvagens, a morbilidade e a mortalidade destes animais podem ser elevadas, bem como a incidência de lesões do pessoal encarregue da captura (Caulkett & Arnemo, 2007). Como tal, a decisão de imobilizar ou não um animal é um dilema comum em medicina zoológica (West, 2011).
2.2. MÉTODOS DE CONTENÇÃO QUÍMICA 2.2.1. INTRODUÇÃO
De forma a examinar, diagnosticar e tratar adequadamente qualquer animal selvagem, é necessário aplicar métodos apropriados de contenção. Os métodos usados em cada situação variam com a espécie do animal, a sua condição física, a experiência da equipa de captura e o objectivo do procedimento (Porter, 2005).
Os efeitos adversos da captura e do maneio são geralmente mais marcados em animais em estado selvagem que não estão acostumados ao contacto humano, mas também pode ocorrer stress de captura em animais em cativeiro que não estão habituados ao maneio, ou mesmo em animais em cativeiro habituados ao maneio e à contenção física (Drew, 1998). As espécies selvagens reagem de formas diferentes aos vários métodos de captura e contenção (Fahlman, 2008), pelo que é muito importante adaptá-los às características comportamentais de cada espécie, de forma a causar o menor grau de stress possível
(Fowler, 1995). Como regra, deve recorrer-se à mínima quantidade de contenção necessária para atingir o objectivo pretendido, com o bem-estar do animal como principal preocupação (Fleming, 2005). Um animal pode ser capturado inicialmente por meios físicos ou químicos (Caulkett & Arnemo, 2007), mas deve ter-se em consideração que cada método de captura produz diferentes padrões de perturbação fisiológica que podem influenciar o seu bem-estar (Kock, Jessup, Clark, Franti & Weaver, 1987; Marco & Lavín, 1999; Cattet et al., 2003c). A contenção física, por exemplo através de armadilhas ou redes, é por vezes necessária durante a captura de animais no seu estado selvagem para confinar os seus movimentos durante a indução anestésica, mas deve ser de curta duração, de modo a evitar as complicações associadas com o stress (Caulkett & Arnemo, 2007). A contenção física pode induzir um grau de stress maior que a contenção química (Cattet et al., 2003c) e mesmo um maior número de lesões e mortes relacionadas com a captura (Haulton, Porter & Rudolph, 2001). Porém, em certas circunstâncias a contenção física pode ser o método preferível. Por exemplo, para procedimentos de curta duração em carneiros-selvagens (Ovis canadensis), a imobilização química esteve associada a uma maior incidência de complicações relacionadas com a captura e a uma mortalidade mais elevada comparativamente com diferentes métodos de contenção física (Kock et al., 1987b).
No entanto, os procedimentos diagnósticos e terapêuticos, o transporte e a translocação da maioria das espécies selvagens só são possíveis através da contenção química (Larsson et al., 2008). Esta tem vindo a substituir os vários métodos de contenção física, tendo a disponibilidade de fármacos adequados melhorado bastante a segurança do maneio, da captura, do transporte e da adaptação após a translocação de animais selvagens (Swan, 1993). A contenção química é eficaz, relativamente fácil de aplicar, e muitas vezes mais rápida e eficiente que os métodos de contenção física (Christman, 2010).
As técnicas utilizadas para administrar fármacos anestésicos a um animal dependem em grande escala da sua cooperação durante o período que precede a indução (Isaza, 2007). Existem várias técnicas e equipamentos disponíveis para uma melhor adequação a cada espécie e situação, de acordo com o tamanho do animal, a capacidade de o confinar, a aptidão do operador e a sua distância ao animal, resumindo-se as opções de administração às vias oral ou injectável (Fowler, 1986a; Atkinson, Kock & Meltzer, 2006).
2.2.2. ADMINISTRAÇÃO ORAL
A eficácia da administração oral para sedar animais selvagens depende da aceitação do fármaco por parte do animal, da sua taxa de absorção e da sua estabilidade no tracto digestivo (Atkinson et al., 2006). A eficácia da administração oral de agentes anestésicos é muitas vezes mínima, uma vez que muitos deles não são absorvidos ou são destruídos no tracto digestivo, dependendo o grau de absorção também da quantidade de alimento
ingerido (Fowler, 2008), o que faz com que as induções sejam prolongadas e imprevisíveis (Isaza, 2007).
Devido ao desenvolvimento de outros sistemas mais eficazes de administração de fármacos, a administração oral é geralmente usada apenas para pré-medicação, incorporada no alimento, o que é particularmente útil em animais que normalmente se tornam agitados com a antecipação da imobilização (Fowler, 2008). Nessas situações, pode-se administrar um tranquilizante por via oral, esperar que este faça efeito e só então dardejar o animal. Esta técnica pode ser utilizada em primatas e carnívoros (estes últimos ingerem mais facilmente os fármacos quando incorporados na carne), mas em ruminantes a grande massa de ingesta e a consequente taxa de absorção mais lenta tornam a administração oral ineficaz (Atkinson et al., 2006).
Por outro lado, a indução de anestesia através da absorção oral transmucosa de opióides potentes tem sido experimentada em várias espécies (Sleeman, Carter, Tobin & Ramsay, 1997; Kearns, Swenson & Ramsay, 2000; Mortenson & Bechert, 2001; Pollock & Ramsay, 2003). Este método pode evitar as complicações associadas ao dardejamento, podendo ser útil em instalações zoológicas e possivelmente em populações selvagens (Mortenson & Bechert, 2001).
2.2.3. ADMINISTRAÇÃO INJECTÁVEL
2.2.3.1. TREINO COMPORTAMENTAL PARA INJECÇÕES MANUAIS
A utilização do treino, dessensibilização e/ou condicionamento operante para facilitar ou realizar um procedimento com a cooperação de um animal, chamada de “contenção comportamental”, deve ser tida em conta aquando do desenvolvimento de um plano de contenção, de forma a reduzir o stress e dessensibilizar o animal para o procedimento (Christman, 2010).
Os programas de maneio animal modernos incentivam o treino baseado no reforço positivo, que leva o animal a cooperar voluntariamente nos seus próprios procedimentos de maneio (Laule, 2003). Este método de condicionamento operante tem sido usado recentemente em instalações zoológicas para treinar animais selvagens em cativeiro para facilitarem alguns procedimentos veterinários (Gamble, 2005; Isaza, 2007; Fowler, 2008).
Os animais podem ser treinados para receberem injecções voluntariamente, quer intramusculares (IM), quer intravenosas (IV). Clinicamente, o stress é menor, as induções são mais suaves, as doses anestésicas podem ser reduzidas e o médico veterinário não é visto como uma ameaça (Gunkel & Lafortune, 2007). Para tal, o médico veterinário deve participar activamente ao longo de todo o processo de treino – primeiro como observador, depois como participante e, finalmente, como operador (Gamble, 2005).
Este processo é preferível ao recurso a jaulas de contenção para injecções IM directas, em que o stress é maior e os animais correm o risco de sofrer lesões causadas pelas barras de
metal durante a indução, ou à contenção manual de animais mais pequenos, que lhes pode induzir um grau de stress bastante elevado e até exacerbar os efeitos secundários cardiovasculares de certos anestésicos (Gunkel & Lafortune, 2007).
Além disso, o processo de treino fornece exercício físico e estimulação mental, ao mesmo tempo reduzindo o medo e a agressão dos animais em cativeiro, facilitando, assim, o seu maneio (Fowler, 2008). O treino comportamental para injecções é o método ideal de indução e deve ser encorajado em todas as instituições de cativeiro (Gunkel & Lafortune, 2007). Muitos felídeos em cativeiro têm sido condicionados para participar neste processo, como tigres, chitas, leões africanos, pumas e leopardos (Gunkel & Lafortune, 2007), por exemplo para a punção das veias caudais através das grades (Gamble, 2005). Outros exemplos incluem o treino de primatas ou ursos para colocarem o braço através das grades da jaula para receberem injecções IV, de rinocerontes e girafas para passarem por uma manga de contenção para receberem injecções IM, ou até de elefantes para manipulação directa e subsequente acesso venoso (Isaza, 2007).
2.2.3.2. SERINGA EXTENSÍVEL
A seringa extensível é um mecanismo muito simples usado para aumentar o alcance de uma injecção manual até 3 ou 4 metros, consistindo numa vara que funciona como extensão do êmbolo da seringa. Pode ser um simples mecanismo caseiro composto por uma seringa descartável ligada à ponta de uma vara de madeira ou plástico, ou um produto comercial. Estes últimos estão disponíveis numa variedade de modelos, sendo geralmente vantajoso optar por um que apresente segmentos desmontáveis e vários calibres, de modo a poder fazer a injecção a diferentes distâncias e de diferentes volumes (Caulkett & Arnemo, 2007). É tipicamente usada para induzir a anestesia em animais confinados, por exemplo em armadilhas ou jaulas, ou ainda para aprofundar a anestesia de animais já em decúbito mas apenas ligeiramente anestesiados (Caulkett & Arnemo, 2007). Apesar de este método ser considerado mais seguro que a injecção manual directa, os animais podem, mesmo assim, reagir à punção e causar lesões ao mover ou redireccionar a seringa extensível (Isaza, 2007).
2.2.3.3. SISTEMAS DE INJECÇÃO REMOTA
Os sistemas de injecção remota são ferramentas essenciais para o médico veterinário que trabalha com espécies selvagens. Permitem uma imobilização segura e eficaz dos animais, sendo mais habitualmente usados quando a segurança humana está em risco devido ao tamanho ou temperamento do paciente (p. ex. carnívoros de grande porte ou primatas) ou com espécies que não toleram a aproximação (p. ex. cervídeos) (Stetter, 2009).
Para além da anestesia, estes sistemas também podem ser usados para a vacinação, a administração de medicações (como antibióticos e anti-helmínticos) ou mesmo a realização de biópsias (com dardos modificados para esse efeito) (Stetter, 2009; West, 2011).
2.2.3.3.1. ZARABATANA
A zarabatana é o mais básico dos sistemas de injecção remota, consistindo num tubo de 1-2 metros para o qual se sopra de modo a impulsionar um dardo leve (3-5 mL) até 10 a 15 metros. Existem vários modelos de distribuição comercial, mas também pode ser utilizado um simples tubo de metal ou plástico adequado à função (Caulkett & Arnemo, 2007).
Apesar da limitação do volume de fármacos e do pequeno alcance associados a este método, ele é útil e frequentemente usado em instalações zoológicas, no resgate de animais selvagens e no controlo urbano de animais erráticos (Caulkett & Arnemo, 2007). A zarabatana é adaptável ao uso em animais pequenos ou grandes, é praticamente silenciosa e os seus dardos causam danos de impacto e trauma tecidular mínimos, devido ao seu peso, massa e velocidade reduzidos (Atkinson et al., 2006; Caulkett & Arnemo, 2007; Isaza, 2007).
É necessário muito cuidado para não contaminar a peça bucal da zarabatana com fármacos, não sendo recomendável a utilização de opióides potentes com este instrumento (Kock, 2006), devido à reduzida margem de segurança desses fármacos em humanos (Nielsen, 1999).
2.2.3.3.2. SISTEMAS DE PROJECÇÃO COM CARGA
Estão disponíveis comercialmente vários sistemas de projecção com carga, variando no formato e no método de propulsão e permitindo um alcance até 50 metros (Caulkett & Arnemo, 2007). A utilização destes sistemas de projecção é recomendada apenas para animais com peso superior a 15 kg, de forma a prevenir lesões graves resultantes do impacto do dardo (Nielsen, 1999).
Genericamente, estes sistemas projectam dardos de duas formas: através da expansão de gás resultante do disparo de cargas de pólvora ou através da libertação de gás comprimido (ar ou CO2). O primeiro método é o que permite um maior alcance, mas também o menos silencioso. O segundo é relativamente silencioso e preciso, sendo habitualmente usado para projectar dardos de baixo peso a distâncias curtas a médias, como, por exemplo, em animais de zoológico confinados mas não adestrados. As espingardas podem utilizar ambos os sistemas, enquanto as pistolas estão disponíveis apenas com o segundo (Caulkett & Arnemo, 2007; Isaza, 2007).
2.2.3.3.3. DARDOS
O dardo, uma espécie de seringa projectável, é o aparelho que carrega os fármacos desde o projector até ao animal (Rohr & McKenzie, 1993). Todos os dardos possuem quatro componentes básicos: um compartimento de armazenamento dos fármacos, um sistema para os injectar, uma agulha para penetrar a pele e um estabilizador para um voo preciso. Os dardos comercialmente disponíveis variam nos seus métodos de expulsão dos fármacos, materiais usados na sua construção, capacidade de volume para os fármacos e anexos como a agulha ou o estabilizador (Isaza, 2007).
Os métodos de expulsão dos fármacos são desenvolvidos para permitir a administração do seu conteúdo num músculo do animal no momento do impacto e a sua escolha deve ser feita de acordo com a situação e o tamanho do animal, bem como com o equipamento de projecção a utilizar (Caulkett & Arnemo, 2007). Hoje em dia, existem três métodos principais em utilização – descarga explosiva, ar/gás comprimido e reacção química (Isaza, 2007). No primeiro, o conteúdo do dardo é expelido através da expansão de gás resultante da detonação de uma pequena cápsula explosiva no momento do impacto. A agulha deve ser farpada, de modo a permanecer agarrada ao músculo durante a injecção, uma vez que a força da expulsão dos fármacos pode ser suficiente para afastar a agulha do músculo e fazer uma injecção apenas parcial. Este tipo de dardo pode provocar trauma muscular considerável e deve ser reservado para animais grandes e bem musculados (Caulkett & Arnemo, 2007; Isaza, 2007; Fowler, 2008).
O segundo funciona através de ar ou gás comprimido, introduzido no dardo através de uma válvula unidireccional. O compartimento com os fármacos fica, assim, sob pressão, pelo que a agulha é fechada na ponta e apresenta uma porta lateral coberta por um selo de silicone. Este é deslocado com o impacto, libertando a pressão e, consequentemente, expelindo o conteúdo do dardo. Os dardos deste tipo podem ser usados repetidamente, mas eventualmente começam a perder qualidade (Caulkett & Arnemo, 2007; Isaza, 2007).
No terceiro, a expulsão do conteúdo do dardo é feita através de gás produzido por uma reacção ácido-base efervescente que ocorre no momento do impacto. A velocidade de injecção é mais lenta que com os sistemas anteriores, o que pode ser benéfico por limitar o trauma de injecção e a possibilidade de o dardo saltar do músculo antes da injecção completa (Isaza, 2007).
É muito importante que o dardo usado seja compatível com o sistema de projecção seleccionado, de forma a não afectar negativamente o voo do dardo e, consequentemente, a segurança e a eficácia da administração (Stetter, 2009).
2.2.3.3.4. CONSIDERAÇÕES PRÁTICAS
Todos estes sistemas de injecção remota, bem como os diferentes tipos de dardos, requerem prática numa diversidade de cenários para o utilizador se tornar um atirador eficaz
e evitar danos traumáticos aos animais. Sempre que se usam dardos, podem ocorrer lesões tecidulares graves, incluindo hemorragia, necrose e fracturas ósseas (Isaza, 2007). As principais causas de lesão são o trauma derivado do impacto do dardo, a colocação imprecisa do dardo e a injecção demasiado rápida do seu conteúdo (Caulkett & Arnemo, 2007).
O trauma de impacto depende principalmente da velocidade do dardo, devendo usar-se a velocidade mais reduzida que permita uma trajectória precisa a uma dada distância. Depende também da massa do dardo, que quanto menor for, menor trauma causará a uma dada velocidade. Estes factores devem ser tidos em conta aquando da selecção de um sistema de dardejamento, particularmente ao lidar com animais de pequeno porte, que são mais propensos ao trauma (Caulkett & Arnemo, 2007). Deve, então, usar-se o dardo mais leve possível, o volume líquido mais reduzido possível e a velocidade mais reduzida possível compatíveis com a operação pretendida (Kock & Jessup, 2006). No entanto, o compartimento dos fármacos deve estar completamente cheio, pois, havendo espaço vazio, o movimento dos líquidos pode alterar a trajectória do dardo (Nielsen, 1999). É por este motivo que, ao carregar um dardo com os fármacos, se deve evitar a presença de ar no respectivo compartimento, através da adição de água estéril, solução salina fisiológica ou solução de dextrose a 5% (Fowler, 1986a) até o encher completamente, de forma a garantir uma maior precisão da trajectória do dardo (Atkinson et al., 2006).
A imprecisão da colocação do dardo depende principalmente da falta de prática do operador, da tentativa de captura a distâncias excessivas ou de problemas inerentes ao próprio sistema de dardejamento (Caulkett & Arnemo, 2007). Os dardos devem ser colocados, idealmente, nas grandes massas musculares femoral ou escapular (Fowler, 2008), e as lesões ocorrem com mais frequência quando se penetra acidentalmente o abdómen, tórax ou estruturas vitais da cabeça e pescoço (Caulkett & Arnemo, 2007). Por exemplo, a penetração do dardo na cavidade torácica pode resultar em pneumotórax ou danificar o tecido pulmonar e causar uma hemorragia fatal (Atkinson et al., 2006; Caulkett & Arnemo, 2007). Por outro lado, a colocação imprecisa do dardo nos membros pode resultar em fracturas ósseas ou outras lesões traumáticas (Atkinson et al., 2006).
A velocidade da injecção varia, como já foi explicado, com o mecanismo de descarga do dardo, sendo os sistemas que expelem os fármacos através de uma carga explosiva os mais rápidos e, portanto, os mais traumatizantes. Também o volume de injecção deve ser minimizado para diminuir o grau de trauma muscular (Caulkett & Arnemo, 2007).
Além destes factores, a penetração da pele pelos selos das agulhas e a contaminação da ferida com pêlos e pele foram também identificadas como importantes factores causadores de lesão por sistemas de administração remota (Cattet et al., 2006).
Em conclusão, as particularidades de cada sistema de projecção e de cada tipo de dardo devem ser bem conhecidas, de forma a serem combinadas para optimizar a utilização em
cada caso concreto. A escolha de um sistema depende sempre do alcance necessário, do tamanho do dardo e das características individuais do animal (Caulkett & Arnemo, 2007).
2.3. FARMACOLOGIA APLICADA 2.3.1. INTRODUÇÃO
Thurmon e Short (2007) definem a anestesia geral como um estado de inconsciência induzido por fármacos, caracterizado por depressão do sistema nervoso central (SNC) e analgesia, controlados mas reversíveis, do qual o paciente não é despertado por estímulos dolorosos e em que as suas funções reflexas sensoriais, motoras e autónomas estão atenuadas. Conforme o tipo de procedimento pretendido, o anestesista procura, ao induzir a anestesia geral, diferentes graus de inconsciência, ausência de resposta reflexa, insensibilidade à dor e relaxamento muscular, devendo, para isso, seleccionar os fármacos mais adequados e ser capaz de avaliar o grau de cada um desses efeitos (Muir, 2007). Muir (2007) descreve o anestésico ideal como aquele que:
não depende do metabolismo do animal para a terminação da sua acção e eliminação;
permite uma indução, alteração da profundidade anestésica e recuperação rápidas;
não deprime a função cardiopulmonar;
não é irritante para qualquer tecido;
é barato, estável, não inflamável e não explosivo;
não requer equipamento especial para a sua administração.
Na imobilização de animais selvagens, algumas destas propriedades, e ainda outras, são particularmente relevantes. Uma indução rápida é um dos mais importantes atributos necessários num fármaco de captura, pois limita o risco de trauma, hipertermia e miopatia de captura, bem como de lesões do pessoal envolvido na captura (Caulkett & Arnemo, 2007). A estabilidade do fármaco numa vasta gama de temperaturas é também importante na captura de animais selvagens, uma vez que esta pode ser feita numa diversidade de cenários e sem recurso à refrigeração (Fowler, 1986a; Caulkett & Arnemo, 2007).
Estes fármacos devem ter uma margem de segurança elevada. Contrariamente às espécies domésticas, ao anestesiar animais selvagens é comum sobrestimar o seu peso, pois este não é habitualmente medido antes da captura, pelo que os fármacos devem apresentar índices terapêuticos elevados, de modo a diminuir o risco de mortalidade por sobredosagem. Adicionalmente, quando os fármacos são administrados por meio de um dardo, é importante que sejam suficientemente potentes e/ou concentrados de modo a serem administrados em pequenos volumes (idealmente < 3 mL), o que diminui o risco de trauma, além de aumentar a precisão do voo do dardo (Caulkett & Arnemo, 2007).
Relativamente ao estado que induzem no animal, a narcose é essencial, já que se pretende que o animal não tenha nenhuma consciência do que o rodeia. Adicionalmente, a analgesia
tem vindo a ser cada vez mais importante, pois tem-se tornado mais comum realizar procedimentos potencialmente dolorosos durante o maneio de animais selvagens (Caulkett & Arnemo, 2007). Quanto a este aspecto, é importante ter sempre em conta que o efeito analgésico de determinado fármaco é eliminado quando este é antagonizado no final de um procedimento (Gunkel & Lafortune, 2007). Mesmo assim, a capacidade de reverter a imobilização é uma característica especialmente importante, pois, além de acelerar a recuperação do animal, a reversão da imobilização pode ser, por vezes, a única opção viável para resolver complicações anestésicas graves (Meltzer, Burroughs & Morkel, 2006; Caulkett & Arnemo, 2007).
Infelizmente, nenhum anestésico combina todas estas qualidades, pelo que a sua escolha deve ser ponderada para cada situação, tendo como principal preocupação a segurança do animal (Muir, 2007). Frequentemente são usados dois ou mais tipos diferentes de agentes neuroactivos, com o objectivo de atingir uma anestesia com a melhor qualidade possível e com efeitos secundários mínimos, através da sinergia de efeitos benéficos ou do antagonismo de efeitos indesejáveis (Papich, 2007). A escolha dos fármacos, doses e via de administração é condicionada por diversos factores, como a espécie, a acessibilidade e o tipo de procedimento, além das variações individuais como idade, peso, atitude, estado de saúde ou estado de jejum, e ainda factores ambientais e disponibilidade de pessoal auxiliar e de equipamento (Gunkel & Lafortune, 2007).
Os fármacos anestésicos que induzem anestesia adequada numa dada espécie podem ser inadequados noutra. Por exemplo, os opióides potentes usados habitualmente na imobilização de ungulados podem produzir depressão respiratória grave em primatas e excitação em espécies felinas (Fahlman, 2008). Mesmo para um dado fármaco imobilizador podem existir grandes diferenças entre espécies. Por exemplo, a dose imobilizadora de etorfina para um elande é de 12-15 mg, ao passo que para um rinoceronte branco é de apenas 3-5 mg (Atkinson et al., 2006). Além disso, os sinais típicos que caracterizam o aprofundamento anestésico podem não ocorrer com alguns fármacos ou combinações de fármacos. Por exemplo, os agentes dissociativos não induzem os sinais oculares típicos de aumento da depressão do SNC, e doses elevadas de propofol não produzem maior insensibilidade à dor proporcionalmente ao aumento da depressão central. Consequentemente, o médico veterinário deve estar familiarizado com as características específicas de cada fármaco, de modo a usá-lo com eficácia e segurança (Muir, 2007). As doses de fármacos necessárias para a imobilização de animais em estado selvagem são geralmente mais elevadas do que as necessárias para animais em cativeiro (Atkinson et al., 2006; Fahlman, 2008). Este facto deve sempre ser tido em conta, de modo a evitar a ocorrência de sub ou sobredosagens. Os animais que recebem uma dose reduzida de fármacos têm tendência a desenvolver uma fase excitatória prolongada durante a indução e em alguns casos podem não alcançar o decúbito. Já um tempo de indução muito rápido
indica uma dose relativamente elevada, pelo que o animal deve ser monitorizado cuidadosamente, devendo considerar-se a reversão parcial, ou mesmo completa, dos efeitos dos fármacos (Atkinson et al., 2006).
O método de administração do fármaco pode também afectar os requisitos de dose. Uma comparação entre injecção manual e administração por dardo em renas (Rangifer tarandus tarandus) demonstrou que foi necessário mais 50% das doses dos fármacos quando os animais foram dardejados (Ryeng, Arnemo & Larsen, 2001). O estado de saúde do animal, apesar de ser muitas vezes difícil de avaliar, também deve ser tido em consideração, já que animais debilitados são provavelmente mais susceptíveis aos fármacos imobilizadores (Atkinson et al., 2006). A época do ano e o género do animal podem também alterar os requisitos de dose do fármaco (Caulkett & Arnemo, 2007).
Os primeiros investigadores da vida selvagem usavam agentes bloqueadores da junção neuromuscular na captura de animais selvagens. Estes agentes produzem imobilização através da paralisia do músculo esquelético, permitindo uma margem de segurança muito estreita relativamente ao risco de paragem respiratória. Além disso, os animais imobilizados estão conscientes e, por conseguinte, sob stress considerável, pelo que, hoje em dia, o recurso a paralisantes musculares como único agente para a captura de animais selvagens é considerado desumano e, portanto, inaceitável (Caulkett & Arnemo, 2007).
Desde então houve grandes desenvolvimentos nesta área e, hoje em dia, são usados fármacos de acção central, que actuam principal ou exclusivamente no SNC e causam imobilização através da sua depressão (Nielsen, 1999). Os animais selvagens são geralmente imobilizados com uma combinação de fármacos de modo a permitir dosagens mais baixas devido aos seus efeitos sinérgicos, a contrariar efeitos secundários e a permitir a reversão da imobilização (Fahlman, 2008).
Tipicamente usam-se misturas que consistem num agente imobilizador propriamente dito e num tranquilizante ou sedativo (Meltzer et al., 2006a). Os agentes imobilizadores são divididos em dois grupos: os opióides ultra-potentes e as ciclohexaminas (Meltzer et al., 2006a; West, 2011). A distinção entre sedativos e tranquilizantes não é consensual entre autores e, para os efeitos desta dissertação, optou-se pela classificação utilizada por Meltzer et al. (2006a), que engloba agonistas α2-adrenérgicos e benzodiazepinas como sedativos e fenotiazinas e butirofenonas como tranquilizantes.
Os antagonistas são frequentemente usados em animais selvagens, particularmente nos que se encontram em estado selvagem, para contrariar os efeitos da imobilização, tanto para garantir que um animal imobilizado recupera o mais rapidamente possível, como para reverter reacções adversas potencialmente fatais dos agentes imobilizadores, que ocorrem ocasionalmente. Os antagonistas aqui descritos actuam competindo pelo(s) mesmo(s) receptor(es) que os agonistas: dependendo da concentração relativa agonista/antagonista no receptor, bem como da respectiva afinidade para este, o antagonista desloca o agonista
e bloqueia efeitos agonistas posteriores. Excepto para os anestésicos gerais e os tranquilizantes, estão disponíveis antagonistas farmacológicos específicos para todos os outros fármacos injectáveis usados na imobilização de animais selvagens (Swan, 1993).
2.3.2. AGENTES IMOBILIZADORES 2.3.2.1. OPIÓIDES
O termo “opióide” é usado para designar um grupo de fármacos com propriedades, em vários graus, semelhantes ao ópio ou à morfina (Swan, 1993). Estes fármacos exercem os seus efeitos através da interacção com receptores opióides específicos, mimetizando a acção dos péptidos opióides endógenos, como as β-endorfinas. Existem três tipos de receptores opióides bem definidos – μ, δ e κ –, mas a maioria dos efeitos associados à administração de opióides é mediada pelos receptores μ. Os agonistas opióides puros actuam como agonistas destes receptores, ao passo que alguns outros opióides actuam como κ-agonistas, mas também com efeitos antagonistas ou agonistas parciais nos receptores μ e/ou δ (Lamont & Mathews, 2007).
Os opióides produzem analgesia e sedação, mas não têm propriedades relaxantes musculares. São previsíveis na sua acção, fornecem uma indução relativamente rápida, e os seus efeitos podem ser revertidos com a administração de antagonistas adequados (Caulkett & Arnemo, 2007). Dependendo da espécie, os seus efeitos farmacológicos variam de depressão a excitação (sabe-se que causam vários graus de excitação em animais das famílias Felidae, Canidae, Suidae e Equidae) (Nielsen, 1999).
Os opióides geralmente usados na imobilização de animais selvagens são o carfentanil, a etorfina e o tiafentanil (Caulkett & Arnemo, 2007). Enquanto a maioria dos opióides é usada como agentes analgésicos, estes opióides extremamente potentes são exclusivamente usados para a captura de animais selvagens (Grimm & Lamont, 2007; Lamont & Mathews, 2007), sendo particularmente eficazes em ungulados (Nielsen, 1999; Caulkett & Arnemo, 2007). Estes fármacos têm uma margem de segurança muito reduzida em humanos, pelo que devem ser manuseados com cuidado extremo para evitar uma exposição acidental, e apenas se estiver prontamente disponível um antagonista apropriado (Nielsen,1999; Caulkett & Shury, 2007; Fowler, 2008). A exposição humana a estes fármacos pode levar à morte por depressão e paragem respiratórias (Nielsen, 1999).
A indução e a duração de acção dependem do fármaco e da dose (Nielsen,1999). A indução ocorre geralmente dentro de 10 minutos após a administração e passa tipicamente por várias fases, começando por ligeiras alterações comportamentais, seguidas de ataxia, excitação, hipertonicidade muscular e finalmente, decúbito. A subdosagem pode resultar num período de indução prolongado, o que é indesejável, pois a excitação opióide prolongada resulta inevitavelmente em problemas como hipertermia, taquicárdia, acidose, exaustão metabólica, miopatia de captura e morte (Meltzer et al., 2006a).
Outros efeitos secundários dos opióides incluem depressão respiratória (um efeito directo destes fármacos no centro respiratório), bradicárdia, hipo ou hipertensão, inibição da motilidade intestinal, regurgitação ou vómito, inibição do mecanismo termorregulador e renarcotização (Nielsen, 1999; Meltzer et al., 2006a; Schumacher, 2008). Se estes fármacos não forem antagonizados, a duração da imobilização é longa, muitas vezes durando várias horas, durante as quais o animal está em risco devido à depressão respiratória por eles induzida (Nielsen, 1999; Caulkett & Arnemo, 2007).
Os opióides são geralmente usados em conjunto com um tranquilizante ou sedativo (Atkinson et al., 2006). Esta adição permite utilizar uma dose mais baixa do opióide e reduzir os seus efeitos secundários, produzindo uma indução mais suave ao contrariar o estado excitatório a eles associado e diminuindo a rigidez muscular (Caulkett & Arnemo, 2007; Schumacher, 2008). No entanto, a depressão da ventilação induzida pelos opióides (que é dose-dependente) é agravada pela co-administração de agentes sedativos e/ou anestésicos (Grimm & Lamont, 2007; Lamont & Mathews, 2007; Mosley & Gunkel, 2007). Numa tentativa de contrariar este efeito, o butorfanol, um opióide agonista-antagonista, tem sido recentemente incorporado em protocolos anestésicos para animais selvagens (Nielsen, 1999), em combinação ou em substituição dos opióides potentes, exibindo menos efeitos adversos (Citino, 2007).
O uso do oxalato de tiafentanil não está ainda muito divulgado, mas sabe-se que permite um tempo de indução mais curto que a etorfina e o carfentanil (Meltzer et al., 2006a; Lance & Kenny, 2012) e que tem também uma duração de acção mais curta e, portanto, um menor potencial para a renarcotização (Citino, 2007; Lance & Kenny, 2012). Tem sido testado com eficácia e segurança em ungulados, principalmente em combinação com medetomidina e quetamina (Citino, Bush, Grobler & Lance, 2001; Grobler, Bush, Jessup & Lance, 2001; Citino, Bush, Grobler & Lance, 2002).
2.3.2.1.1. CARFENTANIL
O citrato de carfentanil é um derivado sintético do fentanil (Fowler 2008) aproximadamente 8000 vezes mais potente que a morfina. As suas vantagens incluem uma indução rápida, fiabilidade, potência (e consequente eficácia com pequenos volumes de administração) e reversão fiável dos seus efeitos com um antagonista apropriado (Caulkett & Arnemo, 2007). A doses óptimas, os primeiros efeitos são observados dentro de 2-10 minutos após injecção IM e tem uma duração de acção de 6-10 horas (Nielsen, 1999).
O carfentanil é geralmente usado para a imobilização de ungulados de grande porte, particularmente cervídeos (Fowler, 2008), mas não é eficaz na imobilização de equídeos (Meltzer et al., 2006a). Apesar de ser maioritariamente administrado por via IM, o carfentanil tem-se mostrado eficaz quando administrado por via oral, mesmo em espécies não
unguladas (Sleeman et al., 1997; Kearns et al., 2000; Mortenson & Bechert, 2001; Pollock & Ramsay, 2003).
Apesar de poder ser usado isoladamente, é geralmente combinado com um agonista α2-adrenérgico ou tranquilizante (Fowler, 2008), de forma a reduzir a excitação durante a indução e a contrariar a rigidez muscular, melhorando, assim, a qualidade da imobilização (Nielsen, 1999; Caulkett & Arnemo, 2007). Os principais efeitos adversos das combinações baseadas em carfentanil incluem depressão respiratória, hipoxémia, hipertensão e hipertermia (Schumacher, Citino & Dawson, 1997; Caulkett, Cribb & Haigh, 2000; Moresco, Larsen, Sleeman, Wild & Gaynor, 2001; Miller et al., 2003a; Paterson, Caulkett & Woodbury, 2009).
Devido à sua longa duração de acção, se os efeitos do carfentanil não forem revertidos, a recuperação é prolongada e difícil, durando várias horas (Nielsen, 1999). Se a duração de acção do antagonista for mais curta que a do carfentanil, pode ocorrer uma renarcotização (Caulkett & Arnemo, 2007). Este problema já foi relatado após o antagonismo do carfentanil com diprenorfina, naloxona, nalmefene e mesmo doses baixas de naltrexona (Haigh, Lee & Schweinsburg, 1983; Kock & Berger, 1987; Allen, 1989; Haigh & Gates, 1995; Miller, Wild & Lance, 1996). Por conseguinte o seu antagonismo deve ser feito com naltrexona num rácio naltrexona:carfentanil de 100:1 (Nielsen, 1999; Meltzer et al., 2006a; Fowler, 2008).
2.3.2.1.2. ETORFINA
O cloridrato de etorfina é um derivado sintético opióide com propriedades analgésicas altamente potentes (Fowler, 1986a; Nielsen, 1999; Fowler, 2008) e a doses óptimas produz depressão profunda do SNC (Nielsen, 1999). É aproximadamente 2.5 vezes menos potente que o carfentanil. A indução e a duração da imobilização são dose-dependentes; a doses óptimas, os primeiros efeitos podem ser observados 3-8 minutos após a injecção IM, o efeito completo é alcançado em 20-30 minutos (Caulkett & Arnemo, 2007) e tem uma duração de acção de 6-8 horas (Nielsen, 1999). A subdosagem pode causar excitação, com os problemas associados (Caulkett & Arnemo, 2007).
A etorfina já foi testada em quase todas as espécies de artiodáctilos, com diferentes graus de eficácia e segurança, mas é particularmente útil para a imobilização de grandes ungulados como o elefante, o rinoceronte ou o hipopótamo (Fowler, 1986a). É também o agente de eleição para a imobilização de equídeos selvagens (Walzer, 2007).
Na maioria dos casos é administrada em conjunto com um tranquilizante ou sedativo, que actua sinergicamente com a etorfina, reduzindo a excitação e a hipertonicidade muscular a ela associadas (Meltzer et al., 2006a). As combinações mais habituais envolvem a adição à etorfina de acepromazina, azaperona, xilazina ou detomidina (Kock, Morkel, Atkinson & Foggin, 1995; Still, Raath & Matzner, 1996; Ramsay et al., 1998; Bush, Raath, Grobler & Klein, 2004; Dangolla, Silva & Kuruwita, 2004; Blix, Lian & Ness, 2011).
O efeito secundário mais grave é a depressão respiratória, pelo que o animal não deve ficar imobilizado por mais tempo que o necessário, e os efeitos do fármaco devem ser revertidos o mais depressa possível. Outros efeitos secundários são muitas vezes dependentes da dose ou da espécie e podem incluir excitação, tremores musculares, convulsões, regurgitação, timpanismo, bradicárdia, taquicárdia, hipertensão, hipertermia e renarcotização (Nielsen, 1999; Caulkett & Arnemo, 2007).
A recuperação sem o antagonismo da etorfina é lenta, mas com a administração de um antagonista apropriado os animais recuperam em 1 a 3 minutos após injecção IV ou 5 a 10 minutos após injecção IM (Caulkett & Arnemo, 2007). A etorfina pode ser antagonizada com diprenorfina, naltrexona ou naloxona (Meltzer et al., 2006a).
2.3.2.1.3. BUTORFANOL
O tartarato de butorfanol é um opióide sintético agonista-antagonista, actuando como agonista dos receptores κ e antagonista dos receptores μ (Lamont & Mathews, 2007). É um fármaco analgésico através dos seus efeitos agonistas, mas tem também o potencial de reverter parcialmente os efeitos dos opióides mais potentes devido aos seus efeitos antagonistas (Meltzer et al., 2006a); a sedação excessiva associada a um agonista μ puro pode ser parcialmente revertida pela administração de doses baixas de butorfanol (Lamont & Mathews, 2007). Este fármaco apresenta ainda propriedades antieméticas e antitússicas (Plumb, 2005).
Uma das suas principais vantagens prende-se com os mínimos efeitos que exerce na função cardiopulmonar. A depressão respiratória dos agonistas-antagonistas exibe um “efeito de tecto” a partir do qual a administração de doses mais elevadas não causa depressão adicional (Lamont & Mathews, 2007). No entanto, há que ter em conta que este efeito de tecto ocorre também em relação à analgesia. O butorfanol exerce menos efeitos cardiovasculares que os agonistas puros, mas pode causar bradicárdia (secundária ao aumento do tónus parassimpático) e hipotensão ligeira (Plumb, 2005).
O uso isolado do butorfanol causa uma sedação apática que pode permitir que o animal desperte quando estimulado, o que, ao lidar com espécies perigosas, pode colocar os trabalhadores em risco. Já em combinação com tranquilizantes e/ou agonistas α2-adrenérgicos a doses baixas induz sedação em estação com segurança em várias espécies de ungulados (Bush, Citino & Lance, 2012).
Este opióide é frequentemente combinado com muitos dos fármacos injectáveis usados na anestesia de animais selvagens pelas suas propriedades analgésicas e ligeiramente anestésicas, permitindo também a redução das doses de cada agente e de vários efeitos secundários (Porter, 2005; Bush et al., 2012). Quando usado em combinação com opióides μ potentes, o butorfanol reduz a depressão respiratória e a rigidez muscular a eles associadas sem reversão significante da narcose. Quando usado em combinação com
tranquilizantes ou sedativos em substituição dos opióides potentes tradicionais, permite também uma imobilização com muito menos depressão respiratória e rigidez muscular que com aqueles (Citino, 2007).
Ao contrário dos opióides mais potentes, que são quase exclusivamente usados na imobilização de ungulados, o butorfanol tem sido incluído com sucesso em protocolos anestésicos de animais pertencentes a uma grande variedade de grupos taxonómicos, como carnívoros ou primatas (Kreeger, Mandsager, Seal, Callahan & Beckel, 1989; Foerster, Bailey, Aguilar, Loria & Foerster, 2000; Radcliffe, Ferrell & Childs, 2000; Leeuw, Forrester, Spyvee, Brash & Delahay, 2004; Wolfe, Goshorn & Baruch-Mordo, 2008; Siegal-Willott et al., 2009; Georoff, James, Kalk, Calle & Martin-Flores, 2010; Larsen, Sauther & Cuozzo, 2011; Rockhill et al., 2011).
Os antagonistas puros como a naloxona ou a naltrexona fornecem reversão completa dos efeitos do butorfanol (Citino, 2007), sendo a naltrexona considerada o antagonista de eleição para este fármaco (Fowler, 2008).
2.3.2.2. ANTAGONISTAS OPIÓIDES
Uma grande vantagem da anestesia baseada em opióides é a capacidade de os antagonizar, revertendo rapidamente a imobilização. Para ser eficaz, o antagonista deve ter uma maior duração de acção que o fármaco agonista e idealmente ser altamente selectivo para o(s) tipo(s) de receptor(es) desejado(s) (Caulkett & Arnemo, 2007). Existe um antagonista específico disponível para cada um dos opióides usados na imobilização de animais selvagens (Nielsen, 1999).
Dependendo da capacidade para reverter os efeitos dos opióides, os antagonistas opióides são classificados em dois grupos: os agonistas-antagonistas mistos, que têm algum grau de actividade opióide intrínseca e afectam o SNC, e os antagonistas puros, que não têm qualquer actividade intrínseca. Os fármacos habitualmente usados em animais selvagens para antagonizar os opióides são, do primeiro grupo, a diprenorfina e a nalorfina, e, do segundo grupo, a naloxona e a naltrexona (Meltzer et al., 2006a). A naloxona e sobretudo a naltrexona são também os antagonistas puros de eleição para a reversão de intoxicação opióide em humanos (Meltzer et al., 2006a; Caulkett & Arnemo, 2007; Fowler, 2008).
O cloridrato de diprenorfina é o antagonista especificamente desenvolvido para a etorfina (Fowler, 1986a; Nielsen, 1999), sendo portanto o habitualmente usado para reverter os seus efeitos (Meltzer et al., 2006a; Caulkett & Arnemo, 2007). Enquanto tem propriedades antagonistas relativamente à etorfina, tem propriedades agonistas próprias. Devido à sua actividade agonista parcial, pode persistir algum grau de depressão por várias horas (Meltzer et al., 2006a) ou mesmo ocorrer um prolongamento da imobilização em casos de sobredosagem (Caulkett & Arnemo, 2007). Assim, devido aos seus efeitos agonistas, a diprenorfina não deve ser usada como antagonista em casos de exposição humana
acidental à etorfina (Nielsen, 1999; Caulkett & Arnemo, 2007). A diprenorfina pode também ser usada como antagonista para o tiafentanil, mas o seu tempo de semi-vida parece ser mais curto que o do carfentanil, pelo que não é fiável para a reversão dos efeitos deste opióide (Meltzer et al., 2006a).
O cloridrato de nalorfina tem também as suas próprias propriedades agonistas, pelo que a sua sobredosagem pode também resultar no prolongamento da imobilização e no agravamento da depressão respiratória (Nielsen, 1999). A nalorfina tem vindo a ser usada recentemente precisamente devido aos seus efeitos agonistas-antagonistas, com vista a reverter parcialmente os efeitos dos opióides, podendo ser usada em doses baixas tituladas para reduzir a depressão respiratória sem despertar o animal. É também usada especificamente no rinoceronte branco para despertar ligeiramente o animal, de forma a ser capaz de andar conduzido por uma pessoa (Atkinson et al., 2006; Meltzer et al., 2006a). O cloridrato de naloxona é um antagonista opióide puro que pode ser usado para reverter os efeitos de todos os opióides potentes (Caulkett & Arnemo, 2007), mas tem uma duração de acção curta, pelo que os animais podem voltar a um estado de imobilização dentro de algumas horas e requerer nova administração (Nielsen, 1999; Meltzer et al., 2006a; Caulkett & Arnemo, 2007; Grimm & Lamont, 2007). Como já foi mencionado, observou-se a ocorrência de renarcotização após a utilização da naloxona como antagonista para o carfentanil (Haigh et al., 1983; Kock & Berger, 1987; Haigh & Gates, 1995).
2.3.2.2.1. NALTREXONA
O cloridrato de naltrexona é um antagonista opióide puro que produz um antagonismo rápido dos agonistas dos receptores opióides μ. Tem actividade após administração IM e IV, sendo o antagonismo mais rápido quando administrado por via IV (Caulkett & Arnemo, 2007). Tem uma longa duração de acção, pelo que produz um antagonismo fiável mesmo dos opióides de longa duração, como o carfentanil, sendo, assim, o antagonista de eleição para este opióide (Meltzer et al., 2006a; Caulkett & Arnemo, 2007). Como já foi referido, a naltrexona é o único antagonista eficaz na prevenção da renarcotização com carfentanil (Allen, 1989; Haigh & Gates, 1995).
Sendo o antagonista opióide mais versátil e com o menor risco de renarcotização (Caulkett & Arnemo, 2007), muitos médicos veterinários usam a naltrexona como o antagonista padrão para todos os opióides (Meltzer et al., 2006a).
As doses recomendadas de naltrexona para o antagonismo dos opióides potentes são de 100 mg por cada mg de carfentanil (Nielsen, 1999; Meltzer et al., 2006a; Fowler, 2008), 40-50 mg por cada mg de etorfina e 10 mg por cada mg de tiafentanil (Meltzer et al., 2006a). As doses para o antagonismo do butorfanol variam entre autores, mas a maioria utiliza a naltrexona a cerca de 2 vezes a dose de butorfanol (Radcliffe et al., 2000; Siegal-Willott et al., 2009; Wenger et al., 2010).
2.3.2.3. CICLOHEXAMINAS
As ciclohexaminas são anestésicos gerais injectáveis que produzem um estado de anestesia dissociativa, em que ocorre depressão do sistema tálamo-neocórtico em conjunção com activação do sistema límbico, resultando em catalepsia, imobilidade, analgesia e amnésia (Grimm & Lamont, 2007). Nesse estado cataléptico, os olhos permanecem abertos e os reflexos de deglutição intactos, e persiste uma hipertonia do músculo esquelético se não se administrar um sedativo forte ou um relaxante muscular (Thurmon & Short, 2007).
Os fármacos deste grupo fornecem uma indução rápida e o grau de inconsciência e de analgesia induzido é dependente da dose (Lin, 2007). A analgesia é de curta duração, pelo que não se aconselha a sua utilização para procedimentos longos e dolorosos (Nielsen, 1999). As ciclohexaminas têm uma margem de segurança relativamente grande e, a doses óptimas, deprimem apenas moderadamente a respiração e a circulação (Nielsen, 1999; Caulkett & Arnemo, 2007).
A fenilciclidina foi a primeira ciclohexamina usada para a captura de animais selvagens (Caulkett & Arnemo, 2007), mas o seu uso foi descontinuado devido aos seus graves efeitos secundários nos animais e, principalmente, à utilização humana abusiva para fins recreativos (Meltzer et al., 2006a). Hoje em dia, as ciclohexaminas utilizadas na imobilização de animais selvagens são a quetamina e a tiletamina (Caulkett & Arnemo, 2007).
São geralmente administradas por via IM ou IV, mas também podem ser administradas por via oral (Swan, 1993). A indução ocorre em 5-10 minutos e os animais desenvolvem os efeitos do fármaco por fases, como foi descrito para os opióides. O grau de excitação é imprevisível, mas pode ser marcado em alguns animais, particularmente com uma subdosagem. As convulsões são comuns, particularmente com doses mais elevadas (Meltzer et al., 2006a). Outros efeitos secundários incluem salivação excessiva, libertação de catecolaminas, hipertonicidade muscular e hipertermia, que se pode desenvolver como resultado das convulsões e da hipertonicidade, particularmente se a indução for prolongada (Meltzer et al., 2006a; Caulkett & Arnemo, 2007). Uma vez que durante a anestesia dissociativa os olhos dos animais permanecem geralmente abertos e com as pupilas dilatadas, é aconselhável a aplicação de um gel oftálmico para proteger a córnea da dessecação e de uma venda para evitar a exposição à luz solar directa (Swan, 1993).
As ciclohexaminas são particularmente eficazes em carnívoros, primatas e aves, mas também têm sido usadas em muitas outras espécies de mamíferos (Nielsen, 1999; Caulkett & Arnemo, 2007). Apesar de poderem ser usadas isoladamente em algumas espécies, as ciclohexaminas beneficiam da acção sinérgica de uma benzodiazepina ou de um agonista α2-adrenérgico, resultando em induções e recuperações mais suaves e no alívio dos efeitos secundários indesejáveis associados ao seu uso isolado (Nielsen, 1999).