UNIVERSIDADE FEDERAL DE UBERLÂNDIA Instituto de Ciências Biomédicas
Programa de Pós-Graduação em Imunologia e Parasitologia Aplicadas
Proteína αKlotho: da associação in vitrocom o ERβ ao perfil antitumoral no soro
de pacientes com câncer de mama
Pedro Augusto do Amaral
UNIVERSIDADE FEDERAL DE UBERLÂNDIA Instituto de Ciências Biomédicas
Programa de Pós-Graduação em Imunologia e Parasitologia Aplicadas
Proteína αKlotho: da associação in vitrocom o ERβ ao perfil antitumoral no soro
de pacientes com câncer de mama
Dissertação apresentada ao Colegiado do Programa de Pós-graduação em Imunologia e Parasitologia Aplicadas como parte de obtenção do título de Mestre.
Pedro Augusto do Amaral
Orientador: Prof. Dr. Marcelo José Barbosa Silva
Dados Internacionais de Catalogação na Publicação (CIP) Sistema de Bibliotecas da UFU, MG, Brasil.
A485p
2018 Amaral, Pedro Augusto do, 1991 Proteína αKlotho: da associação in vitro com o ERβ ao perfil
antitumoral no soro de pacientes com câncer de mama / Pedro Augusto do Amaral. - 2018.
62 f. : il.
Orientador: Marcelo José Barbosa Silva.
Dissertação (mestrado) - Universidade Federal de Uberlândia, Programa de Pós-Graduação em Imunologia e Parasitologia Aplicadas.
Disponível em: http://dx.doi.org/10.14393/ufu.di.2018.790 Inclui bibliografia.
1. Imunologia - Teses. 2. Mamas - Câncer - Teses. 3. Biomarcadores tumorais - Teses. 4. Receptor beta de estrogênio - Teses. I. Silva, Marcelo José Barbosa. II. Universidade Federal de Uberlândia. Programa de Pós-Graduação em Imunologia e Parasitologia Aplicadas. III. Título.
“A maior riqueza do homem é a sua incompletude. Não aguento ser apenas um sujeito que abre portas, que puxa válvulas, que olha o relógio. Perdoai. Mas eu preciso ser outros”
AGRADECIMENTOS
Primeiramente agradeço a Deus, por guiar e iluminar sempre meus caminhos e ter sido sustento durante essa árdua jornada. Agradeço meus pais e irmãos pelo apoio irrestrito e por todo o amor que sempre me alcança, apesar dos quilômetros que nos separam, vocês são minha base, meu refúgio, meus exemplos e o motivo que me faz lutar todos os dias.
Agradeço meus familiares, avós, tios e primos por todo carinho e apoio, vocês são a saudade diária e o meu combustível. De forma especial aos primos Eduardo e Thays, por terem me aberto as portas de Uberlândia, com isso ganhei morada e uma família por aqui, vocês terão sempre o meu amor e respeito.
Agradeço ao professor Marcelo por ter me acolhido, pelos ensinamentos transmitidos e por ter dado a oportunidade e os meios para que este projeto fosse feito. Aos demais professores da pós-graduação que de alguma forma contribuíram para minha formação.
Agradeço aos meus colegas de laboratório, que ao longo do tempo se tornaram grandes amigos. Inicialmente devo agradecer a Lívia pelo carinho e amizade por todos estes anos enquanto preceptora e companheira de trabalho e principalmente por ter sido o elo que me levou ao mundo dos experimentos. Agradeço imensamente ao Felipe, que foi mais que um colega, um co-orientador, não tenho dúvidas de que sem o seu conhecimento, disponibilidade e auxílio este projeto não aconteceria, a você minha gratidão e respeito.
Dani, Pultz, Fenandinha, Brunits e Isa, é tão amplo e singular tudo que vivi com vocês, seja no laboratório ou na vida pessoal, que não consigo dimensionar o quão importante vocês se tornaram ou como essa amizade é essencial para mim, obrigado por isso, contem comigo sempre!
Agradeço ao Núcleo de Prevenção e Pesquisa de Câncer (NUPPEC), a cada um de seus membros pela disponibilização das amostras e dados de seus pacientes, além do apoio incondicional para que o projeto fosse realizado. Estendo este agradecimento também à equipe do Hospital do Câncer em Uberlândia, o Grupo Luta Pela Vida e ao Dr. Rogério Agenor de Araújo.
Agradeço aos membros do laboratório de Imunoparasitologia “Dr. Mário Endsfeldz Camargo”, na figura de seu responsável Prof. Dr. Tiago Wilson Patriarca Mineo, pelo auxílio prestado e a disponibilidade de equipamentos para a realização de parte dos experimentos.
Por fim, agradeço aos órgãos de fomento que aportaram recursos para a pesquisa realizada, Fundação de Amparo à Pesquisa de Minas Gerais (FAPEMIG) e o Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
LISTA DE FIGURAS
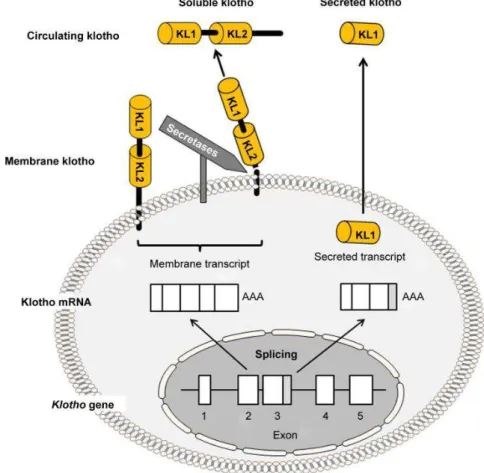
Figura 1. Diagrama esquemático do αKlotho de membrana e geração de sKL...18
Figura 2. Estratégia de gate para o ensaio de proliferação por CFSE em linhagem celular MCF-7...30
Figura 3. Expressão do mRNA de αKlotho após o uso de agonistas de ER em linhagens de câncer de mama...32
Figura 4. Ensaios de proliferação por MTT em linhagem MCF-7...33
Figura 5. Ensaio de proliferação por decaimento de CFSE em linhagem MCF-7...33
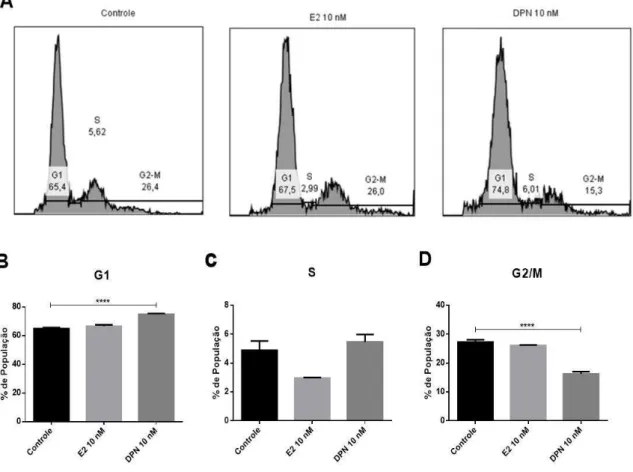
Figura 6. Ciclo celular após estímulo de agonistas dos ER na linhagem MCF-7...34
Figura 7. Expressão relativa do mRNA de reguladores do ciclo celular após ativação dos ER em MCF-7...35
Figura 8. EMT/MET após o agonismo de ER na linhagem MCF-7...35
Figura 9. Níveis séricos de αKlotho em controles saudáveis e pacientes com câncer de mama...38
Figura 10. Níveis séricos de αKlotho em pacientes com câncer de mama de acordo com marcadores imuno-histoquímicos...39
Figura 11. Níveis séricos de αKlotho em pacientes com câncer de mama de acordo com os subtipos moleculares do tumor...40
Figura 12. Porcentagem de Ki67 de acordo com a produção de αKlotho solúvel no soro de pacientes com câncer de mama...41
LISTA DE TABELAS
LISTA DE ABREVIAÇÕES
ADAM - uma desintegrina e metaloprotease BCRJ – banco de células do Rio de Janeiro Ca2+ - íon cálcio
cDNA - ácido desoxirribonucleico complementar CFSE - carboxifluoresceína succinimidil éster CSC - células-tronco cancerígenas
DMSO - dimetilsulfóxido
DNA - ácido desoxirribonucleico DPN - diarilpropionitrilo
E2 - estradiol
ELISA - ensaio de imunoabsorção enzimático ou ensaio imunoenzimático EMT - transição epitélio-mesênquima
ER - receptores de estrogênio ER - receptor de estrogênio beta ERα - receptor de estrogênio alfa ESR2 - gene receptor de estrogênio 2 FBS - soro fetal bovino
FGF - fator de crescimento de fibroblastos FGF19 - fator de crescimento de fibroblastos 19 FGF21 - fator de crescimento de fibroblastos 21 FGF23 - fator de crescimento de fibroblastos 23
FGFR - receptores do fator de crescimento de fibroblastos FSC - detector de luz frontal
FSC-A - área do parâmetro tamanho pelo detector de luz frontal FSC-H - altura do parâmetro tamanho pelo detector de luz frontal HC-UFU - Hospital de Clínicas da Universidade Federal de Uberlândia HEPES - ácido hidroxietil piperazinoetanossulfônico
HER2 - receptor do fator de crescimento epidérmico 2 IC - intervalo de confiança
IFN- – interferon gama
IRS-1 – substrato 1 do receptor de insulina IRS-2 – substrato 2 do receptor de insulina
KL1 - repetição interna 1 da porção extracelular da proteína αKlotho KL2 - repetição interna β da porção extracelular da proteína αKlotho MET - transição msênquima-epitélio
mRNA - ácido ribonucleico mensageiro
NaPi-IIa - Proteína cotransportadora de sódio e fosfato tipo IIa NUPPEC - Núcleo de Prevenção e Pesquisa de Câncer
PBS - solução salina tamponada com fosfato Pi - íon fosfato
PgR - receptor de progesterona qPCR - PCR em tempo real RNA - ácido ribonucleico
ROS - espécies reativas de oxigênio RR - risco relativo
SD - desvio padrão
SEM - erro padrão da média
SIH - Sistema de Informação Hospitalar sKL – Klotho solúvel
SSC - detector de luz de dispersão lateral
RESUMO
αKlotho é uma proteína de antisenescência celular, a qual está relacionada a ações antitumorais, regulando o crescimento, a proliferação e a invasividade em diversos tipos de tumores, incluindo o câncer de mama. O diagnóstico e prognóstico do câncer de mama são baseados em características intrínsecas do tumor, como a presença de receptores estrogênicos, especialmente o ERα. Por sua vez, o ER apesar de demonstrar ações antitumorais, permanece com papel incerto na carcinogênese da mama e seu uso clínico é limitado. O objetivo do estudo foi analisar a relação entre αKlotho e os receptores de estrogênio, bem como avaliar os níveis séricos desta proteína em pacientes com câncer de mama de acordo com características histopatológicas e imunohistoquímicas do tumor. As linhagens luminal e triplo-negativa de câncer de mama MCF-7 e MDA MB-231 foram cultivadas e expostas aos agonistas dos ER, E2 e DPN, para determinação da expressão de αKlotho, posteriormente foram realizados ensaios de proliferação e de avaliação da EMT nas células MCF-7 tratadas com os mesmos agonistas. Para os ensaios de αKlotho solúvel, amostras de soro de 75 pacientes com câncer de mama e 63 controles saudáveis foram randomizadas e os níveis séricos foram avaliados por ELISA sanduíche. Dados clínicos e diagnósticos foram obtidos dos prontuários e bases de dados do hospital. Nas células MCF-7 houve um aumento considerável na expressão de αKlotho após estímulo do ER com DPN (p<0,01). A ativação do ER também levou à diminuição da proliferação e parada do ciclo celular, bem como a inibição da transição epitélio-mesênquima (EMT). Nas análises de soro, mulheres saudáveis apresentaram níveis maiores de αKlotho solúvel do que pacientes (p=0,04). Dentre as pacientes, aquelas com tumor inicial (p=0,02), positivos para ER (p=0,03), de subtipo luminal (p=0,04) apresentaram níveis séricos mais elevados de αKlotho solúvel. Além disso, a produção de αKlotho em baixos ou altos níveis (p=0,04 e p=0,03) foi associada a maiores taxas de proliferação por Ki67. Por fim, pacientes com ausência de metástase linfonodal também apresentaram maiores níveis de αKlotho (p=0,0γ). Esses dados sugerem que αKlotho solúvel foi relacionado a fatores de melhor prognóstico no câncer de mama, e confirmam a relação entre αKlotho e o ER com a regulação positiva da expressão de αKlotho por parte deste receptor e seu perfil antitumoral em linhagem luminal de mama.
ABSTRACT
αKlotho, a cellular anti-senescence protein, is related to antitumor actions, regulating the growth, proliferation and invasiveness in several types of tumors, including breast cancer. The diagnosis and prognosis of breast cancer are based on intrinsic characteristics of the tumor, such as the presence of estrogen receptors, especially ERα. In turn, ER despite demonstrating antitumor actions, remains with an uncertain role in breast carcinogenesis and its clinical use is limited. The aim of the study was to analyze the relationship between αKlotho and estrogen receptors, as well as to evaluate the serum levels of this protein in patients with breast cancer according to histopathological and immunohistochemical characteristics of the tumor. The luminal and triple-negative lineages of breast cancer, MCF-7 and MDA MB-231, were cultured and exposed to the agonists of ER, E2 and DPN, to determine the expression of αKlotho, then proliferation and EMT evaluation trials were performed on MCF-7 cells treated with the same agonists. For the soluble αKlotho assays, serum samples from 75 breast cancer patients and 63 healthy controls were randomized and serum levels were assessed by sandwich ELISA. Clinical and diagnostic data were obtained from hospital records and databases. In MCF-7 cells there was a considerable increase in αKlotho expression after stimulation of ER with PND (p<0.01). Activation of ER also led to decreased proliferation and cell cycle arrest, as well as inhibition of the epithelial-mesenchymal transition (EMT). In serum analyzes, healthy women had higher levels of soluble αKlotho than patients (p=0.04). Among the patients, those with initial tumor (p=0.02), ER positivity (p=0.03), and luminal subtype (p=0.04) had higher serum levels of soluble αKlotho. Furthermore, αKlotho production in low or high levels (p=0.04 and p=0.03) was associated with higher rates of proliferation by Ki67. Finally, patients with no lymph node metastasis also had higher levels of α Klotho (p=0.03). These data suggest that soluble αKlotho was related to factors of better prognosis in breast cancer and confirm the relationship between αKlotho and ER with the positive regulation of αKlotho expression by this receptor and its antitumor profile in breast lumen.
SUMÁRIO
1 INTRODUÇÃO ... 15
1.1 Klotho e senescência celular ... 15
1.2 Proteína de membrana e suas funções homeostásicas ... 16
1.γ αKlotho, um hormônio circulante ... 17
1.4 αKlotho solúvel e carcinogênese ... 19
1.5 Câncer de mama e os receptores de estrogênio ... 20
1.6 αKlotho, estrogênio e seus receptores... 22
2 JUSTIFICATIVA ... 23
3 OBJETIVOS ... 24
3.1 Objetivo Geral ... 24
3.2 Objetivos Específicos ... 24
4 MATERIAIS E MÉTODOS ... 25
4.1 Cultura Celular ... 25
4.2 Reagentes e Tratamentos ... 27
4.3 Reação em cadeia da Polimerase em tempo real (qPCR) ... 27
4.4 Ensaio de proliferação por MTT ... 28
4.5 Ensaio de proliferação por decaimento de CFSE ... 29
4.6 Ensaio de ciclo celular ... 30
4.7 Pacientes e amostras de soro ... 25
4.8 Mensuração de αKlotho solúvel por ELISA ... 26
4.9 Aprovação ética e consentimento em participar ... 25
4.10 Análise estatística ... 31
5 RESULTADOS ... 32
5.1 Ativação do ER aumenta expressão de αKlotho na linhagem MCF-7 ... 32
5.β Ativação do ER diminui a proliferação estimulada por Eβ em células MCF-7 . 32 5.γ Ativação do ER causa parada do ciclo celular e aumento da expressão de pβ1 . 34 5.4 Ativação do ER leva a diminuição de marcadores de EMT em células MCF-7 35 5.5 Análise em pacientes com câncer de mama: caracterização da amostra ... 36
5.6 Níveis séricos de αKlotho são maiores em indivíduos saudáveis e em pacientes com tumores iniciais de mama ... 38
5.8 Níveis séricos de αKlotho são maiores em pacientes com tumores de mama
luminais ... 39
5.9 Pacientes positivos para αKlotho solúvel apresentam menores taxas de Ki67... 40
5.10 Pacientes sem comprometimento linfonodal apresentam maiores níveis de αKlotho ... 41
5.11 Pacientes com tumores ER-negativos apresentam maior risco de metástase linfonodal ... 41
6 DISCUSSÃO ... 43
7 CONCLUSÃO ... 49
15
1 INTRODUÇÃO
1.1 Klotho e senescência celular
Todos os organismos vivos passam pelo processo de envelhecimento que culmina com a sua morte, com isso, ano após ano, o aumento da expectativa de vida e a busca por um gene que determine a longevidade e tenha poder sobre a sobrevida celular sempre foi um dos principais objetivos da ciência moderna. Em 1997, Kuro e colaboradores identificaram um gene que quando mutado levava camundongos a apresentarem fenótipos compatíveis com o envelhecimento, dando um passo de suma importância para o estudo da antisenescência fisiológica, sendo este gene então denominado Klotho. Na mitologia grega, tanto humanos como deuses tinham seus destinos determinados pelas Moiras, três irmãs, filhas de Zeus e Themis a deusa da justiça. Klotho era responsável por girar o fio da vida, Lachesis determinaria seu comprimento e Átropos o cortaria.
16
1.2 Proteína de membrana e suas funções homeostásicas
O gene Klotho codifica uma glicoproteína transmembrana de passagem única do tipo I denominada αKlotho, contendo um domínio extracelular que é formado por duas repetições internas (KL1 e KL2) de aproximadamente 450 aminoácidos (Figura 1). Esta região possui grande homologia com enzimas da família das glicosidases, que são responsáveis por hidrolisar a ligação -glicosídica em sacarídeos, glicoproteínas e glicolipídios (KURO-O et al., 1997; TOHYAMA et al., 2004). Apesar de αKlotho não possuir em sua repetição resíduos de ácido glutâmico conservados, essenciais para atividade catalítica, pesquisas já relataram atividade sialidase e -glucuronidase por parte desta proteína (CHA et al., 2008; CHANG, Q. et al., 2005). αKlotho é composto ainda por um domínio intracelular curto de 10 aminoácidos (KURO-O et al., 1997).
Além da membrana plasmática a proteína αKlotho também já foi relatada no complexo de Golgi, estando expressa em diversos tecidos e órgãos, com maior destaque para o rim onde é encontrado em maiores níveis, especificamente no túbulo contorcido distal e no túbulo proximal (HU et al., 2010; IMURA et al., 2007). Também é expresso no plexo coroide cerebral, glândula paratireoide, área adventícia da aorta, ovário, testículo e placenta (BEN-DOV et al., 2007; KURO-O et al., 1997; RITTER et al., 2015; SOPJANI; DËRMAKU-SOPJANI, 2016).
αKlotho forma um complexo constitutivo obrigatório com os receptores de fator de crescimento de fibroblastos (FGFR), fornecendo afinidade de ligação seletiva destes receptores aos seus ligantes, os fatores de crescimento de fibroblastos (FGF) endócrinos, FGF19, FGF21 e o FGF23, sendo este último o responsável pelas principais ações homeostasícas descritas para αKlotho (IDE et al., 2016; KHARITONENKOV, 2009).
FGF23 é um hormônio derivado do osso que possui um papel central na homeostase de fosfato (Pi) e Ca2+, bem como da vitamina D (calcitriol) (KURO-O, 2006;
KUROSU et al., 2006). αKlotho converte FGFR canônicos em receptores altamente seletivos para FGF23, e este, ao atuar no complexo αKlotho-FGFR, inibe a recaptação de fosfato inorgânico nos túbulos proximais do rim por meio da NaPi-IIa, uma proteína cotransportadora de sódio-fosfato de tipo II, além de regular negativamente a expressão da 1α-hidroxilase (CYP27B1), enzima envolvida na síntese da forma ativa da vitamina D, o calcitriol, que é responsável pela reabsorção de Pi no intestino (KUROSU et al., 2006; URAKAWA et al., 2006). FGF23 atua ainda na reabsorção renal de Ca2+ por meio
17 para uma série de funções fisiológicas vitais do organismo como o metabolismo ósseo, é intimamente ligada a presença de αKlotho de membrana enquanto coreceptor obrigatório de FGF23 (KUROSU et al., 2006; URAKAWA et al., 2006). Corroborando com essas funções, um estudo em camundongos mutados para αKlotho (kl/kl) apresentaram problemas graves de metabolismo mineral, crescimento e vida útil (KURO-O et al., 2006; KURO-O et al., 2017).
Dois outros membros da família Klotho foram detectados, o Klotho e Kotho, sendo o beta expresso no fígado, pâncreas, tecido adiposo e rins, com ações descritas no metabolismo energético, e o gama detectado nos rins, olhos e pele com funções ainda a serem elucidadas (ITO et al., 2002; ITO et al., 2000; KIM, J. H. et al., 2015). Porém, αKlotho é o mais abundante e responsável pela maioria das ações antienvelhecimento já descritas até o presente momento, apresentando além da isoforma transmembranar, uma forma solúvel originada na clivagem da porção extracelular e uma forma secretada gerada por splicing alternativo (MATSUMURA et al., 1998; SHIRAKI-IIDA et al., 1998).
1.3 αKlotho, um hormônio circulante
Além de ser um constituinte da membrana plasmática, o αKlotho pode ser clivado e liberado para atuar como um hormônio circulante autócrino, parácrino ou endócrino, presente no sangue, na urina e no líquido cefalorraquidiano (AKIMOTO et al., 2012; CHEN, C. D. et al., 2014). αKlotho solúvel (sKL) é originado após ação de uma família de proteínas denominadas sheddases, como as proteínas desintegrinas e metaloproteinases (ADAM), especificamente ADAM10 e ADAM17, que clivam a porção externa de αKlotho com as duas repetições KL1 e KL2, como ilustrado na Figura 1 (BLOCH et al., 2009; CHEN, C. D. et al., 2007).
18 sKL pode agir ainda de forma anti-inflamatória sobre as citocinas TNFα e IFN . Camundongos deficientes de Klotho e consequentemente com menor sKL apresentam um aumento da sinalização destas vias de citocinas o que contribui para um envelhecimento acelerado (LIU et al., 2007; THURSTON et al., 2010). Por fim, a homeostase de íons também faz parte dos mecanismos antisenescência gerados pelo sKL em diversos órgãos. Canais iônicos e transportadores de íons, com destaque para os de Pi e Ca2+, sofrem ação direta do sKL através da modificação do N-glicano destes locais por
sua atividade sialidase/ -glucuronidase (CHA et al., 2008; CHANG, Q. et al., 2005; HU et al., 2010).
Baseado nestes diversos mecanismos de ação, sKL vem sendo descrito ao longo dos anos como um hormônio circulante capaz de proteger nosso organismo de várias doenças agudas e crônicas relacionadas à senescência, e com as descobertas da última década, desempenhando, sobretudo, proteção contra o câncer (KURO-O, 2010; SOPJANI; DËRMAKU-SOPJANI, 2016; XUAN, N. et al., 2016; YAMAMOTO et al., 2005).
Figura 1. Diagrama esquemático do αKlotho de membrana e geração de sKL
19
1.4 αKlotho solúvel e carcinogênese
O avanço das descobertas trouxe uma nova perspectiva sobre sKL, determinando sua ação como uma proteína supressora de tumor, uma vez que demonstrou atuar por várias vias de sinalização, como a do FGF, Wnt, p53/p21, fator de crescimento transformador beta (TGF- ) e IGF-1/insulina, influenciando assim o crescimento, proliferação, diferenciação e migração celular (CHEN, B. et al., 2012; CHEN, T. et al., 2016; DOI et al., 2011; PERRI et al., 2017; TANG, X. et al., 2016; WANG, Y. et al., 2013; WOLF et al., 2008; ZHOU, X.; WANG, 2015).
αKlotho é considerado um importante inibidor da via IGF-1/insulina, ligada a funções fisiológicas de sobrevida celular (KUROSU et al., 2006). A desregulação dos componentes do eixo IGF/insulina pode levar a um processo carcinogênico pelo aumento do crescimento, sobrevida e invasividade celular, bem como ações anti-apoptóticas, o que facilita a manutenção de um fenótipo maligno, verificada em diversos tipos tumorais (POLLAK; SCHERNHAMMER; HANKINSON, 2004; RAY; ALALEM; RAY, 2014).
A relação de antagonismo do sKL com a via IGF/insulina teve um importante impacto no processo oncogênico, no qual verificou-se uma influência na homeostasia celular em diversos pontos da cascata de sinalização (WOLF et al., 2008; YAMAMOTO et al., 2005). Estudos utilizando linhagens celulares de câncer de mama, pulmão, pâncreas e hepático mostraram uma regulação negativa pela interação entre sKL e o receptor do fator de crescimento semelhante à insulina tipo 1 (IGF-1R) ou o receptor de insulina (IR), suprimindo a fosforilação destes receptores e de seus substratos IRS-1 e IRS-2, inibindo o eixo PI3K/Akt com consequente efeito inibitório em cascata sobre o crescimento e proliferação celular (ABRAMOVITZ et al., 2011; CHEN, B. et al., 2010; SHU et al., 2013; WOLF et al., 2008).
Outro ponto crucial da via de sinalização do IGF-1/insulina é a sua ação anti-apoptótica, através da transcrição dos genes Bax/Bcl-2, que se mostraram regulados no tratamento com sKL, deixando estas células tumorais mais suscetíveis à apoptose (CHEN, B. et al., 2010).
20 aminoácidos, além da diminuição de seus alvos a jusante, como os transcritos dos genes c-Myc e ciclina D1, responsáveis pela progressão do ciclo celular (CHEN, B. et al., 2012).
Em adição, a inibição na sinalização da via Wnt/ -catenina por parte de sKL parece estar relacionada a influência sobre os ligantes Wnt e a interação destes com os receptores, como no câncer de pulmão, em que foi observada diminuição de Wnt3A, mostrando que a sKL impediu sua internalização (CHEN, B. et al., 2012). Em linhagens celulares de melanoma mostrou que a ligação e internalização do ligante Wnt5A foi prejudicada pela ação sialidásica do sKL sobre os glicanos da superfície celular essenciais para a sinalização, ao mesmo tempo em que diminuiu a capacidade metastática da sinalização de Wnt5A através da inibição da calpaína, uma enzima que, por meio das alterações do citoesqueleto, confere mobilidade e capacidade migratória às células do melanoma (CAMILLI et al., 2011).
Por fim, αKlotho mostrou inibição sobre uma importante via ligada a invasividade tumoral, a do TGF- . Células renais tratadas com sKL tiveram melhora de fibrose e consequentemente diminuição da chance de metástase tumoral por meio da inibição da transcrição de genes e outros marcadores ligados a transição epitélio-mesênquima (EMT), impedindo que estas células criassem características que facilitem sua migração e disseminação pelo organismo (DOI et al., 2011).
Com isso, por meio da inibição de uma ou múltiplas vias, sKL tem validado sua atuação sobre o processo carcinogênico, com impacto inclusive na sobrevida e na resposta à quimioterapia, confirmando assim, seu perfil antitumoral em diversos tipos de câncer, como pulmão, rim, cólon, próstata, ovário e colo uterino, além de ser protagonista em várias pesquisas contra a neoplasia mais prevalente entre as mulheres de todo o mundo, os tumores mamários (CHEN, T. et al., 2016; KIM, J. H. et al., 2016; LEE, J. et al., 2010; LI, X.-X. et al., 2014; RUBINEK, TAMI et al., 2012; SEO et al., 2017; USUDA et al., 2011; WANG, Y. et al., 2013; YAN et al., 2017).
1.5 Câncer de mama e os receptores de estrogênio
21 Por ser uma doença heterogênea em seus padrões genéticos e moleculares, o diagnóstico, estadiamento e tratamento do câncer de mama são atualmente baseados em diversas variáveis, que irão individualizar e definir a conduta clínica, sendo determinantes para o sucesso terapêutico (ALLRED et al., 1998; GIULIANO; EDGE; HORTOBAGYI, 2018; ZAHA, 2014). Dentre as características avaliadas estão os parâmetros histopatológicos, que definirão a morfologia do tumor e o acometimento de tecidos adjacentes ou a distância, como o tamanho tumoral, seu grau de diferenciação com relação ao tecido de origem e a presença de metástases na rede de linfonodos mais próxima da mama (AHMAD et al., 2009; FERNANDES; ROSEL; BRÁBEK, 2017; RAKHA et al., 2010). Somado a isso, características moleculares intrínsecas do tumor também são levadas em conta, como a presença de receptores hormonais e de fatores de crescimento, principalmente os receptores de estrogênio (ER), o receptor de progesterona (PgR) e o receptor 2 do fator de crescimento epidérmico (HER2) (EARLY et al., 2011; HARBECK; THOMSSEN; GNANT, 2013; MALHOTRA et al., 2010).
Os receptores de estrogênio (ER) estão ligados ao desenvolvimento fisiológico da glândula mamária por meio de estímulos provindos de hormônios esteróides (BOCCHINFUSO, WAYNE P.; KORACH, 1997; BOCCHINFUSO, W. P. et al., 2000; OMOTO; IWASE, 2015). Em contraste com a sua função fisiológica, a ativação destes receptores em contextos carcinogênicos gera a base para o desenvolvimento e progressão tumoral (SOMMER; FUQUA, 2001; ZHOU, Z. et al., 2014). As ações biológicas do estradiol (E2), um estrógeno natural, ocorrem então, por sua ligação a um dos membros desta família de receptores, o ERα ou ER (LEE, H.-R. R.; KIM; CHOI, β01β; YAŞAR et al., 2017). O ERα está bem estabelecido no câncer de mama como um regulador de genes ligados ao crescimento e proliferação das células tumorais, por isso é o receptor mais pesquisado e sua presença é a base para as terapias hormonais existentes (ALI; COOMBES, 2000; DUFFY, 2008; HAYASHI et al., 2003). No entanto até 40% dos pacientes não respondem à terapia hormonal vigente baseada no ERα, sendo a resistência e a ocorrência de recidivas um problema clínico significativo, que expõe a necessidade da busca por novos alvos que definiriam melhor quais pacientes seriam beneficiados com este tipo de terapia, como o outro membro da família dos receptores de estrogênio, o ER (HALDOSÉN; ZHAO; DAHLMAN-WRIGHT, 2014; LIAO et al., 2014; LIN et al., 2007; SIEUWERTS et al., 2014).
22 diminuída, apesar disso aproximadamente 50% dos tumores luminais são positivos para ER , também presente em tumores triplo-negativos (MAROTTI et al., 2009). Durante o processo carcinogênico da mama, o gene ESR2, responsável pela expressão deste receptor é hipermetilado, e estas linhagens tendem a perder sua expressão, demonstrando que a sua presença pode desencadear ações que impeçam o desenvolvimento e progressão tumoral (RODY et al., 2005; ZHAO et al., 2003).
Apesar do perfil antitumoral demonstrado, muito tem sido discutido sobre a ação dicotômica do ER . Kontos et al (2011) relataram que apesar de apresentar ações antiproliferativas e antiapoptóticas em linhagem celular de câncer de mama, quando o estudo foi expandido para modelos in vivo com camundongos foi verificado um aumento da massa tumoral induzido pela presença do ER . No entanto, grande parte dos estudos conduzidos a fim de desvendar as ações do ER , sustentam a sua atuação como um regulador negativo da via estrogênica ativada pelo ERα, em especial na expressão conjunta de ambos receptores, o que leva a uma diminuição da proliferação e consequentemente impede o desenvolvimento do tumor, demonstrando que o ER deve ser considerado enquanto marcador promissor de prognóstico e de definição terapêutica no câncer de mama (KARAMOUZIS et al., 2016; PATERNI et al., 2014; PETTERSSON; DELAUNAY; GUSTAFSSON, 2000).
1.6 αKlotho, estrogênio e seus receptores
23
2 JUSTIFICATIVA
24
3 OBJETIVOS
3.1 Objetivo Geral
Verificar a relação entre os receptores de estrogênio e αKlotho na linhagem luminal de câncer de mama MCF-7, bem como dosar e correlacionar em amostras de soro de pacientes os níveis de αKlotho solúvel de acordo com perfis tumorais imuno -histoquímicos e histopatológicos.
3.2 Objetivos Específicos
- Elucidar a influência que a ativação dos ER (ERα e ER ) exerce sobre a expressão de αKlotho em células MCF-7;
- Elucidar, para efeito de comparação, esta mesma influência sobre a expressão de αKlotho em células de câncer de mama triplo negativo, MDA MB-231;
- Analisar o perfil proliferativo e de EMT induzido pelo agonismo de ER em células MCF-7, comparando ao já descrito na literatura para αKlotho;
- Avaliar como os níveis séricos de αKlotho se comportam no paralelo saúde-doença (pacientes com câncer de mama versus controles);
- Avaliar os níveis séricos de αKlotho de acordo com o estágio da doença (inicial e avançado), assim como o subtipo molecular para análise comparativa com resultados da cultura celular;
- Avaliar a relação entre a positividade ou não dos receptores ER, PgR e HER2 com os níveis séricos de αKlotho;
- Avaliar a relação entre os níveis séricos de αKlotho e a proliferação tumoral baseada nas taxas do marcador imuno-histoquímico Ki67;
25
4 MATERIAIS E MÉTODOS
4.1 Aprovação ética e consentimento em participar
O Termo de Consentimento Livre e Esclarecido para uso de anotações médicas e amostras de soro foi assinado por todos os pacientes. Uma vez aceitos, os pacientes foram informados de que suas informações seriam utilizadas em estudos secundários eticamente aprovados pelo Comitê de Ética em Pesquisa do Centro Universitário do Triângulo sob o parecer 1.230.380, de 16 de setembro de 2015. CAAE: 38930314.5.0000.5565. Todas as informações coletadas serão mantidas em sigilo pelos pesquisadores.
4.2 Pacientes e amostras de soro
As amostras dos pacientes em estudo foram obtidas em parceria com o Núcleo de Prevenção e Pesquisa de Câncer (NUPPEC) do setor de oncologia do Hospital de Clínicas da Universidade Federal de Uberlândia (HC-UFU). As amostras de sangue periférico de pacientes e controles foram coletadas por profissionais do NUPPEC durante a primeira consulta destes no serviço. Para participar os pacientes deveriam ter diagnóstico de câncer de mama comprovado por biópsia e não terem realizado nenhum tratamento prévio (cirúrgico, radioterápico ou quimioterápico). Após coleta, o soro foi separado de acordo com o protocolo e armazenado a -80°C no banco de amostras NUPPEC. Para o presente estudo foram randomizadas amostras de soro de 75 pacientes, além de 63 familiares saudáveis sem história prévia de câncer para compor o grupo controle. Ambos os grupos foram compostos por amostras de indivíduos do sexo feminino.
Dados demográficos e clínicos de pacientes e controles foram coletados através de registros médicos e do banco de dados do NUPPEC. As variáveis histopatológicas e imuno-histoquímicas, como tamanho do tumor, grau histológico, status linfonodal, status do ER, status do receptor de progesterona (PgR), status do receptor 2 do fator de crescimento epidérmico (HER2) e do marcador de proliferação Ki67 foram obtidas da biópsia registrada no Sistema de Informações Hospitalares (SIH) do HC-UFU. Os anticorpos utilizados para pesquisa imuno-histoquímica dos marcadores segundo laudo do SIH foram os clones: 6F11 (anti-ERα), 16 (anti-PgR), 5A2 erbB2) e MIB1 (anti-Ki67).
26 ferramenta preconizada pela União Internacional de Controle do Câncer (UICC) para o estadiamento tumoral, baseada na extensão anatômica do tumor primário (T), no acometimento dos linfonodos da cadeia de drenagem próxima a localização do tumor (N) e a presença de metástases a distância (M), serviu de base para o agrupamento das pacientes por estágio tumoral nos grupos inicial e avançado (AMIN et al., 2017). Tumores com tamanho T1 ou T2, sem comprometimento linfonodal ou metástases à distância, foram considerados iniciais. Tumores com um ou mais linfonodos positivos e/ou metástases à distância e/ou tumores T3 (> 5cm) foram considerados avançados.
Posteriormente, os pacientes foram classificados de acordo com o perfil molecular de tumor. Esta classificação foi baseada no Consenso Internacional St. Gallen de Especialistas em Câncer de Mama (UNTCH et al., 2013). Tumores Luminais, compostos pelos subtipos Luminal A e Luminal B, são aqueles com positividade para ER e/ou PgR e negativos para HER2. Tumores Triplo Negativos são aqueles com negatividade para os três receptores ER, PgR e HER2. Por fim, os tumores com superexpressão de HER2 apresentaram positividade apenas para este receptor.
4.3 Mensuração de αKlotho solúvel por ELISA
O αKlotho solúvel no soro dos pacientes e no sobrenadante de cultura de células foi medido pelo ensaio imunoenzimático ELISA, kit DY5334-05 (R&D Systems Europe Ltd., Abingdon, OX, Reino Unido), conduzido de acordo com o protocolo do fabricante. O sobrenadante da cultura de células foi coletado após 72 horas de tratamento. Os ensaios foram realizados em placas de 96 poços, em duplicata para as amostras de soro humano e triplicata para os sobrenadantes de células como controle intra-ensaio. A placa foi lida a 450 nm no Sistema GloMax® Discover (Promega, Madison, WI, EUA) e a absorbância foi obtida por densidade óptica. Os níveis de αKlotho solúvel foram determinados pela comparação com curva padrão da proteína recombinante αKlotho humana. O limite de sensibilidade do kit foi determinado em 50pg/ml.
4.4 Cultura Celular
27 interferência da ação hormonal sobre os receptores estrogênicos em estudo, realizou-se depleção hormonal durante 24 horas com meio RPMI 1640 livre de vermelho fenol, acrescido de 5% de FBS tratado com dextrano e carvão ativado para retirada de hormônios (DEMBINSKI; LEUNG; SHIU, 1985). As células foram cultivadas em ambiente úmido a 37°C com 5% de CO2. Todos os ensaios foram realizados antes das
células atingirem 80% de confluência.
4.5 Reagentes e Tratamentos
Após as células serem submetidas a 24 horas de depleção hormonal, administrou-se para cada grupo em estudo administrou-seu respectivo reagente, administrou-sendo estes, o estradiol (E2) um agonista não específico de ER e o diarilpropionitrilo (DPN), um agonista específico do ER , ambos na concentração de 10nM. O dimetilsulfóxido (DMSO) foi utilizado como veículo para as drogas e como reagente para o grupo controle. Todos os reagentes foram adquiridos da SIGMA (St. Louis, MO, EUA). O tratamento ocorreu durante 48 horas para os ensaios de Reação em Cadeia da Polimerase em tempo real (qPCR) e durante 72hs para os ensaios de proliferação (MTT e decaimento de CFSE) e de ciclo celular.
4.6 Reação em cadeia da Polimerase em tempo real (qPCR)
As células foram cultivadas em placas de 48 poços e tratadas como supracitado. Após isso, a expressão gênica dos alvos propostos na linhagem MCF-7 foi avaliada por qPCR. Primeiramente o RNA total foi extraído utilizando o kit do Sistema de Isolamento de RNA SV Total no equipamento Maxwell® RSC Instrument (Promega, Madison, WI,
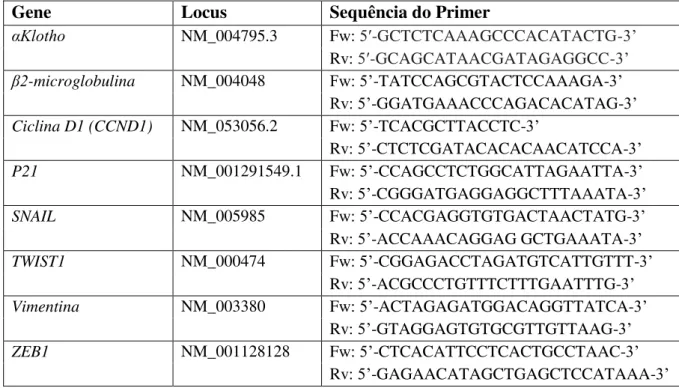
28 Os primers utilizados para amplificação estão descritos na Tabela 1. As sequências foram projetadas com a ferramenta Primer Quest (IDTDNA) e analisadas com o BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi). A curva de eficiência foi realizada para todos os primers. 100ng de cDNA foi utilizado por reação, para um total de 40 ciclos. Os parâmetros das reações foram selecionados de acordo com o protocolo do fabricante. A expressão semiquantitativa foi determinada pelo método 2^ΔΔCt, usando β -microglobulina como gene endógeno e a amostra de referência foram as células não tratadas.
Tabela 1. Sequência dos primers para os genes alvo analisados por qPCR
Gene Locus Sequência do Primer
αKlotho NM_004795.3 Fw: 5′-GCTCTCAAAGCCCACATACTG-γ’
Rv: 5′-GCAGCATAACGATAGAGGCC-γ’
β2-microglobulina NM_004048 Fw: 5’-TATCCAGCGTACTCCAAAGA-γ’
Rv: 5’-GGATGAAACCCAGACACATAG-γ’
Ciclina D1 (CCND1) NM_053056.2 Fw: 5’-TCACGCTTACCTC-γ’
Rv: 5’-CTCTCGATACACACAACATCCA-γ’
P21 NM_001291549.1 Fw: 5’-CCAGCCTCTGGCATTAGAATTA-γ’
Rv: 5’-CGGGATGAGGAGGCTTTAAATA-γ’
SNAIL NM_005985 Fw: 5’-CCACGAGGTGTGACTAACTATG-γ’
Rv: 5’-ACCAAACAGGAG GCTGAAATA-γ’
TWIST1 NM_000474 Fw: 5’-CGGAGACCTAGATGTCATTGTTT-γ’
Rv: 5’-ACGCCCTGTTTCTTTGAATTTG-γ’
Vimentina NM_003380 Fw: 5’-ACTAGAGATGGACAGGTTATCA-γ’
Rv: 5’-GTAGGAGTGTGCGTTGTTAAG-γ’
ZEB1 NM_001128128 Fw: 5’-CTCACATTCCTCACTGCCTAAC-γ’
Rv: 5’-GAGAACATAGCTGAGCTCCATAAA-γ’
4.7 Ensaio de proliferação por MTT
Para o ensaio MTT, após o tratamento as células foram incubadas com uma solução contendo brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difenil-17-tetrazólio (Sigma, St. Louis, MO, EUA) a 5mg/ml em solução salina tamponada com fosfato (PBS). Subsequentemente, 10μl de solução de MTT mais 90μl de meio RPMI 1640 sem vermelho fenol com 10% de FBS livre de hormônios foram adicionados para uma concentração final de 0,5mg/ml. As células foram então incubadas durante 4 horas a 37°C, 5% de CO2, em ambiente úmido protegido da luz. Por fim, a solução de MTT foi
29 formazan. A leitura foi feita usando o sistema GloMax® Discover (Promega, Madison, WI, EUA) a 570nm.
4.8 Ensaio de proliferação por decaimento de CFSE
Para o ensaio de proliferação por decaimento de CFSE, após o tratamento as células foram tripsinizadas, lavadas em PBS e ressuspendidas em meio RPMI 1640 livre de vermelho fenol a uma concentração de 5x105 células/ml. Posteriormente, CFSE
(Invitrogen, Eugene, OR, USA) foi adicionado a uma concentração final de 5µM e as células foram incubadas durante 15 minutos a 37°C em homogeneização constante. Após este período, as células foram lavadas novamente com PBS e a intensidade do CFSE foi avaliada no tempo zero. Na sequência, as células foram semeadas em placas de 12 poços por 72 horas na concentração de 5x104 células por poço. As análises foram feitas por
citometria de fluxo no CytoFlex (Beckman Coulter, Brea, CA, EUA).
30 Figura 2. Estratégia de gate para o ensaio de proliferação por CFSE em linhagem celular MCF-7.
(A) gate MCF-7 para delimitação da população viável destas células. (B)gate singlets para delimitação dos
eventos isolados adquiridos. (C) Histograma para avaliação do decaimento da fluorescência de CFSE após 72 horas de tratamento. NM: células não maracadas em 0 horas (gate negativo), M: células marcadas em 0
horas (gate positivo) e CT: controle.
4.9 Ensaio de ciclo celular
31 no CytoFlex (Beckman Coulter, Brea, CA, EUA), e os dados interpretados utilizando o software FlowJo® (FlowJo LCC, Ashland, OR, EUA).
4.10 Análise estatística
32
5 RESULTADOS
5.1 Ativação do ERβ aumenta expressão de αKlotho na linhagem MCF-7
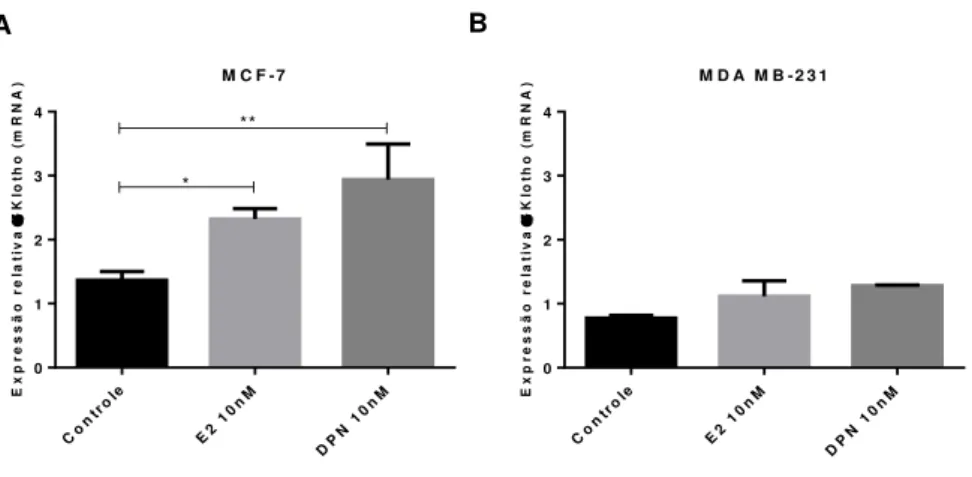
Primeiramente, foi avaliada a influência dos ER na expressão do gene αKlotho em células tumorais de mama luminais MCF-7 e triplo negativas MDA MB-231. Estas células foram tratadas com E2, agonista ambíguo de ER, e DPN, agonista específico para o ER . Ambos induziram a expressão de mRNA de αKlotho na linhagem MCF-7. No entanto, a ativação específica do ER triplicou a expressão do gene αKlotho na comparação com o controle (p <0,01) (Figura 3A). O mesmo não foi observado na linhagem MDA MB-231, na qual os agonistas não mostraram qualquer efeito sobre a expressão de αKlotho (Figura 3B).
M C F -7
E x p r e s s ã o r e la ti v a K lo th o ( m R N A ) Co ntr ole E2 10 nM DP N 1
0n M 0 1 2 3 4 ** *
M D A M B -2 3 1
E x p r e s s ã o r e la ti v a K lo th o ( m R N A ) Co ntr ole E2 10 nM DP N 1
0n M 0 1 2 3 4 A B
Figura 3. Expressão do mRNA de αKlotho após o uso de agonistas de ER em linhagens de câncer de mama. (A) Linhagem luminal de câncer de mama, MCF-7. (B) Linhagem triplo negativa de câncer de mama, MDA MB-231. Ambas linhagens foram incubadas com os reagentes dos respectivos tratamentos por 48 horas. As barras representam média ±SEM (n= 3). Teste estatístico: One-way ANOVA, p= 0,004.
O sobrenadante das culturas de células MCF-7 e MDA MB-231 também foi avaliado para a presença de αKlotho solúvel por meio do ensaio imunoenzimático ELISA, no entanto, a proteína não foi detectada em nenhum dos grupos avaliados.
5.2 Ativação do ERβ diminui a proliferação estimulada por E2 em células MCF-7
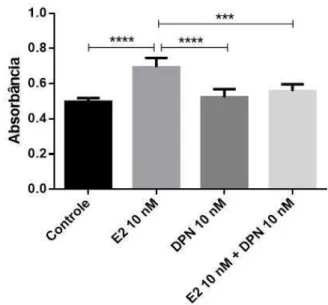
33 CFSE (Figura 5). As células MCF-7 expostas a E2 proliferaram, enquanto as células expostas ao DPN não apresentaram alteração em ambos ensaios. No entanto, na exposição conjunta a ambos os agonistas, foi observada uma diminuição da proliferação celular estimulada por E2 (Figuras 4 e 5B).
Figura 4. Ensaios de proliferação por MTT em linhagem MCF-7. As células foram incubadas com os reagentes dos respectivos tratamentos por 72 horas. A proliferação foi avaliada por MTT. Barras representam média ±SEM (n= 5). Teste estatístico: One-way ANOVA, p<0,0001.
34
5.3 Ativação do ERβ causa parada do ciclo celular e aumento da expressão de p21
Para confirmação do perfil proliferativo do ER foi realizado ainda o ensaio de ciclo celular e avaliada a expressão de genes relacionados à regulação deste ciclo, ciclina D1 (CCND1) e p21. Ficou evidenciado que o tratamento com DPN na linhagem MCF-7 aumentou a porcentagem de células na fase G1 (Figuras 6A e 6B), enquanto diminuiu na fase G2/M (Figuras 6A e 6D), p <0,0001.
Além disso, a ativação do ER também levou ao aumento da expressão do gene p21, regulador de transição de fases G1/S, p <0,01 (Figura 7B), o mesmo não foi observado para ciclina D1 (Figura 7A).
35
C C N D 1
E x p r e s s ã o r e la ti v a ( m R N A ) Co ntr ole E2 10 nM DP N 1
0 n M 0
1 2 3
4 **** ****
P 2 1
E x p r e s s ã o r e la ti v a ( m R N A ) Co ntr ole E2 10 nM DP N 1
0 n M 0 1 2 3 4 ** **** A B
Figura 7. Expressão relativa do mRNA de reguladores do ciclo celular após ativação dos ER em MCF-7. (A) CCND1 e (B) P21 em MCF-7 após o agonismo de ER . O estradiol (Eβ) foi utilizado como
controle positivo. As células foram incubadas com os reagentes dos respectivos tratamentos por 48 horas. As barras representam média ±SEM (n= 3). Teste estatístico: One-way ANOVA, p <0,0001.
5.4 Ativação do ERβ leva a diminuição de marcadores de EMT em células MCF-7
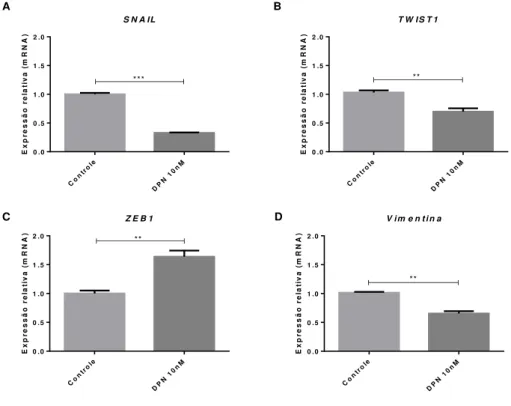
A fim de confirmar o perfil antitumoral do ER , avaliamos também a influência da sua ativação sobre o evento de EMT em células MCF-7, verificando a expressão gênica dos fatores de transcrição SNAIL, TWIST1 e ZEB1, além da vimetina (Figura 8).
S N A IL
E x p re s s ã o r e la ti v a ( m R N A ) Co ntr ole DP N 1
0n M 0 .0 0 .5 1 .0 1 .5 2 .0 ***
T W IS T 1
E x p re s s ã o r e la ti v a ( m R N A ) Co ntr ole DP N 1
0n M 0 .0 0 .5 1 .0 1 .5 2 .0 **
Z E B 1
E x p re s s ã o r e la ti v a ( m R N A ) Co ntr ole DP N 1
0nM 0 .0 0 .5 1 .0 1 .5 2 .0 **
V i m e n t i n a
E x p re s s ã o r e la ti v a ( m R N A ) Co ntr ole DP N 1
0nM 0 .0 0 .5 1 .0 1 .5 2 .0 ** A B C D
36 As células tratadas com DPN mostraram uma diminuição na expressão gênica dos transcritos de SNAIL e TWIST1, p=0,0002 e p=0,0085, respectivamente (Figura 8A-B), combinada com diminuição da expressão de vimentina, um marcador confiável de EMT, p= 0,0011 (Figura 8D), evidenciando um perfil relacionado ao evento de transição mesênquima-epitélio (MET).
5.5 Análise em pacientes com câncer de mama: caracterização da amostra
Em uma segunda etapa, utilizando amostras de soro humano de pacientes com câncer de mama, foram analisados os níveis de αKlotho solúvel e estes correlacionados com parâmetros histopatológicos e imuno-histoquímicos de prognóstico, buscando confirmar o perfil desta proteína para os tumores mamários, bem como, verificar se a relação encontrada nas linhagens de células luminais de câncer de mama entre ER e αKlotho se faz verdadeira no contexto das amostras humanas.
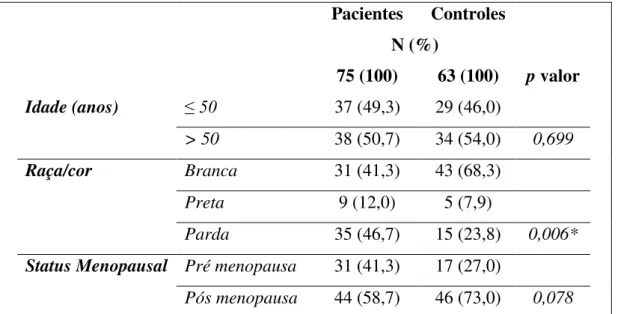
Foram selecionadas e analisadas amostras de soro de 75 pacientes com câncer de mama e 63 familiares saudáveis (grupo controle). A faixa de idade encontrada nas pacientes foi de 31 a 79 anos, enquanto que a idade no grupo controle variou de 34 a 68 anos.
Tabela 2. Características demográficas e clínicas entre pacientes com câncer de mama e grupo controle.
Pacientes Controles
N (%)
75 (100) 63 (100) p valor
Idade (anos) ≤ 50 37 (49,3) 29 (46,0)
> 50 38 (50,7) 34 (54,0) 0,699
Raça/cor Branca 31 (41,3) 43 (68,3)
Preta 9 (12,0) 5 (7,9)
Parda 35 (46,7) 15 (23,8) 0,006*
Status Menopausal Pré menopausa 31 (41,3) 17 (27,0)
37 Os grupos em estudo apresentaram uma distribuição homogênea, exceto para a variável raça, com maioria parda entre as pacientes (46,7%) enquanto que o grupo controle é formado em grande parte por mulheres brancas (68,3%), como demonstrado na Tabela 2.
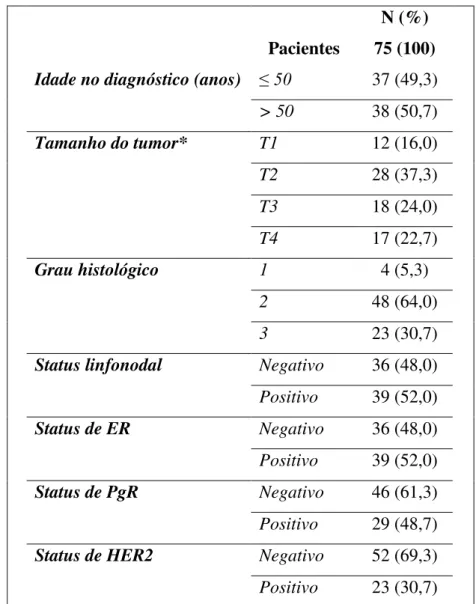
A caracterização dos pacientes de acordo com dados clínicos é apresentada na Tabela 3. Tumores com tamanho entre 2cm e 5cm (T2, 36,78%), moderadamente diferenciados (Grau 2, 65,52%), com pelo menos um linfonodo positivo (52,87%) foram mais prevalentes. Além disso, os tumores ER-positivos foram predominantes (58,63%) em comparação com outros marcadores imuno-histoquímicos, como HER2 e PgR.
Tabela 3. Características imuno-histoquímicas e histopatológicas das pacientes com câncer de mama.
N (%)
Pacientes 75 (100)
Idade no diagnóstico (anos) ≤ 50 37 (49,3)
> 50 38 (50,7)
Tamanho do tumor* T1 12 (16,0)
T2 28 (37,3)
T3 18 (24,0)
T4 17 (22,7)
Grau histológico 1 4 (5,3)
2 48 (64,0)
3 23 (30,7)
Status linfonodal Negativo 36 (48,0)
Positivo 39 (52,0)
Status de ER Negativo 36 (48,0)
Positivo 39 (52,0)
Status de PgR Negativo 46 (61,3)
Positivo 29 (48,7)
Status de HER2 Negativo 52 (69,3)
Positivo 23 (30,7)
Dados apresentados em números absolutos (N) e relativos (%). * O tamanho do tumor foi classificado como
38
5.6 Níveis séricos de αKlotho são maiores em indivíduos saudáveis e em pacientes com tumores iniciais de mama
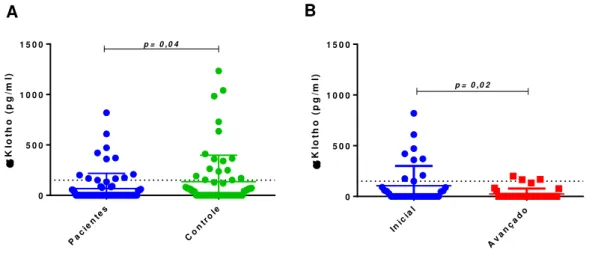
Em uma primeira análise buscou-se avaliar os níveis séricos de αKlotho na comparação entre o grupo das pacientes com câncer de mama e o grupo controle (Figura 9A). Ficou evidenciado que o grupo controle, formado por mulheres saudáveis, apresentou níveis maiores de αKlotho solúvel do que o grupo das pacientes diagnosticadas com câncer de mama (p=0,04). Posteriormente, as pacientes foram divididas para a comparação de acordo com o estágio do tumor que apresentavam, classificados em inicial ou avançado (Figura 9B). Pacientes com tumores iniciais apresentaram níveis séricos mais elevados de αKlotho solúvel do que pacientes com tumores avançados (p=0,03).
Pa cie nte s Co ntr ole 0
5 0 0 1 0 0 0 1 5 0 0
K lo th o ( p g /m l)
p = 0 ,0 4
K lo th o ( p g /m l) Inic ial Av an ça do 0
5 0 0 1 0 0 0 1 5 0 0
p = 0 ,0 2
A B
Figura 9. Níveis séricos de αKlotho em controles saudáveis e pacientes com câncer de mama. (A)
Comparação de αKlotho solúvel entre pacientes (n= 75) e grupo controle (n= 63). (B) Comparação de
αKlotho solúvel de acordo com o estágio do tumor. A classificação TNM foi considerada para a estratificação dos tumores das pacientes em inicial (n= 38) e avançada (n= 37). Os resultados são expressos como mediana, IC 95%. Linha pontilhada representa o cut-off de 150pg/ml que determina baixa ou alta produção de αKlotho solúvel. Teste estatístico: o teste U de Mann-Whitney foi utilizado e a significância estatística foi considerada em p <0,05.
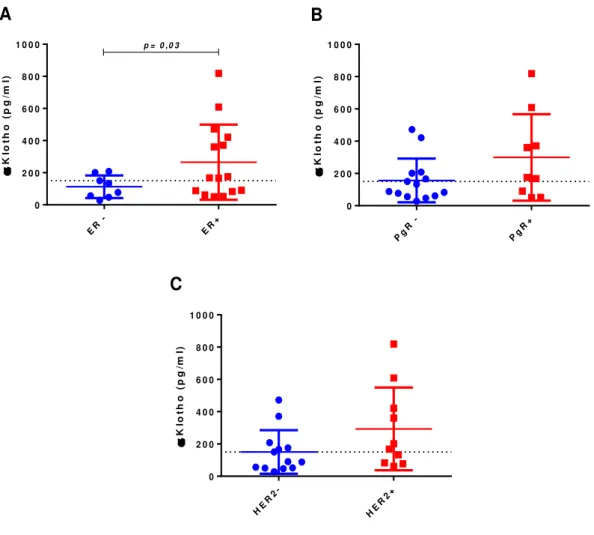
5.7 Pacientes com tumores ER-positivos apresentaram níveis séricos elevados de
αKlotho
39 do que pacientes ER-negativos (p=0,03), como mostra a figura 7A. Este fato não foi observado para os status de PgR e HER2 (Figuras 10B e 10C).
K lo th o ( p g /m l) ER -ER + 0 2 0 0 4 0 0 6 0 0 8 0 0
1 0 0 0 p = 0 ,0 3
K lo th o ( p g /m l) Pg R
-Pg R+
0 2 0 0 4 0 0 6 0 0 8 0 0 1 0 0 0
K lo th o ( p g /m l) HE R2 -HE R2 + 0 2 0 0 4 0 0 6 0 0 8 0 0 1 0 0 0
A B
C
Figura 10. Níveis séricos de αKlotho em pacientes com câncer de mama de acordo com marcadores imuno-histoquímicos. (A) ER: receptor de estrogênio alfa, (B) PgR: receptor de progesterona e (C) receptor do fator de crescimento epidérmico 2 (HER2). A análise foi realizada com todos os pacientes que apresentaram níveis detectáveis αKlotho solúvel (n= 23). Linha pontilhada representa o cut-off de 150pg/ml que determina baixa ou alta produção de αKlotho solúvel. Testes estatísticos: o teste t com correção de Welch foi utilizado para o status de ER com resultados expressos em média ±DP e o teste U de Mann-Whitney para PgR e HER2 com resultados expressos em mediana, IC95%. Significância estatística foi considerada em p <0,05.
5.8 Níveis séricos de αKlotho são maiores em pacientes com tumores de mama luminais
40 baseada na positividade dos marcadores imuno-histoquímicos supracitados, ER, PgR e HER2. Pacientes com tumores luminais apresentaram maiores níveis séricos de αKlotho do que pacientes com tumores triplo-negativos (p=0,03).
K
lo
th
o
(
p
g
/m
l)
Lu min
al
Tri plo
-ne ga
tiv o
0 2 0 0 4 0 0 6 0 0 8 0 0
1 0 0 0 p = 0 ,0 4
Figura 11. Níveis séricos de αKlotho em pacientes com câncer de mama de acordo com os subtipos
moleculares do tumor. A classificação dos pacientes de acordo com os subtipos moleculares em luminal (n= 37) e triplo-negativo (n= 25) foi baseada no Consenso de St. Gallen. Os resultados estão expressos como mediana, IC95%. Linha pontilhada representa o cut-off de 150pg/ml que determina baixa ou alta produção de αKlotho solúvel. Teste estatístico: o teste U de Mann-Whitney foi utilizado e a significância estatística foi considerada em p <0,05.
5.9 Pacientes positivos para αKlotho solúvel apresentam menores taxas de Ki67
41
%
K
i6
7
Nã o d
ete cta
do
Ba ixo
s n íve
is
Alt os
nív eis
0 2 0 4 0 6 0 8 0 1 0 0
p = 0 ,0 4
p = 0 ,0 3
Figura 12.Porcentagem de Ki67 de acordo com a produção de αKlotho solúvel no soro de pacientes com câncer de mama. Pacientes foram consideradas com baixa produção (n=12) quando apresentavam
níveis de αKlotho solúvel abaixo do cut-off de 150pg/ml, enquanto que as pacientes com alta produção (n=11) apresentavam níveis de αKlotho solúvel acima de 150pg/ml, também compõem a análise as pacientes sem produção de αKlotho solúvel no soro (n=52). Os resultados são expressos como média ±DP. Teste estatístico: teste t com correção de Welch foi utilizado e a significância estatística foi considerada em p<0,05.
5.10 Pacientes sem comprometimento linfonodal apresentam maiores níveis de
αKlotho
Subsequentemente, buscou-se avaliar os níveis séricos de αKlotho de acordo com o perfil de disseminação do tumor, baseado na presença de metástases linfonodais (Figura 13). Ficou evidenciado que pacientes sem comprometimento metastático nos linfonodos apresentaram níveis de αKlotho solúvel em soro maiores do que as pacientes com sítios tumorais secundários positivos para linfonodos (p=0,03).
5.11 Pacientes com tumores ER-negativos apresentam maior risco de metástase linfonodal
42 (p=0,0054). Pacientes com tumores ER-negativos têm um risco 93,5% maior de desenvolver metástases linfonodais do que aqueles com tumores ER-positivos (RR=1,935).
K
lo
th
o
(
p
g
/m
l)
Ne ga
tiv o
Po sit
ivo 0
2 0 0 4 0 0 6 0 0 8 0 0
1 0 0 0 p = 0 ,0 3
Figura 13. Níveis séricos de αKlotho de acordo com comprometimento linfonodal. Pacientes positivas (n=8) e negativas (n=15) para metástases em linfonodos estão ilustradas na figura. A análise foi realizada com todos os pacientes que apresentaram níveis detectáveis αKlotho solúvel (n=23). Linha pontilhada representa o cut-off de 150pg/ml que determina baixa ou alta produção de αKlotho solúvel. Teste estatístico: o teste t com correção de Welch foi utilizado, resultados expressos em média ±DP. Significância estatística foi considerada em p <0,05.
Tabela 4. Correlação entre status de ER versus status linfonodal.
Status linfonodal
Positivo Negativo Total
Stat
us d
e E
R
Negativo 25 11 36
Positivo 14 25 39
Total 39 36 75
43
6 DISCUSSÃO
Esse trabalho identificou a relação entre a proteína αKlotho e o ER pela primeira vez no contexto do câncer de mama. Estudos anteriores demonstraram várias ações antitumorais de αKlotho, tais como inibição da proliferação, inibição do crescimento, indução de apoptose e autofagia (DAI et al., 2015; MENCKE; OLAUSON; HILLEBRANDS, 2017; SHU et al., 2013). Os receptores hormonais também têm sua importância estabelecida no diagnóstico, prognóstico e terapia do câncer de mama, especialmente o ERα (KARAMOUZIS et al., 2016; ROTHENBERGER; SOMASUNDARAM; STABILE, 2018). O ER , no entanto, não tem sua influência bem estabelecida no que diz respeito a tumorigênese da mama, exceto por ações antagônicas ao ERα já comprovadas, associadas a um bom prognóstico, a uma boa resposta ao tratamento e a maior sobrevida (HALDOSÉN et al., 2014; LEUNG et al., 2012; TAN et al., 2016).
Em um primeiro momento, como forma de desvendar esta relação entre os receptores de estrogênio e a expressão de αKlotho, foi realizada uma análise in vitro utilizando duas linhagens celulares de câncer de mama, a linhagem luminal MCF-7 e a linhagem triplo-negativa MDA MB-231 como controle. A expressão do gene αKlotho foi aumentada em células MCF-7 após a estimulação com E2 e DPN, sendo que o DPN, um agonista específico de ER , foi mais eficiente em induzir a produção de αKlotho, o que reforça a tese de um perfil antitumoral por parte deste receptor em células luminais. Esta interação foi observada também em um estudo com neurônios do hipocampo de ratos ooforectomizados, que evidenciou o aumento na expressão do gene αKlotho após tratamento sistêmico com DPN nestes animais, gerando um ambiente de neuroproteção (SÁRVÁRI et al., 2016). Por sua vez, a expressão de αKlotho em células MDA MB-231 não sofreu alteração após incubação com os agonistas.
44 uma vez que é forte inibidor de sua via de sinalização, a IGF-1/insulina (BLOCH et al., 2009). A condição do meio de cultura utilizado nos ensaios do presente estudo, em que foi realizada a depleção hormonal, pode então ter afetado a liberação de αKlotho da membrana das células (CHEN, C. D. et al., 2007).
Demonstrado que a ativação de ER aumenta a expressão de αKlotho em células MCF-7, o real perfil deste receptor para a proliferação e disseminação das células luminais de câncer de mama foi avaliado. Inicialmente foram realizados ensaios de proliferação em células MCF-7 após a ativação dos ER. Foi evidenciado que apesar de não gerar um efeito antiproliferativo direto, o agonismo de ER foi capaz de diminuir a proliferação causada por E2, agonista ambíguo. Esses achados evidenciam uma possível ação antagônica do ER , mostrando a capacidade em inibir efeitos pró-tumorais gerados por ERα, fato já demonstrado por diversos estudos (HARTMAN; STRÖM; GUSTAFSSON, 2009; LEUNG et al., 2012; OMOTO; IWASE, 2015). Além disso, no ciclo celular, foi observado um acúmulo de células na fase G1 e diminuição na fase G2/M após ativação do ER . Estes achados, somados ao aumento na expressão da proteína p21, regulador de transição de fase G1/S (KARIMIAN; AHMADI; YOUSEFI, 2016), confirma o perfil antiproliferativo do ER .
De forma semelhante ao ER , αKlotho tem ações antiproliferativas em vários tipos de tumores. A superexpressão de αKlotho em linhagem celular de câncer de pulmão levou ao acúmulo de células nas fases G0/G1 do ciclo celular, mostrando uma tendência decrescente de células em G2/M (WANG; CHEN et al., 2011). No câncer gástrico, por outro lado, a superexpressão de αKlotho levou à inibição do crescimento com expressão aumentada de p21 (WANG; WANG et al., 2011). O aumento da isoforma Klotho, da mesma forma, levou à parada do ciclo celular na fase G1, resultando em um efeito antiproliferativo no hepatocarcinoma (YE et al., 2013).
45 (CHRISTOPOULOS; MSAOUEL; KOUTSILIERIS, 2015; DUPONT, 2001; EKYALONGO; YEE, 2017).
Sabe-se que o processo de EMT leva a alterações morfológicas que facilitam a geração de células-tronco cancerígenas (CSC), com características mesenquimais e auto renováveis que favorecem a disseminação e o estabelecimento de sítios tumorais secundários (HOLLIER; EVANS; MANI, 2009; REIMAN; KNUTSON; RADISKY, 2010; WANG, YIFAN; ZHOU, 2011). Estudos recentes mostram que a indução da EMT pela via do TGF- aumenta a capacidade das células do câncer de se espalharem pelo sistema linfático (KARLSSON et al., 2017; PANG et al., 2016). Além disso, Markiewicz et al (2014) mostraram que as células metastáticas linfonodais apresentam maior expressão de TWIST1, SNAIL1 e SNAIL2 do que células primárias de tumores de mama. Para verificar se o agonismo de ER está ligado à EMT, marcadores relacionados com este evento foram avaliados após a ativação do ER em MCF-7. A exposição de células MCF-7 ao DPN diminuiu a expressão gênica dos fatores de transcrição SNAIL, TWIST1 e vimentina, evidenciando a supressão da EMT e ações compatíveis com a promoção do evento contrário, denominado de transição mesênquima-epitelial (MET), o que expõe um perfil protetor do ER contra a disseminação para sítios tumororais secundários. Estudos prévios com células MCF-7 já haviam demonstrado a regulação de fatores relacionados à EMT por parte do ER (MAK et al., 2013; VOUTSADAKIS, 2016). Similarmente a este, αKlotho possui atividade anti-EMT por inibição das vias TGF- 1, IGF-1 e Wnt, com diminuição da expressão a jusante de marcadores de EMT, como E-caderina, SNAIL 1 e 2, e vimentina em vários tipos de câncer, como renal, pulmonar, ovário e colo uterino (CHANG, B. et al., 2012; CHEN, B. et al., 2010; DOI et al., 2011; LANDOLT et al., 2017; LIU et al., 2007; LOJKIN et al., 2015).
Na segunda etapa do estudo, buscou-se confirmar a relação de αKlotho com contextos clínicos de melhor prognóstico por meio da pesquisa de sua forma solúvel no soro de pacientes com câncer de mama, bem como verificar se os achados evidenciados em cultura celular, no que tange a relação com o ER , se mostram verdadeiros também em amostras humanas.
46 al., 2012; DALTON et al., 2017; IMURA et al., 2004; XIAO et al., 2004; XUAN, N. T.; HAI, 2018).
Na análise que toma por base o estágio tumoral em inicial ou avançado, o grupo de pacientes que apresentavam tumores da mama em estágio inicial mostravam níveis maiores de αKlotho solúvel sérico em comparação com o grupo das pacientes com tumores avançados. Estes mesmos resultados foram encontrados em estudos de carcinoma hepatocelular e carcinoma renal de células claras, onde pacientes em estágios tumorais mais avançados apresentaram uma menor concentração de αKlotho em comparação com os estágios iniciais do tumor (KIM, J. H. et al., 2016; TANG, X. et al., 2016). No câncer de mama, o gene αKlotho tende a ser hipermetilado durante a transformação maligna, o que inibe sua expressão, fazendo com que esta proteína seja mais abundante em tecidos mamários normais (LIGUMSKY et al., 2015; RUBINEK, TAMI et al., 2012). Este evento é explicado pelo fato de αKlotho mostrar potente inibição de vias importantes na carcinogênese, levando a diminuição do crescimento e da progressão tumoral. Com isso, o silenciamento de αKlotho, funciona como uma manobra de resistência por parte das células tumorais (LIU et al., 2007; WOLF et al., 2008).
47 de αKlotho solúvel encontrados nas pacientes com tumores ER-positivos podem não ser produto exclusivamente do ERα, mas também da presença de ER , o que estaria em acordo com os resultados encontrados na linhagem MCF-7 para a expressão de αKlotho após ativação deste receptor. Contudo, esta afirmação não poder feita com base apenas nestes dados, uma vez que não foi realizada marcação do ER nos laudos disponíveis no sistema hospitalar.
Os tumores ER-positivos são classificados em luminais, de acordo com o subtipo molecular, sendo considerados subtipos de bom prognóstico e melhor resposta terapêutica (KIM, H.-S. et al., 2012; YERSAL; BARUTCA, 2014). Na comparação dos níveis séricos de αKlotho entre os subtipos moleculares dos tumores das pacientes em estudo, observou-se que em pacientes com tumores luminais foram detectados maiores níveis de αKlotho solúvel na comparação com as pacientes que possuíam tumores triplo-negativos. Corroborando, assim, com os dados de cultura celular, em que a linhagem luminal mostrou aumento da expressão desta proteína enquanto que a expressão na linhagem triplo-negativa não foi alterada, o que confirma também a importância dos receptores hormonais neste contexto, especialmente o ER .
Para verificar o perfil de proliferação tumoral nas pacientes de acordo com os níveis de αKlotho solúvel, foi utilizado o marcador imuno-histoquímico de proliferação Ki67. Pacientes com ausência de αKlotho sérico no soro apresentaram tumores com maiores taxas de Ki67 em comparação com pacientes positivos para esta proteína, independentemente do nível de produção. Wolf et al. (2008) relataram anteriormente essa relação entre a expressão de αKlotho com baixas taxas de Ki67 em células de tumor de mama. O mesmo fato foi evidenciado no linfoma de células B, no qual a superexpressão de αKlotho em camundongos xenoenxertados levou a uma diminuição na taxa de Ki67 (ZHOU, XIANGXIANG et al., 2017). Estes resultados confirmam o perfil antiproliferativo de αKlotho, resultado de mecanismos inibitórios de vias de sinalização proliferativas já descritas anteriormente.