UNIVERSIDADE FEDERAL DA PARAÍBA CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUTOS NATURAIS E SINTÉTICOS BIOATIVOS
HELOÍSA MARA BATISTA FERNANDES
CONSTITUINTES QUÍMICOS E AVALIAÇÃO DE ATIVIDADES
BIOLÓGICAS DE
Croton polyandrus
SPRENG.
(EUPHORBIACEAE)
João Pessoa – PB
HELOÍSA MARA BATISTA FERNANDES
CONSTITUINTES QUÍMICOS E AVALIAÇÃO DE ATIVIDADES
BIOLÓGICAS DE
Croton polyandrus
SPRENG.
(EUPHORBIACEAE)
Dissertação apresentada ao Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos do Centro de Ciências da Saúde da Universidade Federal da Paraíba, em cumprimento às exigências para obtenção do título de Mestre em Farmacoquímica de Produtos Naturais e Sintéticos Bioativos.
ORIENTADOR: Prof. Dr. Josean Fechine Tavares
F363c Fernandes, Heloísa Mara Batista.
Constituintes químicos e avaliação de atividades biológicas de Croton polyandrus Spreng. (Euphorbiaceae) / Heloísa Mara Batista Fernandes.- -João Pessoa, 2012.
157f. : il.
Orientador: Josean Fechine Tavares Dissertação (Mestrado) – UFPB/CCS
1. Produtos Naturais. 2.Euphorbiacea. 3.Croton polyandrus.
HELOÍSA MARA BATISTA FERNANDES
CONSTITUINTES QUÍMICOS E AVALIAÇÃO DE ATIVIDADES
BIOLÓGICAS DE
Croton polyandrus
SPRENG.
(EUPHORBIACEAE)
COMISSÃO EXAMINADORA
____________________________________________ Prof. Dr. Josean Fechine Tavares
Doutor em Farmacoquímica de Produtos Naturais e Sintéticos Bioativos Universidade Federal da Paraíba – Campus I
(Orientador)
____________________________________________ Prof. Dr. José Galberto Martins da Costa
Doutor em Química
Universidade Regional do Cariri (URCA) (Examinador Externo)
____________________________________________ Profa. Dra. Celidarque da Silva Dias
Doutora em Farmacoquímica de Produtos Naturais e Sintéticos Bioativos Universidade Federal da Paraíba – Campus I
“Não vos conformeis com este mundo, mas tansformai-vos, renovando vossa maneira de pensar e julgar, para que possais distinguir o que é da vontade de Deus, a saber, o que é bom, o
que lhe agrada, o que é perfeito.”
6
AGRADECIMENTOS
Primeiramente agradeço a DEUS, por ter me dado a chance de encontrar pessoas especiais na minha caminhada, sem as quais certamente não teria dado conta desta missão que Ele me confiou. Quero agradecer pelos dons da coragem, força e determinação, por ser meu amparo e refúgio, pela proteção constante. Obrigada Senhor!
Este foi apenas o começo de muitos outros projetos ainda em construção, e é preciso saber reconhecer que sozinhos não conseguiríamos nada...
Quero agradecer aos meus pais, Aloisio Fernandes Beserra e Joséhilda Gomes Batista Fernandes, por todo o amor, o carinho, a preocupação que sempre dedicam a mim. Pelos esforços (e eu sei que foram muitos) e noites mal dormidas em favor de minha educação, por tantas renúncias que fizeram e fazem por mim até hoje e, que me permitiram chegar até aqui. Por sempre compreender minha ausência e minhas curtas visitas em casa, mas que acabam sendo gratificadas com um resultado final como este. Saibam que esta vitória é NOSSA. Obrigada pelo amor incondicional! Que estas palavras sejam a expressão da minha gratidão por tudo que lhes devo. Amo muito vocês.
Ao meu irmão, Héllisson e meu sobrinho-irmão, o pequenininho de Titia, Pedro Henrique, pelo sentimento de afeto e carinho, cada sorriso dado foi fundamental para me fortalecer meus dias aqui. Vocês são meu alicerce e refúgio. Amo vocês.
Ao meu namorado, Abrahão Filho (Filhinho), por ter me apoiado em todas as minhas decisões. Pelo companheirismo e paciência, por ser “meu orientador particular”, quero dizer que é um prazer dividir minhas conquistas com você, nós que estamos evoluindo juntos.Com certeza sem ter você ao meu lado, eu não estaria concluindo este trabalho.
Aos meus avós, tios, tias, primos e primas, especialmente Tia Tetê, Tia Ilma e Tia Aiapor sempre ter me incentivado na minha carreira profissional, por me colocar sempre nas suas orações. Obrigada pela força!
Ao Prof. Dr. Josean Fechine Tavares, orientador desta dissertação, por todo empenho, sabedoria, compreensão e, acima de tudo, exigência. Pela oportunidade e confiança, pelos ensinamentos e desafios propostos. Muito Obrigada.
pela contribuição ao longo desta caminhada, por tantos trabalhos que fizemos juntos, você tem contribuído muito na minha formação. A professora Dra. Edeltrudes de Oliveira Lima pela disponibilidade em contribuir com meu trabalho.
A toda equipe do Laboratório de Farmacologia e Divisão de Toxicologia do CPQBA pela contribuição dos testes antitumorais, aos professores Dr. João Ernesto de Carvalho e Dra. Ana Lúcia T. G. Ruiz, e a Divisão de Fitoquímica do CPQBA pela parceria na
identificação do óleo essencial em nome da professora Dra. Mary Ann Foglio. Conheci
pessoas maravilhosas o tempo que passei na UNICAMP que muito contribuíram para meu amadurecimento pessoal e profissional.
A minha equipe de origem, EQUIPE SOBRAL: Anne Dayse (por dividir comigo não
só um mestrado, mas experiências que eu vou guardar comigo sempre), Susyanne (por ser
muitas vezes minha mãe na bancada), Manso e Vicente (por tantos conselhos, e estarem
dispostos a sempre me ajudar), Sócrates (por tanto contribuir com este trabalho), Isis (tantos
conselhos e experiências divididos), Hellane (pelas brincadeiras e ensinamentos), Sara
(incentivos diversos), Karine (mesmo não estando no momento no laboratório tenho-a
sempre como amiga), Carol, Ania, Paula (por me manter calma), Camila, Tainá, Steno,
Camila Carioca, Denise, Sandro e Cínthia, as alunas de iniciação científica (desejo que
vocês trilhem caminhos de sucesso): Amanda, Andreza, Rayana. Vocês foram fundamentais
para o desenvolvimento deste trabalho, o sentimento de afeto e amizade foram os que me
permitiram passar finais de semana eluindo pacientemente placas analíticas, reabrindo as colunas cromatográficas após memorandos e regras de difícil compreensão, coletando mais uma fração mesmo com o cansaço e, após críticas injustas. Se os desafios foram grandes, a motivação vinda de vocês foi ainda maior. Foi um grande desafio desenvolver este trabalho, mas vocês me permitiram torna-lo agradável.
A Vivianne que nunca me negou uma ajuda ou uma palavra de conforto, mesmo quando eu ligava várias vezes, com toda a minha insegurança, para discutir os mesmos resultados. Por ter me ensinado tanta coisa na minha iniciação científica. Obrigada pelo companheirismo, carinho e amizade. Desejo-a todo sucesso deste mundo.
As minhas co-orientadoras diretas Ana Silvia “Barbosa” e Jacqueline “Chaves”, que sempre estiveram ao meu lado nos momentos mais felizes e, mais tortuosos também, por todos os ensinamentos na bancada, pela amizade e por tantas experiências vividas.
(xuxu, por tantos conselhos e coisas novas que tive a oportunidade de aprender e dividir com você, pela torcida para que tudo desse certo), Daysianne (por ter sido a primeira pessoa a me inserir no LTF, por tentar me guiar sempre pelos caminhos do bem no laboratório), Fábio (personalidade ilustre que tive o prazer de conhecer, de absorver tanto conhecimento), Gabi (que mesmo distante teve uma contribuição imensa, que me ensinou em como me portar quando cheguei no laboratório, por ter se responsabilizado por mim, pela confiança).
Ao LABETOX, por estar me recebendo de braços abertos, pelas contribuição neste trabalho, pelo incentivo e pelos laços de amizade: Déborah (pessoa maravilhosa que tive o prazer de conhecer melhor depois de tantas experiências enriquecedoras juntas...), João, Aline, Renata, Tatis (Mota e Quelvia). Obrigada por me acolher de forma tão carinhosa.
Aos amigos de laboratório: Rafaela, Madalena, Èlida, Roosevelt, Wemerson, pela amizade, companheirismo, ensinamentos, ajuda, apoio e dedicação.
A minha turma de graduação pelos laços de amizade e incentivo profissional: Anny Paloma, Diogo, Fernanda, Flávia, Naty, Jouley (a pseudo-farmaceutica-dentista).
Aos meus amigos da equipe extra-curricular: Maria do Carmo, Ana Silvia e Lázaro Robson.
A minha turma de mestrado por tantos momentos desafiadores juntos, agradeço pelas experiências compartilhadas.
Aos professores desta Pós-Graduação pela disponibilidade, ensinamentos partilhados e contribuição profissional.
A todos os técnicos de laboratório, em especial, a Nonato e Wellington pela enorme ajuda nos experimentos, bem como, pela amizade, excelente convivência e por serem um exemplo de funcionários públicos. As secretárias do curso de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos e a todos os seguranças e funcionários da limpeza e da manuntenção por estarem sempre presentes e dispostos a ajudar.
A coordenação do Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos por toda disponibilidade e atenção durante esses dois anos de mestrado, por estar sempre lutando para torna-lo melhor.
Há muito mais a quem agradecer... A todos aqueles que, embora não nomeados, me brindaram com seus inestimáveis apoios em distintos momentos, o meu reconhecido e carinhoso muito obrigada!
RESUMO
FERNANDES, Heloísa Mara Batista. Constituintes químicos e avaliação de atividades biológicas de Croton polyandrus Spreng. (Euphorbiaceae) 157 p. Dissertação (Mestrado
em Produtos Naturais e Sintéticos Bioativos) – Centro de Ciências da Saúde, Universidade Federal da Paraíba, João Pessoa, 2012.
A família Euphorbiaceae é a sexta maior família em número de espécies vegetais identificadas no mundo representada por 300 gêneros e 8000 espécies. Dentre os inúmeros gêneros que compõe esta família, o gênero Croton se destaca como o segundo maior, com cerca de 1300 espécies, possuindo
uma distribuição neotropical. Esse gênero tem sido um dos mais estudados, em grande parte devido aos compostos químicos produzidos por este grupo. Visando contribuir para o estudo quimiotaxonômico da família Euphorbiaceae e do gênero Croton, o extrato de C. polyandrus foi
submetido a um estudo fitoquímico para isolar seus constituintes químicos, através de métodos cromatográficos usuais, e depois para identificá-los por meio de métodos espectroscópicos, tais como Infravermelho, Ressonância Magnética Nuclear de 1H e 13C uni e bidimensionais e espectométricos, como espectometria de massas, além de comparação com dados da literatura. O estudo químico das folhas e raiz de C. polyandrus resultou na identificação de nove substâncias:
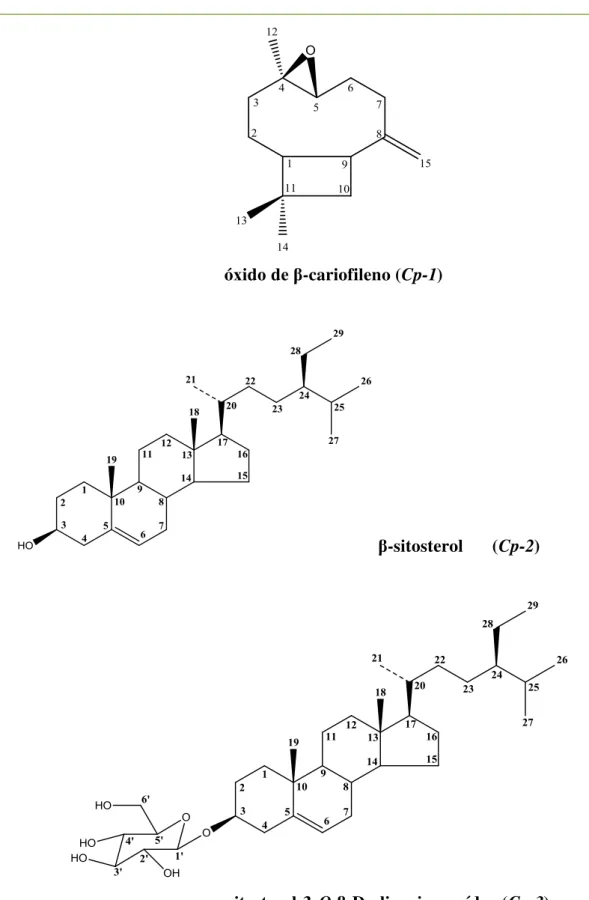
óxido de -cariofileno (Cp-1); -sitosterol (Cp-2); sitosterol-3-O- -D-glicopiranosídeo (Cp-3);
feofitina A (Cp-4); carvacrol (Cp-5); 5- -hidroxi-2-oxo-p-ment-6(1)-eno (Cp-6);
4-hidroxi-3-metoxi-benzaldeído (Cp-7); 1,2,3,4-tetrahidroxi-p-mentano (Cp-8); sacarose (Cp-9), sendo as nove
relatadas pela primeira vez na espécie. A composição química do óleo essencial apresentou trinta e três componentes, dentre os quais, p-cimeno (12.4%), mostrou-se como composto majoritário. O
óleo essencial de C. polyandrus foi testado frente cepas de bactérias gram positivas e gram
negativas, cepas de fungos do gênero Candida, e linhagens de células tumorais. O óleo essencial de C. polyandrus testado não mostrou qualquer atividade antibacteriana, no entanto, apresentou uma
considerável atividade antifúngica e efeito citotóxico para todas as linhagens celulares apenas na maior concentração testada, ao utilizar os valores de TGI, o óleo essencial se mostrou inativo frente as linhagens celulares tumorais.
ABSTRACT
FERNANDES, Heloísa Mara Batista. Chemical constituents and avaliable biological activities of Croton polyandrus Spreng. (Euphorbiaceae) 157 p. Dissertação (Mestrado em
Produtos Naturais e Sintéticos Bioativos) – Centro de Ciências da Saúde, Universidade Federal da Paraíba, João Pessoa, 2012.
The family Euphorbiaceae is the sixth largest family of plants in the world represented by 300 genera and 8000 species. Among the many genres that make up this family, the genus Croton stands as the second largest, with about 1300 species, having a neotropical distribution. This genus has been the most studied, due in large part to the chemical compounds produced by this promising group. To contribute to the chemotaxonomic study of the genus Croton and
family Euphorbiaceae, the extract of C. polyandrus was subjected to a phytochemical study to
isolate chemical constituents through usual chromatographic methods, and then to identify them by means of spectroscopic methods, such as IR, 1H-NMR and 13C and uni-dimensional, spectometryc such as spectrometry mass, and compared with literature data. The chemical study of the aerial parts and roots of C. polyandrus resulted in the identification of nine
substances: oxide -caryophyllene (Cp-1), -sitosterol (Cp-2), sitosterol-3-O-
-D-glucopyranoside (Cp-3); pheophytin A (Cp-4); Carvacrol (Cp-5), 5-
-hydroxy-2-oxo-p-ment-6 (1)-ene (Cp-6), 3-methoxy-4-hydroxy-benzaldehyde (Cp-7), 1,2,3,4-tetrahidroxi-p-mentano
(Cp-8); Sucrose (Cp-9), being the nine first reported in this species. The chemical
composition of essential oil had thirty-three components, among which p-cymene (12.4%) showed a major compound with. The essential oil of C. polyandrus were tested against strains of gram positive and gram negative strains of Candida, and cancer cell lines. The essential oil of C. polyandrus tested showed no antibacterial activity, however, showed considerable antifungal and cytotoxic to all cell lines only at the highest concentration tested, using the values of TGI, the essential oil was inactive against the tumor cell lines.
Keywords: Euphorbiaceae, Croton polyandrus, essential oil, antimicrobial activity, antitumor
Figura 1. Placa T0. A primeira coluna preta representa o controle do meio de cultura (branco do meio, contendo apenas meio com soro fetal bovino). Cada coluna colorida corresponde a uma linhagem em sua densidade de inoculação... 57 Figura 2. Placa teste. A primeira coluna cinza representa o controle do meio de cultura
(branco do meio). A segunda coluna cinza-escura representa o controle de células tumorais. As cores claras indicam as substancias-teste, e as cores escuras respectivas o controle das substancias-teste (branco da amostra) nas concentrações de 250; 25; 2,5 e 0,25 g/mL... 58 Figura 3. Cromatograma da fração 15-22 do extrato hexânico das folhas de Croton
polyandrus... 63
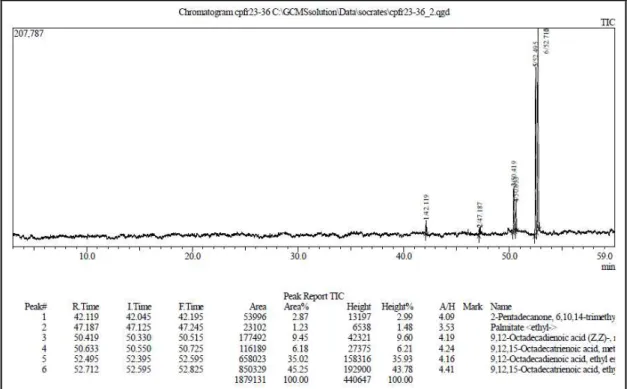
Figura 4. Cromatograma da fração 23-36 do extrato hexânico das folhas de Croton polyandrus... 64
Figura 5. Espectro de RMN de 13C-APT (125 MHz) de Cp-1em CDCl3... 68 Figura 6. Expansão do espectro de RMN de 13C-APT (125 MHz) de Cp-1em CDCl3.... 69 Figura 7. Espectro de RMN 1H (500 MHz) de Cp-1 em CDCl3... 70 Figura 8. Expansão do espectro de RMN 1H (500 MHz) de Cp-1 em CDCl3... 71 Figura 9. Espectro de correlação RMN 1H x 13C-HMQC (500 e 125 MHz) de Cp-1 em
CDCl3... 72 Figura 10. Espectro de correlação RMN 1H x 13C-HMBC (500 e 125 MHz) de Cp-1 em
CDCl3... 73 Figura 11. Expansão do espectro de correlação RMN 1H x 13C-HMBC (500 e 125 MHz)
de Cp-1 em CDCl3... 74 Figura 12. Expansão do espectro de correlação RMN 1H x 13C-HMBC (500 e 125 MHz)
de Cp-1 em CDCl3 na região de 50 a 15 ppm... 75 Figura 13. Expansão do espectro de correlação RMN 1H x 13C-HMBC (500 e 125 MHz)
de Cp-1 em CDCl3 na região de 32 a 27 ppm... 76 Figura 14. Expansão do espectro de correlação RMN 1H x 1H COSY (500 e 125 MHz)
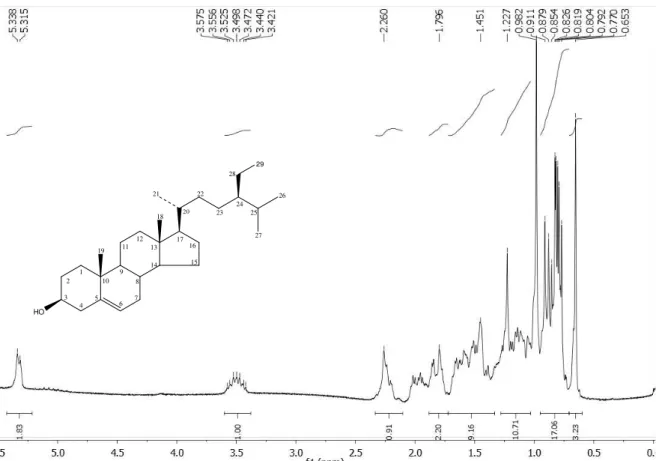
de Cp-1 em CDCl3 na região de 2,8 a 1,0 ppm... 77 Figura 15. Expansão do espectro de RMN 1H (CDCl3, 200 MHz) de Cp-2 na região de
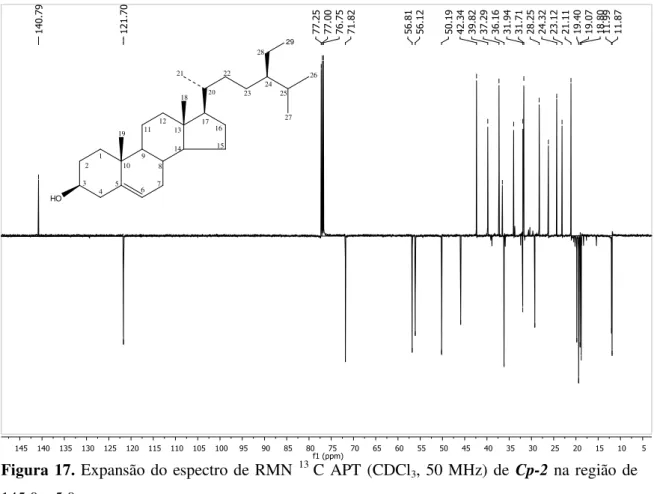
Figura 17. Expansão do espectro de RMN 13C (CDCl3, 50 MHz) de Cp-2 na região de 145,0 – 5,0 ppm... 81 Figura 18. Expansão do espectro de RMN 13C (CDCl3, 50 MHz) de Cp-2 na região de
58,0 – 10,0 ppm... 81 Figura 19. Espectro de RMN de 1H de Cp-3 (C5D5N, 500
MHz)... 85 Figura 20. Expansão do espectro de RMN de 1H de Cp-3 na região de 5,5 a 3,8 ppm
(C5D5N), 500 MHz)Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de
Cp-3 na região de 6,60-5,50
ppm... 86 Figura 21. Figura 22. Figura 23. Figura 24. Figura 25.
Espectro de RMN de 13C APT de Cp-3(C5D5N, 125 MHz)... Expansão do espectro de RMN de 13C de Cp-3 na região de 154 a 101 ppm
(CDCl3, 125 MHz)...
Expansão do espectro de RMN de 13C de Cp-3 na região de 80 a 45 ppm
(CDCl3, 125 MHz)... Expansão do espectro de RMN de 13C de Cp-3 na região de 44 a 10 ppm
(CDCl3, 125 MHz)... Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cp-4 na região de 9,96-7,8 ppm... 87 88 89 90 94 Figura 26. Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cp-4 na região de
6,6 -5,5 ppm... 95 Figura 27. Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cp-4 na região de
3,9 -3,0 ppm... 95 Figura 28. Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cp-4 na região de
4,6 -3,0 ppm... 96 Figura 29. Expansão do espectro de RMN 13C APT (CDCl3, 125 MHz) de Cp-4 na
região de 200,0 – 0,10 ppm... 96 Figura 30. Expansão do espectro de RMN 13C APT (CDCl3, 125 MHz) de Cp-4 na
região de 195,0 – 125,0 ppm... 97 Figura 31. Expansão do espectro de RMN 13C APT (CDCl3, 125 MHz) de Cp-4 na
região de 121,0 – 88,0 ppm... 97 Figura 32. Expansão do espectro de RMN 13C APT (CDCl3, 125 MHz) de Cp-4 na
Figura 33. Espectro de RMN 13C APT (CDCl3, 50 MHz) de Cp-5 na região de 200,0 – 0,0 ppm... 101 Figura 34. Figura 35. Figura 36.
Expansão do espectro de RMN 13C APT (CDCl3, 50 MHz) de Cp-5 na região de 162,0 – 2,0 ppm...
Expansão do espectro de RMN 13C APT (CDCl3, 50 MHz) de Cp-5 na região de 105,0 – 5,0 ppm...
Expansão do espectro de RMN 1H (CDCl3, 200 MHz) de Cp-5 na região de 5,0 – 0,0 ppm...
101 102
102
Figura 37. Expansão do espectro de RMN 1H (CDCl3, 200 MHz) de Cp-5 na região de 8,8- 4,2 ppm... 103 Figura 38. Espectro de Infravermelho em pastilhas de KBr de Cp-6... 107
Figura 39. Espectro de RMN 13C APT (CDCl3, 50 MHz) de Cp-6 na região de 210,0 – 0,0 ppm... 107 Figura 40.
Figura 41.
Figura 42.
Expansão do espectro de RMN 13C APT(CDCl3, 50 MHz) de Cp-6na região de 65,0 – 12,0 ppm...
Espectro de RMN 1H (CDCl3, 200 MHz) de Cp-6 na região de 10,0 – 0,0 ppm...
Expansão do espectro de RMN 1H (CDCl3, 200 MHz) de Cp-6 na região de 1,3 – 0,7 ppm...
108 108
109
Figura 43. Expansão do espectro de RMN 1H (CDCl3, 200 MHz) de Cp-6 na região de 6,9 – 4,1 ppm... 109 Figura 44. Expansão do espectro de RMN 1H (CDCl3, 200 MHz) de Cp-6 na região de
2,8 – 2,2 ppm... 110
Figura 45. Espectro de RMN 13C APT (CDCl3, 125 MHz) de Cp-7 na região de 200,0 – 10,0 ppm... 113 Figura 46. Espectro de RMN 1H (CDCl3, 500 MHz) de Cp-7 na região de 10,5 – 0,5
ppm... 113 Figura 47. Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cp-7 na região de
7,40 – 6,96 ppm... 114 Figura 48. Espectro de Infravermelho em pastilhas de KBr de Cp-8 ... 118
Figura 50. Expansão do espectro de RMN 13C (CDCl3, 125 MHz) de Cp-8 na região de 115,0 – 65,0 ppm... 119 Figura 51. Expansão do espectro de RMN 13C (CDCl3, 125 MHz) de Cp-8 na região de
44,0 – 11,0 ppm... 119 Figura 52. Espectro de RMN 1H (CDCl3, 500 MHz) de Cp-8 na região de 10,0 – 0,0
ppm... 120 Figura 53. Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cp-8 na região de
0,985 – 0,950 ppm... 120 Figura 54. Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cp-8 na região de
2,40 – 1,10 ppm... 121 Figura 55. Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cp-8 na região de
2,41 – 2,27 ppm... 121 Figura 56. Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cp-8 na região de
3,84 – 3,40 ppm... 122 Figura 57. Espectro HMQC (CDCl3, 500 e 125 MHz) de Cp-8... 122 Figura 58. Expansão do espectro HMQC (CDCl3, 500 e 125 MHz) de Cp-8 na região
de (90-10 ppm) x (4,0-0,6 ppm)... 123 Figura 59. Expansão do espectro HMQC (CDCl3, 500 e 125 MHz) de Cp-8 na região
de (80-25 ppm) x (4,2-0,2 ppm)... 123 Figura 60. Expansão do espectro HMQC (CDCl3, 500 e 125 MHz) de Cp-8 na região de
(40-14 ppm) x (2,4-0,6 ppm)... 124 Figura 61. Espectro HMBC (CDCl3, 500 e 125 MHz) de Cp-8 na região de (180,0 - 0,0
ppm) x (7,0-0,0 ppm)... 124 Figura 62. Expansão do espectro HMBC (CDCl3, 500 e 125 MHz) de Cp-8 na região de
180,0 - 10,0 ppm) x (4,2-0,6 ppm)... 125 Figura 63. Expansão do espectro HMBC (CDCl3, 500 e 125 MHz) de Cp-8 na região de
(120,0 - 20,0 ppm) x (2,5-0,6 ppm)... 125 Figura 64. Espectro de COSY (CDCl3, 500 MHz) de Cp-8 na região de (11,0- 0,5 ppm)
x (11,0- 0,5 ppm)... 126 Figura 65. Expansão do espectro de COSY (CDCl3, 500 MHz) de Cp-8 na região de
(2,0- 0,9 ppm) x (2,0- 0,9 ppm)... 127 Figura 66. Expansão do espectro de COSY (CDCl3, 500 MHz) de Cp-8 na região de
Figura 67. Expansão do espectro de NOESY (CDCl3, 500 MHz) de Cp-8... 128
Figura 68. Espectro de RMN de 13C de Cp-9 na região de 190,0 – 0,0 ppm (DMSO, 50
MHz)... 131 Figura 69. Expansão do espectro de RMN de 13C de Cp-9 na região de 105,0 – 60,0
ppm (DMSO, 50 MHz)... 131 Figura 70. Espectro de RMN de 1H de Cp-9 na região de 8,0 – 0,5 ppm (DMSO, 200
MHz)... 132 Figura 71. Expansão do espectro de RMN de 1H de Cp-9 na região de 4,0– 2,4 ppm
(DMSO, 200 MHz)... 132 Figura 72. Expansão do espectro de RMN de 1H de Cp-9 na região de 5,3 – 4,2 ppm
(DMSO, 200 MHz)... 133 Figura 73. Gráfico da atividade antitumoral do óleo essencial das folhas de Croton
polyandrus em cultura de células tumorais humanas, relacionando
LISTA DE TABELAS
Tabela 1. Método utilizado para o processamento cromatográfico do extrato
hexânico das folhas de Croton polyandrus... 44
Tabela 2. Reunião das frações do extrato hexânico das folhas de Croton polyandrus
após monitoramento em CCDA... 44 Tabela 3. Fracionamento cromatográfico do extrato diclorometano das folhas de
Croton polyandrus... 45
Tabela 4. Sistemas de eluições utilizados no processamento cromatográfico do extrato diclorometano das folhas de Croton polyandrus, frações coletadas
para cada sistema de eluição e grupos de frações obtidos após análise em
CCDA... 46 Tabela 5. Método utilizado para o processamento cromatográfico do extrato acetato
de etila das folhas de Croton polyandrus... 48
Tabela 6. Reunião das frações do extrato acetato de etila das folhas de Croton
polyandrus após monitoramento em CCDA... 48
Tabela 7. Fracionamento cromatográfico do extrato metanólico das raízes de Croton
polyandrus... 52
Tabela 8. Sistemas de eluições utilizados no processamento cromatográfico do extrato metanólico das raízes de Croton polyandrus, frações coletadas
para cada sistema de eluição e grupos de frações obtidos após análise em
CCDA... 53 Tabela 9. Densidade de inoculação das linhagens celulares nos ensaios de
atividade antitumoral...... 56
Tabela 10. Estrutura química dos constituintes isolados de Croton polyandrus... 61
Tabela 11. Deslocamentos químicos comparativos, tipos de sinal e constantes de acoplamento Cp-1, verificados nos espectros de RMN 1H e 13C 1D e 2D
(500 MHz) em CDCl3 com modelo 1 (óxido de -cariofileno)
(NUNOMURA et al., 2012)... 67 Tabela 12. Deslocamentos químicos comparativos, tipos de sinais para os átomos
de carbono e hidrogênio de Cp-2, verificados nos espectros de RMN 1H
e 13C (200 e 50 MHz, respectivamente) em CDCl3 com os deslocamentos químicos dos carbonos (δC) apresentados por Tomaz
(2008) para a mesma substância em CDCl3... 79 Tabela 13. Deslocamentos químicos comparativos, tipos de sinais para os átomos
de carbono e hidrogênio de Cp-3, verificados nos espectros de RMN 1H
e 13C (500 e 125 MHz, respectivamente) em C5D5N com os
deslocamentos químicos dos carbonos (δC) da literatura (KOJIMA et
Tabela 14. Deslocamentos químicos comparativos, tipos de sinais para os átomos de carbono e hidrogênio de Cp-4, verificados nos espectros de RMN 1H
e 13C (500 e 125 MHz, respectivamente) em CDCl3 com os deslocamentos químicos dos carbonos (δC) de Lm- 3 apresentados por
Medeiros (2012) para a mesma substância em CDCl3... 93 Tabela 15. Deslocamentos químicos comparativos, tipos de sinal e constantes de
acoplamento Cp-5 verificados nos espectros de RMN 1H e 13C (200 e
50 MHz, respectivamente) em CDCl3 com modelo carvacrol (5-isopropil-2-metil-fenol) (ROMERO et al., 2009)...
100
Tabela 16. Deslocamentos químicos comparativos, tipos de sinal e constantes de acoplamento Cp- 6, verificados nos espectros de RMN 1H e 13C (200 e
50 MHz, respectivamente) com modelo 9 (5-
-hidroxi-2-oxo-p-ment-6(1)-eno) (LIU, et al., 2005) em CDCl3... 106 Tabela 17. Deslocamentos químicos comparativos, tipos de sinal e constantes de
acoplamento Cp-7 verificados nos espectros de RMN 1H e 13C (500 e
125 MHz, respectivamente) em CDCl3 com modelo Ab-13
(4-hidroxi-3-hidroxi-benzaldeído) (FRANÇA, 2003)... 112 Tabela 18. Deslocamentos químicos, tipos de sinal e constantes de acoplamento
Cp-8, verificados nos espectros de RMN 1H e 13C 1D e 2D (500 e 125
MHz) em CDCl3... 117 Tabela 19. Deslocamentos químicos, tipos de sinal e constantes de acoplamento
Cp-9, verificados nos espectros de RMN 1H e 13C (200 e 50 MHz,
respectivamente) em DMSO em comparação com os dados de RMN de 13C da literatura de 1 (δ
C) (DMSO) (OLIVEIRA, et al., β007) (δ em
ppm e J em Hz)... 130
Tabela 20. Composição química do óleo essencial de Croton polyandrus... 134
Tabela 21. Atividade antifúngica do óleo essencial de Croton polyandrus... 136
Tabela 22. Valores de TGI (inibição de crescimento total) do óleo essencial de
LISTA DE QUADROS
Quadro 1. Constituintes químicos isolados das raízes de Croton polyandrus... 33
Quadro 2. Estrutura química de substâncias isoladas de espécies de Croton... 34
Quadro 3. Perfil Fitoquímico do gênero Croton... 35
LISTA DE FLUXOGRAMAS
Fluxograma 1. Etapas envolvidas no processo de obtenção e fracionamento dos extratos das folhas e raízes de Croton polyandrus... 42
Fluxograma 2. Fracionamento cromatográfico da fração 31 do extrato diclorometano das folhas de Croton polyandrus... ...
47
Fluxograma 3. Fracionamento cromatográfico da fração 31-32 do extrato acetato de etila das folhas de Croton polyandrus... 49
Fluxograma 4. Fracionamento cromatográfico da fração 63-83 do extrato acetato de etila das folhas de Croton polyandrus... 50
LISTA DE ABREVIATURAS, SIGLAS E FÓRMULAS
AcOEt Acetato de Etila
APT Attached Proton Test
CC Cromatografia em coluna
CCDA Cromatografia em Camada Delgada Analítica CCDP Cromatografia em Camada Delgada Preparativa CDCl3 Clorofórmio deuterado
CHCl3
CG/EM
Clorofórmio
Cromatografia Gasosa acoplada a Espectrômetro de Massas
cm Centímetro
compr. Comprimento
COSY Correlation Spectroscopy
d Dubleto
dd Duplo dupleto
ddd Duplo duplo dupleto
EEB Extrato Etanólico Bruto EM Espectrometria de massas
EtOH Etanol
H2O Água
HMBC Heteronuclear Multiple Bond Correlation
HMQC Heteronuclear Multiple Quantum Correlation
Hz Hertz
IV Infravermelho
J Constante de acoplamento
KBr Brometo de potássio
kg Quilograma
LTF Laboratório de Tecnologia Farmacêutica
LMCA Laboratório Multiusuário de Caracterização e Análise
MeOH Metanol
m Multipleto
mg Miligrama
min Minuto
mL Mililitro
nm Nanômetro
mm Milímetro
NOESY Nuclear Overhauser Enhancement Spectroscopy
pág. Página
ppm Partes por milhão
Rf Fator de Retenção
RMN 13C Ressonância Magnética Nuclear de Carbono 13 RMN 1H Ressonância Magnética Nuclear de Hidrogênio
s
TGI
Singleto
Total Growth Inibition
UFPB Universidade Federal da Paraíba
UV Ultravioleta
δ Deslocamento químico em ppm
μg Micrograma
SUMÁRIO
1. INTRODUÇÃO... 25 2. FUNDAMENTAÇÃO TEÓRICA... 28 2.1. Considerações sobre a família Euphorbiaceae... 28 2.2. Considerações sobre o gênero Croton ... 29
2.3. Aspectos biológicos, farmacológicos e químicos do gênero Croton... 31
2.4. Aspectos químicos e farmacológicos dos óleos essenciais de espécies do gênero
Croton ... 36
3. OBJETIVOS... 38 3.1. Objetivo geral... 38 3.2. Objetivos específicos... 38 4. MATERIAIS E MÉTODOS... 40 4.1. Métodos cromatográficos... 40 4.2. Métodos espectroscópicos... 40 4.3. Ponto de fusão... 41 4.4. Rotação específica... 41 4.5. Coleta do material botânico... 41 4.6. Processamento das folhas e raízes de Croton polyandrus... 41
4.7. Obtenção dos extratos brutos... 42 4.8. Obtenção e caracterização dos óleos voláteis das folhas de Croton polyandrus... 43
4.9. Fracionamento cromatográfico do extrato hexânico das folhas de Croton polyandrus... 44
4.10. Fracionamento cromatográfico do extrato diclorometano das folhas de Croton polyandrus... 45
4.11. Fracionamento cromatográfico do extrato acetato de etila das folhas de Croton polyandrus... 47
4.12. Fracionamento cromatográfico do extrato metanólico das raízes de Croton polyandrus... 52
4.13. Atividade Antimicrobiana e Antitumoral do óleo essencial das folhas de Croton polyandrus... 54
5. RESULTADOS E DISCUSSÃO... 61 5.1. Caracterização Estrutural dos Constituintes Isolados das folhas de Croton polyandrus... 63
5.1.1 Caracterização dos Constituintes do extrato hexânico e de Cp-1.... 63
5.1.2. Caracterização Estrutural de Cp-2... 78
5.1.3. Caracterização Estrutural de Cp-3... 82
5.1.4. Caracterização Estrutural de Cp-4... 91
5.1.5. Caracterização Estrutural de Cp-5... 99
5.1.6. Caracterização Estrutural de Cp-6... 104
5.1.7. Caracterização Estrutural de Cp-7... 111
5.1.8. Caracterização Estrutural de Cp-8... 115
5.1.9. Caracterização Estrutural de Cp-9... 129
5.2.1 - Caracterização do óleo essencial das folhas de Croton polyandrus... 134
5.2.2 - Atividade Antimicrobiana do óleo essencial de Croton polyandrus... 135
5.2.3 - Atividade Antitumoral da Sulforrodamina B do óleo essencial de Croton polyandrus... 136
6. CONCLUSÕES... 139
REFERÊNCIAS………... 141
1. Introdução
Os vegetais respondem a diferentes estímulos ambientais, de natureza química, física e biológica, dos quais depende a sua relação e interação no ambiente no qual se encontram. Como são impossibilitados de se locomoverem, a resposta a esses estímulos se dá a partir da produção de substâncias químicas oriundas do seu metabolismo secundário (SIMÕES et al., 2007). A produção desses compostos está associada à defesa da planta contra herbívoros, ataque de patógenos, radiação solar (MOANTANARI JR., 2002), ou ainda atuando na competição entre plantas e atração de organismos benéficos como polinizadores, dispersores de sementes e microrganismos simbiontes e também em alelopatias (SANTOS, 2002).
Os metabólitos secundários exercem grande importância ecológica e biológica, não só por atuarem na defesa das plantas, mas também por apresentarem efeitos medicinais ao homem. Essas substâncias são elaboradas a partir da síntese dos metabólitos primários (carboidratos, aminoácidos, lipídeos e etc), e agrupadas em classes, tais como compostos fenólicos, terpenoides, óleos essenciais, alcaloides, flavonoides, taninos entre outros (DI STASI, 1995; VIEGAS JR., 2003; PONTES et al., 2007; SILVA et al., 2007; GATTI et al., 2007).
Assim, o isolamento e a determinação estrutural de substâncias orgânicas produzidas pelo metabolismo secundário de organismos vivos representam importância fundamental para a fitoterapia e o desenvolvimento científico da própria química de produtos naturais, contribuindo para o avanço de outras atividades científicas e tecnológicas no País (LEMOS et al., 2007).
O uso de plantas medicinais, conhecido hoje como fitoterapia, tem ressurgido como uma opção medicamentosa bem aceita e acessível aos povos, e no caso do Brasil é adequada para as necessidades locais de centenas de municípios brasileiros no atendimento primário à saúde. em especial a classe desfavorecida, com o intuito de suprir a carência de medicamentos pouco eficazes e de custos elevados (KINGHORN, 2002). A expansão da fitoterapia pode ser atribuída a diversos fatores tais como: aos efeitos adversos de fármacos sintéticos, a preferência dos consumidores por tratamentos
“naturais”, a validação científica das propriedades farmacológicas de espécies vegetais,
drogas vegetais e seus derivados, além, também, do menor custo se comparado com os fármacos sintéticos (BRAZ FILHO, 2010).
No Brasil há uma grande diversidade de plantas com potencial terapêutico, o que estimula os pesquisadores no estudo de suas possíveis ações farmacológicas, bem como ações tóxicas, a fim de produzir medicamentos com garantia de eficácia e segurança. Pesquisadores da área de produtos naturais mostram-se impressionados pelo fato desses produtos encontrados na natureza revelarem uma gama quase inacreditável de diversidade, em termos de estrutura e de propriedades físico-químicas e biológicas (WALL; WANI, 1996). Estudos relataram que 61% das 877 novas moléculas ativas introduzidas mundialmente na indústria farmacêutica, durante o período de 1981-2002, foram derivadas ou inspiradas em produtos naturais (NEWMAN et al., 2003).
Segundo Lapa (2001), o valor dos produtos naturais, especialmente das plantas medicinais para a sociedade e para a economia do Estado é incalculável. Cerca de 60 a 80% da população mundial, especialmente em países em desenvolvimento, ainda confiam no poder terapêutico de plantas medicinais no tratamento de suas doenças.
Reconhecendo a importância do gênero Croton diante do uso popular no Brasil
para diversas afecções e, com base nos dados apresentados na literatura do potencial farmacológico que os seus diversos constituintes apresentam, principalmente os terpenóides que são marcadores deste gênero, observou-se a necessidade de um maior conhecimento químico e farmacológico a respeito da espécie Croton polyandrus
2. Fundamentação Teórica
2.1. Considerações sobre a família Euphorbiaceae
A família Euphorbiaceae é a sexta maior família de vegetais do mundo e é representada por 300 gêneros e nestes estão incluídos cerca de 7500 espécies, distribuídas em todas as regiões tropicais e subtropicais do globo, principalmente da América e África (CRONQUIST, 1981). Seus principais gêneros em número de espécies são: Euphorbia L. (1500), Croton L. (1300), Acalypha L. (400), Macaranga
Du Petit Thouars (400), Antidesma Burman (150), Drypetes Vahl (150), Jatropha L.
(150), Manihot Miller (150) e Tragia Plumier (150) (WEBSTER, 1994). No Brasil
ocorrem 72 gêneros e cerca de 1100 espécies, de hábito e habitat diferentes, e difundidas em todos os tipos de vegetação (BARROSO et al., 1991).
As espécies de plantas desta família variam de ervas e arbustos para árvores e cactos. Muitos deles contêm um sumo leitoso que é tóxico, especialmente para os animais de sangue frio, e pode produzir um dermatite semelhante ao da hera venenosa. Os frutos são tricapsulares, contendo cada célula uma única semente. Algumas espécies produzem óleos obtidos a partir de sementes tóxicas. (BAIBOUR; WARREN; WOOD, 1951; HIROTA et al., 2010).
As espécies da família Euphorbiaceae são bem conhecidas em diferentes partes do mundo devido às propriedades tóxicas e / ou medicinais (antitumoral, citotóxica, ou atividade antimicrobiana). A grande diversidade dos efeitos descritos é um reflexo da alta diversidade química desta família (EVANS; TAYLOR, 1983; PEREIRA et al., 2002).
A química das Euphorbiaceae é uma das mais complexas e interessantes entre as famílias de eudicotiledôneas, podendo ser até mesmo comparada à sua alta diversidade biológica, por ser uma família ampla é contemplada com diversas classes de constituintes químicos, tais como: esteroides, iridoides, alcaloides, cardenolídeos, cianinas, terpenoides, compostos fenólicos, flavonoides (flavonols, flavonas, flavanonas), antraquinonas (KOTHALE; ROTHE; PAWADE, 2011).
região amazônica ou espécies de Manihot Miller, que foram responsáveis por manter,
durante algum tempo, a economia da região da Caatinga nordestina (ALLEM; IRGANG, 1975). Algumas espécies são utilizadas na alimentação humana, principalmente na região Nordeste do Brasil, como Manihot esculenta Crantz, da qual
extrai-se a farinha de mandioca (BRAGA, 1976).
2.2. Considerações sobre o gênero Croton
O gênero Croton pertence à família Euphorbiaceae Juss que é uma das maiores
das Angiospermae, possuindo mais de 300 gêneros e 8000 espécies. Cosmopolitas, as espécies deste gênero ocorrem em todas as regiões do mundo, amplamente distribuídas em regiões tropicais do Novo e Velho Mundos, possuindo hábitos heterogêneos, que vão desde árvores, arbustos, subarbustos, ervas e trepadeiras. (PEREIRA et al., 2002).
Croton é o segundo maior gênero de Euphorbiaceae, com aproximadamente 1.300
espécies distribuídas predominantemente no continente americano. Com cerca de 300 espécies, o Brasil é um dos principais centros de diversidade do gênero, que está representado nos mais variados ambientes e tipos vegetacionais (BERRY et al.,2005).
Em termos gerais, Croton é caracterizado por sua distribuição nas zonas de
clima tropical e subtropical da América, África, Ásia e Austrália. Registros fósseis datam sua diversificação em aproximadamente 100 milhões de anos. Apresenta mais de 200 espécies paleotropicais (WEBSTER, 1994). Mesmo não reconhecendo várias seções, outros autores reúnem as espécies em 40 seções, sendo a maioria de origem americana (LIMA; PIRANI, 2008). México e Brasil são áreas importantes como centros de diversificação deste gênero. Possui grande importância ecológica, sendo suas espécies importantes elementos de vegetação secundária. Talvez o sucesso do gênero em áreas de mata secundária de regiões tropicais tenha sido um fator chave para sua grande diversificação evolutiva (LIMA; PIRANI, 2008).
Croton é um gênero de taxonomia bastante difícil, devido a seu elevado número
Apesar de muito polimórfico, o gênero é facilmente reconhecido por inflorescências geralmente racemosas com flores pistiladas proximais e estaminadas polistêmones, indumento com tricomas simples, estrelados ou escamiforme, glândulas peciolares e folhas senescentes, tornando-se laranja antes da deiscência (BERRY et al., 2005).
As plantas do gênero Croton crescem em uma grande variedade de habitats e de
solos, encontram-se frequentemente à beira dos rios e riachos e não se desenvolvem em áreas com inundações periódicas. Ocorrem em solos de origem aluvial, profundos ou medianamente profundos e com boa drenagem; com textura arenoso, franco-limoso e francoargilo-arenoso; de reação moderadamente ácida à ligeiramente alcalina (MEZA; PARIONA, 1999; FORERO; CHAVEZ; BERNAL, 2000; POLLITO, 2004).
Segundo Forero et al. (2000) as espécies deste gênero são de floresta tropical seca a muito úmida; com temperaturas médias anuais de 17,7° a 30 ºC e precipitação de 600-4000 mm, que variam de acordo com a altitude e latitude (POLLITO, 2004). Preferem os locais alterados, fragmentos de florestas e especialmente os campos de cultivo abandonados onde convertem-se em espécie pioneira. É uma das espécies mais importantes na dinâmica da sucessão florestal, chegando a predominar na floresta secundária até o décimo ano. Na dinâmica das florestas, as áreas desmatadas com ou sem queima e as clareiras grandes são ocupadas por exemplares de Cecropia sp., Ochroma pyramidale (Cav. ex Lam.) Urb., Jacaranda copaia (Aubl.) D. Don, Inga
spp., Guazuma crinita Mart., Miconia sp.,Trema micrantha (L.) Blume, Vernonia sp., Pouroma sp., entre várias outras, sendo, no entanto, o Croton que possui maior valor
ecológico no processo de recuperação da floresta (POLLITO, 2004).
A presença de plantas de Croton nos primeiros estágios da sucessão deve-se às
suas estratégias fenológicas, de disseminação e de polinização, bem como as estruturas de atração que secretam néctar na época da polinização e estão associadas a insetos, aves e mamíferos (POLLITO, 2004).
No Brasil as espécies de Croton crescem em matas, campos e cerrados de Norte
ao Sul do país, e várias espécies ocorrem na caatinga e nas áreas de brejos de altitudes de Pernambuco (ALBUQUERQUE; ANDRADE, 2002). Croton é um grupo
flores e frutos durante a maior parte do ano, o que torna suas espécies candidatas para a restauração de áreas degradadas (LIMA; PIRANI 2008).
Dentre as espécies deste gênero encontradas no Brasil, encontra-se a Croton polyandrus Spreng. que é conhecida no nordeste brasileiro como “croton de tabuleiro”,
comum em terrenos arenosos e em vegetação da costa desta região. Trata-se de uma espécie do semi-árido brasileiro, embora ocorra também no domínio da floresta atlântica ocorrendo nos estados de Alagoas, Bahia, Ceará, Paraíba, Pernambuco, Piauí, Rio Grande do Norte e Sergipe (SILVA; SALES; TORRES, 2009).
2.3. Aspectos biológicos, farmacológicos e químicos do gênero Croton
No Nordeste são usadas na medicina popular no tratamento de inflamações, úlceras e hipertensão (BIGHETTI et al., 1999; HIRUMA-LIMA et al., 1999), algumas espécies são relatadas ainda por seu uso popular contra a diarreia como Croton campestri (CRUZ, 1982), Croton cajucara (COSTA et al., 1989) e Croton rhamnifolioides (RANDAU et al., 2002).
Várias espécies de Croton, tais como C. lechleri, C. palanostigma, C. urucurana e C. draconoides, contem um seiva vermelha viscoso que é obtida após fazer cortes nas
raízes (DUKE; VASQUEZ, 1994). As árvores maduras de C. lechleri L. Produzem
uma seiva de vermelho à laranja-amarelado, que é altamente valorizada por acelerar a cicatrização de feridas. Devido a sua aparencia com o sangue, o látex é chamado de "sangre de drago" ou "sangre de grado", traduzida em Inglês como "sangue de dragão" e "sangue de árvore", respectivamente (MILANOWSKI et al., 2002; RIINA; BERRY; VAN, 2009).
C. eluteria é uma árvore de médio porte comum na região norte da América do
Sul e que se estende pela Améria Central e sul do México. Apresenta caule de alto valor medicinal e rico em óleos voláteis, diterpenos, alcalóides e taninos, sendo aplicada como balsâmica, digestiva, estomáquica, febrífuga, hipotensora, narcótica e tônica. Bastante utilizada contra febre-terçã (decorrente da malária) e como um substituto de Cinchona e Cascara (SALATINO; SALATINO, NEGRI, 2007). Outra espécie amazônica, C. pullei não apresenta citações como medicinal, porém possui óleo volátil e
A C. micans é um arbusto de ampla ocorrência, conhecido no Brasil como
“alecrim-de-vaqueiro” e reconhecido como sedativa e calmante, sendo utilizada também
no tratamento de distúrbios cardíacos e gripes(COMPAGNONE et al., 2010).
A C. malambo Karst, uma pequena árvore que cresce no oeste da Venezuela e
norte da Colômbia, é conhecida como palomatias e Torco. A infusão das cascas é utilizada na medicina tradicional para o tratamento de diabetes, diarreia, reumatismo, úlcera gástrica e como anti-inflamatório e analgésico (SUÁREZ et al., 2003).
Existem ainda espécies Croton zehntneri e Croton cajucara que estão presentes
na Relação Nacional de Plantas Medicinais de Interesse ao Sistema Único de Saúde (RENISUS) por apresentar potencial e poder gerar produtos de interesse ao SUS. Esta relação foi criada com o intuito de contribuir para a regulamentação do setor, contém o nome de 71 espécies nativas ou exóticas, já utilizadas por vários serviços de saúde estaduais e municipais, a partir do conhecimento tradicional e popular e de estudos químicos e farmacológicos disponíveis (NASCIMENTO-JÚNIOR et al., 2010)
Espécies de Croton são fontes abundantes de substâncias ativas contra o câncer,
tais como diterpenóides (clerodano, furoclerodane e diterpenos acíclicos) e alcalóides (por exemplo taspina) (SALATINO; SALATINO; NEGRI, 2007). Além disso, estudos farmacológicos com espécies de Croton têm mostrado atividade antioxidante Croton lechleri Müll. Arg. (LOPES E LOPES et al., 2004), efeitos hepatoprotetores (AHMED
et al., 2002), imunomoduladores (WILLIAMS, 2001), e no Brasil, efeitos
vasorelaxantes com Croton nepetifolius Baill. (LAHLOU et al., 2000) e antimicrobianos
contra bactérias multidrogas resistentes com Croton campestris A. (MATIAS et al.,
2011).
Estudos fitoquímicos realizados por Araújo-Júnior et al. (2003) com três espécies do gênero Croton resultaram no isolamento dos seguintes compostos: das
partes aéreas de Croton moritibensis Baill., popularmente conhecida como “velame
-preto”, quatro alcalóides (harmana e tetrahidroharmana, 2-etóxicarbonil
tetrahidroharmana e 6-hidróxi-2- metiltetrahidroharmana) e três diterpenos (sonderianol, 12-hidróxi-13-metil 8,11,13-podocarpatrien-3-ona e 12-hidróxi-13-metil-1,8,11,13-podocarpatrien-3-ona); das raízes de Croton muscicapa Müll. Arg., três novos
alcalóides sesquiterpênicos do tipo guaiano, uma nova classe, muscicapina A, muscicapina B, e muscicapina C; das raízes de Croton polyandrus Spreng., a cordatina,
Quadro 1. Constituintes químicos isolados das raízes de Croton polyandrus
Já estudos realizados por Medeiros (2012) com as partes aereas de Croton grewioides Baill. Resultaram no isolamento de treze substâncias (
2-oxo-cleroda-3,13-dien-15α,16-olideo-21-ato, 2-oxo-cleroda-3,13-dien-15 ,16-olideo-21-ato, ent
-15,16-epoxi-2-oxo-3,13(16),14-clerodatrieno, ent
-15,16-epoxi-20-acetoxi-2-oxo-3,13(16),14-clerodatrieno, ácido ent-15,16-epóxi-3,13(16),14-clerodatrien-20-óico,
2-oxo-5α,8α-cleroda-3,13-dien-15,16-olideo, ácido cleroda-3,13-dien-15,16-olideo-8-óico, ácido ent-caur-16-en-19-óico, ent-7α-acetoxitraquiloban-18-óico, ácido trans-octacosil
ferulato, 4-alil-1,2-dimetoxibenzeno, 2-hidroxi-4,6-dimetoxi-acetofenona e estigmast-4-en-3-ona), sendo destes, três descritos pela primeira vez na literatura, dois isolados pela primeira vez no gênero e oito relatados pela primeira vez na espécie.
flavonoides e alcalóides, como ilustrado no Quadro 2. Também são ricas em terpenóides de baixo peso molecular (mono e sesquiterpenos), que juntamente com arilpropanóides formam outra importante classe de produtos naturais, os óleos essenciais, responsáveis pelo odor característico de muitas espécies de Croton.
Quadro 2. Estrutura química de substâncias isoladas de espécies de Croton
Outros compostos, também isolados de diferentes espécies de Croton foram
classificados em 21 categorias, a saber, aliciclicos, alifáticos, alcalóides, compostos benzênicos, carboidratos, diterpenos, flavonóides, lignanas, lipídios, monoterpenos, peptídeos, fenantrenos, fenilpropanóides, proteínas, quinonas, sesterpenos,
sesquiterpenos, esteróides, triterpenos e xantonas, como mostrado no Quadro 3, o que demonstra a importância do estudo fitoquímico do gênero (MEDEIROS, 2012).
Quadro 3. Perfil Fitoquímico do gênero Croton (MEDEIROS, 2012)
0 100 200 300 400 500
Coum arin Lact ona Feni lbut anoi de Sest erpe no Pira zidi na Qui noid es Het eroc iclo de oxig ênio Lim onoi des Polic iclo s Meg asti gman os Fura noce mbr anoi des Xant onas Prot eina s Benz oil-M etilp olió is Lign anas Carb oidr atos Lipí deos Benz enoi des Este roid es Trit erpe nos Flav onoi des Alif átic os Feni lpro pano ides Alcal
2.4. Aspectos químicos e farmacológicos dos óleos essenciais de espécies do gênero
Croton
Embora não seja relatado na literatura a existência de muitas plantas aromáticas na família Euphorbiaceae, várias espécies do gênero Croton já foram caracterizadas por
produzir óleos voláteis, estes por sua vez, são constituidos por fenilpropanóides e terpenóides (mono e sesquiterpenos) (SALATINO, SALATINO; NEGRI, 2007).
Estudos químicos com os óleos essenciais das folhas e da casca do caule de C. nepetaefolius revelaram a presença de monoterpenos, tais como 1,8-cineol e terpineol,
sesquiterpenos, como biciclogermacreno, e fenilpropanóides voláteis, como metileugenol (SALATINO,SALATINO; NEGRI, 2007). Já pesquisas com os óleos essenciais de C. micans e C. matourensis demonstraram que são ricos em terpinen-4-ol,
D-limoneno, espatulenol, α-cadinol e -elemeno (COMPAGNONE et al., 2010).
Muitas das espécies de Croton são capazes de produzir óleos essenciais
amplamente utilizados para fins medicinais, como por exemplo: C. zehntneri e C. cajucara, que são comumente utilizadas no Brasil para o tratamento de distúrbios
gastrointestinais, hepáticos e diabetes (CEGIÉLA-CARLIOZ et al., 2005) e C. lechleri,
que é amplamente utilizado em países sul-americanos para inflamações, úlceras gástricas, cicatrização de feridas e câncer (ROSSI et al., 2011).
Pesquisas científicas com os óleos essenciais de espécies deste gênero demonstraram consideráveis atividades farmacológicas: efeito depressor do sistema nervoso central, antinociceptivo, gastroprotetor, vasorelaxante e larvicida (LAZARINI et al., 2000; OLIVEIRA et al., 2001; TORRE et al., 2008; MAGALHÃES et al., 2008; COELHO-DE-SOUZA et al., 2012).
O trabalho realizado por Moreno et al. (2007) revelou que o óleo essencial de C. heterocalyx apresenta uma elevada atividade antifúngica contra as espécies Aspergillus niger (16404) e Candida albicans (ATCC 10231), bem como atividade antibacteriana
contra as cepas de Staphylococcus aureus (ATCC 6538), Escherichia coli (ATCC 8739)
e Pseudomonas aeruginosa (ATCC 9027).
Além disso, o estudo de Sylvestre et al. (2006) com o óleo essencial de C. flavens demonstrou um considerável efeito antitumoral contra células humanas de
3. Objetivos
3.1. Objetivo geral
Dando continuidade à pesquisa por novos compostos biologicamente ativos a partir de espécies da família Euphorbiaceae, foi utilizado como objeto de estudo Croton polyandrus Spreng., visando contribuir para o estudo químico, biológico e
quimiotaxonômico de plantas do norte/nordeste brasileiro.
3.2. Objetivos específicos
Isolar, identificar e/ou elucidar constituintes químicos de Croton polyandrus;
Caracterizar os constituintes voláteis de Croton polyandrus;
Avaliar a citotoxicidade e atividade antitumoral do óleo essencial das folhas de
Croton polyandrus;
4. Material e Métodos
4.1. Métodos cromatográficos
Cromatografias em coluna por adsorção (CC) sob pressão reduzida e Cromatografia Líquida de Média Pressão (CLMP) utilizando-se como adsorvente sílica gel Merck 7734, com partículas 0,063-0,200 mm e sílica flash com partículas 0,040-0,063 mm de diâmetros, respectivamente. A eluição se procedeu utilizando-se como eluentes, hexano, diclorometano, acetato de etila e metanol, puros ou em misturas binárias em gradiente crescente de polaridade.
As Cromatografias em Camada Delgada Analítica (CCDA) foram feitas utilizando sílica gel 60, da Merck PF 254 artigo 7749 na espessura 0,25mm, suspensa
em água destilada (1μβ), distribuída sobre placas de vidro por meio de um cursor “Quick fit”, secas ao ar e ativadas em estufa a 110oC durante cerca de 2 horas.
Os solventes empregados foram das marcas MERCK, TEDIA BRASIL e solventes comerciais destilados no LTF/UFPB.
As revelações das substâncias nas cromatoplacas analíticas foram executadas pela exposição à lâmpada de irradiação ultravioleta em aparelho Mineralight, modelo UVGL- 58 em dois comprimentos de onda (254 e 366nm) e/ou câmara saturada com vapores de iodo.
4.2. Métodos espectroscópicos
Os espectros de absorção na região do infravermelho (IV) foram obtidos em espectrômetro: BOMEM, modelo MB 100, na faixa de 4000 a 400 cm-1, utilizando-se pastilhas de KBr.
Os espectros de ressonância magnética nuclear (RMN) foram registrados em espectrômetros VARIAN, modelo MERCURY, operando a 200 MHz (RMN 1H) e 50 MHz (RMN 13C) e SYSTEM operando a 500 MHz (RMN 1H) e 125 MHz (RMN 13C). O solvente utilizado na dissolução das amostras foi clorofórmio deuterado (CDCl3), dimetilsulfóxido (DMSO) e piridina. Os deslocamentos químicos (δ) foram expressos
largo), d (dupleto), dd (duplo dupleto), t (tripleto) qd (quaterto de dupleto) e m
(multipleto), ddd (duplo duplo dupleto).
4.3. Ponto de fusão
O ponto de fusão das substâncias foi determinado em aparelho digital para ponto de fusão, modelo MQAPF-302 da Microquímica, com bloco de platina em microscópio
óptico tipo “Kofler”, marca REICHERT, modelo Rγβ7λ, com variação de temperatura
de 0-350 ºC.
4.4. Rotação específica
A rotação específica das substâncias foi realizada no polarímetro do modelo Polarimeter, série P-2000, marca JASCO.
4.5. Coleta do material botânico
As folhas e as raízes de Croton polyandrus Sprengforam coletadas no município
de Santa Rita, estado da Paraíba, em fevereiro de 2011. O material botânico foi identificado pela Profa. Maria de Fátima Agra, da Universidade Federal da Paraíba; uma exsicata da planta esta depositada no Herbário Prof. Lauro Pires Xavier (JPB), da Universidade Federal da Paraíba sob identificação AGRA & GOIS 1446 (JPB).
4.6. Processamento das folhas e raízes de Croton polyandrus
4.7. Obtenção dos extratos brutos
O pó das folhas (3000 g), seco e pulverizado foi submetido à maceração com hexano, diclorometano, acetato de etila e etanol, em um recipiente de aço inoxidável, durante 72 horas cada extração. Após a extração, as soluções extrativas foram concentradas em rotavapor sob pressão reduzida a uma temperatura de 45 °C obtendo-se os extratos: hexânico (40,25 g/ Rendimento 1,34 %); diclorometano (46,59 g/ Rendimento 1,55 %); acetato de etila (59,82 g/ Rendimento 1,99 %) e etanólico (194,44 g/ Rendimento 6,48 %) em relação ao peso seco da planta (Fluxograma 1). O pó das raízes (500 g), seco e pulverizado, foi submetido à maceração com metanol, nas mesmas condições descritas acima. Essa etapa foi repetida por quatro vezes. Após a extração a solução extrativa foi concentrada em rotavapor sob pressão reduzida a uma temperatura de 45 ºC, obtendo-se o extrato metanólico bruto (10,0 g/ Rendimento 2,0 %), como mostrado no fluxograma 1.
Fluxograma 1. Etapas envolvidas no processo de obtenção e fracionamento dos extratos das folhas de Croton polyandrus
- Maceração com hexano, diclorometano, acetato de etila, etanol e metanol;
- Concentração em evaporador rotativo.
Material botânico seco e pulverizado folhas (3000 g) e raízes (500 g)
extrato hexânico (40,25 g) - folhas
extrato etanólico (194,44 g) - folhas
extrato diclorometano (46,59 g) –
folhas
extrato acetato de etila (59,82g) - folhas
4.8. Obtenção e caracterização dos óleos voláteis das folhas de Croton polyandrus
As folhas frescas de Croton polyandrus foram submetidas à hidrodestilação
durante 4 horas, utilizando um aparelho do tipo Clevenger a temperatura de 40°C. O óleo obtido apresentou coloração amarela. Este foi seco com sulfato de sódio
anidro e filtrado. Para a análise, β L do óleo volátil foi diluído em 1 mL de acetato de etila.
A amostra de óleo essencial foi analisada num cromatógrafo gasoso Hewlett Packard 6890, série II, diretamente acoplado a detector seletivo de massas Hewlett Packard 5975 70 eV, equipado com uma coluna capilar HP5MS (30 m x 0,25 mm – 0,β5 m fase estacionária). As condições de análise foramμ temperatura de injeçãoμ ββ0
°C; temperatura do detector: 250 °C; programa de temperatura: 60-240 °C, 3 °C/min.; gás de arraste He 0,7 bar, 1 mL/min.; volume de amostra injetada: 1-β L; razão de
Split 1:100. Os compostos químicos presentes foram identificados por dois métodos, distintos e concomitantes:
Comparação dos espectros de massas, também chamados fragmentogramas, com uma literatura (ADAMS, 2007);
Cálculo do índice de retenção aritmético (AI), com base nos tempos de retenção obtidos da injeção de uma mistura de hidrocarbonetos (C-9 – C-40).
Além disso, como forma de identificação complementar, fez-se a comparação dos espectros de massas obtidos com os existentes na mesma literatura.
Os compostos identificados foram quantificados através da porcentagem relativa fornecida automaticamente pelo software do equipamento, através da integração dos
picos e do cálculo das áreas dos mesmos. Essa quantificação foi realizada utilizando um índice de Threshold de 19.0. Esse índice indica ao software qual é o nível abaixo do
4.9. Fracionamento cromatográfico do extrato hexânico das folhas de Croton
polyandrus
Uma alíquota do extrato hexânico (15,0 g) das folhas de Croton polyandrus foi
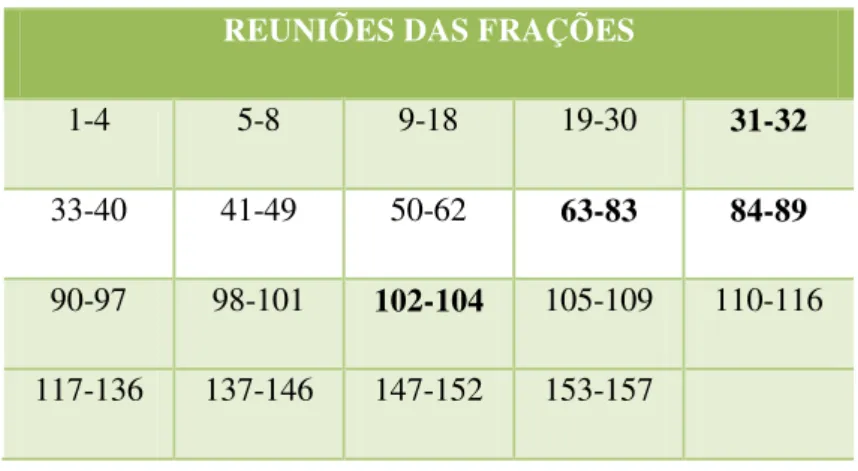
submetida à Cromatografia Líquida de Média Pressão (CLMP), utilizando Aparelho de Sistema binário de separação flash da Büchi, equipado com dois módulos de bombas (C-601 e C-605), módulo controlador (C- 615), coluna empacotada com sílica flash (ART 7734 MERCK - 0,04 – 0,063) e utilizando o fluxo de 30 mL/min. Para esta coluna foram programados 3 segmentos obedecendo as variações de polaridade e tempo expostos na Tabela 1 (Pág. 44). Foram coletadas 88 frações de 100 mL cada, que foram concentradas em evaporador rotativo e reunidas por CCDA, de acordo com seus perfis cromatográficos em 14 grupos (Tabela 2, pág. 44).
Tabela 1. Método utilizado para o processamento cromatográfico do extrato hexânico das folhas de Croton polyandrus
SEGMENTOS VARIAÇÃO DE POLARIDADE TEMPO
1 Hexano Puro Hexano Puro 45 min
2 Hexano Puro Hex:AcOEt (1:99) 2h 45 min 3 AcOEt Puro AcOEt: MeOH (70:30) 30 min
Tabela 2. Reunião das frações do extrato hexânico das folhas de Croton polyandrus após monitoramento em CCDA.
REUNIÕES DAS FRAÇÕES
1-3 4-9 10-14 15-22 23-36
37 38-41 42-46 47-49 50-52
As frações 15-22; 23-36 foram submetidas à cromatografia gasosa (CG), com metodologia descrita na página 43. A fração 37 apresentou-se sob a forma de óleo incolor e, foi codificada como Cp-1(10,0 mg) (0,00067 %).
4.10. Fracionamento cromatográfico do extrato diclorometano das folhas de
Croton polyandrus
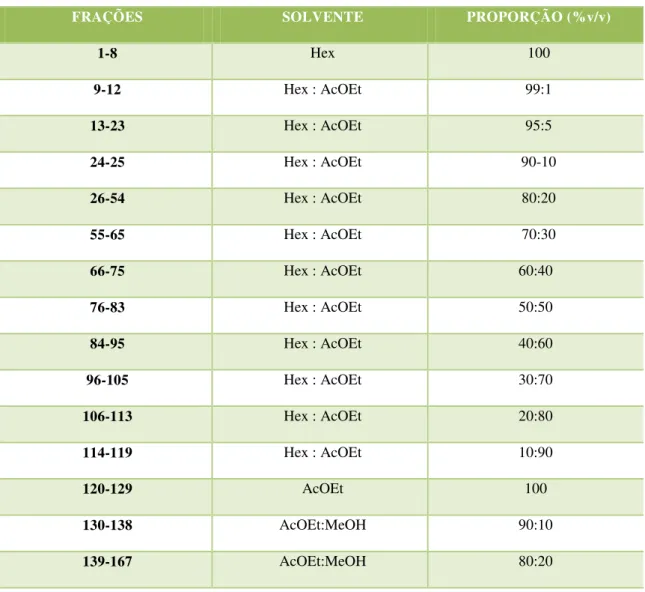
Uma alíquota do extrato diclorometano (15,00 g) foi submetida à cromatografia de adsorção em coluna (CC) sob pressão usando-se sílica gel 60 (ART 7734 MERCK - 0,063 – 0,200) como fase estacionária e como eluentes, os solventes hexano, acetato de etila e metanol individualmente ou em misturas binárias, em gradiente crescente de concentração. Foram coletadas 167 frações de 125 mL cada, e os resultados obtidos após o fracionamento cromatográfico, são fornecidos no Tabela 3 (pág. 45), abaixo.
Tabela 3. Fracionamento cromatográfico do extrato diclorometano das folhas de Croton polyandrus
FRAÇÕES SOLVENTE PROPORÇÃO (%v/v)
1-8 Hex 100
9-12 Hex : AcOEt 99:1
13-23 Hex : AcOEt 95:5
24-25 Hex : AcOEt 90-10
26-54 Hex : AcOEt 80:20
55-65 Hex : AcOEt 70:30
66-75 Hex : AcOEt 60:40
76-83 Hex : AcOEt 50:50
84-95 Hex : AcOEt 40:60
96-105 Hex : AcOEt 30:70
106-113 Hex : AcOEt 20:80
114-119 Hex : AcOEt 10:90
120-129 AcOEt 100
As frações foram analisadas comparativamente através de cromatografia em camada delgada analítica (CCDA) utilizando diferentes sistemas de eluição e reunidas, quando semelhantes, em 27 grupos de acordo com os perfis cromatográficos, após análise à luz UV e impregnação com vapores de iodo (Tabela 4, pág. 46).
Tabela 4. Sistemas de eluições utilizados no processamento cromatográfico do extrato diclorometano das folhas de Croton polyandrus, frações coletadas para cada sistema de eluição e grupos de frações obtidos após análise em CCDA.
A fração 28 apresentou-se como cristais brancos, sendo codificada como Cp-2
(203,0 mg)(0,0067 %). A fração 31 (370,0 mg) foi submetida a uma nova cromatografia em coluna preenchida com gel 60 (ART 7734 MERCK - 0,063 – 0,200) e eluída com Hexano e AcOEt, puros ou em misturas binárias seguindo gradiente de
FRAÇÕES COLETADAS SISTEMA DE ELUIÇÃO GRUPOS APÓS CCDA
1-8 Hex (100%) 1-12; 13-15; 17-20; 21-27
9-12 Hex : AcOEt (99:1 v/v)
13-23 Hex : AcOEt (95:5 v/v)
24-25 Hex : AcOEt (90:10 v/v) 28; 29-30; 31; 32-44; 45-54; 55-67
26-54 Hex : AcOEt (80:20 v/v) 55-65 Hex : AcOEt (70:30 v/v)
66-75 Hex : AcOEt (60:40 v/v) 68-81; 82; 83-89; 90-92; 93-94; 95-100; 101-103; 76-83 Hex : AcOEt (50:50 v/v)
84-95 Hex : AcOEt (40:60 v/v) 96-105 Hex : AcOEt (30:70 v/v)
106-113 Hex : AcOEt (20:80 v/v) 104-110; 111-120; 121-127; 128-131; 132-134; 135-139; 140- 143; 144-152;
153-159; 160-167 114-119 Hex : AcOEt (10:90 v/v)
120-129 AcOEt (100 %)