CENTRO DE CIÊNCIAS AGRPARIAS DEPARTAMENTO DE ENGENHARIA DE PESCA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA DE PESCA
ATIVIDADE ANTICOAGULANTE DE GALACTANAS SULFATADASDE ALGAS MARINHAS VERMELHAS DO GÊNERO Halymenia E SEU EFEITO IMUNOESTIMULANTE NO CAMARÃO MARINHO Litopenaeus vannamei
JOSÉ ARIÉVILO GURGEL RODRIGUES
JOSÉ ARIÉVILO GURGEL RODRIGUES
DISSERTAÇÃO DE MESTRADO SUBMETIDA À COORDENAÇÃO DO PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA DE PESCA DA UNIVERSIDADE FEDERAL DO CEARÁ, COMO REQUISITO PARCIAL PARA
A OBTENÇÃO DO GRAU DE MESTRE EM ENGENHARIA DE PESCA
Universidade Federal do Ceará e encontra-se à disposição dos interessados na Biblioteca de Ciências e Tecnologia da referida Universidade.
A transcrição de qualquer trecho desta dissertação é permitida, desde que seja feita de acordo com as normas da ética científica.
______________________________ José Ariévilo Gurgel Rodrigues
DISSERTAÇÃO APROVADA EM 17/11/2006
_______________________________________ Prof. Wladimir Ronald Lobo Farias, D.Sc.
Orientador da Dissertação Presidente
________________________________________ Prof. Paulo Antônio de Souza Mourão, Ph.D.
Conselheiro
________________________________________ Profa. Silvana Saker Sampaio, Ph.D
Primeiramente a Deus, ao qual devo tudo que conquistei a te hoje, pela sua companhia na bisca pelas minhas convicções e anseios profissionais, a Engenharia de Pesca. Através de seus ensinamentos, procurarei sempre agir com ética e postura responsável entre as pessoas;
A minha família, Célia e Ari (meus pais) e Aracélia e Celina (minhas irmãs), que mesmo ainda sem compreenderem a minha perseverança pelos meus ideais profissionais;
As minhas tias e avô, que não estão mais entre meu convívio, dedico também este trabalho de dissertação;
Os meus louváveis agradecimentos ao meu mestre, orientador e amigo, Prof. Dr. Wladimir Ronald Lobo Farias, pelas horas de dedicação, paciência e ensinamentos profissionais (concedidos a mim) durante todo o meu curso de mestrado, os quais procurarei transmitir em um futuro próximo;
Também aos meus profundos amigos Silvana e Alexandre. A Prof. Silvana presto minha profunda admiração pelo seu carisma, cordialidade e conselhos prestados a minha pessoa. E ao Prof. Alexandre, retrato aqui, uma grande consideração também pela sua pessoa e nunca esquecerei o que fizestes por mim durante todo o meu curso de mestrado. Muito obrigado!;
Ao Dr. Paulo Antônio de Souza Mourão, Professor da Universidade do Rio de Janeiro, pela sua grande atenção e disponibilidade em aceitar ao meu convite para participar de minha banca de defesa de dissertação de mestrado;
Ao Prof. Francisco Hiran Farias Costa, pela disponibilidade do laboratório de Aqüicultura para a realização de pesquisa;
Ao Coordenador do curso de mestrado em Engenharia de Pesca, Prof. Dr. Manuel Furtado, pela sua atenção durante todo o meu curso de mestrado. Muito obrigado!;
Os meus agradecimentos aos estudantes de graduação, Eduardo Izidorio de Melo, e de pós graduação, Fábio Rabelo Melo e Leonardo Paes Cinelli, da Universidade Federal do Rio de Janeiro (Laboratório de Tecido Conjuntivo), pela atenção (cedida a mim) durante o início do meu projeto de mestrado;
Ao Engenheiro Agrônomo, Francisco Élder Calvacante Barros, pela sua disponibilidade no momento inicial deste trabalho;
A FUNCAP, pelo auxílio financeiro no momento inicial do trabalho e em prol do desenvolvimento da ciência e tecnologia no Estado do Ceará;
A CAPES, pelo auxílio financeiro no momento inicial do trabalho e em prol do desenvolvimento da ciência e tecnologia no Brasil;
A indústria de ração FRI-RIBE, representada pelos Engenheiros de Pesca Ítalo Régis Castelo Branco (Coordenador Técnico) e Jeffersson Couto (Representante de Vendas), pela diação do insumo do qual foi fundamental durante o período experimental;
A Fazenda Dú Vale, localizada no município de Jaguaruana/CE, pela doação dos camarões, e por ter me acolhido muito bem, em um momento extremamente difícil. Presto aqui, os meus sinceros agradecimentos;
Aos funcionários Antônio, Omar Ribeiro, Omar, Edílson, Zacarias, Leni e Henrique, o meu muito obrigado!;
A secretária do curso de mestrado em Engenharia de Pesca, Rogéria, pela sua atenção e consideração.
Página DEDICATÓRIA
AGRADECIMENTOS
RESUMO iii
ADSTRACT v
LISTA DE FIGURAS vi
LISTA DE TABELAS viii
LISTA DE SIGLAS E ABREVIATURAS ix
1. INTRODUÇÃO 1
1.1. Algas marinhas. 1
1.2. O gênero Halymenia. 3 1.3. Polissacarídeos sulfatados (PS) de algas marinhas. 4
1.4. Atividades biológicas dos polissacarídeos sulfatados. 9 1.4.1. Atividade anticoagulante. 12 1.4.2. Atividade imunoestimulante. 15 1.5. Produção de camarão marinho, Litopenaeus vannamei, no Brasil e no mundo.
20
2. MATERIAIS E MÉTODOS 26
2.1. Coleta e identificação das algas marinhas. 26 2.2. Extração dos polissacarídeos sulfatados. 27 2.3. Fracionamento dos polissacarídeos sulfatados em coluna de troca iônica.
30
2.4. Teste de Dubois. 30
2.7.1. Aquisição e manejo dos camarões Litopenaeus vannamei.
32
2.7.2. Preparação das soluções de polissacarídeos sulfatados. 33 2.7.3. Procedimento experimental. 33 2.7.4. Análises fídico-químicas. 34
2.8. Análises estatísticas. 35
2.9. Extração dos polissacarídeos sulfatados dos camarões. 36 2.10. Fracionamento dos polissacarídeos sulfatados em coluna de
troca iônica.
37
2.11. Eletroforese em gel de agarose. 37
3. RESULTADOS E DISCUSSÃO 38
3.1. Extração dos polissacarídeos sulfatados. 38 3.2. Fracionamento dos polissacarídeos sulfatados em
DEAE-celulose.
39
3.3. Eletroforese em gel de agarose. 43 3.4. Atividade anticoagulante (aPTT). 46
3.5. Efeito imunoestimulante. 49
3.5.1. Biomassa viva final. 50
3.5.2. Parâmetros físico-químicos. 55 3.5.3. Extração dos polissacarídeos sulfatados dos camarões. 56 3.5.4. Análise cromatográfica, em coluna de DEAE-celulose, dos extratos brutos de polissacarídeos sulfatados obtidos das algas e dos camarões.
57
3.5.5. Eletroforese das frações eluídas a partir do extrato bruto dos camarões.
61
4. CONCLUSÃO 64
Muitos compostos têm sido descritos como anticoagulantese imunoestimulantes, dentre essas os polissacarídeos sulfatados (PS) de algas marinhas que também são conhecidos por apresentar outras atividades biológicas, tais como antitrombótica e antiviral. A descoberta de novas drogas anticoagulantes é importante para prevenir os efeitos adversos do uso da heparina, como hemorragias e trombocitopenia. Além disso, o uso de imunoestimulantes também pode reduzir o impacto do estresse no cultivo intensivo de organismos aquáticos. O objetivo deste trabalho foi avaliar a atividade anticoagulante de galactanas sulfatadas de duas espécies de algas marinhas vermelhas do gênero Halymenia e o seu efeito imunoestimulante no camarão branco Litopenaeus vannamei. Os PS foram extraídos, através de digestão enzimática, a partir de algas marinhas coletadas na Praia de Fleixeiras/CE. Em seguida, os extratos brutos foram fracionados em coluna de DEAE-celulose, sendo as frações eluídas com soluções de diferentes concentrações de NaCl e o grau de purificação analisado por eletroforese. A atividade anticoagulante das frações foi avaliada pelo teste do aPTT, utilizando plasma de coelho citratado, sendo o tempo de coagulação registrado em um coagulômetro. Para avaliar efeito imunoestimulante, três doses diferentes de PS foram administradas, através de banhos de imersão, no camarão L. vannamei. Os tratamentos, com três repetições cada, foram 0,5 μg.L-1; 1,5
μg.L-1 e 1,0 mg.L-1, e um controle, sem polissacarídeos. O experimento teve
(09:00 e 17:00 h), após as trocas de água e antes da alimentação doa animais. Depois de 15 dias de imersão, não houve diferenças significativas entre as taxas de mortalidade dos tratamentos. Entretanto, depois do período do estresse, o tratamento com 1,0 mg.L-1 apresentou uma mortalidade significativamente menor do que as observadas nos tratamentos s/PS e 0,5
μg.L-1. Com relação à atividadeanticoagulante, as frações obtidas da espécie
Página Figura 1. Estrutura de um proteoglicano de mamífero (“agregan”)
mostrando a proteína central em azul e as cadeias de condroitim sulfato (CS) e queratam sulfato (KS). Fonte: Glycoword.
5
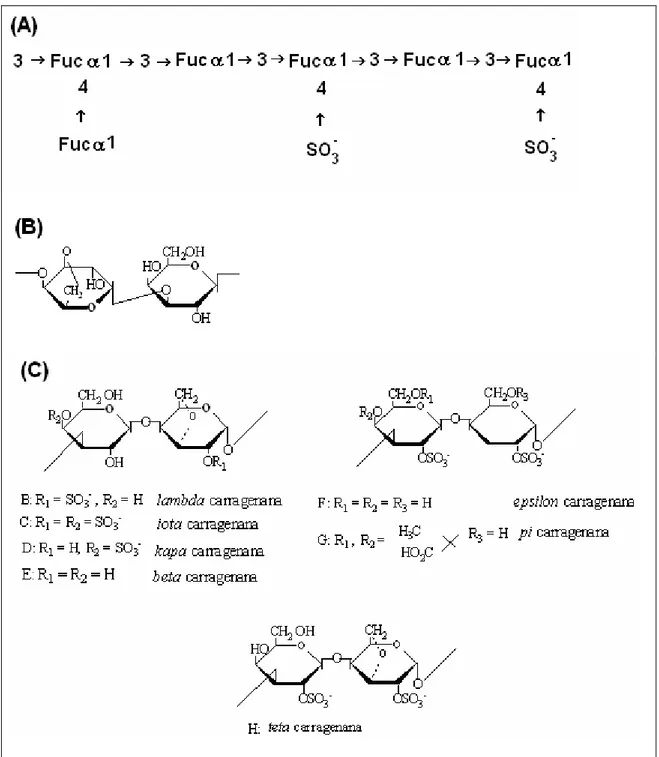
Figura 2. Estruturas químicas de polissacarídeos sulfatados de algas marinhas: (A) fucoidam; (B) agar; (C) carragenanas.
7
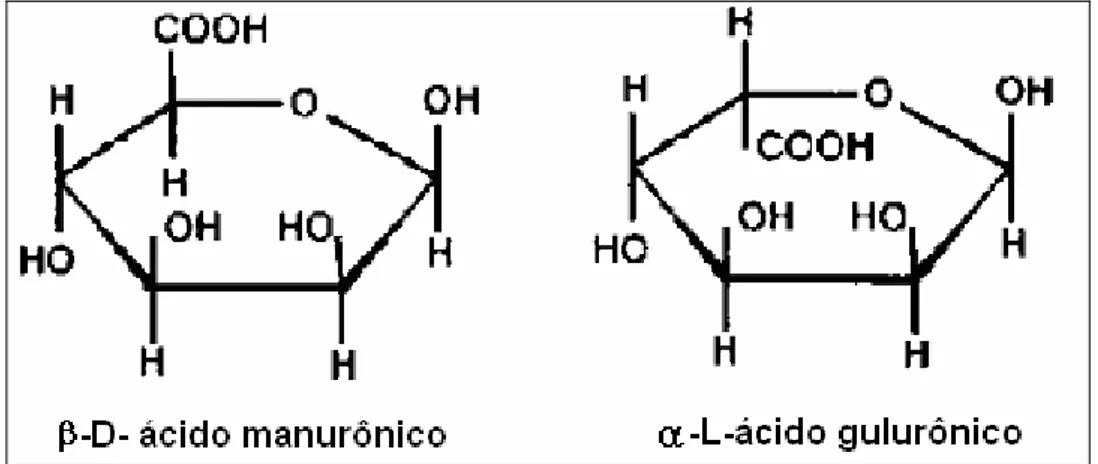
Figura 3. Unidades monoméricas do ácido algínico presente em algas marinhas pardas (FAO, 1987).
8
Figura 4. Unidade dissacarídica repetitiva da heparina (MIKUS et al., 2004).
13
Figura 5. Camarão marinho Litopenaeus vannamei. 21 Figura 6. Alga marinha vermelha Halymenia pseudofloresia. Em
destaque o talo em formato de fita (A) e as regiões dicotômicas em (B).
27
Figura 7. Alga marinha vermelha Halymenia sp. Em destaque o talo foleáceo expandido (A) fixo ao apressório (B).
27
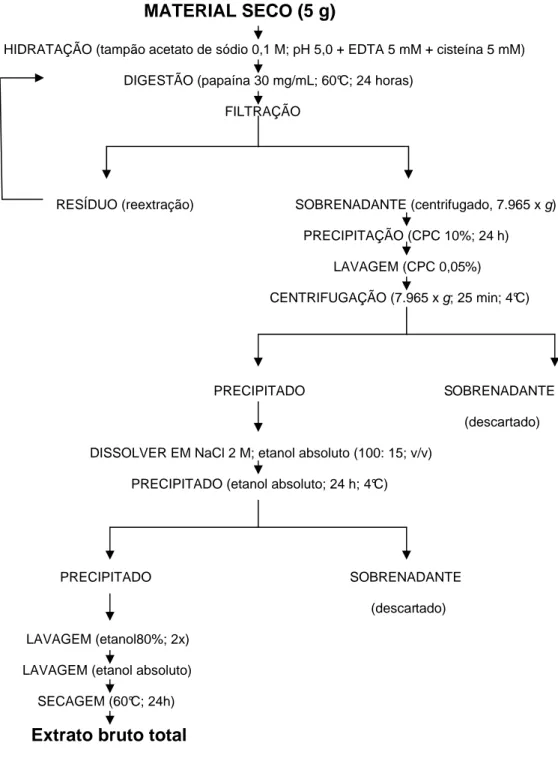
Figura 8. Fluxograma dos procedimentos de extração para a obtenção dos polissacarídeos sulfatados totais.
29
Figura 9. Vista parcial do sistema de aquários utilizado durante o período experimental.
34
Figura 10. Rendimento (%) dos extratos brutos das algas marinhas vermelhas Halymenia sp e H. pseudofloresia, em cada uma das extrações.
38
Figura 11. Cromatografia em DEAE-celulose dos PS, obtidos na 1a (A), 2a (B) e 3a (C) extrações da alga marinha vermelha Halymenia sp.
40, 41
Figura 12. Cromatografia em DEAE-celulose dos PS, obtidos na 1a (A), 2a (B) e 3a (C) extrações da alga marinha vermelha Halymenia pseudofloresia.
F3.
Figura 14. Eletroforese em gel de agarose 0,5% das frações obtidas na 1a e 3a extrações de PS da espécie Halymenia pseudofloresia. Extrato bruto (EB) e as frações F1; F2 e F3.
45
Figura 15. Mortalidade semanal dos camarões Litopenaeus vannamei, por tratamento, durante o período experimental.
Letras diferentes sobre as barras indicam diferenças significativas ao nível de 5%.
50
Figura 16. Biomassa final viva dos camarões Litopenaeus vannamei, por tratamento, ao término do período experimental.
Letras diferentes sobre as barras indicam diferenças significativas ao nível de 5%.
51
Figura 17. Variação da concentração do nitrogênio amoniacal (mg.-L) durante o período de cultivo.
56
Figura 18. Cromatografias em coluna de DEAE-celulose dos extratos brutos obtidos dos camarões e da alga marinha Halymenia pseudofloresia.
58
Figura 19. Eletroforeses em gel de agarose das frações do extrato animal (F1c; F2c e F3c) e da alga marinha Halymenia pseudofloresia (F1a; F2a e F3a).
Página Tabela 1. Atividade anticoagulante (aPTT) das frações de
polissacarídeos sulfatados obtidas das algas vermelhas Halymenia sp e H. pseudofloresia em relação à heparina não fracionada.
ABCC. Associação Brasileira dos Criadores de Camarão. AIDS. Síndrome da Imunodeficiência Adquirida.
aPTT. Tempo de Ativação Parcial da Tromboplastina. CS. Condroitim Sulfato.
DMB. Azul Dimetil Dimetileno. DS. Dermatam Sulfato. EB. Extrato Bruto.
FAO. Organização das Nações Unidas para a Alimentação e Agricultura. KS. Queratam Sulfato.
NHP. Necrose Hepatopancreática. PG. Proteoglicano.
1. INTRODUÇÃO
1.1. Algas marinhas
As algas abrangem um vasto grupo do reino vegetal, as quais são classificadas a partir de suas características fisiológicas e morfológicas, sendo incluídas em uma grande variedade de classes, famílias e gêneros. Esses vegetais exercem papéis importantes no meio ambiente e também servem como fonte de produtos naturais com diversos usos para o homem. BICUDO; BICUDO (1970) reportam que as algas encontram-se organizadas em doze classes, treze divisões e diversos outros grupos menores ainda não totalmente estudados. ROUND (1965) comenta que essas plantas abrangem formas unicelulares sem muita diferenciação, formas coloniais, filamentosas e sifonáceas, bem como, complexos talos parenquimatosos, com tecidos especializados para o desenvolvimento de diversas funções.
Dentre as principais divisões de macroalgas marinhas, podem ser citadas Chlorophyta (verdes), Phaeophyta (pardas ou marrons) e Rhodophyta, essa última representada pelas macroalgas vermelhas. A Chlorophyta está representada por cinco ordens no Brasil, cujas espécies se caracterizam pela presença ou não de filamentos, ocorrência ou não de talo cenocítico, presença de vários pigmentos acessórios (carotenóides) e, por último, tendo o amido como substância de reserva (JOLY, 1965).
quantidades do pigmento acessório fucoxantina e apresentando na sua parede celular celulose, alginato e fucoidina. Como substâncias de reserva podem ser encontradas a laminarina, o manitol e gorduras.
As algas Rhodophyta possuem pigmentos acessórios denominados de ficobilinas, uma substância de reserva denominada de “amido das florídeas”, células reprodutivas femininas arranjadas em uma estrutura especial denominada de carpogônio e gametas masculinos chamados de espermácios (BOLD; WYNNE, 1978). ABBOTT; HOLLENBERG (1976) destacam também que as algas vermelhas são predominantemente marinhas dotadas de uma estrutura multicelular, filamentosa ou pseudoparenquimatosa, com ou sem ramos, podendo ocorrer talos na forma cilíndrica, comprimida ou foliácea e com diversos exemplares microscópicos. Na divisão Rhodophyta são encontradas duas classes de algas marinhas, a Bangiophyceae e a Florideophyceae. A primeira é caracterizada por uma estrutura reprodutiva não muito definida. Já a segunda classe, apresenta um ciclo de vida mais complexo que envolve plantas gametófitas eesporófitas (GRAHAM; WILCOX, 2000).
NORRIS; KUGRENS (1982) relatam que os exemplares dessa divisão podem ser encontrados nos mares tropicais, subtropicais e temperados, com uma ocorrência mais restrita nas regiões boreais e sub-boreais, distribuindo-se desde a zona de marés (zona intertidal e subtidal) até a profundidade de 200m.
1.2. O gênero Halymenia
As algas do gênero Halymenia C. Agardh (1817) são descritas como plantas de talo foleáceo, inteiro ou variavelmente lobulado ou ramificado com consistência gelatinosa ou carnosa flexível, mostrando, em sua estrutura medular, filamentos delgados bem separados em uma camada gelatinosa (TAYLOR, 1960). Esse gênero está distribuído nos mares tropicais, sendo registradas até então 161 espécies (ABBOTT; HOLLENBERG, 1976; WOMERSLEY, 1994).
A sistemática desse gênero ainda é muito contraditória na literatura vigente. Diversos estudos taxonômicos são feitos há décadas a fim de definir seu arranjo ideal dentro da Ficologia. Em uma antiga classificação taxonômica, o gênero participava da extinta ordem Cryptonemiales (VAN DEN HOEK; CORTEL-BREEMANN, 1970; DIXON et al., 1972; WISEMAN, 1977). Essa ordem foi dividida em dois grandes grupos de famílias: o primeiro formado pelas famílias Dumontiaceae, Gloiosiphonaceae, Endocladiaceae, Halymeniaceae e Kallymeniaceae e, o segundo, representado pelas famílias Rhodophyllidaceae, Polyideaceae, Peyssonnelliaceae, Hildenbrandiaceae, Squamariaceae e Choreocolacaceae, sendo esta última, de classificação ainda muito duvidosa (KYLIN, 1956).
JOLY (1965) ainda inclui as famílias Corallinaceae e Grateloupiaceae na ordem Cryptonemiales, sendo a família Grateloupiaceae representada pelos gêneros Cryptonemia, Grateloupia e Halymenia.
Cryptonemiales, os ficologistas resolveram reunir todos os exemplares da antiga e extinta ordem e incluí-los na ordem Gigartinales, pois os critérios de separação eram ainda muito artificiais (GRAHAM; WILCOX, 2000).
1.3. Polissacarídeos sulfatados (PS) de algas marinhas
Os carboidratos são moléculas orgânicas que têm na sua estrutura química o radical poliidroxialdeído ou poliidroxicetonas e ocorrem amplamente em todos os seres vivos, principalmente nos vegetais. Esses compostos podem ser classificados de acordo com o número de unidades de açúcares, ou seja, monossacarídeos, oligossacarídeos (dissacarídeos, trissacarídeos etc) e polissacarídeos, os quais são constituídos por vários resíduos de monossacarídeos unidos por ligações glicosídicas podendo ainda ser lineares ou ramificados. Dentre os polissacarídeos mais comuns, estão celulose, amido, glicogênio e quitina, esse último encontrado em artrópodes (MENEZES, 1991).
Em sua grande maioria, os PS não ocorrem isoladamente. Essas moléculas formam compostos de maior complexidade ligados covalentemente a uma proteína central e denominados de proteoglicanos (PGs) (Figura 1). Nos vertebrados, esses PGs estão representados por açúcares sulfatados chamados de glicosaminoglicanos (GAGs), dos quais os galactosaminoglicanos, condroitim sulfato (CS) e dermatam sulfato (DS), e os glucosaminoglicanos, heparina e ácido hialurônico, são os mais conhecidos (KJELLÉN; LINDAHAL, 1991).
Figura 1. Estrutura de um proteoglicano de mamífero (“agregan”) mostrando a proteína central em azul e as cadeias de condroitim sulfato (CS) e queratam sulfato (KS). Fonte: Glycoword.
Com respeito às algas marinhas, diversos PS já foram isolados e caracterizados. De acordo com PERCIVAL; MCDOWEL (1967), esses açúcares sulfatados estão presentes nas algas marinhas pardas (Phaeophyceae) na forma de fucanas, como galactanas nas algas vermelhas (Rhodophyceae) e, nas algas verdes (Chlorophyceae), os mais comuns são as arabino-galactanas.
origem à matriz celular na qual todo o componente fibrilar encontra-se banhado. Dentre os componentes mucilaginosos mais comuns nas algas pardas estão o ácido algínico e o fucoidam (Figura 2A), galactanas e polímeros de galactose nas algas vermelhas (ágar, carragenana, porfirana, furcelerana e funorana) e resíduos nas algas verdes (D-galactose, D-xilose, D-ácido glucurônico, L-arabinose e L-ramnose) (PAINTER, 1983).
O ágar (Figura 2B) foi o primeiro ficocolóide a ser usado na indústria alimentícia na forma de géis e em diversas outras aplicações industriais, como aditivos em alimentos (SELBY; WYNNE, 1973; MEER, 1980; GLICHSMAN, 1983). É um composto insolúvel em água fria, mas solúvel em água quente, formado de monômeros de galactose. O ágar pode ser extraído de algumas espécies dos gêneros Gelidium, Gelidiella e Gracilaria, e várias outras como Pterocladia capillacea, Ahnpheltia plicata, Acanthopheltis japonica, Ceramium hypnaeordes e C. boydenii, por exemplo (LEVRING et al., 1969).
Assim como o ágar, a carragenana (Figura 2C) também é muito valorizada comercialmente. Esse polímero, altamente sulfatado, detém propriedades aniônicas e hidrofílicas o que permite os mais diferentes usos, como na fabricação de sorvetes, produtos de leite pasteurizado, chocolates, estabilização de emulsificantes, cremes aerossóis etc (GUISELEY et al., 1980).
Figura 2. Estruturas químicas de polissacarídeos sulfatados de algas marinhas: (A) fucoidam; (B) ágar; (C) carragenanas.
Sargassum e Turbinaria são grandes produtoras desse ficocolóide. Os
alginatos podem ser usados como produtos farmacêuticos, em alimentos, na fabricação de papéis etc (HILTON,1969; McNEELY; PETTITT, 1973).
Figura 3. Unidades monoméricas do ácido algínico presente em algas marinhas pardas (FAO, 1987).
A indústria de ficocolóides é um mercado crescente que movimenta anualmente milhões de dólares no mundo. O interesse econômico pelos ficocolóides explica-se pelo fato de eles apresentarem propriedades gelatinizantes e espessantes, o que lhes agrega considerável valor comercial. Algas do gênero Gracilaria, por exemplo, amplamente distribuídas ao redor do mundo, têm como principal ficocolóide o ágar (ADB-FAO, 1983) e, por essa razão, são cultivadas em diversos países para atender a crescente demanda por esse ficocolóide (CHIANG et al., 1981; 1984).
também pode ser usada para fazer sopas, géis, agentes para doces e alimento para cavalos (LEVRING et al., 1969).
O Chile investe significativamente na otimização da capacidade industrial de produção, processamento e estudos científicos de algas marinhas. Esse trabalho é de extrema importância, já que a produção de algas no país é baseada no extrativismo dos estoques naturais e a Gracilaria chilensis é a única espécie de macroalga marinha cultivada para utilização de matéria-prima pelas indústrias chilenas (BUSCHMANN et al., 1995; NORAMBUENA, 1996; BUSCHMANN et al., 2001).
1.4. Atividades biológicas dos polissacarídeos sulfatados
Os PS são polímeros de grande importância comercial, tanto na indústria alimentícia quanto como fonte de novas drogas, já que alguns apresentam atividades biológicas, tais como antibacteriana (JENEY et al., 1997; CHOTIGEAT et al., 2004), antiviral (HAYASHI et al., 1996; TALARICO et al., 2005), antitumoral (WANG et al., 2004; ZHOU et al., 2004), imunoestimulante (VADSTEIN, 1997; MILES et al., 2001; ZHOU et al., 2004), entre outras.
essencial para o desenvolvimento de novas drogas (PEREIRA et al., 1999; FARIAS et al., 2000).
ÂNGULO; LOMONTE (2003) mostraram que o fucoidam, extraído da alga marinha parda Fucus vesiculosus, apresentou uma eficiente atividade citotóxica e miotóxica contra o veneno das serpentes Bothrops asper, Cerrophidion godmani, Atropoides nummifer e Bothriechis schlegelii.
Além das atividades biológicas citadas, várias outras merecem destaque, tais como antiinflamatória, antiproliferativa, antimetastática e antiadesiva. Alguns trabalhos reportam o efeito inibitório do fucoidam, galactanas, ulvanas, arabinanas e mananas contra o vírus do herpes simples tipos I e II (BOISSON-VIDAL et al., 1995; MAZUMDER et al., 2002; TALARICO et al., 2004; ZHOU et al., 2004). PS extraídos das algas Nothogenia fastigiata e Gracilaria corticata (vermelhas) e Sargassum horneri (parda) apresentaram
uma potente atividade contra o vírus do herpes simples tipo I, através da inibição do ancoramento do vírus na célula hospedeira (DAMONTE et al., 1994; HOSHINO et al., 1998; MAZUMDER et al., 2002).
As galactanas sulfatadas extraídas das macroalgas vermelhas Gymnogongrus griffithsiae e Cryptonemia crenulata também apresentaram
atividade antiviral contra o vírus do herpes simples tipos I e II. O mecanismo de ação está relacionado com a inibição da adsorção do vírus na célula-alvo. Além disso, essas galactanas foram eficientes em evitar a infecção viral do herpes tipo II a partir do uso tópico na vagina de roedores (TALARICO et al., 2004).
peroxidação lipídica in vitro revelando uma relação dose-dependente em ensaios in vivo em camundongos.
Os PS extraídos da alga marinha verde Ulva pertusa foram utilizados em testes de atividade anti-hiperlipidêmica. Após a degradação, duas frações de baixo peso molecular foram fornecidas na dieta de ratos durante 21 dias. Os resultados indicaram que esses polímeros, com diferentes pesos moleculares, diminuíram os níveis de lipídios desses animais (YU et al., 2003).
Vários outros estudos também reportam sobre a atividade antitrombótica. MARTINICHEN-HERRERO et al. (2005) relatam o grande desenvolvimento em pesquisas desses polímeros que, além da atividade anticoagulante, possuem efeito antitrombótico. Além disso, os cientistas também abordaram um estudo in vivo realizado com o polímero isolado do líquen, Parmotrena mantiqueirense, através da administração intravenosa em ratos. Os autores concluíram que a dosagem de 0,5 mg/kg de peso corporal representou a dose ótima para inibir a formação de trombos.
Segundo ZHOU et al. (2004), a Rhodophyceae Chondrus ocellatus possui galactanas sulfatadas com atividades antitumoral e imunomodulatória. Esses polissacarídeos foram degradados em frações com diferentes pesos moleculares, e todas apresentaram atividade em maior ou menor grau.
HAYASHI et al. (1996) mostraram que o PS da microalga marinha Spirulina platensis, o “cálcio spirulam”, apresentou uma elevada atividade
antiviral contra os vírus do herpes simples tipo I e da AIDS (HIV-I).
ALVES et al. (1997), trabalhando com ouriço-do-mar das espécies Echinometra lucunter, Arbacia lixula e Lytechinus variegatus, demonstraram
indutora da reação acrossômica em espermatozóides da mesma espécie e não de espécies diferentes. A reação acrossômica acontece quando o espermatozóide encontra o envoltório gelatinoso do óvulo, sendo um passo decisivo para a fusão dos gametas (ALBERTS et al., 1989).
1.4.1. Atividade anticoagulante
O mecanismo de coagulação sanguínea consiste simplesmente na “conversão” do sangue líquido em coágulo. Para que isso ocorra, é necessária a transformação do fibrinogênio solúvel em filamentos insolúveis através de uma complexa interação enzimática (RANG et al., 2001).
A cascata de coagulação sangüínea envolve uma série de reações dependentes da presença de cálcio. Essas reações podem ocorrer em duas vias, a intrínseca, responsável pelo crescimento e manutenção da rede de fibrina, e a extrínseca, dependente de um fator tecidual (DAVIE et al., 1991). A enzima trombina é necessária para a coagulação do sangue, colaborando tanto para formar a rede de fibrina como para ativar outros cofatores importantes (OLSON; BJORK, 1992).
Os componentes chamados de “fatores” estão presentes no sangue na forma de precursores inativos que são ativados por proteólise, promovendo a ativação de uma pequena quantidade de certo fator que catalisa a formação de quantidades maiores do fator seguinte e assim sucessivamente, de modo que a cascata proporciona um mecanismo de amplificação (RANG et al., 2001).
Os anticoagulantes são freqüentemente utilizados no tratamento do sangue durante as práticas de diálises e cirurgias como medicamento para evitar a coagulação intravascular, tromboses decorrentes de diversas doenças e testes in vitro utilizando sangue (TAMADA, 2004).
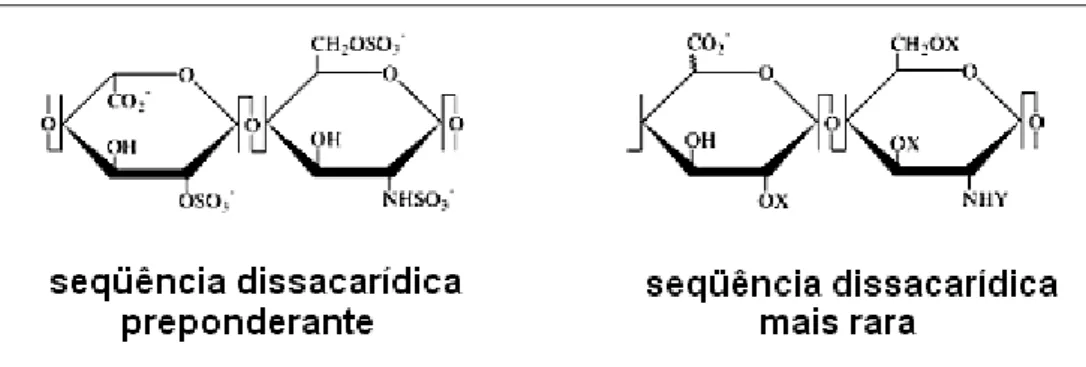
A heparina, polímero heterogêneo da família dos glicosaminoglicanos sulfatados (Figura 4), foi descoberta em 1916. Esse polissacarídeo é um potente anticoagulante extraído do pulmão bovino ou do intestino de suínos, sendo os mais utilizados na clínica médica aqueles de baixo peso molecular (RANG et al., 2001). Além da propriedade anticoagulante, ela também é usada como antitrombótico terapêutico. A heparina consiste em uma cadeia linear de
açúcar formada por unidades dissacarídicas repetitivas alternadas de
α-D-glucosamina e α-L-ácido idurônico (MOURÃO, PEREIRA, 1999).
Figura 4. Unidade dissacarídica repetitiva da heparina (MIKUS et al., 2004).
Para muitos cientistas, tais substâncias podem ser encontradas em algas, peixes, crustáceos, pepinos-do-mar, dentre outros organismos marinhos (TARANTINO, 2005).
O primeiro relato de atividade anticoagulante de um PS de alga marinha foi realizado por CHARGAFF et al. (1936). Em seus experimentos, os cientistas associaram a atividade anticoagulante a uma galactana sulfatada obtida da alga vermelha Iridaea laminarioides. Mais tarde, de acordo com DI ROSA (1972), essa atividade também foi observada em carragenanas extraídas das algas marinhas vermelhas Gigartina accicularis e Chondrus crispus.
Nas algas marinhas, diversas frações de polissacarídeos com atividade anticoagulante têm sido isoladas e caracterizadas, especialmente nas classes Rhodophyceae, como nas carragenanas extraídas de Chondrus crispus, e Phaeophyceae, nas fucanas sulfatadas presentes em Laminaria digitata. Na classe Chlrophyceae, também tem sido reportada em arabino-galactanas nas espécies Codium fragile e C. cylindricum. Nessa última, o efeito anticoagulante foi similar ao da heparina, embora o mecanismo de ação seja diferente (HAWKINS; LEONARD, 1962; GRAUFFEL et al., 1989; ROGERS et al., 1990; MATSUBARA et al., 2001).
FARIAS et al. (2000), avaliando o efeito de galactanas sulfatadas extraídas da alga marinha vermelha Botryocladia occidentalis, constataram que ela apresenta uma potente atividade anticoagulante, inibindo a ação da trombina via antitrombina e cofator II da heparina.
cromatografia em coluna de troca iônica apresentaram uma atividade anticoagulante inferior a da heparina padrão.
HAYAKAWA et al. (2000) relataram a inibição da trombina pelo cofator II da heparina utilizando oito diferentes tipos de PS obtidos de algas marinhas verdes. A atividade anticoagulante desses polímeros foi maior que a obtida com a heparina e com o dermatam sulfato de mamíferos. A inibição mais significante foi encontrada em um PS isolado de uma espécie da ordem Codiales, sugerindo que esses compostos presentes na divisão Chlorophyta ativam primariamente o cofator II da heparina por um efeito distinto do mecanismo alostérico.
Segundo GHOSH et al. (2004), o extrato bruto obtido da alga marinha verde Caulerpa racemosa não apresentou atividade anticoagulante, verificada através do tempo de ativação da tromboplastina (aPTT) e do tempo da trombina (TT), comparados com aqueles obtidos com a heparina padrão.
Invertebrados marinhos (moluscos, equinodermas e ascídias) também possuem PS com atividade anticoagulante. No caso das ascídias, o polímero é denominado dermatam sulfato. Outro PS, o condroitim sulfato fucosilado, isolado do pepino-do-mar Ludwigothuria grisea, também possui atividade anticoagulante e antitrombótica (BURSON et al., 1956; PAVÃO et al., 1998).
1.4.2. Atividade imunoestimulante
adquirida contra patógenos e seus produtos metabólicos sendo estes denominados de antígenos (KUBITZA; KUBITZA, 1999).
A água é essencial à vida no planeta Terra. Além dessa propriedade vital, a água forma diversos ecossistemas que abriga os organismos marinhos, estuarinos ou de água doce. Entretanto, a água também pode ser um veículo de doenças para transmissão de patógenos e parasitas aos animais aquáticos.
Em sistemas intensivos de cultivo de peixes e camarões, por exemplo, a disseminação de organismos causadores de doenças é favorecida por altas densidades de estocagem, maior aporte de matéria orgânica (restos de ração, fezes e urina) e água de abastecimento. Nos organismos cultivados, esses invasores se instalam por via oral (alimentação), pele, brânquias, narinas e ânus, como também por “transmissão vertical” de mãe para filho.
mucosa intestinal dos peixes). Já a imunidade celular é responsável pelo combate às infecções bacterianas crônicas, virais e fúngicas. Para isso, ocorre transformação dos linfócitos em células plasmáticas, as quais darão origem a cinco outros tipos de células formadoras de anticorpos (os linfócitos definidos, os plasmócitos, as células blastos, os macrófagos e os eosinófilos). Algumas células irão adquirir uma “memória imunológica” que intensificarão o combate ao antígeno através de ações fagocíticas (KUBITZA; KUBITZA, 1999).
Em crustáceos, as manifestações de defesa estão associadas a hemolinfa, composta pelos hemócitos (“células sanguíneas”) e pelo plasma (HENNIG et al., 1999). A hemolinfa é transportada para vários órgãos, passando pela estrutura branquial, onde ocorrem as trocas gasosas, e retorna ao coração (NEWMAN; BULLIS, 2001). Durante o processo de defesa, o reconhecimento do corpo invasor se faz necessário e, para desempenhar esse papel, os hemócitos e as proteínas plasmáticas são os principais agentes. Desse modo, moduladores protéicos ligam-se aos componentes presentes na parede da célula microbiana, tais como lipopolissacarídeos, peptidoglicanas e
β-glicanaproteínas. Uma vez aderidas, essas proteínas se ligam à superfície do
hemócito ativando o sistema imune, estimulando a síntese de melanina para a produção de metabólicos tóxicos, resultando então em uma ação antimicrobiana (SRITUNYALUCKSOMA; SODERHALL, 2000). Assim, em crustáceos decápodes, a investigação dos hemócitos sanguíneos tem sido importante nos estudos da ação imunoestimulante (VARGAS-ALBORES, 1995; ROCH, 1999).
coagulação sanguínea e aglutinação celular (SODERHLL; CERENIUS, 1992; SRITUNYALUCKSANA; SODERHALL, 2000), dos quais a atividade fagocítica é o mecanismo de defesa mais comum (KONDO et al., 1998).
A Organização das Nações Unidas para a Alimentação e Agricultura estima que em 2020 mais de 50% da produção de pescado deverão provir da aqüicultura, devido ao grande crescimento da população humana, ao crescente aumento da demanda por pescado e ao declínio ou estagnação da produção proveniente da pesca (FAO, 2002). Por outro lado, muitos países que adotam a aqüicultura intensiva têm sofrido com a destruição da vegetação costeira, salinização do solo e poluição dos cursos d’água adjacentes aos cultivos (PHILLIPS et al., 1993).
Além dessa problemática, a aqüicultura intensiva gera situações adversas para os organismos cultiváveis, que podem ser de natureza química, física e/ou biológica. Devido ao grande crescimento da carcinicultura no mundo, surgiram diversas doenças de origem bacteriológica ou viral, limitando a expansão do cultivo de camarão marinho. Várias estratégias visam minimizar este impacto na produção, tais como a redução da densidade de estocagem e o melhoramento no manejo alimentar das pós-larvas. Além disso, essas estratégias atualmente vêm sendo combinadas com o uso de uma grande variedade de imunoestimulantes (VADSTEIN, 1997; HAUTON; SMITH, 2004).
antibióticos que favorece a seleção da microbiota e o acúmulo de resíduos químicos nos organismos dos animais (COOK et al., 2003).
A fim de promover o controle de doenças nos cultivos intensivos de peixes e camarões, muitos cientistas sugerem o uso de imunoestimulantes. SAKAI (1999) relata que diversos compostos são utilizados como
imunoestimulantes, tais como β-glucanos, quitina, lactoferrina e levamisol. Dentre esses compostos, também podem ser citados os fatores nutricionais, tais como as vitaminas B e C, o hormônio do crescimento e a prolactina. Ultimamente, diversas substâncias com efeitos no sistema imune como agentes bacteriológicos, químicos e extratos de plantas e animais têm sido estudadas com o objetivo de controlar doenças.
Vários PS extraídos de algas marinhas já foram descritos como agentes imunoestimulantes. Nesse sentido, estudos com o extrato bruto do fucoidam extraído da alga marinha parda Sargassum polycystum revelaram que esse polímero pode reduzir o impacto causado pela síndrome do vírus da mancha branca no camarão Penaeus monodon. De acordo com a pesquisa, após a inclusão do PS na dieta dos camarões, foi observado um aumento significativo na taxa de sobrevivência. O extrato bruto do fuicodam, administrado por via oral aos camarões, foi capaz de inibir o crescimento do Vibrio harveyi, Staphylococcus aureus e Escherichia coli (CHOTIGEAT et al., 2004).
A prevenção do estresse em truta arco-íris, Oncorhynchus mykiss, foi
cortisol, glicose, proteína total e composição da população de leucócitos do sangue. Depois desse período, foram observados níveis elevados de cortisol e glicose no plasma em todos os grupos tratados com β-glucano, indicando que a
administração de pequenas doses, antes do transporte, pode ajudar a prevenir os efeitos negativos do estresse(JENEY et al., 1997).
CAMPA-CÓRDOVA et al. (2002) avaliaram os efeitos do β-glucano e de
um PS extraído de uma microalga cianofícea, usados em banhos de imersão de juvenis do camarão, Litopenaeus vannamei, por 1, 3 e 6 horas. Os pesquisadores concluíram que esses polímeros apresentaram atividade
imunoestimulante, sendo que o PS foi 500 vezes mais potente do que o β -glucano (não sulfatado), após 6 horas de imersão.
A atividade imunoestimulante da alga marinha Macrocystis pyrifera foi avaliada após sua adição na ração para a alimentação de camarões. Segundo RIVERA et al. (2002), após 25 dias, as dietas compostas com 15 e 20% de farinha de algas estimularam o consumo alimentar desses animais.
HUANG et al. (2006) reportaram o uso oral do extrato bruto obtido da alga marinha parda Sargassum fusiforme. Os resultados mostraram que, após 30 dias os camarões, Fenneropenaeus chinensis, infectados com Vibrio harveyi, se tornaram resistentes ao patógeno.
1.5. Produção de camarão marinho, Litopenaeus vannamei, no Brasil e no mundo
pode ser explicada pelo fato de eles possuírem alto valor nutritivo, admirável sabor e excelentes produções em cativeiro, levando a uma boa cotação no mercado consumidor e respeito perante as comunidades científica e produtora (MENDES, 1992).
O camarão marinho Litopenaeus vannamei (Boone, 1931) (Figura 5), tem uma distribuição geográfica que se estende da costa do Panamá até Tumbes, norte do Peru (PEREZ FARFANTE; KENSLEY, 1997). Atualmente essa espécie é cultivada em todos os países do mundo ocidental. Altas produtividades, taxa de crescimento uniforme, fácil adaptabilidade, porte razoável, reprodução satisfatória em laboratório e condições climáticas favoráveis levaram o Brasil a cultivar esse crustáceo (PLATAFORMA TECNOLÓGICA DO CAMARÃO MARINHO CULTIVADO, 2001).
Figura 5. Camarão marinho Litopenaeus vannamei.
Nos últimos 15 anos, a atividade de cultivo de camarão tem se intensificado, principalmente, na costa tropical e subtropical ao redor do mundo. Como conseqüência dessa expansão, a produção mundial de L. vannamei cultivado em 2003 chegou a 1.630.000 t, com os países orientais respondendo por 83,4% do volume produzido, e, os ocidentais, por apenas 16,6%.
O Brasil contribuiu com aproximadamente 90.190 t em 2003, sendo referência de produção no Hemisfério Sul e ocupando o sexto lugar no “ranking” mundial, com o Rio Grande do Norte e Ceará, respondendo por 96,5% do volume total (ROCHA; RODRIGUES, 2004). O censo realizado pela Associação Brasileira de Criadores de Camarão (ABCC) sobre o perfil da carcinicultura brasileira, no final de 2002 e início de 2003, demonstrou um ritmo acelerado de crescimento, com aumento de 34% no número de produtores e 29% da área de viveiros em produção. O aumento da produção nacional chegou em torno de 50% com produtividade média de 5.458 kg/ha/ano destacando-se, mais uma vez, os estados do Rio Grande do Norte e Ceará, com 30,77 e 27,25% da produção total do camarão marinho L. vannamei, respectivamente (ROCHA; RODRIGUES, 2003).
“antidumping” promovida pelos Estados Unidos, o que fez cair bastante seu preço no mercado internacional.
Para os produtores do Rio Grande do Norte, o setor enfrenta a pior crise desde 1992. Em 2005, as exportações tiveram redução de 17% no Estado, somando-se apenas US$ 57,3 milhões, bem diferente do cenário de 2004, ano em que o setor comercializou cerca de US$ 82,6 milhões no mercado internacional (MERCADO DA PESCA, 2006).
Recentemente, a União Européia estabeleceu uma outra barreira ao pescado brasileiro. Por meio de medidas sanitárias, os veterinários europeus decidiram exigir testes mais rigorosos aos produtos nacionais diante das condições inadequadas das exportações das carnes brasileiras (MERCADO DA PESCA, 2006).
Dentre as doenças viróticas que agridem a saúde do camarão destacam-se a necrose hepatopancreática (NHP), a mionecrose infecciosa (NIM) e a mancha branca (WSSV).
totalmente esbranquiçada e reduzida com túbulos lesionados (NUNES; MARTINS, 2002).
A NIM, até então desconhecida, surgiu nas carciniculturas do Nordeste brasileiro atingindo a indústria de camarão com prejuízos de aproximadamente US$ 20 milhões em 2003 (BUCHELI et al., 2004; NUNES et al., 2004). As evidências até agora apontam para o desequilíbrio ambiental, provocado pelas alterações do meio aquático e da modificação da flora e fauna planctônicas, resultando em alterações físico-químicas ocasionadas pelas precipitações pluviométricas ocorridas em curto espaço de tempo no ano de 2004 (FONSECA; CARVALHO, 2004).
Os primeiros registros de incidência do WSSV datam dos anos 90, nos países do Nordeste asiático. A partir de então, a virose rapidamente se espalhou em diferentes países da América Central (Nicarágua, Honduras e Panamá). O diagnóstico da doença envolve alterações macroscópicas, através da observação de manchas esbranquiçadas sob o exoesqueleto, sendo bem mais facilmente reconhecíveis no camarão negro Penaeus monodon. No camarão L. vannamei, manchas brancas cuticulares podem ou não ser vistas facilmente ao olho nu. Segundo os produtores, a idade para o aparecimento do vírus se dá entre PL20 – PL21, apresentando como sintomas: camarões letárgicos, corpo com coloração rosada ou pardo-avermelhado, mortalidade de até 100% nos primeiros 3 a 10 dias após a exibição dos sinais clínicos, acúmulo de camarões no fundo do viveiro e manchas brancas variando de 0,5 a 2,0 mm de diâmetro no interior do exoesqueleto (NUNES; MARTINS, 2002).
foi em Santa Catarina, o que causou muita preocupação por parte do setor produtivo daquele estado (JURGENFELD, 2005).
No Ceará, técnicos do Instituto de Ciências do Mar (LABOMAR) da Universidade Federal do Ceará diagnosticaram a presença do DNA do vírus causador da WSSV em junho de 2005. O primeiro município cearense que revelou a presença da virose foi Aracati na região do Vale do Jaguaribe (O POVO, 2005).
Tendo em vista que o surgimento dessas doenças causou um grande impacto nas produções de camarão tanto em nível mundial como nacional, estratégias que visem tornar esse animal mais resistente às enfermidades são extremamente importantes. Desta forma, a imunoestimulação aliada a um bom manejo ambiental podem contribuir de maneira significativa para a reestruturação do setor.
O objetivo presente trabalho foi avaliar a atividade anticoagulante de galactanas sulfatadas extraídas das algas marinhas vermelhas Halymenia sp e Halymenia pseudofloresia C. Agardh, 1817 (Gigartinales), bem como, avaliar o
2. MATERIAIS E MÉTODOS
2.1. Coleta e identificação das algas marinhas
A coleta das espécies, Halymenia pseudofloresia e Halymenia sp. (Gigartinales, Rhodophyta), foi realizada na Praia de Fleixeiras, no município de Trairí/CE, em julho de 2005, a partir de exemplares arribados na zona entre-marés. Logo após a coleta, as algas foram acondicionadas em sacos plásticos e conduzidas ao laboratório de Bioquímica Marinha, do Departamento de Engenharia de Pesca da Universidade Federal do Ceará.
A espécie Halymenia pseudofloresia (Figura 6) pode ser encontrada nas Ilhas do Atlântico (TAYLOR, 1960), na América do Sul (GANESAN, 1990) e nas Ilhas Caribenhas (LITTLER; LITTLER, 2000). A alga apresenta talo cheio de lóbulos contendo membranas gelatinosas, de formato geralmente irregular, podendo atingir de 7 a 36 cm de comprimento. Na estrutura interna há presença de filamentos dispersos na camada medular (TAYLOR, 1960). Macroscopicamente, seu talo se caracteriza por apresentar um formato de fita de largura variável, com ramificação dicotômica na grande maioria de seus ramos e de textura bastante lisa, fixo no substrato por um apressório basal.
Figura 6. Alga marinha vermelha Halymenia pseudofloresia. Em destaque o talo em formato de fita (A) e as regiões dicotômicas (B).
Figura 7. Alga marinha vermelha Halymenia sp. Em destaque o talo foleáceo expandido (A) fixo ao apressório (B).
2.2. Extração dos polissacarídeos sulfatados
Inicialmente, 5 g de alga seca e triturada foram hidratados com 250 mL de tampão acetato de sódio 0,1 M, pH 5,0 + cisteína 5 mM e EDTA 5mM.
Em seguida, foram adicionados 17 mL de uma solução de papaína bruta (30 mg/mL), sendo a mistura incubada em banho-maria a 60°C por 24 horas. Após esse período, o material foi filtrado, centrifugado (7.965 x g; 25 min; 4ºC)
(A)
(B)
e, ao sobrenadante, foram adicionados 16 mL de cloreto de cetilpiridínio (CPC) a 10% para a precipitação dos polissacarídeos presentes na mistura por, no mínimo, 24 horas à temperatura ambiente.
Logo após a precipitação, os PS foram lavados com 500 mL de CPC 0,05% sendo, em seguida, dissolvidos em 174 mL de cloreto de sódio 2 M : etanol absoluto (100:15;v/v) em banho-maria a 60°C e s ubmetidos a uma nova precipitação por, no mínimo, 24 horas a 4°C, através da adição de mais 305 mL de etanol absoluto.
MATERIAL SECO (5 g)
HIDRATAÇÃO (tampão acetato de sódio 0,1 M; pH 5,0 + EDTA 5 mM + cisteína 5 mM)
DIGESTÃO (papaína 30 mg/mL; 60°C; 24 horas)
FILTRAÇÃO
RESÍDUO (reextração) SOBRENADANTE (centrifugado, 7.965 x g)
PRECIPITAÇÃO (CPC 10%; 24 h)
LAVAGEM (CPC 0,05%)
CENTRIFUGAÇÃO (7.965 x g; 25 min; 4°C)
PRECIPITADO SOBRENADANTE
(descartado)
DISSOLVER EM NaCl 2 M; etanol absoluto (100: 15; v/v)
PRECIPITADO (etanol absoluto; 24 h; 4°C)
PRECIPITADO SOBRENADANTE
(descartado)
LAVAGEM (etanol80%; 2x)
LAVAGEM (etanol absoluto)
SECAGEM (60°C; 24h)
Extrato bruto total
2.3. Fracionamento dos polissacarídeos sulfatados em coluna de troca iônica
Os extratos brutos (EB) obtidos nas várias extrações foram fracionados em coluna de DEAE-celulose (6,5 cm x 1,5 cm) acoplada a um coletor de frações, a fim de separar os PS. A coluna foi, inicialmente, equilibrada com tampão acetato de sódio 0,1 M, pH 5,0 + cisteína 5 mM e EDTA 5mM. Em seguida, foi aplicado no topo do gel 1,0 mL deuma solução de 4 mg/mL de EB sendo o fluxo da coluna ajustado para 60 mL/h. A eluição dos PS presentes no EB foi realizada passo a passo, utilizando soluções com diferentes concentrações de NaCl (0,25; 0,50; 0,75; 1,0; 1,25; 1,50; 1,75 e 2,0 M), preparadas no mesmo tampão de equilíbrio. Durante a eluição da coluna, foram coletadas frações de 1 mL e a presença dos PS foi evidenciada através
da reação metacromática. Para isso, 200 μL de cada fração foram misturados
com 1 mL de azul-dimetil-dimetileno (DMB) para a leitura da absorbância em espectrofotômetro, no comprimento de onda de 525 nm.
2.4. Teste de Dubois
A presença de açúcar nas frações obtidas da coluna de troca-iônica foi detectada de acordo com a metodologia proposta por DUBOIS et al. (1956). O
teste foi realizado em duplicata utilizando amostras de 50 μL de solução do
polissacarídeo, as quais foram incubadas por 30 minutos com 350 μL de água
Após 30 minutos de incubação, as amostras foram levadas ao espectrofotômetro para a leitura da absorbância em 490 nm.
2.5. Eletroforese em gel de agarose
As frações contendo os PS foram reunidas, dialisadas exaustivamente contra água destilada e concentradas por liofilização. Em seguida, foram submetidas à eletroforese em gel de agarose 0,5% em tampão
propilenodiamino (0,05 M; pH 9,0). Cerca de 10 μL de cada fração (1mg/mL)
foram aplicados no gel e a corrida foi realizada em voltagem constante (110V) durante 60 minutos. Após a corrida, os PS presentes no gel foram fixados com uma solução de cetavlon 0,1% por 24 horas. Em seguida, o gel foi corado com azul de toluidina 0,1%, preparado a partir de 100 mL da solução descorante por 24 horas, e, finalmente, descorado com uma solução de etanol absoluto, água destilada e ácido acético glacial (49,5:49,5:1, v/v/v).
2.6. Atividade anticoagulante
A avaliação da atividade anticoagulante foi realizada pelo teste do aPTT (tempo de ativação parcial da tromboplastina) segundo ANDERSSON et al. (1976), utilizando plasma citratado de coelho; o tempo de coagulação foi determinado em um coagulômetro (Drake, modelo Quick-timer).
Primeiramente, o sangue de coelho foi centrifugado (73,75 x g; 15 min) para a obtenção de um plasma pobre em plaquetas. Para a realização do teste,
cefalina ativada e 5 μL de solução de PS. Após a incubação, foram adicionados
50 μL de cloreto de cálcio 0,025 M à mistura para ativar a cascata de
coagulação. Os testes foram realizados em duplicata, sendo o tempo de coagulação determinado automaticamente pelo coagulômetro. A atividade anticoagulante foi expressa em unidades internacionais por mg (UI/mg) utilizando um padrão de heparina (100 UI/mg).
2.7. Efeito imunoestimulante
O efeito imunoestimulante dos PS obtidos da alga marinha vermelha H. pseudofloresia foi avaliado in vivo, utilizando camarões da espécie L. vannamei (Boone, 1931).
2.7.1. Aquisição e manejo dos camarões Litopenaeus vannamei
Aproximadamente 500 exemplares adultos do camarão marinho, L. vannamei, aclimatados em água doce e com peso médio de 8,187 g, foram doados pela Fazenda Dú Vale, localizada no município de Jaguaruana/CE, distante aproximadamente 140 km de Fortaleza.
Na fazenda, os camarões foram coletados, estocados em sacos plásticos (40 indivíduos/saco) contendo oxigênio dissolvido e acondicionados em caixas de papelão forradas com isopor. Posteriormente, os camarões foram transportados, durante 3 horas, até o Laboratório de Aqüicultura do Departamento de Engenharia de Pesca da Universidade Federal do Ceará.
contendo 38 L de água doce, na densidade de 0,3 camarões/L. Após a estocagem, os animais permaneceram sob observação durante uma semana para que se recuperassem do estresse causado pelo transporte. Durante esse período, foram realizadas, diariamente (8 e 16 h), duas trocas parciais de 25% da água de cada aquário por sifonamento, sendo também retirados restos de ração e dejetos dos animais. Além disso, foram também realizados ajustes no sistema de aeração e a alimentação foi fornecida, ad libitum, em duas refeições diárias, utilizando ração com 35% de proteína bruta. Esse mesmo manejo foi mantido durante o período experimental.
2.7.2. Preparação das soluções de polissacarídeos sulfatados
Os PS totais, obtidos a partir do extrato bruto da espécie H. pseudofloresia, foram utilizados em testes de imersão. Para isso, foram preparadas três diferentes doses a fim de se obter concentrações finais de
0,5 μg.L-1, 1,5 μg.L-1 e 1,0 mg.L-1 na água de cultivo dos camarões.
Inicialmente, os PS foram dissolvidos em um pequeno volume de água destilada e, em seguida, as referidas soluções foram adicionadas, diariamente, nos respectivos tratamentos.
2.7.3. Procedimento experimental
O experimento constou de quatro tratamentos com três repetições cada, sendo o controle sem a adição do PS, e mais três tratamentos contendo PS
nas concentrações 0,5 μg.L-1, 1,5 μg.L-1 e 1,0 mg.L-1. As diferentes doses
alimentados e a aeração desligada por 1 hora. O experimento teve duração de 20 dias, sendo 15 dias de administração dos PS e 5 dias de indução de estresse, quando trocas parciais de água foram suspensas (Figura 9).
Figura 9. Vista parcial do sistema de aquários utilizado durante o período experimental.
Ao final do experimento, os animais foram contados, pesados e sacrificados, sendo então congelados em freezer. A pesagem foi realizada utilizando uma balança semi-analítica com precisão de 0,01g, (GEHAKA, modelo BG 400).
2.7.4. Análises físico-químicas
O pH foi determinado com o auxílio de um medidor de pH de bancada
(Marconi, MAPA 200) com precisão de ± 0,005 pH em duas amostras de água
coletadas, semanalmente, de cada tratamento.
A temperatura (ºC) e a concentração de oxigênio dissolvido (mg.L-1) da água foram determinadas com o auxílio de um oxímetro digital de sonda polarográfica estável, modelo YSI F-1550A, com precisão de ± 0,3°C para a
temperatura e ± 2% de ar saturado ou 2% de leitura.
A amônia foi determinada através do método de Nessler, a partir de duas amostras de água de cada tratamento, coletadas semanalmente. Esse método está baseado no fato de que, o nitrogênio amoniacal solúvel contido na amostra, na presença do reagente de Nessler forma uma coloração amarela que será tão intensa quanto maior for a presença de amônia. Assim, amostras de 25 mL receberam 3 gotas de um estabilizante mineral, 3 gotas de álcool polivinil e 1 mL do reagente de Nessler. Em seguida, a mistura foi agitada e deixada em repouso por 1 minuto, até que uma coloração amarelada se formasse, indicando a presença do nitrogênio amoniacal na amostra. Um branco foi preparado utilizando os mesmos reagentes em 25 mL de água destilada. Após o repouso, a amostra foi levada a um espectrofotômetro (Hach Company, modelo DR/2000) para a leitura da absorbância em um comprimento de onda de 425 nm, sendo a concentração de amônia expressa em mg.L-1.
2.8. Análises estatísticas
(ANOVA) com fator único e teste t não-pareado para médias. Para todos os testes, foi adotado um nível de significância de 5%.
2.9. Extração dos polissacarídeos sulfatados dos camarões
A extração de PS foi realizada em dois diferentes grupos de camarões, um que não foi exposto aos PS (controle) e outro que recebeu a maior dose de PS (1 mg.L-1). Para isso, três indivíduos de cada grupo foram descabeçados e descascados, sendo separada apenas a parte muscular. Em seguida, o músculo foi lavado com uma pequena quantidade de água destilada e levado para secagem em estufa a 40°C durante 24 horas.
A extração foi realizada a partir do material seco (1,2 g), o qual foi cortado e depois hidratado com 100 mL de tampão acetato de sódio 0,1 M, pH 5,0 + cisteína 5 mM e EDTA 5mM. Em seguida, foram adicionados 10% de papaína bruta, sendo a mistura incubada em banho-maria a 60°C por 24 horas. Após esse período, o material foi filtrado em tela fina, centrifugado (7.965 x g; 30 min; 4°C) e, ao sobrenadante, fora m adicionados 4 mL de cloreto de cetilpiridínio (CPC) a 10% para a precipitação dos PS presentes na mistura por 72 horas à temperatura ambiente.
Em seguida, o material foi centrifugado (7.965 x g; 30 min; 4°C) e submetido a duas lavagens com 120 mL de etanol a 80% e uma com 75 mL de etanol absoluto. Após essa etapa, os PS foram então levados à estufa a 60°C, por um período de 48 horas para secagem e obtenção do extrato bruto.
2.10. Fracionamento dos polissacarídeos sulfatados em coluna de troca iônica
Os PS presentes no extrato bruto, obtidos dos camarões, foram fracionados em uma coluna de toca iônica DEAE-celulose de acordo com a metodologia já descrita no item 2.3 (Página 30).
2.11. Eletroforese em gel de agarose
3. RESULTADOS E DISCUSSÃO
3.1. Extração dos polissacarídeos sulfatados
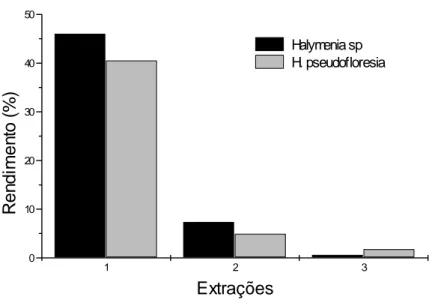
No total, foram realizadas três extrações de cada espécie de alga e os resultados mostraram que os rendimentos dos extratos brutos foram significativos e semelhantes, sendo de 53,96% para a espécie Halymenia sp e de 47,14% para a espécieH. pseudofloresia, considerando todas as extrações. Além disso, a maior quantidade de PS foi obtida durante as primeiras extrações das duas algas, sendo decrescente nas demais (Figura 10).
1 2 3
0 10 20 30 40 50
R
e
n
d
im
e
n
to
(
%
)
Extrações
Halymenia sp H. pseudofloresia
Figura 10. Rendimento (%) dos extratos brutos das algas marinhas vermelhas Halymenia sp e H. pseudofloresia, em cada uma das três extrações.
obtidos das algas vermelhas Solieria filiformis (PONTES, 2005) e Champia feldimannii (TORRES, 2005) resultaram, respectivamente, em rendimentos de 46,8% e 36,2%. Já em algas da divisão Chlorophyta, as espécies Caulerpa racemosa (RODRIGUES, FARIAS, 2005) e C. sertularioides (BEZERRA-NETO,
2005) perfizeram 13,0 e 7,1%, respectivamente. Como é possível observar, existe uma grande variação nos rendimentos de PS extraídos de algas marinhas devido, tanto ao emprego de diferentes metodologias de extração como a utilização de diferentes espécies(CHOTIGEAT et al., 2004).
Segundo PONTES (2005), o maior rendimento de PS da alga marinha vermelha Solieria filiformis foi obtido na 1a extração, sendo decrescente nas demais, semelhante ao encontrado para as algas Halymenia sp e H. pseudofloresia, utilizadas neste trabalho. Por outro lado, o aumento ou diminuição do rendimento no decorrer das extrações depende da espécie de alga utilizada. TORRES (2005) afirma que os rendimentos obtidos da alga vermelha C. feldimannii aumentaram a partir da 1a extração. Este comportamento também foi observado por PEREIRA (2006) e ALENCAR (2006)após estudos com duas espécies da divisão Phaeophyta, sendo uma do gênero Sargassum e outra do gênero Lobophora.
3.2. Fracionamento dos polissacarídeos sulfatados em DEAE-celulose
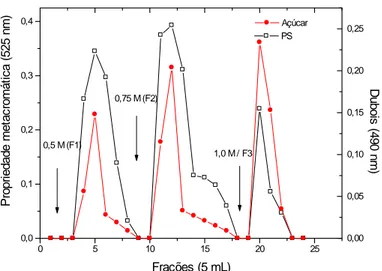
extrações só foram obtidas três frações (F1, F2 e F3), não sendo eluída nenhuma fração com 1,25 M de NaCl (F4). Entretanto, as frações F1 (2a extração) e F1 e F2 (3a extração) foram as que apresentaram as maiores metacromasias dentre todas as extrações. Além disso, a metacromasia das frações aumentou no decorrer das extrações.
0 5 10 15 20 25 30 35 40 45
0,00 0,05 0,10 0,15 0,20 0,25 0,30 0,35
Frações (5 mL)
P ropr iedade m et ac rom á ti c a (525 n m ) PS 0,00 0,02 0,04 0,06 0,08 0,10 0,12
1,025M / F4 1,0 M / F3
0,75 M / F2
0,5 M / F1
D u bo is ( 4 9 0 nm) Açúcar
0 5 10 15 20 25 30 35
0,00 0,05 0,10 0,15 0,20 0,25
Frações (5 mL)
P ropr ieda de m et ac rom át ic a ( 525 nm ) PS 0,00 0,05 0,10 0,15 0,20 0,25 0,30
1,0 M / F3 0,75 M / F2
0,5 M / F1 D
0 5 10 15 20 25 0,0 0,1 0,2 0,3 0,4
Frações (5 mL)
P ro p ri ed ad e met a c ro m á ti c a ( 5 25 n m ) PS 0,00 0,05 0,10 0,15 0,20 0,25
1,0 M / F3 0,75 M (F2)
0,5 M (F1)
D u bo is ( 4 90 nm ) Açúcar
Figura 11. Cromatografia em DEAE-celulose dos polissacarídeos sulfatados, obtidos na 1a (A), 2a (B) e 3a (C) extrações da alga marinha vermelha Halymenia sp.
Com relação à espécie H. pseudofroresia, na 1a extração foram obtidas cinco frações eluídas com 0,5 (F1); 0,75 (F2); 1,0 (F3); 1,25 (F4) e 1,50 M (F5) de NaCl, das quais a fração eluída com 0,5 M (F1) foi a que apresentou a maior metacromasia (Figura 12). Na 2a extração foram obtidas apenas as frações F1, F2, F3 e F4 e, na 3a extração, apenas as frações F1, F2 e F3. Além disso, nessas últimas extrações, a fração eluída com 0,75 M de NaCl (F2) foi a mais metacromática, sendo a maior diferença observada na 2s extração. Mais uma vez, foi observado um aumento significativo na atividade metacromática das frações (F1, F2 e F3) no decorrer das extrações.
0 10 20 30 40 0,00 0,05 0,10 0,15 0,20 0,25 0,30 0,35
Frações (5 mL)
P rop ri e dad e met a c romát ic a ( 5 2 5
nm) PS
0,0 0,1 0,2 0,3 0,4
1,5 M / F5 1,25 M / F4
1,0 M / F3 0,75 M / F2
0,5 M / F1
D ubo is ( 4 90 nm) Açúcar
0 5 10 15 20 25 30 35
0,00 0,05 0,10 0,15 0,20 0,25
Frações (5 mL)
P ropr iedade m e ta c rom át ic
a (525 nm
) PS 0,00 0,05 0,10 0,15 0,20 0,25
1,025M / F4 1,0 M / F3
0,75 M / F2
0,5 M / F1
D uboi s ( 490 nm ) Açúcar
0 5 10 15 20 25 30
0,0 0,1 0,2 0,3 0,4 0,5
Frações (5 mL)
P ropr ie dade m et ac rom át ic a ( 52
5 nm) PS
0,00 0,05 0,10 0,15 0,20 0,25 0,30
1,0 M / F3 0,75 M (F2)
0,5 M (F1)
D ub oi s ( 490 nm) Açúcar
Figura 12. Cromatografia em DEAE-celulose dos polissacarídeos sulfatados, obtidos na 1a (A), 2a (B) e 3a (C) extrações da alga marinha vermelha Halymenia pseudofloresia.
(A)
(B)
Dessa forma, foram constatadas diferenças marcantes nos perfis cromatográficos obtidos das diferentes extrações de ambas as espécies estudadas, principalmente no tocante à quantidade de frações obtidas e intensidade da atividade metacromática. Resultados semelhantes foram obtidos com os PS das algas marinhas verdes Caulerpa sertularioides e C. racemosa, e da alga vermelha Solieria filiformes, quando também foram
observadas diferenças significativas entre os perfis cromatográficos obtidos pela coluna de DEAE-celulose, durante o processo de extrações sucessivas (BEZERRA-NETO, 2005; PONTES, 2005; RODRIGUES; FARIAS, 2005).
3.3. Eletroforese em gel de agarose
1a extração
EB F1 F2 F3 3a extração
EB F1 F2 F3
Figura 13. Eletroforeses em gel de agarose 0,5% das frações obtidas na 1a e 3a extrações de polissacarídeos sulfatados da espécie Halymenia sp. Extrato bruto (EB) e frações F1, F2 e F3.
Comportamento muito parecido também foi observado nas eletroforeses dos PS extraídos nas 1a e 3a extrações da espécie H. pseudofloresia (Figura 14), principalmente, no tocante à variação no grau de purificação das frações. Uma diferença significativa com relação à espécie Halymenia sp, foi o aparecimento de duas bandas no extrato bruto obtido da 3a extração. As duas bandas obtidas no extrato bruto diferem entre si, claramente, pela densidade
+
-
+
de cargas, sendo uma mais carregada que a outra. O desaparecimento de uma das bandas nas frações pode ser explicado pela falta de interação com a coluna de troca iônica, já que praticamente não é carregada, pois quase não migrou no gel.
1a extração
EB F2 F3 F4 F5 3a extração
EB F1 F2 F3
Figura 14. Eletroforeses em gel de agarose 0,5% das frações obtidas na 1a e 3a extrações de polissacarídeos sulfatados da espécie Halymenia pseudofloresia. Extrato bruto (EB) e frações F1, F2, F3, F4 e F5.
+
+
-
O fato de se obter bandas mais definidas na eletroforese de frações obtidas, a partir da reextração de PS de algas marinhas, pode indicar que o grau de complexidade dessas moléculas talvez esteja diminuindo no decorrer das extrações, o que pode ser bastante útil para a caracterização estrutural desses compostos, já que estas moléculas são muito complexas e heterogêneas (FARIAS et al., 2000).
3.4. Atividade anticoagulante (aPTT)
A Tabela 1 mostra o tempo de ativação da tromboplastina (aPTT) em segundos e a atividade anticoagulante das frações, obtidas das algas marinhas vermelhas, expressa em Unidades Internacionais UI.mg-1, tendo como referência um padrão de heparina não-fracionada (100 UI.mg-1).
De uma maneira geral, a espécie H. pseudofloresia apresentou frações com maior atividade anticoagulante. As frações mais ativas foram obtidas na 1a extração, sendo maior a F4, eluída com 1,25 M de NaCl, seguida da F2 (0,75 M) e da F3 (1,0 M), cujas atividades foram 464,2; 211,6 e 103,5 UI.mg-1, respectivamente. Como é possível observar, a fração F4 foi, pelo menos, 4,6 vezes mais potente que o padrão de heparina utilizado, prolongando o tempo de coagulação do plasma de coelho em, no mínimo, 9 vezes.
Tabela 1. Atividade anticoagulante (aPTT) das frações de polissacarídeos sulfatados obtidas algas vermelhas Halymenia sp e Halymenia pseudofloresia em relação a heparina não fracionada.
Espécies Extrações Frações UI.mg-1 aPTT (s) T1/T0
F1 54,1 28,0 1,05
F2 110,4 57,1 2,14
F3 79,6 41,2 1,54
1a
F4 98,8 51,1 1,91
F1 58,2 30,1 1,13
F2 143,1 74,0 2,77
Halymenia sp
3a
F3 73,6 38,1 1,43
F2 211,6 109,4 4,10
F3 103,5 53,5 2,00
F4 464,2 240,0 9,00 1a
F5 101,7 52,6 1,97
F1 137,1 70,9 2,66
F2 96,5 49,9 1,87
H. pseudofloresia
3a
F3 89,2 46,1 1,73
Heparina - Não-fracionada 100,0 51,7 1,94
Tempo (s) controle
do plasma de coelho - - - 26,7 1,00
Neste trabalho, foram observadasdiferenças na atividade anticoagulante das frações obtidas de diferentes extrações, bem como entre as duas espécies de algas testadas.
vezes, sendo muito superior as demais que prolongaram, no máximo, 1,8 vezes o referido tempo. Desta forma, durante o processo de extrações sucessivas, é possível extrair PS distintos, com atividades biológicas diferenciadas, possivelmente situados em diferentes camadas do tecido algal.
TORRES (2005) também observou a presença da atividade anticoagulante em PS da alga marinha vermelha Champia feldimannii. As frações eluídas na 4a extração com 1,2 M (F4) e 1,4 M (F5) de NaCl tiveram seus tempos de aPTT prolongados cerca de 6,4 e 4,8 vezes, respectivamente, diferentemente das frações isoladas das demais extrações, cujas atividades anticoagulantes foram bem menores. Por outro lado, PONTES (2005) mostrou que os PS da alga vermelha Solieria filiformis praticamente não modificaram o tempo de coagulação sanguínea.
Entretanto, uma baixa atividade biológica não implica na ausência de outras ações bioativas. Recentemente, PS brutos de Solieria filiformis foram utilizados em bioensaios como imunoestimulantes no camarão L. vannamei infectados com o vírus da mionecrose infecciosa, sendo observado um aumento significativo na sobrevivência dos animais (COSTA et al., 2006).
TALARICO et al. (2004) revelaram que os PS extraídos da alga marinha vermelha Cryptonemia crenulata apresentaram uma potente atividade antiviral, apesar de não apresentarem atividade anticoagulante (FARIAS et al., 2000).
Contudo, quando a dose foi elevada para 0,5 mg.kg-1, a atividade foi totalmente abolida, demonstrando que o efeito não foi dose-dependente.
Recentemente, uma galactana sulfatada, extraída da alga marinha vermelha Schizymenia binderi, foi fracionada em frações de baixo peso molecular para se avaliar a atividade anticoagulante. As frações obtidas por despolimerização do radical livre apresentaram atividades anticoagulantes similares ao polissacarídeo nativo. Entretanto, quando essas frações foram supersulfatadas e dessulfatadas, seus valores de atividade anticoagulante diferiram significativamente. No primeiro caso, a atividade foi aumentada após a adição de sulfato e, no segundo, a atividade anticoagulante foi completamente abolida após a dessulfatação do composto. Assim, a pesquisa mostrou que o aumento do prolongamento da coagulação sanguínea está diretamente ligado à presença de radicais sulfato na molécula (ZUNIGA el al., 2006).
3.5. Efeito imunoestimulante
A Figura 15 mostra a mortalidade semanal dos camarões, em cada tratamento. Como é possível observar, durante a administração dos PS (semanas 1 e 2), não houve diferenças significativas entre os tratamentos. Entretanto, na terceira semana, ou seja, no período de indução do estresse, o tratamento contendo a dose de 1,0 mg.L-1 (T4) apresentou uma mortalidade significativamente menor do que as observadas para os tratamentos T1