Universidade de Trás-os-Montes e Alto Douro
Biópsias uterinas na avaliação da integridade funcional do
endométrio em burras do Planalto Mirandês
Dissertação de Mestrado
Mestrado Integrado em Medicina Veterinária
Márcia Cristina Bastos de Carvalho
Orientadora: Professora Doutora Rita Maria Payan Martins Pinto Correia
Co-orientadora: Professora Doutora Graça Ferreira Dias
- iii -
Universidade de Trás-os-Montes e Alto Douro
Biópsias uterinas na avaliação da integridade funcional do endométrio em burras do Planalto Mirandês
Dissertação de Mestrado
Mestrado Integradoem Medicina Veterinária
Márcia Cristina Bastos de Carvalho
Orientadora: Professora Doutora Rita Maria Payan Martins Pinto Correia Co-orientadora: Professora Doutora Graça Ferreira Dias
Composição de júri:
________________________________________ ________________________________________ ________________________________________
- v -
DECLARAÇÃO
Nome: Márcia Cristina Bastos de Carvalho C.C.: 13203144
Telemóvel: 968810553
Correio electrónico: cristinacarvalho_87@hotmail.com
Designação do mestrado: Mestrado Integrado em Medicina Veterinária
Título da Dissertação de Mestrado em Medicina Veterinária: Biópsias uterinas na
avaliação da integridade funcional do endométrio em burras do Planalto Mirandês.
Orientadores: Professora Doutora Rita Maria Payan Martins Pinto Correia
Professora Doutora Graça Ferreira Dias
Ano de conclusão: 2015
Declaro que esta dissertação de mestrado é resultado da minha pesquisa e trabalho pessoal e das orientações dos meus supervisores. O seu conteúdo é original e todas as fontes consultadas estão devidamente mencionadas no texto e na bibliografia final. Declaro ainda que este trabalho não foi apresentado em nenhuma outra instituição para obtenção de qualquer grau académico.
Vila Real, 27 de Março de 2015 Márcia Cristina Bastos de Carvalho
- vii -
Para os meus pais Para o meu querido avô Vasco
- ix -
Agradecimentos
Agradeço a todos os Professores de medicina veterinária que leccionam na Universidade de Trás-os-Montes e Alto Douro, por todos os conhecimentos transmitidos e a ajuda prestada no decorrer destes 6 anos. Um agradecimento em especial à Professora Doutora Ana Cláudia, Professora Doutora Cristina Saraiva, Professora Doutora Isabel Pires e Professor Doutor Francisco Brito por todo o apoio, conversas e gargalhadas. Bem hajam!
Agradeço à minha orientadora Professora Doutora Rita Payan por todo o tempo que disponibilizou e por toda ajuda prestada na orientação desta tese de mestrado, bem como a paciência para os meus devaneios.
Agradeço à minha co-orientadora Professora Doutora Graça Ferreira-Dias por toda a disponibilidade e ajuda na orientação desta tese, bem como na análise realizada às lâminas das biópsias.
Agradeço à Professora Doutora Maria dos Anjos Pires por todo o trabalho que teve com o processamento das lâminas das biópsias deste trabalho prático bem como toda a disponibilidade e amabilidade.
Agradeço ao Professor Doutor Mário Silvestre por toda a ajuda com a parte estatística deste trabalho prático.
Agradeço à AEPGA pela disponibilização dos animais que entraram neste estudo.
Ao Doutor Miguel Quaresma por toda a ajuda na recolha das biópsias uterinas, pelos conhecimentos que me transmitiu ao longo destes anos e por toda a amizade e carinho.
Aos meus amigos Sara Campos, Magda Teixeira, Teresa Velez Rosa, Fernanda Queirós, Marta Cunha, Liliana Damil, João Morais e Alexandre Triguinho que tornaram estes anos na faculdade mais enriquecedores, cheios de vivências fantásticas e com um espirito de união. Obrigada por terem a coragem de me aturar!
Aos meus amigos Cristina Correia Marques, Marlene Saraiva, Marisa Cima, Ricardo Teixeira, Mizé Monteiro e Rute Vilela por todo o companheirismo, apoio e amizade. Foram um grande pilar e uma segunda família!
Agradeço acima de tudo às pessoas mais importantes da minha vida, os meus pais e a minha irmã, pois sem a ajuda deles, sem o carinho, sem a paciência e apoio a todos os níveis não poderia ter alcançado o sonho de ser médica veterinária.
- xi -
Resumo
A qualidade do endométrio é um fator determinante da fertilidade em equinos, uma espécie naturalmente predisposta a desenvolver com o avançar da idade afeções inflamatórias e degenerativas do endométrio, regra geral de evolução subclínica e que comprometem a função uterina. È por isso uma das espécies em que a biópsia do endométrio é mais utilizada na avaliação ginecológica de fêmeas usadas para fins reprodutivos. As biópsias de endométrio permitem a deteção de alterações do endométrio e, em caso de existirem, o seu diagnóstico mais preciso, possibilitando assim estabelecer a abordagem terapêutica que melhor se ajusta à situação, acompanhar a resposta ao tratamento e prever a evolução da situação clínica, além de permitir estimar a fertilidade potencial da égua.
Neste trabalho pretendeu-se aplicar a técnica da biópsia do endométrio na avaliação pré-beneficiação de burras do Planalto Mirandês, tirando-se partido das semelhanças anatómicas entre éguas (Equus caballus) e burras (Equus asinus). Para este estudo utilizou-se um grupo de 21 animais, com idades compreendidas entre os 5 e os 25 anos de idade. Devido a particularidades anatómicas da cérvix, nomeadamente o seu menor calibre e a sua maior extensão, as amostras foram obtidas no decorrer do estro e o fragmento foi enviado para análise histopatológica. Após coloração de rotina com hematoxilina e eosina, as amostras foram avaliadas de acordo com a classificação de Kenney.
Pode-se verificar através da análise dos resultados que as biópsias endometriais do grupo das 21 burras se encontravam distribuídas nas categorias II e III da classificação de Kenney, com uma média de idade de 12 anos. Verificou-se nesta amostra que a idade não interferiu de forma significativa com a classificação uterina, sendo no entanto afetada pelo número de gestações prévias da fêmea. Observaram-se úteros em éguas jovens classificados como pertencentes à categorização III (de maior grau de fibrose) e que ficaram gestantes em percentagens elevadas. Não foi encontrada nenhum útero com categorização I (estado saudável e sem fibrose do útero) mesmo em fêmeas mais jovens. Os resultados obtidos neste trabalho parecem sugerir que a escala de Kenney não se encontra ajustada à classificação da qualidade uterina em Equus asinus.
- xiii -
Abstract
The quality of the endometrium is an important factor in the fertility of the mare, which is a predisposed species to develop inflammation and degeneration of endometrium. Usually it evolves subclinically, but compromising the uterine function. For this reason the endometrium biopsy is very often used for the gynecological evaluation of the females intended for reproduction. Uterine biopsies allow excluding endometrial pathological changes. If these pathologies are found, it permits to make a more precise diagnosis, aiding the establishment of a better therapeutic approach. It also lets the clinician evaluate the response to treatment and the evolution of the condition. Finally it allows a good estimation of the potential fertility of the mare.
This study aims to apply the endometrial evaluation of biopsies in the pre-breeding gynecological exam of Planalto Mirandês jennies; considering the anatomical similarities between mares (Equus caballus) and jennies (Equus asinus). Twenty one animals, with ages between 5 and 25 years old, were surveyed. All biopsies were obtained during estrus, using mares uterine forceps. The uterine biopsy was later processed for histological analyses and evaluated using Kenney’s classification for fibrosis degree of the uterus in order to predict the jennies fertility. However, the results obtained by the histopathological analysis and fertility were not in accordance to what was previously observed in mares.
The results showed that the biopsies, of 21 jennies, were distributed between category II and III of Kenney’s scale and the medium age of the jennies was about 12 years old. However the analyses of the results demonstrated that the age of the jennies was not significantly associated with the classification of the uterus and that the existence of previous parturitions may interfere with the classification of the jennies endometrium.The uterus of some young jennies were on category III, with normal fertility and, none of the animal were on the category I. With the work presented herein one can conclude that the Kenney’s classification cannot be directly applied on the evaluation of uterine biopsies of jennies (Equus asinus).
- xv -
Índice de figuras
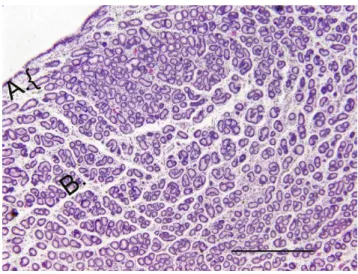
Figura 1- Detalhe da porção superficial do endométrio de equino, sendo que A corresponde ao stratum compactum e B ao stratum espongiosum. (Fotografia retirada de Snider et al, 2011)………... 14
Figura 2 – Representação do endométrio uterino de equino comprendendo o miométrio e o perimétrio. (Fotografia retirada de Online veterinary anatomy museum)………15
Figura 3 – Lâmina de biópsia uterina de burra que apresenta fibrose, glandulas com congestão e ninhos de fibrose periglandular. (Fotografia gentilmente cedida pela Prof. Dra. Graça Ferreira-Dias)……… 20
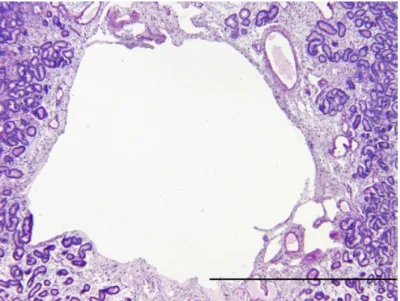
Figura 4 – Biópsia uterina de equino na qual se observa a presença de uma lacuna linfática. (Fotografia retirada de Snider et al, 2011)……… 25
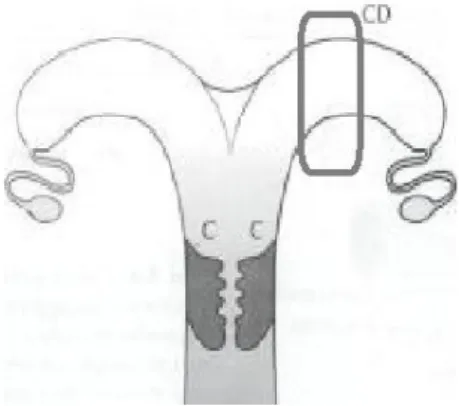
Figura 5- Esquematização do local aproximado de punção da biópsia endometrial no trato reprodutivo de burra………... 34
- xvii -
Índice de tabelas
Tabela 1 – Categorização do infiltrado inflamatório no endométrio em éguas de acordo com Doig et al, (1981)………. 19
Tabela 2 – Distribuição etária segundo as categorias do endométrio……...38
Tabela 3 – Tabela com o número de animais por classificação e por classe de idades………... 39
Tabela 4 – Número de burras com registo de gestações registadas………... 40
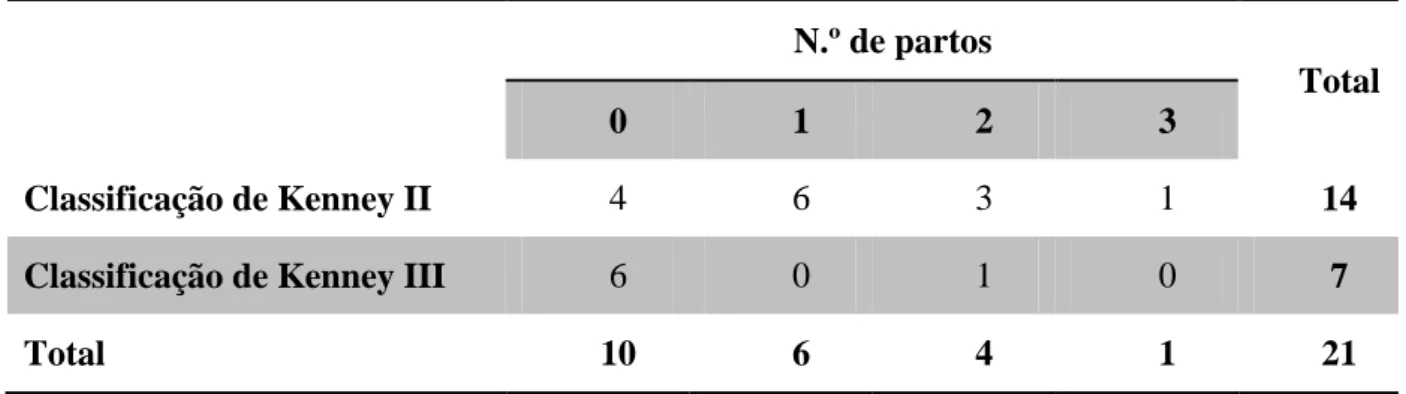
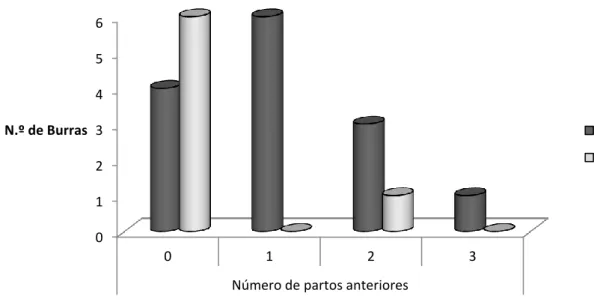
Tabela 5 – N.º de partos anteriores a 2013 nas fêmeas biópsiadas, segundo as categorias de Kenney………40
Tabela 6 – Intervalo de partos superior ou inferior a 1 ano consoante a classificação de Kenney……… 41
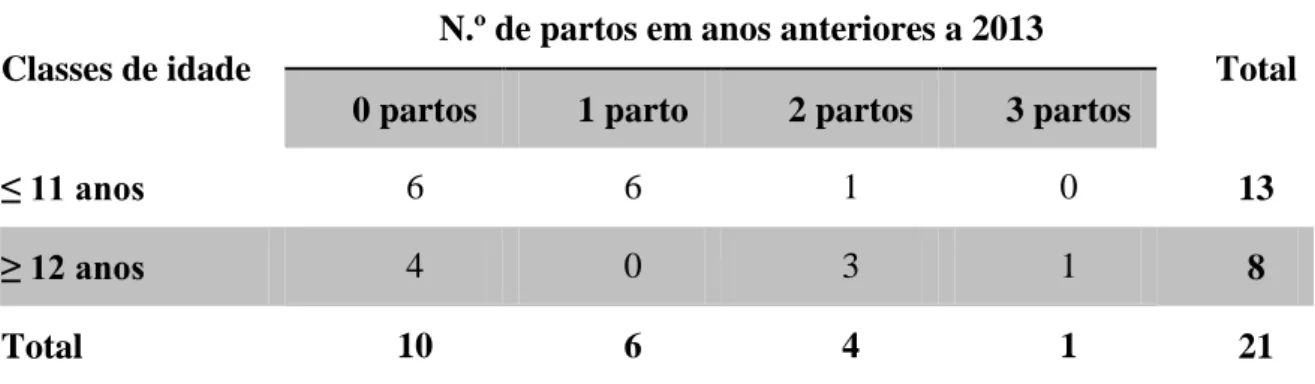
Tabela 7 – Número de partos nos anos anteriores a 2013 consoante as classes de idade………. 42
Tabela 8– Número de burras beneficiadas pelo macho……….. 42
Tabela 9 – Diagnóstico de gestação pós-biópsia uterina consoante a classificação de Kenney………... 43
Tabela 10 - Alterações endometriais de acordo com as diferentes classes de idade………. 45
- xix -
Índice de gráficos
Gráfico 1 – Resultados das biópsias uterinas (categorizas de Kenney) em função da idade………. 38
Gráfico 2 – Distribuição da categorização das biópsia endometrial por classe de idades……… 39
Gráfico 3 – Número de burras por categoria de classificação de Kenney consoante o número de partos, antes de 2013……….. 41
Gráfico 4 – Distribuição das burras beneficiadas pelo macho por categoria da classificação de Kenney………... 43
- xxi -
Índice
Página
Introdução………. 1
Parte I - Revisão bibliográfica……… 3
1. Indicação para a realização de biópsias uterinas……… 5
2. Procedimento de recolha de biópsias uterinas………... 6
2.1. Momento de toma da amostra………. 6
2.2.Local para colheita de biópsias uterinas………... 7
2.3. Técnica de realização da biópsia uterina………...8
3. Fatores determinantes na avaliação histopatológica das lâminas……….. 9
4.Factores que afetam a qualidade do endométrio em equinos……… 10
4.1. Idade………... 10
4.1.1. Alterações vasculares associadas à idade………... 11
4.1.2. Alterações endometriais associadas à idade………... 12
4.2. Influência da regularidade de partos………. 12
5.Morfologia uterina normal em equinos………. 14
6. Alterações encontradas no útero de equinos que afectam a fertilidade e a classificação uterina……… ...17
6.1. Inflamação e infeção uterinas………... 17
6.2. Endometrose……….. 19
6.2.1. Fibrose endometrial……….... 22
6.3. Hipoplasia e Atrofia endometrial………... 23
6.4. Alterações degenerativas e inflamação dos vasos uterinos………... 24
6.5. Hiperplasia endometrial……… 26
- xxi -
7.1. Classificação de Kenney………... 26 7.2. Classificação de Doig………... 28 7.3. Outras grelhas de classificação………. 30 8. Concordância entre biópsias e citologias uterinas………... 31 Parte II - Componente Prática……….. 33 1. Objetivos………. 33 2. Material & Métodos... 33 2.1. Animais………. 33 2.2. Procedimentos para a realização das biópsias uterinas………. 34 2.3. Processamento das amostras e sua categorização………... 35 2.4. Análise estatística………... 35 3.Resultados……… 37 4. Discussão... 45 5.Conclusão... 51 6. Bibliografia………. 53 7. Webgrafia………... 58
- 1 -
Introdução
Os burros (Equus asinus) sempre foram de grande importância para a humanidade, pela ajuda que prestavam no trabalho agrícola (a lavrar campos) e também no transporte de pessoas e bens. Todavia, com a revolução industrial, este nobre animal foi deixado no esquecimento tendo sido em grande parte substituído por máquinas nos países industrializados (Carluccio et al, 2008). Com o decorrer dos tempos e com o desinteresse na utilização dos burros, a população de asininos foi decrescendo a ponto de serem considerados em algumas áreas geográficas uma espécie em extinção, tendo mesmo algumas das raças desaparecido. Contudo, tem ressurgido um maior interesse nos burros em termos científicos e empresariais, pois ainda há muito a desvendar sobre estes amistosos animais.
A fertilidade é um parâmetro determinante para a sobrevivência de uma população ou de uma espécie. Nos equinos, a qualidade do endométrio é determinante para o sucesso reprodutivo (Kenney, 1978; Simon et al, 1999). Sendo a incidência de alterações inflamatórias e degenerativas do útero com evolução subclínica maior na égua do que nas outras espécies domésticas (Doig et al, 1981), o recurso à biópsia do endométrio como forma de estimar a competência da fêmea para receber uma gestação é um recurso frequente. O facto de o burro (Equus asinus) e o cavalo (Equus caballus) serem bastante semelhantes anatomicamente (Saber et al, 2008), levou ao desenvolvimento deste estudo, pois as fêmeas de burro não existem praticamente literatura disponível sobre a avaliação da fertilidade com base na classificação endometrial.
O estudo apresentado nesta dissertação de Mestrado Integrado em Medicina Veterinária tem como foco estimar a fertilidade das burras do Planalto Mirandês com base na classificação histológica do útero em material de biópsia endometrial, através da aplicação da grelha de classificação de Kenney, estabelecida para éguas.
- 3 -
Parte I - Revisão bibliográfica
Nos equinos, a fertilidade é definida como a capacidade de conceber, manter a gestação e parir um poldro vivo (Kenny, 1978). Na égua, um dos principais fatores determinantes da fertilidade é a qualidade do endométrio, em particular no que respeita à sua integridade morfofuncional (Kenney, 1978; Simon et al, 1999). Esta espécie tem predisposição para desenvolver, com o avançar da idade, situações inflamatórias e degenerativas que cursam frequentemente de forma subclínica e comprometem a função uterina (Doig et al, 1981).
Ao longo da vida reprodutiva da fêmea, o útero passa por várias transformações decorrentes da alternância cíclica dos esteroides ováricos ou associadas à gestação. Além do mais, pode ser periodicamente exposto a fontes de contaminação por agentes patogénicos, seja associado à beneficiação, à involução no pós-parto ou, no caso particular dos equinos, por contaminação ascendente da vagina decorrente de anomalias perineais (Watson, 2000; Maischeberger et al, 2008; Snider et al, 2011; Woodward et al, 2012). Assim, só a capacidade de resolver de forma satisfatória estas modificações fisiológicas permite à égua manter a sua fertilidade ao longo do tempo (Watson, 2000; Snider et al, 2011; Woodward et al, 2012).
É frequente recorrer-se a biópsias uterinas para estimar a capacidade para manter a gestação nas éguas (Ferreira-Dias et al, 1999). Este procedimento é o método mais sensível para realizar o diagnóstico de algumas das alterações atrás referidas, pois baseia-se na análise histopatológica de um fragmento do endométrio (Simon et al, 1999: Martins et al, 2011). Os seus resultados são analisados por comparação com a normal morfologia do endométrio na espécie (Kenney, 1978; Snider et al, 2011). Através das biópsias de endométrio podemos chegar ao diagnóstico de uma afeção associada a infertilidade não detetável num exame ginecológico mais simples, além de seguir a resposta do endométrio a um tratamento dirigido a uma afeção particular ou emitir um prognóstico relativo à capacidade do útero levar a termo uma gestação (Doig Waelchli, 2011; Kenney, 1978; Maischeberger et al, 2008; McCue, 2009; Martins et al, 2011).
A biópsia do endométrio aparece assim como um valioso método auxiliar de diagnóstico de infertilidade na égua, pelo que deve sempre ser inserido em contexto clinico, completando o exame ginecológico (Waelchli, 1990; Sepoy, 2008; Doig e Waelchli, 2011), em particular em fêmeas que apresentam história de baixa eficiência reprodutiva. Vários estudos demonstram que o exame histológico associado à biópsia tem, não só, valor diagnóstico como
- 4 -
também prognóstico da fertilidade da égua (Doig e Waelchli, 2011; Overbeck et al, 2013). Por outro lado, a sua utilidade pode ser complementada com a realização concorrente de exames microbiológicos (Doig e Waelchli, 2011). A biópsia uterina é utilizada não só para diagnóstico de alterações degenerativas do endométrio, mas também para determinar a distribuição e severidade de eventuais processos inflamatórios (Doig e Waelchli, 2011). A biópsia uterina é uma técnica invasiva que requer equipamento e recurso a laboratórios especializados (Overbeck et al, 2011).
Apesar da biópsia do endométrio se ter tornado parte integrante na avaliação reprodutiva de éguas usadas para fins reprodutivos em geral e de éguas sub-férteis em particular (Ganjam e Evans, 2006; Overbeck et al, 2013), há contudo que salvaguardar que a eficiência reprodutiva não depende exclusivamente da saúde do trato reprodutivo, especialmente do útero, dependendo também do maneio reprodutivo a que as éguas se encontram sujeitas (Waelchli, 1990).
A biopsia deverá ser feita sempre a tempo de permitir a utilização da fêmea na mesma época reprodutiva. Em caso de infertilidade, a realização da biópsia no início ou durante a época reprodutiva poderá ser demasiado tardia para possibilitar a instituição de um tratamento e obter a recuperação a tempo de se poder obter um poldro ainda nessa época reprodutiva (Doig e Waelcli, 2011). Idealmente, e sempre que se suspeita de infertilidade numa fêmea, deveria realizar-se a biópsia no final da época reprodutiva anterior, para assim se poder realizar um tratamento eficaz e recuperar a fertilidade da fêmea a tempo da nova época reprodutiva (Doig e Waelchli, 2011).
A realização de uma biópsia uterina permite estimar a capacidade de implantação potencial das éguas no momento em que é executado o exame (Schlafer, 2007). Outras razões que levaram ao crescente desenvolvimento e uso desta técnica prendem-se com o aumento do número de Médicos Veterinários envolvidos na área da reprodução, pelo valor económico que determinados exemplares atingem no mercado e pela necessidade de associar o melhoramento genético à manutenção das características de fertilidade em algumas reprodutoras de qualidade (Snider et al, 2011).
A primeira biópsia de endométrio a ser usada com fins clínicos terá sido realizada no decorrer de 1960 (Schlafer, 2007; Snider et al, 2011) conjugando a disponibilidade dos instrumentos necessários e a publicação sobre lesões primárias do endométrio. Ao longo dos últimos 40 anos o número de biópsias uterinas em éguas tem mostrado uma grande evolução,
- 5 -
em paralelo com aumento do conhecimento sobre as alterações uterinas e a sua associação com infertilidade, mas também pelo aperfeiçoamento da técnica (Schlafer, 2007; Snider et al, 2011; Overbeck et al, 2013).
1. Indicações para a realização de biópsias uterinas
As biópsias uterinas podem ser realizadas em todas as fêmeas não gestantes, em particular nas quais haja a suspeita de alguma afeção que comprometa a fertilidade (Doig e Waelchli, 2011). De entre as situações mais frequentemente apontadas para a realização de biópsias uterinas, encontram-se (Kenney, 1978; Doig e Waelchli, 2011; Snider et al, 2011):
Fêmeas repetidoras, ou seja fêmeas (primíparas ou multíparas) beneficiadas várias vezes por um macho/sémen de fertilidade comprovada no decorrer da última época reprodutiva, dentro das boas práticas de maneio, mas que não obtiveram uma gestação;
Fêmeas com história de mortalidade embrionária precoce;
Fêmeas não gestantes mas que apresentam comportamento de anestro em plena época reprodutiva, bem como hipoplasia de ovários;
Fêmeas com histórico de perda embrionária precoce ou aborto;
Éguas com anomalias do trato genital detetadas através de observação, ecografia ou palpação;
Fêmeas com indicação para cirurgia corretiva do períneo;
Antes e depois da realização de uma intervenção cirúrgica no trato genital;
Fêmeas com suspeita ou diagnóstico de piómetra e /ou mucómetra ou que apresentem conteúdo uterino;
Sempre que se pretende comprar um fêmea com o intuito de a reproduzir;
Éguas selecionadas como recetoras ao abrigo de um programa de transferência de embriões;
Acompanhamento de tratamentos ou verificação dos resultados da terapia instituída; Em situações particulares, para efeitos de investigação científica.
- 6 -
2. Procedimentos de recolha de biópsias uterinas 2.1. Momento de toma da amostra
A fase do ciclo éstrico durante a qual se realiza a colheita da amostra uterina pode ter implicações quer na duração do ciclo quer na qualidade do diagnóstico emitido (Sepou, 2008; Doig e Waelchli, 2011; Snider et al, 2011). Apesar de não estar definida uma fase específica do ciclo éstrico para a recolha de amostras do endométrio em éguas (Sepoy, 2008), esta recolha realiza-se preferencialmente no diestro, pois é a fase do ciclo mais longa e a que apresenta menos variações histológicas (Snider et al, 2011), mantendo-se a morfologia histológica mais uniforme (Doig e Waelchli, 2011). É também nesta fase que o endométrio apresenta um maior desenvolvimento glandular (Keller, 2004). Por outro lado, durante o estro, a impregnação estrogénica origina um edema crescente, que é mais pronunciado na periferia da ovulação, e que favorece a separação de células epiteliais vizinhas (Doig e Waelchli, 2011), além da proliferação e enovelamento das glândulas ser menor, o que pode limitar a emissão de diagnóstico histológico (Keller, 2006; Doig e Waelchli, 2011).
A literatura disponível é controversa sobre os possíveis efeitos secundários associados à realização de uma biópsia uterina nas diferentes fases particulares do ciclo éstrico. Alguns autores consideram que se a realização de biópsias endometriais se processar na ausência de infeção uterina no momento da recolha, não afetará o decorrer normal do ciclo éstrico. Crê-se também que a colheita durante o estro minimiza a probabilidade de a égua contrair uma infeção uterina comparativamente a uma recolha realizada no diestro (Sepoy, 2008). Outros investigadores defendem que existem momentos particulares do diestro em que a realização da biópsia ou de material para cultura pode ter como consequência a indução de uma luteólise precoce (Sepoy, 2008; Snider et al, 2011). A colheita da amostra 4 a 5 dias depois da ovulação pode levar à produção de prostaglandinas, devido à manipulação do útero e cérvix, resultando num acentuado declínio da concentração de progesterona no sangue (Sepoy, 2008; Snider et al, 2011). Esta luteólise precoce acarretaria um encurtamento do diestro e por consequência uma redução do intervalo interovulatório ou interéstrico (Sepoy, 2008). Caso as biópsias endometriais sejam obtidas nos dias 16 e 20 do ciclo éstrico (dia 0 = dia da ovulação) poderá observar-se um ligeiro alongamento destes intervalos. Por outro lado, não se esperam alterações no padrão dos ciclos se as biopsias forem recolhidas nos dias 0 e 12 do ciclo (Gilbert, 1989).
- 7 -
2.2. Local para colheita de biópsias uterinas
O estudo histopatológico dos dados obtidos por biópsia uterina revelou que as alterações degenerativas não variam de modo significativo com o local do útero em que a amostra é recolhida (Overbeck et al, 2013). É geralmente aceite que uma única amostra de biópsia uterina é representativa de todo o endométrio (Ferreira-Dias et al, 1999; Fiala et al, 2010), dado que representa cerca de 0.1% a 0.2% da área superficial total do endométrio (Snider et al, 2011). Se a maior parte das alterações do endométrio são uniformes, podem no entanto existir algumas situações em que elas se desenvolvem de forma focal, sejam de tipo degenerativo ou inflamatório (Sepoy, 2008; Overbeck et al, 2013). Neste caso, a recolha de amostra para biopsia apenas numa única localização poderia prejudicar o valor do resultado obtido (Doig e Waelchli, 2011). Assim, se no exame clínico se observar uma alteração num ponto específico do útero, será conveniente fazer a recolha de amostra nesse ponto (Keller, 2004). Contudo, alguns autores defendem que é mais vantajoso realizar múltiplas colheitas em diferentes locais do útero, em particular se existe a suspeita de alterações, ainda que elas não sejam detetáveis durante a palpação ou ecografia do útero (McCue,2009; Sepoy, 2008; Fiala et al, 2010; Aresu et al, 2011).
Há que ter em conta que a amostra deve ser recolhida suficientemente afastada da cérvix. A análise do tecido do cérvix não tem valor (Sepoy, 2008); a amostra recolhida neste local tem menor densidade de glândulas, o que poderia ser erroneamente entendido por um avaliador mais inexperiente, como atrofia do endométrio por desequilíbrio hormonal (Keller, 2004; Doig e Waelchli, 2011).
Existe a recomendação geral que, na ausência de alterações, o tecido para biópsia seja recolhido a meio de um dos cornos uterinos (Ricketts, 1975). No entanto, Kenney (1978) defende que o local de punção da biópsia uterina seja próximo do local de implantação, ou seja, na base do corno uterino junto ao corpo do útero. Caso existam alterações uterinas palpáveis ou detetadas ecograficamente, então deverá proceder-se, como já foi mencionado, não só à amostra descrita anteriormente, como ainda à recolha de uma amostra no ponto de lesão (Ricketts, 1975). Em regra, uma amostra ventral ou dorsal é suficiente para o diagnóstico (Kenney, 1978; Doig et al, 1981).
- 8 -
2.3. Técnica de realização da biópsia uterina
Antes da recolha de amostra há que confirmar que a égua à qual se pretende fazer a biópsia uterina não se encontra gestante, pois este procedimento levará inevitavelmente a aborto (McCue, 2009).
Durante todo o procedimento as éguas são contidas em troncos (Nielsen, 2005; Snider et al, 2011) e mantidas em estação (Simon et al, 1999). Os procedimentos devem decorrer com o máximo de assepsia possível. A cauda é elevada e coberta com uma luva de palpação descartável (Nielsen, 2005; McCue, 2009) e as fezes são removidas manualmente do reto. Antes da realização da biópsia realiza-se a palpação do trato reprodutivo, em particular do útero, para avaliar o seu tónus, espessura e tamanho e ainda identificar eventuais alterações (Ricketts, 1975), e dos ovários, para determinar a atividade ovárica (Simon et al, 1999). Procede-se em seguida à lavagem da vulva e da região perineal, por 3 vezes consecutivas, com água morna e sabão; retirando todos os resíduos e sacando por fim com uma toalhita de papel descartável (Kenney, 1978; McCue, 2009).
O espéculo é envolvido pela mão protegida com luva de palpação, devidamente lubrificada, e introduzido na vagina após separação dos lábios vulvares, até à porção caudal do canal cervical (Kenney, 1978; Nielsen, 2005; McCue, 2009). Localizado o cérvix, faz-se progredir o instrumento de biópsia através do canal cervical até ao útero com a ajuda do dedo indicador (Ricketts, 1975; Kenney, 1978, Sepoy, 2008). Para facilitar a progressão do fórceps mais profundamente no útero, traciona-se o cérvix de forma suave em direção caudal, pela sua área posterior (Ricketts, 1975). Entretanto, mantendo o fórceps em posição com a ajuda da outra mão, o braço que se encontra no interior da vagina sai e é introduzida no reto para ajudar a guiar o instrumento de biopsia e a posicioná-lo no local pretendido (Ricketts, 1975; McCue, 2009). Identificado o local da colheita de amostra no útero, abre-se o fórceps e posiciona-se o instrumento em paralelo com o endométrio; exercendo pressão com um dos dedos da mão inserida no reto na área pretendida do útero, entre as mandíbulas do fórceps. De seguida encerram-se as mandíbulas do fórceps, que assim seccionam uma amostra de endométrio. A tração do instrumento de biópsia fechado permite a recolha do tecido (Snider at al, 2011). No exterior, o tecido é retirado do fórceps com uma pinça ou agulha e colocado num recipiente contendo o fixador, devidamente identificado (McCue, 2009). Será posteriormente enviado a um laboratório de histopatologia acompanhado de uma requisição detalhando as suspeitas e descrevendo eventuais lesões já encontradas.
- 9 -
No laboratório, após a fixação, o tecido é impregnado em parafina e posteriormente processado de acordo com os procedimentos de rotina, cortado e corado com hematoxilina-eosina, Van Gieson ou pela coloração de Gram-Twort (Ricketts, 1975; Kenney, 1978).
3. Fatores determinantes na avaliação histopatológica das lâminas
O clínico deverá ter consciência de que o modo como executa a técnica de biópsia poderá influenciar a amostra. Na biópsia transcervical a amostra do endométrio, com cerca de 1 a 2 cm e uma espessura 2 cm (Ricketts, 1975; McCue, 2009; Aresu et al, 2012), raramente comporta um fragmento do miométrio, ao contrário do que se observa quando a amostra é obtida por punção transmural (geralmente com um punch de 3 a 5 mm) associada a celiotomia. A pequena espessura da biopsia realizada por via transcervical, que não comporta o miométrio, regra geral não engloba o estrato vascular, que comporta grandes artérias e grandes vasos que irrigam o endométrio, pelo que o procedimento quando corretamente executado não é excessivamente sangrante (Esteller-Vico et al, 2012). Um fator que pode condicionar o valor diagnóstico da biópsia é a pouca espessura da amostra, que será considerada insuficiente para permitir uma análise histopatológica adequada (Kenney, 1978) por não ostentar todas as camadas da parede uterina necessárias à avaliação do útero (Aresu et al, 2012).
Existe ainda a possibilidade de se produzirem artefactos associados quer a uma técnica de recolha descuidada, como a uma má manipulação dos tecidos, pois podem danificar o epitélio luminal ou provocar a sua perda, ou ainda a invaginação das criptas glandulares e mesmo esmagamento da amostra de endométrio (Ricketts, 1975; Kenney, 1978; Snider et al, 2011).
Uma vez que o tecido endometrial de equinos se deteriora com grande facilidade e rapidez, há que os submergir o mais rapidamente possível no fixador (Ferreira-Dias et al, 1994). O fixador utilizado poderá também originar artefactos na arquitetura do órgão, associados à retração tecidular por desidratação das células e desnaturação das proteínas (Martins et al, 2011). Embora o formol tamponado seja utilizado com bastante frequência, induz alguns artefactos nos tecidos, pelo que alguns autores advogam a utilização do fixador de Bouin, que preserva melhor a arquitetura da amostra. Contudo, ao optar por este último, há que ter o cuidado de transferir a amostra para álcool a 70º ou formol a 10% ao fim de 24h, para não enrijecer demasiado o fragmento (Snider et al, 2011).
- 10 -
Para além do método utilizado na recolha, vários outros fatores podem influenciar os resultados de uma biópsia do endométrio em equinos (Sepoy, 2008). A biópsia uterina é um pequeno procedimento cirúrgico relativamente invasivo que causa distúrbios no ambiente uterino normal (Doig e Waelchli, 2011) Uma das sequelas comuns é a ocorrência de um pequeno sangramento no local de recolha, que poderá originar contaminação da amostra por sangue (Snider et al, 2011). Por outro lado, um valor negativo da biópsia do endométrio pode ser provocado pela fraca qualidade de preservação do material, falha na obtenção da amostra pretendida, incompleta informação clinica sobre o animal, o nível de experiência e interesse do executor e das pessoas intervenientes na avaliação da amostra (Schlafer, 2007). Além disso, a avaliação histopatológica e classificação atribuída à amostra de endométrio deverão ser sempre executadas pelo mesmo patologista a fim de evitar discrepâncias (Sepoy, 2008).
4. Fatoresque afetam a qualidade do endométrio em equinos 4.1. Idade
As éguas que apresentem uma idade superior a 11 ou 15 anos começam a demonstrar um declínio da sua fertilidade, ficando cada vez mais difícil ficarem gestantes ou manter a gestação (Ball,2000; McCue, 2009; Snider et al, 2011). Vários autores afirmam que a idade das éguas afeta negativamente a fertilidade, dado que é um fator para a progressão de alterações endometriais degenerativas (Waelchli, 1990; Woodward et al, 2012) e éguas mais velhas apresentam um ambiente uterino pouco propício para levar a termo uma gestação (Ball, 2000). Uma grande parte das fêmeas mais velhas é considerada infértil, devido ao facto de que com o avançar da idade ocorrer um aumento significativo de deposição de fibrose no endométrio (Doig et al, 1981; Mambelli et al, 2013). Há que ter ainda em conta que uma égua mais velha geralmente ovula folículos mais pequenos e apresenta um maior número de ovulações múltiplas comparativamente com éguas mais jovens (Paradis, 2010).
O envelhecimento celular ocorre devido a efeitos cumulativos genéticos e de lesão ambiental progressiva (LeBlanc et al, 2009), pelo que há uma relação inversa entre a idade e a fertilidade nas éguas (Waelchli, 1990). Foi demonstrado que éguas mais velhas apresentam uma classificação superior, segundo a escala de Kenney e uma taxa de fertilidade inferior relativamente a éguas mais novas. Não existe consenso sobre a idade a partir da qual estas alterações serão mais prevalentes, sendo descritas por diferentes autores diferentes idades: os
- 11 -
11 anos (Waelchli, 1990; Snider et al, 2011), os 13 anos (Ganjam e Evans, 2006) ou os 15 anos (McCue, 2009).
Contudo, há estudos que comprovam que a taxa de concepcão e gestação precoce seria idêntica tanto em fêmeas jovens como em fêmeas mais velhas, sendo no entanto a taxa de morte embrionária precoce no período decorrente entre o dia 2 e o dia 14 de gestação marcadamente mais elevada em fêmeas mais velhas (Waelchli, 1990; Paradis, 2010). Para a perda embrionária contribuiriam tanto o facto de os embriões serem anormais como existir um pobre ambiente uterino e do oviduto, típicos de éguas com idade avançada (LeBlanc et al, 2009).
Éguas que nunca pariram tendem também a apresentar endometrose com mais frequência, reforçando a ideia que a idade por si só não é a única responsável pela deposição de fibrose no endométrio (Woodward et al, 2012). Existe no entanto uma maior ocorrência de lacunas linfáticas em éguas idosas (Sepoy, 2008).
4.1.1. Alterações vasculares associadas à idade
As alterações que as paredes das artérias uterinas sofrem com o avançar da idade são comuns (Schlafer, 2007), havendo uma maior percentagem de ocorrência de angiopatias em éguas com mais de 15 anos e multíparas comparativamente a éguas jovens que nunca pariram (LeBlanc et al, 2009; Woodward et al, 2012).
No entanto, a incidência de alterações vasculares é maior em éguas nulíparas velhas, comparativamente com éguas nulíparas mais jovens (Sepoy, 2008; Woodward eta al, 2012). No entanto, há estudos em que não se encontrou degeneração vascular associada à idade (Esteller-Vico et al, 2012). Há que saber diferenciar as degenerescências vasculares relacionadas com a idade das lesões vasculares causadas por uma agressão mais específica (Schlafer, 2007). Num estudo levado a cabo por Schlafer (2007), verificou-se a presença de hiperplasia das células do tecido muscular liso da túnica média das artérias uterinas e um aumento de fibras elásticas, estando este aumento diretamente relacionado com a idade, uma vez que não foram encontradas lesões vasculares em éguas mais jovens.
- 12 -
4.1.2. Alterações endometriais associadas à idade
As alterações histológicas do endométrio relacionadas com a idade verificam-se tanto em éguas nulíparas como multíparas. O grau de endometrose aumenta em éguas com idade avançada, não parecendo existir associação com o número de partos que a fêmea tenha feito ao longo da sua vida (Sepoy, 2008; Hoffmann et al, 2009; Snider et al, 2011; Woodward et al, 2012). No entanto, fêmeas nulíparas de idade avançada apresentam dificuldades acrescidas para obter e levar a termo uma gestação, pelo que necessitam ser beneficiadas num maior número de ciclos para conseguirem obter uma gestação (McCue, 2009). A atrofia endometrial ocorre também com mais frequência em fêmeas mais velhas e normalmente encontra-se associada com infertilidade (Ricketts, 1975).
A perda de competência da imunidade local tem sido associada ao aumento da idade, sendo este um fator que propicia a ocorrência de endometrite pós-coito persistente (McCue, 2009; Christoffersen et al, 2012; Woodward et al, 2012). Nas éguas mais velhas denota-se uma maior retenção de Streptococcus spp., microsferas e líquido livre no útero comparativamente com éguas mais jovens (LeBlanc et al, 2009), pois apresentam uma capacidade de limpeza do útero reduzida, mantendo o fluido inflamatório no lúmen uterino por vários dias (McCue, 2009). Por outro lado, éguas velhas e que nunca pariram até aos 10 anos de idade ou aquelas que perdem o embrião, apresentam regra geral um atraso na limpeza do útero devido ao mau funcionamento do cérvix (LeBlanc et al, 2009).
De todos os estudos conclui-se que as alterações degenerativas glandulares e a fibrose são transformações inevitáveis com o avançar da idade que podem levar a atrofia endometrial demonstrando senilidade ginecológica (Snider et al 2011). Assim sendo, as taxas de gravidez e de parto são superiores em éguas jovens (Waelchli, 1990).
4.2. Influência da regularidade de partos
Os anos que uma fêmea fica sem levar a termo uma gestação afeta significativamente as taxas de gestação subsequentes. Conforme tenham uma fibrose leve, moderada ou grave esta tem também um efeito significativo na percentagem de partos nas éguas (Doig et al, 1981). Além disso, quando comparadas éguas que não procriaram num período inferior a um ano com éguas que não procriam num período de tempo superior a um ano, as primeiras apresentam parâmetros de fertilidade superiores (Waelchli, 1990). Assim, as fêmeas velhas
- 13 -
que recentemente produziram um poldro têm uma probabilidade maior de voltar a conceber comparativamente com fêmeas da mesma idade e que não procriaram na época reprodutiva anterior (McCue, 2009).
Quando se comparam fêmeas com o mesmo grau de fibrose, as que não ficaram gestantes nos anos anteriores têm uma maior dificuldade em obter uma gestação, o que sugere que existem outros fatores para além da fibrose a interferir com a fertilidade (Doig et al, 1981). Éguas estéreis apresentam um grau de endometrose mais elevado (Lehmann et al, 2011), existindo mais éguas estéreis com endometrose moderada e destrutiva comparativamente com éguas de endometrose grave que levam a termo uma gestação (Lehmann et al, 2011).
Contudo, fêmeas multíparas com registo de um elevado número de partos apresentam uma qualidade endometrial mais baixa comparativamente a éguas que tenham parido poucos poldros (Woodward et al, 2012). No entanto, Lehmann e seus colaboradores (2011) defendem que o grau de endometrose não está associado com o número de partos ocorrido ao longo da vida reprodutiva da fêmea. Foi demonstrado que as camadas de fibrose depositadas em torno das glândulas, nas camadas mais profundas da lâmina própria, se encontram diretamente relacionadas com os anos em que as éguas ficaram sem procriar (Keller, 2004; Sepoy, 2008). A nível vascular, fêmeas que tenham um elevado número de parições apresentam degeneração vascular no endométrio, miométrio e camada vascular (Esteller-Vico et al, 2012). O número de partos decorridos durante a vida reprodutiva de uma égua tem um grande valor preditivo no que se refere à degeneração vascular (Fiala et al, 2010).
Assim sendo, a classificação endometrial não se encontra significativamente relacionada com o número de parições anteriores de uma égua (Esteller-Vico et al, 2012). Fêmeas que apresentem uma deposição de fibrose no endométrio leve a moderada e que fiquem sem procriar durante alguns anos têm maior dificuldade em mais tarde levar a termo uma gestação (Doig e Waelchli, 2011). Acredita-se que a causa possa estar relacionada com a capacidade de eliminar as bactérias do útero após o coito se encontrar diminuída mesmo que a contaminação apresentada seja mínima (Lehmann et al, 2011).
Também se tem verificado atrofia endometrial bastante expressiva em éguas que ficam mais de três anos sem procriar, havendo uma relação direta entre os anos de inatividade reprodutiva com a severidade de fibrose periglandular (Snider et al, 2011). De modo semelhante, a hipoplasia endometrial tem sido encontrada em fêmeas nulíparas e em fêmeas que ficaram alguns anos sem procriar (Ricketts, 1975).
- 14 -
5. Morfologia uterina normal em equino
O útero das fêmeas dos asininos (Equus asinus) apresentam várias semelhanças com a morfologia dos úteros das éguas (Equus caballus) (Abd-Elnaeim, 2008), assim sendo, o presente trabalho irá relatar a morfologia uterina das éguas, dado a parca existência de informação relativamente ao aparelho reprodutor dos asininos.
Morfologicamente, o útero da égua apresenta 3 camadas:
A mucosa ou endométrio, que comporta elementos epiteliais (epitélio de superfície e epitélio glandular) e estroma (Kenney, 1978; Schlafer, 2007), podendo este último ser sub-dividido em estroma superficial (stratum compactum), em posição sub-luminal (Kenney, 1978; Graça Ferreira-Dias et al, 1999), constituído por células mais ovaladas e de citoplasma parco, extremamente vascularizado e em que ocorre acumulação de células do sistema imunitário (Schlafer, 2007); e o estroma intermédio e profundo (stratum spongiosum), de baixa densidade celular mas com células fusiformes muito extensas, criando uma aparência esponjosa (Kenney, 1978) (Figura 1). O estroma dá suporte aos elementos glandulares do endométrio. O epitélio varia em resposta às influências dos esteroides sexuais, de cuboide a colunar alto consoante a fase do ciclo, apresentando esporadicamente células ciliadas (Schlafer, 2007);
Figura 1- Detalhe da porção superficial do endométrio de equino, sendo que A corresponde ao
stratum compactum e B ao stratum espongiosum. (bar=0.5mm) (Fotografia retirada de Snider et al, 2011)
- 15 -
O estrato subglandular, no qual existem muitos vasos e poucas glândulas, e que se encontra entre o endométrio e miométrio (Keller, 2004);
O miométrio (camada muscular), no qual fibras musculares lisas se dispõem numa camada circular (interna) e longitudinal (externa) (Keller, 2006), entre as quais se dispõe o estrato vascular comportando grandes artérias, veias, vasos linfáticos e nervos (Esteller-Vico et al, 2012) (Figura 2);
A serosa ou perimétrio, revestido pelo mesotélio peritoneal, sendo constituído por tecido conjuntivo laxo, vasos e nervos (Keller, 2004) (Figura 2).
Figura 2 – Representação do endométrio uterino de equino comprendendo o miométrio e o perimétrio.
(Fotografia retirada de Online veterinary anatomy museum)
Nas éguas, o relevo interno do útero apresenta cerca de 12 a 15 pregas longitudinais, constituídas por tecido conjuntivo sem glândulas; estas aglomeram-se nos intervalos entre as pregas (Kenney, 1978). A camada superficial do estroma endometrial concentra um infiltrado de células inflamatórias, sobretudo linfócitos T, que integram o sistema imunitário inato do útero (Huth et al, 2014). Comparativamente, as pregas da mucosa uterina nos asininos apresentam uma disposição longitudinal regular nos cornos uterinos, enquanto a nível do corpo do útero a organização das pregas da mucosa uterina é irregular (Abd-Elnaeim, 2008).
A alternância das fases folicular e lútea refletem-se na morfologia do endométrio, sendo esta também diferente consoante a fêmea esteja em estação reprodutiva ou em anestro (Kenney, 1978; Leishman et al, 1982; Schlafer, 2007). Quando a biópsia é recolhida durante o anestro as fêmeas ostentam um endométrio inativo, com atividade proliferativa moderada
- 16 -
(Huth et al, 2008). As glândulas endometriais encontram-se inativas, as células do epitélio luminal podem ter uma forma cuboide e apresentam um citoplasma bastante basófilo (Kenney, 1978). Algumas áreas de endométrio podem apresentar atrofia dispersa (Kenney, 1978). Quando seccionadas transversalmente as ramificações das glândulas são de pequeno diâmetro, enquanto parecem tubos estreitos quando em secção longitudinal. Nesta fase do ciclo reprodutivo não se observa edema da lâmina própria, e também a densidade de glândulas é menor (Kenney, 1978). O epitélio das criptas glandulares é frequentemente colunar baixo, e as células apresentam um citoplasma mais pálido do que as das glândulas basais. Na área basal do endométrio é frequente observarem-se elementos glandulares decorrentes do enrolamento das glândulas endometriais durante o diestro (Dog & Waelchli, 2011).
Durante a estação reprodutiva, as células epiteliais do epitélio de superfície são geralmente mais altas do que no anestro, sendo o seu tamanho determinado pela fase do ciclo em que a fêmea se encontra (Kenney, 1978). No estro, o epitélio endometrial apresenta-se constituído por células colunares a colunares altas e pálidas, com vacúolos na porção basal do epitélio luminal (Kenney 1978; Doig e Waelchli, 2011). É comum a presença de neutrófilos nos capilares subepiteliais e nas vénulas da lâmina própria (Kenney, 1978). O edema do estroma é mais percetível na lâmina própria e a ramificação das glândulas endometriais apresenta um diâmetro maior quando seccionados transversalmente, sendo pouco tortuosos em secção longitudinal (Doig & Waelchli, 2011).
No entanto, cada fase do estro apresenta características particulares, que se descrevem em seguida:
No proestro o epitélio luminal apresenta-se como sendo colunar de baixo a médio, variando de simples a pseudoestratificado; as células são hipocromáticas (Keller, 2004). As glândulas são menos tortuosas que no decorrer do diestro, ocasionalmente as ramificações de glândulas individuais surgem em ninhos, que parecem ocorrer devido ao edema do estroma interglandular (Kenney, 1978);
No início do estro o epitélio luminal atinge a sua altura máxima, sendo colunar alto (Ricketts, 1975); havendo uma maior proliferação das células luminais por vezes lembra um epitélio pseudo-estratificado (Martins et al, 2011). No final do estro, em algumas éguas, o epitélio luminal retorna a colunar baixo, o que em certos animais apenas ocorre após a cessação do comportamento de cio (Doig e Waelchli, 2011). É frequente as células do epitélio luminal apresentarem um citoplasma vacuolizado (Kenney, 1978) e uma coloração
- 17 -
citoplasmática pálida (Ricketts, 1975). Há uma tendência para a acumulação de neutrófilos nas margens das vénulas e capilares que se dirigem à área superficial do endométrio (Kenney, 1978). Observa-se também um infiltrado de células mononucleares (Ricketts, 1975). Nesta fase as glândulas têm uma menor densidade (Leishman et al, 1982), com ductos glandulares curtos e retilíneos, podendo conter material amorfo (Doig e Waelchli, 2011); as suas células epiteliais são altas e pálidas, (Ricketts, 1975);
No diestro o epitélio é colunar e/ou cuboide, consoante o momento da recolha de amostra se encontrar mais próximo ou mais afastado do inicio do estro (Kenney, 1978). O citoplasma das células apresenta uma coloração marcada, sendo as células hipercromáticas (Ricketts, 1975). Há uma diminuição da vascularização e do edema endometrial. As células do estroma apresentam uma coloração mais pronunciada e uma pequena infiltração celular (Riketts, 1975). A densidade glandular aumenta durante o diestro e é notória a ramificação e enovelamento das glândulas, conferindo-lhes trajetos tortuosos e longos (Kenney, 1978; Leishman et al, 1981).
Na transição de Verão para Outono pode-se observar-se, em algumas éguas, um ligeiro assincronismo entre o comportamento de cio e o estadio do endométrio, e este pode já apresentar um grande grau de atrofia típico de anestro (Snider et al, 2011).
6. Alterações encontradas no útero de equinos que afetam a fertilidade e a classificação uterina
A existência de lesões, bem como a assincronia funcional das células do epitélio endometrial, estão associadas a subfertilidade (Schlafer, 2007) que se vai tornando cada vez mais presente com beneficiações e infeções sucessivas. Situações inflamatórias recorrentes ou crónicas podem resultar em alterações degenerativas do endométrio e morte embrionária precoce (Lepina e Antane, 2011). Na égua, as alterações mais frequentemente diagnosticadas por biópsia endometrial são a fibrose e a inflamação do endométrio (Ganjam e Evans, 2006).
6.1. Inflamação e infeção uterinas
A inflamação uterina tem um impacto negativo importante na fertilidade da égua, em particular por evoluir frequentemente de forma subclínica (Schlafer, 2007; LeBlanc et al, 2009; Snider et al, 2011). Situações inflamatórias do útero comprometem a sobrevivência dos
- 18 -
gâmetas e a fecundação e predispõem a perda fetal precoce, ao aborto, ao desenvolvimento de placentite, à síndrome do neonato séptico, à metrite pós-parto ou ao atraso no retorno à reprodução (LeBlanc et al, 2009). As situações de endometrites podem ser caracterizadas de acordo com o tempo de ocorrência (aguda vs crónica) ou com o seu grau de severidade (leve, moderada ou grave), mas também em função do tipo de células inflamatórias envolvidas (linfócitos ou neutrófilos, entre outras) e o seu padrão de distribuição (multifocal vs difusa; perivascular vs intersticial) (Snider et al, 2011). Reconhece-se também uma variante particular de evolução aguda: a endometrite associada ao coito (Watson, 2000; Doig e Waelchli, 2011).
A existência de uma eventual infeção do endométrio, para além de estimular uma reação inflamatória local, pode originar lesões permanentes do endométrio (Schlafer, 2007), originando uma atrofia endometrial e fibrose do estroma do endométrio (LeBlanc et al, 2009). Nas endometrites agudas, as células predominantes são os neutrófilos (Ferreira Dias et al, 1994), indicando um processo infecioso ativo (Ricketts, 1975; Doig et al, 1981). Observa-se ainda, no epitélio luminal e em algumas áreas do stratum compactum, um infiltrado de células mononucleares, a presença de sinais de degenerescência e, em casos mais severos, de necrose do estroma que podem estar na origem da formação de abcessos. Em casos mais arrastados no tempo pode observar-se um aumento da vascularização do estroma e hiperplasia glandular (Ricketts, 1975). A persistência ou a recorrência de situações de endometrite aguda pode levar a alterações fibróticas no endométrio uterino (Woodward et al, 2012).
Nas endometrites crónicas são os linfócitos que constituem a população imune preponderante, embora se possa ainda encontrar, em menor quantidade, um número variável de plasmócitos, macrófagos, eosinófilos e mastócitos dispersos pelo estroma do endométrio (Kenney, 1978; Doig et al, 1981). Os linfócitos dispersam-se por toda a altura do endométrio (Ricketts, 1975; Kenney, 1978). É frequente, nas situações crónicas, que ocorra perda do epitélio superficial e se observe um aumento da camada de muco que recobre a superfície do endométrio, o que favorece a adesão bacteriana e formação de biofilmes (LeBlanc, 2010). A irritação crónica uterina é caracterizada pela ocorrência de perda de epitélio, exsudado excessivo e hiperplasia epitelial (LeBlanc et al, 2009).
Na análise histopatológica, a morfologia, as características de coloração e localização de bactérias ou fungos podem ajudar a compreender o seu significado, promover a sua identificação e podem servir como pontos de referência para os resultados de uma eventual cultura feita a partir de esfregaços do endométrio (Snider et al, 2011). Dentro dos
- 19 -
microrganismos que podem invadir o ambiente uterino, os mais frequentemente encontrados são: Streptococcus zooepidemicus, Escherichia coli, Pseudomonas aeruginosa, Klebsiella
pneumoniae, e as leveduras (Watson, 2000).
A severidade de uma inflamação apresenta diferentes graus que se encontram descritos e caracterizados na tabela 1.
Tabela 1 – Categorização do infiltrado inflamatório no endométrio em éguas de acordo com Doig et al, (1981).
Grau de infiltração Caracterização
Infiltrações celulares leves
Poucas células inflamatórias, geralmente localizadas no stratum compactum ou ocasionalmente em focos no stratum spongiosum
Infiltrações celulares moderadas
As células do sistema imunitário dispersas pelo stratum compactum e/ou na área periglândular, podendo ainda estar presentes no interior do lúmen glandular.
Infiltrações celulares graves
São caracterizadas por um infiltrado inflamatório difuso em todo o endométrio, acompanhando frequentemente um pleomorfismo do epitélio
6.2. Endometrose
O termo endometrose foi introduzido em 1992 para definir uma fibrose endometrial periglandular e/ou do estroma que pode evoluir de forma ativa ou inativa (Hoffmann et al, 2009; Rebordão et al, 2014). A endometrose é uma doença multifatorial para a qual contribuem a idade, várias gestações, partos, inflamação crónica e problemas endócrinos (Aresu et al, 2012). A irritação crónica uterina é caracterizada pela ocorrência de perda de epitélio, exsudado excessivo e hiperplasia epitelial (LeBlanc et al, 2009).
A endometrose compreende as alterações glandulares com diferenciação atípica, degenerativas ou císticas, com focos de fibrose; pode afetar apenas as glândulas ou ninhos de glândulas (Hoffmann et al, 2008; Lehmann et al, 2011; Ricketts, 1975) (Figura 3). As glândulas uterinas com fibrose passam por alterações cíclicas em resposta às hormonas circulantes (Hoffmann et al, 2009). Esta diferenciação epitelial glandular pode ser dividida em ciclo síncrono, assíncrono ou intermédio (Hoffmann et al, 2009).
- 20 -
A endometrose pode ser resultado de infeções uterinas crónicas, tratamentos mal executados (Sasani e Gharagozlou, 2002) e repetidas lesões inflamatórias (Aresu et al, 2012; Liepina e Antane, 2011). Nas situações de coexistência de endometrite e endometrose, observa-se a estimulação e ativação metabólica dos fibroblastos do estroma endometrial (Hoffmann et al, 2009). No entanto, Vilés e seus colaboradores (2013) afirmam que o grau de inflamação não se encontra relacionado com as alterações fibróticas degenerativas do endométrio das burras.
Figura 3 – Lâmina de biópsia uterina de burra que apresenta fibrose, glandulas com congestão e ninhos de
fibrose periglandular (ampliação 100×). (Fotografia gentilmente cedida pela Prof. Dra. Graça Ferreira-Dias)
Na endometrose observa-se a dilatação cística das glândulas, que se encontram preenchidas com material de secreção e material celular (Walter et al, 2001) No início do processo de endometrose, as células do estroma periglandular apresentam-se poligonais e tem capacidade de produção de fibras de colagénio (Hoffmann et al, 2009) que se organizam em feixes periglandulares e camadas concêntricas de fibroblastos (Keller, 2004). A lâmina basal encontra-se alterada e com acumulação focal de células do estroma que sintetizam colagénio. As alterações fibróticas podem envolver glândulas individuais, isoladas ou apenas seus ramos (Kenney, 1978). Pode verificar-se a presença de nichos de fibrose glandular, que se definem como deposição de fibrose ou tecido cicatricial em torno das glândulas endometriais (McCue, 2009). Em estadios mais avançados predominam células que podem ser metabolicamente ativas ou inativas, sem sinais de produção de colagénio, bem como miofibroblastos (Hoffmann et al, 2009).
- 21 -
Reconhece-se a existência de vários tipos de endometrose:
A endometrose ativa apresenta glândulas simples com fibrose do estroma circundante, com fibroblastos diferenciados de núcleo hipocromático ovoide e citoplasma pálido. Estas células apresentam um aumento dos recetores para os esteroides sexuais (Hoffmann et al, 2009; Lehmann et al, 2011);
A endometrose inativa distingue-se pela existência de pequenos nichos glandulares rodeados por células estromais fusiformes, com disposição periglandular, dispostas paralelamente ao eixo da glândula adjacente. Estas últimas exibem um núcleo hipercromático e um citoplasma alongado e uma diferenciação metabolicamente inativa; observando-se uma redução na sua expressão de recetores para o estrogénio e progesterona (Hoffmann et al, 2009; Lehmann et al, 2011);
A endometrose ativa destrutiva apresenta glândulas rodeadas por células estromais metabolicamente ativas, que são invasivas e penetram no epitélio glandular. Denota-se também uma aparência de diferentes camadas desordenadas e células epiteliais visivelmente degeneradas (Hoffmann et al, 2009; Lehmann et al, 2011);
A endometrose inativa destrutiva caracteriza-se pela presença de glândulas envolvidas por células estromais fibrosadas que se encontram metabolicamente inativas e em que as células epiteliais apresentam destruição multifocal e aglomeração das secreções uterinas (Hoffmann et al, 2009; Lehmann et al, 2011; Mambelli et al, 2013);
Na endometrose destrutiva mista as glândulas são rodeadas por células do estroma ativas e inativas e que penetram no epitélio glandular (Hoffmann et al, 2009; Lehmann et al, 2011).
O grau de severidade de deposição de fibrose é avaliado pelo número de camadas de colagénio (Kenney, 1978). A fibrose dispõe-se em camadas em redor das glândulas ou dos ninhos glandulares, que podem variar entre suave (1 a 3 camadas), moderada (4 a 10 camadas) ou grave (mais de 10 camadas) (Snider et al, 2011). As fêmeas que disponham de mais de 3 camadas de fibrose periglandular no endométrio têm um pobre prognóstico quanto a manter uma gestação, enquanto as fêmeas que tenham menos de 3 camadas de tecido fibrótico têm o dobro da probabilidade de levar a termo uma gestação (Leishman et al, 1982).
A endometrose deve distinguir-se de outras situações de dilatação cística no endométrio que ocorrem em resposta ao aumento da pressão de secreção, a qual pode estar associada a
- 22 -
uma obstrução à secreção glandular (Walter et al, 2001), mostrando-se como uma dilatação generalizada não fibrosada das glândulas, em regra sem material de secreção mucoide que persiste durante a fase fisiológica da época reprodutiva e que também se pode encontrar associada a uma diminuição da fertilidade. No entanto, o progresso desta última não se encontra sob a influência das alterações endócrinas cíclicas e sazonais (Lehmann et al, 2011). A sua prevalência ainda não é conhecida (Ozkan et al, 2008). É considerada uma doença crónica degenerativa do endométrio, que se pensa ser um processo severo, irreversível e progressivo (Watson, 2000; Ganjam e Evans, 2006; Fiala et al, 2010; Rebordão et al, 2014). A endometrose é prevalente em éguas mais velhas que têm como historial reprodutivo incapacidade de conceber, elevadas taxas de aborto e uma aumentada suscetibilidade para a ocorrência de infeções (Ganjam e Evans, 2006; Aresu et al, 2012).
6.2.1. Fibrose endometrial
A fibrose intersticial do endométrio é uma das lesões mais proeminentes associada a degeneração endometrial crónica (Schlafer, 2007), sendo um dos maiores problemas reprodutivos na égua (Rebordão et al, 2014). Os fibroblastos têm como função a síntese e regulação do tecido conjuntivo extracelular (Walter et al, 2001). O colagénio do estroma não se deposita apenas em torno das glândulas endometriais e suas ramificações, uma vez que as células da lâmina própria podem produzir colagénio como resposta a um estímulo ou lesão, como a inflamação crónica entre outros (Snider et al, 2011).
A extensão e a severidade da fibrose encontram-se diretamente relacionadas com a capacidade de levar a termo uma gestação. As éguas com fibrose destrutiva têm menor probabilidade de levar a termo uma gestação comparado com éguas que apresentem fibrose não destrutiva leve (Lehmann et al, 2011). Embora em pequeno número, é possível que éguas diagnosticadas como tendo fibrose generalizada fiquem gestantes. Contudo, na maioria dos casos, ocorre aborto antes dos 90 dias de gestação (Kenney, 1978). A fibrose do endométrio reduz a eficácia dos mecanismos de defesa uterina, bem como, a capacidade de nutrição do feto (Liepina e Antane, 2011). De notar, que mesmo após a inflamação ter terminado o processo de deposição de colagénio pelos fibroblastos e a acumulação de matriz extracelular mantém-se (Fiala et al, 2010; Aresu et al, 2012).
A fibrose normalmente ocorre em torno das glândulas ou em associação com a membrana basal do epitélio luminal. A principal evidência de fibrose é a perda de células do stratum
- 23 -
compactum ou do stratum spongiosum, em torno das glândulas (Kenney, 1978). No entanto,
alguns autores defendem que a fibrose periglandular em tecido endometrial com endometrose não é caracterizada pelo aumento do número de fibras de colagénio mas sim pelo arranjo de fibroblastos na zona periglandular em mais do que uma camada (Walter et al, 2001).
O colagénio interfere com a integridade do epitélio. Tal é evidenciado pelo facto de nos primeiros estádios o epitélio tender a se apresentar hipertrofiado, enquanto, a atrofia e o pleomorfismo ocorrem mais tardiamente. A deposição de colagénio pode ocorrer por baixo da membrana basal do epitélio luminal. Onde interfere com a associação entre as células epiteliais e os capilares sanguíneos (Kenney, 1978). Verificando-se que as glândulas, com fibrose endometrial ou inflamação, apresentam uma diminuição bastante notória de intensidade da coloração. No stratum spongiosum, os esteroides aí existentes e as células que o constituem reconheceram uma assincronia das células que se encontram nas áreas com fibrose periglandular (Schlafer, 2007).
6.3. Hipoplasia e Atrofia endometrial
A hipoplasia endometrial pode refletir uma disfunção endócrina. É muito comum ocorrer em fêmeas mais velhas com fraca atividade ovárica e deve-se ao facto de os ovários não produzirem hormonas esteroides em quantidade suficiente para estimular os seus tecidos-alvo (Doig e Waelchli, 2011). Foi demonstrado que o tecido obtido de éguas com situações de infertilidade prolongadas apresenta uma diminuição do número de glândulas uterinas (Leishman et al, 1982). A atrofia endometrial é causa direta de repetição reprodutiva em éguas multíparas velhas (Kenney, 1978). A atrofia glandular senil, na qual se verifica uma diminuição do número de glândulas, também ocorre em fêmeas mais velhas. A hipoplasia endometrial encontra-se ainda em fêmeas que apresentem inatividade ovárica, um trato genital infantil ou juvenil ou fêmeas com mosaico cromossómico (Ricketts, 1975; Kenney, 1978). A hipoplasia endometrial tem sido associada a imaturidade das fêmeas (Riketts, 1975). Por outro lado, a fibrose compromete a função glandular e a deposição acrescida de colagénio interfere, com o tempo, com a integridade do epitélio, o que provoca a atrofia (Sokka et al, 2001). Na análise histológica, uma atrofia endometrial caracteriza-se pela existência de células epiteliais do epitélio superficial e glandular serem de tipo cuboide inativo e por um lúmen glandular contraído (Doig e Waelchli, 2011). O endométrio encontra-se extremamente fino e com glândulas inativas dispersas, preenchidas com encontra-secreções mais