1
TABELA PERIÓDICA DOS ELEMENTOS QUÍMICOS (TPEQ)
A TPEQ é um diagrama onde estão organizados os elementos químicos conhecidos pelo homem.
Elemento químico: conjunto de todos os átomos com o mesmo número atômico.
Os elementos químicos estão representados na TPEQ através de símbolos.
Regra geral para simbolizar um elemento químico:
“Primeira letra do nome do elemento químico em maiúscula”. Exemplos:
Nome do elemento Símbolo
Oxigênio O
Carbono C
Nitrogênio N
Hidrogênio H
Para os elementos que têm o nome iniciado pela mesma letra de um outro elemento, acrescenta-se a segunda letra em minúscula para diferenciá-los.
Exemplos:
Nome do elemento Símbolo
Cálcio Ca
Hélio He
Ósmio Os
Alguns elementos possuem o símbolo diferente do seu nome em português. Isso porque o seu símbolo é derivado do seu nome em latim.
Exemplos:
Nome em português Nome em latim Símbolo
Ouro Aurum Au
Sódio Natrium Na
Potássio Katrium K
Enxofre Súlfur S
Para simplificar o estudo do comportamento dos diferentes átomos os elementos químicos foram organizados em uma tabela pelo pesquisador Mendeleev.
Figura 1. Dmitri Ivanovich Mendeleev (1834-1907).
Essa tabela denomina-se Tabela Periódica dos Elementos Químicos (TPEQ) e nela os elementos são agrupados em ordem crescente de número atômico (Z).
Sobre cada elemento químico a tabela nos dá muitas informações indicadas em cada célula. Toda tabela possui uma célula legenda mostrando as informações que ali estão contidas.
2 Figura 2. Legenda de um elemento atômico da tabela periódica.
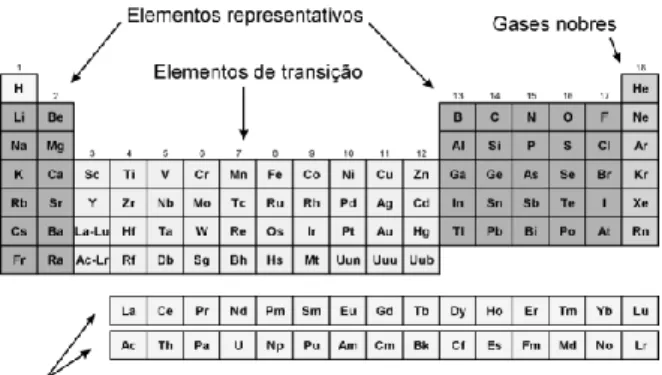
Além das células a TPEQ possui linhas e colunas:
As linhas são denominadas períodos. A TPEQ possui 7 períodos;
As colunas são denominadas famílias ou grupos. A TPEQ possui 18 grupos. Períodos:
Os elementos que fazem parte de um mesmo período têm o mesmo número de camadas eletrônicas ao redor de seus núcleos.
Observação: o 1º período é o mais curto, tendo somente dois elementos: hidrogênio (H) e hélio (He). Colunas, Grupos ou Famílias:
As famílias são divididas em dois grupos:
GRUPO A: formado pelas colunas 1, 2, 13, 14, 15, 16, 17 e 18. GRUPO B: formado pelas colunas 3, 4, 5, 6, 7, 8, 9, 10, 11 e 12.
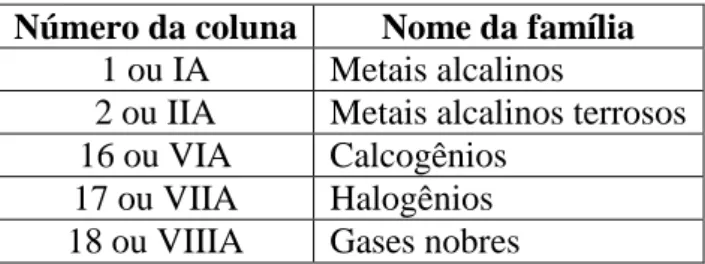
Algumas famílias do grupo A recebem nomes especiais. Observe:
Número da coluna Nome da família
1 ou IA Metais alcalinos
2 ou IIA Metais alcalinos terrosos 16 ou VIA Calcogênios
17 ou VIIA Halogênios 18 ou VIIIA Gases nobres
Observação: para as famílias A, o seu número (1A, 2A, 3A, 4A, 5A, 6A, 7A e 8A) representa o número de elétrons do elemento na última camada (camada de valência).
As colunas A são as mais estudadas no ensino básico e seus elementos são denominados representativos (o último elétron distribuído na eletrosfera está nos subníveis s ou p).
As colunas B são dos elementos de transição (o último elétron distribuído na eletrosfera está nos subníveis d ou f).
Quando a família não tem nome especial, é comum citá-la pelo nome do primeiro elemento que nela aparece. Metais, Semi-metais, Ametais e Gases Nobres:
Metais: existem, aproximadamente, 86 elementos metálicos. Em temperatura ambiente são sólidos (com exceção do mercúrio, que é líquido), dúcteis (apresentam a capacidade de formar fios), maleáveis, bons condutores de calor e energia e possuem brilho característico. Possuem tendência em doar elétrons.
Ametais: são 11 elementos. Têm propriedades opostas aos metais. Possuem tendência em receber elétrons. Semi-metal: são 7 elementos. Têm propriedades intermediárias aos metais e ametais.
Gases nobres: são 6 elementos (pertencentes à coluna 18 ou 8A). São gasosos e são denominados nobres por serem os únicos elementos encontrados isolados na natureza, isto é, sem realizarem ligações químicas com outros elementos.
OBS.: O hidrogênio tem características distintas de todos os demais elementos e, em algumas tabelas periódicas é representado à parte, ou representado duplamente sobre a família dos metais alcalinos e sobre a dos halogênios, pois manifesta características dessas duas famílias.
3 Figura 3. Localização dos elementos na tabela periódica.
Propriedades Periódicas dos elementos
1) Raio Atômico: simplificadamente, o raio atômico é a distância entre o centro do átomo e a sua camada de valência, que é a última camada preenchida com elétrons “a mais externa”.
Figura 4. Raio atômico (d) Obedece aos seguintes critérios:
Quanto maior o número de camadas (níveis), maior o raio atômico (nas famílias, o raio atômico aumenta de cima para baixo, porque aumenta o numero de camadas);
Quanto maior o número de prótons (número atômico), maior a atração do núcleo sobre os elétrons e menor o raio atômico (nos períodos, o raio atômico aumenta da direita para a esquerda).
Figura 5. Variação do raio atômico na TPEQ. 2) Eletronegatividade: é a capacidade que um átomo tem, de atrair elétrons.
A eletronegatividade de um átomo está intimamente relacionada com o seu raio atómico: Quanto menor o tamanho do átomo, maior a eletronegatividade desse átomo.
4
ATENÇÃO: a eletronegatividade não é definida para os gases nobres.
3) Eletropositividade ou caráter metálico: é a capacidade que um átomo tem, de perder elétrons.
Um aumento no número de camadas diminui a força de atração do núcleo sobre os elétrons da camada de valência, facilitando a perda de elétrons pelo átomo e, consequentemente, aumentando a sua eletropositividade. Os gases nobres são excluídos, pois não têm tendência em perder elétrons.
Nos períodos a eletropositividade cresce da direita para a esquerda e nas famílias de cima para baixo:
Figura 7. Sentido de aumento da eletropositividade.
EXERCÍCIOS
1. Na tabela periódica os elementos encontram-se organizados em ordem crescente de
____________________.
2. Um elemento localizado no terceiro período possui ____ camadas eletrônicas. 3. A coluna 2 recebe o nome de Família dos Metais _________________________. 4. Consulte a tabela periódica e dê o nome dos elementos abaixo:
a) Pb b) Sb c) Na d) S e) Li f) C g) Ca h) N i) P j) Se k) Au l) O m) B n) Mg o) K p) Ba q) F r) Mn s) Ni t) Ag u) Fe
5. Qual o número atômico do terceiro elemento da família dos metais alcalinos-terrosos? Quantos elétrons
ele possui? Como esses elétrons estão distribuídos na eletrosfera?
6. Qual é o segundo elemento da família do boro?
7. A que família e período pertencem o elemento de número atômico igual a 18? 8. Cite 3 características dos metais.
9. Quais são os elementos do 2º período da tabela periódica?
10. O que os elementos químicos de um mesmo período possuem em comum?
11. Dados os elementos abaixo e suas localizações na tabela periódica, assinale a(s) proposição (ões) VERDADEIRA(S):
01. Entre os átomos A, B e C, o de maior raio atômico é A.
02. Entre os átomos A, D, F e I, o de menor número de camada é I. 04. Entre os átomos I, L, H e E, o mais eletronegativo é E.
08. O maior caráter metálico, entre todos os átomos da tabela dada, é apresentado por C.
12. Leia o texto abaixo e responda:
O ar,
É a principal fonte para se existir; Se você quer colaborar Nós estamos aqui para te ajudar
Ah! Eu sei Eu sei,
Que o ar poluído vai nos prejudicar, Mas isso não impede que eu repita: “O ar é vida, vou ganhar esta partida!!”!
Sobre os componentes do ar puro (principais componentes: gás nitrogênio, gás oxigênio e gás argônio), podemos afirmar que:
01. O elemento químico oxigênio é um gás nobre. 02. Entre os halogênios, encontraremos o nitrogênio. 03. O argônio é um gás nobre.
04. Nitrogênio, oxigênio e argônio pertencem a uma mesma família da tabela periódica. 05. Oxigênio é calcogênio e argônio é gás nobre.
13. “De todos os materiais recicláveis os metais são, sem dúvida, um dos mais vantajosos e lucrativos, pois,
podem ser reciclados diversas vezes sem perder suas propriedades”. Os metais recicláveis podem ser divididos em dois grupos: Metais ferrosos e metais não ferrosos. Os metais não ferrosos, no entanto, são mais rentáveis e sua reciclagem é mais destacada. A grande estrela dos metais não ferrosos é o alumínio (Al: Z = 13). Sobre o texto e temas relativos, analise as afirmativas abaixo:
01. Os metais constituem a maioria dos elementos químicos.
02. O alumínio é um elemento químico que se localiza na família 3A. 03. Encontraremos o alumínio no 3º período da classificação periódica. 04. Podemos afirmar que o alumínio é um elemento de transição.
05. Outros metais não ferrosos são: cobre e chumbo, que também são metais representativos da tabela periódica.
14. Analise as afirmações e assinale as corretas:
01. Entre os metais alcalinos o raio atômico aumenta de cima para baixo. 02. Em geral os calcogênios formam íons com duas cargas negativas. 03. Ametais são elementos de baixa eletronegatividade.
04. Polônio, flúor e hélio são todos gases nobres.
15. Em uma família ou período, quanto menor o átomo, mais ... será a retirada do elétron. Logo, devemos
esperar uma ... eletronegatividade”. O texto será corretamente preenchido pela alternativa: a) Fácil; maior. b) Fácil; menor. c) Difícil; maior. d) Difícil; menor. e) Rápida; baixo.
16. Um determinado elemento químico está situado no quarto período da tabela periódica e pertence à
família 6A. Sobre este elemento afirma-se: 01. Tem seis elétrons em sua última camada. 02. Apresenta três camadas eletrônicas. 03. É um calcogênio.
04. Possui baixa eletronegatividade.
05. Pertence à mesma família do oxigênio.
17. A chuva corresponde a uma mudança de estado físico da matéria, e em regiões poluídas torna-se ácida.
Esta chuva ácida causa um grande impacto no meio ambiente ao cair em áreas naturais que não suportam uma acidez elevada. Os efeitos dessas chuvas podem ser verificadas em riachos e lagos, onde ocorre grande mortandade de peixes; e em florestas, onde suas árvores sofrem corrosão tanto nas folhas como nos galhos. A molécula de água pura é constituída por átomos de hidrogênio (Z = 1) e oxigênio (Z = 8). Sobre estes elementos afirma-se que:
a) O hidrogênio é mais eletronegativo que o oxigênio. b) O raio atômico do oxigênio é menor que o do hidrogênio. c) Oxigênio e hidrogênio são semimetais.
d) O hidrogênio é um metal alcalino. e) O oxigênio é um calcogênio.
18. Um determinado elemento químico está situado no quarto período da tabela periódica e pertence à
família 6A. Sobre este elemento afirma-se: 01. Tem seis elétrons em sua última camada. 02. Apresenta três camadas eletrônicas. 03. É um calcogênio.
04. Possui baixa eletronegatividade. 05. Pertence à mesma família do oxigênio.
19. O elemento químico flúor, de número atômico 9, possui:
a) Alta eletronegatividade. b) 6 elétrons na camada de valência. c) Um raio atômico maior que o potássio. d) Características metálicas.
e) Grande facilidade de conduzir a corrente elétrica.
20. Para os elementos de um mesmo período, no sentido da esquerda para a direita e para elementos de um
mesmo grupo, no sentido de cima para baixo, na tabela periódica, a eletronegatividade, respectivamente: a) Aumenta e diminui. b) Aumenta e aumenta.
c) Diminui e aumenta. d) Diminui e diminui. e) Aumenta e não varia.
21. Um elemento que tem raio atômico grande e baixa eletronegatividade é provavelmente um:
a) Metal. b) Ametal. c) Semimetal. d) Gás nobre. e) Halogênio.
22. Por que os ametais são elementos eletro negativos?
ATIVIDADE DE PRODUÇÃO Construindo conhecimento
Construir a tabela periódica, a partir do material de apoio. Pesquisar e discutir com seu professor a história da TPEQ.