Marcelo Veronesi Fukuda
Contribuição ao conhecimento taxonômico
dos silídeos (Polychaeta: Syllidae) da
região sudeste-sul do Brasil
Contribution to the taxonomic knowledge of the
syllids (Polychaeta: Syllidae) from
southeastern-southern Brazil
Marcelo Veronesi Fukuda
Contribuição ao conhecimento taxonômico
dos silídeos (Polychaeta: Syllidae) da
região sudeste-sul do Brasil
Contribution to the taxonomic knowledge of the
syllids (Polychaeta: Syllidae) from
southeastern-southern Brazil
Tese apresentada ao Instituto de
Biociências da Universidade de
São Paulo, para a obtenção de
Título de Doutor em Ciências, na
Área de Zoologia.
Orientador: João Miguel de
Matos Nogueira
Fukuda, Marcelo Veronesi
Contribuição ao conhecimento
taxonômico dos silídeos (Polychaeta:
Syllidae) da região sudeste-sul do Brasil
340 p.
Tese (Doutorado) - Instituto de
Biociências da Universidade de São
Paulo. Departamento de Zoologia.
1. Polychaeta 2. Syllidae 3.
Taxonomia I. Universidade de São
Paulo. Instituto de Biociências.
Departamento de Zoologia.
Comissão Julgadora:
Prof(a). Dr(a). Prof(a). Dr(a).
Prof(a). Dr(a). Prof(a). Dr(a).
Resumo
Syllidae Grube, 1850 é uma das maiores famílias de poliquetas, caracterizada por apresentar animais errantes de corpos relativamente pequenos, com segmentação homônoma e parapódios unirremes internamente sustentados por acículas, excepcionalmente adquirindo condição birreme nas formas epítocas; associado à porção posterior da faringe, o proventrículo, estrutura muscular em forma de barril que pode ser facilmente visualizado por transparência através da superfície do corpo, é uma das sinapomorfias da família. O grupo destaca-se pela variedade de estratégias reprodutivas, com representantes apresentando, em geral, o fenômeno da epitoquia, mas também sendo encontradas incubação externa de ovos, viviparidade, partenogênese e arquitomia. Syllidae conta atualmente com 5 subfamílias, Syllinae Grube, 1850, Autolytinae Langerhans, 1879, Exogoninae Langerhans, 1879, Eusyllinae Malaquin, 1893, e Anoplosyllinae Aguado & San Martín, 2009, divididas de acordo com a morfologia dos palpos, antenas, cirros peristomiais e cirros dorsais ao longo do corpo, além do formato da faringe e proventrículo.
Apesar de ser uma das famílias mais abundantes e diversificadas dentre todos os Polychaeta, o estado do conhecimento da fauna de silídeos ocorrendo ao longo do litoral brasileiro ainda é bastante pobre. Até o momento, foram registrados apenas 25 gêneros e 84 espécies para a costa brasileira, o que é relativamente pouco em comparação com outras regiões onde a fauna de silídeos é melhor conhecida, como a Península Ibérica, por exemplo.
A presente Tese consiste em um estudo taxonômico dos Syllidae da região sudeste/sul do Brasil, a partir de material coletado por três projetos independentes: “REVIZEE/Score Sul/Bentos Marinho”, “BIOTA/FAPESP/Biodiversidade Bêntica Marinha no Estado de São Paulo”, e “Biodiversidade de Anelídeos Poliquetas em Costões Rochosos ao Longo do Estado de São Paulo”.
As identificações foram feitas com base em caracteres morfológicos, utilizando microscópio óptico e, em alguns casos, microscópio eletrônico de varredura (MEV), com o auxílio de bibliografia especializada e atualizada. No caso de algumas espécies, foram feitas comparações com material-tipo e espécimes coletados em outras localidades. Para as ilustrações, foram utilizadas câmaras-clara e fotográfica digital acopladas ao microscópio óptico, além de MEV.
Abstract
Syllidae Grube, 1850, is one of the largest polychaete families, comprehending relatively small-bodied errant animals, with homonomous segmentation and uniramous parapodia internally sustained by aciculae, exceptionally biramous in epitokous forms; located at the posterior part of the pharynx, the proventricle, a barrel-shaped muscular structure easily seen by transparency through the body wall, is one of the synapomorphies of the family. The group is notorious by the diversity of reproductive strategies, with representatives usually presenting the phenomena of epitoky, but external brooding of eggs, viviparity, parthenogenesis and architomy are all also found among syllids. Syllidae currently consists on 5 sub-families, Syllinae Grube, 1850, Autolytinae Langerhans, 1879, Exogoninae Langerhans, 1879, Eusyllinae Malaquin, 1893, and Anoplosyllinae Aguado & San Martín, 2009, defined by the morphology of the palps, antennae, peristomial and dorsal cirri, and by the shape of the pharynx and proventricle.
Despite being one of the most abundant and diverse families of Polychaeta, the state of knowledge of the syllid fauna occurring off the Brazilian coast is still poor. Up to the present, only 25 genera and 84 species have been registered for the area, which is a relatively low number compared to regions where the syllid fauna has been more extensively investigated, as the Iberian Peninsula, for example.
The present Thesis is a taxonomic study of the Syllidae from the southeastern-southern coast off Brazil, based on material collected by three independent projects: ‘REVIZEE/Score Sul/Bentos Marinho’, ‘BIOTA/FAPESP/Benthic Marine Biodiversity in the State of São Paulo’, and ‘Biodiversity of Intertidal Polychaetes (Annelida: Polychaeta) on Rocky Shores off the State of São Paulo’.
Identifications were based on morphological characters seen under compound light microscope and, in some cases, scanning electron microscope (SEM), with the aid of specialized and updated scientific literature. For some species, comparisons were made with type-material and specimens from other localities. Illustrations were done with the aid of drawing tubes and/or digital camera attached to the microscope, in addition to the SEM images, when available.
1
I-) INTRODUÇÃO
A Classe Polychaeta engloba animais aquáticos, em sua maioria marinhos, e conta atualmente com cerca de 80 famílas e 9000 espécies, contendo tanto animais errantes, vágeis, quanto sedentários, tubícolas, com os mais variados hábitos de vida (Rouse & Pleijel, 2001).
Os poliquetas podem ser encontrados em praticamente todos os ambientes marinhos, desde a zona entremarés até grandes profundidades, junto a fontes hidrotermais nos leitos oceânicos. Apesar de também existirem formas planctônicas, havendo, inclusive, algumas famílias restritas a este domínio, são animais principalmente bentônicos, figurando entre os organismos mais abundantes e frequentes no bentos marinho (Amaral & Nonato, 1996).
Tal expressividade também se reflete em sua importância ecológica, uma vez que os poliquetas exercem importante papel na dinâmica dos ecossistemas marinhos, atuando na ciclagem de nutrientes (Nichols, 1970; Myers, 1977) e como fonte de alimento para outros organismos, como, por exemplo, gastrópodes (Kohn, 1959; Leviten, 1976) e várias espécies de peixes. Neste último caso, os poliquetas chegam a representar quase 80 % do conteúdo estomacal de algumas espécies (Amaral & Migotto, 1980; Amaral et al., 1994).
Além disso, muitos poliquetas têm importância direta para o homem, com algumas espécies sendo importantes bioindicadores de ambientes eutrofizados (Amaral et al., 1998; Licciano et al., 2007), enquanto outras são utilizadas para atividades de lazer, servindo de isca para pesca (Olive, 1994; Fidalgo e Costa, 1999).
A classe poliqueta foi, durante muitos anos, dividia em duas grandes ordens, Sedentaria Lamarck, 1818, e Errantia Audouin & Milne Edwards, 1834, com base principalmente na estrutura da região anterior e nos hábitos de vida dos animais. Outras classificações seguindo esquemas hierarquizados em ordens e subordens foram propostas por diversos autores; muitas destas classificações, no entanto, ainda que adotando nomes diferentes, praticamente resgatavam em grande parte a divisão em Errantia e Sedentaria, estando as diferenças no arranjo dos táxons em níveis mais específicos (ver Fauchald & Rouse, 1997).
2
estavam ali alocados por não poderem ser enquadrados claramente em nenhuma das duas grandes ordens.Mais recentemente, adotando métodos cladísticos, Rouse & Fauchald (1997) dividiram os Polychaeta em dois grupos, Palpata e Scolecida. Em Palpata, encontramos a subdivisão em Canalipalpata e Aciculata, formando agrupamentos semelhantes a, respectivamente, Sedentaria e Errantia; em Scolecida, foram alocadas famílias de relações menos conhecidas, em parte resgatando o agrupamento dos Archiannelida.
Estas propostas, contudo, referem-se a filogenias baseadas em caracteres morfológicos; vários grupos desta forma tradicionalmente aceitos, contudo, não puderam ser recuperados em análises baseadas em dados moleculares (Rousset et al., 2007).
Assim, estudos mais recentes vêm apontando de forma cada vez mais incisiva para o parafiletismo de Polychaeta com a exclusão de Clitellata, havendo, ainda, fraco suporte para a definição do próprio Filo Annelida e de muitos grupos de “Polychaeta” (McHugh, 1997, 2005; Westheide, 1997; Bleidorn et al., 2003; Garraffoni & Amorin, 2003; Worsaae et al., 2005; Rousset et al., 2007).
De acordo com a classificação tradicional proposta por Fauchald (1977), a família Syllidae enquadra-se na Ordem Phyllodocida Dales, 1962, Subordem Nereidiformia Benham, 1894.
A primeira descrição conhecida de um silídeo data do século XVIII. Na ocasião, O.F. Müller (1771), utilizando a então recém criada classificação linneana, descreveu a espécie Nereis armillaris, hoje alocada no gênero Syllis, subfamília Syllinae. Nessa primeira fase da história do conhecimento da família, vários animais hoje reconhecidos como silídeos foram descritos por diversos autores, como, dentre muitos outros, Audouin & Milne Edwards (1834), e Lamarck (1818), este último tendo proposto o gênero Syllis, que, mais tarde, viria a dar nome à família. Por essa época, os silídeos descritos careciam de uma posição taxonômica mais rigorosa, sendo apenas destacada sua similaridade com Nereis. Foi somente então, numa grande revisão do Filo Annelida, que Grube (1850) descreveu a família Syllidea Grube, 1850, reconhecendo a existência de um grupo conciso formado por esses animais, que começaram a ser descritos havia menos de cem anos.
3
Agassiz (1862), que descreveu o ciclo reprodutivo de Autolytus cornutus Agassiz, 1862 (hoje alocado no gênero Proceraea Ehlers, 1864).Alguns anos após a descrição da família, Langerhans (1879) propôs três tribos para melhor acomodar os silídeos: Syllideae Grube, 1850, Exogoneae Langerhans, 1879, e Autolyteae Langerhans, 1879. Complementando esta nova divisão, Malaquin (1893) adicionou a tribo Eusylleae Malaquin, 1893. O trabalho de Malaquin (1893) foi a primeira grande monografia específica sobre Syllidae, descrevendo espécies novas, propondo novas classificações e abordando aspectos de sua biologia.
No século XX, Fauvel (1923) lança sua obra “Polychètes Errantes”, da série “Faune de France”, complementando-a posteriormente com as formas sedentárias (Fauvel, 1927). Estas duas obras são consideradas marcos na taxonomia de poliquetas, sendo que chaves de identificação nelas incluídas ainda são úteis para alguns grupos. Fauvel (1923) e, mais tarde, Rioja (1925) elevaram ao nível de subfamília os grupos de silídeos até então considerados como tribos, divisão vigente até hoje. Mais recentemente, destaca-se a obra de San Martín (2003), da série “Fauna Iberica”, como uma síntese dos conhecimentos sobre a família Syllidae, além de apresentar todas as espécies do grupo até então conhecidas na Península Ibérica.
Portanto, a partir da segunda metade do século XIX, os Syllidae são subdivididos em quatro grupos: Autolytinae Langerhans, 1879, caracterizada pela perda secundária de cirros ventrais, ou fusão dos mesmos aos parapódios, conforme defendido por San Martín (2003); Eusyllinae Malaquin, 1893, englobando silídeos com palpos fundidos na base e apêndices (antenas, cirros peristomiais e cirros dorsais) lisos ou irregularmente articulados; Exogoninae Langerhans, 1879, silídeos com palpos completamente fundidos, ou com uma pequena bifurcação terminal, e apêndices inarticulados, geralmente curtos; e Syllinae Grube, 1850, animais com palpos completamente separados e apêndices articulados (moniliformes).
4
Os silídeos são poliquetas errantes, de corpo subcilíndrico, geralmente apresentando a porção dorsal convexa e a ventral, plana. Em muitas espécies, em especial alguns membros da subfamília Autolytinae, padrões de coloração de complexidade bastante variável, por vezes exuberantes, podem estar presentes. Além da coloração, papilas podem também recobrir o dorso e parapódios, dispostas em padrões variados, por vezes dificultando a observação do animal, por favorecerem a aglutinação de detritos.A região da cabeça, formada pelo prostômio (Fig. 1: pro), é bem definida, com um par anterior de palpos (Fig. 1: p), geralmente triangulares, com grau de fusão variável; os Autolytinae apresentam os palpos rebatidos para baixo do prostômio, frequentemente inconspícuos dorsalmente. Em sua maioria, os silídeos apresentam prostômio com dois pares de olhos relativamente complexos, lenticulados (Verger-Bocquet, 1983); em muitas espécies, um par manchas ocelares pode também estar presente próximo da margem anterior do prostômio. Em geral, os silídeos apresentam ainda três antenas no prostômio, inseridas em pontos próximos ou separadas, a central (Fig. 1: ac) geralmente maior do que as laterais (Fig. 1: al).
Imediatamente após o prostômio, circundando a parte posterior do mesmo, localiza-se o peristômio (Fig. 1: per), também conhecido como segmento tentacular ou bucal. O peristômio é aqueto e possui 1-2 pares de cirros peristomiais (Fig. 1: cpd, cirro peristomial dorsal; cpv, cirro peristomial ventral). Em geral mais fino e mais curto do que os setígeros, o peristômio pode ser inconspícuo dorsalmente; pode, ainda, recobrir o prostômio por extensão variável, e, em algumas espécies, formar um lóbulo nucal que recobre a parte posterior do prostômio (Figs. 12A-B; 13A, C; 14A-D; 66A-B, E). Entre o prostômio e o peristômio localizam-se os órgãos nucais, com função quimiorreceptora, dispostos como um par de curtas fendas ciliadas em posição dorso-lateral (Figs. 29E; 41E), ou como densas fileiras de cílios (Figs. 12A-B; 14A-D; 66B, E); nos Autolytinae e em Amblyosyllis Grube, 1857 (Eusyllinae), os órgãos nucais apresentam-se como projeções nucais estendendo-se em direção posterior (épaulettes), de extensão variável (Fig. 4B). Além de nos órgãos nucais, ciliação pode também estar presente nos palpos e prostômio (Figs. 14A-D; 62B, D), em fileiras transversais no dorso (Figs. 15B; 84D; 86B) e ventre (Figs. 85A-E; 86C) dos segmentos, fileiras longitudinais laterais (Fig. 62E), em tufos nos parapódios (Figs. 10E, 84C), ou ainda irregularmente distribuída nas antenas e cirros.
5
formas epítocas; os cirros ventrais (Fig. 1: cv) são geralmente mais curtos do que os lóbulos parapodiais, mas encontram-se ausentes nos Autolytinae (ou, talvez, fundidos aos lóbulos parapodiais; San Martín, 2003). Internamente, os parapódios são sustentados por acículas, de número e morfologia variáveis.Fig. 1. Esquema da região anterior de Haplosyllis em vista dorsal, mostrando as estruturas
6
Antenas, cirros peristomiais, cirros dorsais e cirros anais, comumente denominados coletivamente como “apêndices”, apresentam uma variedade de formatos, desde papiliformes, ovais (Figs. 40A; 41A), passando por subulados, com bases esféricas e pontas afiladas (Fig. 55A), até alongados filiformes; neste último caso, podem ser tanto lisos, sem articulação (Figs. 10A-B, D-E; 16A), articulados apenas em uma porção do apêndice, padrão denominado “pseudoarticulado” (Fig. 21A), ou totalmente articulados, em padrão moniliforme (Figs. 62A-F; 76A-F; 81A). Em apêndices moniliformes, o número de artículos não necessariamente reflete o tamanho relativo entre os apêndices, uma vez que o tamanho dos artículos pode variar de acordo com o apêndice e, no caso dos cirros dorsais, com a região do corpo.Em Syllidae há tanto cerdas simples quanto compostas, estas últimas geralmente de articulação heterogonfa. As cerdas simples consistem em uma dorsal (p. ex., Figs. 2B; 12F; 30E-F; 66D), e outra ventral (p. ex., Figs. 7D; 15F; 32H; 68M), geralmente presentes ao menos nos setígeros posteriores. As cerdas compostas são principalmente falcígeras (p. ex., Figs. 2A; 5A-B; 33B, E-F, I; 68A-K), embora várias espécies apresentem também cerdas denominadas pseudoespinígeras (p. ex., Figs. 32A; 41F; 77E), termo proposto por San Martín (1992), uma vez que suas lâminas são proporcionalmente mais grossas e menos alongadas e pontiagudas do que as típicas cerdas espinígeras encontradas em diversas outras famílias de Polychaeta (Dorsey & Phillips, 1987). Hastes e lâminas podem ser espinuladas, e as lâminas são uni- ou bidentadas, quase sempre distalmente recurvadas. Em algumas raras exceções, cerdas podem ser secundariamente simples, pela perda da lâmina (Figs. 45A; 80I-J) ou fusão desta à haste (Figs. 73B; 74E-H).
Na extremidade posterior, o corpo termina em um pigídio com um par de cirros anais semelhantes aos cirros dorsais posteriores, ou mais longos do que estes (Figs. 3A; 23L; 30J; 81I). Uma proeminente papila pode estar presente entre o par de cirros anais (Figs. 24H; 28H).
Internamente, a faringe (Fig. 1: f) estende-se por um número variável de segmentos a partir da boca, esta localizada no peristômio. A faringe pode ser inerme ou, mais comumente, armada com um dente (Fig. 1: df), uma fileira completa ou incompleta de dentículos (trépano), ou ambos.
7
Todas estas variações morfológicas são importantes caracteres taxonômicos, definindo espécies, ou mesmo gêneros e subfamílias. Além disso, também bastante importante para a classificação principalmente das subfamílias, são os aspectos reprodutivos empregados pelos animais, capítulo em que os silídeos merecem destaque dentre os invertebrados.O fenômeno da reprodução dos silídeos que mais atraiu a atenção dos pesquisadores desde o seu descobrimento é a epitoquia. Neste processo, compartilhado com outras famílias de poliquetas, a forma átoca (bentônica, mais duradoura) dá origem a formas epítocas (planctônicas, de curta existência), cuja função é o transporte e liberação dos gametas.
O enxameamento, quando os epítocos vão todos simultaneamente para a coluna d’água, é desencadeado por diversos fatores, tais como o ciclo lunar, duração dia/noite, temperatura da água, etc. Epítocos machos e fêmeas se reconhecem frequentemente através de ferormônios, em algumas espécies havendo também interação através de pulsos de bioluminescência (Fischer & Fischer, 1995), ocorrendo então a liberação dos gametas.
Em Syllidae, a formação dos epítocos pode se dar através de duas maneiras (Franke, 1999):
8
O cuidado parental também está presente na família, com espécies apresentando armazenamento de ovos, através de sacos ovígeros ou presos junto ao corpo, este último caso sendo particularmente importante em Exogoninae. Neste grupo, a incubação se dá por dois processos distintos, o que, segundo San Martín (2005), diferenciaria duas linhagens dentro da subfamília, possivelmente tornando-a polifilética, uma vez que cada uma ter-se-ia originado a partir de ancestrais distintos. Em um destes tipos, a incubação é dorsal, por meio de notocerdas capilares especializadas, enquanto no outro ela é ventral, através de secreções de glândulas adesivas ventrais; neste último caso, os juvenis permanecem ligados à forma parental, recebendo nutrientes desta e se desenvolvendo até um estágio com vários setígeros, quando então são liberados (San Martín, 2005).Em alguns casos menos comuns, a reprodução em Syllidae pode ainda envolver viviparidade, hermafroditismo sequencial ou simultâneo, dança nupcial e transferência direta de espermatozóides através de espermatóforos. Além desses processos reprodutivos sexuados, pode haver ainda partenogênese e reprodução assexuada por fragmentação do corpo seguida de regeneração (arquitomia) (Franke, 1999).
Os Syllidae podem ser encontrados em grande abundância e diversidade em praticamente qualquer ambiente marinho, ainda que sejam ligeiramente mais raros em grandes profundidades (San Martín, 2003). Assim, há formas epítocas planctônicas e formas átocas bentônicas presentes nos mais variados habitats, incluindo formas intersticiais componentes da meiofauna arenosa (Westheide, 1974a; Nogueira et al., 2004; Riera et al., 2007; di Domenico et al., 2009) e da criptofauna de diversos tipos de substratos marinhos, como recifes de corais, esponjas, algas e bancos de moluscos, dentre outros, da zona entremarés ao infra-litoral, e em ambientes de profundidade, em comunidades associadas a fontes hidrotermais (San Martín, 2004).
9
briozoários e tunicados (San Martín, 2003; Nygren, 2004) e de ofiuróides (San Martín, 2003). Além disso, o parasitismo também está presente na família, ainda que mais raro, com representantes ecto-parasitas de hidrozoários (San Martín, 2003), crustáceos (Martin et al., 2008) e outros poliquetas (Treadwell, 1909).321
V-) CONSIDERAÇÕES FINAIS
O presente trabalho analisou a fauna de silídeos a partir de material coletado por 3 projetos independentes. Dessa forma, foram obtidos animais desde a zona entremarés, componentes da meiofauna arenosa ou de fauna associada a costões rochosos e fital, até representantes de ambientes de profundidade, alcançando os 800 m.
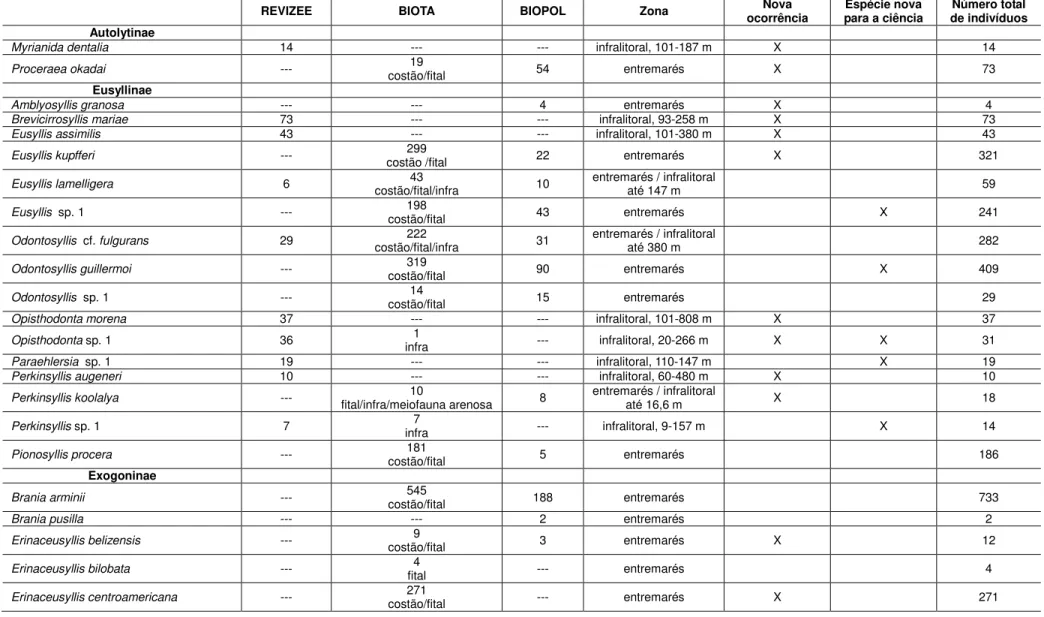
Como era de se esperar, conforme dados encontrados na literatura (p. ex. San Martín, 2003; 2004), foi encontrada uma maior diversidade e abundância de silídeos na zona entremarés até ambientes de profundidades relativamente baixas (Tabela 1). Assim, das 83 espécies analisadas no presente estudo, 55 foram encontradas na zona entremarés, 46 das quais exclusivamente nesta faixa (Tabela 1).
A Tabela 1 sumariza as espécies abrangidas pela presente Tese, bem como os projetos e ambientes nos quais foram encontradas, explicitando as espécies novas para a ciência, e novas ocorrências para a costa brasileira.
Conforme já dito, antes do presente estudo, a família Syllidae contava com a ocorrência de 84 espécies na costa brasileira. Com os novos registros aqui apresentados, incluindo novas ocorrências e espécies novas para a ciência, que serão formalmente descritas em breve, o Brasil passa a contar com 139 espécies de silídeos registradas. Vale destacar, contudo, que esta deve ser uma pequena parcela do real número de espécies do grupo na costa brasileira, uma vez que a quase totalidade desses registros é referente à região sudeste-sul do Brasil, particularmente ao litoral de São Paulo, e com uma baixa variedade de tipos de ambientes amostrados.
322
Tabela 1. Espécies abrangidas pelo presente estudo, explicitando as quantidades de espécimes encontrados em cada projeto e, no caso do projeto “BIOTA/FAPESP/Bentos Marinho”, também o tipo de ambiente.
REVIZEE BIOTA BIOPOL Zona ocorrência Nova para a ciência Espécie nova de indivíduos Número total Autolytinae
Myrianida dentalia 14 --- --- infralitoral, 101-187 m X 14
Proceraea okadai --- costão/fital 19 54 entremarés X 73
Eusyllinae
Amblyosyllis granosa --- --- 4 entremarés X 4
Brevicirrosyllis mariae 73 --- --- infralitoral, 93-258 m X 73
Eusyllis assimilis 43 --- --- infralitoral, 101-380 m X 43
Eusyllis kupfferi --- costão /fital 299 22 entremarés X 321
Eusyllis lamelligera 6 costão/fital/infra 43 10 entremarés / infralitoral até 147 m 59
Eusyllis sp. 1 --- costão/fital 198 43 entremarés X 241
Odontosyllis cf. fulgurans 29 costão/fital/infra 222 31 entremarés / infralitoral até 380 m 282
Odontosyllis guillermoi --- costão/fital 319 90 entremarés X 409
Odontosyllis sp. 1 --- costão/fital 14 15 entremarés 29
Opisthodonta morena 37 --- --- infralitoral, 101-808 m X 37
Opisthodonta sp. 1 36 infra 1 --- infralitoral, 20-266 m X X 31
Paraehlersia sp. 1 19 --- --- infralitoral, 110-147 m X 19
Perkinsyllis augeneri 10 --- --- infralitoral, 60-480 m X 10
Perkinsyllis koolalya --- fital/infra/meiofauna arenosa 10 8 entremarés / infralitoral até 16,6 m X 18
Perkinsyllis sp. 1 7 infra 7 --- infralitoral, 9-157 m X 14
Pionosyllis procera --- costão/fital 181 5 entremarés 186
Exogoninae
Brania arminii --- costão/fital 545 188 entremarés 733
Brania pusilla --- --- 2 entremarés 2
Erinaceusyllis belizensis --- costão/fital 9 3 entremarés X 12
Erinaceusyllis bilobata --- fital 4 --- entremarés 4
323
REVIZEE BIOTA BIOPOL Zona ocorrência Nova para a ciência Espécie nova de indivíduos Número total
Erinaceusyllis perkinsi 12 fital/infra/meiofauna arenosa 50 2 entremarés / infralitoral até 187 m X 64
Erinaceusyllis subterranea --- meiofauna arenosa 44 --- entremarés (meiofauna arenosa) X 44
Exogone (Exogone) africana --- costão/fital 519 39 entremarés X 558
Exogone (Exogone) anomalochaeta 14 --- --- infralitoral, 101-147 m X 14
Exogone (Exogone) arenosa 11 infra 3 --- infralitoral, 44,6-110 m 14
Exogone (Exogone) breviantennata 1 costão/fital/infra/meiofauna 1139
arenosa 369
entremarés / infralitoral
até 110 m 1509
Exogone (Exogone) dispar 182 costão/fital/infra 19 --- entremarés / infralitoral até 157 m 201
Exogone (Exogone) lourei 3 --- --- infralitoral, 105-146 m X 3
Exogone (Exogone) marisae --- fital 8 --- entremarés 8
Exogone (Exogone) mompasensis 68 --- --- infralitoral, 100-147 m X 68
Exogone (Exogone) sp. 1 36 infra 7 --- infralitoral, 9,5-168 m X 43
Exogone (Exogone) sp. 2 --- --- 45 entremarés X 45
Exogone (Exogone) sp. 3 16 --- --- infralitoral, 93-210 m X 16
Exogone (Exogone) sp. 4 328 --- --- infralitoral, 100-187 m X 328
Exogone (Sylline) naidinoides --- costão/fital 109 8 entremarés X 117
Exogone (Sylline) simplex --- --- 2 entremarés X 2
Parapionosyllis longicirrata --- costão/fital 20 --- entremarés X 20
Parexogone anseforbansensis --- costão/fital 63 2 entremarés X 65
Parexogone caribensis --- costão/infra 4 --- entremarés / infralitoral até 45,1 m X 4
Parexogone exmouthensis --- costão/fital 29 --- entremarés X 29
Parexogone cf. gambiae 2 --- --- infralitoral, 147 m X 2
Parexogone wolfi 6 --- --- infralitoral, 100-330 m X 6
Parexogone sp. 1 --- costão 1 1 entremarés X 2
Prosphaerosyllis isabellae 36 infra 1 --- infralitoral, 25,1-808 m 37
Prosphaerosyllis xarifae --- costão 6 3 entremarés X 9
Salvatoria neapolitana --- fital/infra/meiofauna arenosa 131 --- entremarés / infralitoral até 12,1 m 131
324
REVIZEE BIOTA BIOPOL Zona ocorrência Nova para a ciência Espécie nova de indivíduos Número total
Sphaerosyllis annulata --- infra 2 --- infralitoral, 21-25 m X 2
Sphaerosyllis capensis --- costão/fital 3 2 entremarés X 5
Sphaerosyllis densopapillata --- costão/fital 90 3 entremarés X 93
Sphaerosyllis magnidentata --- costão/fital 8 --- entremarés X 8
Sphaerosyllis piriferopsis --- fital 2 --- entremarés X 2
Sphaerosyllis sp. 1 --- meiofauna arenosa 7 --- entremarés (meiofauna arenosa) X 7
Sphaerosyllis sp. 2 144 --- --- infralitoral, 93-500 m X 144
Syllinae
Branchiosyllis exilis --- fital 10 75 entremarés 85
Haplosyllis loboi 8 --- --- infralitoral, 163-380 m X 8
Haplosyllis sp. 1 --- costão/fital 39 135 entremarés X 174
Opisthosyllis brunnea --- costão/fital 55 133 entremarés 188
Opisthosyllis viridis --- costão 54 18 entremarés X 72
Parasphaerosyllis indica --- --- 4 entremarés 4
Syllis cf. aciculigrossa 5 --- --- infralitoral, 102-480 m X 5
Syllis corallicola --- costão/fital 40 116 entremarés 156
Syllis garciai 2 --- --- infralitoral, 163-168 m 2
Syllis cf. gerlachi --- costão/fital 25 4 entremarés 29
Syllis glandulata 2 --- --- infralitoral, 147-168 m 2
Syllis gracilis 1 costão/fital/infra 21 317 entremarés / infralitoral até 147 m 339
Syllis hyllebergi --- costão/fital 77 253 entremarés 330
Syllis lutea --- infra 7 --- infralitoral, 6,7-7,8 m 7
Syllis magellanica --- costão/fital/infra 105 329 entremarés / infralitoral até 43,8 m X 434
Syllis maryae --- costão 9 63 entremarés 72
Syllis ortizi 4 --- --- infralitoral, 163-187 m X 4
Syllis prolifera --- costão/fital 104 289 entremarés 393
325
REVIZEE BIOTA BIOPOL Zona ocorrência Nova para a ciência Espécie nova de indivíduos Número total
Syllis rosea --- costão 70 21 entremarés X 91
Syllis sclerolaema 15 --- --- infralitoral, 153-380 m X 15
Syllis truncata --- costão 1 12 entremarés 13
Syllis westheidei --- costão 10 3 entremarés X 13
Syllis sp. 1 --- costão 199 23 entremarés X 222
Trypanosyllis aurantiacus --- --- 23 entremarés 23
326
VI-) REFERÊNCIAS BIBLIOGRÁFICAS
ABREU, J. 1978. Ecologia e distribuição dos Polychaeta e Mollusca na Enseada da Fortaleza (Ubatuba, Estado de São Paulo). Tese de Doutorado – Instituto Oceanográfico, Universidade de São Paulo. 77 p.
AGASSIZ, A. 1862. On alternate generation of Annelids and the embriology of Autolytus cornutus. Journal of the Boston Society for Natural History, 7: 384-409.
AGUADO, M.T., NYGREN, A. & SIDDALL, M.E. 2007. Phylogeny of Syllidae (Polychaeta) based on combined molecular analysis of nuclear and mitochondrial genes. Cladistics, 23: 552-564.
AGUADO, M.T. & SAN MARTÍN, G. 2009. Phylogeny of Syllidae (Polychaeta) based on morphological data. Zoologica Scripta, 38 (4): 379-402.
AGUADO, M.T., SAN MARTÍN, G. & NISHI, E. 2008. Contribution to the knowledge of Syllidae (Annelida, Phyllodocida) from Japan with descriptions of three new species. Systematics and Biodiversity, 6 (4): 521-550.
AGUADO, M.T., SAN MARTÍN, G. & NYGREN, A. 2005. A new species of Opisthosyllis (Polychaeta: Syllidae) from California (U.S.A.). Zootaxa, 1068: 47-58.
AMARAL, A.C.Z. 2006. Metodologia. In: Amaral, A.C.Z., Rizzo, A.E. & Arruda, E.P. (Eds.).
Manual de Identificação dos Invertebrados Marinhos da Região Sudeste-Sul do Brasil, vol. I. EDUSP, São Paulo. pp. 23-25.
AMARAL, A.C.Z., LANA, P.C. FERNANDES, F.C. & COIMBRA, J.C. 2004. Parte I – Caracterização do ambiente e da macrofauna bentônica. In: Amaral, A.C.Z. &
Rossi-Wongtschowski, C.L.B. (eds.), Biodiversidade Bentônica da Região Sudeste-Sul do
Brasil – Plataforma Externa e Talude Superior. (Série Documentos REVIZEE-Score Sul). Instituto Oceanográfico, São Paulo. pp. 11-46.
AMARAL, A.C.Z. & MIGOTTO, A.E. 1980. Importância dos anelídeos poliquetas na alimentação da macrofauna demersal e epibentônica da região de Ubatuba. Boletim do Instituto Oceanográfico, São Paulo, 29 (2): 31-35.
AMARAL, A.C.Z., MORGADO, E.H. & SALVADOR, L.B. 1998. Poliquetas bioindicadores de poluição orgânica em praias paulistas. Revista Brasileira de Biologia, 58 (2): 307-316. AMARAL, A.C.Z., NALLIN, S.A.H. & STEINER, T.M. 2006. Catálogo das species de
Annelida Polychaeta do Brasil.
327
AMARAL, A.C.Z. & NONATO, E.F. Annelida Polychaeta: características, glossário echaves para famílias e gêneros da costa brasileira. Editora da UNICAMP, Campinas. 124 p.
AMARAL, A.C.Z., NONATO, E.F. & PETTI, M.A.V. 1994. Contribution of the polychaetous annelids to the diet of some brazilian fishes. In: J.C. Dauvin, Laubier, L. & Reish, D.J. (eds.), Actes de la 4ème Conférence internationale des Polychètes. Mémoires du Muséum National d’Histoire Naturelle, 162: 331-337.
ATTOLINI, F.S. 1997. Composição e distribuição dos anelídeos poliquetas na
plataforma continental da região da Baía de Campos, RJ, Brasil. Dissertação de Mestrado - Instituto Oceanográfico, Universidade de São Paulo. 122 p.
AUDOUIN J.V. & MILNE EDWARDS, H. 1833. Classification des Annélides et description de celles qui habitent les côtes de la France. Annales des Sciences Naturelles, 28: 187-247; 29: 195-269.
AUDOUIN J.V. & MILNE EDWARDS, H. 1834. Recherches pour servir à l´Historie naturelle du littoral de la France, ou Recueil de mémoires sur l´anatomie, la physiologie, la classification et les moeurs des animaux des nos côtes; ouvrage accompagné de planches faites d´aprés nature. Vol. 2. Annélides Part I.Crochar, Paris. 290 p.
AUGENER, H. 1918. Polychaeta. Beitrage zur Kenntnis der Meeresfauna Westafrikas, 2 (2): 67-625.
AUGENER, H. 1931. Die bodensässigen Polychäten nebst einer Hirudinee der
<<Meteor>>-Fahrt. Mitteilungen der Zoologisches Staatinstitut und zoologisches Museum,
Hamburg, 44: 279-313.
BENHAM, W.B. 1921. Polychaeta. Australasian Antarctic Expedition 1911–14 under the
leadership of Sir Douglas Mawson, D.Sc. B.E. Scientific Reports, Series C – Zoology and Botany, 6 (3): 1-128.
BERKELEY, E. & BERKELEY, C. 1938. Notes on polychaeta from the coaste of western Canada. 2. Syllidae. Annals and Magazine of Natural History, London, series 11, 1: 33-49.
BLEIDORN, C., VOGT, L. & BARTOLOMAEUS, T. 2003. New insights into polychaete phylogeny (Annelida) inferred from 18S rDNA sequences. Molecular Phylogenetis and Evolution, 29: 279-288.
BÖGGEMANN, M. & WESTHEIDE, W. 2004. Interstitial Syllidae (Annelida: Polychaeta) from Mahé (Seychelles). Journal of Natural History, 38: 403-446.
328
CAPA, M. 2003. Estudio de la criptofauna coralina y de los Anélidos Poliquetos(Annelida: Polychaeta) de sustratos duros del Parque Nacional de Coiba, Panamá. Tese de Doutorado – Facultad de Ciencias, Universidad Autónoma de Madrid. 382 p.
CAPA, M., SAN MARTÍN, G. & LÓPEZ, E. 2001. Description of a new species of
Parasphaerosyllis (Polychaeta: Syllidae: Syllinae). Proceedings of the Biological Society of Washington, 114 (1): 280-284.
ÇINAR, M.E. 2007. A new species of Trypanosyllis (Polychaeta: Syllidae) from the Levantine coast of Turkey (eastern Mediterranean). Journal of the Marine Biological Association of the United Kingdom, 87: 451-457.
CLAPARÈDE, E. 1864. Glanures zootomiques parmi les Annélides de Port-Vendres (Pyrenés Orientales). Mémoires de la Société de Physique et Sciences Naturelles de Genève, 17 (2), 463-600.
DALY, J.M. 1975. Reversible epitoky in the life history of the polychaete Odontosyllis polycera (Schmarda, 1861). Journal of the Marine Biological Association of the United Kingdom, 55: 327-344.
DAY, J.H. 1953. The polychaet fauna of South África. Part 2. Errant species from Cape Shores and estuaries. Annals of the Natal Museum, 12 (3): 397-441.
DAY, J.H. 1967. A Monograph on the Polychaeta of Southern Africa. Part.1. Errantia.
Trustees of the British Museum (Natural History), Londres. 458 p.
DAY, J.H. 1973. New Polychaeta from Beaufort, with a key to all species recorded from North Carolina. NOAA Technical Report NMFS Circ. 375. 140 p.
Di DOMENICO, M., LANA, P.C. & GARRAFFONI, A.R.S. 2009. Distribution patterns of interstitial polychaetes in sandy beaches of southern Brazil. Marine Ecology, 30: 47-62. DORSEY, J.H. & PHILLIPS, C.A. 1987. A new species of Syllis (Ehlersia) (Polychaeta:
Syllidae) from southern California, and description of the epitoke and atoke variation in S. (Ehlersia) heterochaeta Moore, 1909. Bulletin of the Biological Society of Washington, 7: 152-161.
DUJARDIN, F. 1839. Sur une Annèlide (Exogone pusilla) qui porte à la fois des oeufs et des spermatozoïdes. Annales des Sciences Naturelles, 15: 298-301.
DUARTE, L.F.L. 1980. A endofauna da esponja Zygomicale parishii (Bowerbank)
(Composição, dominância, diversidade e natureza da associação). Dissertação de Mestrado – Instituto de Biologia, Universidade Estadual de Campinas. 103 p.
DUARTE, L.F.L. & NALESSO, R.C. 1996. The sponge Zygomycale parishii (Bowerbank) and its endobiotic fauna. Estuarine, Coastal and Shelf Science, 42: 139-151.
329
EHLERS, E. 1901. Die Polychaeten des magellanischen und chilenischen Strandes. Ein
faunistischer Versuch. Festschrift zur Feies des 150-jährigen Bestehens der Königlichen Gesellschaft der Wissenschaften zu Göttingen. Wiedmannsche Buchhandlung, Berlin. 232 p.
ESTAPÉ, S. & SAN MARTÍN, G. 1991. Descripción de los estolones reproductores de algunas especies de la subfamilia Syllinae (Polychaeta, Syllidae). Miscel·lània Zoològica, 15: 43-62.
FAN, M. D., ZHIHU, D., JING, Z. & BAOLING, W. 1993. A preliminary study on small syllides from the Huanghai Sea (Yellow Sea). Journal of Oceanography of Huanghai & Bohai Seas, 11 (1): 19-36.
FAUCHALD, K. 1977. The Polychaeta Worms. Definitions and keys to the Orders,
Families and Genera. Natural History Museum of Los Angeles County, Science Series, 28: 1-188.
FAUCHALD, K. & JUMARS, P.A. 1979. The diet of worms: a study of polychaete feeding guilds. Oceanography and Marine Biology: an Annual Review, 17: 193-284.
FAUCHALD, K. & ROUSE, G. 1997. Polychaete systematics: Past and present. Zoologica Scripta, 26 (2): 71-138.
FAUVEL, P. 1923. Polychètes Errantes. In: Faune de France, vol. 5. LeChevallier, Paris. 488 p.
FAUVEL, P. 1927. Polychaetes Sédentaires. Addenda aux Errantes, Archiannélides,
Myzostomaires. In: Faune de France, vol. 16. Le Chevallier, Paris. 494 p.
FIDALGO E COSTA, P. 1999. Reproduction and growth in captivity of the polychaete Nereis diversicolor O.F. Müller, 1776, using two different kinds of sediment: preliminary assays. Boletin del Instituto Español de Oceanografía, 15 (1-4): 351-355.
FISCHER, A. & FISCHER, U. 1995. On the life-style and life-cycle of the luminescent polychaete Odontosyllis enopla (Annelida: Polychaeta). Invertebrate Biology, 114: 236-247.
FRANKE, H.D. 1999. Reproduction of the Syllidae (Annelida: Polychaeta). In: Dorresteijn, A. & Westheide, W. (eds.), Reproductive strategies and developmental patterns in annelids. Hydrobiologia, 402: 39-55.
FREIRE, O. 2004. Apresentação do Programa REVIZEE. In: Amaral, A.C.Z. &
Rossi-Wongtschowski, C.L.B. (eds.), Biodiversidade Bentônica da Região Sudeste-Sul do
Brasil – Plataforma Externa e Talude Superior. (Série Documentos REVIZEE-Score Sul). Instituto Oceanográfico, São Paulo. pp. 5-6.
330
FUKUDA, M.V., YUNDA-GUARÍN, G. & NOGUEIRA, J.M.M. 2009. The genusProsphaerosyllis (Polychaeta: Syllidae: Exogoninae) in Brazil, with description of a new species. Journal of the Marine Biological Association of the United Kingdom, 89 (7): 1443-1454.
GARRAFFONI, A.R.S. & AMORIN, D.S. 2003. Análise filogenética de Questidae e Clitellata: o problema da parafilia de “Polychaeta”. Iheringia, Série Zoológica, 93 (1): 97-109. GARDINER, S.L. 1975. Errant polychaete annelids from North Carolina. Journal of the Elisha
Mitchell Scientific Society,91 (3): 77-220.
GARDINER, S.L. & WILSON, Jr., W.H. 1979. New records of polychaete annelids from North Carolina with descriptions of a new species of Sphaerosyllis (Syllidae). Journal of the Elisha Mitchell Scientific Society, 93 (4): 159-172.
GARWOOD, P. 1991. Reproduction and the classification of the Family Syllidae (Polychaeta). Ophelia, supplement 5: 81-87.
GIANGRANDE, A., LICCIANO, M. & PAGLIARA, P. 2000. The diversity of diets in Syllidae (Annelida: Polychaeta). Cahiers de Biologie Marine, 41: 55-65.
GLASBY, C.J. 1993. Family revision and cladistic analysis of the Nereidoidea (Polychaeta: Phyllodocida). Invertebrate Taxonomy, 7: 1551-1573.
GLASBY, C.J. & WATSON, C. 2001. A new genus and species of Syllidae (Annelida: Polychaeta) commensal with octocorals. The Beagle, Records of the Museums and Art Galleries of the Northern Territory, 17: 43-51.
GOMES, M.F. 2006. Variações espaciais e sazonais na composição e estrutura da comunidade macrobêntica na Plataforma Continental e Talude Superior de Cabo Frio, Rio de Janeiro, Brasil. Dissertação de Mestrado – Instituto Oceanográfico, Universidade de São Paulo. 164 p.
GOODRICH, E.S. 1930. On a new hermaphroditic syllid. Quaterly Journal of Microscopical Science, 73: 651-666.
GRAVIER, C. 1900. Contribution à l’étude des Annélides Polychètes de la Mer Rouge. Nouvelles Archives du Muséum d’Histoire Naturelle, Série 4, 2 (2): 137-282.
GRUBE, A.E. 1840. Actinien, Echinodermen und Wurmen des Adriatischen und
Mittelmeers nach eigenen sammlungen beschrieben. J.H. Bon, Königsberg. 92 p. GRUBE, A.E. 1850. Die Familien der Anneliden. Archiv für Naturgeschichte, 16: 249-364 GRUBE, A.E. 1860. Beschreibung neuer oder wenig bekannter Anneliden. Archiv für
Naturgeschichte, 26: 71-118.
331
HARTMAN, O. 1965. Deep-water benthic polychaetous annelids off New England toBermuda and other North Atlantic areas. Occasional Papers of the Allan Hancock Foundation, 28: 1-378.
HARTMANN-SCHRÖDER, G. 1956. Polychaeten-Studien I. Zoologischer Anzeiger, 157
(5/6): 87-91.
HARTMANN-SCHRÖDER, G. 1959. Zur Okologie der polychaeten des mangrove-estero-gebiets von El Salvador. Beitrage zur Neotropical Fauna 1: 70-183.
HARTMANN-SCHRÖDER, G. 1960. Polychaeten aus dem Rotem Meer. Kieler
Meeresforschungen, 16: 69-125.
HARTMANN-SCHRÖDER, G. 1965. Zur Kenntnis der Eulitoralen Polychaetenfauna von
Hawaii, Palmira und Samoa. Abhandlungen und Verhandlungen des
Naturwissensschaflichen Vereins in Hamburg, 9:81-161.
HARTMANN-SCHRÖDER, G. 1971. Annelida, Borstenwürmer, Polychaeta. Vol. 58. In:
Dahl, F. (ed.), Die Terwelt Deustschlands. Gustav Fischer Verlag, Jena. 594 p. HARTMANN-SCHRÖDER, G. 1974. Zur Kenntnis des Sublitorals der Afrikanischen
Zwischen Angola und Kap de Guten Hoffnung und der Afrikanischen Ostküste von Südafrika und Mocambique unter Besonder Berücksichtigung der Polychaeten und Ostracoden. Teil II Die Polycheten des Untersuchungsgebietes. Mitteilungen aus dem Hamburgischen Zoologischen Museum und Institut, 69: 95-228.
HARTMANN-SCHRÖDER, G. 1979. Die Polychaeten der tropischen Nordwestküste Australiens (zwischen Derby im Norden und Port Hedland im Süden). In: Hartmann-Schröder, G. & Hartmann, G. Zur Kenntnis des Eulitorals der australischen Küsten unter besonderer Berücksichtigung der Polychaeten und Ostracoden. Teil 2. Mitteilungen aus dem Hamburgischen Zoologischen Museum und Institut, 76: 75-218. HARTMANN-SCHRÖDER, G. 1980. Die Polychaeten der tropischen Nordwestküste
Australiens (zwischen Port Samson im Norden und Exmouth im Süden). In: Hartmann-Schröder, G. & Hartmann, G. Zur Kenntnis des Eulitorals der australischen Küsten unter besonderer Berücksichtigung der Polychaeten und Ostracoden. Teil 4. Mitteilungen aus dem Hamburgischen Zoologischen Museum und Institut, 77:41-110 HARTMANN-SCHRÖDER, G. 1985. Die Polychaeten der Antiborealen Südküste Australiens
(zwischen Port Lincoln im Westen und Port Augusta im Osten). In: Hartmann-Schröder, G. & Hartmann, G. Zur Kenntnis des Eulitorals der australischen Küsten unter besonderer Berücksichtigung der Polychaeten und Ostracoden. Teil 11. Mitteilungen aus dem Hamburgischen Zoologischen Museum und Institut, 82:61-99.
332
Hartmann, G. Zur Kenntnis des Eulitorals der australischen Küsten unter besonderer Berücksichtigung der Polychaeten und Ostracoden. Teil 15. Mitteilungen aus dem Hamburgischen Zoologischen Museum und Institut, 87: 41-87.HARTMANN-SCHRÖDER, G. 1991. Die Polychaeten der subtropisch-tropischen bis tropischen Ostküste Australiens zwischen Maclean (New South Wales) und Gladstone (Queensland) sowie von Heron Island (Grosses Barriere-Riff). In: Hartmann-Schröder, G. & Hartmann, G. Zur Kenntnis des Eulitorals der australischen Küsten unter besonderer Berücksichtigung der Polychaeten und Ostracoden. Teil 16. Mitteilungen aus dem Hamburgischen Zoologischen Museum und Institut, 88:17-71.
HARTMANN-SCHRÖDER, G. 1996. Annelida, Borstenwürmer, Polychaeta. 2,
neubearbeitete Auflage. Die Tierwelt Deutschlands und der angrenzenden Meeresteile, 58. Gustav Fischer, Jena. 648 p.
HASWELL, W.A. 1920. Australian Syllidae, Eusyllidae and Autolytidae. Proceedings of the Linnean Society of New South Wales, 45: 90-112.
IMAJIMA, M. 1966a. The Syllidae (Polychaetous Annelids) from Japan (II) Autolytinae. Publications of the Seto Marine Biological Laboratory, 14: 27-83.
IMAJIMA, M. 1966b. The Syllidae (Polychaetous Annelids) from Japan (I). Exogoninae. Publications of the Seto Marine Biological Laboratory, 13: 385-404.
IMAJIMA, M. 1966c. The Syllidae (Polychaetous Annelids) from Japan (IV). Syllinae (1). Publications of the Seto Marine Biological Laboratory, 14 (3): 219-252.
IMAJIMA, M. 1966d. The Syllidae (Polychaetous Annelids) from Japan (IV). Syllinae (2). Publications of the Seto Marine Biological Laboratory, 14 (4): 253-294.
IMAJIMA, M. & HARTMAN, O. 1964. The polychaetous annelids of Japan. Occasional Papers of the Allan Hancock Foundation, 26: 1-452.
International Commission on Zoological Nomenclature. 1999. International Code of Zoological Nomenclature. The International Trust for Zoological Nomenclature, London. JIMÉNEZ, M., SAN MARTÍN, G. & LÓPEZ, E. 1994. Redescriptions of Pionosyllis neapolitana Goodrich, 1930 and Pionosyllis nutrix Monro, 1936, referred to the genus Grubeosyllis Verrill, 1900 (Polychaeta, Syllidae, Exogoninae). Polychaete Research, 16: 52-55.
JIMÉNEZ, M., SAN MARTÍN, G. & LÓPEZ, E. 1995. Pionosyllis maxima Monro, 1930, P.
anops Hartman, 1953, and P. epipharynx Hartman, 1953, redescribed as Eusyllis
maxima (Monro, 1930), a new combination (Polychaeta: Syllidae: Eusyllinae). Proceedings of the Biological Society of Washington, 108 (3): 496-501.
JOHNSON, H.P. 1902. Collateral budding in annelids of the genus Trypanosyllis. The American Naturalist, 36 (424): 295-315.
333
KROHN, A. 1852. Ueber die Erscheiungen bei der Fortpflanzung von Syllis prolifera undAutolytus prolifer. Archiv für Naturgeschichte, 18 (1): 66-76.
KUDENOV, J.D. & HARRIS, L.H. 1995. Family Syllidae Grube, 1850. In: Blake, J., Hilbig, B. & Scott, P.H. (eds.), Taxonomic atlas of the benthic fauna of the Santa Maria Basin and western Santa Barbara Channel, vol. 5. Santa Barbara Museum of Natural History, Santa Barbara. pp. 1-97.
KUPER, M. & WESTHEIDE, W. 1998. External gestation in exogonine syllids (Annelida: Polychaeta): dorsal egg attachment by means of epitoke chaetae. Invertebrate Biology, 117 (4): 299-306.
LAMARCK, J.B.P.A. 1818. Histoire Naturelle des animaux sans vertèbres, preséntant les caractères généraux et particuliers de ces animaux, leur distribution, leurs classes, leurs familles, leurs genres, et la citation synonymique des principales espèces qui s’y rapportent; precedes d’une Introduction offrant la determination des caractères essentiels de l’Animal, sa distinction du vegetal et des autres corps naturelles, enfin l’Exposition des Principes fondamentaux de la Zoologie, vol. 5. Deterville, Paris. 612 p.
LANA, P.C. 1981. Padrões de distribuição e diversidade específica de anelídeos
poliquetos na região de Ubatuba, estado de São Paulo. Dissertação de Mestrado - Instituto Oceanográfico, Universidade de São Paulo. 111 p.
LANA, P.C. 1984. Anelídeos poliquetas errantes do litoral do estado do Paraná. Tese
de Doutorado - Instituto Oceanográfico, Universidade de São Paulo. 275 p.
LANERA, P., SORDINO, P. & SAN MARTÍN, G. 1994. Exogone (Parexogone) gambiae, a
new species of Exogoninae (Polychaeta, Syllidae) from the Mediterranean Sea. Italian Journal of Zoology, 61 (3): 235-240.
LANGERHANS, P. 1879. Die Würmfauna von Madeira. Zeitschrift für Wissenschaftliche Zoologie, 33: 513-592.
LANGERHANS, P. 1881. Ueber einige canarische anneliden. Nova Acta (physico-medica) Academiae Caesareae Leopoldino-carolinae, Naturae curiosorum 42 (3): 95-124. LATTIG, P. & MARTIN, D. 2009. A taxonomic revision of the genus Haplosyllis Langerhans,
1887 (Polychaeta: Syllidae: Syllinae). Zootaxa, 2220: 1-40.
LATTIG, P., SAN MARTÍN, G. & MARTIN, D. 2007. Taxonomic and morphometric analyses of the Haplosyllis spongicola complex (Polychaeta: Syllidae: Syllinae) from Spanish seas, with re-description of the type species and descirptions of two new species. Scientia Marina, 71 (3): 551-570.
334
LICCIANO, M., STABILI, L., GIANGRANDE, A. & CAVALLO, R.A. 2007. Bacterialaccumulation by Branchiomma luctuosum (Annelida: Polychaeta): a tool for
biomonitoring marine systems and restoring polluted waters. Marine Environmental Research, 63: 291-302.
LICHER, F. 1999. Revision der Gattung Typosyllis Langerhans, 1879 (Polychaeta: Syllidae).
Morphologie, Taxonomie und Phylogenie. Abhandlungen der Senckenbergischen
Naturforschenden Gesellschaft, 551: 1-336.
LICHER, F. & KUPER, 1998. Typosyllis tyrrhena (Polychaeta, Syllidae, Syllinae), a new species from the island Elba, Tyrrhenian Sea. Italian Journal of Zoology, 65 (2): 227-233.
LÓPEZ, E. 1995. Anélidos poliquetos de sustratos duros de las Islas Chafarinas. Tese
de Doutorado – Facultad de Ciencias, Universidad Autónoma de Madrid. 672 p.
LÓPEZ, E. & SAN MARTÍN, G. 1994. Syllidae (Polychaeta) recolectados en las Islas de Cabo Verde por la I Expedición Ibérica. Revista de Biología Tropical, 42: 129-139.
MACHADO, M.C.S. 1986. Sistema planctônico da região do emissário submarino de
esgotos de Ipanema – Rio de Janeiro – RJ – Populações Zooplanctônicas: Annelida Polychaeta. Dissertação de Mestrado – Universidade Federal do Rio de Janeiro. 256 p.
MALAQUIN, A. 1893. Recherches sur les syllidiens. Morphologie, Anatomie, Reproduction, Développement. Mémoires de la Société des Sciences, de l´Agriculture et des Arts de Lille, 4ème série, 18: 1-477.
MARTIN, D. & BRITAYEV, T.A. 1998. Symbiotic polychaetes : review of known species. Oceanography and Marine Biology: an Annual Review, 36 : 217-340.
MARTIN, D., BRITAYEV, T.A., SAN MARTÍN, G. & GIL, J. 2003. Inter-population variability and character description in the sponge-associated Haplosyllis spongicola complex (Polychaeta: Syllidae). Hydrobiologia, 496 : 145-162.
MARTIN, D., MARIN, I. & BRITAYEV, T.A. 2008. Features of the first known association between Syllidae (Annelida, Polychaeta) and crustaceans. Organisms, Diversity & Evolution, 8 : 279-281.
MARTÍNEZ, J., ADARRAGA, I. & SAN MARTÍN, G. 2002. Exogone (Exogone) mompasensis (Exogoninae: Syllidae: Polychaeta), a new species of the Iberian Peninsula. Proceedings of the Biological Society of Washington, 115 (3): 676-680.
335
McHUGH, D. 1997. Molecular evidence that echiurans and pogonophorans are derivedannelids. Proceedings of the National Academy of the Sciences of the United States of America, 94: 8006-8009.
McHUGH, D. 2005. Molecular systematics of polychaetes (Annelida). Hydrobiologia,
535/536: 309-318.
MILNE EDWARDS, M. 1845. Observations sur le développement des annélides. Annales des Sciences Naturelles, Paris, 3: 145-182.
MONRO, C.C.A. 1937. Polychaeta. The John Murray Expedition 1933-34. British Museum (Natural History) Scientific Reports, 4 (8): 32-321.
MORGADO, E.H. 1980. A endofauna de Shizoporella unicornis (Johnston, 1847)
(Bryozoa), no Litoral Norte do Estado de São Paulo. Dissertação de Mestrado – Instituto de Biologia, Universidade Estadual de Campinas. 126 p.
MORGADO, E. H. & AMARAL, A.C.Z. 1985. Anelídeos poliquetos associados ao briozoário Schizoporella unicornis (Johnston). V. Syllidae. Revista Brasileira de Zoologia, 3 (4): 219-227.
MÜLLER, O.F. 1771. Von Würmern dês süssen und salzigen wassers. H. Mumme & Faber. Hof-Buchdrucke, Nicolaus Möller, Copenhague. 200p.
MUNIZ, P. & PIRES, A.M.S. 1999. Trophic structure of polychaetes in the São Sebastião Channel (Southeastern Brazil). Marine Biology, 134: 517-528.
MUSCO, L. & GIANGRANDE, A. 2005. A new sponge-associated species, Syllis mayeri n. sp. (Polychaeta: Syllidae), with a discussion on the status of S. armillaris (Müller, 1776). Scientia Marina, 69 (4): 467-474.
MYERS, A.C. 1977. Sediment processing in a marine subtidal sandy bottom community. II. Biological consequences. Journal of Marine Research, 35: 633-647.
NICHOLS, F.H. 1970. Benthic polychaete assemblages and their relationship to the sedimentation in Port Madison. Marine Biology, 6: 48-57.
NOGUEIRA, J.M.M. 2000. Anelídeos poliquetas associados ao coral Mussismilia
hispida (Verrill, 1868) em ilhas do litoral do Estado de São Paulo. Phyllodocida,
Amphinomida, Eunicida, Spionida, Terebellida, Sabellida. Tese de Doutorado – Instituto de Biociências, Universidade de São Paulo. 265 p.
NOGUEIRA, J.M.M. 2006. Família Syllidae. In: Amaral, A.C.Z., Rizzo, A.E. & Arruda, E.P.
(eds.), Manual de Identificação dos Invertebrados Marinhos da Região
Sudeste-Sul do Brasil, volume 1. Edusp, São Paulo. pp. 134-164.
336
NOGUEIRA, J.M.M. & SAN MARTÍN, G. 2002. Species of Syllis Savigny in Lamarck, 1818
(Polychaeta: Syllidae) living in corals in the state of São Paulo, southeastern Brazil. Beaufortia, 52 (7): 57-93.
NOGUEIRA, J.M.M., SAN MARTÍN, G. & AMARAL, A.C.Z. 2001. Description of five new species of Exogoninae (Polychaeta, Syllidae) associated with a stony coral on islands off the coast of São Paulo State, Brazil. Journal of Natural History, 35 (12): 1773-1794 NOGUEIRA, J.M.M., SAN MARTÍN, G. & FUKUDA, M.V. 2004. On some exogonines
(Polychaeta, Syllidae) from the northern coast of the State of São Paulo, southeastern Brazil – Results of BIOTA/FAPESP/Bentos Marinho Project. Meiofauna Marina 13: 45-78.
NOGUEIRA, J.M.M. & YUNDA-GUARÍN, G. 2008. A new species of Syllis (Polychaeta: Syllidae: Syllinae) from off Fortaleza, north-eastern Brazil. Journal of the Marine Biological Association of the United Kingdom, 88 (7): 1391-1399.
NUÑEZ, J. 1990. Anelidos Poliquetos de Canarias: Estudio Sistematico de los Ordenes
Phyllodocida, Amphinomida y Eunicida. Tese de Doutorado – Departamento de Biologia Animal (Zoologia), Universidade de La Laguna. 620 p.
NUÑEZ, J., SAN MARTÍN, G. & BRITO, M.C. 1992. Exogoninae (Polychaeta, Syllidae) from the Canary Islands. Scientia Marina, 56 (1): 43-52.
NYGREN, A. 2004. Revision of Autolytinae (Syllidae: Polychaeta). Zootaxa 680: 1-314. NYGREN, A. & GIDHOLM, L. 2001. Three new species of Proceraea (Polychaeta: Syllidae:
Autolytinae) from Brazil and the United States, with a synopsis of all Proceraea-like taxa. Ophelia, 54 (3): 177-191.
OLANO, M.L., LÓPEZ, E. & SAN MARTÍN, G. 1998. Dos especies nuevas de Sílidos (Polychaeta, Syllidae, Exogoninae) para el litoral ibérico: Sphaerosyllis belizensis Russell, 1989 y Exogone (Parexogone) cognettii Castelli, Badalamenti et Lardicci, 1987. Boletín de la Real Sociedad Española de Historia Natural (Sección Biológica), 94 (1-2): 83-88.
OLIVE, P.J.W. 1994. Polychaete as a world resource: a review of pattern of exploitation as sea angling baits and the potential for aquaculture based production. In: J.C. Dauvin, Laubier, L. & Reish, D.J. (eds.), Actes de la 4ème Conférence internationale des Polychètes. Mémoires du Muséum National d’Histoire Naturelle, 162: 603-610.
PAGLIOSA, P.R. 2005. Another diet of worms: the applicability of polychaete feeding guilds as a useful conceptual framework and biological variable. Marine Ecology, 26: 246-254.
337
PAIVA, P.C., YOUNG, P.S. & ECHEVERRÍA, C.A. 2007. The Rocas Atoll, Brazil: apreliminary survey of the crustacea and polychaete fauna. Arquivos do Museu Nacional, Rio de Janeiro, 65: 241-250.
PAOLA, A., SAN MARTÍN, G. & MARTIN, D. 2006. A new species of Haplosyllis Langerhans, 1879 (Annelida: Polychaeta: Syllidae: Syllinae) from Argentina. Proceedings of the Biological Society of Washington, 119 (3): 346-354.
PASCUAL, M., NUÑEZ, J. & SAN MARTÍN, G. 1996. Exogone (Polychaeta: Syllidae: Exogoninae) endobiontics of sponges from the Cannary and Madeira islands, with descriptions of two new species. Ophelia, 45: 67-80.
PERKINS, T. 1981. Syllidae (Polychaeta), principally from Florida, with descriptions of a new genus and twenty-one new species. Proceedings of the Biological Society of Washington, 93 (4): 1080-1172.
PETTIBONE, M.H. 1963. Marine polychaete worms of the New England region. 1. Aphroditidae through Trochochaetidae. Bulletim of the United States National Museum, 227 (1): 1-356.
PLEIJEL, F. 2001. Syllidae Grube, 1850. In: Rouse, G. & Pleijel, F. (eds), Polychaetes. Oxford University Press, Oxford. pp. 102-105.
RIERA, R., NÚNEZ, J. & BRITO, M.C. 2007. A new species of the interstitial genus
Neopetitia (Polychaeta, Syllidae, Eusyllinae) from Tenerife, with modified acicular chaetae in males. Helgoland Marine Research, 61: 221-223.
RIOJA, E. 1925. Anélidos Poliquetos de San Vicente de la Barquera (Cantábrico). Trabajos del Museo Nacional de Ciencias Naturales. Serie Zoológica, 53: 5-62.
RIOJA, E. 1941. Estudios anelidológicos. III. Datos para el conocimiento de la fauna de poliquetos de las costas del Pacifico de Mexico. Anales del Instituto de Biología de la Universidad Nacional de México, 12 (2): 669-746.
RISER, N.W. 1991. An evaluation of taxonomic characters in the genus Sphaerosyllis (Polychaeta: Syllidae). Ophelia, supplement 5: 209-217.
ROUSE, G. & FAUCHALD, K. 1997. Cladistics and polychaetes. Zoologica Scripta, 26: 139-204.
ROUSE, G. & PLEIJEL, F. 2001. Introduction. In: Rouse, G. & Pleijel, F. (eds), Polychaetes. Oxford University Press, Oxford. pp. 1-7.
ROUSSET, V., PLEIJEL, F., ROUSE, G.W., ERSÉUS, C. & SIDDALL, M.E. 2007. A molecular phylogeny of annelids. Cladistics, 23: 41-63.
338
RULLIER, F. & AMOUREUX, L. 1979. Annélides Polychètes. Annales de l’InstituteOceanographique, 55: 145-206.
RUSSELL, D.E. 1989. Three new species of Sphaerosyllis (Polychaeta, Syllidae) from mangrove habitats in Belize. Zoologica Scripta, 18 (3): 375-380.
RUSSELL, D.E. 1991. Exogoninae (Polychaeta: Syllidae) from the Belizean barrier reef with a key to species of Sphaerosyllis. Journal of Natural History, 25: 49-74.
SAN MARTÍN, G. 1984a. Estudio biogeográfico, faunístico y sistemático de los
Poliquetos de la família Sílidos (Syllidae: Polychaeta) en Baleares. Publicaciones de la Universidad Complutense de Madrid, 187, Madri. 581p.
SAN MARTÍN, G. 1984b. Descripción de una nueva espécie y revisión del género Sphaerosyllis (Polychaeta: Syllidae). Cahiers de Biologie Marine, 25: 375-391.
SAN MARTÍN, G. 1990. Eusyllinae (Syllidae, Polychaeta) from Cuba and Gulf of Mexico. Bulletin of Marine Science, 46 (3): 590-619.
SAN MARTÍN, G. 1991. Grubeosyllis and Exogone (Exogoninae, Syllidae, Polychaeta) from Cuba, the Gulf of Mexico, Florida and Puerto Rico, with a revision of Exogone. Bulletin of Marine Science, 49 (3): 715-740.
SAN MARTÍN, G. 1992. Syllis Savigny in Lamarck, 1818 (Polychaeta: Syllidae: Syllinae) from Cuba, the Gulf of Mexico, Florida and North Carolina, with a revision of several species described by Verrill. Bulletin of Marine Science, 51 (2): 167-196.
SAN MARTÍN, G. 2003. Annelida Polychaeta II: Syllidae. In: Ramos, M.A. et al. (eds.), Fauna Ibérica, vol. 21. Museo Nacional de Ciências Naturales, CSIC, Madri. 544 p. SAN MARTÍN, G. 2004. Deep sea Syllidae from the Pacific Ocean, collected during cruises
with the RV Sonne (Annelida, Polychaeta, Syllidae). Senckenbergiana Biologica, 84 (1/2): 13-25.
SAN MARTÍN, G. 2005. Exogoninae (Polychaeta, Syllidae) from Australia with the description of a new genus and twenty-two new species. Records of the Australian Museum, 57: 39-152.
SAN MARTÍN, G., AGUADO, M.T. & MURRAY, A. 2007. A new genus and species of Syllidae (Annelida: Polychaeta) from Australia with unusual morphological characters and uncertain systematic position. Proceedings of the Biological Society of Washington, 120 (1): 39-48.
339
SAN MARTÍN, G. & HUTCHINGS, P. 2006. Eusyllinae (Polychaeta: Syllidae) from Australiawith the description of a new genus and fifteen new species. Records of the Australian Museum, 58: 257-370.
SAN MARTÍN, G., HUTCHINGS, P. & AGUADO, M.T. 2008a. Syllinae (Polychaeta: Syllidae)
from Australia. Part 1. Genera Branchiosyllis, Eurysyllis, Karroonsyllis,
Parasphaerosyllis, Plakosyllis, Rhopalosyllis, Tetrapalpia n.gen., and Xenosyllis. Records of the Australiam Museum, 60: 119-160.
SAN MARTÍN, G., HUTCHINGS, P. & AGUADO, M.T. 2008b. Syllinae (Polychaeta, Syllidae) from Australia. Part 2. Genera Inermosyllis, Megasyllis n. gen., Opisthosyllis, and Trypanosyllis. Zootaxa, 1840: 1-53.
SAN MARTÍN, G. & LÓPEZ, E. 2003. A new genus of Syllidae (Polychaeta) from Western Australia. Hydrobiologia, 496: p. 191-197.
SAN MARTÍN, G., LÓPEZ, E. & AGUADO, M.T. 2009. Revision of the genus Pionosyllis (Polychaeta: Syllidae: Eusyllinae), with a cladistic analysis, and the description of five new genera and two new species. Journal of the Marine Biological Association of the United Kingdom, 89 (7): 1455-1498.
SAN MARTÍN, G. & PARAPAR, J. 1997. “Errant” polychaetes of the Livingston Island shelf (South Shetlands, Antarctica), with the description of a new species. Polar Biology, 17: 285-295.
SOVIERZOSKI, H.H. 1991. Estrutura temporal da comunidade macrobentônica da foz
do Rio Maciel, Baía de Paranaguá, Paraná. Dissertação de Mestrado - Universidade Federal do Paraná. 89 p.
SOVIERZOSKI, H.H. 1999. Anelídeos poliquetas do litoral de Alagoas, Brasil. Tese de
Doutorado – Instituto de Biociências, Universidade de São Paulo. 208 p.
TEMPERINI, M.T. 1981. Sistemática e distribuição dos poliquetos errantes da
plataforma continental brasileira entre as latitudes 23º05´S e 30º00S. Dissertação de Mestrado - Instituto Oceanográfico, Universidade de São Paulo. 89 p.
TREADWELL, A.L. 1909. Haplosyllis cephalata as an ectoparasite. Bulletin of the American Museum of Natural History, 26: 359-360.
TREADWELL, A.L. 1931. Three new species of polychaetous annelids from Chesapeake Bay. Proceedings of the United States National Museum, 79 (1): 1-5.
UEBELACKER, J. M. 1984. Family Syllidae Grube, 1850. In: Uebelacker, J.M. & Johnson,
P.G. (eds.), Taxonomic Guide to the Polychaetes of the Northern Gulf of Mexico.
Volume IV. Barry A. Vittor & Associates, Metairie. pp. 30-1 – 30-151.
340
VERRILL, A. E. 1900. Additions to the Turbellaria, Nemertina and Annelida of the Bermudaswith revisions of some New England genera and species. Transactions of the Connecticut Academy of Arts and Sciences, 10: 595-671.
WEBSTER, H.E. 1879. Annelida Chaetopoda of the Virginian coast. Transactions of the Albany Institut, 9: 201-272.
WEBSTER, H.E. & BENEDICT, J.E. 1884. The Annelida Chaetopoda from Provicentown and Wellfleet, Mass. Reports of the United States Commissioner of Fish and Fisheries for 1881: 699-747.
WESTHEIDE, W. 1974a. Interstitial polychaetes from Brazilian sandy beaches. Mikrofauna Meersbodens, 31: 3-16.
WESTHEIDE, W. 1974b. Interstitielle Fauna von Galapagos. XI. Pisionidae, Hesionidae, Pilargidae, Syllidae (Polychaeta). Mikrofauna Meersbodens, 44: 195-338.
WESTHEIDE, W. 1997. The direction of evolution within Polychaeta. Journal of Natural History, 31: 1-15.
WORSAAE, K., NYGREN, A., ROUSE, G.W., GIRIBET, G., PERSSON, J., SUNDBERG, P. & PLEIJEL, F. – 2005. Phylogenetic position of Nerillidae and Aberranta (Polychaeta, Annelida), analyzed by direct optimization of combined molecular and morphological data. Zoologica Scripta, 34: 313-328.