Escola de Farmácia
Programa de Pós-Graduação em Ciências Farmacêuticas - CiPharma
NANOPARTICULAS BIOADESIVAS PARA ADMINISTRAÇÃO INTRAMAMÁRIA: DESENVOLVIMENTO, CARACTERIZAÇÃO
FISICO-QUÍMICA, CINÉTICA DE LIBERAÇÃO E AVALIAÇÃO BIOLÓGICA EX VIVO
Raquel Gomes Castanheira
Escola de Farmácia
Programa de Pós-Graduação em Ciências Farmacêuticas - CiPharma
NANOPARTICULAS BIOADESIVAS PARA ADMINISTRAÇÃO INTRAMAMÁRIA: DESENVOLVIMENTO, CARACTERIZAÇÃO
FISICO-QUÍMICA, CINÉTICA DE LIBERAÇÃO E AVALIAÇÃO BIOLÓGICA EX VIVO
Dissertação apresentada ao Programa de Pós-Graduação em Ciências Farmacêuticas da Escola de Farmácia da Universidade Federal de Ouro Preto, como requisito essencial à obtenção do Título de Mestre em Ciências Farmacêuticas
Orientadora: Profa. Dra. Vanessa Carla F. Mosqueira
Co-orientador: Dr. Humberto de Melo Brandão
iii
Este trabalho contou com a colaboração de:
Dra. Margareth Spangler de Andrade
Fundação Centro Tecnológico de Minas Gerais, CETEC - MG
Dr. José Mario Carneiro Vilela
iv
DEDICATÓRIA
Dedico este trabalho aos meus pais e minhas irmãs, pelo amor, amizade e por orientarem minhas decisões e sempre me apoiarem nos caminhos que decidi trilhar.
v AGRADECIMENTOS
Agradeço à professora Vanessa pela orientação inteligente e consciente e por estar sempre disposta e paciente para sanar minhas dúvidas. Obrigada pela confiança em meu trabalho e pela amizade.
À Escola de Farmácia de Ouro Preto pelo ensino gratuito e de qualidade e aos professores do Programa de Pós-Graduação em Ciências Farmacêuticas, pela contribuição em minha formação.
À Fundação de Amparo à Pesquisa do Estado de Minas Gerais – FAPEMIG pela bolsa concedida para a realização deste trabalho e à Rede NANOBIOMG/FAPEMIG pelo apoio financeiro.
Ao Humberto de Mello Brandão, da Embrapa-Gado de Leite, pela orientação, auxilio na realização de experimentos e fornecimento de materiais para execução deste trabalho.
À Dra. Margareth Spangler, pela possibilidade de realização dos experimentos de microscopia de força atômica (MFA) no Centro Tecnológico de Minas Gerais (CETEC) e aos Dr. José Mário Vilela, pela grande colaboração na execução e análise das imagens obtidas por MFA.
Ao laboratório de Farmacotécnica da UFMG, aos professores Lucas Antônio Miranda Ferreira e Mônica Cristina de Oliveira e ao aluno de doutorado Guilherme Carneiro, pela permissão e auxílio no uso do equipamento Zetasizer.
Aos professores Ieso e Rogélio e à Zezé do LBCM, que tiveram a gentileza de fornecer parte do nitrogênio líquido deste trabalho.
Aos colegas do laboratório, Bruno, Renata, Carina e Alessandra com quem vivi muitos momentos de alegria e amizade.
Em especial agradeço às amigas e colegas de laboratório Giani e Líliam, pela grande amizade construída nesses dois anos e por me divertirem mesmo nos momentos mais difíceis, fazendo tudo parecer possível. Agradeço também à Líliam pela constante orientação em meus experimentos, sempre contribuindo significativamente em meus resultados – sem seu auxílio eu não teria finalizado meu trabalho.
Às alunas de iniciação científica Larissa, Carol e Mari, pelo auxílio nos experimentos. À Raquel Araújo, pela amizade a auxilio na orientação dos meus experimentos, me auxiliando a dar continuidade ao trabalho iniciado por ela.
Aos funcionários do CiPharma, porteiros, moças da limpeza e à Mirela e Fátima, secretárias muito importantes na nossa pós-graduação.
vi Às minhas amigas da graduação Nilda, Monique e Marcela, pela grande amizade construída, pelo apoio e carinho mesmo quando estão distantes.
À minha amiga de longa data Gersiane, por estar ao meu lado há tantos anos, tornando a vida mais leve e bonita.
Aos amigos Luciene e Jaspion e aos seus lindos filhos Maria Clara e André, que deram um novo sentido aos meus dias nesses últimos dois anos, me alegrando em muitos momentos difíceis. Obrigada Lu pelo apoio e pelas conversas e por me permitir amar uma família tão especial.
Às minhas primas-irmãs Alice e Elisa, pela grande amizade e união.
Aos meus avós, Alarico, Selvita e Maria Sylvia, pelo amor e confiança. E ao meu avô Paulo, a quem enxergo através do meu pai, por guiar meus passos e olhar por mim há tantos anos.
Aos meus pais e minhas irmãs pelo amor, paciência, dedicação, generosidade e apoio em absolutamente tudo que eu já fiz e ainda quero fazer na vida. Ao minha mãe, pelo amor sem limites, meu pai pelo exemplo de força e caráter. À minha irmã Laura, pelo exemplo profissional e pela generosidade.
À minha irmã Luciana e meu querido cunhado Duavesso, pelo apoio, amizade, carinho e pelos ótimos momentos vividos.
Ao Alan, uma bênção que recebi em minha vida, meu grande amor, pela amizade, carinho, cumplicidade, dedicação e por estar ao meu lado em qualquer situação.
A toda minha família, pela grande união e amor que nos envolve e por saber que posso contar sempre com vocês. Em especial aos tios João e Natércia, grandes amigos.
Aos meus padrinhos tio Ricardo e tia Fatinha, pelo amor, preocupação e amizade e por acreditarem na minha capacidade e aos seus filhos, em especial à Carol, pela amizade. Em especial agradeço à tia Fatinha pelo exemplo de garra, força, fé e superação.
A todas as demais pessoas que participaram dessa importante etapa da minha vida.
vii SUMÁRIO
LISTA DE FIGURAS ... X LISTA DE TABELAS ... XIV LISTA DE ABREVIATURAS ... XVI RESUMO ... XVIII
ABSTRACT ... 22
INTRODUÇÃO ... 24
INTRODUÇÃO GERAL ... 2
REVISÃO DE LITERATURA ... 5
1-SISTEMAS VETORIZADOS ... 5
2-POLÍMEROS UTILIZADOS NO PREPARO DE NANOPARTÍCULAS ... 9
2.1 - Poli-ε-caprolactona... 9
2.2 - Quitosana ... 10
3-MASTITE E APLICABILIDADE DE NANOPARTÍCULAS EM VETERINÁRIA ... 12
4-CLOXACILINA BENZATINA ... 15
5-LIOFILIZAÇÃO DE NANOPARTÍCULAS ... 17
6-CRIOPROTETORES ... 19
OBJETIVO GERAL ... 21
OBJETIVOS ESPECÍFICOS ... 21
CAPÍTULO I ... 22
DESENVOLVIMENTO E CARACTERIZAÇÃO DE NANOCÁPSULAS E NANOESFERAS BIOADESIVAS ... 22
1. OBJETIVO GERAL ... 23
2. OBJETIVOS ESPECÍFICOS ... 23
3. MATERIAIS E MÉTODOS ... 24
3.1MATERIAIS ... 24
3.2PREPARO DAS NANOPARTÍCULAS ... 24
3.3DETERMINAÇÃO DA SOLUBILIDADE DE CLOXB EM DIFERENTES MEIOS ... 26
viii
3.4.1 Distribuição de tamanho ... 26
3.4.2 Potencial Zeta (ζ) ... 28
3.4.3 Análise morfológica das nanopartículas ... 29
3.5ANÁLISE ESTATÍSTICA DOS DADOS ... 30
3. RESULTADOS E DISCUSSÃO ... 31
3.1PREPARO DAS NANOPARTÍCULAS ... 31
3.2DETERMINAÇÃO DA SOLUBILIDADE DE CLOXB EM DIFERENTES MEIOS ... 31
3.3CARACTERIZAÇÃO FÍSICO-QUÍMICA DAS NANOPARTÍCULAS ... 32
3.3.1 Distribuição de tamanho ... 32
3.3.2 Potencial Zeta (ζ) ... 40
3.3.3 Análise morfológica das nanopartículas ... 41
CAPÍTULO II - PREPARO E CARACTERIZAÇÃO DE NANOCÁPSULAS E NANOESFERAS CONTENDO CLOXACILINA BENZATINA E ESTUDO EM MODELO DE PERFUSÃO DE ÚBERE BOVINO ISOLADO... 48
1. OBJETIVO GERAL ... 49
2. OBJETIVOS ESPECÍFICOS ... 49
3. MATERIAIS E MÉTODOS ... 50
3.1MATERIAIS ... 50
3.2PREPARO E CARACTERIZAÇÃO FÍSICO-QUÍMICA DAS NANOPARTÍCULAS ... 50
3.3DETERMINAÇÃO DO TEOR DE FÁRMACO ENCAPSULADO ... 51
3.3.1 Porcentagem e Eficiência de Encapsulação ... 51
3.4 ANÁLISE VISUAL E FOTOMICROGRAFIA DE NANOPARTÍCULAS ... 53
3.5ANÁLISE MORFOLÓGICA DAS NANOPARTÍCULAS ... 53
3.6SOLUBILIDADE DA CLOXB EM PBS COM DIFERENTES QUANTIDADES DE LEITE ... 53
3.7DETERMINAÇÃO DA CINÉTICA DE LIBERAÇÃO IN VITRO ... 54
3.8INTERAÇÃO DE NANOCÁPSULAS COM A GLÂNDULA MAMÁRIA EM MODELO DE PERFUSÃO DE ÚBERE BOVINO ISOLADO ... 56
4. RESULTADOS E DISCUSSÃO ... 58
4.1PREPARO E CARACTERIZAÇÃO FÍSICO-QUÍMICA DAS NANOPARTÍCULAS ... 58
4.2DETERMINAÇÃO DO TEOR DE FÁRMACO ENCAPSULADO ... 62
4.2.1 Porcentagem e Eficiência de encapsulação ... 62
ix
4.4ANÁLISE MORFOLÓGICA DAS NANOPARTÍCULAS ... 68
4.5SOLUBILIDADE DA CLOXB EM PBS COM DIFERENTES QUANTIDADES DE LEITE ... 74
4.6DETERMINAÇÃO DA CINÉTICA DE LIBERAÇÃO IN VITRO ... 75
CAPÍTULO III - LIOFILIZAÇÃO DE NANOPARTÍCULAS ... 83
1. OBJETIVO GERAL ... 84
2. OBJETIVOS ESPECÍFICOS ... 84
3. MATERIAIS E MÉTODOS ... 85
3.1MATERIAIS ... 85
3.2PREPARO DE NANOPARTÍCULAS ... 85
3.5DETERMINAÇÃO DO TEOR DE FÁRMACO ENCAPSULADO ... 87
3.6ANÁLISE MORFOLÓGICA DE FORMULAÇÕES LIOFILIZADAS ... 87
4. RESULTADOS E DISCUSSÃO ... 88
4.1LIOFILIZAÇÃO DE NANOPARTÍCULAS ... 88
4.1.1 Tamanho médio de nanopartículas liofilizadas ... 88
4.1.2 Determinação do teor de fármaco encapsulado ... 94
4.1.3 Análise morfológica de nanopartículas liofilizadas ... 98
CONCLUSÃO ... 107
ANEXO I ... 110
x LISTA DE FIGURAS
Figura 1: Representação esquemática de nanocápsulas (NC) e nanoesferas (NS) poliméricas: a) fármaco dissolvido no núcleo oleoso das NC; b) fármaco adsorvido à parede polimérica das NC; c) fármaco retido na matriz polimérica das NS; d) fármaco adsorvido ou disperso molecularmente na matriz polimérica das NS (adaptado de Schaffazick et al., 2003a). ... Erro! Indicador não definido. Figura 2: Representação esquemática do polímero poli-ε-caprolactona (PCL)Erro! Indicador não definido.
Figura 3: Representação esquemática do polímero quitosana (QUI) . Erro! Indicador não definido. Figura 4: Representação esquemática das junções oclusivas ... Erro! Indicador não definido. Figura 5: Esquema da glândula mamária bovina (Sandholm et al., 1995)Erro! Indicador não definido.
Figura 6: Estrutura química da Cloxacilina Benzatina (CloxB) ... Erro! Indicador não definido. Figura 7: Representação esquemática de um liofilizador e do processo de secagem (adaptado de Araújo,2009). ... Erro! Indicador não definido. Figura 8: Estrutura química da sacarose (a) e da glicose (b) ... Erro! Indicador não definido. Figura 9: Etapas do Preparo de Nanocápsulas e Nanoesferas. 1) A solução orgânica é vertida na solução aquosa; 2) A suspensão obtida é mantida em agitação por 10 minutos; 3) O solvente e o excesso de água são evaporados.*No preparo de nanoesferas não são adicionados óleo e tensoativo hidrofóbico. ... Erro! Indicador não definido. Figura 10: Esquema representativo da dupla camada elétrica ... Erro! Indicador não definido. Figura 11: Representação esquemática da constituição de nanoesferas (a) e nanocápsulas bioadesivas (b). ... Erro! Indicador não definido. Figura 12: Representação esquemática da organização do tween 80 entre as fases aquosa e orgânica (a). Adaptado de Baldursdottir et al, 2011. Estrutura química do tween 80 (b).Erro! Indicador não definido.
xi Figura 17: Imagens de MFA de nanoesferas brancas em zoom, altura (a), fase (b) e amplitude (c). Escaneamento de 1.2 μm x 1,2 μm. Z range: 200 nm. É destacada a superfície irregular da nanoesfera. ... Erro! Indicador não definido. Figura 18: Imagem de MFA de nanoesferas brancas (a) e perfil topográfico (b) demonstrando altura das nanoesferas (setas vermelhas) e diâmetro (setas azuis). Relação d/h= 4,9.Erro! Indicador não definido.
Figura 19: Imagem de MFA de nanocápsulas brancas, altura (a) e imagem de fase (b). Escaneamento de 3 μm x 3 μm. Z range: 200 nm. ... Erro! Indicador não definido. Figura 20: Imagem em 3D de nanocápsulas brancas analisadas por MFA. Escaneamento de 5 x 5 μm. Z range: 200nm. ... Erro! Indicador não definido. Figura 21: Imagem de MFA de nanocápsulas brancas, imagem de fase (a) e amplitude (b) de amostras preparadas em superfície de parafilm. Escaneamento 5 μm x 5 μm.Erro! Indicador não definido.
Figura 22: Imagem de MFA de nanoesferas brancas (a) e perfil topográfico (b) demonstrando altura das nanoesferas (setas vermelhas) e diâmetro (setas azuis). Relação d/h = 7,1.Erro! Indicador não definido.
Figura 23: Representação esquemática das dosagens de CloxB nas formulações de NC e NS para determinação de porcentagem e eficiência de encapsulação. ... Erro! Indicador não definido. Figura 24: Representação esquemática da extração de CloxB em amostras de leite.Erro! Indicador não definido.
xii Figura 29: Fotografia de nanocápsulas, com destaque para a formação de precipitado provocado pelo aumento da concentração de fármaco à formulação. (a) NcC (1,0 mg/mL de CloxB), (b) NcG (7,0 mg/mL de CloxB) e (c) NcI (10,0 mg/mL de CloxB). ... Erro! Indicador não definido. Figura 30: Fotomicrografia de nanoesferas, em que é possível comparar uma NsC em que não há formação de precipitado (a) e uma NsG em que há formação de precipitado (b). Destaca-se a visualização de agregados, atribuídos às nanopartículas e ao fármaco, na imagem b. ... Erro! Indicador não definido.
Figura 31: Fotomicrografia de nanocápsulas, em que é possível observar cristais, atribuídos à precipitação da CloxB. (a) NcG e (b) NcI. ... Erro! Indicador não definido. Figura 32: Imagem de MFA de nanoesferas, altura (a) e imagem de fase (b). Escaneamento 10 μm x 10 μm. Z range: 200 nm. Observa-se grande número de partículas com tamanhos variados. ... Erro! Indicador não definido.
Figura 33: Imagem de altura de MFA de nanoesferas contendo 0,5 mg/mL de CloxB (a) e perfil topográfico (b) demonstrando altura das nanoesferas (setas vermelhas) e diâmetro (setas azuis e verdes).Relação d/h = 5,1. ... Erro! Indicador não definido. Figura 34: Imagem tridimensional de nanocápsulas contendo 0,5 mg/mL de CloxB analisadas por MFA. Escaneamento de 5 x 5 μm. Z range: 200nm. ... Erro! Indicador não definido. Figura 35: Imagens de MFA de fase de NS destacando escurecimento das NP com a passagem sucessiva da sonda (a, b,c,d). Escaneamento 10 μm x 10 μm. Z range: 341 nm.Erro! Indicador não definido.
xiii tempos de 0 a 2880 minutos; Gráfico menor= tempos de 0 a 180minutos.Erro! Indicador não definido.
Figura 41: Interação de NC em modelo de perfusão de úbere bovino. Glândula mamária fixada em suporte de metal para experimento ex vivo (a), cortes histológicos representativos de tecido mamário em microscopia de campo brilhante (b1 e c1) e de fluorescência (b2 e c2). Corte de tecido controle (sem NC) (b1 e b2) e cortes de tecido da glândula mamária a 5, 10 e 15 cm da base do teto após 6 horas de administração intramamária de NC de quitosana contendo CloxB (c1 e c2). As setas vermelhas indicam os ductos galactóforos. Destaca-se a fluorescência visualizada em todos os cortes de 5, 10 e 15 cm, demonstrando presença de NC nas regiões tanto proximais quanto distais da base do teto. Barra = 0,15mm. ... Erro! Indicador não definido. Figura 42: Imagens de MFA de altura (a e c) e fase (b e d) de NS com 1,0 mg/mL de CloxB. Destaque para as estruturas esféricas tanto antes (a e b) quanto após a liofilização (c e d). Escaneamento 20 μm x 20 μm (a e b) e 10 μm x 10μm (c e d). Z range: 500 nm (a e b) e 1000nm (c e d)... Erro! Indicador não definido. Figura 43: Imagens de MFA de altura (a) e fase (b) de NS liofilizadas e ressuspendidas em água, destacando manchas claras, atribuídas ao crioprotetor sacarose, sobre as quais estão depositadas algumas NS . Escaneamento 30 x 30 μm. Z range: 1000 nm. ... Erro! Indicador não definido. Figura 44: Imagens de MFA de altura de NS liofilizadas, após ressupensão em água, destacando manchas claras, atribuídas ao crioprotetor sacarose. Escaneamento 30 x 30 μm. Z range: 1000 nm. ... Erro! Indicador não definido. Figura 45: Imagem tridimensional de NS analisadas por MFA antes (a) e após a liofilização (b). Destaque para a diferença de topografia das NS, com essas “mergulhadas” em crioprotetor (b), sendo possível visualizar somente as pontas das NS. Escaneamento de 10 x 10 μm. Z range: 200nm. ... Erro! Indicador não definido. Figura 46: Imagens de MFA de altura (a e c) e fase (b e d) de NC com 1,0 mg/mL de CloxB. Destaque para as estruturas esféricas tanto antes (a e b) quanto após a liofilização (c e d). Escaneamento 15 μm x 15 μm (a e b) e 10 μm x 10 μm (b e c). Z range: 500 nm (a e b) e 2000nm (c e d). Destaca-se a formação de nuvem de crioprotetor sob as NC (d). Erro! Indicador não definido. Figura 47: Imagem tridimensional de NC analisadas por MFA antes (a) e após a liofilização (b). Destaque para a diferença de topografia das NC, com aparente achatamento de algumas das partículas após liofilização (b). Escaneamento de 15 x 15 μm. Z range: 500nm.Erro! Indicador não definido.
xiv Figura 49: Imagem tridimensional de NC analisadas por MFA após a liofilização. Não ocorre agregação das NC devido ao recobrimento pela sacarose. Escaneamento de 3 x 3 μm. Z range: 1500nm... Erro! Indicador não definido.
LISTA DE TABELAS
Tabela 1: Diferentes tipos de nanocarreadores e algumas de suas funções (adaptado de Kanwar et al., 2011) ... Erro! Indicador não definido. Tabela 2: Efeito das concentrações de polímeros no tamanho médio de nanoesferasErro! Indicador não definido.
Tabela 3: Efeito da presença de Tween 80 no tamanho médio de nanoesferasErro! Indicador não definido.
Tabela 4: Efeito do Volume final de solvente no preparo das NP no tamanho médio de NS ... Erro! Indicador não definido.
Tabela 5: Comparação do tamanho médio de nanocápsulas em relação à variação na concentração de polímeros PCL e Quitosana... Erro! Indicador não definido. Tabela 6: Efeito do tipo de surfactante hidrofílico no tamanho médio de nanocápsulas ... Erro! Indicador não definido.
Tabela 7: Efeito do tipo de óleo e concentração do surfactante hidrofóbico no tamanho médio de NC ... Erro! Indicador não definido. Tabela 8: Comparação das propriedades de tamanho de nanocápsulas em relação à variação do tipo de óleo e variação da concentração de surfactante hidrofóbico ... Erro! Indicador não definido. Tabela 9: Potencial zeta de formulações estáveis de NC e NS brancasErro! Indicador não definido.
xv Tabela 11: Efeito das variações de concentrações de Cloxacilina Benzatina no tamanho das NS ... Erro! Indicador não definido. Tabela 12: Efeito da concentração de Cloxacilina Benzatina no tamanho de NCErro! Indicador não definido.
Tabela 13: Porcentagem e eficiência de encapsulação de formulações de NS com variadas concentrações de CloxB ... Erro! Indicador não definido. Tabela 14: Porcentagem e eficiência de encapsulação de formulações de NC com variadas concentrações de CloxB ... Erro! Indicador não definido. Tabela 15: Tamanho médio de NS e NC com 1,0 mg/mL de CloxB analisadas por ECF e MFA ... Erro! Indicador não definido. Tabela 16: Solubilidade da CloxB em diferentes meios ... Erro! Indicador não definido. Tabela 17: Modelização dos mecanismos de liberação de fármacos a partir de sistemas poliméricos de liberação controlada considerando as diferentes geometrias ... Erro! Indicador não definido. Tabela 18: Parâmetros cinéticos de liberação resultantes da aplicação dos modelos matemáticos de Higuchi e Korsmeyer-Peppas aos dados de liberação da CloxB a partir de NC e NS. ... Erro! Indicador não definido.
Tabela 19: Formulações liofilizadas com variadas concentrações de crioprotetoresErro! Indicador não definido.
Tabela 20: Variação do tamanho médio e índice de polidispersão de nanoesferas congeladas a -80ºC ou a -196ºC (nitrogênio líquido), usando glicose ou sacarose como crioprotetores.Erro! Indicador não definido.
Tabela 21: Tamanho médio e índice de polidispersão de nanocápsulas congeladas a 80ºC ou a -196ºC (nitrogênio líquido), usando glicose ou sacarose como crioprotetoresErro! Indicador não definido.
Tabela 22: Porcentagem e eficiência de encapsulação (EE) de nanoesferas congeladas a 80ºC ou a -196ºC (nitrogênio líquido), usando glicose ou sacarose como crioprotetoresErro! Indicador não definido.
Tabela 23: Porcentagem e eficiência de encapsulação (EE) de nanocápsulas congeladas a -80ºC ou a -196ºC (nitrogênio líquido), usando glicose ou sacarose como crioprotetoresErro! Indicador não definido.
xvi LISTA DE ABREVIATURAS
ζ– Potencial zeta
xvii CO2– Dióxido de Carbono
H2O - Água
KCl – Cloreto de potássio MgCl2– Cloreto de Magnésio
NaCl – Cloreto de sódio
NaH2PO4– Diidrogenofosfato de sódio
NaHCO3– Hidrogenocarbonato de sódio (Bicarbonato de sódio)
O2– Gás oxigênio
ANOVA – Análise de Variância
ALD – Anemometria do Laser Doppler
CETEC-MG - Centro Tecnológico de Minas Gerais CLAE - Cromatografia líquida de alta eficiência CLOXB - Cloxacilina benzatina
DAD – Detector de Arranjo de Diodos D/h – Relação diâmetro/altura
DL50– Dose letal para 50% do grupo estudado
DNA – Ácido desoxirribonucléico DP – Desvio padrão
ECF – Espectroscopia de correlação de fótons EE – Eficiência de encapsulação
FITC – Fluoresceína isotiocianato
HPLC –“High Performance Liquid Chromatography” ou cromatografia líquida de alta eficiência
IP – índice de polidispersão LDH – Lactato desidrogenase
MFA – Microscopia de Força Atômica mV - millivolts
MM – Massa molar NC – Nanocápsulas
NP - Nanopartícula
Nc G – Nanocápsulas contendo glicose como crioprotetor Nc S – Nanocápsulas contendo sacarose como crioprotetor NS – Nanoesferas
xviii Ns S – Nanoesfera contendo sacarose como crioprotetor
QUI – Quitosana
PBS – Tampão fosfato salino PCL – Poli-e-caprolactona
PCL-NP – Nanopartícula de poli-ε-caprolactona convencional
PCL-QUIT-NP – Nanopartícula de poli-ε-caprolactona revestida com quitosana PLGA – Ácido poli-lático-co-glicólico
pH – Potencial hidrogeniônico PI – Índice de polidispersão PLA – Ácido polilático
p/v – Porcentagem peso por volume PVA – Ácido polivinílico
xix
xxii
2 INTRODUÇÃO GERAL
A utilização de vetores com o objetivo de controlar a liberação de fármacos em sítios de ação específicos, otimizando o regime de dosagem e a velocidade de cedência de substâncias, tem sido alvo de intensas pesquisas na área farmacêutica nos últimos anos (Espuelas et al., 1997; Legrand et al., 2007; Bilensoy et al., 2008). Dentre esses vetores, incluem-se as micropartículas e os sistemas coloidais, como lipossomas e nanopartículas poliméricas (Schaffazik et al., 2003).
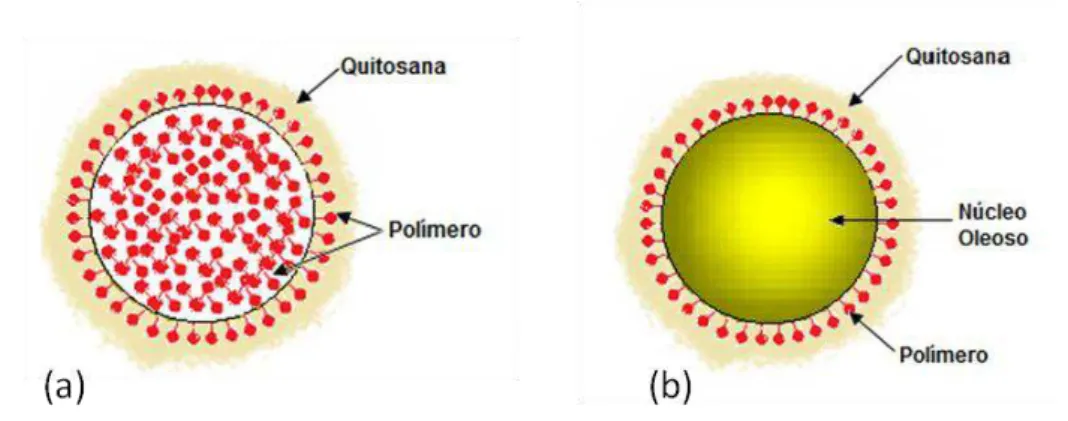
As nanopartículas poliméricas são sistemas carreadores de fármacos com diâmetro inferior a 1μm. Dentre os principais sistemas nanoestruturados encontram-se os lipossomas e as nanopartículas (nanocápsulas e nanoesferas) (Schaffazik et al., 2003). As nanocápsulas (NC) e as nanoesferas (NS) diferem entre si quanto à composição e organização estrutural. As NC são sistemas do tipo reservatório, constituídos por núcleo revestido por uma camada externa polimérica, com surfactantes lipofílicos e/ou hidrofílicos em sua interface. Inicialmente o núcleo das NC era oleoso, permitindo a encapsulação de substâncias lipossolúveis. Mais recentemente foram desenvolvidas NC com núcleo aquoso, para encapsulamento de substâncias hidrossolúveis (Vauthier et al., 2008). As NC podem carrear o fármaco dissolvido no núcleo e/ou adsorvido à membrana polimérica. Por outro lado, as NS são sistemas constituídos por uma matriz polimérica na qual o fármaco pode estar retido e/ou adsorvido (Mora-Huertas et al., 2010; Rao et al., 2011).
Vários requisitos devem ser levados em consideração no desenvolvimento de nanopartículas (NP) como carreador de fármacos. Dentre tais requisitos podemos citar: o tamanho de partículas, as suas propriedades de superfície e a liberação das substâncias farmacologicamente ativas, a fim de se obter a ação do fármaco no local específico desejado, com um aprimoramento da terapêutica e da posologia e diminuição dos efeitos tóxicos (Mohanraj et al., 2006).
3 encapsuladas em nanopartículas de PLGA, apresentando liberação sustentada e considerável melhora na eficácia após administração oral (Pandey et al. 2003).
Uma afecção que poderia se beneficiar dessa tecnologia é a mastite bovina, uma inflamação da glândula mamária causada principalmente por bactérias. Esta doença provoca uma redução na produção e qualidade do leite, resultando em perdas econômicas consideráveis em todo mundo, o que favorece o desenvolvimento de estratégias de controle da doença (Gehring et al., 2006). Diferentes classes de antibióticos e suas combinações são utilizadas para o tratamento de mastite (Gruet et al., 2001) e a permanência de resíduos desses no leite está associada ao número de doses administradas, do veículo utilizado, da via de aplicação e da concentração de antibiótico utilizada.
A cloxacilina benzatina é um antibiótico β-lactâmico usado clinicamente na terapêutica veterinária devido à sua atividade antibacteriana gram-positiva. Este fármaco é utilizado no tratamento e prevenção de mastite bovina causada por bactérias do gênero Staphylococcus (Perez et al., 1997). A cloxacilina benzatina foi escolhida pela equipe da Embrapa Gado de Leite, por não apresentar histórico de resistência bacteriana no banco de isolados de mastite da Embrapa há aproximadamente 10 anos. Além disso, o sal benzatino faz com que a CloxB apresente menor solubilidade em água em relação à cloxacilina, o que maximiza a taxa de encapsulação em nanopartículas (Embrapa, 2009). A vetorização da cloxacilina benzatina objetiva a obtenção de uma nova forma farmacêutica de administração do antibiótico e de tratamento da mastite, mantendo-se a via de administração convencional, intramamária, obtendo-se concentrações elevadas do fármaco no local da infecção, com redução na absorção sistêmica, diminuição da dose e dos efeitos adversos, diminuição de resíduo do antibiótico no leite, além do aumento da retenção do fármaco no úbere bovino. Para tal, foram desenvolvidas e caracterizadas físico-quimicamente e quanto à eficiência de encapsulação e perfil de liberação do fármaco, nanocápsulas e nanoesferas destinadas ao encapsulamento de cloxacilina benzatina, utilizando-se os polímeros poli-ε-caprolactona e quitosana. O interesse pela quitosana têm sido crescente nos últimos anos, por ser um polímero abundante na natureza e por suas propriedades de mucoadesividade e aumento de permeabilidade das membranas, características que tornam esse polímero um forte candidato à produção de nanopartículas com carga superficial positiva e mucoadesivas (Ilum, 1998).
5 REVISÃO DE LITERATURA
1 - Sistemas Vetorizados
Nas últimas décadas estudos têm demonstrado que uma abordagem eficaz para aperfeiçoar a ação farmacológica de fármacos, é associar a molécula ativa a um sistema de liberação nanoestruturado (Tabela 1) (Piñon-Segundo et al, 2005). A nanotecnologia vem sendo aplicada no desenvolvimento desses sistemas de liberação controlada, que muitas vezes veiculam fármacos com aplicação no tratamento do câncer, de doenças parasitárias, entre outras patologias (Mohanraj et al, 2006). É consenso que a utilização de sistemas coloidais nanoestruturados, tais como os lipossomas, nanoemulsões e nanopartículas poliméricas, tornou-se uma alternativa que visa alterar a biodistribuição de fármacos após administração por diferentes vias. O sistema de liberação vetor-orientado tem o potencial de aumentar o índice terapêutico de diversos fármacos já disponíveis no mercado, aumentando sua eficácia, prevenindo a degradação ou inativação durante o trânsito até o sítio alvo, atingindo níveis plasmáticos constantes por um longo período e protegendo o corpo de reações adversas devido à distribuição inapropriada (Banker & Rhodes, 1996). Finalmente, esses sistemas também podem facilitar o desenvolvimento de sistemas de liberação multifuncionais com aplicações terapêuticas e de diagnóstico (Alexis et al, 2008).
Dentre os sistemas de liberação controlado, também conhecidos como vetores, incluem-se as micropartículas, os sistemas lipídicos (lipossomas e emulsões submicronicas) e particulados coloidais (nanoesferas e nanocápsulas poliméricas).
6 Tabela 1: Diferentes tipos de nanocarreadores e algumas de suas funções (adaptado de Kanwar et al., 2011)
Nome Estrutura Composição Perspectivas e usos Ref.
Nanopartículas poliméricas Polímeros biodegradáveis e/ou biocompatíveis
Permitem maior controle da farmacocinética do fármaco carreado, gerando níveis mais constantes dos mesmos
Rawa et al., 2008; Mahidhar
a et al., 2011
Nanopartículas
lipídicas sólidas Lipídeos sólidos
Podem ser usadas como adjuvantes em vacinas e como agentes para transfecção não-viral Mehnert & Mader, 2001 Nanopartículas funcionalizadas Metais inorgânicos, anticorpos, ligantes específicos
Pode-se incorporar
propriedades fluorescentes para uso como biossensores; também usadas como marcador em biologia molecular e no direcionamento de fármacos específicos.
Schneider et al.,
2000
Lipossomas anfifílicos Lipídeos
Alteram o perfil
farmacocinético de fármacos encapsulados. Rawa et al., 2006 Micelas poliméricas Polímeros dibloco anfifílicos
Formadas em meio
hidrofóbico, adequadas para carrear fármacos insolúveis em água devido à composição do núcleo.
Miyata et al, 2011
Dendrímeros Monômeros do
tipo ABn
Tamanho nanométrico, fácil modificação e preparo. Usadas como agentes de revestimento, protegendo e direcionando fármacos para vários sítios.
Choi et al., 2005 Nanotubos de carbono Composto de fulerenos (C60) e/ou outros carbonos, formando estruturas ocas
Aumentam o volume interno e podem modificar facilmente superfícies internas e externas. Com uma camada são usados no direcionamento de genes e fármacos; com duas camadas, na transfecção.
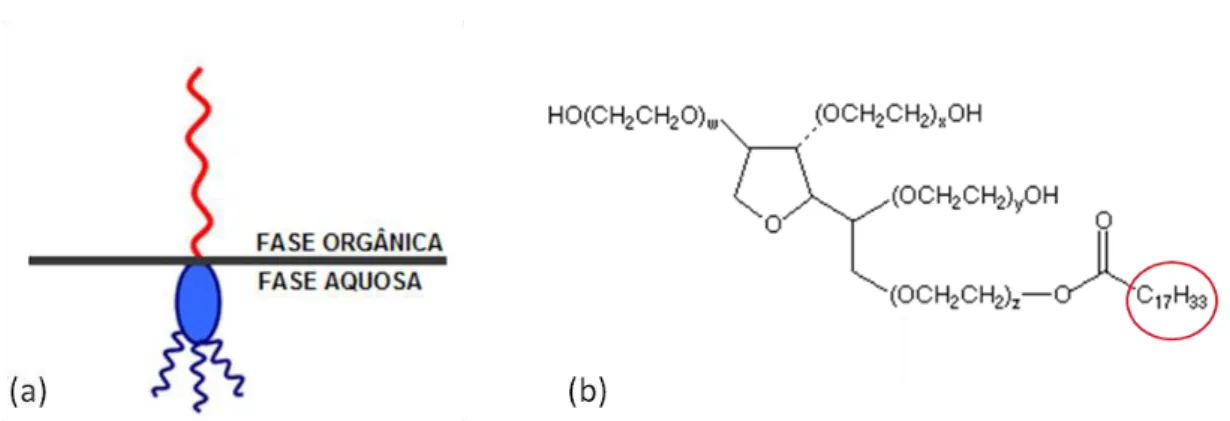
7 As NP poliméricas apresentam diâmetro inferior a 1μm e, dependendo do método de preparo e das matérias-primas utilizadas, podem ser obtidas nanocápsulas (NC) ou nanoesferas (NS) (Figura 1) (Irache et al, 2011, Rao et al, 2011). As NC são sistemas reservatório, constituídas de um núcleo oleoso ou aquoso revestido por uma parede externa polimérica, contendo surfactantes lipofílicos e/ou hidrofílicos em sua interface (Schaffazick et al, 2003a). Quando se objetiva encapsular fármacos lipofílicos, diversos tipos de óleos podem ser utilizados, de origem vegetal ou mineral. O principal determinante para a escolha do fármaco é a solubilidade deste no óleo ou meio aquoso a ser utilizado. Por outro lado, as NS são sistemas matriciais, que, portanto, não apresentam núcleo em sua estrutura. Na matriz das NS o fármaco pode estar adsorvido ou retido (Schaffazick et al, 2003a). A nanoencapsulação tornou-se uma estratégia adequada para aumentar a biocompatibilidade e a dispersão em escala nanométrica de compostos lipofílicos em meio aquoso e biológico (Deda et al, 2009).
Figura 1: Representação esquemática de nanocápsulas (NC) e nanoesferas (NS) poliméricas: a) fármaco dissolvido no núcleo oleoso das NC; b) fármaco adsorvido à parede polimérica das NC; c) fármaco retido na matriz polimérica das NS; d) fármaco adsorvido ou disperso molecularmente na matriz polimérica das NS (adaptado de Schaffazick et al., 2003a).
As nanopartículas (NP) poliméricas oferecem algumas vantagens específicas em relação aos lipossomas, tais como melhor estabilidade em fluidos biológicos e durante armazenamento, viabilizam liberação sustentada de fármacos e são aplicáveis à maioria das vias de administração (Vila et al, 2002). Embora os lipossomas tenham sido, e ainda sejam, utilizados como carreadores de fármacos, a sua produção ainda é limitada devido à algumas desvantagens, como: baixa estabilidade durante o armazenamento que leva à agregação e fusão das partículas e, principalmente o custo elevado de fosfolipídios utilizados na formulação (Mozarafi, 2005).
8 nanoprecipitação, também conhecida como deposição de um polímero pré-formado seguida de evaporação do solvente, é uma técnica simples, reprodutível e facilmente transponível para a produção de nanopartículas em grande escala (Couvreur et al, 2002, Fessi et al, 1989; Legrand et al, 1999). Este método consiste basicamente em verter uma solução contendo o fármaco e polímero, dissolvidos num solvente orgânico miscível com a água, numa fase aquosa contendo um tensoativo hidrofílico como estabilizante. Imediatamente após a injeção, o solvente orgânico difunde-se na água, dando origem a uma suspensão coloidal de nanoesferas. Para a obtenção de nanocápsulas, um óleo e um tensoativo lipofílico são adicionados à fase orgânica da preparação. Após a formação das partículas, as suspensões são submetidas à evaporação para remoção do solvente orgânico e concentração até volume desejado (Fessi et al, 1989).
No desenvolvimento de NP como sistema de transporte e liberação de fármacos, as principais características que devem ser controladas são o tamanho das partículas, as propriedades de superfície e a liberação de substâncias farmacologicamente ativas, a fim de atingir a ação no local específico, com aprimoramento da posologia e da terapêutica (Mohanraj et al, 2006). Além das vantagens das nanopartículas já citadas acima, estes sistemas apresentam outros benefícios, do ponto de vista tecnológico, dentre os quais se destacam: método de preparo simples, alto teor de encapsulamento de fármacos e viabilidade de encapsular substâncias tanto lipofílicas quanto hidrofílicas (Peltonen et al, 2004). Tais características das NP possibilitam melhoras na biodisponibilidade de fármacos, modificação de seus perfis farmacocinéticos, especificidade de ação com diminuição dos efeitos colaterais, proteção do fármaco contra degradação e penetração intracelular de substâncias macromoleculares. Aliado a isso, a manipulação das características físico-químicas e de superfície viabilizam o direcionamento passivo e ativo do fármaco após sua administração (Irache et al, 2011).
9 2 - Polímeros utilizados no preparo de nanopartículas
Uma extensa variedade de materiais, tanto naturais quanto sintéticos, vem sendo empregados no preparo de nanopartículas poliméricas. O polímero ideal deve ser não-tóxico, biodegradável e/ou biocompatível, facilmente processável e livre de impurezas. Os polímeros sintéticos (ácidos poli-lático e poli-glicólico, poli-ε-caprolactona, poli-acrilatos) possuem a vantagem de permitirem a liberação sustentada do fármaco, visto que, em geral apresentam degradação mais lenta que os polímeros naturais (quitosana, albumina, gelatina) (Irache et al, 2011). O homopolímero de poli-ε-caprolactona (PCL), por exemplo, sofre uma degradação total em dois a quatro anos (Woodruff et al, 2010), enquanto a QUI é degradada em alguns dias ou meses, dependendo do seu teor de desacetilação (Kean et al, 2010). Graças aos progressos na química de polímeros e na físico-química de colóides poliméricos, atualmente é possível preparar NP poliméricas com diversas propriedades em condições controladas (Couvreur et al, 2006).
O conceito atual da vetorização de fármacos não visa apenas prolongar a duração da liberação, mas também realizar o controle da distribuição no organismo. O controle do tempo consiste em alterar a cinética convencional de liberação do princípio ativo, durante o tratamento, objetivando a liberação sustentada, com possível aumento do intervalo de doses. Já o controle da biodistribuição visa o direcionamento de um vetor de fármacos para locais desejados, objetivando o aumento da eficácia do princípio ativo, redução de efeitos colaterais e até mesmo redução da dose a ser administrada (Brigger et al,2002).
2.1 - Poli-ε-caprolactona
10 Figura 2: Representação esquemática do polímero poli-ε-caprolactona (PCL)
2.2 - Quitosana
A quitosana (QUI) (Figura 3) é um polímero natural produzido a partir da N-desacetilação parcial da quitina, componente da parede celular de fungos e do exoesqueleto de artrópodes. Possui características de biodegradabilidade e biocompatibilidade e baixa imunogenicidade (Meng et al, 2011), além de ser bastante abundante e ter baixo custo de produção (Berger et al, 2004). A QUI é metabolizada por algumas enzimas humanas, especialmente a lisozima. Em pH ácido, seus grupamentos amino estão protonados, transformado-se em um policátion que lhe confere característica de mucoadesividade.
A mucoadesividade se refere à bioadesividade de substâncias ou partículas ao muco ou às membranas mucosas (Smart, 2005). Para que a adesão ocorra, as moléculas da substância devem interagir com a interface, o que pode ocorrer por ligações iônicas, covalentes, de hidrogênio, ligações de Van-der-Waals e hidrofóbicas. No caso da QUI com membranas mucosas, ocorre predominantemente a ligação iônica, por meio da atração eletrostática entre as cargas positivas do polímero e as cargas negativas da superfície de mucosas (Smart, 2005). Este fenômeno torna a QUI um candidato importante para a liberação de fármacos em mucosas (Sayin et al, 2009; Kean et al, 2010; Kumari et al, 2010). Estudos relatam a baixa toxicidade desse polímero, particularmente via oral, tendo sido atribuída a DL50 de 16 g/kg em camundongos, um valor semelhante aos de sacarose
11 Figura 3: Representação esquemática do polímero quitosana (QUI)
Polímeros catiônicos, como a quitosana e a poli-lisina podem interagir com as proteínas das junções oclusivas (Figura 4), promovendo sua reorganização e subseqüente abertura (Bravo-Osuna et al,2008), agindo portanto, como promotores de penetração (Kotzé et al1999; Thanou et al, 2001).
Aliado a todas essas características que favorecem o uso da quitosana como polímero de recobrimento de NP, há o fato de que ainda não existem relatos de uso da quitosana para administração de NP via intramamária. Os estudos já desenvolvidos relatam a aplicação da quitosana em vetores administrados por via oral (Prego et al, 2005), nasal (Illum et al, 1994; Vila et al,2004), pulmonar (Grenha et al, 2005 e 2008) e oftálmica (de la Fuente et al, 2010).
O H2C
NH OH
O
H3C O
OH
O
O OH H2C OH
NH2
O OH
H2C OH
NH2 O
12 Figura 4: Representação esquemática das junções oclusivas (adaptado de Biological Science 2/e – Pearson Prentice Hall, Inc. 2005)
3 - Mastite e aplicabilidade de nanopartículas em veterinária
A vetorização de fármacos antibióticos é uma das áreas promissoras para emprego de nanopartículas, especialmente no tratamento de infecções em humanos e animais (Santos-Magalhães et al,2000; Schiffelers et al, 2001; Barratt, 2003).
A mastite é a enfermidade mais prevalente e economicamente relevante entre bovinos leiteiros em todo o mundo (Vintov et al, 2003), afetando a produção e qualidade do leite, além de poder ocasionar a morte do animal. No Brasil estima-se que as perdas decorrentes da doença são da ordem de 10 a 15% na produção de leite total, o que representa, atualmente, prejuízos de cerca de 3 a 4 milhões de litros por ano (Costa et al, 1998; Fonseca et al, 2000; Embrapa, 2010). No mundo inteiro, estima-se que as perdas anuais ocasionadas pela mastite chegam a 35 bilhões de dólares (Wellenberg et al, 2002).
Os prejuízos econômicos associados à mastite se devem principalmente à queda na produção leiteira do rebanho, gastos com medicamentos, descarte do leite de animais em tratamento e à reposição precoce de animais cronicamente acometidos, os quais acabam sendo sacrificados (Costa et al, 2011). A mastite é a doença responsável por grande parte dos descartes em um rebanho, chegando a 26,9% de causa dos descartes nos Estados Unidos (Demeu et al, 2011). Silva e colaboradores (2004) verificaram que a mastite representa a causa de descarte de 56,82% dos animais de raça holandesa no Brasil. Associado aos dados relatados, a contagem aumentada de células somáticas e a diminuição de teores de gordura e caseína do leite provocam queda no rendimento da indústria láctea (Wellenberg et al, 2002; Seegers et al, 2003).
13 ocorre principalmente durante a ordenha, entre eles Staphylococcus aureus, Streptococcus agalactiae, Corynebacterium bovis (Gruet et al, 2001; Andersen et al, 2010; Dohoo et al, 2011).
A mastite pode ser classificada como clínica – com sinais clínicos no quarto mamário inflamado e com alterações físico-químicas no leite – ou subclínica – que é assintomática e com redução na produção e qualidade do leite (Gruet et al, 2001; Moon et al, 2007). O tratamento da mastite, em geral, é realizado com uso de antimicrobianos, via intramamária – direcionando o fármaco ao úbere, através do canal do teto – ou combinando infusão intramamária e administração parenteral (Gruet et al, 2001). O método de administração pela via intramamária de agentes antimicrobianos para o tratamento de mastite clínica ou subclínica é o preferido pela indústria do leite, permitindo aplicações de pequenas quantidades de agentes antimicrobianos diretamente no local da infecção (Tozzetti et al, 2008). Preferencialmente, o tratamento deve ocorrer durante o período seco, visto que o úbere seco apresenta vantagens em relação ao úbere em lactação, tais como (Oliver et al, 1990; Gruet et al, 2001):
Manutenção de níveis mais uniformes de antimicrobiano, uma vez que a glândula não sofrerá esvaziamento constante;
Não há descarte de leite contaminado com antimicrobiano;
Podem ser administradas doses mais elevadas de antimicrobiano a fim de combater a invasão precoce de patógenos no período seco.
A terapia no período seco é realizada com dois objetivos: tratar infecções intramamárias em quartos contaminados e prevenir novas infecções no início do período de lactação. A maior taxa de eliminação de infecção ocorre quando o tratamento dos quartos infectados é feito após a última ordenha do período de lactação, com altas doses de formulações de liberação lenta (Gruet et al, 2001). Apesar das vantagens do tratamento durante o período seco, a mastite clínica muitas vezes precisa ser tratada durante a lactação, e deve apresentar resposta clínica perceptível em 5 a 7 dias (Gruet et al, 2001). Nesses casos, o leite coletado deverá ser totalmente descartado, uma vez que existe contaminação com antimicrobianos. Já a mastite subclínica deve ser tratada durante o período seco.
14 proteção imunológica local, devido à presença de células linfóides, além de uma barreira física contra a entrada de bactérias fornecida pela camada epitélio-queratinosa que reveste o canal do teto. Um fármaco é efetivo no tratamento de mastite quando alcança uma concentração ótima no alvo da infecção, sendo que os patógenos causadores de mastite podem estar no leite ou em compartimentos intracelulares, como células epiteliais dos alvéolos da glândula mamária (Gruet et al, 2001; Gehring et al, 2006).
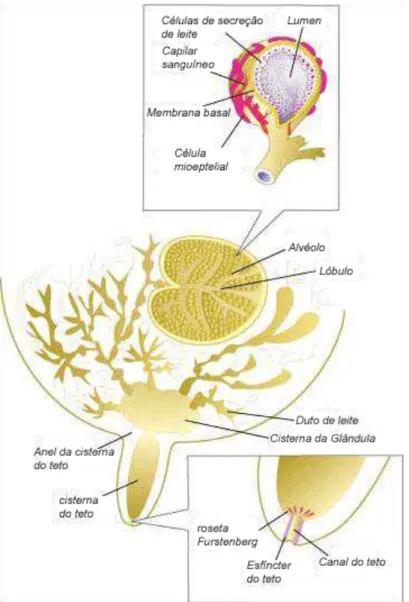
Figura 5: Esquema da glândula mamária bovina (Sandholm et al., 1995)
15 adoção dos antimicrobianos, há constante pressão internacional a fim de reduzir a sua dose e freqüência de uso (Gruet et al, 2001).
Desta maneira, algumas possibilidades podem ser investigadas com o objetivo de desenvolver medicamentos mais eficazes para o tratamento dos animais infectados, com menor difusão do fármaco para a corrente circulatória. A fim de diminuir essa difusão, a aplicação de antibióticos por via intramamária é amplamente utilizada (Gruet et al, 2001; Mckellar et al, 2004; Gehring et al, 2006; Kietzmann et al, 2010). Portanto, o desenvolvimento de uma formulação antibiótica para o tratamento da mastite deverá possuir características como facilidade de penetração em células fagocitárias, manutenção da atividade do antibiótico nos lisossomas dos fagócitos, cujo meio é ácido, possibilidade de administração via intramamária sem acarretar perda da atividade ou degradação do antibiótico e liberação sustentada no local de ação (Craven et al, 1984).
Diante desse contexto, a utilização de vetores nanoestruturados de fármacos, uma estratégia amplamente estudada para terapia humana, surge como uma possível forma de tratamento da mastite bovina. Sabe-se que estes vetores protegem o fármaco contra a degradação, são rapidamente capturados por células do sistema mononuclear fagocitário e podem ser administradas por várias vias, com aumento da seletividade pelo local de ação (Vila et al, 2002). De acordo com a literatura, há poucos estudos quanto à utilização de vetores nanoestruturados na área veterinária (Bodmeier et al, 1997; Gruet et al, 2001) e existem diversas possibilidades de aplicação, o que possibilitou o depósito de patente por nosso grupo de trabalho que desenvolveu formulações nanoestruturadas para aplicação na mastite bovina (Mosqueira, 2009).
O destino in vivo das NP parece depender das interações que ocorrem entre a superfície da NP e os componentes biológicos ao redor dela, sendo que tais interações dependem da via de administração do vetor (Vauthier et al, 2007). No desenvolvimento de um vetor para administração em mucosas, como no caso da glândula mamária para o tratamento da mastite bovina, deve ser considerado o caráter bioadesivo da superfície desse vetor, o que permitirá seu aprisionamento no muco glandular e manutenção prolongada do vetor no sítio de ação, onde ele poderá liberar o fármaco de maneira sustentada e diretamente no local desejado. As NP revestidas por quitosana parecem ser promissoras para a terapia da mastite bovina já que apresenta característica de mucoadesão (PI 1002601-0).
16 O surgimento de formas de liberação prolongada de penicilinas ocorreu nas décadas de 40 e 50, sendo que uma delas foi a síntese de Penicilina G através da reação ácido-base da penicilina com a N,N´-dibenziletilenodiamina, uma base forte, que produziu um sal com menor taxa de degradação, menor hidrossolubilidade que a penicilina e níveis plasmáticos sustentados por um longo período (Elias et al, 1951). Posteriormente foram desenvolvidos diversos sais derivados da penicilina, como a Penicilina V e a Cloxacilina Benzatina (CloxB) (Szabo et al, 1951).
As penicilinas pertencem à família química dos antibióticos beta-lactâmicos, os quais possuem estrutura semelhante à do dipeptídeo D-alanil-D-alanina presente no peptideoglicano da parede celular das bactérias. O mecanismo de ação dos betalactâmicos ocorre por meio da sua ligação covalente a um resíduo de aminoácido serina da enzima transpeptidase. Uma vez que essa enzima está relacionada à síntese da parede celular bacteriana, a ligação do antibiótico a inibe e, consequentemente, não ocorre formação da parede bacteriana (Faure, 2008).
A Cloxacilina Benzatina (Figura 6) é um antibiótico β-lactâmico usado em terapias veterinárias devido à sua atividade contra bactérias gram-positivas. Suspensões contendo CloxB são muito utilizadas no tratamento de mastite bovina por oferecer proteção prolongada contra novas infecções no período seco. Apresenta eficácia contra estafilococos resistentes a penicilinas, especialmente Staphylococcus aureus, o patógeno gram-positivo mais prevalente em infecções do úbere bovino (Perez et al, 1997; Kietzmann et al, 2010). Suas propriedades físico-químicas, tais como baixa solubilidade em água e em pH fisiológico, dificultam a administração de uma forma farmacêutica convencional pela via tradicional, intramamária. Portanto, faz-se necessário o desenvolvimento de uma formulação nanoestruturada, que seja eficaz na entrega seletiva do fármaco no local de ação desejado, a glândula mamária.
17 Figura 6: Estrutura química da Cloxacilina Benzatina (CloxB)
5 - Liofilização de Nanopartículas
A liofilização é um processo, comumente utilizado na indústria, para assegurar a estabilidade em longo prazo e preservar as propriedades originais de produtos farmacêuticos e biológicos (Abdelwahed et al, 2006a). O processo consiste na remoção de água de uma amostra, previamente congelada, por sublimação do gelo sob vácuo, o que transforma a água congelada diretamente em vapor (Abdelwahed et al, 2006c).
O esquema do equipamento e a evolução da secagem (Boss, 2004) estão representados na figura 7. A liofilização ocorre em três fases: a primeira etapa do processo é o congelamento do produto (Figura 7a) a ser seco em baixas temperaturas. Ele pode ser inserido congelado na câmara de secagem ou pode ser congelado na própria prateleira, dependendo do equipamento. A segunda etapa é a secagem (Figura 7b). O vácuo é iniciado (Figura 7c) e o gelo é sublimado por pressão reduzida. À medida que o gelo sublima, a amostra fica porosa. O vapor originado na interface atravessa o material seco na câmara de liofilização e é condensado abaixo da câmara de secagem, no condensador. Por último, ocorre a segunda secagem, na qual é retirada a água residual adsorvida ao pó, obtendo-se o produto final seco (Figura 7d) (Tang et al, 2004; Chen et al, 2007). Durante o processo de liofilização, a amostra congelada deve ser mantida abaixo de sua temperatura de transição vítrea ou da temperatura de fusão (Qian et al., 2010).
Cl N O C H N O N O S CH 3 CH3 C O O N+ CH2 H2C H
CH2
N+
H H2C
H H
18 Figura 7: Representação esquemática de um liofilizador e do processo de secagem (adaptado de Araújo,2009).
O processo de liofilização tem sido aplicado, nos últimos anos, visando melhorar a estabilidade em longo prazo de nanopartículas (De Chasteigner et al, 1996; Abdelwahed et al, 2006a). Esta aplicabilidade se deve ao fato de que os sistemas coloidais apresentam problemas de instabilidade física (agregação e fusão de partículas) e química (hidrólise de polímeros, vazamento de fármaco e reação química do fármaco durante estocagem) quando mantidas na forma de suspensões aquosas por um longo período (Chacon et al, 1999; Abdelwahed et al, 2006c).
19 Diversas formas de congelamento já foram testadas para nanopartículas e estão descritas na literatura. Para as nanoesferas é comum a utilização de nitrogênio líquido (-196°C) (Chacon et al, 1999; De Jaeghere et al, 1999 ; Auvillain et al, 1989), congelamento em freezer a -70°C (Chacon et al, 1999), a -45°C (Saez, et al, 2000; Abdelwahed et al, 2006d) e a -60°C (Konan
et al, 2002). Para as nanocápsulas já foram estudados o congelamento em freezer a -45 °C (Abdelwahed et al, 2006b), a -20ºC (Schaffazick et al, 2003b), a -70°C e congelamento em nitrogênio líquido a -196°C (Auvillain et al, 1989; Chacon et al, 1999).
Quando uma solução aquosa é congelada a -196ºC, em nitrogênio líquido, a temperatura extremamente baixa resulta na rápida formação de núcleos de gelo, com crescimento de pequenos cristais de gelo a partir desses núcleos. Entretanto, quando se utiliza uma temperatura mais elevada de congelamento (-80, -60, -20ºC, por exemplo) a nucleação do gelo é lenta, e esse núcleo tende a crescer como cristais de gelo maiores, levando à formação de produtos com poros grandes e aleatórios após a liofilização (Qian et al, 2010).
Abdelwahed e colaboradores (2006d) descreveram o que ocorre com a amostra durante o congelamento. Sabe-se que há uma separação defases entre o gelo e a solução crio-concentrada, que contém as NP e os outros componentes da formulação. A alta concentração do sistema particulado pode induzir agregação e, até mesmo a fusão das partículas, além do estresse mecânico causado pela cristalização do gelo, conforme já mencionado. Para evitar tais problemas, os crioprotetores devem ser adicionados à suspensão de NP (Abdelwahed et al, 2006a).
6 - Crioprotetores
Os crioprotetores mais comumente encontrados na literatura, usados na liofilização, são os açúcares, tais como: sacarose, glicose (Figura 8), trealose e manitol (Auvillain et al, 1989; Quintanar-Guerrero et al, 1998; Chacon et al, 1999; Saez et al, 2000; Konan et al, 2002; Abdelwahed et al, 2006a) e polímeros, tais como: álcool polivinílico (Abdelwahed et al, 2006a) e a gelatina (Saez et al, 2000). Os crioprotetores agem pela imobilização das NP na matriz vítrea dos mesmos, o que pode prevenir sua agregação e protegê-las contra o estresse mecânico do processo (Abdelwahed et al, 2006c). A quantidade de crioprotetor a ser adicionada varia de uma formulação para outra. Na literatura encontram-se dados descrevendo desde o uso de 2% de crioprotetor até 30% (p/v) (Schwarz et al, 1997; Cavalli et al, 1997; Saez et al, 2000).
20 entre os açúcares e o grupo polar dos fosfolípides, impedindo a fusão dos lipossomas durante o processo de desidratação (Nounou et al, 2005; Chen et al, 2010).
Em relação às NP poliméricas, o mecanismo de proteção conferido pelos crioprotetores ainda não está totalmente elucidado. Uma hipótese é a de que os crioprotetores formam uma matriz amorfa ao redor das NP, promovendo espaçamento entre elas e evitando, assim, a agregação durante o congelamento, tornando-as redispersíveis (Saez et al, 2000). Além disso, seu efeito protetor pode ser devido à formação de ligações de hidrogênio com a água fazendo com que grupos polares presentes na superfície das partículas, como o poloxamer 188, sejam parcialmente dessolvatados (Crowe et al., 1993; Allison et al., 1998).
21 OBJETIVO GERAL
Desenvolver e caracterizar nanopartículas poliméricas contendo quitosana como polímero de recobrimento, avaliando a influência de seus constituintes e concentrações na estabilidade geral da formulação, bem como o efeito sobre as suas características físico-químicas, para encapsulação eficiente da cloxacilina benzatina. Estudar ex vivo a interação de NP com a glândula mamária em modelo de úbere bovino isolado.
OBJETIVOS ESPECÍFICOS
Desenvolver formulações de nanocápsulas e nanoesfera de CloxB a partir dos polímeros quitosana e poli-ε-caprolactona, avaliando a influência de seus constituintes sobre os aspectos físico-químicos e morfológicos da preparação;
Caracterizar as nanocápsulas e nanoesferas obtidas quanto ao tamanho, índice de polidispersão, potencial zeta e morfologia;
Avaliar a liberação in vitro de uma formulação de nanocápsula e uma de nanoesfera;
CAPÍTULO I
23 1. OBJETIVO GERAL
Neste capítulo o objetivo geral foi o preparo e a caracterização de nanopartículas poliméricas, avaliando seus constituintes e suas concentrações, visando a otimização e padronização dos parâmetros da formulação e maior reprodutibilidade do método.
2. OBJETIVOS ESPECÍFICOS
Desenvolver formulações de nanocápsulas e nanoesferas a partir dos polímeros quitosana e poli-ε-caprolactona;
Caracterizar as nanocápsulas e nanoesferas quanto ao tamanho, índice de polidispersão e potencial zeta;
24 3. MATERIAIS E MÉTODOS
3.1 Materiais
Para o preparo das nanopartículas foram utilizadas as seguintes substâncias: fosfatidilcolina de soja (~ 70% fosfatidilcolina) (Epikuron 170®, Lucas Meyer, França), monooleato de sorbitan (Span 80) (Sigma, EUA), Miglyol® 812N (Sasol, Brasil), Velsan® (triglicéride cáprico/caprílico) (Pharma Special, Brasil), poloxamer 188 (Synperonic) (ICI Surfactants, Cleveland, Reino Unido), poli-ε-caprolactona (PCL) (PM 42500Da) (Sigma, EUA), quitosana de baixo peso molecular (QUI) (Sigma-Aldrich, Brasil), tween 80 (Vetec, Brasil), metanol grau analítico (Labimpex, Brasil), acetona grau analítico (Vetec, Brasil), fosfato de potássio dibásico (Rielde-Haёn®), metanol grau CLAE (Merck, Alemanha), acetonitrila grau CLAE (Tedia, EUA). A
água de qualidade Milli-Q foi purificada nos sistemas Direct-Q e Symplicity/System 185, da Millipore®.
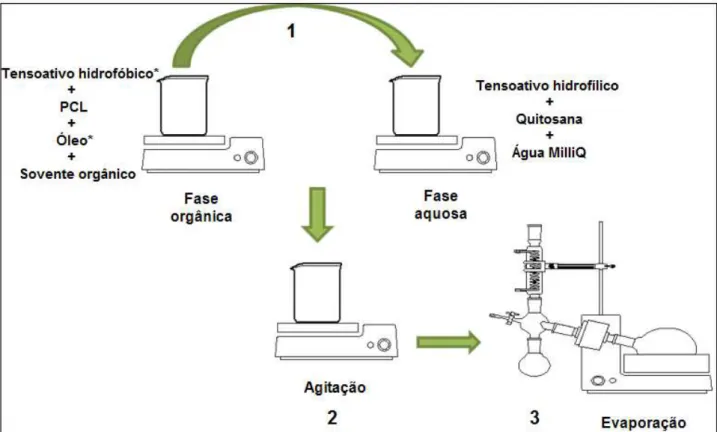
3.2 Preparo das Nanopartículas
As nanopartículas foram preparadas pelo método de deposição interfacial de um polímero pré-formado, descrito por Fessi e colaboradores (1989). O processo de obtenção de nanopartículas consiste na mistura de uma fase orgânica, miscível em água, em uma solução aquosa contendo surfactante hidrofílico (Figura 9).
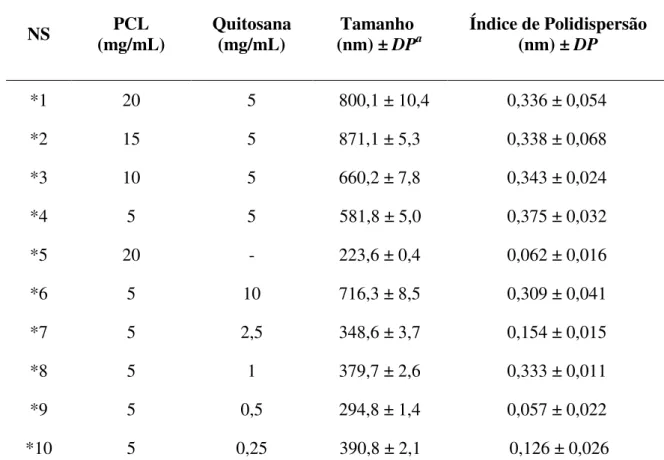
Para o preparo de nanoesferas brancas foi feita a dissolução de PCL (2,5; 5; 10; 15 ou 20 mg/mL) em acetona (2,5; 3,5 ou 6,5 mL) e metanol (1,5 mL), sob agitação magnética. Essa solução foi vertida em uma solução aquosa contendo 6 mg/mL de tween 80 e quitosana (0,25; 0,5; 1; 2,5; 5 ou 10 mg/mL) solubilizada em ácido cítrico 0,06 mol/L, também sob agitação magnética, mantida por 10 minutos, a 500 rpm. Posteriormente, o excesso de solvente da suspensão coloidal obtida foi evaporado à pressão reduzida em rotavapor (Heidolph Instruments, Alemanha), a uma temperatura de 40 ºC, até volumes finais de 2 ou 5 mL.
25 evaporação do excesso de solvente foi realizada conforme metodologia descrita acima, até volumes finais de 2 ou 5 mL.
Figura 9: Etapas do Preparo de Nanocápsulas e Nanoesferas. 1) A solução orgânica é vertida na solução aquosa; 2) A suspensão obtida é mantida em agitação por 10 minutos; 3) O solvente e o excesso de água são evaporados.*No preparo de nanoesferas não são adicionados óleo e tensoativo hidrofóbico.
26 3.3 Determinação da solubilidade de CloxB em diferentes meios
Visando uma melhor avaliação dos resultados obtidos no desenvolvimento de nanopartículas foi realizado o estudo de solubilidade da CloxB em óleos Miglyol® 812N e Velsan e em água. Foi também determinado o coeficiente de partição octanol/água do fármaco.
Os experimentos de solubilidade foram realizados a 37ºC. Para o estudo de solubilidade um excesso de CloxB (0,5g) foi equilibrado com cada um dos 3 meios (Miglyol®, Velsan e água) por 72h sob agitação em um tubo de Falcon de 15 mL. Após esse período foram coletadas alíquotas de 50 μL de cada um dos meios e colocadas em balões volumétricos de 2 mL contendo acetonitrila:metanol (7:3). Após solubilização, alíquotas de 200 μL dessa solução foram coletadas, diluídas para 1mL com acetonitrila: metanol (7:3) e quantificadas em CLAE a 225nm (Mosqueira e cols., 2006).
Para a determinação do LogP, tubo Falcon contendo uma mistura 1:1 (volume total de 15mL) de n-octanol:água foram mantidas sob agitação por 24h. Após esse período, centrifugou-se a amostra, para centrifugou-separação dos meios. Em centrifugou-seguida foram adicionados 0,25g de CloxB a cada um dos meios e estes mantidos sob agitação a 37ºC por mais 72h. Após esse período foram coletadas alíquotas de 50 μL de cada um dos meios e colocadas em balões volumétricos de 2 mL contendo acetonitrila:metanol (7:3). Após solubilização, alíquotas de 200 μL dessa solução foram coletadas, diluídas para 1mL com acetonitrila: metanol (7:3) e quantificadas em CLAE a 225nm (Mosqueira e cols., 2006).
3.4 Caracterização Físico-Química das Nanopartículas
3.4.1 Distribuição de tamanho
27 A técnica de espalhamento dinâmico da luz ou espectroscopia de correlação de fótons baseia-se na determinação das flutuações na intensidade da luz espalhada pelas partículas, em função do tempo, e no cálculo da respectiva função de auto- correlação. Uma grande vantagem desta técnica em comparação ao espalhamento de luz estático é permitir a determinação da distribuição do diâmetro das partículas, e não apenas um valor médio de diâmetro. A fim de entendermos esse fenômeno, é necessário relembrar algumas definições. Partículas em meio líquido movem-se ao acaso (movimento Browniano), devido a colisões com as moléculas do meio de dispersão. Partículas menores se movimentam mais rapidamente que partículas grandes e, portanto, apresentam coeficiente de difusão (D) maior. A medida da intensidade da luz espalhada por uma dispersão permite detectar e analisar esse movimento browniano das partículas. A luz espalhada por uma dispersão em um dado instante é combinada, formando um padrão de interferência que depende das posições relativas das partículas. À medida que as partículas sofrem deslocamentos aleatórios, o padrão de interferência acompanha estas modificações, produzindo uma variação da intensidade da luz espalhada no detector. Embora a flutuação da intensidade espalhada seja aleatória por natureza, ela ocorre em uma escala de tempo de micro a milissegundos. O movimento lento das partículas grandes causará lentas alterações na intensidade da luz espalhada. Por outro lado, a movimentação rápida de partículas pequenas provocará uma flutuação muito rápida na intensidade da luz espalhada. Para uma dispersão de partículas com viscosidade η, em uma temperatura constante T, o coeficiente de difusão D é inversamente proporcional ao diâmetro hidrodinâmico dH
das partículas, conforme mostra a equação de Stokes-Einstein: Onde k é a constante de Boltzmann.
A constante de Boltzmann é uma constante física que relaciona temperatura e energia de moléculas. É obtida pela razão entre a constante dos gases ideais (R) pela constante de avogrado (N).
As flutuações da intensidade da luz espalhada ao longo do tempo são representadas por meio da função de correlação. No caso das partículas pequenas essa função de correlação entre as intensidades diminui mais rapidamente com o tempo do que no caso das partículas grandes. No tempo t= t0= 0, a intensidade de espalhamento em um tempo (t0 + ô) estará cada vez menos
H d kT D 3 K J N R
28 correlacionada com a intensidade de espalhamento inicial, e a média dos produtos das intensidades tende a zero. Para partículas esféricas e monodispersas, a função decai exponencialmente num intervalo de tempo t, e a constante de decaimento da curva exponencial gerada pela função de correlação está relacionada com o coeficiente de difusão translacional das partículas. A constante de decaimento depende do índice de refração do líquido que dispersa as partículas, do ângulo de detecção da luz espalhada e do comprimento de onda da luz incidente (Calvo e cols., 1995). O diâmetro médio efetivo das partículas e sua dispersão foram determinados por meio da técnica de espalhamento dinâmico de luz, a um ângulo de detecção da luz espalhada fixo em 90°, na temperatura de 20°C em meio aquoso.
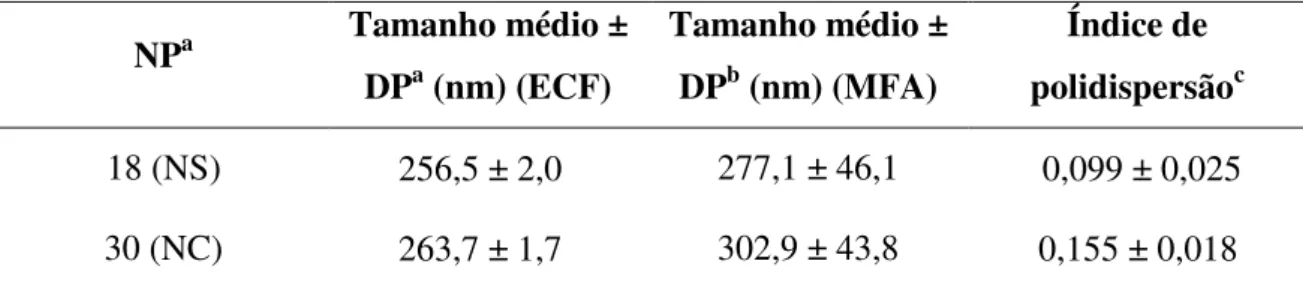
A espectroscopia de correlação de fótons (ECF), além do diâmetro médio das nanoestruturas, fornece por meio do cálculo, o índice de polidispersão (I.P.) das formulações. O I.P. é utilizado para determinar a distribuição de tamanho das partículas nas amostras. Formulações de NP com valores de I.P. menores ou iguais a 0,3 apresentam-se monodispersas (Scholes e cols., 1993).
3.4.2 Potencial Zeta (ζ)
O potencial zeta foi determinado pela técnica de microeletroforese associada à anemometria de laser Doppler (ALD), utilizando-se o equipamento Zetasizer 3000HS (Malvern Instruments, UK). As amostras foram analisadas, diluindo 10 μL da suspensão de nanopartículas em 9990 μL de solução aquosa NaCl 1 mmol/L previamente filtrada em filtro de 0,45 μm, obtendo-se, assim, suspensões coloidais com forças iônicas semelhantes (1,2 ± 0,2 mS/cm2). As medidas foram realizadas em triplicata em alíquotas da mesma amostra e os resultados obtidos foram expressos como média ± desvio padrão.
29 Quando uma camada de macromoléculas é adsorvida na superfície da partícula, ela move o plano de cisalhamento para longe da superfície, alterando o potencial zeta. O potencial zeta é função da carga superficial da partícula, de qualquer camada adsorvida na interface com o meio e da natureza e composição do meio que a circunda.
Figura 10: Esquema representativo da dupla camada elétrica
O potencial zeta (ζ) reflete o potencial elétrico existente na superfície das partículas e pode ser influenciado pela carga dos diferentes componentes dessas estruturas, localizado na interface com o meio dispersante, e pela adsorção de espécies iônicas do meio de dispersão (Legrand e cols., 1999).
3.4.3 Análise morfológica das nanopartículas
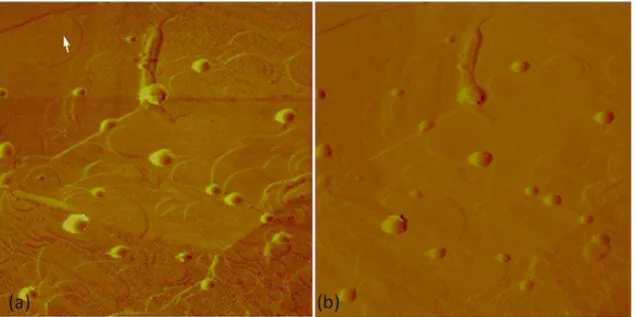
Até o momento foram realizadas análises morfológicas das nanoesferas brancas e contendo 0,1 mg/mL de CloxB e da formulação de nanocápsula branca. Para análise morfológica foi utilizada a microscopia de força atômica (MFA), utilizando os equipamentos Multimode e Dimension 300, ambos monitorados por controlador Nanoscope IIIa (Digital Instruments, Santa Bárbara, EUA), no Centro Tecnológico de Minas Gerais (CETEC, MG). As imagens foram obtidas no modo de contato intermitente (tapping mode) utilizando sondas de silício de comprimento de 228 μm, com uma freqüência de ressonância de 75-98 kHz, força constante de 29-61 N/m e raio de curvatura de 5 nm a 10 nm.
30 pixels. A análise das amostras foi realizada utilizando um programa de análise do sistema (Section Analysis).
3.5 Análise Estatística dos Dados