EMPREGO DE TECNOLOGIAS EMERGENTES NO PROCESSAMENTO DE SUCO DE LARANJA ADICIONADO DE FRUTO-OLIGOSSACARÍDEOS E SUCO
PREBIÓTICO DE LARANJA PRODUZIDO VIA SÍNTESE ENZIMÁTICA
FRANCISCA DIVA LIMA ALMEIDA
EMPREGO DE TECNOLOGIAS EMERGENTES NO PROCESSAMENTO DE SUCO DE LARANJA ADICIONADO DE FRUTO-OLIGOSSACARÍDEOS E SUCO
PREBIÓTICO DE LARANJA PRODUZIDO VIA SÍNTESE ENZIMÁTICA
Tese submetida à Coordenação do Curso de Pós-graduação em Biotecnologia - Renorbio, da Universidade Federal do Ceará, como requisito parcial para obtenção do grau de Doutor em Biotecnologia.
Área de concentração: Biotecnologia Industrial
Ponto focal: Universidade Federal do Ceará (UFC)
Orientadora: Profª Drª Sueli Rodrigues.
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências e Tecnologia
A446e Almeida, Francisca Diva Lima.
Emprego de tecnologias emergentes no processamento de suco de laranja adicionado de fruto-oligossacarídeos e suco prebiótico de laranja produzido via síntese enzimática./ Francisca Diva Lima Almeida. – 2015.
108 f. : il. color.
Tese (Doutorado) – Universidade Federal do Ceará, Centro de Ciências Agrárias, Programa de Pós-Graduação em Biotecnologia (Rede Nordeste de Biotecnologia), Fortaleza, 2015.
Área de Concentração: Biotecnologia Industrial. Orientação: Profa. Dra. Sueli Rodrigues.
1. Suco de laranja. 2. Oligossacarídeos. 3. Bioteconologia. I. Título.
EMPREGO DE TECNOLOGIAS EMERGENTES NO PROCESSAMENTO DE SUCO DE LARANJA ADICIONADO DE FRUTO-OLIGOSSACARÍDEOS E SUCO
PREBIÓTICO DE LARANJA PRODUZIDO VIA SÍNTESE ENZIMÁTICA
Tese submetida à Coordenação do Curso de Pós-graduação em Biotecnologia - Renorbio, da Universidade Federal do Ceará, como requisito parcial para obtenção do grau de Doutor em Biotecnologia.
Aprovada em: 30/10/2015
BANCA EXAMINADORA
______________________________ Profa. Dr. Sueli Rodrigues (Orientadora)
Universidade Federal do Ceará (UFC)
______________________________ Profa. Dr. Ana Lúcia Fernandes Pereira
Universidade Federal do Maranhão (UFMA) - Membro
______________________________ Profa. Dr. Luciana Rocha Barros Gonçalves Universidade Federal do Ceará (UFC) - Membro
______________________________ Dr. Edy Sousa de Brito
Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA)
______________________________ Dr. Elenilson de Godoy Alves Filho
Dedico este trabalho,
ao meu anjinho particular, Heitor (in memoriam),
caminhada. Por me conduzir sempre nos melhores caminhos, por colocar pessoas tão bondosas e cheias de luz em meu caminho.
Aos meus pais, José Eudes de Almeida e Maria de Fátima Lima Almeida, por todo amor e carinho de sempre. Por confiarem e acreditarem nas minhas escolhas. Por sempre me darem forças, pelas inúmeras vezes que me ligaram perguntando: “Como está o doutorado? E o artigo?”. Pelas orações da minha mãe, por todo cuidado e zelo. Amo vocês e, é por vocês todo o meu esforço.
À minha orientadora, Profa. Dra. Sueli Rodrigues, que me acolheu de braços abertos desde o mestrado. Obrigada pelos inúmeros ensinamentos, por todas as oportunidades, por estar sempre à disposição, por acreditar em mim, por cada ajuda e puxão de orelha. Obrigada por ser esse exemplo de profissional.
Ao Leonardo Primo, presente de Deus na minha vida. Obrigada por toda paciência durante esses anos que me acompanhou durante o doutorado. Obrigada por toda ajuda, toda torcida, por todo amor, por me fazer confiar que no final tudo daria certo. Obrigada pelo companheirismo, mesmo durante o período em que estávamos afastados fisicamente.
À Rosane, minha dupla inseparável do doutorado e da vida. Obrigada pelos agradáveis momentos que compartilhamos juntas, sorrimos juntas, choramos juntas.
Aos amigos queridos e companheiros de laboratório e sala do DIT: Richam, Lubna, Sonal, Lu, Carmem, Shashi, NN, por toda ajuda, ensinamentos, momentos de alegrias, por me acolherem tão bem na “Ilha de Esmeralda”.
Aos amigos do LABIOTEC: Niédila, Cristiane, Cláudia, Jonas, Elenylson, Imilena, Soraya, Simone, Mariana, Nair, Lívia, às Thatis Nunes, Vidal e Cavalcante, por todo carinho, em especial ao Wesley, por todo carinho e amizade e, também, por toda ajuda na finalização deste trabalho.
Às minhas queridas irmãs, Virgínia, Clarissa e Cristiane por todo carinho e força, por sempre torcerem por mim.
Aos meus queridos “Bioamigos”, em especial, Karine Pires, André Leandro, Milena Esmeraldo, Eduardo Neves, Luís Neto, Anderson Weyne, Camila Salviano, pelos momentos prazerosos que compartilhamos durante o período de doutorado.
Aos doutores Edy Brito e Elenilson Godoy e às professoras doutoras Ana Lúcia Fernandes e Luciana Gonçalves por, gentilmente, aceitarem o convite para participar da banca examinadora.
Aos meus tios Regina e Alfredo por me acolherem durante quase todo o período do doutorado. Obrigada por todo carinho.
À CAPES peça concessão da bolsa de estudos e ao CNPQ pelo financiamento do meu projeto de pesquisa.
processamento de suco de laranja adicionado de fruto-oligossacarídeos e suco prebiótico de laranja produzido via síntese enzimática. 2015. Tese – Programa de Pós-graduação em Biotecnologia - Renorbio. Universidade Federal do Ceará, Fortaleza.
processamento de suco de laranja adicionado de fruto-oligossacarídeos e suco prebiótico de laranja produzido via síntese enzimática. 2015. Tese – Programa de Pós-graduação em Biotecnologia - Renorbio. Universidade Federal do Ceará, Fortaleza.
a prebiotic food. The other parameters analyzed were preserved. Thus, atmospheric cold plasma and ozone are suitable non-thermal alternatives for prebiotic orange juice treatment.
Figura 1 - Representação da reação do aceptor ... 27 Figura 2 - Esquema de montagem experimental para sistema de plasma frio. ... 36 Figura 3 - Sistema esquemático de tratamento de ozônio. ... 38
CAPÍTULO 2
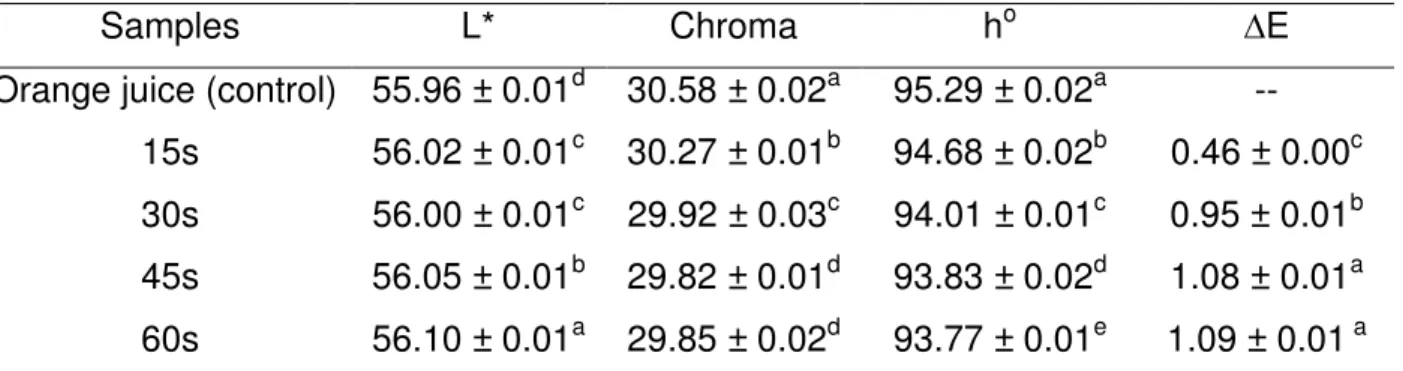
Table 1 - Color parameters of the orange juice after direct exposure by plasma ... 64
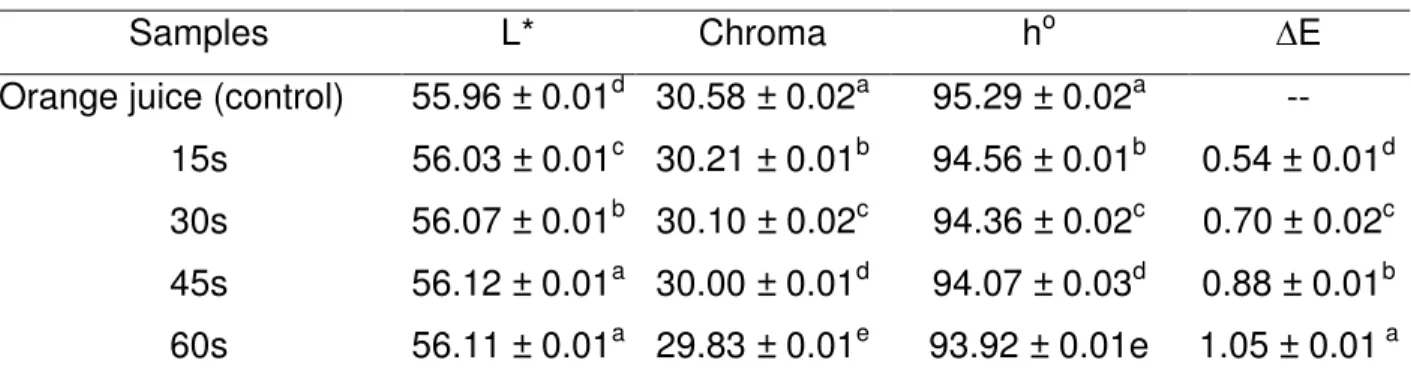
Table 2 - Color parameters of the orange juice after indirect exposure by plasma.. ... 65
Table 3 - Color parameters of the orange juice treated by HPP.. ... 66
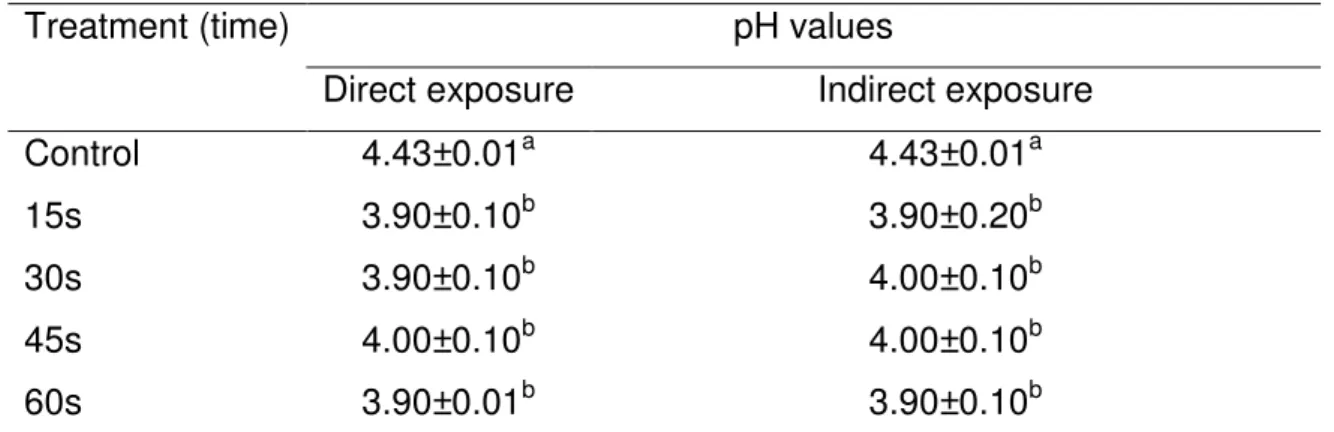
Table 4 - pH values in prebiotic orange juice after high pressure processing ... 67
Table 5 - pH values in prebiotic orange juice after plasma treatment. ... 67
CAPÍTULO 3 Table 1 – pH values in prebiotic orange juice after ozone processing. ... 88
Table 2 – pH values in prebiotic orange juice after plasma treatment ... 89
Table 3 – Oligosaccharide concentration and loss after non-thermal treatment ... 94
Table 4 – Color parameters of the prebiotic orange juice after ozone processing.. ... 96
Table 5 – Color parameters of the prebiotic orange juice after plasma treatment ... 97
– –
DPPH 2,2 – difenil1 – picrilhidrazil FOS Fruto-oligossacarídeos TLC Thin Layer Chromatography
HPLC High Performance Liquid Chromatography DP Degree of Polymerization
ACP Atmospheric Cold Plasma DBD Descarga de barreira dielétrica LAB Lactic acid bacteria
GS Glucansucrases FS Fructansucrases
INTRODUÇÃO ... 17
CAPÍTULO 1: REVISÃO BIBLIOGRÁFICA ... 20
1.1 Alimentos funcionais: uma visão geral ... 20
1.2 Oligossacarídeos prebióticos ... 22
1.2.1 Oligossacarídeos prebióticos produzidos via síntese enzimática ... 25
1.3 Sucos de frutas como veículo de ingredientes funcionais. ... 27
1.3.1 Suco de laranja como um alimento funcional ... 28
1.4 Métodos de processamentos de alimentos: convencionais X tecnologias emergentes ... 31
1.4.1 Tecnologia de plasma na conservação de alimentos ... 34
1.4.2 Emprego do ozônio ... 37
1.4.3 Altas Pressões ... 39
REFERÊNCIAS ... 41
CHAPTER 2 - EFFECT OF ATMOSPHERIC COLD PLASMA AND HIGH PRESSURE PROCESSING ON FRUCTO-OLIGOSACCHARIDES, ORGANIC ACIDS AND ORANGE JUICE COLOR ... 50
2.1 Introduction ... 51
2.2 Materials and Methods ... 53
2.2.1 Prebiotic orange juice preparation ... 53
2.2.2 Plasma Treatment ... 53
2.2.3 High pressure processing ... 54
2.2.4 Carbohydrate analysis ... 55
2.2.4.1 Fructo-oligosaccharides degree of polymerization characterization ... 55
2.2.5 Color measurement ... 56
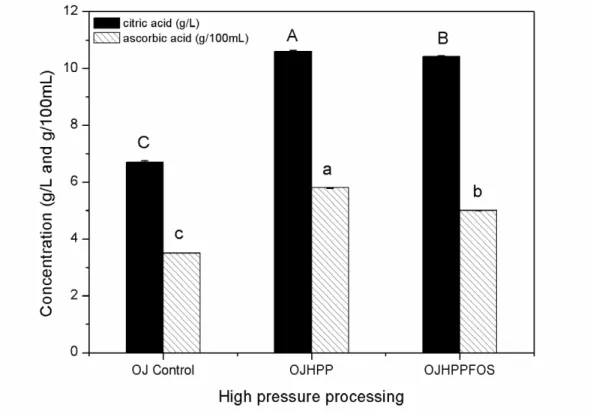
2.2.6 Organic acid quantification ... 57
2.2.7 Statistical analysis ... 57
2.3. Results and Discussion ... 58
2.3.1 Fructo-oligosaccharides quantification by TLC ... 58
REFERENCES ... 72
CAPÍTULO 3: EFFECTS OF ATMOSPHERIC COLD PLASMA AND OZONE ON PREBIOTIC ORANGE JUICE ... 75
3.1. Introduction ... 76
3.2. Materials and methods ... 78
3.2.1 Orange juice ... 78
3.2.2 Dextransucrase production and enzyme activity determination ... 78
3.2.3 Prebiotic oligosaccharides synthesis in orange juice ... 79
3.2.4 Plasma treatment on prebiotic orange juice ... 79
3.2.5 Ozone treatment on prebiotic orange juice ... 81
3.2.6 Carbohydrate analysis ... 82
3.2.6.1 Oligosaccharides degree of polymerization ... 82
3.2.6.2 Sugars and oligosaccharides quantification ... 83
3.2.7 Color analysis ... 84
3.2.8 Total phenolic content ... 85
3.2.9 Antioxidant activity determination ... 85
3.2.9.1 DPPH method ... 86
3.2.9.2 ABTS method ... 86
3.2.10 Statistical analysis ... 87
3.3 Results and discussions ... 87
3.3.1 Orange juice characterization ... 87
3.3.2 Effect of plasma and ozone on the juice pH ... 88
3.3.3 Oligosaccharides characterization after plasma and ozone treatments... 89
3.3.4 Oligosaccharides quantification by HPLC after plasma and ozone treatments. ... 91
3.3.5 Color analysis ... 96
3.3.6 Total phenolic content ... 99
3.3.7 Total antioxidant activity ... 100
INTRODUÇÃO
Um número crescente de consumidores está, cada vez mais, consciente da importância dos alimentos funcionais devido aos benefícios adicionais de saúde que estes oferecem. Diante disso, os alimentos funcionais, sendo uma das principais categorias de alimentos do mercado de saúde e bem-estar global, estão se tornando um grande foco de desenvolvimento de novos produtos na indústria de alimentos.
Dentro da categoria de alimentos funcionais, os prebióticos vêm ganhando um destaque especial. Eles são ingredientes alimentares seletivamente fermentados que permitem mudanças específicas, tanto na composição quanto na atividade da microbiota gastrintestinal, conferindo benefícios de saúde e bem-estar ao hospedeiro.
Atualmente, a grande maioria dos alimentos contendo oligossacarídeos são produtos à base de leite. Contudo, a produção de alimentos prebióticos não lácteos é uma opção interessante e bastante promissora para a produção desse tipo de alimento a baixo custo e em escala industrial.
Dessa forma, o desenvolvimento de alimentos funcionais vem estimulando a inovação e o desenvolvimento de novos produtos na indústria de alimentos. Entretanto a estabilização microbiológica do mesmo sem o uso de conservantes e processamento térmico representa um desafio. Os desenvolvimentos na área de processamento de alimentos são, geralmente, conduzidos de forma a combinar a inovação tecnológica com os hábitos sociais e culturais, a fim de produzir alimentos que satisfaçam as necessidades nutricionais, pessoais e sociais de todas as comunidades.
Diante disso, a tecnologia de plasma representa uma alternativa potencial aos métodos tradicionais de processamento não térmico de alimentos. Enquadra-se, ainda, entre as tecnologias avançadas não térmicas como uma abordagem alternativa para a eliminação de micro-organismos deteriorantes e patógenos. Este processo apresenta numerosas vantagens sobre os métodos convencionais, como: processo operacional de baixo custo, tempo de tratamento curto a baixas temperaturas, natureza não tóxica e aplicação para uma grande variedade de produtos (Ziuzina et al. 2013).
A aplicação da tecnologia de alta pressão (HPP), em alimentos, resulta em produtos com qualidade sensorial superior quando comparados com produtos submetidos a processamento térmico (Patras et al. 2009). O processamento utilizando altas pressões é capaz, ainda, de ativar e inibir micro-organismos, ativar e inativar enzimas a baixas temperaturas, enquanto que os compostos de baixo peso molecular, tais como vitaminas e compostos relacionado com a pigmentação e aroma, permanecem inalterados (Carnonell-Capella et al. 2013).
alimentos, com o intuito de atender a demanda dos consumidores por produtos prontos para o consumo, que sejam frescos e seguros. O ozônio é um alótropo triatômico de oxigênio e é caracterizado por um elevado potencial de oxidação, transmitindo propriedades bactericidas e viricidas. O ozônio inativa os micro-organismos através de oxidação e o residual de ozônio decompõe-se a produtos não tóxicos (isto é, oxigênio), tornando-o um agente antimicrobiano ambientalmente amigável para utilização na indústria de alimentos (Patil et al. 2009b).
CAPÍTULO 1: REVISÃO BIBLIOGRÁFICA
1.1 Alimentos funcionais: uma visão geral
Os alimentos funcionais, sendo uma das principais categorias de alimentos do mercado de saúde e bem-estar global, estão se tornando um grande foco de desenvolvimento de novos produtos na indústria de alimentos (Khan et al. 2013). Esta por sua vez, tem um papel central no sentido de facilitar as práticas alimentares mais saudáveis através da prestação e promoção de alimentos que sejam saborosos, visualmente atrativos e saudáveis (Nagpal, Kumar, and Kumar 2012; Saad et al. 2013). Nesse contexto, grandes avanços vêm ocorrendo no desenvolvimento dos alimentos funcionais.
Alimentos funcionais são definidos como alimentos que afetam beneficamente a saúde de quem os consomem, além dos efeitos nutricionais adequados. Essa classe de alimentos é similar aos alimentos convencionais com relação à aparência, contudo eles vão além do papel tradicional de alimentos como provedor de nutrição. Eles fornecem função específica, proporcionando efeitos adicionais de saúde sobre o consumo sustentável (Lamsal 2012; Silva, Rabelo e Rodrigues 2012). Ingredientes alimentares funcionais estão inclusos, principalmente, os probióticos, prebióticos, vitaminas e minerais e são comumente aplicados em leites fermentados, iogurtes, bebidas esportivas, alimentos para bebês, etc (Lamsal 2012).
variáveis, tais como: a interação desse composto com a matriz alimentar, a estabilidade ao processamento e a sua biodisponibilidade (Amigo-Benavent et al. 2013). A principal motivação dos consumidores para a compra de alimentos funcionais é o crescente desejo em prevenir doenças crônicas, como doença cardiovascular, Alzheimer e osteoporose, ou para aperfeiçoar a saúde, por exemplo, aumentando a energia, estimulando o sistema imunológico e geração de bem-estar (Bigliardi and Galati 2013; Khan et al. 2013; Nobre, Suvarov e De Weireld 2014). No desenvolvimento de alimentos funcionais é necessário compreender os impactos sensoriais de seus componentes e determinar como a sua adição aos produtos pode influenciar a preferência e aceitabilidade dos consumidores em termos de aparência, aroma, sabor e textura, a fim do desenvolvimento e formulação direta dos produtos (Pimentel, Madrona e Prudencio 2014).
1.2 Oligossacarídeos prebióticos
O termo “Prebiótico” foi definido pela primeira vez em 1995 por Gibson e Roberfroid, como “ingredientes alimentares não digeríveis que afetam beneficamente o hospedeiro por estimularem seletivamente o crescimento e/ou atividade de um ou de um número limitado de espécies bacterianas já residentes no cólon” (Gibson and Roberfroid, 1995). No entanto, a literatura recente não restringe o cólon como único local de ação e, o termo prebiótico é atualmente definido como “um ingrediente alimentar seletivamente fermentado que permite mudanças específicas, tanto na composição quanto na atividade da microbiota gastrintestinal, conferindo benefícios de saúde e bem-estar ao hospedeiro” (Figueroa-González et al. 2011; Roberfroid, 2010; Saad et al. 2013).
Com exceção da inulina, que é uma mistura de fruto-oligossacarídeos e polissacarídeos, os prebióticos são misturas de oligossacarídeos não digeríveis, que consistem de 3-10 monômeros de carboidratos (Saad et al. 2013). Dentre estes, podem ser citados os fruto-oligossacarídeos, glico-oligossacarídeos, isomalto-oligossacarídeos (IMOS), galacto-oligossacarídeos, oligossacarídeos de soja, etc (Patel e Goyal 2010). Estes oligossacarídeos são encontrados em diferentes fontes alimentares, tais como: leite, mel, cana de açúcar, soja, alho, beterraba (Mussatto e Mancilha 2007).
quais atuam na melhoria da saúde, além de minimizar o crescimento de bactérias patogênicas (Srinivasjois, Rao e Patole 2013).
As mudanças entre as colônias de espécies microbianas no intestino humano produz uma ampla gama de efeitos positivos, incluindo o aumento da saciedade e da absorção de cálcio da dieta, regulação da motilidade intestinal, produção de ácidos graxos de cadeia curta, prevenção de diarreia e constipação (Johnson et al. 2013; Pimentel et al. 2014). Além disso, o consumo regular de prebióticos alivia os sintomas de constipação, estimula o sistema imunológico (Lee and Mazmanian 2010), pode diminuir o risco de câncer de cólon e os fatores de risco associados à obesidade e síndrome metabólica (Johnson et al. 2013).
Contudo, para que os prebióticos possam atuar como ingredientes funcionais, eles devem ser quimicamente estáveis às etapas de processamento de alimentos, como calor, baixo pH e condições da reação de Maillard (Huebner et al. 2008). Esses ingredientes devem, ainda, apresentar alguns critérios importantes: serem resistentes à ação de enzimas salivares e intestinais e estimular o crescimento de bactérias benéficas no intestino (Lamsal 2012).
2014). O consume de 200 mL de suco prebiótico de laranja corresponde a uma ingestão de 14 g de FOS.
A European Food Standard Agency define os valores de referência para fibra dietética a 25 g por dia para adultos de 18 anos de idade ou mais, para sustentar a função normal do intestino (European Food Safety Authority, 2010). No entanto, não existem recomendações oficiais com relação ao consumo de prebióticos. Enquanto isso, muitos investigadores têm oferecido algumas sugestões: 10 g por dia de FOS (Bouhnik et al. 1999) e 7 g por dia de galato-oligosacarídeos (Silk et al. 2009).
Diversos estudos envolvendo a adição de ingredientes prebióticos em alimentos têm relatado efeitos positivos, uma vez que esses ingredientes apresentam a capacidade de favorecer o crescimento de micro-organismos probióticos (Tako et al. 2014), bem como melhorias nos atributos físico-químicos, reológicos e sensoriais dos produtos (Cruz et al. 2013; Liu et al. 2014; Freitas, Amancio e Morais 2012; Tako et al. 2014).
1.2.1 Oligossacarídeos prebióticos produzidos via síntese enzimática
Nas últimas décadas, muitos estudos têm investigado a produção de prebióticos como ingredientes alimentares capazes de promover um estado de bem-estar e saúde aos consumidores. A maioria dos ingredientes prebióticos identificados atualmente são obtidos por extração direta a partir de fontes naturais, ou produzidos por meio de processos químicos que hidrolisam polissacarídeos, ou ainda, pela síntese química através de reações de transglicosilação de carboidratos de baixo grau de polimerização e síntese enzimática de dissacarídeos (Charalampopoulos e Rastall 2012; Figueroa-González et al. 2011; Saad et al. 2013).
Diversos trabalhos têm demonstrado a obtenção de ingredientes prebióticos por diferentes vias. Sangwan et al. (2014) estudaram a produção de
galacto-oligossacarídeos (GOS) a partir da síntese de β-galactosidase, produzida pelo
Streptococcus thermophilus. Silva et al. (2013b) investigaram a produção de
fruto-oligossacarídeos (FOS), em meio aquoso, a partir da atividade enzimática da inulase imobilizada. Praznik et al. (2013) avaliaram a estrutura de fruto-oligossacarídeos obtidos de folhas e caules da cultivar Agave tequilana. Silva, Rabelo and Rodrigues (2012) produziram oligossacarídeos prebióticos por processo enzimático, através da adição da enzima dextranasacarase em suco de caju clarificado.
oligossacarídeos. Elas são responsáveis em catalisar a transferência de unidades de glicose, a partir de uma molécula doadora, para um receptor específico (Rabelo, Fontes, and Rodrigues 2009a; Rodrigues, Lona, and Franco 2005, 2006; Saad et al. 2013).
Bactérias ácido-lácticas apresentam a capacidade de produzir uma ampla variedade de um grupo particular de glicosiltransferases, as quais são utilizadas para a produção de oligossacarídeos (Rabelo, Honorato, e Rodrigues 2009b). Lactobacillus spp. e Leuconostoc spp. estão envolvidos na síntese de importantes produtos para a saúde humana, devido suas propriedades prebióticas e atividade imunomoduladora (Bivolarski et al. 2013). Quando a estirpe Leuconostoc mesenteroides NRRL B512 é cultivado em meio contendo sacarose como fonte de carbono, uma fonte de nitrogênio e minerais, ele fermenta os açúcares do meio produzindo a enzima dextranasacarase (Rodrigues, Lona, and Franco 2003).
Dextranasacarase é uma enzima bacteriana extracelular que catalisa a formação de dextrana quando o meio contém sacarose como único substrato. Contudo, em um meio contendo um aceptor como substrato (frutose, glicose, maltose, etc.), além da sacarose como segundo substrato, a enzima apresenta a capacidade de produzir oligossacarídeos prebióticos. Esta reação é conhecida como reação do aceptor e a proporção sacarose: aceptor está diretamente relacionado com o rendimento e grau de polimerização da dextrana e oligossacarídeos formados (Rodrigues, Lona and Franco 2006).
desviadas da cadeia de dextrana para a formação do produto do aceptor (Rabelo et al. 2006). Como as unidades de glicose são incorporadas na cadeia de oligossacarídeos, o grau de polimerização dos mesmos tende a aumentar. Graus de polimerização com até 10 unidades de glicose, com as mesmas sendo incorporadas por síntese enzimática,
através de ligações do tipo α-1,6, são conhecidos como oligossacarídeos prebióticos
(Silva, and Rodrigues 2012). A figura a seguir representa um esquema da reação do aceptor:
Figura 1 – Representação da reação do aceptor. Fonte: Silva (2013a)
1.3 Sucos de frutas como veículo de ingredientes funcionais.
Atualmente, a grande maioria dos alimentos contendo oligossacarídeos prebióticos são produtos à base de leite (Cruz et al. 2013). Entretanto, alguns consumidores evitam o consumo destes produtos devido a problemas de alergia ao leite, intolerância a lactose ou vegetarianismos (Araújo et al. 2014). Dessa forma, a produção de alimentos prebióticos em escala industrial vem enfrentando grandes desafios. A produção de oligossacarídeos não lácteos é uma opção interessante e
Dextranasacarase
Dextranasacarase Sacarose
Sacarose + Aceptor
Dextrana + Frutose
bastante promissora para a produção de alimentos prebióticos a baixo custo e em escala industrial (Figueroa-González et al. 2011).
Nesse contexto, sucos de frutas são considerados substratos adequados para veicular esses ingredientes funcionais, uma vez que são alimentos ricos em nutrientes, como vitaminas, fibras, minerais e antioxidantes. Além disso, eles possuem perfis de sabor agradável e são alimentos consumidos com regularidade por todas as faixas etárias, devido seu sabor refrescante e seu status de alimento saudável (Pereira 2013; Pimentel et al. 2014). Vários trabalhos têm reportado o uso de suco de frutas como substrato para a incorporação de ingredientes prebióticos.
Araújo et al. (2014) e Coelho (2013) desenvolveram um novo produto funcional a partir da desidratação, em leito de jorro, de suco de acerola e limão, respectivamente contendo oligossacarídeos prebióticos, produzidos a partir da reação de aceptor da dextranasacarase.
Silva (2013a) utilizou diferentes tipos de sucos de frutas: cajá, jambo e siriguela para sintetizar oligossacarídeos prebióticos como forma de elaboração de novos produtos funcionais. Silva, Rabelo and Rodrigues (2012) produziram oligossacarídeos prebióticos por processo enzimático, adicionando a enzima dextranasacarase em suco de caju clarificado.
1.3.1 Suco de laranja como um alimento funcional
2014). O suco de laranja fresco é um dos sucos mais consumidos mundialmente, com uma participação de 35% do mercado de bebidas de frutas e, isso é devido ao seu rico conteúdo em vitamina C e valor nutritivo (Agcam, Akyıldız, e Evrendilek 2014; Ferreira et al. 2013), além da perfeita combinação dos seus atributos sensoriais, tais como a cor, sabor e aroma (Vervoort et al. 2011). Ele é uma importante fonte de compostos bioativos, como ácidos orgânicos, compostos fenólicos, carotenoides, os quais têm mostrado serem bons contribuidores para a capacidade antioxidante total (Carbonell-Capella et al. 2013; Zulueta et al. 2013).
Devido à riqueza nutricional que o suco de laranja apresenta, ele tem sido considerado um substrato promissor para a elaboração de novos produtos com propriedades funcionais.
Diante disso, diversos estudos têm demonstrado a potencialidade do suco de laranja e de seus subprodutos como veículo para a entrega de ingredientes funcionais. Nesse contexto, Manderson et al. (2005) avaliaram as propriedades prebióticas de oligossacarídeos extraídos da casca de subprodutos da fabricação de suco de laranja, bem como estudaram uma forma mais eficaz em termos de custos para a produção desses oligossacarídeos.
Com relação à aceitação sensorial dos sucos contendo ingredientes funcionais, diferentes estudos têm sido realizados com essa finalidade e os resultados ainda apresentam algumas contradições. Luckow e Delahunty (2004) estudaram o impacto sensorial de ingredientes funcionais probióticos no sabor e aroma de suco de laranja. Os resultados desse estudo mostraram que sucos de laranja contendo propriedades funcionais são associados a um sabor não característico do suco. Os consumidores preferiram as características sensoriais do suco de laranja convencional ao suco funcional.
Por outro lado, Coelho (2009) realizou um estudo envolvendo a aceitação sensorial de suco de laranja probiótico e adoçado. Os resultados mostraram uma aceitação global de 84% dos consumidores. A autora relata que a adição de açúcar pode ser uma estratégia utilizada para melhorar a aceitação do suco de laranja fermentado. Contudo, a informação ao consumidor acerca dos benefícios que esses alimentos promovem à saúde, leva a uma melhoria da aceitação do produto.
Apesar do seu baixo pH, a estabilidade do suco de laranja é bastante limitada durante a estocagem, devido um importante número de reações de deterioração, como por exemplo, a degradação do ácido ascórbico, deterioração microbiana, ação de enzimas, desenvolvimento de off-flavour, alterações na cor, textura e aparência (Zulueta et al. 2013).
nutritivas irreversíveis, que afeta a qualidade do suco e, muitas vezes, a aceitação do produto (Demirdöven and Baysal 2014; Vervoort et al. 2011).
1.4 Métodos de processamentos de alimentos: convencionais X tecnologias emergentes
Sob o ponto de vista tecnológico, os principais objetivos dos processos de preservação e conservação consistem em prolongar a vida útil dos produtos alimentícios, oferecendo aos consumidores produtos que não somente apresentem boa qualidade nutritiva e sensorial, mas também, alimentos seguros, isentos de micro-organismos e suas toxinas. A escolha do método de conservação adequado irá depender da origem do alimento, seu estado físico (sólido, líquido, emulsionante), o tempo de conservação necessário e o destino final do produto (Fellows 2006).
Dentre os inúmeros métodos de conservação disponíveis, o tratamento térmico continua sendo um dos métodos mais importantes empregados no processamento e conservação dos alimentos, principalmente pelos efeitos de conservação através da inativação de enzimas e micro-organismos. Contudo, a aplicação do calor pode resultar em alterações dos componentes dos alimentos, responsáveis por suas características sensoriais, bem como em alterações do conteúdo nutritivos dos mesmos (Demirdöven e Baysal 2014).
qualidade dos sucos de frutas. No entanto, conseguir a estabilização microbiológica desses alimentos sem o uso de conservantes e aplicação de um processamento térmico ainda é um grande desafio (Damasceno et al. 2008).
Vários trabalhos têm avaliado os efeitos do tratamento térmico convencional na qualidade de sucos de frutas e alguns autores comparam seus impactos com a de um processamento não térmico. Nesse contexto, Vervoort et al. (2011) compararam o impacto do processamento térmico, tecnologia de altas pressões e o processo de campo elétrico pulsado nos parâmetros de qualidade químico e bioquímico do suco de laranja. Com relação aos parâmetros de qualidade investigados (açúcares, ácidos orgânicos, vitamina C, furfural, carotenoides e HMF), não houve impacto significativamente diferente das três técnicas utilizadas.
Cortés, Esteve e Frígola (2008) estudando o efeito da estocagem refrigerada no conteúdo de ácido ascórbico de suco de laranja submetido aos tratamentos de pasteurização térmica e campo elétrico pulsado, relataram que, em temperatura de estocagem a 2 ºC, a qualidade nutricional do suco de laranja (ácido ascórbico) foi mantida por mais tempo no suco tratado por campo elétrico pulsado (277 dias de vida de prateleira), enquanto que no suco tratado por pasteurização térmica convencional a vida de prateleira só chegou até 90 dias. Patil et al. (2009a) e Tarazona-Díaz e Aguayo (2013) avaliaram o efeito da pasteurização térmica em sucos de frutas e concluíram que esse processo ocasionou degradação da cor dos produtos e redução dos compostos bioativos, resultando na redução da qualidade sensorial e nutricional do suco.
al. (2009), Klewicki (2007) e Huebner et al. (2008) estudaram a estabilidade de ingredientes funcionais durante a pasteurização a baixos valores de pH, e concluíram que os FOS são altamente susceptíveis à hidrólise nas condições de pasteurização de sucos de frutas, dentre outras bebidas. A quantidade hidrolisada desses ingredientes é maior quanto menor for o pH e mais longo for o tempo de pasteurização.
Diante disso, os prebióticos serão funcionalmente estáveis se a sua atividade prebiótica, antes e após as condições de processamento de alimentos, aumentar ou permanecer inalterada (Huebner et al. 2008). Dessa forma, um cuidado especial deve ser observado durante a aplicação de um processo para a conservação e aumento da vida útil de um produto com propriedades funcionais, visto que, o tratamento e suas condições podem afetar as características do produto em questão.
1.4.1 Tecnologia de plasma na conservação de alimentos
Plasma é um gás ionizado que pode ser produzido a partir da aplicação de uma descarga elétrica a um gás inicialmente neutro. O processo pode ocorrer à temperatura ambiente e pressão atmosférica, com um fluxo brilhoso composto de espécies químicas com características antimicrobianas e bastante reativas: fótons UV, partículas carregadas, superóxido, radicais hidroxila, óxido nítrico e ozônio (Bermúdez-Aguirre et al. 2013; Rød et al. 2012).
Nesse contexto, quando o plasma é produzido sob as condições acima citadas, é frequentemente chamado de “descargas luminescentes à pressão atmosférica” ou
ainda, “plasma de atmosfera fria (Atmosferic Cold Plasma – ACP)” para enfatizar o fato
de que as temperaturas dos gases estão próximas à temperatura ambiente (30- 60 °C) (Fernández and Thompson 2012). Contudo, dependendo dos níveis relativos de energia dos elétrons e espécies constituintes, os plasmas são classificados em plasmas térmicos e não térmicos (Jiang et al. 2014).
seladas, o que elimina o risco de contaminação pós-processamento (Misra et al. 2014a).
O uso da tecnologia de plasma para a conservação de alimentos embalados tem sido bem documentado (Pankaj et al. 2014a). Misra et al. (2014a) demonstraram, recentemente, a aplicação de plasma frio na conservação de morangos embalados, sem comprometer a qualidade dos mesmos. Pankaj et al. (2013), por sua vez, avaliaram a cinética de inativação da enzima peroxidase na conservação de tomates embalados.
A temperatura do plasma frio varia em torno de 30–60 ºC, e esta temperatura é desejada pela indústria de alimentos, uma vez que baixa energia é requerida para a formação do plasma, além de não afetar os compostos sensíveis a altas temperaturas (Bermúdez-Aguirre et al. 2013).
Esta tecnologia apresenta numerosas vantagens sobre os métodos convencionais, uma vez que apresenta custos operacionais de processo reduzido, utiliza tempo de tratamento reduzido a baixas temperaturas, apresenta natureza não tóxica e é aplicado a uma grande variedade de produtos (Ziuzina et al. 2013).
Figura 2 – Esquema de montagem experimental para sistema de plasma frio. Adaptação de Pankaj et al. (2013)
Diversos estudos têm reportado sobre a aplicação da tecnologia de plasma frio na conservação de alimentos, por meio da inativação de micro-organismos e, estes estudos têm mostrado resultados efetivos de inativação (Fernández et al. 2013; Misra et al. 2015; Patil et al. 2014; Ziuzina et al. 2014). As condições de tratamento aplicadas no presente estudo foram baseadas nesses trabalhos.
1.4.2 Emprego do ozônio
O uso do ozônio tem se destacado como um método alternativo aos processos térmicos, e é empregado na conservação de sucos de frutas e outros alimentos, com o intuito de atender a demanda dos consumidores por produtos prontos para o consumo, que sejam frescos e seguros (Patil et al. 2009a).
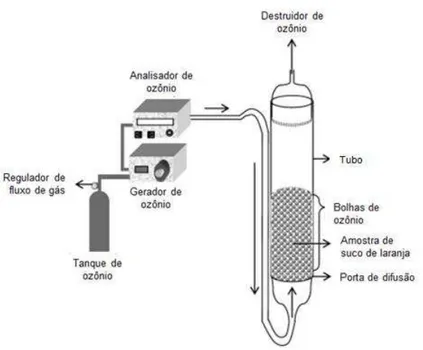
O ozônio é um alótropo tri-atômico do oxigênio e é um agente antimicrobiano capaz de inativar micro-organismos em geral, como fungos, vírus, protozoários, esporos fúngicos e bactérias. Isso é possível graças ao potencial altamente oxidante que o ozônio apresenta, resultando nessas propriedades bactericidas e viricidas que ele transmite. Os resíduos de ozônio se decompõem em produtos não tóxicos, sendo considerado, dessa forma, um agente antimicrobiano ambientalmente adequado para o uso na indústria de alimentos (Patil et al. 2009b). As reações de oxidação são causadas pelo ozônio molecular dissolvido ou pelas espécies de radicais livres formados durante a decomposição do ozônio (Patil et al. 2010a). A figura 3 apresenta uma representação do sistema de tratamento com ozônio.
Em 1997, a Food and Drug Administration (FDA) dos EUA, declarou o ozônio como um ingrediente “Geralmente Reconhecido como Seguro” (GRAS) para o uso no
Figura 3: Sistema esquemático de tratamento de ozônio. Fonte: Tiwari et al. (2008a)
Tradicionalmente, o processamento por ozônio dentro da indústria de alimentos tem se concentrado em alimentos sólidos, pela aplicação de qualquer tratamento gasoso, ou ainda, pela lavagem de frutas e vegetais com água ozonizada. No entanto, com a aprovação do ozônio como um aditivo direto à alimentação, surgiu a possibilidade de aplicação do mesmo em alimentos líquidos (Patil et al. 2010a).
conservação de sucos de frutas com propriedades prebióticas. Portanto, um dos objetivos do atual trabalho de tese foi avaliar os efeitos do tratamento de ozônio nas características funcionais de suco de laranja, além de avaliar as características sensoriais e de qualidade do produto tratado.
1.4.3 Altas Pressões
O processamento de alta pressão (HPP) pode ser uma ferramenta útil para a obtenção de produtos alimentícios mais saudáveis e seguros (Carnonell-Capella et al. 2013). Diante disso, esta tecnologia foi adaptada às necessidades específicas da indústria de alimentos e, atualmente, uma gama de produtos tratados por pressão, incluindo sucos de frutas e vegetais, molho de abacate, cozidos de presunto embalado, arroz cozido e carne de frango marinado, já foram introduzidos na União Europeia e no mercado americano (Patras et al. 2009).
No que diz respeito à qualidade de ingestão do produto acabado, a aplicação da tecnologia de altas pressões pode apresentar vantagens sobre os processamentos térmicos. Isso ocorre porque as moléculas pequenas, tais como compostos voláteis de aroma e pigmentos relacionados com a qualidade sensorial dos alimentos não são afetados pelo processamento de alta pressão (Patras et al. 2009).
REFERÊNCIAS
BRASIL. Disponível em:
http://portal.anvisa.gov.br/wps/content/Anvisa+Portal/Anvisa/Inicio/Alimentos/Assuntos+ de+Interesse/Alimentos+Com+Alegacoes+de+Propriedades+Funcionais+e+ou+de+Sau de/Alegacoes+de+propriedade+funcional+aprovadas
Acesso: 14/10/2014
Agcam, E., Akyıldız, A. and Evrendilek, G.A. 2014. “Effects of PEF and Heat
Pasteurization on PME Activity in Orange Juice with Regard to a New Inactivation
Kinetic Model.” Food chemistry 165:70–76. Retrieved August 26, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/25038650).
Amigo-Benavent, M., Nitride, C., Bravo, L., Ferranti, P. and Del Castillo, M.D. 2013.
“Stability and Bioactivity of a Bowman-Birk Inhibitor in Orange Juice during
Processing and Storage.” Food & function 4(7):1051–60. Retrieved December 15,
2014 (http://www.ncbi.nlm.nih.gov/pubmed/23536125).
Araújo, A.D.A. et al. 2014. “Production and Spouted Bed Drying of Acerola Juice
Containing Oligosaccharides.” Food and Bioproducts Processing 1–7. Retrieved
September 23, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S096030851400090X).
Bermúdez-Aguirre, D., Erik, W., Patrick, P., Barbosa-Cánovas, G. and Garcia-Perez, M. 2013. “Effect of Atmospheric Pressure Cold Plasma (APCP) on the Inactivation of
Escherichia Coli in Fresh Produce.” Food Control 34(1):149–57. Retrieved August
27, 2014 (http://linkinghub.elsevier.com/retrieve/pii/S0956713513002065).
Bigliardi, B. and Galati, F. 2013. “Innovation Trends in the Food Industry: The Case of
Functional Foods.” Trends in Food Science & Technology 31(2):118–29. Retrieved
July 24, 2014 (http://linkinghub.elsevier.com/retrieve/pii/S0924224413000678). Bivolarski, Veselin et al. 2013. “Characterization of Glucansucrases and
Fructansucrases Produced by Wild Strains Leuconostoc Mesenteroides URE13 and Leuconostoc Mesenteroides LM17 Grown on Glucose or Fructose Medium as a Sole Carbon Source.” 68.
Bouhnik, Yoram et al. 1999. “Short-Chain Fructo-Oligosaccharide Administration
Dose-Dependently Increases Fecal Bifidobacteria in Healthy Humans.” Journal of
Nutrition 129(1):113–16. Retrieved
Carbonell-Capella, J. M., Barba, F.J., Esteve, M.J., and Frígola, A. 2013. “High Pressure Processing of Fruit Juice Mixture Sweetened with Stevia Rebaudiana Bertoni:
Optimal Retention of Physical and Nutritional Quality.” Innovative Food Science &
Emerging Technologies 18:48–56. Retrieved November 22, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S1466856413000295).
Charalampopoulos, D. and Rastall, R.A. 2012. “Prebiotics in Foods.” Current opinion in
biotechnology 23(2):187–91. Retrieved November 04, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/22244693).
Coelho, J.C. 2009. “Elaboração de Bebida Probiótica a Partir Do Suco de Laranja Fermentado com Lactobacillus Casei.”
Coelho, R. M. D. 2013. “Elaboração de Pó Do Suco de Limão Prebiótico Desidratado Em Secador Em Leito de Jorro.”
Cortés, C., Esteve, M.J., and Frígola, A. 2008. “Effect of Refrigerated Storage on Ascorbic Acid Content of Orange Juice Treated by Pulsed Electric Fields and
Thermal Pasteurization.” European Food Research and Technology 227(2):629–35.
Retrieved December 12, 2014 (http://link.springer.com/10.1007/s00217-007-0766-x).
Cruz, A. G. et al. 2013. “Developing a Prebiotic Yogurt: Rheological, Physico-Chemical and Microbiological Aspects and Adequacy of Survival Analysis Methodology.”
Journal of Food Engineering 114(3):323–30. Retrieved August 24, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0260877412004013).
Damasceno, L. F., Fernandes, F.A.N., Magalhães, M.M.A., and Brito, E.S. 2008. “Non -Enzymatic Browning in Clarified Cashew Apple Juice during Thermal Treatment:
Kinetics and Process Control.” Food Chemistry 106(1):172–79. Retrieved August
26, 2014 (http://linkinghub.elsevier.com/retrieve/pii/S0308814607005237).
Demirdöven, A. and Baysal, T. 2014. “Optimization of Ohmic Heating Applications for
Pectin Methylesterase Inactivation in Orange Juice.” Journal of food science and
technology 51(9):1817–26. Retrieved December 15, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/25190836).
European Food Safety Authority Panel on Dietetic Products, Nutrition and Allergies (NDA) (2010). Scientific opinion on dietary reference values for carbohydrates and dietary fibre. EFSA Journal, 8(3), 1462–1538.
Fernández, A, Noriega, E. and Thompson, A. 2013. “Inactivation of Salmonella Enterica Serovar Typhimurium on Fresh Produce by Cold Atmospheric Gas Plasma
Technology.” Food microbiology 33(1):24–29. Retrieved December 15, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/23122497).
Fernández, A. and Thompson, A. 2012. “The Inactivation of Salmonella by Cold
Atmospheric Plasma Treatment.” Food Research International 45(2):678–84.
Retrieved July 27, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0963996911002390).
Ferreira, L. R., Macedo, J.A., Ribeiro, M.L. and Macedo, G.A. 2013. “Improving the Chemopreventive Potential of Orange Juice by Enzymatic Biotransformation.” Food
Research International 51(2):526–35. Retrieved December 15, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0963996913000379).
Figueroa-González, I., Quijano, G., Ramírez, G. and Cruz-Guerrero, A. 2011. “Probiotics and Prebiotics--Perspectives and Challenges.” Journal of the science of food and
agriculture 91(8):1341–48. Retrieved November 06, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/21445871).
Fontes, C. P. M. L. 2012. “Produção de Oligossacarídeos Pré-Bióticos Em Sucos de Frutas Cláudia Patrícia Mourão Lima Fontes Fortaleza - Ce Produção de
Oligossacarídeos Pré-Bióticos Em Sucos de Frutas.”
Freitas, K. C., Amancio, O. M. S. and Morais, M. B. 2012. “High-Performance Inulin and Oligofructose Prebiotics Increase the Intestinal Absorption of Iron in Rats with Iron
Deficiency Anaemia during the Growth Phase.” The British journal of nutrition
108(6):1008–16. Retrieved August 27, 2014 (http://www.ncbi.nlm.nih.gov/pubmed/22172251).
Gibson, G. R. and Roberfroid, M. B. 1995. “Critical Review Dietary Modulation of the Human Colonie Microbiota : Introducing the Concept of Prebiotics.” (August 1994).
Huebner, J., Wehling, R. L., Parkhurst, A. and Hutkins, R. W. 2008. “Effect of Processing Conditions on the Prebiotic Activity of Commercial Prebiotics.”
International Dairy Journal 18(3):287–93. Retrieved November 21, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0958694607001756).
Jiang, B. et al. 2014. “Review on Electrical Discharge Plasma Technology for
Wastewater Remediation.” Chemical Engineering Journal 236:348–68. Retrieved
August 19, 2014 (http://linkinghub.elsevier.com/retrieve/pii/S1385894713012941). Johnson, C.R., Thavarajah, D., Combs, G. F. and Thavarajah, P. 2013. “Lentil (Lens
51(1):107–13. Retrieved August 27, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0963996912004942).
Khan, R. S., Grigor, J., Winger, R. and Win, A. 2013. “Functional Food Product
Development – Opportunities and Challenges for Food Manufacturers.” Trends in Food Science & Technology 30(1):27–37. Retrieved July 31, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0924224412002592).
Klewicki, R. 2007. “The Stability of Gal-Polyols and Oligosaccharides during
Pasteurization at a Low pH.” LWT - Food Science and Technology 40(7):1259–65. Retrieved December 11, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0023643806002283).
Lamsal, B. P. 2012. “Production, Health Aspects and Potential Food Uses of Dairy Prebiotic Galactooligosaccharides.” Journal of the science of food and agriculture 92(10):2020–28. Retrieved December 15, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/22538800).
Lee, Y. K. and Mazmanian, S.K. 2010. “Has the Microbiota Played a Critical Role in the Evolution of the Adaptive Immune System?” Science (New York, N.Y.)
330(6012):1768–73. Retrieved July 10, 2014
(http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=3159383&tool=pmcentre z&rendertype=abstract).
Liu, Z. et al. 2014. “Prebiotic Effects of Almonds and Almond Skins on Intestinal
Microbiota in Healthy Adult Humans.” Anaerobe 26:1–6. Retrieved August 26, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/24315808).
Luckow, T. and Delahunty, C. 2004. “Consumer Acceptance of Orange Juice Containing
Functional Ingredients.” Food Research International 37(8):805–14. Retrieved
December 15, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0963996904000924). Manderson, K. et al. 2005. “In Vitro Determination of Prebiotic Properties of
Oligosaccharides Derived from an Orange Juice Manufacturing By-Product Stream In Vitro Determination of Prebiotic Properties of Oligosaccharides Derived from an Orange Juice Manufacturing By-Product Stream.”
Matusek, A., Merész, P., Le, T. K. D. and Örsi, F. 2009. “Effect of Temperature and pH on the Degradation of Fructo-Oligosaccharides.” European Food Research and
Technology 228(3):355–65. Retrieved August 26, 2014
Misra, N. N. et al. 2014a. “In-Package Atmospheric Pressure Cold Plasma Treatment of
Strawberries.” Journal of Food Engineering 125:131–38. Retrieved December 15,
2014 (http://linkinghub.elsevier.com/retrieve/pii/S0260877413005384).
Misra, N., Keener, K.M., Bourke, P., Mosnier, J.P. and Cullen, P.J. 2014b. “In-Package Atmospheric Pressure Cold Plasma Treatment of Cherry Tomatoes.” Journal of
bioscience and bioengineering 118(2):177–82. Retrieved December 11, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/24650730).
Misra, N. N. et al. 2015. “Atmospheric Pressure Cold Plasma (ACP) Treatment of Wheat
Flour.” Food Hydrocolloids 44:115–21. Retrieved December 11, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0268005X14002951).
Mussatto, S. I. and Mancilha, I.M. 2007. “Non-Digestible Oligosaccharides: A Review.”
Carbohydrate Polymers 68(3):587–97. Retrieved December 11, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0144861706006151).
Nagpal, R., Kumar, A. and Kumar, M. 2012. “Fortification and Fermentation of Fruit
Juices with Probiotic Lactobacilli.” Annals of Microbiology 62(4):1573–78. Retrieved
December 15, 2014 (http://link.springer.com/10.1007/s13213-011-0412-5). Nobre, C., Suvarov, P. and Weireld, G. 2014. “Evaluation of Commercial Resins for
Fructo-Oligosaccharide Separation.” New Biotechnology 31(1):55–63. Retrieved August 26, 2014 (http://www.ncbi.nlm.nih.gov/pubmed/23806732).
Okino-Delgado, C. H. and Fleuri, L. F. 2014. “Obtaining Lipases from Byproducts of
Orange Juice Processing.” Food Chemistry 163:103–7. Retrieved July 28, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/24912703).
Pankaj, S. K., Bueno-Ferrer, C., Misra, N. N., Milosavljević, V. et al. 2014a. “Applications
of Cold Plasma Technology in Food Packaging.” Trends in Food Science &
Technology 35(1):5–17. Retrieved December 15, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S092422441300229X).
Pankaj, S. K., Bueno-Ferrer, C., Misra, N. N., O’Neill, L. et al. 2014b. “Characterization of Polylactic Acid Films for Food Packaging as Affected by Dielectric Barrier
Discharge Atmospheric Plasma.” Innovative Food Science & Emerging
Technologies 21:107–13. Retrieved July 21, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S1466856413001604).
Pankaj, S. K., Misra, N. N. and Cullen, P. J. 2013. “Kinetics of Tomato Peroxidase Inactivation by Atmospheric Pressure Cold Plasma Based on Dielectric Barrier
Discharge.” Innovative Food Science & Emerging Technologies 19:153–57.
Retrieved August 27, 2014
Patel, S. and Goyal, A. 2010. “Functional Oligosaccharides: Production, Properties and
Applications.” World Journal of Microbiology and Biotechnology 27(5):1119–28.
Retrieved December 15, 2014 (http://link.springer.com/10.1007/s11274-010-0558-5).
Patil, S., Torres, B. et al. 2010a. “Safety and Quality Assessment during the Ozonation
of Cloudy Apple Juice.” Journal of food science 75(7):M437–43. Retrieved August
27, 2014 (http://www.ncbi.nlm.nih.gov/pubmed/21535553).
Patil, S. et al. 2014. “Influence of High Voltage Atmospheric Cold Plasma Process Parameters and Role of Relative Humidity on Inactivation of Bacillus Atrophaeus
Spores inside a Sealed Package.” The Journal of hospital infection 88(3):162–69.
Retrieved December 11, 2014 (http://www.ncbi.nlm.nih.gov/pubmed/25308932). Patil, S., Bourke, P., Frias, J. M., Tiwari, B. K. and Cullen, P. J. 2009a. “Inactivation of
Escherichia Coli in Orange Juice Using Ozone.” Innovative Food Science &
Emerging Technologies 10(4):551–57. Retrieved August 27, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S1466856409000629).
Patil, S., Cullen, P. J., Bridget K., Frias, J. M. and Bourke, P. 2009b. “Extrinsic Control Parameters for Ozone Inactivation of Escherichia Coli Using a Bubble Column.” 107(2007):830–37.
Patil, S., Valdramidis, V. P., Cullen, P. J., Frias, J.M., and Bourke, P. 2010b.
“Inactivation of Escherichia Coli by Ozone Treatment of Apple Juice at Different pH
Levels.” Food microbiology 27(6):835–40. Retrieved August 27, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/20630327).
Patil, S., Valdramidis, V. P., Cullen, P. J., Frias, J. M. and Bourke, P. 2010c. “Ozone Inactivation of Acid Stressed Listeria Monocytogenes and Listeria Innocua in
Orange Juice Using a Bubble Column.” Food Control 21(12):1723–30. Retrieved
August 27, 2014 (http://linkinghub.elsevier.com/retrieve/pii/S0956713510002185). Patras, A., Brunton, N., Pieve da S., Butler, S., and Downey, G. 2009. “Effect of Thermal
and high pressure processing on antioxidant activity and instrumental colour of tomato and carrot purées.” 10:16–22.
Pereira, A. L. F. 2013. “Elaboração E Secagem Em Spray Dryer de Bebida Probiótica Formulada a Partir Da Fermentação Do Suco de Caju.” Tese. Universidade Federal do Ceará. Programa de Pós-Graduação em Ciência e Tecnologia de Alimentos. 115p.
Acceptability.” LWT - Food Science and Technology 1–9. Retrieved December 15, 2014 (http://linkinghub.elsevier.com/retrieve/pii/S0023643814004897).
Praznik, W., Löppert, R., Rubio, J. M., Zangger, K., and Huber, A. 2013. “Structure of Fructo-Oligosaccharides from Leaves and Stem of Agave Tequilana Weber, Var.
Azul.” Carbohydrate Research 381:64–73. Retrieved August 07, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/24071527).
Rabelo, M. C., Fontes, C. P. M. L. and Rodrigues, S. 2009a. “Enzyme Synthesis of
Oligosaccharides Using Cashew Apple Juice as Substrate.” Bioresource
Technology 100(23):5574–80. Retrieved August 26, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/19608414).
Rabelo, M. C., Honorato, T. L., and Rodrigues, S. 2009b. “Optimization of Enzymatic Synthesis of Isomalto-Oligosaccharides Production.” 33(2009):342–54.
Rabelo, M. C., Honorato, T. L., Gonçalves, L.R.B, Pinto, G.A.S., and Rodrigues, S. 2006. “Enzymatic Synthesis of Prebiotic Oligosaccharides.” 133:31–40.
Roberfroid, M., et al. 2010. “British Journal of Nutrition.” (November).
Rød, S. K., Hansen, F., Leipold, F., and Knøchel, S. 2012. “Cold Atmospheric Pressure Plasma Treatment of Ready-to-Eat Meat: Inactivation of Listeria Innocua and
Changes in Product Quality.” Food microbiology 30(1):233–38. Retrieved August
27, 2014 (http://www.ncbi.nlm.nih.gov/pubmed/22265306).
Rodrigues, S., Lona, L. M. F., and Franco, T. T. 2003. “Effect of Phosphate
Concentration on the Production of Dextransucrase by Leuconostoc Mesenteroides
NRRL B512F.” Bioprocess and Biosystems Engineering 26(1):57–62. Retrieved
August 26, 2014 (http://www.ncbi.nlm.nih.gov/pubmed/14505164).
Rodrigues, S., Lona, L. M. F., and Franco, T.T. 2005. “The Effect of Maltose on Dextran
Yield and Molecular Weight Distribution.” Bioprocess and Biosystems Engineering
28(1):9–14. Retrieved August 26, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/16163491).
Rodrigues, S., Lona, L. M. F., and Franco, T.T. 2006. “Optimizing Panose Production by Modeling and Simulation Using Factorial Design and Surface Response Analysis.”
Journal of Food Engineering 75(3):433–40. Retrieved August 26, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0260877405002852).
Saad, N., Delattre, C., Urdaci, M., Schmitter, J. M. and Bressollier, P.. 2013. “An
Overview of the Last Advances in Probiotic and Prebiotic Field.” LWT - Food
Science and Technology 50(1):1–16. Retrieved July 15, 2014
Sangwan, V., Tomar, S.K., Ali, B., Singh, R.R. B., and Singh, A.K. 2014. “Production of Β-Galactosidase from Streptococcus Thermophilus for Galactooligosaccharides
Synthesis.” Journal of Food Science and Technology. Retrieved August 26, 2014
(http://link.springer.com/10.1007/s13197-014-1486-4).
Silk, D. B. A., Davis, A., Vulevic, J., Tzortzis, G., and Gibson, G. R. 2009. “Clinical Trial: The Effects of a Trans-Galactooligosaccharide Prebiotic on Faecal Microbiota and
Symptoms in Irritable Bowel Syndrome.” Alimentary pharmacology & therapeutics
29(5):508–18. Retrieved January 12, 2015
(http://www.scopus.com/inward/record.url?eid=2-s2.0-59149093199&partnerID=tZOtx3y1).
Silva, I. M., Rabelo, M.C., and Rodrigues, S. 2012. “Cashew Juice Containing Prebiotic
Oligosaccharides.” Journal of Food Science and Technology. Retrieved August 26,
2014 (http://link.springer.com/10.1007/s13197-012-0689-9).
Silva, J. L. A. da. 2013a. “Síntese e Secagem de Sucos de Frutas Tropicais e Exóticas contendo Oligossacarídeos: estudo do cajá, siriguela e jambo.”
Silva, M.F. et al. 2013b. “Fructooligosacharides Production in Aqueous Medium with Inulinase from Aspergillus Niger and Kluyveromyces Marxianus NRRL Y-7571
Immobilized and Treated in Pressurized CO2.” Food and Bioproducts Processing
91(4):647–55. Retrieved August 26, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0960308513000424).
Srinivasjois, R., Rao, S., and Patole, S. 2013. “Prebiotic Supplementation in Preterm Neonates: Updated Systematic Review and Meta-Analysis of Randomised
Controlled Trials.” Clinical nutrition (Edinburgh, Scotland) 32(6):958–65. Retrieved August 27, 2014 (http://www.ncbi.nlm.nih.gov/pubmed/23786897).
Tako, E., Glahn, R., Knez, M., and Stangoulis, J. 2014. “The Effect of Wheat Prebiotics on the Gut Bacterial Population and Iron Status of Iron Deficient Broiler Chickens.” Nutrition Journal 13(1):58. Retrieved August 20, 2014
(http://www.nutritionj.com/content/13/1/58).
Tarazona-Díaz, M. P. and Aguayo, E. 2013. “Influence of Acidification, Pasteurization, Centrifugation and Storage Time and Temperature on Watermelon Juice Quality.”
Journal of the science of food and agriculture 93(15):3863–69. Retrieved December
15, 2014 (http://www.ncbi.nlm.nih.gov/pubmed/23907928).
Tiwari, B. K., Muthukumarappan, K., O’ Donnell, C. P., and Cullen, P. J. 2008a. “Modelling Colour Degradation of Orange Juice by Ozone Treatment Using
Response Surface Methodology.” Journal of Food Engineering 88(4):553–60.
Retrieved August 27, 2014
Tiwari, B. K., O’Donnell, C. P., Patras, A., Brunton, N., and Cullen, P. J. 2009. “Effect of Ozone Processing on Anthocyanins and Ascorbic Acid Degradation of Strawberry
Juice.” Food Chemistry 113(4):1119–26. Retrieved August 27, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0308814608010637).
Tiwari, B. K., Muthukumarappan, K., O’Donnell, C. P., and Cullen, P. J. 2008b. “Kinetics of Freshly Squeezed Orange Juice Quality Changes during Ozone Processing.” 6416–22.
Torres, B. et al. 2011. “Effect of Ozone Processing on the Colour, Rheological
Properties and Phenolic Content of Apple Juice.” Food Chemistry 124(3):721–26.
Retrieved August 27, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0308814610007600).
Vervoort, L. et al. 2011. “Comparing Equivalent Thermal, High Pressure and Pulsed
Electric Field Processes for Mild Pasteurization of Orange Juice.” Innovative Food
Science & Emerging Technologies 12(4):466–77. Retrieved November 28, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S1466856411000762).
Yang, B., Prasad, K.N., Xie, H., Lin, S., and Jiang, Y. 2011. “Structural Characteristics of Oligosaccharides from Soy Sauce Lees and Their Potential Prebiotic Effect on
Lactic Acid Bacteria.” Food Chemistry 126(2):590–94. Retrieved August 27, 2014
(http://linkinghub.elsevier.com/retrieve/pii/S0308814610014664).
Ziuzina, D., Patil, S., Cullen, P. J., Keener, K. M., and Bourke, P. 2013. “Atmospheric Cold Plasma Inactivation of Escherichia Coli in Liquid Media inside a Sealed
Package.” Journal of applied microbiology 114(3):778–87. Retrieved November 18,
2014 (http://www.ncbi.nlm.nih.gov/pubmed/23190122).
Ziuzina, D., Patil, S., Cullen, P. J., Keener, K. M., and Bourke, P. 2014. “Atmospheric Cold Plasma Inactivation of Escherichia Coli, Salmonella Enterica Serovar
Typhimurium and Listeria Monocytogenes Inoculated on Fresh Produce.” Food
microbiology 42:109–16. Retrieved November 27, 2014
(http://www.ncbi.nlm.nih.gov/pubmed/24929725).
Zulueta, A., Barba, F.J., Esteve, M.J., and Frígola, A. 2013. “Changes in Quality and Nutritional Parameters During Refrigerated Storage of an Orange Juice–Milk Beverage Treated by Equivalent Thermal and Non-Thermal Processes for Mild
Pasteurization.” Food and Bioprocess Technology 6(8):2018–30. Retrieved
CHAPTER 2 - EFFECT OF ATMOSPHERIC COLD PLASMA AND HIGH PRESSURE PROCESSING ON FRUCTO-OLIGOSACCHARIDES, ORGANIC ACIDS AND
ORANGE JUICE COLOR
Abstract
In this study, the effect of atmospheric pressure cold plasma (ACP) and high pressure processing on the prebiotic orange juice processing were evaluated. Orange juice containing 7% (w/v) of commercial fructo-oligosaccharides (FOS) was directly and indirectly exposed to plasma discharge at 70 kV for 15, 30, 45 and 60 seconds.For high pressure processing, the juice containing the same concentration of FOS was treatedat 450 bars for 5 minutes. After the treatments, the fructo-oligosaccharides were qualified and quantified by Thin Layer Chromatography (TLC). The organic acids, color and pH values were also evaluated. Both processes did not degrade the FOS, making them suitable for the processing of functional foods containing FOS. The organic acids and the color of the treated samples were also well preserved. Therefore, ACP and high pressure processing can be used as non-thermal alternatives for the production of prebiotic orange juice.
2.1 Introduction
A growing number of consumers are aware of the importance of functional foods due to their health benefits. Prebiotic oligosaccharides are among the functional compounds that added to foods grant to them the desired functionality. Prebiotics are
defined as “non-digestible food ingredients that beneficially affects host by selectively
stimulating the growth and the activity of one or a limited number of bacteria in the
colon” (Hernandez-Hernandez et al. 2012). The beneficial health effects attributed to the
intake of prebiotic have been previously reported as well (Hess et al. 2011; Wichienchot et al. 2010; Vergara et al. 2010).
Prebiotic compounds have been used in several food products. Fruits and fruit juices can be used as vehicles for these compounds. Renuka et al. (2009) studied the fortification of selected fruit juice beverages with fructo-oligosaccharides (FOS), a low caloric prebiotic.
According to ANVISA (National Health Surveillance Agency, Brazil), the recommended daily intake (RDI) for foods containing prebiotic compounds should provide at least 3 g of FOS in solid foods or 1.5 g in liquid foods. Besides, the FOS consumption should not exceed 30 g per day in products ready for consumption. The consumption of 200 mL of the prebiotic orange juice corresponds to the intake of 14 g of FOS.
juice can cause off-flavors and the degradation of the product's quality due to non-enzymatic browning (Patil et al. 2009).
Nowadays, the consumers are looking for safe food products with high quality retention. The preservation of the nutraceutical properties of functional foods, of non-thermal innovative technologies to produce foods with a minimum of nutritional, physicochemical, and organoleptic changes and without degradation of the prebiotic compounds (Esteve and Frígola 2007).
Among these technologies, atmospheric cold plasma (ACP) and high pressure technologies have been reported as a good non-thermal food processing that guarantees food preservation at safe standards maintaining, as much as possible, the fresh-like characteristics of foods (Ramos et al. 2013). Studies involving the application of atmospheric cold plasma and high pressure on fruits and vegetables reported a positive effect on pathogens and enzyme inactivation (Misra et al. 2014; Ziuzina et al. 2013; Patterson et al. 2005).
However, there is no published data showing the advantages and limitations of these technologies, when applied to fructo-oligosaccharides (FOS), the most studied and used functional carbohydrate in food industry. The evaluation of a non-thermal treatment for fruit juice processing containing FOS is important because a previous study showed thermal degradation of FOS due to thermal treatment (Matusek et al. 2009; Klewicki 2007). Orange juice is largely consumed due to its vitamin C content.
orange juice. The influence of ACP and HPP processing on the organic acid profile and on the juice color was also evaluated.
2.2 Materials and Methods
2.2.1 Prebiotic orange juice preparation
Orange juice (Squeez©, Fruit Juices Ltd, Ireland) was purchased from a local supermarket (Dunnes, Dublin - Ireland). Orange juice containing prebiotic ingredients was prepared by adding of 7% (w/v) of commercial fructo-oligosaccharide (ORAFTI© P95, Beneo GmbH, Mann, Germany) in a liter of the juice. The pH of the juice was determined by direct measurement in a 420A pHmeter, (Orion research Inc, Beverly, MA. US). The pHmeter was calibrated before use with buffer solutions of pH 4.0, 7.0 and 10.0.
2.2.2 Plasma Treatment
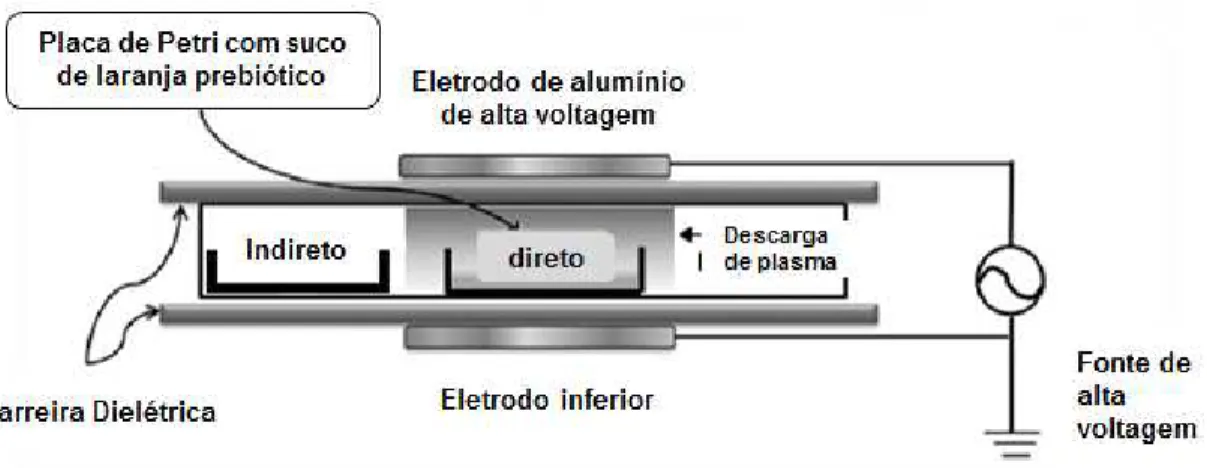
was 22 mm and equal to the height of the container. Voltage was monitored using an InfiniVision 2000 X-Series Oscilloscope (Agilent Technologies Inc., Santa Clara, CA, USA). All experiments were performed at 70 kV peak to peak at ambient air and atmospheric pressure conditions.
A volume of 20 mL of orange juice samples containing 7% (w/v) of fructo-oligosaccharide was transferred to an open Petri dish, which was placed in a polypropylene box, sealed with a polymeric film of 50 µm thickness (Cryovac BB3050). This film served as an additional layer of dielectric barrier (Pankaj et al. 2014). Then, samples were treated with atmospheric cold plasma (ACP) with processing times of 15, 30, 45 and 60 seconds and different exposure kinds: direct plasma field (in) and indirect plasma field (out). These treatment times were selected based on a previous study carried for pathogens inactivation in orange juice (Ziuzina et al. 2013). These authors achieved a complete bacterial inactivation after 20 s of direct and 45 s of indirect plasma treatment. Treated samples of prebiotic orange juice were stored at room temperature (25 ºC) for 24 h before opening the container. A control sample, containing the same concentration of FOS dissolved in water was prepared and packed and treated in the same way that the prebiotic orange juice
2.2.3 High pressure processing
pressure processing. A control sample, containing the same concentration of FOS dissolved in water was prepared and packed and treated in the same way that the prebiotic orange juice. The processing was done at the industrial conditions: 5 minutes at 450 bars as recommended by HPP Toolings Business (Dublin, Ireland) for fruit juices. The juice processing in industrial equipment is a differential of this study because almost all published studies on fruit juice processing by HPP are done in small equipment with small volumes. After the treatment, quality analyses were carried out on the final product.
2.2.4 Carbohydrate analysis
2.2.4.1 Fructo-oligosaccharides degree of polymerization characterization
composed of n-butanol/2-propanol/H2O (10:5:4 [vol/vol/vol]) mixture (Shiomi, Onodera and Sakai 1997). The TLC plate was irrigated by the solvent systems three times. To visualize the separated carbohydrates in the plates, a fine spray containing 1-butanol/water (80% w/w) as solvent, phosphoric acid (6.78 mL), urea (3 g) and ethanol (8 mL) in 100 mL was used. The plates were oven heated at 120 °C for 10 min. For the quantification of the oligosaccharides, a TLC scanner CAMAG 4 20x20 cm densitometer was used, using the Planar winCATS Chromatografy Manager software. The wavelength used was 450 nm. The analyses were performed in triplicate.
2.2.5 Color measurement
The color of the samples was measured using a colorimeter (Color Quest XE Hunter Lab, Northants, UK). The instrument operates on CIELAB (L*, a* and b*) and it was calibrated using white (L*= 93.97, a*= 0.88 and b*= 1.21) standard. The L, a, b parameters were used to calculate the chromaticity, the hue angle and the ∆E according to equations 1, 2 and 3, respectively:
Chroma = (1)
Hue = tan-1 (2)
∆E= {(∆L2) + (∆a2) + (∆b2
)}1/2 (3)