'(3$57$0(172'(48Ë0,&$25*Æ1,&$(,125*Æ1,&$ &8562'(3Ï6*5$'8$d2(048Ë0,&$25*Æ1,&$
&2175,%8,d2$2(678'2),7248Ë0,&2'2
*Ç1(52&52721
&UKDPQLIROLXV
(XSKRUELDFHDH
7HVHGH'RXWRUDGR
)UDQFLVFD.DUHQ6RX]DGD6LOYD
)RUWDOH]D&(
&2175,%8,d2$2(678'2),7248Ë0,&2'2
*Ç1(52&52721
&UKDPQLIROLXV
(XSKRUELDFHDH
7HVH GH 'RXWRUDGR VXEPHWLGD j FRRUGHQDomR GD 3yV*UDGXDomR HP 4XtPLFD 2UJkQLFD FRPR UHTXLVLWR SDUD D REWHQomR GR 7tWXORGH'RXWRUDGR
25,(17$'253URI(GLOEHUWR5RFKD6LOYHLUD
)RUWDOH]D±&(
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências e Tecnologia
S58c Silva, Francisca Karen Souza da
Contribuição ao estudo fitoquímico do gênero croton : C. rhamnifolius (Euphorbiaceae) / Francisca Karen Souza da Silva. – 2012.
198f. : il. color., enc. ; 30 cm.
Tese (doutorado) – Universidade Federal do Ceará, Centro de Ciências, Departamento de Química Analítica e Fisico-química, Programa de Pós-Graduação em Química, Fortaleza, 2012.
Área de Concentração: Química Orgânica Orientação: Prof. Dr. Edilberto Rocha Silveira
1. Diterpenos. 2. Flavonoides. 3. Alcaloides. 4. Cumarinas. I. Título.
(VWHWUDEDOKRIRLUHDOL]DGRVREDRULHQWDomRGR3URI(GLOEHUWR5RFKD6LOYHLUDGR 'HSDUWDPHQWRGH4XtPLFD2UJkQLFDH,QRUJkQLFDGD8QLYHUVLGDGH)HGHUDOGR&HDUi
$*5$'(&,0(1726
$'HXVSHODYLGDHRSRUWXQLGDGHGHFRQFOXLUPDLVXPDHWDSD
$RVPHXV3DLV)iWLPDH6LOYDFRPDFHUWH]DGHGHYHUFXPSULGRSHODGHGLFDomRSHORDSRLR
SHOD DWHQomR FDULQKR H SULQFLSDOPHQWH SRU WRGRV HQVLQDPHQWRV VHPSUH FRHUHQWHV H LQGLVSHQViYHLV
IRUQHFLGRVGXUDQWHWRGDDPLQKDYLGD
$R PHX PDULGR(GVRQ0HVTXLWDSHORVHXFDULQKRFRPSDQKHLULVPRHDWHQomR3HODUHYLVmR
ILQDOGRVWH[WRVHSRUVHXDX[tOLRLQFRQGLFLRQDOGXUDQWHWRGRRSHUtRGRGHHODERUDomRGHVWDWHVH
$PHXLUPmR:HQGOH\SHODPRWLYDomRHDSRLR
$RPHXRULHQWDGRU3URI(GLOEHUWR5RFKD6LOYHLUDSRUWRGDDWHQomRGLVSHQVDGDSHODDPL]DGH
GHGLFDomRHSRUWRGDVDVFUtWLFDVHVXJHVW}HVTXHFRQWULEXtUDPSDUDRDSULPRUDPHQWRGHVWDWHVH
$ 3URID 0DU\ $QQH 6RX]D /LPD SHOR JUDQGH LQFHQWLYR FRODERUDomR H RULHQWDomR SHODV FUtWLFDVHVXJHVW}HVSHODGHGLFDomRHDPL]DGHHSRUWRGRVRVFRQKHFLPHQWRVYDOLRVRVTXHWUDQVPLWLXH
TXHPHDMXGDUDPDFRQWLQXDUFUHVFHQGR
$WRGRVRVSURIHVVRUHVGRFXUVRGH3yV*UDGXDomRHP4XtPLFD2UJkQLFD
$RV PHXV FROHJDV GH EDQFDGD /$),3/$0 , $UWXU =HOLQD 3DWUtFLD 3DXOD 'DQLHOH
$QW{QLD .DUtVLD 9DQHVVD 5HJLYDOGR +RQyULR 3pUVLR 0DULDQR -RmR 9LWR 1D\DUD H 0LOWRQ SHOR
DSRLRFRQVWDQWHHFRQYLYrQFLDVHPSUHDOHJUHHGLYHUWLGD
$RVRSHUDGRUHVGRVDSDUHOKRVGH5HVVRQkQFLD0DJQpWLFD1XFOHDU(VSHFWURPHWULDGHPDVVDH
,QIUDYHUPHOKR
$RVIXQFLRQiULRVGRGHSDUWDPHQWRSULQFLSDOPHQWHD0XQGLQKD/DQD6U3DXORH&pOLD
$R&13T&$3(6)81&$3),1(3H3521(;SHORDSRLRILQDQFHLUR
$WRGRVTXHGLUHWDRXLQGLUHWDPHQWHDX[LOLDUDPQDFRQFOXVmRGHVWHWUDEDOKR
>/^dZs/dhZ^͕^1DK>K^^/'>^͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϵ >/^d&/'hZ^͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϬ >/^dd>^͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϰ >/^d&>hyK'ZD^͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϳ >/^dYhZK͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϴ Z^hDK͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϵ ^dZd͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϮϬ ϭ/EdZKhK͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϮϮ ϮKE^/ZO^KdE/^͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘Ϯϲ
2.1 Considerações botânicas sobre a família Euphorbiaceae͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘Ϯϲ
2.2 Algumas considerações botânicas sobre o gênero Croton͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘Ϯϳ
2.3 Algumas considerações botânicas sobre Croton rhamnifolius͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘Ϯϳ ϯ>sEdDEdK/>/K'Z&/K^KZ>>K/^Kd/K^WZd/Z
^W/^ƌŽƚŽŶ͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϯϬ
3.1 Alcaloides͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϯϬ
3.2 Os alcaloides como produtos do metabolismo secundário͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϯϭ
3.3 Biossíntese͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϯϮ 3.3.1 Alcaloides derivados de triptofano͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϯϮ 3.3.2 Alcaloides derivados de ácido antranílico͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϯϯ
ϰd/s/&ZDK>M'/͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϰϭ
4.1 Farmacologias avaliadas͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϰϭ 4.1.1 Tripanocida͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϰϭ 4.1.2 Leishmanicida͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϰϮ 4.1.3 Citotoxicidade͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϰϯ
4.2 Ensaios farmacológicos aplicados em rhamnifolina͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϰϯ 4.2.1 Metodologia para análise da atividade tripanocida͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϰϯ 4.2.2 Metodologia para análise da atividade contra Leishmania amazonensis͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϰϯ 4.2.3 Metodologia para análise da atividade citotóxica͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϰϰ
ϱdZD/EK^dZhdhZ>K^KE^d/dh/Ed^Yh1D/K^EKͲsK>d/^K ydZdK,yE/K;Z,ͿdEM>/KKh>;ZͿydZdKdEM>/K Z/;ZZͿ͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϰϳ
5.1 Determinação estrutural de CRD-1͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϰϳ
5.3 Determinação estrutural de CRD-3͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϲϯ
5.4 Determinação estrutural de CRD-4͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϳϬ
5.5 Determinação estrutural de CRD-5͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϳϲ
5.6 Determinação estrutural de CRD-6͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϴϰ
5.7 Determinação estrutural de CRD-7͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϴϵ
5.8 Determinação estrutural de CRD-8͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϵϲ
5.9 Determinação estrutural de CRD-9͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϬϱ
5.10 Determinação estrutural de CRD-10͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϭϰ
5.11 Determinação estrutural de CRD-11͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϮϰ
5.12 Determinação estrutural de CRD-12͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϮϵ
5.13 Determinação estrutural de CRD-13͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϯϵ ϲWZdyWZ/DEd>͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϮ
6.1 Métodos Cromatográficos͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϮ 6.1.1 Cromatografia líquida em coluna aberta (CC)͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϮ 6.1.2 Cromatografia em camada delgada (CCD)͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϮ 6.1.3 Cromatografia líquida em Coluna sob Pressão (“Flash”)͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϮ 6.1.4 Cromatografia de exclusão͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϯ 6.1.5 Cromatografia líquida de alta eficiência (CLAE)͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϯ
6.2 Métodos Espectroscópicos͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϰ 6.2.1 Espectroscopia de Ressonância Magnética Nuclear de prótio (RMN 1H) e de Carbono-13 (RMN 13C)͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϰ 6.2.2 Cromatografia Gasosa acoplada a Espectrometria de Massa (CG/EM)͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϰ 6.2.3 Cromatografia Gasosa de alta resolução (CG/AR)͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϱ 6.2.4 Espectroscopia na região do Infravermelho (IV)͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϱ
6.3. Métodos Físicos͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϱ 6.3.1 Ponto de fusão (p.f.)͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϱ 6.3.2 Rotação óptica (Į)͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϲ
6.4 Isolamento dos metabólitos secundários não-voláteis de C. rhamnifolius͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϲ 6.4.1 Material vegetal͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϲ 6.4.2 Obtenção do extrato etanólico da raiz de C. rhamnifolius (CRRE)͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϲ 6.4.3 Obtenção do extrato hexânico e etanólico do caule de C. rhamnifolius (CRCH e CRCE)͘͘͘͘ϭϱϲ 6.4.4 Isolamento de CRD-1͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϱϵ 6.4.5 Isolamento de CRD-2͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϲϮ 6.4.6 Isolamento de CRD-3͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϲϲ
6.4.10 Isolamento de CRD-7͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϳϳ 6.4.11 Isolamento de CRD-8͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϳϴ 6.4.12 Isolamento de CRD-9͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϴϬ 6.4.13 Isolamento de CRD-10͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϴϮ 6.4.14 Isolamento de CRD-11͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϴϰ 6.4.15 Isolamento de CRD-12͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϴϰ 6.4.16 Isolamento de CRD-13͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘͘ϭϴϲ
LISTA DE ABREVIATURAS, SÍMBOLOS E SIGLAS
CRRE Extrato etanólico da raiz de Croton rhamnifolius
CC Cromatografia em coluna
CCD Cromatografia em camada delgada
CCDP Cromatografia em camada delgada preparativa
CPD Composite Pulse Decoupling
CGL/EM Cromatografia gás-líquido acoplada a espectrometria de massa
COSY Correlated spectroscopy
DEPT Distortionless enhancement by polarizatior transfer
EM Espectrometria de massa
HMBC Heteronuclear multiple bond correlation
HSQC Heteronuclear single-quantum coherence
IC50 Concentração que causa 50% de inibição da reação enzimática
IE Impacto eletrônico
IV Infravermelho
J Constante de acoplamento
m/z Razão massa/carga
p.f. Ponto de fusão
RMN 13C Ressonância magnética nuclear de carbono-13
LISTA DE FIGURAS
Figura 1. Metabólitos secundários isolados do extrato hexânico do caule de C.
rhamnifolius (FILGUEIRAS, 1994) ... 23
Figura 2. Metabólitos secundários isolados do extrato etanólico das raízes de C. rhamnifolius (SILVA, 2008) ... 24
Figura 3. Representação de (a) folha peninérvea e (b) inflorescências cimosas e (c) racemosas... 26
Figura 4. Fotografia de um espécime de Croton rhamnifolius, com detalhes para as folhas, flores e frutos. (Fotos: Prof. Edilberto R. Silveira) ... 28
Figura 5. Representaçãoestrutural dos principais esqueletos de alcaloides encontrados em plantas. ... 31
Figura 6. Aminoácidos precursores de alcaloides ... 32
Figura 7. Resumo da biossíntese de alcaloides harmina, ajmalicina, ácido lisérgico a partir do triptofano ... 33
Figura 8. Resumo da biossíntese de alcaloides derivados do ácido antranílico ... 34
Figura 9. Constituintes químicos ativos ... 41
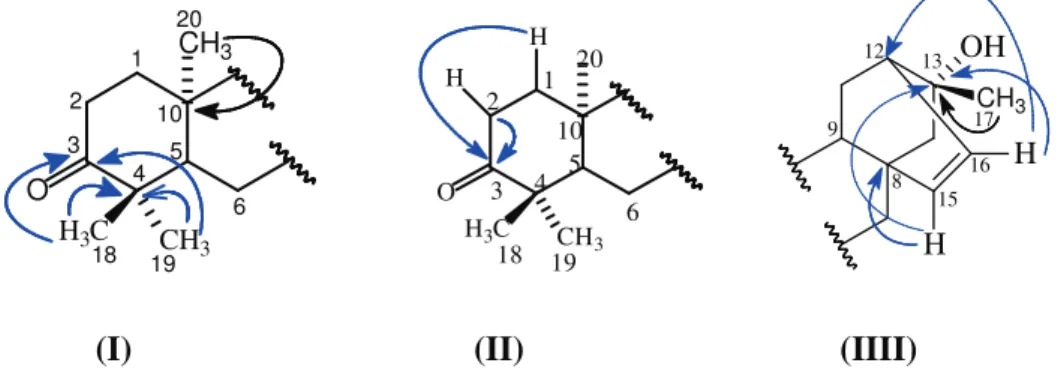
Figura 10. Estruturas I, II e III de CRD-1, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 49
Figura 11. Estereoquímica do composto senecrassidiol e senecrassidiol ȕ-glicosilado obtidos por Bohlmann e Xiang, respectivamente. ... 50
Figura 12. Estrutura química de CRD-1: senecrassidiol ... 51
Figura 13. Espectro de RMN 1H (500 MHz, CH3OD) de CRD-1 ... 51
Figura 14. Espectro de RMN 13C – CPD (125 MHz, CH3OD) de CRD-1 ... 52
Figura 15. Espectro de RMN 13C-DEPT 135º (125 MHz, CH3OD) de CRD-1 ... 53
Figura 16. Espectro de RMN bidimensional de 1H ,13C – HSQC (500 x 125 MHz, CH3OD) de CRD-1 ... 53
Figura 17. Espectro de RMN bidimensional de 1H,13C – HMBC (500 x 125 MHz, CH3OD) de CRD-1 ... 54
Figura 18. Espectro de Infravermelho de CRD-1 (Pastilha de KBr) ... 54
Figura 19. Espectro de massa (IE, 70 eV) de CRD-1 ... 55
Figura 20. Estrutura básica de um diterpeno do tipo atiseno. ... 57
Figura 21. Substruturas I, II e III de CRD-2, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 58
Figura 22. Estrutura química de CRD-2: 13Į-hidroxi-atisen-3-ona... 58
Figura 23. Espectro de RMN 1H (500 MHz, CH3OD) de CRD-2 ... 60
Figura 24. Espectro de RMN 13C – CPD (125 MHz, CH3OD) de CRD-2 ... 60
Figura 25. Espectro de RMN 13C-DEPT 135º (125 MHz, CH3OD) de CRD-2 ... 61
Figura 26. Espectro de RMN bidimensional de 1H, 13C – HSQC (500 x 125 MHz, CH3OD) de CRD-2 ... 61
Figura 27. Espectro de RMN bidimensional de 1H, 13C – HMBC (500 x 125 MHz, CH3OD) de CRD-2 ... 62
Figura 28. Espectro de massa (IE, 70 eV) de CRD-2 ... 62
Figura 29. Estrutura básica do diterpeno de esqueleto caureno ... 64
Figura 30. Estrutura de CRD-3, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 65
Figura 31. Estrutura química de CRD-3: caur-16-eno ... 65
Figura 32. Espectro de RMN 1H (500 MHz, CDCl3) de CRD-3 ... 67
Figura 33. Espectro de RMN 13C – CPD (125 MHz, CDCl3) de CRD-3 ... 67
Figura 35. Espectro de RMN bidimensional de 1H,13C – HSQC (500 x 125 MHz,
CDCl3) de CRD-3 ... 68
Figura 36. Espectro de RMN bidimensional de 1H,13C – HMBC (500 x 125 MHz, CDCl3) de CRD-3 ... 69
Figura 37. Espectro de massa (IE, 70 eV) de CRD-3 ... 69
Figura 38. Estrutura química de CRD-4: lupenona ... 71
Figura 39. Espectro de RMN 1H (500 MHz, CDCl3) de CRD-4 ... 73
Figura 40. Espectro de RMN 13C – CPD (125 MHz, CDCl3) de CRD-4 ... 73
Figura 41. Espectro de RMN 13C-DEPT 135º (125 MHz, CDCl3) de CRD-4 ... 74
Figura 42. Espectro de massa (IE, 70 eV) de CRD-4 ... 74
Figura 43. Espectro de Infravermelho de CRD-4 (Pastilha de KBr) ... 75
Figura 44. Estrutura básica do diterpeno de esqueleto clerodânico ... 77
Figura 45. Sub-estruturas I, II e III de CRD-5, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 78
Figura 46. Estrutura química de CRD-5: ácido hardwickiico ... 79
Figura 47. Espectro de RMN 1H (500 MHz, CDCl3) de CRD-5 ... 80
Figura 48. Espectro de RMN 13C – CPD (125 MHz, CDCl3) de CRD-5 ... 80
Figura 49. Espectro de RMN 13C-DEPT 135º (125 MHz, CDCl3) de CRD-5 ... 81
Figura 50. Espectro de RMN bidimensional de 1H 13C – HSQC (500 x 125 MHz, CDCl3) de CRD-5 ... 81
Figura 51. Espectro de RMN bidimensional de 1H 13C – HMBC (500 x 125 MHz, CDCl3) de CRD-5 ... 82
Figura 52. Espectro de Infravermelho de CRD-5 (Pastilha de KBr) ... 82
Figura 53. Espectro de massa (IE, 70 eV) de CRD-5 ... 83
Figura 54. Sub-estrutura I de CRD-6 ... 84
Figura 55. Estrutura química de CRD-6: lupeol ... 85
Figura 56. Espectro de RMN 1H (500 MHz, CDCl3) de CRD-6 ... 87
Figura 57. Espectro RMN 13C-CPD (125 MHz, CDCl3) de CRD-6 ... 87
Figura 58. Espectro de RMN 13C-DEPT 135º (125 MHz, CDCl3) de CRD-6 ... 88
Figura 59. Estrutura básica de flavona ... 90
Figura 60. Estrutura I de CRD-7, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 91
Figura 61. Estrutura química de CRD-7: 3', 4’, 5-trihidroxi-3,7-dimetóxi-flavona ... 92
Figura 62. Espectro de RMN 1H (500 MHz, C5D5N) de CRD-7 ... 93
Figura 63. Espectro de RMN 13C – CPD (125 MHz, C5D5N) de CRD-7 ... 93
Figura 64. Espectro de RMN 13C-DEPT 135º (125 MHz, C5D5N) de CRD-7 ... 94
Figura 65. Espectro de RMN bidimensional de 1H,13C – HSQC (500 x 125 MHz, C5D5N) de CRD-7 ... 94
Figura 66. Espectro de RMN bidimensional de 1H, 13C – HMBC (500 x 125 MHz, C5D5N) de CRD-7 ... 95
Figura 67. Espectrode Infravermelho de CRD-7 (Pastilha de KBr) ... 95
Figura 68. Estrutura básica do diterpeno de esqueleto clerodânico ... 97
Figura 69. Estrutura de CRD-8, mostrando as correlações I e II a mais de uma ligação observadas no espectro HMBC ... 98
Figura 70. Estrutura química de CRD-8: Ácido cleroda-3,13-dien-16,15-olido-18-óico ... 100
Figura 71. Espectro de RMN 1H (500 MHz, CH3OD) de CRD-8 ... 101
Figura 72. Espectro de RMN 13C – CPD (125 MHz, CH3OD) de CRD-8 ... 101
Figura 74. Espectro de RMN bidimensional de 1H, 13C – HSQC (500 x 125 MHz,
CH3OD) de CRD-8 ... 102
Figura 75. Espectro de RMN bidimensional de 1H, 13C – HMBC (500 x 125 MHz, CH3OD) de CRD-8 ... 103
Figura 76. Espectro de massa (IE, 70 eV) de CRD-8 ... 103
Figura 77. Espectro de Infravermelho de CRD-8 (Pastilha de KBr) ... 104
Figura 78. Estrutura básica de um diterpeno de esqueleto beiereno ... 106
Figura 79. Sub-estruturas III e IV de CRD-9, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 107
Figura 80. Sub-estruturas V e VI de CRD-9, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 108
Figura 81. Estrutura química de CRD-9: beier-15-eno-3,12-diol ... 108
Figura 82. Espectro de RMN 1H (500 MHz, CDCl3) de CRD-9 ... 110
Figura 83. Espectro de RMN 13C – CPD (125 MHz, CDCl3) de CRD-9 ... 110
Figura 84. Espectro de RMN 13C-DEPT 135º (125 MHz, CDCl3) de CRD-9 ... 111
Figura 85. Espectro de RMN bidimensional de 1H, 13C – HSQC (500 x 125 MHz, CDCl3) de CRD-9 ... 111
Figura 86. Espectro de RMN bidimensional de 1H 13C – HMBC (500 x 125 MHz, CDCl3) de CRD-9 ... 112
Figura 87. Espectro de expansão de RMN bidimensional de 1H, 13C – HSQC (500 x 125 MHz, CDCl3) de CRD-9 ... 112
Figura 88. Espectro de massa (IE, 70 eV) de CRD-9 ... 113
Figura 89. Espectro de infravermelho de CRD-9 (Pastilha de KBr) ... 113
Figura 90. Estrutura básica de um esqueleto triterpênico do tipo oleanano ... 115
Figura 91. Sub-estruturas I e II para CRD-10, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 116
Figura 92. Sub-estruturas III e IV para CRD-10, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 117
Figura 93. Sub-estrutura V para CRD-10, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 117
Figura 94. Estrutura química de CRD-10: ácido acetil aleuritólico ... 118
Figura 95. Espectro de RMN 1H (500 MHz, CDCl3) de CRD-10 ... 120
Figura 96. Espectro de RMN 13C – CPD (125 MHz, CDCl3) de CRD-10 ... 120
Figura 97. Espectro de RMN 13C-DEPT 135º (125 MHz, CDCl3) de CRD-10 ... 121
Figura 98. Espectro de RMN bidimensional de 1H, 13C – HSQC (500 x 125 MHz, CDCl3) de CRD-10 ... 121
Figura 99. Espectro de RMN bidimensional de 1H,13C – HMBC (500 x 125 MHz, CDCl3) de CRD-10 ... 122
Figura 100. Espectro de expansão (0,9 – 2,5 ppm) do espectro de RMN bidimensional de 1H, 13C – HMBC (500 x 125 MHz, CDCl3) de CRD-10 ... 122
Figura 101. Espectro de massa (IE, 70 eV) de CRD-10 ... 123
Figura 102. Espectro de Infravermelho de CRD-10 (Pastilha de KBr) ... 123
Figura 103. Estrutura química de CRD-11: escopoletina ... 126
Figura 104. Espectro de RMN 1H (500 MHz, CDCl3) de CRD-11 ... 127
Figura 105. Espectrode RMN 13C – CPD (125 MHz, CDCl3) de CRD-11 ... 127
Figura 106. Espectro de RMN 13C-DEPT 135º (125 MHz, CDCl3) de CRD-11 ... 128
Figura 107. Espectro de Infravermelho de CRD-11 (Pastilha de KBr) ... 128
Figura 109. Sub-estruturas IV e V, mostrando as correlações a mais de uma ligação
observadas no espectro HMBC ... 131
Figura 110. Sub-estruturas VI e VII, mostrando as correlações observadas no espectro COSY ... 132
Figura 111. Estrutura química de CRD-12: rhamnifa ... 133
Figura 112. Espectro de RMN 1H (500 MHz, CDCl3) de CRD-12 ... 134
Figura 113. Espectro de RMN 13C-CPD (125 MHz, CDCl3) de CRD-12 ... 134
Figura 114. Espectro de RMN 13C-DEPT 135 (125 MHz, CDCl3) de CRD-12 ... 135
Figura 115. Espectro de RMN bidimensional de 1H, 13C – HSQC (500 x 125 MHz, CDCl3) de CRD-12 ... 135
Figura 116. Espectro de RMN bidimensional de 1H, 13C – HMBC (500 x 125 MHz, CDCl3) de CRD-12 ... 136
Figura 117. Espectro Infravermelho de CRD-12 (Pastilha de KBr) ... 136
Figura 118. Espectro de RMN 1H, 1H - COSY (500 x 500 MHz, CDCl3) de CRD-12 ... 137
Figura 119. Espectro de massas de alta resolução de CRD-12 (ESI) ... 137
Figura 120. Espectros de massa (IE, 70 eV) de CRD-12 ... 138
Figura 121. Sub-estrutura I de CRD-13, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 141
Figura 122. Sub-estruturas II e III de CRD-13, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 141
Figura 123. Sub-estruturas IV e V de CRD-13, mostrando as correlações a mais de uma ligação observadas no espectro HMBC ... 142
Figura 124. Sub-estruturas VI e VII, mostrando as correlações observadas no espectro COSY ... 142
Figura 125. Estrutura química de CRD-13: quinorhamina ... 143
Figura 126. Espectro de RMN 1H (500 MHz, CH3OD) de CRD-13 ... 144
Figura 127. Expansão do espectro de RMN 1H (500 MHz, CH3OD) de CRD-13 ... 144
Figura 128. Expansão do espectro de RMN 1H (500 MHz, CH3OD) de CRD-13 ... 145
Figura 129. Espectro de RMN 13C – CPD (125 MHz, CH3OD) de CRD-13 ... 145
Figura 130. Espectro de RMN 13C-DEPT 135º (125 MHz, CH3OD) de CRD-13 ... 146
Figura 131. Espectro de RMN bidimensional de 1H, 13C – HSQC (500 x 125 MHz, CH3OD) de CRD-13 ... 146
Figura 132. Espectro de RMN bidimensional de 1H, 13C – HMBC (500 x 125 MHz, CH3OD) de CRD-13 ... 147
Figura 133. Expansão do espectro de RMN bidimensional de 1H, 13C – HMBC (500 x 125 MHz, CH3OD) de CRD-13 ... 147
Figura 134. Expansão do espectro de RMN bidimensional de 1H, 13C – HMBC (500 x 125 MHz, CH3OD) de CRD-13 ... 148
Figura 135. Expansão do espectro de RMN bidimensional de 1H, 13C – HMBC (500 x 125 MHz, CH3OD) de CRD-13 ... 148
Figura 136. Espectro de RMN 1H, 1H COSY (500 x500 MHz, CH3OD) de CRD-13 148 Figura 137. Expansão do espectro de RMN 1H, 1H – COSY (500 x 500 MHz, CH3OD) de CRD-13 ... 149
Figura 138. Espectro de massas de alta resolução de CRD-13 (ESI) ... 150
Figura 139. Espectro de Infravermelho de CRD-13 (Pastilha de KBr) ... 150
Figura 140. Cromatograma de CLAE da fração CRRECC-(8-11) ... 167
Figura 141. Cromatograma de CLAE da fração CRCECC-(8) ... 180
Figura 142. Cromatograma de CLAE da fração CRCECC-(9)-(4-10)-(3-6) ... 182
LISTA DE TABELAS
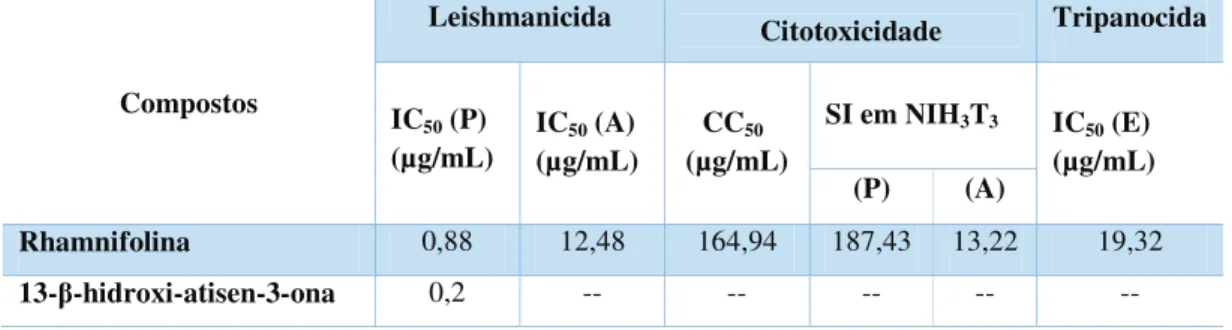
Tabela 1. Relação dos alcaloides obtidos a partir de espécies de Croton ... 35 Tabela 2. Atividade dos compostos isolados contra formas promastigotas (P) e
amastigotas (A) de Leishmania amazonensis, citotoxicidade em células NIH3T3 e
atividade contra a forma epismatigotas (E) de Trypanosoma cruzi. ... 44
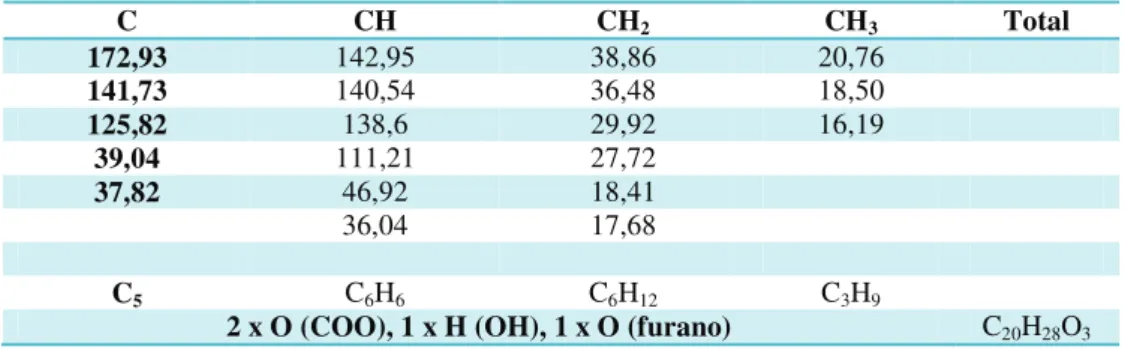
Tabela 3. Deslocamentos químicos de RMN 13C (125 MHz, CH3OD) de CRD-1 por
padrão de hidrogenação. ... 48
Tabela 4. Correlação heteronuclear 1H, 13C- HSQC e HMBC (500 x 125 MHz,
CH3OD) de CRD-1. ... 49
Tabela 5. Comparação dos dados de RMN 13C – CPD de CRD-1 (125 MHz, CD3OD)
com os registrados na literatura para o senecrassidiol (75 MHz, CD3OD)
(BOHLMANN, 1981) e senecrassidiol – ȕ - glicosilado (125 MHz, CD3OD) (XIANG,
2004). ... 50
Tabela 6. Deslocamentos químicos de RMN 13C (125 MHz, CH3OD) de CRD-2 por
padrão de hidrogenação. ... 56
Tabela 7. Correlação heteronuclear 1H, 13C- HSQC e HMBC (500 x 125 MHz,
CH3OD) de CRD-2 e análise comparativa dos deslocamentos químicos (į) de RMN 13C
de 13Į-hidroxi-atisen-3-ona (300 MHz, CDCl3) (HELUANI, 1998) com CRD-2. ... 59
Tabela 8. Deslocamentos químicos de RMN 13C (125 MHz, CDCl3) de CRD-3 por
padrão de hidrogenação. ... 63
Tabela 9. Correlação heteronuclear 1H, 13C- HSQC e HMBC (500 x 125 MHz, CDCl3)
de CRD-3 e comparação dos dados com os descritos na literatura (125 MHz, CDCl3)
(PACHECO, 2009) ... 66
Tabela 10. Deslocamentos químicos de RMN 13C (125 MHz, CDCl3) de CRD-4 por
padrão de hidrogenação. ... 71
Tabela 11. Comparação entre os dados de RMN 13C-CPD de CRD-4 (125 MHz, CDCl3) com os dados descritos na literatura para Lupenona (75 MHz, CDCl3)
(BARREIROS, 2000). ... 72
Tabela 12. Deslocamentos químicos de RMN 13C (125 MHz, CDCl3) de CRD-5 por
padrão de hidrogenação. ... 77
Tabela 13. Correlação heteronuclear 1H, 13C- HSQC e HMBC (500 x 125 MHz, CDCl3) de CRD-5 e análise comparativa dos deslocamentos químicos (į) de RMN 13C
do ácido hardwickiico (75 MHz, CDCl3) (SILVEIRA, 1985) com CRD-5. ... 79
Tabela 14. Deslocamentos químicos de RMN 13C (75 MHz, CDCl3) de CRD-6 por
padrão de hidrogenação ... 85
Tabela 15. Comparação entre os dados de RMN 13C-CPD de CRD-6 (125 MHz, CDCl3) com os dados descritos na literatura para o lupeol (125 MHz, CDCl3
(MAHATO, 1994). ... 86
Tabela 16. Deslocamentos químicos de RMN 13C (125 MHz, C5D5N) de CRD-7 por
padrão de hidrogenação. ... 90
Tabela 17. Correlação heteronuclear 1H, 13C- HSQC e HMBC (500 x 125 MHz, C5D5N) de CRD-7 e análise comparativa dos deslocamentos químicos (δ) de RMN 13C
de 3', 4’, 5-trihidroxi-3,7-dimetóxi-flavona [125 MHz, (CD3)2CO] (COSTA, 2008) .... 92
Tabela 18. Deslocamentos químicos de RMN 13C (125 MHz, CH3OD) de CRD-8 por
padrão de hidrogenação. ... 97
Tabela 20. Correlação heteronuclear 1H, 13C- HSQC e HMBC (500 x 125 MHz,
CH3OD) de CRD-8 e análise comparativa dos deslocamentos químicos (į) de RMN 13C
do ácido patagônico (500 MHz, CDCl3) (PINTO, 2010) ... 100
Tabela 21. Deslocamentos químicos de RMN 13C (125 MHz, CDCl3) de CRD-9 por padrão de hidrogenação. ... 106
Tabela 22. Correlação heteronuclear 1H, 13C- HSQC e HMBC (500 x 125 MHz, CDCl3) de CRD-9 ... 109
Tabela 23. Deslocamentos químicos de RMN 13C (125 MHz, CDCl3) de CRD-10 por padrão de hidrogenação. ... 115
Tabela 24. Correlação heteronuclear 1H, 13C- HSQC e HMBC (500 x 125 MHz, CDCl3) de CRD-10 e comparação dos dados descritos na literatura para o ácido acetil aleuritólico (75 MHz, CDCl3) (MCLEAN, 1987) ... 119
Tabela 25. Deslocamentos químicos de RMN 13C (125 MHz, CDCl3) de CRD-11 por padrão de hidrogenação ... 125
Tabela 26. Comparação entre os dados de RMN 13C-CPD de CRD-11 (125 MHz, CDCl3) com os dados descritos na literatura para Escopoletina (75 MHz, DMSO) (ZHANG, 2011). ... 126
Tabela 27. Deslocamentos químicos de RMN 13C (125 MHz, CDCl3) de CRD-12 por padrão de hidrogenação. ... 129
Tabela 28. Correlação heteronuclear 1H, 13C- HSQC e HMBC (500 x 125 MHz, CDCl3) de CRD-12. ... 133
Tabela 29. Deslocamentos químicos de RMN 13C (125 MHz, CH3OD) de CRD-13 por padrão de hidrogenação. ... 140
Tabela 30. Correlação heteronuclear 1H, 13C- HSQC e HMBC (500 x 125 MHz, CH3OD) de CRD-13. ... 143
Tabela 31. Frações resultantes do fracionamento cromatográfico de CRRE ... 157
Tabela 32. Frações resultantes do fracionamento cromatográfico de CRCH ... 158
Tabela 33. Frações obtidas no fracionamento cromatográfico de CRCE ... 158
Tabela 34. Frações resultantes do fracionamento cromatográfico de CRRE-C ... 159
Tabela 35. Frações resultantes do fracionamento cromatográfico de CRREC-A ... 160
Tabela 36. Frações resultantes do fracionamento cromatográfico de CRRECA-(2-34) ... 160
Tabela 37. Frações obtidas no fracionamento cromatográfico de CRRECA-(2-34)-(19-38) ... 161
Tabela 38. Frações resultantes do fracionamento cromatográfico de CRRECA-(2-34)-(19-38)-(18-42) ... 162
Tabela 39. Frações resultantes do fracionamento cromatográfico de CRRE-H ... 163
Tabela 40. Frações resultantes do fracionamento cromatográfico de CRREH-C ... 163
Tabela 41. Frações obtidas no fracionamento cromatográfico de CRREHC (29-31) . 164 Tabela 42. Frações resultantes do fracionamento cromatográfico de CRREHC (31) . 165 Tabela 43. Frações resultantes do fracionamento cromatográfico de CRREHC (29-31)-(96-104) ... 165
Tabela 44. Frações obtidas no fracionamento cromatográfico de CRRE-C ... 166
Tabela 45. Frações resultantes do fracionamento cromatográfico de CRREC-C ... 167
Tabela 46. Frações obtidas no fracionamento cromatográfico de CRCH-H ... 168
Tabela 47. Frações obtidas no fracionamento cromatográfico de CRCHH-C ... 169
Tabela 48. Frações obtidas no fracionamento cromatográfico de CRCHHC-A ... 169
Tabela 50. Frações resultantes do fracionamento cromatográfico de
CRCHHCA-H/D20%(18) ... 170
Tabela 51. Frações resultantes do fracionamento cromatográfico de CRCHHCA-H/D20%(18)-(8-14) ... 171
Tabela 52. Frações resultantes do fracionamento cromatográfico de CRCHHCA-H/D20%(18)-(8-14)-(11-16) ... 172
Tabela 53. Frações resultantes no fracionamento cromatográfico de CRCHHCA- D 173 Tabela 54. Frações resultantes do fracionamento cromatográfico de CRCHHCAD-(12-15) ... 173
Tabela 55. Frações obtidas no fracionamento cromatográfico de CRCH-C ... 174
Tabela 56. Frações resultantes do fracionamento cromatográfico de CRCHC-C ... 175
Tabela 57. Frações resultantes do fracionamento cromatográfico de CRCHCC-(10) 175 Tabela 58. Frações resultantes do fracionamento cromatográfico de CRCHCC-(10)-(7-26) ... 176
Tabela 59. Frações resultantes do fracionamento cromatográfico de CRCHCC-(10)-(7-26)-(19-43) ... 176
Tabela 60. Frações obtidas no fracionamento cromatográfico de CRCE-A ... 177
Tabela 61. Frações resultantes do fracionamento cromatográfico de CRCEA-A ... 178
Tabela 62. Frações obtidas no fracionamento cromatográfico de CRCE-C ... 179
Tabela 63. Frações resultantes do fracionamento cromatográfico de CRCEC-C ... 179
Tabela 64. Frações resultantes do fracionamento cromatográfico de CRCECC (9) ... 181
Tabela 65. Frações resultantes do fracionamento cromatográfico de CRCECC (9) (4-10) ... 181
Tabela 66. Frações resultantes do fracionamento cromatográfico de CRCEC-A ... 183
Tabela 67. Frações resultantes do fracionamento cromatográfico de CRCEC-A ... 183
Tabela 68. Frações resultantes do fracionamento cromatográfico CRCECA (10) (11) ... 184
LISTA DE FLUXOGRAMAS
Fluxograma 1. Isolamento dos constituintes não voláteis do extrato etanólico da raiz de Croton rhamnifolius ...184
Fluxograma 2. Isolamento dos constituintes não voláteis do extrato hexânico do caule de Croton rhamnifolius...185
LISTA DE QUADRO
RESUMO
Croton rhamnifolius (Müll. Arg.) é uma espécie comum do sertão nordestino, principalmente nos estados de Pernambuco e Ceará. O espécime foi coletado na cidade de Salgueiro – PE onde é popularmente conhecido por “quebra-faca”, cujas as folhas são empregadas para o tratamento de mal-estar gástrico, febre e ânsia de vômitos. Este trabalho apresenta uma abordagem fitoquímica, visando o isolamento e caracterização estrutural dos constituintes químicos de C. rhamnifolius. A investigação química foi realizada com os extratos hexânico e etanólico do caule, e extrato etanólico da raiz. Os extratos foram submetidos a partições líquido-líquido, cromatografias convencionais (adsorção-gel de sílica e exclusão - gel de dextrana) e atuais (HPLC - fase normal e reversa), resultando no isolamento e identificação de dez terpenos, um alcaloide, um flavonoide e uma cumarina. Dentre as substâncias isoladas, temos dois diterpenos de esqueleto clerodânico: ácido hardwickico e o ácido cleroda-3,13-dien-16,15-olido-18-óico; além do diterpeno de esqueleto beierano: beiereno-3,12-diol; atiseno: 13ȕ
-hidroxi-atisen-3-ona; caurano: caur-16-eno; labdano rearranjado: rhamnifa, do sesquiterpeno: senecrassidiol; três triterpenos pentacíclicos: ácido acetil aleuritólico (AAA), lupeol e lupenona; o alcaloide de esqueleto quinolínico quinorhamina, um flavonoide 3', 4’, 5-trihidroxi-3,7-dimetóxiflavona; e uma cumarina escopoletina. O alcaloide indólico, rhamnifolina, obtido durante a dissertação de mestrado e o diterpeno 13ȕ
-hidroxi-atisen-3-ona foram avaliados quanto às suas atividades citotóxicas, tripanocida e leishmanicida, e os resultados obtidos evidenciaram uma excelente atividade do primeiro composto nos três testes farmacológicos. Para o segundo, foram obtidos resultados positivos contra Leishmania amazonensis. As substâncias químicas isoladas tiveram suas estruturas elucidadas por métodos físicos (ponto de fusão e rotação óptica) e espectroscópicos (Espectroscopia na região do Infravermelho, Espectrometria de Massas e Espectroscopia de Ressonância Magnética Nuclear de 1H e 13C, incluindo técnicas uni e bidimensionais), além de comparação com dados da literatura.
ABSTRACT
Croton rhamnifolius (Müll. Arg.) is a very common shrub of the interior northeastern region of Brazil, particularly in the states of Pernambuco and Ceará. A specimen was harvested at Salgueiro County – Pernambuco where it is known as “quebra-faca” (Pat. lit. = knife breaker) and is used to treat gastric problems. This work reports the phytochemical approach to isolate and characterize its chemical constituints. The chemical investigation was perfomed with hexane and ethanol extracts of the think, and the ethanol extract for the roots. Liquid-liquid partitioning, conventional (si-gel adsorption and dextran gel exclusion) and modern chromatography normal and revers phase (HPLC) lead to the isolation and characterization of ten terpenoids, an alkaloid, a flavonoid, and coumarin. Of the isolation compounds two were of the clerodane type hardwickic acid and cleroda-3,13-dien-16,15-olide-18-óico acid; a beyerene: beier-15-eno-3,12-diol; a atisane: 13ȕ-hydroxy-atisen-3-one; a kaurene: kaure-16-ene; a labdane:
rhamnife; diterpene senecrassidiol; three were pentacyclic triterpenes: lupeol, lupenone and aleuritolic acid; an alkaloid quinoline: quinorhamine; a flavonoid 3', 4’, 5-trihydroxy-3,7-dimethoxy-flavone; and coumarin: scopoletin. The indole alkaloid rhamnifoline, previously isolated and the diterpene 13ȕ-hydroxy-atisen-3-one were
evaluated concerning to their cytotoxic, tripanocidal and leishmanicidal activities. Just the alkaloid showed positive results for all assays. The diterpene showed activity just on the leishmania test. The structure of all isolated compounds were determined through physical methods (melting points and optical rotation) and spectroscopic means (IR, MS and NMR) including two dimensional techniques and comparision to the literature.
1 INTRODUÇÃO
O estudo fitoquímico de plantas da flora nordestina, realizado há muitos anos, tem permitido isolar, caracterizar e testar farmacologicamente os princípios ativos destas plantas, validando cientificamente o emprego de fitoterápicos produzidos a partir de plantas utilizadas na medicina popular (RANDAU, 2004). As informações sobre o uso e as virtudes terapêuticas das plantas medicinais foram sendo acumuladas através dos séculos e a utilização de suas propriedades representa uma forma de tratamento e cura de doenças. Apesar do uso de plantas medicinais ter a sua propagação associada ao conhecimento popular empírico, paulatinamente vem sendo reconhecido e incorporado ao saber científico.
O gênero Croton, o segundo mais numeroso da família Euphorbiaceae compreende cerca de 1.900 espécies, distribuídas nas Antilhas, América do Sul e América do Norte (WEBSTER, 1994). Muitas espécies desse gênero são utilizadas na medicina popular como analgésico. As atividades farmacológicas experimentalmente comprovadas colocam em destaque o seu potencial como antihipertensivo, antiinflamatório, antimalárico, antimicrobiano, antiespasmódico, antiulcerogênico, antiviral e mio-relaxante (SALATINO, 2007).
A química do gênero Croton tem sido bastante explorada e os estudos fitoquímicos efetuados têm conduzido ao isolamento de alcaloides, flavonoides, triterpenoides e uma grande variedade estrutural de diterpenoides, correspondendo estes principalmente a esqueletos do tipo clerodano, caurano, labdano, e traquilobano (SALATINO, 2007). Muitas das espécies são produtoras de óleo essencial cuja composição química é rica em mono e sesquiterpenoides (CRAVEIRO, 1981).
A espécie Croton rhamnifolius, nativa da região nordeste do Brasil, é conhecida
popularmente como “quebra-faca” ou “caatinga-branca”. O primeiro nome é uma alusão à rigidez de seu tronco, e o outro devido ao seu aroma e coloração do caule (RANDAU, 2001). A espécie é comumente utilizada na medicina popular para o tratamento contra mal estar gástrico, ânsia de vômitos e febre (RANDAU, 2004).
Foi realizada uma pesquisa bibliográfica no programa de busca acadêmica, Scifinder, onde foi possível verificar dois trabalhos envolvendo C. rhamnifolius. O
furânico: 17-carboxihardwiickiato de metila (1) e 17-carbometoxi-3-hidroxi-3,4-dihidro-hardwiickiato de metila (2) e o 7-oxo-20-acetoxianoneno (3) e de um triterpeno pentaciclíco, o lupeol (4) (Fig. 1) (FILGUEIRAS, 1994); dois outros artigos estão relacionados a identificação dos constituintes químicos voláteis das partes aéreas (CRAVEIRO, 1981); e ao estudo farmacognóstico do extrato da referida espécie (RANDAU, 2004); o quarto trabalho, foi o estudo fitoquímico das raízes de C.
rhamnifolius realizado pela autora desta tese, revelando o grande potencial químico da
espécie através do isolamento de um alcaloide de esqueleto indólico denominado de rhamnifolina (5); de dois diterpenos do tipo beierano denominados estachenona (6) e 12 – oxoestachenona (7); e dois triterpenos pentacíclícos, um da série oleanano, o ácido acetilaleuritólico (AAA) (8) e o outro da série lupano, lupeol (4) (Fig. 2, p. 24) Dentre os compostos isolados, o diterpeno estachenona é inédito no gênero Croton, e o alcalóide rhamnifolina inédito na literatura. Ensaios farmacológicos indicaram as atividades tripanocida e leishmanicida para o alcaloide rhamnifolina (SILVA, 2008).
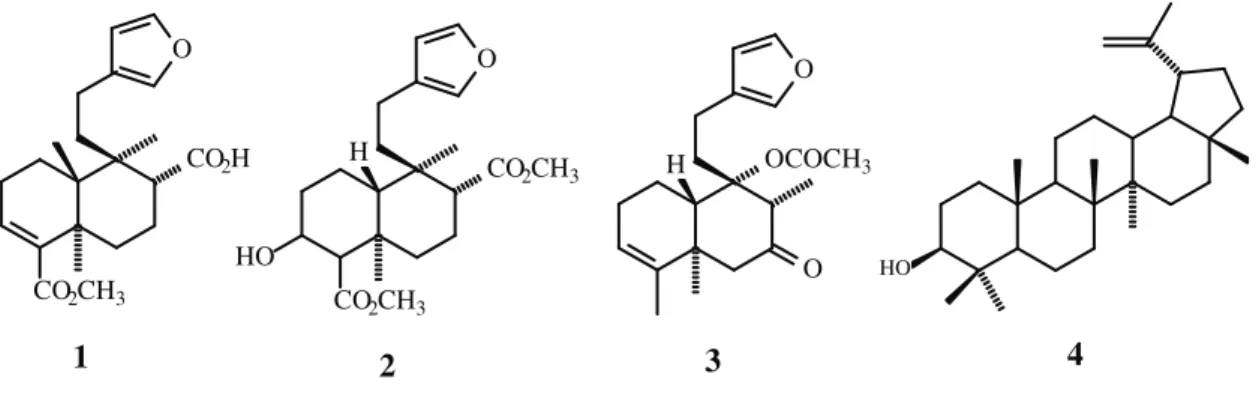
Figura 1. Metabólitos secundários isolados do extrato hexânico do caule de C.
rhamnifolius (FILGUEIRAS, 1994)
CO2H
CO2CH3
O
CO2CH3
CO2CH3
HO H
O
OCOCH3
H
O O
HO
1 2 3 4
5 6 7
8 4
Devido ao estudo avaliativo do potencial químico e farmacológico da espécie, realizada durante a dissertação de mestrado, foi dado continuidade ao estudo fitoquímico de Croton rhamnifolius, com ênfase no estudo de outra parte da planta e extratos ainda não-investigados como: o extrato hexânico e etanólico da casca e lenho do caule.
Este trabalho está composto de oito capítulos, onde o primeiro é referente a introdução, o segundo, às considerações botânicas relacionadas à espécie estudada e a família a qual pertence, destacando suas respectivas descrições morfológicas, distribuição geográfica e características gerais. O terceiro capítulo é referente ao levantamento bibliográfico realizado; o quarto corresponde às atividades farmacológicas de alguns constituintes químicos obtidos; o quinto capítulo se refere à determinação estrutural dos constituintes fixos isolados do extrato etanólico da raiz e extrato hexânico e etanólico da casca e lenho do caule da referida espécie; no sexto capítulo, temos os procedimentos experimentais realizados para obtenção dos constituintes químicos obtidos. O capítulo 7 contém as considerações finais sobre o trabalho apresentado. Por fim, encontram-se as referências bibliográficas utilizadas. O trabalho foi escrito seguindo as normas vigentes da Universidade Federal do Ceará no ano de 2012.
HO
Figura 2. Metabólitos secundários isolados do extrato etanólico das raízes de C.
rhamnifolius (SILVA, 2008)
O C O H3C
COOH
O
O
N N
H H
OH
2 CONSIDERAÇÕES BOTÂNICAS
2.1 Considerações botânicas sobre a família Euphorbiaceae
A família Euphorbiaceae é uma complexa e diversificada família com cerca de 300 gêneros e 8.000 espécies (WEBSTER, 1994) distribuídas especialmente na região dos trópicos. No Brasil, ocorrem 72 gêneros e aproximadamente 1.100 espécies difundidas em todos os tipos de vegetações e habitats (BARROSO, 1991). Espécies desta família possuem hábito bastante variado, cujos espécimes vão desde ervas, trepadeiras e arbustos a árvores, apresentando-se frequentemente com folhas peninérveas, alternas ou opostas, raramente verticiladas, com limbo inteiro ou lobado, simples ou compostas (Fig. 3a) (SECCO, 2004). Barroso (1991) considera a disposição das flores nas inflorescências um caráter muito importante para a sistemática dos gêneros desta família. As inflorescências podem ser cimosas ou racemosas, às vezes reduzidas, formando uma estrutura semelhante a uma única flor, denominada de ciátio (Fig. 3b) (SOUZA, 2005), e as flores são unissexuadas, monóicas ou dióicas, com ou sem vestígio de sexo atrofiado (BARROSO, 1991). O fruto geralmente é uma cápsula com deiscência elástica (tricoca), raramente baga, drupa ou sâmara; sementes frequentemente ariladas ou com uma carúncula (SOUZA, 2005).
Figura 3. Representação de (a) folha peninérvea e (b) inflorescências cimosas e (c) racemosas
(a) (b) (c)
nordeste; macaxeira que fornece amido e farinha, coroa-de-cristo (Euphorbia) utilizada como planta ornamental e o quebra-pedras (Phyllantus) de uso medicinal (Jolly, 1966). Outros exemplos comuns são o marmeleiro (Croton) e o pinhão (Jatropha) (BRAGA, 1960).
O gênero Euphorbia se destaca com aproximadamente 2400 espécies seguido dos gêneros Croton (1900 espécies), Manihot (160 espécies), Jatropha (150 espécies) e
Tragia (140 espécies).
2.2 Algumas considerações botânicas sobre o gênero Croton
O gênero Croton, o segundo mais abundante da famíla Euphorbiaceae, é um dos mais importantes da flora nordestina ocorrendo em caatingas, cerrados, mata dos tabuleiros litorâneos e matas pluviais. São representados por árvores, arbustos, ervas e trepadeiras, geralmente monóicas, algumas vezes dióicas, com tricomas de formas variadas (estrelados, escamiformes, etc.). Em geral, as inflorescências apresentam as flores pistiladas na base e as estaminadas no ápice, os estames dobrados no botão floral e as pétalas das flores pistiladas reduzidas ou ausentes. Desde o tratamento de Müller na
Flora Brasiliensis (1873), as espécies brasileiras não foram revisadas e diversos táxons novos vêm sendo propostos, o que tornou confusa a taxonomia do gênero. Alguns tratamentos recentes sobre as espécies da América do Sul ainda são insuficientes para que se possam avaliar precisamente os limites específicos deste gênero (SALATINO, 2007).
2.3 Algumas considerações botânicas sobre Croton rhamnifolius
Segundo Martius (1873), Croton rhamnifolius apresenta folhas com limbo 3-6
Figura 4. Fotografia de um espécime de Croton rhamnifolius, com detalhes para as
3 LEVANTAMENTO BIBLIOGRÁFICO SOBRE ALCALOIDES OBTIDOS A PARTIR DE ESPÉCIES DE Croton
Este capítulo trata da revisão bibliográfica sobre alcaloides oriundos de diversas espécies de Croton, em virtude do isolamento e caracterização estrutural de dois alcaloides de esqueletos indólico e quinolínico das raízes de Croton rhamnifolius. Esta classe de substâncias não é muito comum no gênero quando comparada com a grande quantidade de isolamento e identificação de compostos terpênicos para Croton.
3.1 Alcaloides
Alcaloides são substâncias orgânicas que contém nitrogênio possuindo caráter básico, derivadas principalmente de plantas, mas que também podem ser encontradas em fungos, bactérias e animais (SIMÕES, 1999). Nas plantas, podem existir no estado livre, bem como, na forma de sais ou óxidos. Eles também correspondem aos principais agentes terapêuticos naturais com ação anestésica, analgésica, psico-estimulante e neurodepressora, entre outras atividades farmacológicas (HENRIQUES et al., 2000).
Os alcaloides mostram grande variedade na sua origem botânica e bioquímica, na estrutura química e ação farmacológica. Consequentemente, muitos diferentes sistemas de classificação são possíveis.
Os alcaloides podem ser classificados em dois grandes grupos:
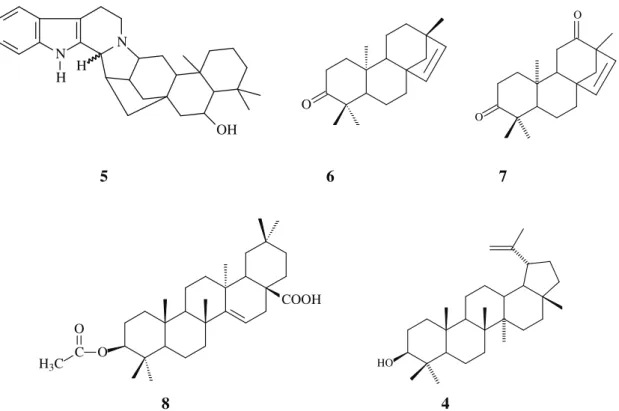
Figura 5. Representaçãoestrutural dos principais esqueletos de alcaloides encontrados em plantas. O O NH2 O N H N H N N N H N NMe
II.1 Pirrol II.4 Piridina
II.5 Piperidina II.6 Tropano II.7 Quinolina
N NMe N N H N N N H N N NH N II.8 Isoquinolina
II. 9 Aporfina
II.10 Quinolizidina
II.11 Indol II. 12 Indolizidina II. 13 Imidazol II. 14 Purina
II.2 Pirrolidina II.3 Pirolizidina
I. Mescalina
3.2 Os alcaloides como produtos do metabolismo secundário
3.3 Biossíntese
A biossíntese dos alcaloides inclui sempre pelo menos um aminoácido. Também podem ser incorporadas outras unidades provenientes de piruvato, malonato ou mevalonato. De acordo com os precursores biogenéticos e função da estrutura do metabólito final, podemos sistematizar os alcaloides como derivados dos aminoácidos ornitina, lisina, fenilalanina, tirosina, triptofano e ácido artranílico (Fig. 6).
Figura 6. Aminoácidos precursores de alcaloides
COOH H NH2
H2N
Ornitina
H2N NH2
HCOOH
Lisina
NH2
COOH
R
R = H Fenilalanina R = OH Tirosina
N NH2
COOH
H
Triptofano
CO2H
NH2
Ácido antranílico
3.3.1 Alcaloides derivados de triptofano
Alcaloides indólicos são derivados do aminoácido triptofano como pode facilmente ser interpretado por comparação do seu núcleo contendo nitrogênio à estrutura química do triptofano. Os alcaloides que se formam possuem uma unidade estrutural de indol-C2N proveniente do triptofano (aminoácido proveniente do ácido
chiquímico) (CARBONEZI, 2004).
Podem considerar-se dois tipos estruturais:
b) alcaloides derivados de biossíntese mista triptofano/mevalonato. Destes metabólitos são exemplos: a) a harmina e b) ajmalicina e ácido lisérgico (CARBONEZI, 2004) (Fig. 7).
Figura 7. Resumo da biossíntese de alcaloides harmina, ajmalicina, ácido lisérgico a partir do triptofano
N NH2
COOH
H
N NH2
H
N N
H
H3CO
N N
H
H3CO
O
H3COOC
NCH3
N
HO2C
Triptofano
Unidade Indol: C2N
Harmina
Ajmalicina
Ácido lisérgico
3.3.2 Alcaloides derivados de ácido antranílico
Figura 8. Resumo da biossíntese de alcaloides derivados do ácido antranílico
CO2H
NH2
N
O OH
OCH3
OCH3
CH3
CO2H
NH2
OH
CO2CH3
NHCH3
OCH3
N O
OCH3
O
ácido antranílico
Estrutura de acridina (arborinina)
Estrutura de quinolina (lunacrina)
ácido 3-hidroxiantranílico
damascenina
O levantamento bibliográfico sobre alcaloides obtidos de espécies de Croton e suas respectivas atividades farmacológicas foi realizado utilizando o Chemical Abstract (SciFinder Scholar) e Web of Science como ferramenta de pesquisa de periódicos no período que vai de 1962 até outubro de 2011. Em ambos, foi utilizada a palavra-chave “alkaloids” e refinado por “croton”, resultando na totalidade de 409 referências. Dentre estes artigos mencionados apenas 62 foram utilizados para o levantamento bibliográfico, haja vista, que a maioria estava relacionado a temas diferentes do proposto: isolamento e identificação destes alcaloides. Através da análise desses artigos foi possível registrar 50 compostos com seus respectivos dados de origem, estruturas químicas, denominações e referências que foram agrupados na Tabela 1 (p. 35 e 36) em ordem alfabética de espécie e no Quadro 1 (p. 37 a 39) em ordem numérica para cada estrutura química .
Tabela 1. Relação dos alcaloides obtidos a partir de espécies de Croton
Espécies Parte da
planta Alcaloides Atividade Referências
C. bonplandianum - 3-metoxi-4,6-dihidroximorfinandien-7-ona (47) - TIWARI, 1981
C. celtidifolius Folhas isoboldina (33), laudanina (38) Antifúngica (33) AMARAL, 1997 C. chilensis isosalutaridina (34), flavinantina (35), metilflavinantina (36), isocoridina
(37)
- BITTNER,1997
C. crassifolius Raiz crassifoleina (3) - HOANG, 2008
C. cuneatus Folhas julocrotol (4), isojulocrotol (5), julocrotona (6) e julocrotonina (7) Citotóxica SUAREZ, 2004
C. draco Seiva taspina (2) Inibidor de enzima acetil
colinesterase MURILLO, 2001 TSACHEVA, 2004
C. flavens Folhas amuronina (22) - CHARRIS, 2000
escoulerina (15), coreximina (48), salutaridina (12), salutarina (46), norsinoacutina (25), flavinantina (28), sebiferina (50), saludimerinas A (26) e B (27)
- EISENREICH, 2003
flavinantina (28) e flavinina(41) - CHAMBERS, 1968
flavinina (41) - STUART, 1967
C. hemiargyreus C. flavens
Folhas hemiargirina (11), salutaridina (12) e norsalutaridina (49) - AMARAL, 1998
Folhas glaucina (9) Antinflamatória
Folhas oxoglaucina (10) Antinflamatória
C. lechleri Seiva taspina (2) Anticolinesterásica DE MARINO, 2008
RISCO, 2003 VAISBERG, 1989 Folhas glaucina (9), isoboldina (33), magnoflorina (1), norisoboldina (43),
thaliporphina (44) e sinoacutina (32) Antinflamatória (9) CARLIN, 1996 - 8,14-dihydrosalutaridina (13); 8,14 dihidronorsalutaridina (14) - HAYNES, 1967
C. membranaceus Raiz julocrotina (8) - ABOAGYE, 2010
C. micradenus Folhas e talos ocobotrina (31), sinoacutina (32), 8,14 dihidro-salutaridina (13) e
isoboldina (33) - - HILL, 2001
C. moritibensis - Ǻ-carbolina 2-etoxicarboniltetrahidro-harman (42);
6-hidroxi-2-metiltetradihidroharman (16) - ARAÚJO-JÚNIOR, 2004
C. muscicapa Raiz anabasina (17) , muscicapinas A (18), B (19) e C (20) - ARAÚJO-JÚNIOR,
C. palanostigma Seiva taspina (2) Anticolinesterásica ITOKAWA, 1991
C. pullei - julocrotina (8), crotonomida A(23) e B (24) - BARBOSA, 2007
- Julocrotina (8), crotonomida A (23) e B (24)C Leishmanicida(8) GUIMARAES, 2010
C. ruizianus Folhas Crotsparina (40), jacularina (45) - COTILLO, 1996
Flavinantina (28) e o-metilflavinantina (29) Indução de agregação
plaquetária com trombina PIACENTE, 1997
C. salutaris Folhas Salutarina e salutaridina (12) - BRUNETON, 1999
C. sparsiflorus
- Crotsparinina (30) - BHAKUNI, 1969
- Esparsiflorina (39) - CHATTERJ, 1965
C. xalapensis - Magnoflorina (1) - AREVALO, 2009
Quadro 1. Estrutura química dos alcaloides obtidos de espécies de Croton N O HO OH O O O O N O O O N HO NH N N O O O H R2 R1
1 2 3
N N O O O H
CHCH2CH3
CH3 N O O O O H N O O O O O N O HO H O OH
8 9 10 11
OH O O N O O O R1
CH3O
N R2 N O OH H OH O NH N HO
12 15 15 16
N NH O O H NH R N O O O H H H
17 22
4 R1 = H, R2 = OH
5 R1 = OH, R2 = H
6 R1 = R2 = O
7 R1 = R2 = H
13 R1 = OH, R2 = CH3
14 R1 = R2 = H
18 R = H
19 R = CH2CH(CH3)2
20 R = CH2CH(CH3)CH2CH3
N N R O O O H OH O O N R O OH O O N O O HO O O H N Ϯϲ OH O O N O O HO O O H N O O N O R N H OH O
O O
O
HO
CH3O
H NCH3
27 30 31
O O
HO
CH3O
H NCH3 O HO O OH N N H OR2
R1O
O O N O O HO
CH3O
CH3
H
32 33 37
NCH3 O O O O NH HO HO OCH3 NH H3CO
HO
H
O
H3CO
HO
O
OCH3
NH
38 39 40 41 23 R = CH2CH3
24 R = CH3CHCH3
25 ent-1 R = CH3 ent-2 R = H
28 R = OH
29 R = OCH3
34 R1 = CH3, R2 = H
35 R1 = H, R2 = CH3
N NH O O 42 NR1 OR2 O O HO H HN OH OCH3 H O ϰϱ O OCH3 R1 OCH3 N CH3 R2 O OH OH OCH3 N H N HO
CH3O
OH OCH3 H O OCH3 OH OCH3 N H ϰϳϰϴϰϵ
Durante o levantamento bibliográfico foi observado o relato de atividades apresentadas para alguns alcaloides obtidos de Croton. Apresentou atividade antifúngica o composto isoboldina (33) obtido de C. celtidifolius (AMARAL, 1997), atividade citotóxica para julocrotol (4), isojulocrotol(5), julocrotona (6) e julocrotonina (7), obtidos de C.
cuneatus (SUAREZ, 2004), inibição da enzima acetil colinesterase para o composto taspina (2), oriundos de C. draco, C. lechleri, C. palanostigma (TSACHEVA, 2004; RISCO, 2003; ITOKAWA, 1991). Atividadeantiinflamatória para glaucina (9) isolada de C. flavens e C. lechleri (AMARAL, 1998; CARLIN, 1996) e para oxoglaucina (10) obtido de C.
flavens (AMARAL, 1998). A atividade Leishmanicida foi apresentada pelo composto julocrotina (8) obtido de C. pullei (GUIMARÃES, 2010). Já o efeito positivo de indução de agregação plaquetária com trombina foi observado em flavinantina (28) e o-metilflavinantina (29) de C. ruizianus (PIACENTE, 1997) (Tab. 1, p. 35 e 36).
46 R1 = OH, R2 = H
50 R1 = H, R2 = OCH3
43 R1 = R2 = H
4 ATIVIDADE FARMACOLÓGICA
Os terpenos estachenona, 12-oxo-estachenona, 13ȕ-hidroxi-atisen-3-ona, ácido
acetilaleutitólico, e o alcalóide rhamnifolina, constituintes químicos obtidos através do estudo fitoquímico de Croton rhamnifolius, foram submetidos a testes farmacológicos de tripanocida, leishmanicida e citotoxicidade, realizados no departamento de farmácia da Universidade de Brasília.
Dois dos compostos analisados se apresentaram eficientes em pelo menos um dos testes, o diterpeno de esqueleto atiseno, 13ȕ-hidroxi-atisen-3-ona (1) e o alcaloide de
esqueleto indólico, rhamnifolina (2)(Fig. 9).
O primeiro composto foi submetido aos quatro testes, obtendo resultado positivo apenas contra Leishamania amazonensis, apresentando índice de inibição de 50% a 0,2 µg/mL.
O alcaloide rhamnifolina foi submetido a ensaios farmacológicos contra
Tripanossoma cruzi, Leishmania amazonensis e citotoxicidade, apresentando resposta positiva nos três testes aplicados.
Figura 9. Constituintes químicos ativos
O
OH
H
(1) (2)
4.1 Farmacologias avaliadas
4.1.1 Tripanocida
O Trypanosoma cruzi é um protozoário, agente etiológico da doença de Chagas. Trata-se de uma infecção transmissível em que o parasita circula no sangue periférico e tecidos, provocando lesões teciduais graves, principalmente no coração e em órgãos
N N
H H
do aparelho digestivo (esôfago e intestino). O T. cruzi possui um ciclo biológico complexo, envolvendo três formas evolutivas (tripomastigota, epimastigota e amastigota) e várias espécies de triatomíneos e de mamíferos, silvestres e domésticos, que atuam respectivamente, como vetores e reservatórios do parasito (PRATA, 2001). O fármaco mais freqüentemente utilizado no tratamento da Doença de Chagas no Brasil é o Benzonidazol (Roche), um derivado nitroimidazólico, com fómula química N-benzil-2-nitro-1-imidazolacetamida, desenvolvido na década de 1960. Esse composto é ativo na fase aguda da Doença de Chagas, curando cerca de 70% dos infectados, mas apresenta eficácia limitada na forma crônica da doença (KIRCHHOFF, 1999).
4.1.2 Leishmanicida
As Leishmanioses são um grupo de doenças polimórficas, causadas por protozoários parasitas pertencentes ao gênero Leishmania (Ordem Kinetoplastida, Trypanosomatidae), que são transmitidos ao homem e a outros mamíferos através da picada da fêmea do inseto
Lutzomyia spp. A doença tem apresentações clínicas diversas, podendo acometer a pele, as mucosas e as vísceras. No Brasil, existem sete espécies distintas do parasito: L. braziliensis,
L. amazonensis, L. guyanensis, L. lansoni, L. shawii, L. naiffi, L. chagasi) (GENARO e MICHALICK, 2005; GENARO e REIS, 2005a). As leishmanias apresentam duas formas evolutivas: a amastigota, que é obrigatoriamente parasita intracelular em vertebrados, e a forma promastigota que se desenvolve no tubo digestivo dos hospedeiros invertebrados.