UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE CIÊNCIAS
DEPARTAMENTO DE QUÍMICA ORGÂNICA E INORGÂNICA
ESTUDO FITOQUÍMICO
DE ABAREMA COCHLIACARPOS (GOMES)
BARNEBY & J. W. GRIMES E CALLIANDRA
DEPAUPERATA BENTH.
ANDREZA MARIA LIMA PIRES
ESTUDO FITOQUÍMICO
DE ABAREMA COCHLIACARPOS (GOMES)
BARNEBY & J. W. GRIMES E CALLIANDRA
DEPAUPERATA BENTH.
Tese submetida à Coordenação do Curso de Pós-Graduação em Química,
da Universidade Federal do Ceará, como requisito parcial para a obtenção
do grau de Doutor em Química.
ANDREZA MARIA LIMA PIRES
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências e Tecnologia
P744e Pires, Andreza Maria Lima.
Estudo fitoquímico de Abarema cochliacarpos (Gomes) Barneby e J. W. Grimes e Calliandra depauperata Benth / Andreza Maria Lima Pires. – 2011.
211 f. : il. color., enc. ; 30 cm.
Tese (doutorado) – Universidade Federal do Ceará, Centro de Ciências, Departamento de Química Orgânica e Inorgânica, Programa de Pós-Graduação em Química, Fortaleza, 2011.
Área de Concentração: Química Orgânica.
Orientação: Profa. Dra. Otília Deusdênia Loiola Pessoa Cavalcante.
1. Química vegetal. 2. Leguminosa. 3. Flavonóides. 4. Diterpenos. I. Título.
Este trabalho foi realizado sob a orientação da Professora Dra. Otília Deusdênia Loiola Pessoa do Departamento de Química Orgânica e Inorgânica do Centro de Ciências da
AGRADECIMENTOS
A Deus, pelo amor que nos faz fortes e perseverantes, que nos encoraja nas horas mais difíceis. Senhor Tu és a esperança e a certeza que podemos tudo de novo...
À Professora Doutora Otília Deusdênia Loiola Pessoa, que com compreensão e paciência guiou-me até a conclusão deste trabalho;
Ao Professor Doutor Edilberto Rocha Silveira, pela imprescindível e inestimável colaboração;
Aos Professores do curso de Pós-graduação em Química Orgânica por todos os conhecimentos adquiridos;
À Professora Doutora Maria Rose Jane Ribeiro Albuquerque (UVA), não somente pelos valiosos ensinamentos, mas pelo apoio, amizade e pelo exemplo de dedicação e amor ao trabalho;
Ao Professor Raimundo Braz-Filho (UENF), exemplo de competência e humildade, pela colaboração na elucidação estrutural de algumas substâncias;
Aos alunos da Pós-graduação Daniel Esdras e José Gustavo (CENAUREM) pela obtenção dos espectros;
Aos alunos de iniciação científica Roberto, Aurélio e Robério, pelo convívio que tornava as horas de trabalho mais agradáveis e menos cansativas;
A todos que fazem parte do Laboratório de Análise Fitoquímica de Plantas Medicinais (LAFIPLAM), e a todos os colegas de curso pelo convívio amigável e colaboração;
Aos funcionários Mundinha, Lana, Célia e Sr. Paulo pelo excelente suporte técnico;
A todos que direta ou indiretamente contribuíram para que este trabalho se tornasse realidade, em especial àqueles que souberam compreender os altos e baixos dessa convivência;
SUMÁRIO
LISTA DE FIGURAS iv
LISTA DE TABELAS ix
LISTA DE FLUXOGRAMAS xi
LISTA DE QUADROS xi
LISTA DE ABREVIATURAS E SÍMBOLOS xii
RESUMO xiii
ABSTRACT xiv
INTRODUÇÃO 1
CAPÍTULO 1-CONSIDERAÇÕES GERAIS E BOTÂNICAS 4
1.1. Família Leguminosae e a Tribo Mimosoideae 4
1.2. O gênero Abarema e a espécie Abarema cochliacarpos (Gomes) Barneby & J. W. Grimes
5
1.3. O gênero Calliandra e a espécie Calliandra depauperata Benth. 9
CAPÍTULO 2-LEVANTAMENTO BIBLIOGRÁFICO DOS
CONSTITUINTES QUÍMICOS ISOLADOS DE ESPÉCIES DO GÊNERO CALLIANDRA
11
CAPÍTULO 3-ELUCIDAÇÃO ESTRUTURAL 29
3.1. Elucidação estrutural dos constituintes químicos isolados de Abarema cochliacarpos
29
3.1.1. Elucidação estrutural dos esteróides 29
3.1.1.1. Determinação estrutural de ACC-1 29
3.1.1.2. Determinação estrutural de AC-6 37
3.1.1.3. Determinação estrutural de AC-7 42
3.1.2. Elucidação estrutural dos triterpenos 50
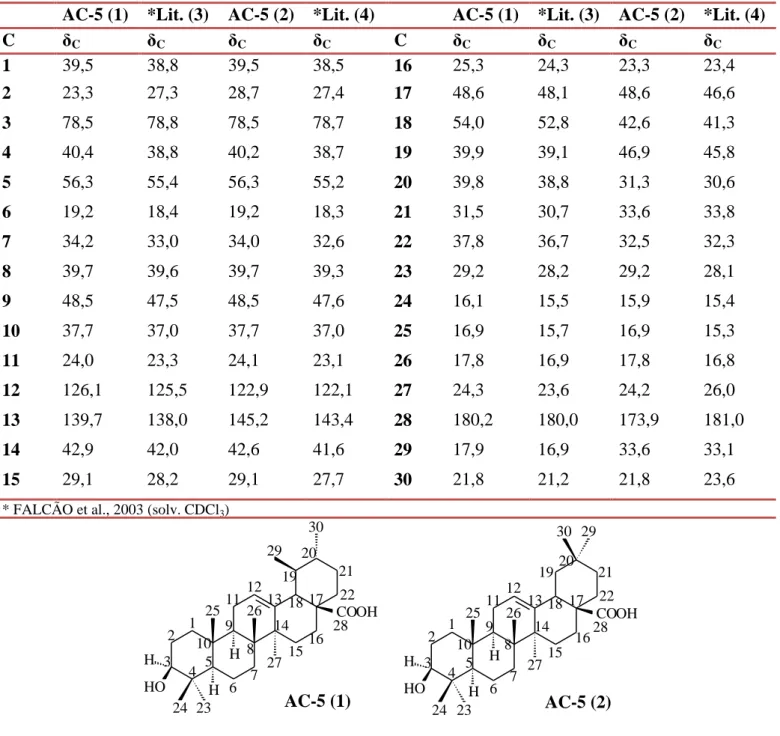
3.1.2.1. Determinação estrutural de AC-5 50
3.1.3. Elucidação estrutural dos flavonóides 55
3.1.3.2. Determinação estrutural de AC-1 63
3.1.3.3. Determinação estrutural de AC-4 69
3.1.3.4. Determinação estrutural de AF-2 77
3.1.4. Elucidação estrutural dos derivados polihidroxilados do ácido benzóico 85
3.1.4.1. Determinação estrutural de AC-2 85
3.1.4.2. Determinação estrutural de AF-1 90
3.2. Elucidação estrutural dos constituintes químicos isolados de Calliandra depauperata
95
3.2.1. Elucidação estrutural dos flavonóides 95
3.2.1.1. Determinação estrutural de CD-5 95
3.2.1.2. Determinação estrutural de CD-6 103
3.2.1.3 Determinação estrutural de CD-7 111
3.2.2. Elucidação estrutural dos diterpenos 120
3.2.2.1. Determinação estrutural de CD-1 120
3.2.2.2. Determinação estrutural de CD-4 128
3.2.2.3. Determinação estrutural de CD-3 135
3.2.3. Elucidação estrutural dos ésteres graxos 143
3.2.3.1. Determinação estrutural de CD-8 143
3.2.3.2. Determinação estrutural de CD-2 150
CAPÍTULO 4-PARTE EXPERIMENTAL 157
4.1. Métodos Cromatográficos 157
4.1.1. Cromatografia de adsorção 157
4.1.2. Cromatografia líquida de exclusão molecular 158
4.1.3. Cromatografia líquida de alta eficiência (CLAE) 158
4.2. Métodos Espectroscópicos 158
4.2.1. Ponto de fusão 159
4.2.3. Espectroscopia de ressonância magnética nuclear (RMN) 159
4.2.4. Espectroscopia na região de infravermelho (IV) 160
4.3. Material Botânico de Abarema. cochliacarpos 160
4.4. Isolamento dos Constituintes não voláteis Químicos de Abarema. cochliacarpos
160
4.4.1. Obtenção dos extratos 160
4.4.2. Fracionamento cromatográfico de EECCA, EECA e EEFA 161
4.4.3. Isolamento do constituinte químico ACC-1 161
4.4.4. Isolamento do constituinte químico ACC-2 162
4.4.5. Isolamento dos constituintes químicos AC-1, AC-2, AC-3 e AC-4 162 4.4.6. Isolamento dos constituintes químicos AC-5, AC-6 e AC-7 165 4.4.7. Isolamento dos constituintes químicos AF-1 e AF-2 166
4.5. Material botânico de Calliandra depauperata 168
4.6. Isolamento dos constituintes não voláteis de C. depauperata 168
4.6.1. Obtenção dos extratos 168
4.6.2 Tratamento cromatográfico do extrato etanólico das raízes de C.depauperata (EECD)
169
4.6.3. Isolamento dos metabólitos secundários de C. depauperata 169
CONCLUSÃO 176
CONSTANTES FÍSICAS E DADOS ESPECTROMÉTRICOS 179
LISTAS DE FIGURAS
Figura 01. Abarema cochliacarpos (Gomes) Barneby & J.W.Grimes. (a) Folhas, (b) Folhas e Fruto, (c) Fruto e (d) Flores. Fotos: Prof. Edilberto R. Silveira.
8
Figura 02. Fotos de Calliandra depauperata. A - Habitat natural; B - Inflorescência e folhas; C - Folhas. Fotos: Prof. Edilberto R. Silveira.
10
Figura 03. Espectro de absorção na região de infravermelho de ACC-1. 33 Figura 04. Espectro de RMN 1H (500 MHz, CDCl3) e expansão de ACC-1. 33
Figura 05. Espectro de RMN 13C (125 MHz, CDCl3) de ACC-1. 34
Figura 06. Espectro de RMN 13C-DEPT 135° (125 MHz, CDCl3) de ACC-1. 34
Figura 07. Mapa de contorno HSQC (500 e 125 MHz, CDCl3) de ACC-1. 35
Figura 08. Mapa de contorno HSQC (500 e 125 MHz, CDCl3) de ACC-1. 35
Figura 09. Espectro de massas de ACC-1. 36
Figura 10. Espectro de absorção na região de infravermelho de AC-6. 40 Figura 11. Espectro de RMN 1H (500 MHz, C5D5N) e expansões de AC-6. 40
Figura 12. Espectro de RMN 13C (125 MHz, C5D5N) de AC-6. 41
Figura 13. Espectro de RMN 13C-DEPT 135° (125 MHz, C5D5N) de AC-6. 41
Figura 14. Estruturas parciais obtidas para AC-7. 43
Figura 15. Principais correlações a mais de uma ligação (1H, 13C-HMBC) observadas para AC-7.
44
Figura 16. Espectro de absorção na região de infravermelho de AC-7. 46
Figura 17. Espectro de RMN 1H (500 MHz, CDCl3) de AC-7. 46
Figura 18. Espectro de RMN 13C (125 MHz, CDCl3) de AC-7. 47
Figura 19. Espectro de RMN 13C-DEPT 135° (125 MHz, CDCl3) de AC-7. 47
Figura 20. Mapa de contorno HSQC (500 e 125 MHz, CDCl3) de AC-7. 48
Figura 21. Mapa de contorno HMBC (500 e 125 MHz, CDCl3) de AC-7. 48
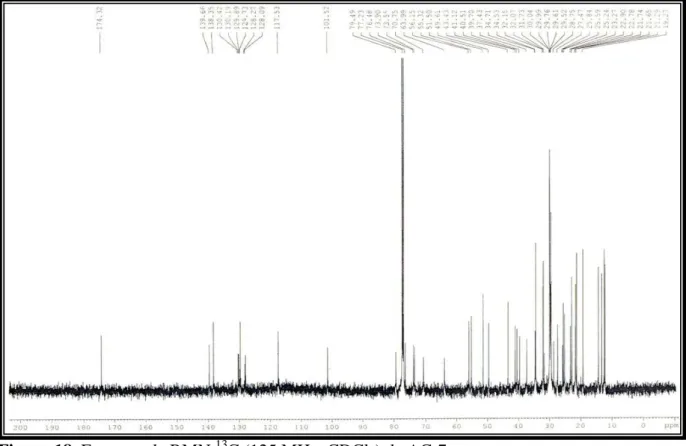
Figura 24. Espectro de RMN 1H (500 MHz, C5D5N) e expansão de AC-5. 52
Figura 25. Espectro de RMN 13C (125 MHz, C5D5N) de AC-5. 53
Figura 26. Espectro de RMN 13C-DEPT 135° (125 MHz, C5D5N) de AC-5. 53
Figura 27. Espectro de massas de AC-5. 54
Figura 28. Estruturas parciais deduzidas através do experimento de RMN 1H para ACC-2.
55
Figura 29. Estruturas parciais deduzidas através do experimento de RMN 1H para ACC-2.
57
Figura 30. Espectro de absorção na região de infravermelho de ACC-2. 59
Figura 31. Espectro de RMN 1H (500 MHz, CD3OD) de ACC-2 59
Figura 32. Espectro de RMN 13C (125 MHz, CD3OD) de ACC-2. 60
Figura 33. Espectro de RMN 13C-DEPT 135° (125 MHz, CD3OD) de ACC-2. 60
Figura 34. Espectro 1H, 1H-COSY (125 MHz, CD3OD) de ACC-2. 61
Figura 35. Mapa de contorno HMBC (500 e 125 MHz, CD3OD) de ACC-2. 61
Figura 36. Mapa de contorno HSQC (500 e 125 MHz, CD3OD) de ACC-2. 62
Figura 37. Espectro de massas de ACC-2. 62
Figura 38. Espectro de absorção na região de infravermelho de AC-1. 66 Figura 39. Espectro de RMN 1H (500 MHz, CD3OD) e expansões de AC-1. 66
Figura 40. Espectro de RMN 1H (500 MHz, CD3OD) e expansões de AC-1. 67
Figura 41. Espectro de RMN 13C-DEPT 135° (125 MHz, CD3OD) de AC-1. 67
Figura 42. Espectro de massas de AC-1. 68
Figura 43. Estruturas parciais obtidas pelo experimento de RMN 1H para AC-4. 69 Figura 44. Principais correlações a mais de uma ligação observadas no espectro
HMBC para AC-4.
71
Figura 45. Espectro de absorção na região de infravermelho de AC-4. 73 Figura 46. Espectro de RMN 1H (500 MHz, CD3OD) e expansões de AC-4. 73
Figura 47. Espectro de RMN 1H (500 MHz, CD3OD) e expansões de AC-4. 74
Figura 49. Espectro 1H, 1H-COSY (500 MHz, CD3OD) de AC-4. 75
Figura 50. Mapa de contorno HSQC (500 e 125 MHz, CD3OD) de AC-4 75
Figura 51. Mapa de contornos HMBC (500 e 125 MHz, CD3OD) de AC-4. 76
Figura 52. Mapa de contornos HMBC (500 e 125 MHz, CD3OD) de AC-4. 76
Figura 53. Estruturas parciais obtidas pelo experimento de RMN 1H para AF-2. 77 Figura 54. Principais correlações a mais de uma ligação (1H, 13C-HMBC) observados
para AF-2.
79
Figura 55. Espectro de absorção na região de infravermelho de AF-2. 81 Figura 56. Espectro de RMN 1H (500 MHz, CD3OD) e expansões de AF-2. 81
Figura 57. Espectro de RMN 13C (125 MHz, CD3OD) de AF-2. 82
Figura 58. Espectro de RMN 13C-DEPT 135° (125 MHz, CD3OD) de AF-2. 82
Figura 59. Espectro 1H, 1H-COSY (500 MHz, CD3OD) de AF-2. 83
Figura 60. Espectro 1H, 1H-COSY (500 MHz, CD3OD) de AF-2. 83
Figura 61. Espectro de massas de AF-2. 84
Figura 62. Espectro de absorção na região de infravermelho de AC-2. 87
Figura 63. Espectro de RMN 1H (500 MHz, CD3OD) de AC-2. 87
Figura 64. Espectro de RMN 13C (125 MHz, CD3OD) de AC-2. 88
Figura 65. Espectro de RMN 13C-DEPT 135° (125 MHz, CD3OD) de AC-2 88
Figura 66. Espectro de massas de AC-2. 89
Figura 67. Espectro de absorção na região de infravermelho de AF-1. 92 Figura 68. Espectro de RMN 1H (500 MHz, CD3OD) e expansões de AF-1. 92
Figura 69. Espectro de RMN 13C (125 MHz, CD3OD) de AF-1. 93
Figura 70. Espectro de RMN 13C-DEPT 135° (125 MHz, CD3OD) de AF-1. 93
Figura 71. Espectro de massas de AF-1. 94
Figura 72. Estruturas parciais obtidas através experimento de RMN 1H para CD-5. 95 Figura 73 Principais correlações a mais de uma ligação (1H, 13C-HMBC) observadas
para CD-5.
97
Figura 75 Espectro de RMN 1H (500 MHz, C5 D5N) de CD-5. 99
Figura 76 Espectro de RMN 13C (125 MHz, C5 D5N) de CD-5. 100
Figura 77 Espectro de RMN 13C-DEPT 135° (125 MHz, C5 D5N) de CD-5. 100
Figura 78 Mapas de contorno HMBC (500 e 125 MHz, C5 D5N) de CD-5. 101
Figura 79 Mapas de contorno HSQC (500 e 125 MHz, C5 D5N) de CD-5. 101
Figura 80 Mapas de contorno HSQC (500 e 125 MHz, C5 D5N) de CD-5. 102
Figura 81 Principais correlações a mais de uma ligação (1H, 13C-HMBC) observadas para CD-6.
105
Figura 82 Espectro de absorção na região de infravermelho de CD-6. 107 Figura 83 Espectro de RMN 1H (500 MHz, CD3OD) e expansão de CD-6. 107
Figura 84 Espectro de RMN 13C (125 MHz, CD3OD) de CD-6. 108
Figura 85 Espectro de RMN 13C-DEPT 135° (125 MHz, CD3OD) de CD-6. 108
Figura 86 Espectro 1H, 1H-COSY (125 MHz, CD3OD) de CD-6. 109
Figura 87 Mapas de contorno HMBC (500 e 125 MHz, CD3OD) de CD-6. 109
Figura 88 Mapas de contorno HSQC (500 e 125 MHz, CD3OD) de CD-6 110
Figura 89 Espectro de massas de alta resolução (EMAR) de CD-6. 110 Figura 90 Principais correlações a mais de uma ligação (1H, 13C-HMBC) observadas
para CD-7.
113
Figura 91 Espectro de absorção na região do infravermelho de CD-7. 115 Figura 92 Espectro de RMN 1H (500 MHz, C5D5N) de CD-7. 115
Figura 93 Espectro de RMN 13C (125 MHz, C5D5N) de CD-7. 116
Figura 94 Espectro de RMN 13C-DEPT 135° (125 MHz, C5D5N) de CD-7. 116
Figura 95 Espectro 1H, 1H-COSY (125 MHz, C5D5N) de CD-7. 117
Figura 96 Mapas de contorno HSQC (500 e 125 MHz, C5D5N) de CD-7. 117
Figura 97 Mapas de contorno HMBC (500 e 125 MHz, C5D5N) de CD-7. 118
Figura 98 Mapas de contorno HMBC (500 e 125 MHz, C5D5N) expansão de CD-7. 118
Figura 99 Mapas de contorno HMBC (500 e 125 MHz, C5D5N) expansão de CD-7. 119
Figura 101 Principais correlações a mais de uma ligação (1H, 13C-HMBC) observadas para CD-1.
122
Figura 102 Espectro de absorção na região do infravermelho de CD-1. 124 Figura 103 Espectro de RMN 1H (500 MHz, CDCl3) de CD-1. 124
Figura 104 Espectro de RMN 13C (125 MHz, CDCl3) de CD-1. 125
Figura 105 Espectro de RMN 13C (125 MHz, CDCl3) de CD-1. 125
Figura 106 Espectro 1H, 1H-COSY (125 MHz, CDCl3) de CD-1. 126
Figura 107 Mapas de contorno HSQC (500 e 125 MHz, CDCl3) de CD-1. 126
Figura 108 Mapas de contorno HMBC (500 e 125 MHz, CDCl3) de CD-1. 127
Figura 109 Espectro de massas de alta resolução (EMAR) de CD-1. 127 Figura 110 Acoplamentos à longa distância (1H, 13C-HMBC) observados para CD-4. 129 Figura 111 Espectro de RMN 1H (500 MHz, CD3OD) de CD-4. 131
Figura 112 Espectro de RMN 13C (125 MHz, CD3OD) e expansão de CD-4. 131
Figura 113 Espectro de RMN 13C-DEPT 135° (125 MHz, CD3OD) de CD-4. 132
Figura 114 Espectro 1H, 1H-COSY (125 MHz, CD3OD) de CD-4. 132
Figura 115 Mapas de contorno HSQC (500 e 125 MHz, CD3OD) de CD-4. 133
Figura 116 Mapas de contorno HMBC (500 e 125 MHz, CD3OD) de CD-4. 133
Figura 117 Espectro de massas de alta resolução (EMAR) de CD-4. 134 Figura 118 Principais correlações a mais de uma ligação (1H, 13C-HMBC) observados
para CD-3.
137
Figura 119 Espectro de absorção na região do infravermelho de CD-3. 139 Figura 120 Espectro de RMN 1H (500 MHz, CD3OD) e expansões de CD-3. 139
Figura 121 Espectro de RMN 13C (125 MHz, CD3OD) e expansões de CD-3. 140
Figura 122 Espectro de RMN 13C-DEPT 135° (125 MHz, CD3OD) de CD-3. 140
Figura 123 Espectro 1H, 1H-COSY (125 MHz, CD3OD) de CD-3. 141
Figura 124 Mapas de contorno HSQC (500 e 125 MHz, CD3OD) de CD-3. 141
Figura 125 Mapas de contorno HMBC (500 e 125 MHz, CD3OD) de CD-3. 142
Figura 127 Acoplamentos a longa distância (1H, 13C-HMBC) de CD-8. 144 Figura 128 Espectro de absorção na região do infravermelho de CD-8. 146 Figura 129 Espectro de RMN 1H (500 MHz, C5D5N) e expansão de CD-8. 146
Figura 130 Espectro de RMN 13C (125 MHz, C5D5N) de CD-8. 147
Figura 131 Espectro de RMN 13C-DEPT 135° (125 MHz, C5D5N) de CD-8. 147
Figura 132 Espectro 1H, 1H-COSY (125 MHz, C5D5N) de CD-8. 148
Figura 133 Mapas de contorno HSQC (500 e 125 MHz, CD3OD) de CD-8. 148
Figura 134 Mapas de contorno HMBC (500 e 125 MHz, CD3OD) de CD-8. 149
Figura 135 Espectro de massas de alta resolução (EMAR) de CD-8. 149 Figura 136 Acoplamentos a longa distância (1H,13C-HMBC) de CD-2. 151 Figura 137 Espectro de absorção na região do infravermelho de CD-2. 153 Figura 138 Espectro de RMN 1H (500 MHz, C5D5N) e expansão de CD-2. 153
Figura 139 Espectro de RMN 13C (125 MHz, C5D5N) de CD-2. 154
Figura 140 Espectro de RMN 13C-DEPT 135° (125 MHz, C5D5N) de CD-2. 154
Figura 141 Espectro 1H, 1H-COSY (125 MHz, C5D5N) de CD-2. 155
Figura 142 Mapas de contorno HSQC (500 e 125 MHz, C5D5N) de CD-2. 155
Figura 143 Mapas de contorno HMBC (500 e 125 MHz, C5D5N) de CD-2. 156
Figura 144 Espectro de massas de alta resolução (EMAR) de CD-2. 156 Figura 145 Cromatogramas obtidos a partir das frações (a) 7/10, (b) 11/21 e (c) 31/49. 164
Figura 146 Cromatograma obtido a partir da fração 39/51. 168
LISTA DE TABELAS
Tabela 01. Relação dos constituintes químicos isolados e das espécies de Calliandra investigadas.
13
Tabela 02. Estrutura dos flavonóides isolados de Calliandra 17
Tabela 03. Estrutura das saponinas triterpênicas isoladas de Calliandra. 20
Tabela 04. Estrutura dos terpenóides isolados de Calliandra. 26
Tabela 05. Estrutura dos aminoácidos isolados de Calliandra. 27
Tabela 06. Estrutura dos derivados fenólicos isolados de Calliandra. 27 Tabela 07. Estruturas dos compostos fenólicos identificados por espectrometria de massas de
alta resolução (DART) de C. calothyrsus.
28
Tabela 08. Principais constituintes voláteis de C. tweedi Benth e C. haematocephala. 28 Tabela 09. Padrão de hidrogenação dos carbonos determinado através da análise comparativa
entre os espectros de RMN 13C-CPD e DEPT 135° de ACC-1.
30
Tabela 10. Deslocamentos químicos (δ) de RMN 13C (125 MHz, CDCl3) de ACC-1. 32
Tabela 11. Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de AC-6.
38
Tabela 12. Deslocamentos químicos (δ) de RMN 13C (125 MHz, C5D5N) de AC-6. 39
Tabela 13. Deslocamentos químicos (δ) de RMN 13C (125 MHz, CDCl3) de AC-7. 45
Tabela 14. Deslocamentos químicos (δ) de RMN 13C (125 MHz, C5D5N) de AC-5. 51
Tabela 15. Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de ACC-2.
56
Tabela 16. Deslocamentos químicos (δ) de RMN 1H (500 MHz, CD3OD) e 13
C (125 MHz, CD3OD) de ACC-2.
58
Tabela 17 Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de AC-1.
64
Tabela 18 Deslocamentos químicos (δ) de RMN 1H (500 MHz, CD3OD) e 13
C (125 MHz, CD3OD) de AC-1.
65
Tabela 19 Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de AC-4.
70
Tabela 20 Deslocamentos químicos (δ) de RMN 1H (500 MHz, CD3OD) e 13
C (125 MHz, CD3OD) de AC-4.
Tabela 21 Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de AF-2.
78
Tabela 22 Deslocamentos químicos (δ) de RMN 1H (500 MHz, CD3OD) e 13
C (125 MHz, CD3OD) de AF-2.
80
Tabela 23 Deslocamentos químicos (δ) de RMN 1H (500 MHz, CD3OD) e 13
C (125 MHz, CD3OD) de AF-2.
86
Tabela 24 Deslocamentos químicos de RMN 13C (125 MHz, CD3OD) e 1
H (500 MHz, CD3OD) de AF-1.
91
Tabela 25 Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de CD-5.
96
Tabela 26 Deslocamentos químicos (δ) de RMN 1H (500 MHz, CD3OD) e 13
C (125 MHz) de CD-5.
98
Tabela 27 Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de CD-6.
104
Tabela 28 Deslocamentos químicos (δ) de RMN 1H (500 MHz, CD3OD) e 13
C (125 MHz, CD3OD) de CD-6.
106
Tabela 29 Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de CD-7.
112
Tabela 30 Deslocamentos químicos (δ) de RMN 1H (500 MHz, C5D5N) e 13
C (125 MHz, C5D5N) de CD-7.
114
Tabela 31 Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de CD-1.
120
Tabela 32 Deslocamentos químicos (δ) de RMN 1H (500 MHz, CD3OD) e 13
C (125 MHz, CD3OD) de CD-1.
123
Tabela 33 Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de CD-4.
128
Tabela 34 Deslocamentos químicos (δ) de RMN 1H (500 MHz, CD3OD) e 13
C (125 MHz, CD3OD) de CD-4.
130
Tabela 35 Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de CD-3.
135
Tabela 36 Deslocamentos químicos (δ) de RMN 1H (500 MHz, CD3OD) e 13
C (125 MHz, CD3OD) de CD-3.
138
Tabela 37 Deslocamentos químicos (δ) de RMN 13C (125 MHz, C5D5N) de CD-8. 145
Tabela 38 Deslocamentos químicos (δ) de RMN 13C (125 MHz, C5D5N) de CD-2. 152
LISTA DE FLUXOGRAMAS
LISTA DE QUADROS
cochiliacarpos.
Tabela 41 Dados referentes ao fracionamento cromatográfico de EECCA. 162 Tabela 42 Dados referentes ao fracionamento cromatográfico de EECAD.o 166 Tabela 43 Dados referentes ao fracionamento cromatográfico da fração 3. 166
Tabela 44 Dados referentes ao fracionamento cromatográfico de EEFAA. 167
Tabela 45 Dados referentes à obtenção dos extratos C. depauperata. 168
Tabela 46 Dados referentes ao fracionamento cromatográfico de EECD. 169
Tabela 47 Dados referentes ao fracionamento cromatográfico de EECDD. 170
Tabela 48 Dados referentes ao fracionamento cromatográfico das frações IV. 172
Tabela 49 Dados referentes ao fracionamento cromatográfico de Fr:V. 174
Fluxograma 01. Dados referentes ao fracionamento cromatográfico de EECAA
164
Fluxograma 02. Isolamento dos constituintes químicos obtidos do extrato etanólico das raízes de C. depauperata
175
Quadro 1. Estrutura dos constituintes químicos isolados de Abarema cochiliacarpos.
177
Quadro 2. Estrutura dos constituintes químicos isolados de Calliandra depauperata.
LISTA DE ABREVIATURAS E SÍMBOLOS
δ Deslocamento químico em ppm
ABNT Associação Brasileira de Normas Técnicas
CC Cromatografia em coluna
CCD Cromatografia em camada delgada
CENAUREMN Centro Nordestino de Aplicação e Uso da Ressonância Magnética Nuclear CLAE Cromatografia Líquida de Alta Eficiência
COSY Correlation Spectroscopy
CPD Composite Pulse Decoupling
DART Direct Analysis in Real Time
DEPT Distortionless Enhancement by Polarization Transfer
EM Espectrometria de massas
EMAR Espectrometria de massa de alta resolução IES Ionização por Eletrospray
FM Fórmula molecular
HMBC Heteronuclear Multiple Bond Connectivity HSQC Heteronuclear Single Quantum Coherence
IV Infravermelho
J Constante de acoplamento
LEMANOR Laboratório de Espectrometria de Massas do Nordeste NOESY Nuclear Overhauser Effect Spectroscopy
OMS Organização Mundial de Saúde
P.A. Pro analyse
PM Peso molecular
Rf Índice de retenção
RMN 13C Ressonância Magnética Nuclear de Carbono-13 RMN 1H Ressonância Magnética Nuclear de Hidrogênio
RESUMO
Este trabalho descreve a investigação química de plantas dos gêneros Abarema e Calliandra, ambas pertencentes à família Leguminosae. A prospecção química de Abarema cochliacarpos culminou no isolamento de 11 substâncias, enquanto de Calliandra depauperata foram isolados 10 compostos. Dos extratos etanólicos das diversas partes de A. cochliacarpos (madeira do caule, casca do caule e folhas) foram isolados e caracterizados os esteróides: espinasterol, 3-O-ί -D-glicopiranosil-espinasterol e 3-O-ί-D-(6’-O-dodecanoil)-glicopiranosil-espinasterol; a mistura dos triterpenos ácido oleanóico e ácido ursólico; os flavonóides catequina, taxifolina,
miricetrina e γ’,4’,7,8-tetrahidroxiflavonol, além do ácido gálico e galato de etila. O composto 3-O-ί-D-(6’-O-dodecanoil)-glicopiranosil-espinasterol esta sendo registrado pela primeira vez. Do extrato etanólico das raízes de C. depauperata isolou-se os flavonóides 5-metoxi-γ’,4’,7-trihidroxiflavona; γ’,4’,7-trihidroxiflavona e 4’,6’,7 -trimetoxi-γ’-hidroxiflavonaν os diterpenos de esqueletos cassano 7ί,17 -dihidroxi-12-oxo-cassan-13,15-dieno; 15,16-bisnor-7ί,17-dihidroxi-12-oxo-cassan-13-eno e depauperatina, além dos ésteres graxos: tetracosanodioato de bis-(2,3-dihidroxipropila); docosanodioato de bis-(2,3-dihidroxipropila); 24-hidroxi-tetracosanoato de 2,3-dihidroxipropila e 26-hidroxi-hexacosanoato de
2,3-dihidroxipropila. Os compostos 4’,6’,7-trimetoxi-γ’-hidroxiflavona;
ABSTRACT
This work describes the chemical investigation of plants from the genera Abarema and Calliandra both belonging to Leguminosae family. The chemical prospection of Abarema cochliacarpos resulted in the isolation of 11 substances while from Calliandra depauperata was isolated 10 compounds. From EtOH extracts of different parts of A. cochliacarpos (wood, wood bark and leaves) were isolated and characterizated of steroids: spinasterol, 3-O-ί-D-glucopiranosyl-spinasterol and 3-O-ί-D-(6’ -O-dodecanoil)-glucopiranosyl-spinasterol), the mixture triterpenes oleanolic and ursolic acids; the flavonoids catechin, taxifolin, miricetrin and γ’,4’,7,8-tetrahydroxyflavonol, besides of galic acid and ethyl galate. Compound 3-O-ί-D-(6’ -O-dodecanoil)-glucopiranosyl-spinasterol) was isolated for the firs time. From roots EtOH extract of C. depauperata were isolated the flavonoids 5-methoxy-γ’,4’,7-trihydroxyflavoneν γ’,4’,7
-trihydroxyflavone and 4’,6’,7-trimethoxy-γ’-hydroxyflavone; the cassane diterpenes: 7ί,17-dihydroxy-12-oxo-cassan-13,15-diene, 15,16-bisnor-7ί ,17-dihydroxy-12-oxo-cassan-13-ene and depauperatin, besides the fatty esters bis-(2,3-dihydroxypropil) tetracosanodioate, bis-(2,3-dihydroxypropil) docosanodioate, 24-hydroxy-tetracosanoate-2,3-dihydroxypropil and
Introdução
INTRODUÇÃO
Atualmente, as plantas constituem a maior fonte para a obtenção de compostos bioativos. Segundo a Organização Mundial de Saúde (OMS) cerca de 80% da população mundial busca na medicina popular meios para o alívio de alguma sintomatologia dolorosa ou desagradável. Aproximadamente 11% das drogas consideradas básicas e essenciais pela OMS são produzidas exclusivamente por plantas medicinais, além disto, um grande número de drogas foi desenvolvido a partir de fontes naturais [DA SILVA et al., 2010a; SANTOS et al., 2007]. Considerando que a maior parte da flora medicinal é ainda desconhecida, tanto do ponto de vista químico como farmacológico, a seleção de plantas a partir de informações da medicina tradicional, tem se mostrado de grande eficácia, uma vez que, muitos dos metabólitos secundários obtidos de plantas apresentam relevantes atividades biológicas muitos dos quais têm sido utilizados pela indústria farmacêutica [DA SILVA et al., 2006].
A família Leguminosae Adans. (Fabaceae) é conhecida por sua grande importância econômica. As plantas pertencentes a esta família são utilizadas na alimentação humana e animal, forrageamento, marcenaria, como medicinal, combustível, pesticida, corante, goma, óleo ou ornamental. Ecologicamente, possui grande valor devido à capacidade de fixar nitrogênio, associando-se ao Rhizobium e ao Bradyrhizobium, formando nódulos nas raízes que propiciam diversas estratégias para o aumento do fornecimento de nutrientes, tornando-as pioneiras em solos pouco férteis. A família Leguminosae é subdividida em três subfamílias distintas, Caesalpinioideae, Papilionoideae e Mimosoideae. Esta última é constituída por sessenta gêneros, dentre os quais, os gêneros Abarema e Calliandra [DUTRA et al., 2008].
Introdução
Com distribuição exclusivamente neotro;pical, o gênero Calliandra é composto por 132 espécies e, apresenta como um dos principais centros de diversidade a Chapada da Diamantina, onde ocorrem 40 espécies, sendo 30 delas endêmicas desta região [SOUZA et al., 2004]. Algumas espécies pertencentes ao gênero Calliandra são utilizadas na medicina tradicional no tratamento de doenças renais e malaria. São ainda empregadas como antifebril [TAKEDA et al., 1993], laxativo [ORISHADIPE et al., 2010], inflamações da próstata e dores de dentes [ENCARNACIÓN-DIMAYUGA et al., 2006]. A literatura relata ainda diversas atividades biológicas atribuídas a extratos de espécies do gênero Calliandra como: analgésica [AGNU et al., 2005], antimicrobiana [ORISHADIPE et al., 2010; ENCARNACIÓN-DIMAYUGA, 1994], antibacteriana [NIA et al., 1999], antioxidante [MOHARRAM et al., 2006], inseticida [ROMEO, 1984], antituberculose e citotóxica [ENCARNACIÓN-DIMAYUGA et al., 2006], atividade hemolítica e adjuvantes contra o antígeno da ovoalbumina [BARBOSA et al., 2008].
De acordo com levantamento bibliográfico realizado no “Sci Finder® ScholarTM” envolvendo o gênero Abarema, não foi encontrado qualquer relato sobre o isolamento de compostos envolvendo plantas do gênero. Entretanto, para o gênero Calliandra, foram encontrados relatos sobre a investigação química de 11 espécies, com destaque para C. haematocephala e C. anomala. Não foram encontrados relatos para as espécies Abarema cochliacarpos e Calliandra depauperata, ressaltando assim a relevância da investigação química na contribuição ao conhecimento químico das espécies e dos gêneros em questão.
Para o isolamento dos compostos utilizou-se técnicas cromatográficas clássicas como cromatografia de adsorção, utilizando gel de sílica, cromatografia por exclusão molecular empregando Sephadex LH-20, além de cromatografia líquida de alta eficiência (CLAE).
A determinação estrutural foi realizada através do uso de técnicas espectrométricas como infravermelho (IV), ressonância magnética nuclear de hidrogênio (RMN 1H) e carbono- 13 (RMN 13C), incluindo técnicas bidimensionais como COSY, HSQC, HMBC e NOESY, e espectrometria de massa (EM).
Introdução
Capítulo 1-Considerações gerais e botânicas
1. CONSIDERAÇÕES GERAIS E BOTÂNICAS
1.1. Família Leguminosae e a Tribo Mimosoideae
A família Leguminosae, também conhecida como Fabaceae, é a terceira maior família das Angiospermas, depois das Asteraceae e Orchidaceae. São aproximadamente 19.400 espécies em mais de 730 gêneros, pertencendo boa parte originalmente à flora Brasileira. Estão amplamente distribuídas nas zonas tropicais e subtropicais, estendendo-se ainda às regiões temperadas [IGANCI & MORIM, 2009].
As plantas dessa família possuem folhas alternas e compostas, que podem ser pinadas, bipinadas, trifoliolares e digitadas. Há presença de estípulas que podem ser de tamanho variado, muitas vezes essa estípula é transformada em espinho. Na base da folha e dos folíolos existem articulações chamadas, respectivamente de pulvinos e pulvínulos, utilizados por algumas espécies do gênero Mimosa, para movimentar-se rapidamente em resposta a agentes externos. Suas flores são andrógenas, zigmórfas ou actinomorfas, heteroclamídeas. Com cálice gamossépalo ou raramente diassépalo, com prefloração, valvar ou imbricada. O androceu tipicamente apresenta dez estames, podendo apresentar maior ou menor número. O gineceu de ovário súpero, unicarpelar, uniocular, às vezes divididos por falsos septos é, em geral, multiovulado. O fruto é mais comumente do tipo legume, monocarpelar, seco e deiscente, mas às vezes pode ser indeiscente (Arachis), Sâmara (Machaerium), entre outros [BARROSO, 1991].
Capítulo 1-Considerações gerais e botânicas
A família Leguminosae é subdividida em três subfamílias distintas, cuja variação nos nomes se deve a coexistência atual de mais de um sistema de classificação [BARROSO, 1991; LIMA et al., 1994]
● Faboideae ou Papilionaceae – É constituída por 430 genêros e aproximadamente 12.600 espécies de ampla distribuição pelo mundo. É considerada a subfamília mais evoluída dentre as leguminosas, e também a de maior importância econômica. Dentre alguns exemplos mais representativos da família, podemos citar a soja (Glycine max), a ervilha (Pisum sativum), o feijão (Phaseolus vulgaris) e a alfafa (Medicago sativa);
● Caesalpinioideae ou Caesalpiniaceae – É constituída por 152 gêneros e aproximadamente 2.700 espécies distribuídas nas regiões tropicais e subtropicais. Entre as espécies mais conhecidas no Brasil, podemos citar a tamarindo (Tamarindus indica) e o pau-brasil (Caesalpinia echinata);
● Mimosoideae ou Mimosaceae – É constituída por 60 gêneros, incluindo os gêneros Abarema e Calliandra, e aproximadamente 3.000 espécies distribuídas em regiões tropicais, subtropicais e cálido-temperadas. Alguns exemplos mas representativos da subfamília incluem: faveiro (Albizia lebbeck), dormideira (Mimosa pudica) e ingá-do-brejo (Ingá uruguensis).
1.2. O gênero Abarema e a espécie Abarema cochliacarpos (Gomes) Barneby & J.
W. Grimes
O gênero Abarema (Mimosoideae) é formado por quarenta e nove espécies neotropicais, de hábito arbustivo ou arbóreo. No Brasil, ocorre principalmente em faixas da Mata Atlântica distribuídas pelos estados da Bahia e Paraíba, podendo ser encontrado na caatinga, no cerrado e em campos ruprestes, às vezes alcançando altitudes de até 1100 metros [SILVA et al., 2009].
Segundo Iganci & Morim, 2009, o gênero apresenta a seguinte descrição taxonômica:
Capítulo 1-Considerações gerais e botânicas
pinas em 1 a 10 pares opostos; oióculos sésseis, coriáceos a membranáceos, assimétricos, lanceolados, obovovados, oblongo-lanceolados ou rômbicos, com ou sem indumento, margem revoluta, venação camptódroma; nervura primária subcentral. Sinflorescências axilares; conflorescências homomórficas ou heteromórficas, racemos laxos, congestos ou capitados; bractéolas em geral decíduas; flores pentâmeras; subsésseis a pediceladas nas flores da base da influorecência e subsésseis nas flores do ápice da influorescência; cálice campanulado, verde, gamossépalo, glabro ou indumentado; corola verde, gamepétala, glabra ou indumentada; androceu com muitos estames, alvos, exsertos; filetes unidos em tubo incluso nas flores periféricas, incluso ou exserto nas flores diferenciadas; anteras rimosas; ovário súpero, subséssil, ápice truncado ou atenuado, glabro ou piloso, estigma puntiforme. Fruto legume, falcado a espiralado, valvas cartáceas, geralmente com endocarpo de coloração rubra; sementes bicolores, com plurograma aberto ou fechado, funículo persistente; embrião invaginado, axiliar e cripto-radicular; plúmula desenvolvida, diferenciada em pinas ou em pinas e folióculos.
No Brasil, são citadas, trinta espécies com centros de diversidade nas Florestas Amazônica e Pluvial [IGANCI & MORIM, 2009].
Capítulo 1-Considerações gerais e botânicas
em diversas regiões do Brasil, para o tratamento de feridas purulentas (cicatrizante), inflamações na pele (anti-inflamatório), no combate a leucorréias e blenorragias e como analgésico. Diversas atividades biológicas foram comprovadas em laboratório, dentre elas, cicatrizante, antiulcerogênica e analgésica [DA SILVA et al., 2010b; DA SILVA et al., 2010c; SILVA et al., 2009].
Segundo Iganci & Morim, 2009, a espécie A. cochliacarpos (Fig. 01, pág. 8), apresenta a seguinte descrição botânica:
Capítulo 1-Considerações gerais e botânicas
Capítulo 1-Considerações gerais e botânicas
1.3. O gênero Calliandra e a espécie Calliandra depauperata Benth.
Calliandra Benth. é um gênero pertencente a família Leguminosae e a subfamília Mimosoideae. A mais recente revisão taxonômica de todo o gênero foi realizada por Barneby (1998), que redefiniu seus limites excluindo os táxons da África e do subcontinente indiano de modo que, na presente circunscrição, o gênero é inteiramente neotropical. São descritas cento e trinta e duas espécies, com área de distribuição estendendo-se do sul dos Estados Unidos ao norte da Argentina. No Brasil, a Chapada Diamantina é um dos principais centros de diversidade de Calliandra, aonde ocorrem quarenta e duas espécies, sendo trinta e duas endêmicas desta região [SOUZA, 2001; SOUZA e QUEIROZ, 2004].
Calliandra depauperata (Fig. 02, pág. 10) é um arbusto típico de caatinga com ampla distribuição na Chapada Diamantina. Floresce nos meses de janeiro a maio, podendo frutificar nos meses de dezembro, fevereiro, abril e maio. Apresenta a seguinte descrição botânica [SOUZA, 2001]:
Capítulo 1-Considerações gerais e botânicas
cilíndrico, glabro, tubo ca. 0,8mm compr., lacínios deltóides, ca. 0,2mm compr.; corola infundibuliforme, glabra, tubo ca. 2mm compr., lacínios agudos, ca. 1mm compr.; estames vermelhos, estemonozone ca. 0,5 mm compr. tubo estaminal ca. 2mm compr., filetes livres por ca. 4mm compr.; nectário intraestaminal discóide ca.0,3mm; ovário obovado, glabro, ca. 1mm compr., estipitado, estipe ca. 2mm compr. estilete ca.3mm compr., estigma capitado. Legume linear-oblanceolado, ápice arredondado, base atenuada, ca. 4 x 0,7cm, valvas coriáceas, glabras. Semente oboval, ca. 4 x 2mm, testa óssea, ocre.
Figura 02. Fotos de Calliandra depauperata. A - Habitat natural; B - Inflorescência e
folhas; C - Folhas. Fotos: Prof. Edilberto R. Silveira.
A
B
Capítulo 2-Levantamento bibliográfico
2. LEVANTAMENTO BIBLIOGRÁFICO DOS CONSTITUINTES QUÍMICOS
ISOLADOS DE ESPÉCIES DO GÊNERO CALLIANDRA
Levantamento bibliográfico realizado no Sci Finder® ScholarTM abrangendo o período de 1970 a 2010, e sites como http://www.sciencedirect.com.br, revelou registros de estudos químicos para onze espécies do gênero Calliandra. Destas, as mais estudas foram C. haematocephala e C. anomala.
A investigação química de espécies do gênero Calliandra, resultou no isolamento de várias classes de metabólitos secundários, como por exemplo: flavonóides (18, 19, 22, 23, 38-40, 45-53, 55-65, 67, 71-73; Tabela 02, pág. 17), saponinas triterpênicas (5-17, 77; Tabela 03, pág. 20), terpenóides (20, 21, 31, 32, 41, 42; Tabela 04, pág. 26), aminoácidos (1-4, 33, 34, 43, 44, 74-76; Tabela 05, pág. 27) e
derivados fenólicos (35-37, 54, 66; Tabela 06, pág. 27). Também, por espectrometria de massas, usando as técnicas DART e ESI foram identificados a partir de C. calothyrsus diversos compostos fenólicos, incluindo cumarinas e flavonóides (24-29; Tabela 07, pág. 28).
A literatura descreve ainda o estudo dos constituintes voláteis do óleo essencial das flores de C. tweedii Benth (Tabela 08, pág. 28), que apresentou como constituintes
majoritáriosμ α-terpineol (78), salicilato de metila (69), eugenol (79), p-anisaldeído (80), 1,8-cineol (81) e limoneno (82) [LAMARQUE et al., 1998]. Do óleo essencial das partes aéreas de C. haematocephala, foram identificados o fitol (68), o cis-4-hexen-1-ol (70) e o salicilato de metila (69) [ABOU ZEID, 2006].
Capítulo 2-Levantamento bibliográfico
Ainda com base no levantamento bibliográfico, outra classe de metabólitos secundários bastante comuns são as saponinas triterpênicas (Tabela 03, pág. 20). Estas são conjugados de triterpenos e hidratos de carbono. As saponinas isoladas de espécies de Calliandra apresentam um núcleo triterpênico típico com unidades glicídicas associados a C-3 e/ou C-28. A principal característica destas saponinas é a presença de onoterpenos intercalados com as unidades de açúcar no C-28 [DA SILVA et al. 2005].
Estudos revelaram uma notória atividade antimicrobiana de C. californica atribuída à presença de flavonas [ENCARNACIÓN-DIMAYUGA et al., 1994]. Entretanto, a investigação química das raízes de C. californica resultou no isolamento de diterpenos de esqueletos tricíclicos do tipo cassano, revelando que a espécie contém outros compostos com potencial antimicrobiano. Esses compostos foram adicionalmente investigados e apresentaram promissora atividade citotóxica e antituberculose [ENCARNACIÓN-DIMAYUGA et al., 2006].
O ácido pipecólico (1) e seus derivados apresentam restrita distribuição nas plantas, contudo, o gênero Calliandra, apresenta uma vasta gama destes compostos [BLEECKER & ROMEO, 1983]. C. angustifolia e C. haematocephala contém muito destes aminoácidos (Tabela 05, pág. 27), e quando comparadas a outras plantas associadas, mostraram atividade contra insetos, revelando o potencial inseticida desses aminoácidos [ROMEO, 1984].
Capítulo 2-Levantamento bibliográfico
Tabela 01. Relação dos constituintes químicos isolados e das espécies de Calliandra investigadas.
Composto Espécies Parte
estudada
Referências
Ácido pipecólico (1) C. angustfolia Folhas ROMEO, 1984
Ácido trans-4-hidroxipipecólico (2) ″ ″ ″
Ácido cis-5-hidroxipipecólico (3) ″ ″ ROMEO, 1984;
BLEECER & ROMEO, 1981 Ácido 2,4-trans-4,5-trans
-4,5-dihidroxipipecólico (4)
″ ″ ″
Calliandra saponina A (5) C. anomala Ramos TAKEDA et al., 1993
Calliandra saponina B (6) ″ ″ ″
Calliandra saponina C (7) ″ ″ NAKAMURA, TAKEDA e
OGIAHARA, 1994
Calliandra saponina D (8) ″ ″ ″
Calliandra saponina E (9) ″ ″ ″
Calliandra saponina F (10) ″ ″ ″
Calliandra saponina G (11) ″ ″ TANI et al., 1996
Calliandra saponina H (12) ″ ″ ″
Calliandra saponina I (13) ″ ″ ″
Calliandra saponina J (14) ″ ″ ″
Calliandra saponina K (15) ″ ″ ″
Calliandra saponina L (16) ″ ″ ″
Brevifoliasaponina (17) C. brevifolia ″ BARBOSA, DA SILVA E
PARENTE, 2008
β’,4’,5’,7-Tetrametoxiflavona (18) C. californica Raízes ENCARNACIÓN-D. et al., 1994
5-hidroxi-β’,4’,5’,7-Tetrametoxiflavona (19) ″ ″ ″
Escobarina A (20) ″ ″ ENCARNACIÓN-D. et al., 2006
Escobarina B (21) ″ ″ ″
3-O-α-L-ramnopiranosil-7-metoxi-5,γ’,4’ -trihidroxiflavona (22)
C. calothyrsus Folhas MORENO-MURILLO et al., 2008
3-O-α-L-ramnopiranosil-5,7,γ’,4’ -tetrahidroxiflavona (23)
″ ″ ″
Ácido gálico (24) ″ ″ ″
Dihidroxicumarina (25) ″ ″ ″
Capítulo 2-Levantamento bibliográfico
Tabela 01. cont.
Composto Espécies Parte
estudada
Referências
Catequina (27) ″ ″ ″
Quercetina (28) C. calothyrsus Folhas MORENO-MURILLO et al.,
2008
Dihidroquercetina (29) ″ ″ ″
C14H11O10 (30) ″ ″ ″
Eriofilal (31) C. eriophylla Raízes ANAM, 1999
Eriofolalol (32) ″ ″ ″
Ácido 2,4-trans-4,5-cis -4,5-dihidroxipipecólico (33)
C. haematocephala - MARLIER, DARDENNE e CASIMIR, 1972
2S,4R-carboxi-2-acetilamino-4-piperidina (34) ″ Folhas MARLIER, DARDENNE e CASIMIR, 1979
Ácido p-hidroxibenzóico (35) ″ Caule NIA et al., 1999
Ácido caféico (36) ″ ″ ″
Ácido protecatecuíco (37) ″ ″ ″
Astilbina (38) ″ ″ ″
neo-Isoastilbina (39) ″ ″ ″
Catequina-3-O-raminosídeo (40) ″ ″ ″
Lupeol (41) ″ ″ ″
Ácido betulínico (42) ″ ″ ″
Ácido pipecólico (1) ″ Folhas ROMEO, 1984
Ácido trans-4-hidroxipipecólico (2) ″ ″ ″
Ácido trans-5-hidroxipipecólico (43) ″ ″ ″
Ácido 2,4-trans-4,5-trans -4,5-dihidroxipipecólico (4)
″ ″ ″
Ácido trans-acetilaminopipecólico (44) ″ ″ ″
Quercetina (45) ″ ″ ABOU ZEID et al., 2006
Camferol (46) ″ ″ ″
Miricetina (47) ″ ″ ″
Miricetina 3-O-(β”,γ”-di-O-galoil)-α -ramnopiranosídeo (48)
″ ″ ″
Camferol 3-O-(β”,γ”-O-galoil)-α -ramnopiranosídeo (49)
″ ″ ″
Quercetina 3-O- α-ramnopiranosídeo (50) ″ ″ ″
Capítulo 2-Levantamento bibliográfico
Tabela 01. cont.
Composto Espécies Parte
estudada
Referências
Quercitrina β”-O-cafeato (51) C. haematocephala Folhas e caule MOHARARRAM et al., 2006
Quercitrina γ”-O-cafeato (52) ″ ″ ″
Quercitrina β”,γ”-di-O-galato (53) ″ ″ ″
Ácido gálico (24) ″ ″ ″
Galato de metila (54) ″ ″ ″
Ácido caféico (36) ″ ″ ″
Miricitrina (55) ″ ″ ″
Quercitrina (56) ″ ″ ″
Miricetina 3-O-β-D-4C1-glicopiranosídeo (57) ″ ″ ″
Afzelina (58) ″ ″ ″
Isoquercitrina (59) ″ ″ ″
Miricetina 3-O-(6”-O-galoil)-β -D-glicopiranosídeo (60)
″ ″ ″
Miricitrina β”-O-galato (61) ″ ″ ″
Quercitrina β”-O-galato (62) ″ ″ ″
Afzelina β”-O-galato (63) ″ ″ ″
Miricitrina γ”-O-galato (64) ″ ″ ″
Afzelina γ”-O-galato (65) ″ ″ ″
1,2,3,4,6-penta-O-galoil-β-D-4C1
-glicopiranose (66)
″ ″ ″
Miricitrina β”,γ”-di-O-galato (48) ″ ″ ″
Quercetina 3-O-metil éter (67) ″ ″ ″
Fitol (68) ″ ″ ABOU ZEID, 2006
Salicilato de metila (69) ″ ″ ″
cis-4-hexen-1-ol (70) ″ Folhas ABOU ZEID, 2006
β’,γ’,4’,7-Tetrametoxiflavona (71) C. inermis - MAHESWARA,et al., 2004
β’,γ’,4’,7-Tetrametoxiflavonona (72) ″ - ″
4’,7-dimetoxi-γ’-hidroxiflavona (73) ″ - ″
Ácido cis-4-hidroxipipecólico (74) C. pittieri Folhas ROMEO, SWAIN E
Capítulo 2-Levantamento bibliográfico
Tabela 01. cont.
Composto Espécies Parte
estudada
Referências
Ácido 2,4-cis-4,5-trans -4,5-dihidroxipipecólico (75)
C. pittieri Folhas ROMEO, SWAIN E BLEECKER, 1983 Ácido 2,4-cis-4,5-cis
-4,5-dihidroxipipecólico (76)
″ ″ BLEECKER & ROMEO,
1983
Pulcherrimasaponina (77) C. pulcherrima ″ DA SILVA et al., 2005
α-Terpineol (78) C.tweedii Flores LAMARQUE et al., 1998
Salicilato de metila (69) ″ ″ ″
Eugenol (79) ″ ″ ″
p-Anisaldeído (80) ″ ″ ″
1,8-Cineol (81) ″ ″ ″
Limoneno (82) ″ ″ ″
Salicilato de metila (69) ″ ″ ″
Eugenol (79) ″ ″ ″
p-Anisaldeído (80) ″ ″ ″
1,8-Cineol (81) ″ ″ ″
Capítulo 2-Levantamento bibliográfico
Flavonóides
Tabela 02. Estrutura dos flavonóides isolados de Calliandra.
O R1
R3
O
R6 R5
R7
R2 R4
R8
R1 R2 R3 R4 R5 R6 R7 R8
18 OCH3 H H H OCH3 OCH3 H OCH3
19 OCH3 OH H H OCH3 OCH3 H OCH3
45 OH OH OH H OH OH H H
46 OH OH OH H H OH H H
47 OH OH OH H OH OH OH H
67 OH OH OCH3 H H OH H H
71 OCH3 H H OCH3 OCH3 OCH3 H H
73 OCH3 H H H OH OCH3 H H
O HO
OH O
O
O HO
HO
OH OR1
R2
R3
R4
R1 R2 R3 R4
57 H OH OH OH
59 H OH OH H
Capítulo 2-Levantamento bibliográfico
Tabela 02. cont.
O O R3
O O
R6
R7
HO
R2 R1
R4
R5
R1 R2 R3 R4 R5 R6 R7
22 OH OH OCH3 OH OH OH H
23 OH OH OH OH OH OH H
48 galoila galoila OH OH OH OH OH
49 galoila galoila OH OH H OH H
50 OH OH OH OH OH OH H
51 cafeoila OH OH OH H OH OH
52 OH cafeoila OH OH H OH OH
53 galoila galoila OH OH H OH OH
55 OH OH OH OH OH OH OH
56 OH OH OH OH H OH OH
58 OH OH OH OH H OH H
61 galoila OH OH OH OH OH OH
62 galoila OH OH OH H OH OH
63 galoila OH OH OH H OH H
64 OH galoila OH OH OH OH OH
Capítulo 2-Levantamento bibliográfico
Tabela 02. cont.
O
R3
O
R6
R1
R2 R4
R5
R7
R1 R2 R3 R4 R5 R6 R7
38 OH OH O-ram (2R-trans) H H OH OH
39 OH OH O-ram (2S-cis) H H OH OH
40 OH OH O-ram H OH OH H
72 OCH3 H H OCH3 OCH3 OCH3 H
Capítulo 2-Levantamento bibliográfico
Saponinas triterpênicas
Tabela 03. Estrutura das saponinas triterpênicas isoladas de Calliandra.
O OH
O OH
O R1O
R3 O OH NHCOCH3 O O O OH O O OH OH C O O O CH3 O OH O OH O O OH O OH
OH R2O
OH OH OH HO HO HO HO
R1 R2 R3
Capítulo 2-Levantamento bibliográfico
Tabela 03. cont.
Capítulo 2-Levantamento bibliográfico
Tabela 03. cont.
C O
OH O
O OH HO C
O
O
COCH3 OH
(10)
C O
O
C O
OH O
CH3
OH
O HO
H OH
(11)
C O
O
C O
OH O
CH3
OH
O HO
COCH3 OH
Capítulo 2-Levantamento bibliográfico
Tabela 03. cont.
O CH3
OH
O HO C
O
O C
O
O
O OH
O HO
C O
OH
H OH
(13)
C O
OH C
O
O
O OH
O HO
H H
Capítulo 2-Levantamento bibliográfico
Tabela 03. cont.
O CH3
OH
O HO
C O
OH C
O
O C
O
O
O OH
O HO
COCH3 OH
(15)
C O
OH C
O
O
O OH
O HO
COCH3 H
Capítulo 2-Levantamento bibliográfico
Tabela 03. cont.
O O O OH OH HO O O O OH OH O O O O H OH O O N H C O HO HO O HOHO O O O OH HO HO C O O HO HO O O
O OHOH O O O HO O O OH HO O O HO HO OH O OH HO HO HO (17) O O OH O O N H C O HO HO O O OH HO O O OH HO OH O O O OH HO O O O O
HO HO O
O O HOHO O O O HOHO OH O O
OH O O O
OH
OH OH HO
HO O OH
Capítulo 2-Levantamento bibliográfico
Terpenóides
Tabela 04. Estrutura dos terpenóides isolados de Calliandra.
HO
HO
H CO2H
H H
CHO
HO
HO
H CO2H
H H CHO HO H H H OH O O O H H H H OH O O OH
(20) (21) (31)
(32) HO H H H H (41)
CO2H
H
H
H H
OH
Capítulo 2-Levantamento bibliográfico
Aminoácidos
Tabela 05. Estrutura dos aminoácidos isolados de Calliandra.
N H
CO2H
HO N
H CO2H
OH
(1)
N H OH
CO2H
(2)
N H
CO2H HO
(3)
N H
CO2H
H OH H HO (4) N H OH H HO
CO2H
H
(33)
N CO2H
NHCOCH3 H H (34) (43) N H
CO2H
NHCOCH3
(44)
N H
CO2H
OH
(74)
N H
CO2H
OH H H HO (75) N H
CO2H
OH H H HO (76) Derivados fenólicos
Tabela 06. Estrutura dos derivados fenólicos isolados de Calliandra.
CO2H
OH (35) HO HO O OH (36)
CO2H
Capítulo 2-Levantamento bibliográfico
Tabela 07. Estruturas dos compostos fenólicos identificados por espectrometria de massas de alta resolução (DART) de C. calothyrsus.
OH HO OH COOH (24) O O HO HO (25) O O HO HO HO (26) O HO OH OH OH OH (27) O OH HO OH OH OH O (28) O HO OH OH OH OH O (29) Constituintes voláteis
Tabela 08. Principais constituintes voláteis de C. tweedi Benth e C. haematocephala.
O O OH (69) OH (70) OH (78) HO H3CO
Capítulo 3-Elucidação Estrutural
3. ELUCIDAÇÃO ESTRUTURAL
3.1. Elucidação estrutural dos constituintes químicos isolados de Abarema cochliacarpos
3.1.1. Elucidação estrutural dos esteróides
3.1.1.1. Determinação estrutural de ACC-1
A fração CH2Cl2, resultante da partição seqüencial (extração líquido-líquido) do
extrato etanólico da casca do caule de A. cochliacarpos, foi submetida a coluna cromatográfica (item 4.4.3, pág. 161), da qual obteve-se um sólido branco amorfo, com faixa de fusão 154,4–155,0 ºC.
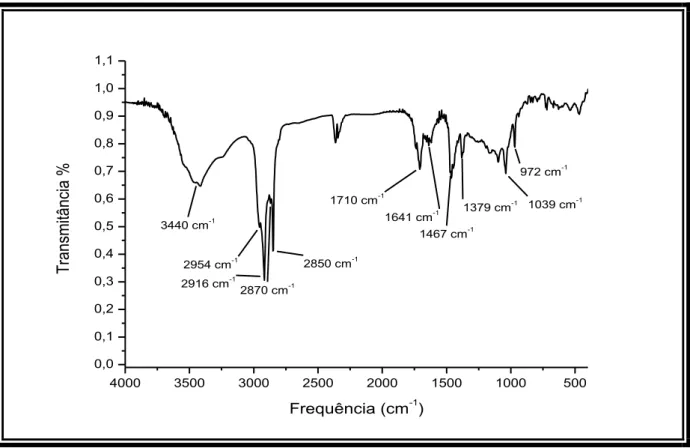
O espectro de absorção na região do infravermelho (Fig. 03, pág. 33) exibiu uma banda centrada em 3440 cm-1 indicativa de deformação axial de ligação OH, absorções referentes à deformação axial de ligação C-H (Csp3) em 2954 a 2850 cm-1, uma banda
em 1641 cm-1 compatível com deformação axial de ligação C=C, bandas em 1467 e 1379 cm-1 características de deformação angular de ligação C-H e uma banda em 1039 cm-1 representativa de deformação axial de ligação C-O [SILVERSTEIN, WEBSTER e KIEMLE, 2007].
O espectro de RMN 13C-CPD (125 MHz, CDCl3) (Fig. 05, pág. 34) apresentou
29 linhas espectrais. Através da análise comparativa dos espectros de RMN 13C-CPD e DEPT 135° (Fig. 06, pág. 34) foi possível determinar para ACC-1 a presença de onze carbonos metínicos, três deles localizados na região de carbono com hibridização sp2 e um oxigenado; nove carbonos metilênicos não funcionalizados, e seis carbonos metílicos. A subtração dos sinais observados nos espectros acima citados possibilitou identificar a presença de três carbonos não-hidrogenados (Tabela 09, pág. 30), um dos quais, com hibridização sp2. O sinal em δC 71,3 (C-3, CH) caracterizou um carbono
oxigenado enquanto os sinais em δC 139,8 (C-8), 117,7 (C-7, CH), 138,4 (C-22, CH) e
129,6 (C-23, CH) sugeriram a presença de duas ligações duplas, uma trissubstituída e outra dissubstituída. Esses dados foram compatíveis com a fórmula molecular C29H48O,
Capítulo 3-Elucidação Estrutural
O espectro de RMN 1H (500 MHz, CDCl3) (Fig. 04, pág. 33) apresentou sinais
em δH 5,18 (dd, J=8,8 e 15,1 Hz) e 5,04 (dd, J=8,8 e 15,1 Hz), compatíveis com
hidrogênios olefínicos. De acordo com a integração, o sinal em δH 5,18 corresponde a
dois hidrogênios, confirmados através do espectro HSQC (Fig. 07, pág. 35), o qual
revelou correlação com os sinais de carbono em δC 117,6 (C-7) e 138,3 (C-22),
enquanto a absorção em δH 5,04 correlacionou-se com o sinal de carbono em δC 129, 6
(C-23).
Tabela 09. Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de ACC-1.
Baseado nos valores das constantes de acoplamento (J=8,8 e 15,1 Hz), os
hidrogênios olefínicos em δH 5,18 (H-22) e 5,04 (H-23) encontram-se em configuração
trans. O espectro mostra ainda sinais correspondentes a seis grupamentos metílicos, dois deles apresentando-se como singleto em δH 0,55 (H-18); 0,80 (H-19/H-27), e três
como dubletos δH 1,03 (d, J=6,5 Hz, H-26); 0,85 (d, J=6,3 Hz, H-21) e 0,82 (d, J=7,2,
H-29), além do sinal em 3,62 (m) associado ao hidrogênio pertencente ao carbono oximetínico.
De acordo com os dados e com base na análise comparativa dos deslocamentos químicos de RMN 13C registrados na literatura [KOJIMA et al., 1990], chegou-se à
C CH CH2 CH3 Fórmula Molecular
139,8 138,4 39,7 21,6
43,5 129,6 38,2 21,3
34,4 117,7 37,3 19,2
71,3 (C-O)a 31,7 13,3
56,1 29,8 12,5
55,3 28,7 12,3
51,5 25,6
49,7 23,2
41,0 21,8
40,5 32,1
3C 11CH 9CH2 6CH3 C29H48O
Capítulo 3-Elucidação Estrutural
conclusão de que ACC-1 trata-se do esteróide estigmast-7,22-dien-3-ί-ol, denominado usualmente de espinasterol (Tabela 10, pág. 32).
HO
Capítulo 3-Elucidação Estrutural
Tabela 10. Deslocamentos químicos (δ) de RMN 13C (125 MHz, CDCl3) de ACC-1.
HO 29 28 27 26 25 24 23 22 21 20 19 18 17 16 15 1413 12 11
10 9 8 7 6 5 4 3 2 1 ACC-1
C ACC-1 (δ 13C) * Lit. (δ 13C) C ACC-1 (δ 13C) * Lit. (δ 13C)
1 37,3 37,1 16 28,7 28,5
2 31,7 31,4 17 56,1 55,8
3 71,3 71,0 18 12,3 12,0
4 38,2 38,0 19 13,3 13,0
5 40,5 40,2 20 41,0 40,8
6 29,8 29,6 21 21,6 21,4
7 117,7 117,4 22 138,4 138,7
8 139,8 139,5 23 129,6 129,4
9 49,7 49,4 24 51,5 51,2
10 34,4 34,2 25 32,1 31,9
11 21,8 21,5 26 21,3 21,1
12 39,7 39,4 27 19,2 19,0
13 43,5 43,3 28 25,6 25,4
14 55,3 55,1 29 12,5 12,3
15 23,2 23,0
Capítulo 3-Elucidação Estrutural
4000 3500 3000 2500 2000 1500 1000 500
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 1,1
T
ra
n
smi
tâ
n
ci
a
%
Frequência (cm-1)
1467 cm-1 1379 cm-1
3440 cm-1
2916 cm-1
2850 cm-1 2954 cm-1
2870 cm-1
1710 cm-1 1039 cm-1
1641 cm-1
972 cm-1
Figura 03. Espectro de absorção na região de infravermelho de ACC-1.
Capítulo 3-Elucidação Estrutural
Figura 05. Espectro de RMN 13C (125 MHz, CDCl3) de ACC-1.
Capítulo 3-Elucidação Estrutural
Figura 07. Mapa de contorno HSQC (500 e 125 MHz, CDCl3) de ACC-1.
Capítulo 3-Elucidação Estrutural
Capítulo 3-Elucidação Estrutural
3.1.1.2. Determinação estrutural de AC-6
AC-6 foi isolado da fração AcOEt/MeOH-1:1, obtida do fracionamento cromatográfico a vácuo da fração CH2Cl2 do extrato etanólico do caule de A.
cochliacarpos (item 4.4.6, pág. 165), sob a forma de um sólido branco cristalino.
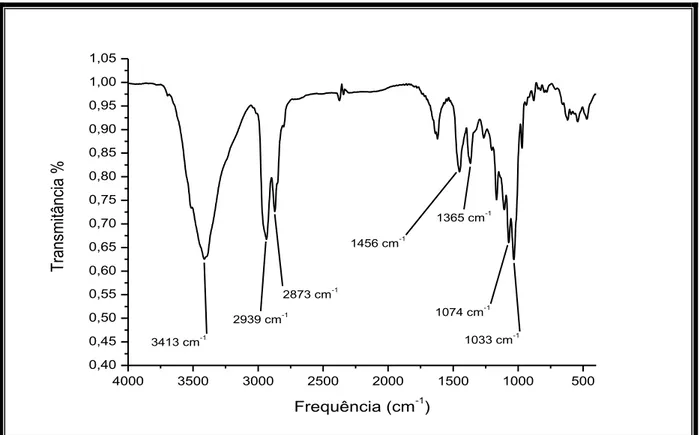
O espectro de absorção na região do infravermelho (Fig. 10, pág. 40) exibiu uma banda larga centrada em 3413 cm-1 indicativa de deformação axial de ligação O-H, absorções em 2939 e 2873 cm-1 referentes à deformação axial de ligação C-H, bandas de deformação angular de ligação C-H em 1456 e 1365 cm -1, além de uma banda em 1033 cm-1 representativa de deformação axial de ligação C–O [SILVERSTEIN, WEBSTER e KIEMLE, 2007].
O espectro de RMN 13C-CPD (125 MHz, C5D5N) (Fig. 12, pág. 41) exibiu 34
linhas espectrais. Através da análise comparativa dos espectros de RMN 13C-CPD e DEPT 135° (Fig. 13, pág. 41) foi possível observar a presença de dezesseis carbonos metínicos, três deles localizados na região de carbono com hibridização sp2 e seis
ligados a átomos de oxigênioν nove carbonos metilênicos, sendo um oxigenado (δC
63,3) e seis carbonos metílicos. A subtração dos sinais observados nos espectros acima citados possibilitou determinar a presença de três carbonos não-hidrogenados (Tabela. 11, pág. 38), um dos quais, é olefínico (δC1γ9,9). O sinal em δC 77,5 (C-H) caracterizou
um carbono oxigenado enquanto os sinais δC 139,9 (C), 118,2 (CH), 138,9 (CH); 130,0
(CH) evidenciaram a presença de duas ligações duplas, uma trissubstituída e outra
dissubstituída. Os sinais em δC 102,6; 78,9; 78,7; 75,6; 72,1 e 63,3 sugerem a presença
de uma unidade de açúcar na estrutura de AC-6. Considerando a teoria de deslocamento químico pode-se deduzir que a estrutura do composto em discussão é compatível com uma molécula de esqueleto esteroidal contendo uma unidade glicosídica.
O espectro de RMN 1H (500 MHz, C5D5N) (Fig. 11, pág. 40) apresentou um
sinal em δH 5,08 (m) com integração para três átomos de hidrogênios, característico de
hidrogênios olefínicos. Na região de hidrogênios ligados a carbonos oxigenados foram
observados sinais no intervalo de δH 4,61-γ,98, onde o sinal em δH 4,34 (d, J=8,8 Hz)
foi compatível com um hidrogênio ligado a carbono anomérico. Os sinais no intervalo
de δH 2,05-0,58 são condizentes com uma molécula de esqueleto triterpênico ou
esteroidal, corroborando com as informações discutidas através do espectro de RMN
13
Capítulo 3-Elucidação Estrutural
Tabela 11. Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-CPD e DEPT 135° de AC-6.
C CH CH2 CH3 Fórmula Molecular
139,9 138,9 63,2 (C-O)b 22,1
43,5 130,1 39,9 21,6
34,9 118,2 37,6 19,5
102,6 (C-O)a 35,0 13,3
78,9 (C-O)b 30,3 12,8
78,7 (C-O)a 29,2 12,5
77,5 (C-O)a 29,2 75,6 (C-O)b 26,0 72,1 (C-O)b 23,6
56,4 21,9
55,6 51,7 49,9 41,4 40,5 32,4
3C 16CH 10CH2 6CH3 C35H58O6
a Um átomo de oxigênio ligado a dois átomos de carbono sp3; b Oxigênio pertencente a um grupo hidroxila
A análise comparativa dos deslocamentos de RMN 13C de AC-6 com dados existentes na literatura [KOJIMA et al., 1990], permitiu caracterizar o composto como sendo o esteróide 3-O-ί-D-glicopiranosil-espinasterol (Tabela 12, pág. 39).
O
OH HO
HO
OH
O
Capítulo 3-Elucidação Estrutural
Tabela 12. Deslocamentos químicos (δ) de RMN 13C (125 MHz, C5D5N) de AC-6.
O OH HO HO O OH 1 2 3
4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 1' 2' 3' 4' 5' 6' AC-6
C AC-6 (δ 13C) *Lit. (δ 13C) C AC-6 (δ 13C) *Lit. (δ 13C)
1 37,7 37,4 19 13,4 13,1
2 29,2 30,4 20 41,4 41,2
3 77,5 77,3 21 21,9 21,7
4 35,1 34,8 22 139,0 138,7
5 41,4 40,2 23 130,0 129,7
6 30,4 30,1 24 51,8 51,5
7 118,2 117,9 25 32,5 32,2
8 139,9 139,7 26 21,6 21,4
9 50,0 49,7 27 19,5 20,1
10 34,9 34,6 28 26,0 25,8
11 22,1 21,8 29 12,8 12,6
12 40,5 39,7 1’ 102,3 102,3
13 43,8 43,5 2’ 75,7 75,4
14 55,6 55,4 3’ 78,9 78,7
15 23,7 23,5 4’ 72,2 71,8
16 29,2 29,0 5’ 78,7 78,5
17 56,4 56,1 6’ 63,3 62,9
18 12,6 12,3
Capítulo 3-Elucidação Estrutural
4000 3500 3000 2500 2000 1500 1000 500
0,40 0,45 0,50 0,55 0,60 0,65 0,70 0,75 0,80 0,85 0,90 0,95 1,00 1,05
T
ra
n
smi
tâ
n
ci
a
%
Frequência (cm-1)
3413 cm-1
2939 cm-1 2873 cm-1
1456 cm-1
1365 cm-1
1074 cm-1
1033 cm-1
Figura 10. Espectro de absorção na região de infravermelho de AC-6.
Capítulo 3-Elucidação Estrutural
Figura 12. Espectro de RMN 13C (125 MHz, C5D5N) de AC-6.