Bol OfSanit Panam 88(l), 1980
PREVENCION
Y CONTROL
DE LA RINOTRAQUEITIS
INFECCIOSA
BOVINAI
Dr. James A. Idouse
Se explican los mecankmos inmunológicos que el animal desarrolla contra la rinotraquet’tis infecciosa bovina, a la vez que se examinan diversas caracte&icas de esa enfermedad en relacih con la @ven- ción y el control de la misma.
Breve análisis del sistema inmunológico
Los dos brazos de la respuesta inmuno- lógica son la inmunidad de base celular y la inmunidad por anticuerpos. Las cé,lulas involucradas son los linfocitos T y B que establecen una interacción y cuentan con el l
’ Publicado en: Control de Enfmedades de los Animales en las Amértcar, 1977. Docummtm de la X Reunión Interamericana, a Nzuel Mtnzrterial, sobre el Control de la Ftebm Aftosa y Otras Zoono- su. 14-I 7 de mano de 1977, Washington, D.C. Publicación Cien- tífica 358, OPS, Washington, D.C., 1978.
z Director de Investigación Biológica, Pitman-Moore, Inc. Washington Crossing, Nueva Jersey, E.U.A.
apoyo de macrófagos (figura 1) para cum- plir sus funciones.
El timo siembra linfocitos T en el tejido linfoide por todo el cuerpo. Estos repre- sentan la mayoría de los linfocitos circulan- tes y a ellos se’debe la hipersensibilidad de tipo tardío, fa resistencia a enfermedades infecciosas y tumores, el rechazo de injer- tos, alergias a algunos medicamentos, al- gunas enfermedades autoinmunes y la in- teracción con linfocitos B (cuadro 1).
A los linfocitos B se debe la inmunidad por anticuerpos y al parecer se derivan de las células tallo que tienen su origen en la
FIGURA l-leucocitos que participan en las respuestas in- munológicas.
BASE CELULAR
CELULAS TALLO
yNFo[p~ ANTICUERPOS
MACROFAGOS
36 BOLETIN DE LA OFICINA SANITARIA PANAMERICANA
*
Enero 1980
CUADRO l-Respuesta inmunológica de base
celular.a
Hipersensibilidad de tipo tardío Resistencia a los agentes infecciosos Resistencia a los tumores
Rechazo de injertos
Alergias a algunos medicamentos Algunas enfermedades autoinmunes Interacciones con los linfocitos B
a Adaptado de J. A. Bellanti. Immunolo~. Filadelfia; W. B. Saunders Company, 1971.
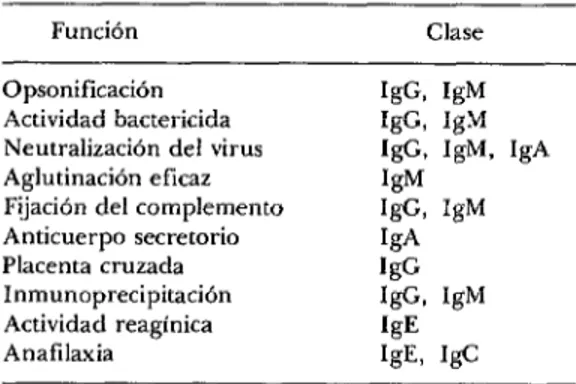
médula ósea. Producen varias clases de an- ticuerpos que explican la opsonificación, la actividad bactericida, la neutralización del virus, las reacciones de aglutinación, la fi- jación del complemento, la protección lo- cal, la inmunización pasiva del neonato, la inmunoprecipitación, las reacciones alér- gicas inmediatas y la anafilaxia (cuadro 2). Los macrófagos participan inextrica- blemente tanto en la inmunidad de base celular como en la inmunidad por anti- cuerpos. Por vía de la fagocitosis y de un proceso catabólico de antígenos ofrecen el estímulo inmunitario a las células T y B. Además, excretan diversos factores solu- bles (lynphokines) que regulan la inmuni- dad de base celular y por anticuerpos (cuadro 3).
CUADRO 2-Las funciones de diversas clases de inmunoglobulinas.a
Función Clase
Opsonificación Actividad bactericida Neutralización del virus Aglutinación eficaz Fijación del complemento Anticuerpo secretorio Placenta cruzada Inmunoprecipitación Actividad reagínica Anafilaxia
IgG IgM IgG IgM IgG, IgM IgA W
IgG IgM IgA 16 IgG, IgM W IgL IgC
’ Compilado de J. A. Bellanti. Immunology. Filadelfia; W. B. Saunders Company, 1971.
CUADRO 3-Algunas funciones de los macrófa- g0s.a
Inmunidad por anticuerpos
Manejo de antígenos Catabolismo y presentación
Cooperación Mediadores de desprendimiento que afectan los linfocitos
Inmunidad de base celular
-
Manejo de antígenos Catabolismo y presentación
Expresión Actividad bactericida Mediadores de
desprendimiento de la IMC
Formación de granulomas
Varios Hacen interferón y componentes del complemento
r)
a Adaptado de M. Feldman. En: S. Cohen y E. H. Ladun, Eds. Immuno¿ogy O/ Parclsilic Infectiow Londres; Blackwell Scientific Publication. 1976.
Las respuestas
inmunológicas en la rinotraqueítis infecciosa bovina (RIB)
+
Hou.se RINOTRAQUEITIS INFECCIOSA BOVINA 37
anticuerpos sumados al complemento des- truían por inmunolisis las células infec- tadas permitiendo a los anticuerpos neu- tralizar los virus desprendidos.
En el cuadro 4 se resume el mecanismo hipotético para eliminar la infección por herpesvirus en los sistemas de cultivo tisu- lar; este sistema infectado con herpesvirus ,y cubierto de anticuerpos, complemento y
leucocitos, semeja muy de cerca al ecosis- tema celular de un animal inmune; es de- cir, hay zonas de vigilancia de anticuerpos, complemento y leucocitos en las que las cé- lulas están infectadas de manera latente con herpesvirus. Si bien el mecanismo de eliminación de las células infectadas y del virus funciona en los cultivos tisulares in- fectados, al parecer el herpesvirus puede persistir en estado de aislamiento protegi- do en algunas células infectadas del ani- mal por períodos prolongados sin poner en marcha un mecanismo eliminatorio. * Sheffy y Davies (26) demostraron que
podría recrudecerse el virus RIB (provo- car su reaparición) tratando animales que hubiesen estado previamente infectados, .con corticosteroide o con ACTH. Observa-
ron que 18 de 19 animales infectados eli- minaban virus en la secreción nasal al cabo de seis días de tratamiento con corticoste- roide, y que ocho de 13 animales infecta-
CUADRO 4-E¡ mecanismo probable para la eli- minación del virus herpético del cultivo de tejido infectado.
l
1.
2.
3.
4.
5.
Prevención de la propagación extracelular del virus por los anticuerpos.
Prevención de LI propagación del virus de célula a célula mediaute factores solubles producidos por los leucocitos.
Prevención de la reproducción vírica mediante factores leucocíticos solubles.
Innmuólisis de LIS células infectadas por los anti-
cuerpos sut~ixlos al complen~ento.
Neutralización del virus suelto por los anticuerpos.
dos eliminaban virus por la conjuntiva. El mecanismo para la supresión corticoste- roide del sistema inmunológico al parecer participa en la supresión de leucocitos (7). Así, existe una correlación entre la partici- pación in vitre de leucocitos que controla la difusión del herpesvirus y la supresión cor-
ticosteroide de leucocitos in vivo.-
Dennet et al. (9) demostraron que había recrudescencia del virus RIB en ll de 19 vacunos infectados naturalmente em- pleando una sola inyección de corticoste- roide. La recrudescencia espontánea del virus RIB, según lo demostró Snowdon (28) ha sucedido hasta 578 días después de la infección.
Se ha dicho que parte del mecanismo que controla la difusión del virus RIB ac- túa mediante la producción de interferón. El interferón es un producto celular solu- ble capaz de proteger a las células del daño causado por la infección vírica interrum- piendo la reproducción vírica. La produc- ción y el desprendimiento del interferón pueden ser inducidos por la infección ví- rica. El virus RIB es un inductor de inter- ferón bastante eficaz, pero no es tan sus- ceptible al interferón como lo son muchos otros virus.
Respuesta serológica
A los linfocitos B se debe la inmunidad por anticuerpos. Comúnmente se mide el anticuerpo anti-RIB por métodos de neu- tralización. Los anticuerpos empiezan a detectarse entre siete y 10 días después de haber estado expuesto el sujeto al virus RIB; posiblemente se componga de IgM y
38 BOLETIN DE LA OFICINA SANITARIA PANAMERICANA
+ Enero 1980
Vacunas de protección contra el RI6
Aunque son muchas las formas clínicas de enfermedad que puede causar el virus RIB, solo se ha demostrado un serotipo. Los investigadores han revelado cuando mucho solamente pequeñas diferencias entre diversos aislados del virus (4, ll, 17).
Vacunas parenterales modificadas de virus vivo
Schwartz et al. (25) atenuaron el virus mediante pases en cultivo tisular con técni- cas de dilución terminal. La vacuna viva modificada resultante para inyección in- tramuscular indujo tanto una respuesta de anticuerpos como una respuesta protec- tor,a sin propagación del virus entre los ani,males vacunados y los testigos (3, 23, 25). La vacunación con otras vacunas vivas modificadas también ha resultado eficaz (ZG, 2?,32). La respuesta inmunológica de base celular parece alcanzar su valor má- ximo entre siete y 10 días después de la vacunación y un tope del título cerca de 19 días después de la vacunación (18).
Se ha demostrado la aceptación sobre el terreno de las vacunas vivas de RIB modi- ficadas para inyección intramuscular por las ventas que, según informes, alcanzaron aproximadamente 40,000,OOO .de dosis en Estados Unidos de América en 1975.3
La mayoría de los datos sobre la eficacia de la vacuna proceden de su empleo para prevenir la forma respiratoria de la en- fermedad. Si bien se trata de la forma más corriente, también es factor de mucho peso el de las repercusiones económicas que tiene la RIB en el sistema reproductor del ganado vacuno. Saunders, Olson y Ra- dostit (23) demostraron que la inmuniza-
3 Cifras de la Secretaría de Agricultura de Estados Cnidos de América correspondientes al ejercicio económico de 1975
ción con la vacuna RIB viva modificada era muy eficaz para evitar el aborto. Vacuna- ron a 17 vacas y dejaron a 16 testigos sin vacunar. Esas terneras fueron cruzadas con toros de cría y sometidas a un virus RIB virulento entre cinco y siete meses después de ser vacunadas. El resultado in- dicó que el 62.5% de los testigos abortó (10/16), mientras que solo el 5.9% de las, vacunadas abortó (l/ 17).
Por eso, la vacunación intramuscular es eficaz para proteger tanto contra la en- fermedad respiratoria como contra la en- fermedad reproductora ocasionadas por el virus RIB. Las vacunas parenterales RIB no se recomiendan en la actualidad para las vacas preñadas, pues existe la sospecha de que pueden provocar el aborto.
Se han desarrollado vacunas combina- das con otras vacunas víricas vivas modifi- cadas tales como la diarrea bovina vírica y el virus de tipo parainfluenza bovina tipo 3. También se han empleado vacunas bac@ terianas de Pasteurella como diluyentes
(24).
Vacunas intranasales
Todd et &. (30) describieron en 1971 una cepa atenuada de virus RIB que se administra por vía intranasal. La vacuna produjo protección ante un virus RIB vi- rulento de tres a cuatro días después de la vacunación.
Al parecer, esta protección se debió a la II producción de interferón por células de la vacuna infectada por el virus del tracto respiratorio. Asimismo, describieron la va- cunación intranasal de 24 vacas suscepti- bles a la RIB que se hallaban en distintas etapas de preñez. No se produjeron abor- tos atribuibles a la vacuna en el plazo de 95 días. Otros estudios sobre el terreno de- mostraron la inocuidad de esta vacuna para las vacas preñadas (12).
*
House RINOTRAQUEITIS INFECCIOSA BOVINA 39
sistema respiratorio y genital da protec- ción. Hace poco Zygraich (34) describió un mutante del virus RIB sensible a la tempe- ratura e incapaz de reproducirse a una temperatura de 39OC, que es la tempera- tura corporal del ganado. La inmunoge- nicidad de ese virus fue demostrada y, al parecer, tenía buena correlación con , el anticuerpo neutralizador del suero
como la tienen otras vacunas de virus vivo modificado.
Hace poco termiriamos un ensayo sobre el terreno en el que se empleó una vacuna intranasal mezclada de RIB y PI-3 en vacas preñadas. No se registraron reacciones desfavorables atribuibles a la vacunación y se demostró que la vacuna era segura y eficaz. Los datos que aparecen en el cua- dro 5 indican que 158 vacas preñadas eran seronegativas al virus RIB y que 91 eran inmunes al virus RIB en el momento de la vacunación. Las tasas de aborto fueron 1.3 9 1.1% respectivamente. Ningún aborto se debió al virus RIB o a PI-3. En las 158 vacas seronegativas, el 97% de las vacuna- das desarrolló anticuerpos al virus RIB.
McKercher y otros (16) han comparado la vacuna RIB administrada intranasal y parenteralmente. No hubo diferencias en el grado de protección proporcionado ni
CUADRO J-Resumen de los resultados obteni- dos en ensayos sobre el terreno con la vacuna RIB? l Vacunados Testigos
Número que Núm&o que desarrolla desarrolla Estado NlílllW3 RIB Número RIB
Colorado 1,250 14 (1.1%) 1,802 140 (7.7%) Idaho 1,074 5 (0.5%) 777 96 (12.3%) Nebraska 816 6 (0.7%) 592 143 (24.0%) Washington 205 10 (0.5%) 200 200 (100%)
Total 3,345 35 (1.0%) 3,371 579 (17.2%)
’ Tomado de C. J. York et al. Infections bovine rhino- tracheitis vaccine-Efficacy in controlled field trials. Vef Med 53:522, 1958.
en la respuesta inmunológica. Por ende, en los programas de salud del ganado vacuno que cuentan con una campaña habitual de vacunación, la facilidad de administración de la vacuna parenteral ofrece muchas ventajas pues la protección consiguiente es estable y prolongada. En algunos casos, ta- les como el de vacas preñadas o en los que sea conveniente inducir niveles de interfe- rón en el sistema respiratorio del ganado vacuno, la vacuna intranasal puede ser útil.
Vacunas RIB inactivadas
En los virus RIB vivos modificados siempre ha existido una buena correlación entre la presencia de anticuerpo sérico y el estado inmunológico del huésped según lo indican los estudios de confrontación y protección. Con la aparición de vacunas RIB muertas aparece una discrepancia en la correlación entre anticuerpo y protec- ción. Sheffy y Rodman (27) usaron una va- cuna RIB inactivada y lograron demostrar que había niveles relativamente elevados de anticuerpo neutralizador del suero después de dos inyecciones de vacuna. Al ser expuestas a la RIB virulenta, 16 terne- ras de un total de 16 no revelaron protec- ción apreciable. Esa falta de protección puede atribuirse a la falta de respuesta in- munológica de base celular. Se supone que una de las exigencias críticas que debe sa- tisfacer una vacuna RIB es la de que sea capaz de inducir la respuesta inmunoló- gica de base celular.
l
40 BOLETIN DE LA OFICINA SANITARIA PANAMERICANA \Enero 1980respondido (22). Dicho de otro modo, es costo de la misma para justificar el uso de posible que se hayan incluido en este la vacuna. No todo el ganado vacunado grupo animales ya sensibilizados al virus contra una determinada enfermedad va a RIB. Sheffy y Rodman (27) usando la verse expuesto a ella. Por eso, es la inci- misma vacuna, no lograron demostrar su dencia de la enfermedad la que dicta la eficacia en condiciones experimentales necesidad de vacunar y, asimismo, la efica-
controladas. cia de la vacuna.
Duración de la inmunidad
Chow (5) estudió vacunos inoculados con virus RIB virulento por vías intramus- cular e intratraqueal y demostró que había protección hasta 5% años. Por desgracia, no se ha hecho estudio alguno de tan lar- ga duración empleando vacunas de virus. Bittle et al. (3) vacunaron terneras y lue- go las aislaron por espacio de 14 meses. Algunos animales perdieron títulos de an- ticuerpos detectables durante ese período; se volvieron a vacunar después de 14 me- ses de la primera vacunación y desarrolla- ron una respuesta anamnésica, lo que in- dica que habían permanecido sensibles al virus RIB.
York y otros (32) resumieron los resul- tados obtenidos en ensayos sobre el te- rreno con una vacuna RIB viva modificada * según se indica en el cuadro 6. Se observa que el 1% del ganado vacunado y el 17.2% de los testigos desarrolló RIB clínica. Con una incidencia de 17.2%, según lo ha seña- lado el estudio, no sería difícil justificar el uso de una vacuna eficaz. Fue espectacular el grado de protección proporcionado por una vacuna polivalente que contiene RIB, BVD y PI-3, estudiada en 1968 (2). En este caso la morbilidad y mortalidad se reduje- ron aproximadamente en un tercio, con la vacunación de casi 6,000 vacunos compa- rados con unos 6,600 testigos. 6
Economía de la vacunación
La prevención de la enfermedad causada por el virus l%B
El beneficio económico de la vacunación Para evitar las epidemias de RIB y man- tiene que ser apreciablemente superior al tener la salud del hato, se recomienda la
CUADRO 6-Resumen de los resultados obtenidos en ensayos sobre el terreno con una vacuna RIB, BVD y PI-3.a
Estado No.
Montana 1,818 Coloradr) 100 Mississippi 100 California 180 Georgia 3,799
Total 5,997
Vacunados
Morbilidad Tratamiento (%ó) wo)
2.6 2.6 3.1 3.1 11.0 3.0 2.2 2.2 7.6 7.6
5.9 5.8
No.
1,900 160 106 175 4,240
6,581
l
Testigos
Morbilidad Tratamiento @ó) (%)
1.5 1.5 17.5 17.5 75.0 21.0 8.0 8.0 22.0 22.0
16.5 15.6
l
Howe RINOTRAQUEITIS INFECCIOSA BOVINA 41
vacunación preventiva usando principal- mente vacuna de virus RIB vivo modifi- cado por vía parenteral, de la manera que sigue:
1) Vacunar a todos los terneros después de los cinco meses de edad, pero no en el mes de la reproducción.
, 2) En los hatos con problemas, debe va- cunarse a los terneros al mes de nacidos y nuevamente al cumplir los cinco meses.
3) Vacunar a los terneros en el lugar donde se han criado 30 días antes de ser trasladados. De no ser posible, vacúneseles al llegar al nuevo lugar y redúzcase, en lo posible, la tensión.
4) Vacunar a todo el ganado de cría anualmente al menos un mes antes de la reproducción. Aliméntese a todos los ter- neros con calostro, de preferencia a los 15 minutos de nacidos.
5) Se recomienda el uso de vacunas po- evalentes que contengan antígenos para la
RIB, BVD y PI-3.
6) No se vacune a las vacas preñadas. De ser necesario hacerlo, empléense las vacu- nas intranasales.
7) No se vacune durante el brote de una enfermedad.
8) Todos los animales de reemplazo que ingresan a un hato deben comprarse de una procedencia conocida y venir acom- pañados de un certificado de vacunación. Se debe aislar a estos nuevos reemplazos del hato por espacio de dos semanas. Si no @ estuviesen vacunados habría que vacunar-
los apenas lleguen.
Control de un brote de RIB
Se debe subrayar que es mucho más fácil prevenir la RIB mediante inmunización adecuada antes de la exposición a un virus virulento que controlar una enfermedad fulminante. Puede ser posible vacunar ante un brote de RIB y proteger al ganado vacuno con éxito.
Las investigaciones sobre vacunación in- tranasal hechas por Todd y otros (30, 31) han revelado que los animales vacunados tres o cuatro días antes de verse expuestos a un virus virulento tienen resistencia a la enfermedad. No se dispone de datos sobre la temprana manifestación de la protec- ción que ofrecen las vacunas RIB parente- rales. Hay que crear en el cliente una com- prensión clara de que tales procedimientos pueden no ser eficaces y que pueden aún producirse graves pérdidas, incluido el aborto, causadas por virus o bacterias pa- tógenos virulentos.
Si se produce una epidemia de RIB o de otra enfermedad respiratoria grave, se debe aislar al grupo de animales afectados, separándolos de los demás, y se les debe administrar vitaminas, antibióticos y tera- pia electrolítica de apoyo. El ganado de- berá alimentarse con una variedad de ali- mentos de buena calidad.
Además, es importante hacer hincapié en el uso apropiado de un agente inmuno- profiláctico eficaz en el programa general de salud. animal. Una administración vete- rinaria eficaz puede disminuir rápida- mente las pérdidas económicas debidas a la infección por RIB.
Resumen
42 BOLETIN DE LA OFICINA SANITARIA PANAMERICANA
I, Enero 1980
general de vacunación que emplea princi- medidas básicas para controlar un brote de palmente vacunas de virus vivos modifica- RID. 0
dos para uso parenteral y se describen las
REFERENCIAS
(1) Bellanti, J. A. Immunology. Filadelfia: W. B. Saunders Company, 1971.
(2) Bittle, J. L. y C. J. York. Combination vaccines for control of bovine respiratory diseases. J Am Vet Med Assoc 152889-892, 1968. (3) Bittle, J. L., K. Schell y R. Sanderson. Theclini-
cal and serological response of colostrum deprived calves to combinations of IBR, BVD-MD, and PI-3 virus vaccines. Con- ference of Research Workers in Animal Dis- eases, diciembre de 1968. > (4) Bowling, C. P., C. R. Goodheart y G. Plummer.
Oral and genital bovine herpesviruses.J Virol 3:95-07, 1969.
(5) Chow, T. L. Duration of immunity in heifers inoculated with infectious bovine rhinotra- cheitis virus.] Am Vet Med Assoc 160:51-54, 1972.
(6) Cohen, S. Immune effector mechanisms. En: Immunology of Parrsitic Infections, S. Cohen y
E. H. Ladun, Eds. capítulo 2. Londres: Blackwell Scientific Publication, 1976. (7) Davies, D. H. y L. G. Carmichael. Role of cell-
mediated inmmunity in the recovery of cattle from primary and recurrent infections with bovine rhinotracheitis virus. Infect Immun 8:510-518, 1973.
(8) Davis, D. D. et nl. Microbzology, 2a ed. Nueva York: Harper and Row Publishers, Inc.,
1973.
(9) Dennett, D. P.. J. 0. Barasa y R. H. Johnson. Infectious bovine rhinotracheitis virus: Stud- ies on the venereal carrier status in range cattle. Re.\ Vet Sri 20:77-83, 1976.
(10) Feldmann, Marc. Cellular basis of immune sen- sitization. En: Immut~ology of Parktic Infec- tiotns. S. Cohen y E. H. Ladun, Eds. Londres: Blackwell Scientific Publication, 1976. (II) House, J. A. Bovine herpesvirus IBR-IPV.
Strain differences. Lor&l Vet 62:431-453, 1972.
(12) Kahrs, R. F., R. B. Hillman y J. D. Todd.Ob- servations on the intranasal vaccination of pregnant cattle against infectious bovine rhi- notracheitis and parainfluenza- virus in- fection. J Am Vrt Mrd As~oc 163:436-441,
1973.
(14)
(15)
(16)
(17)
(18)
(19)
(20)
(21)
(22)
Kendrick, J. W., C. J. York y D. G. McKercher. l A controlled Beld trial of a vaccine for in- fectious bovine rhinotracheitis. Proc CJS Anim Health Assoc, 1956.
Lodmell, D. L., A. Niwa, K. Hayashi y A. L. Natkins. Prevention of cell-to-cell spread of herpes simplex virus by leukocytes. J Exp Med 137:706-720, 1973.
Matsuoka, T., T. M. Folkerts y C. Gale. Eval- uation in the calves of an inactivated bovine rhinotracheitis and parainfluenza- vaccine combined with pasteurella bacterin. J Am Vet Med Assoc 160:333-337, 1972.
McKercher, D. F. y G. L. Crenshaw. Compar- ative effcacy of intranasally and parenteral- ly administered infectious bovine rhinotra-e cheitis vaccines. J Am Vet Med Assoc 159:
1362-1369, 1971.
Potgieter, L. N. D. y C. J. Maré, Differentiation of strains of infectious bovine rhinotracheitis virus by neutralization kinetics with late 19s rabbit antibodies. Infect Immun 10:520- 527, 1974.
Rouse, B. T. y L. A. Babiuk. Host defense mechanisms against infectious bovine rhi- notracheitis virus: In vitro stimulation of sensitized lymphocytes by virus antigen. Infect Immun 10:681-687, 1974.
Rouse, B. T. y L. A. Babiuk. Host responses to infectious bovine rhinotracheitis virus III. Isolation and immunologic activities of bovine T lymphocytes.] Immunol 113:1319- l
1398, 1974.
Rouse, B. T. y L. A. Babiuk. Host defense mechanisms against infectious bovine rhi- notracheitis virus II. Inhibition of vira1 plaque formation by immune peripheral blood limphocytes. Ce11 Immunol 17:43-56, 1975.
Rouse, B. T. y L. A. Babiuk. Defense mecha- nisms against infectious bovine rhinotrache- itis virus: Inhibition of virus infection by murine macrophages. Infect Immun 11:505- 511, 1975.
Sampson, G., T. Matsuoka. R. D. Olson. J. A. Miyat y L. V. Tonkinson. Clinical appraisal of an inactivated bovine rhinotracheitisl
(L
House RINOTRAOUEITIS INFECCIOSA BOVINA 43
para-influenza-3 vaccine with Pasteurella bacterin. Vet Med Small Anim Clin 67:1356- 1357, 1972.
(23) Saunders, J. R., S. M. Olson y 0. M. Radostit. Efflcacy of an intramuscular infectious bo- vine rhinotracheitis vaccine against abortion due to the virus. Can Vet J 13:273-278, 1972. (24) Schell, K., R. P. Sanderson, J. W. Whalen y J. L. Bittle. The antigenicity of multivalent vaccines for bovine respiratory disease. l (25) Schwartz, A. J. F., C. J. York, L. W. Zirbel y Cornell Vet 62:101-109, 1972.
L. A. Estella. Modification of infectious bo- vine rhinotracheitis (IBR) virus in tissue culture and development of a vaccine. Proc Soc Exp Biol Med’96:453-458, 1957. (26) Sheffy, B. E. y D. H. Davies. Reactivation of
a bovine herpesvirus after corticosteroid treatment. Proc Soc Exp Biol Med 140(3): 974-976, 1972.
(27) Sheffy, B. E. y S. Rodman. Activation of latent infectious bovine rhinotracheitis infec- tion. J Am Vet Med Assoc 163:850-851, 1973. (28) Snowdon, W. A. The IBR-IPV virus: Reaction
to infection and intermittent recovery of virus from experimentally infected cattle.
* Aust VetJ 41:135-142, 1965.
(29) Straub, 0. C. Die dureh IBR-IPY-Viren hervo- gerufenen Krankheiten bein Rind und ihre
Bekämpfung mit einem neuen Leben- dimpfstoff Bundesforschungsanstalt für Vi- ruskrankheiten der Tiere Tübingen. Alema- nia Occidental, 1972.
(30) Todd, J. D., F. J. Valenec e 1. M. Paton. Intra- nasal vaccinations against infectious bovine rhinotracheitis: Studies on early onset of pro- tection and use of the vaccine in pregnant cattle. J Am Vet Med Assoc 159:1370-1374,
1971.
(31) Todd, J. D., F. J. Valenec e 1. M. Paton. Inter- feron in nasal secretions and sera of calves after intranasal administration of a virulent infectious bovine rhinotracheitis virus: As- sociation of interferon in nasal secretions with early resistance to challenge with viru- lent virus. I$ect Immun 5:699-706, 1972. (32) York, C. J., A. J. F. Schwartz, L. W. Zirbel y L.
A. Estella, Infectious bovine rhinotracheitis vaccine-efficacy in controlled field trials. Vet Med 53:522, 1958.
(33) Zuschek, F. y T. L. Chow. Immunogenicity of 2 infectious bovine rhinotracheitis vaccines, J Am Vet Med Assoc 139:236-237, 1961. (34) Zygraich, N., M. Lobmann, E. Vascoboinic, E.
Berge y C. Huygelen. In vivo and tn vitre properties of a temperature-sensitive mutant of infectious bovine rhinotracheitis virus. Res Vet Sci 16:328-335, 1974.
Measures for the prevention and control of infectious bovine rhinotracheitis (Summary)
Protective immunity against infection with nasal vaccines are useful in pregnant cattle, infectious bovine rhinotracheitis (IBR) ap- or where it is desirable to establish interferon pears to involve the cell-mediated immune levels in the respiratory tract, resulting in response. The widely used parenteral modi- early protection. A general vaccination pro- fied live virus vaccines elicit both antibody gram using mainly parenteral modified live and cell-mediated responses and are effica- virus vaccines and basic measures for con- S cious in protecting against the respiratory trolling an IBR outbreak are outlined.
and reproductive forms of the disease. Intra-
Prevencão e controle da rinotraqueíte infecciosa bovina (Resumo)
44 BOLETIN DE LA OFICINA SANITARIA PANAMERICANA
l
Enero 1980
Prévention et contrôle de la rhino-trachéite infectieuse bovine (Résumé)
L’immunité protrectrice centre I’infection de la rhino-trachéite infectieuse bovine (RIB) in- troduirait la réponse immunisée grâce à la cel- lule. Les vaccins de virus vivant modifié pour I’administration par voie parentérale, tant am- plement utilisés, suscitent une réponse par I’intermédiaire, 2 la fois de I’anticorps et de la cellule et sont efficaces pour protéger centre les formes respiratoires et reproductrices de la mdladie. Les vaccins intranasaux sont titiles
pour les vaches pleines ou bien chaque fois qu’il importe augmenter des niveaux d’interféron dans le système respiratoire, ce qui se traduit par une protection précoce. Un compte rendu a été fait d’un programme général de vaccination qui utilise principalement des vaccins viriques vivants modiftés à usage parentéral et des me- sures essentielles permettant de contrôler une
poussée de RIB. l