DEPARTAMENTO DE CIÊNCIAS FISIOLÓGICAS
Programa de Pós-graduação em Ciências Fisiológicas
EFEITO DA SIMPATECTOMIA PROVOCADA PELA
GUANETIDINA SOBRE FÊMURES DE RATAS CASTRADAS
VALÉRIA GONÇALVES ALBIERI MATTOS
DEPARTAMENTO DE CIÊNCIAS FISIOLÓGICAS
Programa de Pós-graduação em Ciências Fisiológicas
EFEITO DA SIMPATECTOMIA PROVOCADA PELA
GUANETIDINA SOBRE FÊMURES DE RATAS CASTRADAS
VALÉRIA GONÇALVES ALBIERI MATTOS
Dissertação apresentada ao Programa de Pós-Graduação em Ciências Fisiológicas da Universidade Federal de São Carlos, como parte dos requisitos para obtenção do título de Mestre em Ciências Fisiológicas.
Orientadora: Profa. Dra. Keico Okino Nonaka
Ficha catalográfica elaborada pelo DePT da Biblioteca Comunitária da UFSCar
M444es
Mattos, Valeria Gonçalves Albieri.
Efeito da simpatectomia provocada pela guanetidina sobre fêmures de ratas castradas / Valeria Gonçalves Albieri Mattos. -- São Carlos : UFSCar, 2006.
77 p.
Dissertação (Mestrado) -- Universidade Federal de São Carlos, 2005.
1. Medicina experimental - rata. 2. Fêmur. 3. Sistema nervoso autônomo. 4. Ovariectomia. 5. Osteoporose. I. Título.
_______________________________________
OrientadoraAo meu esposo, Maurício, por ter sido meu
alicerce emocional nesta trajetória.
A minha filha, Camila, pelo amor recebido
através de seu olhar, incentivando minha inspiração.
Aos meus pais, Albieri e Cydha, pela segurança
transmitida.
Agradeço a todos que contribuíram de alguma forma para a realização deste trabalho, em especial:
À Profa. Dra. Keico Okino Nonaka, pela oportunidade em participar deste programa de Pós-graduação, e de conviver com sua competência e ética profissional no decorrer deste tempo;
Ao Programa de Pós-graduação em Ciências Fisiológicas da Universidade Federal de São Carlos, pela oportunidade de conquista deste título de Mestre;
Aos docentes e funcionários do Departamento de Ciências Fisiológicas, pela contribuição no desenvolvimento deste trabalho, especialmente Sr. Sérgio Dias;
À Profa. Dra. Heloísa Sobreiro Selistre de Araújo por ter disponibilizado seu laboratório (Laboratório de Farmacologia, Bioquímica e Biologia Molecular / Departamento de Ciências Fisiológicas – UFSCar) para a utilização do espectrofotômetro;
À Profa. Dra. Marisa Narciso Fernandes pela utilização do leitor de micro placas (ELISA) do Laboratório de Histologia e Microscopia / Departamento de Ciências Fisiológicas – UFSCar;
Dr. Luiz Antônio de Arruda Camargo / Departamento de Fisiologia – UNESP (Araraquara) pelas contribuições importantes no exame de qualificação;
Aos (ex e atuais) pós-graduandos do Laboratório de Neuroendocrinologia Adriana Adler Macagnan, Charles Chenwei Wang, Dernival Bertoncelo, Edvanina de Souza Costa Queiroz, Fernando Talhari, Fernando Vidal D’Ávila, Juciléia Barbosa Bezerra, Lidiângela Dias Vilar, Lucélia Maria Albertin, Luiz Carlos Paula Mello (in memorian), Patrícia Driusso pelo companheirismo indispensável ao cumprimento deste trabalho;
À Gabriela Schiffler, amiga e colega profissional, pelo apoio durante o tempo que estive afastada do consultório em prol do Mestrado;
Aos meus sogros, José Roberto Gomes de Mattos e Maria Angélica Loreti Mattos, pelo grande apoio.
Efeito da Simpatectomia Provocada pela Guanetidina sobre Fêmures de Ratas Castradas
A inervação simpática do osso influencia a atividade osteoblástica e providencia suporte para o papel do Sistema Nervoso Autônomo sobre a regulação da formação óssea. O tratamento com Guanetidina promove a desnervação do Sistema Nervoso Simpático, tanto em humanos quanto em animais. O objetivo do presente estudo foi investigar a atuação do Sistema Nervoso Simpático sobre fêmures de ratas adultas e castradas, por meio da análise de parâmetros biométricos, físicos, biomecânicos e concentração de cálcio no plasma e femur dos animais experimentais. Quarenta e uma ratas Wistar com 4 meses de idade foram divididas nos seguintes grupos experimentais: Basal (n=9), Intacto (n=8) – salina 0,1ml/Kg/PC, Castrado (n=7) - salina 0,1ml/Kg/PC, Castrado e Tratado por 6 semanas (n=9) – Guanetidina 37mg/Kg PC, Castrado e Tratado por 8 semanas (n=8) – Guanetidina 40mg/Kg PC. O tratamento foi realizado durante seis dias por semana, os animais foram mantidos sob um regime de luz (10 horas claro/ 14 horas escuro), com ração comercial e água “ad libitum”. Após 8 semanas, os animais foram sacrificados. A castração aumentou o ganho de Peso Corporal e induziu osteopenia. A não-atuação do sistema nervoso simpático periférico sobre o tecido ósseo, ocasionada pela simpatectomia induzida pela guanetidina, não promoveu proteção aos efeitos deletérios da castração, fato indicado pelos parâmetros de densidade óssea, densidade mineral, peso das cinzas, porcentagem de água, porcentagem de material mineral, rigidez e cálcio plasmático.
Effects of sympathectomy promoted by guanetidine on femurs of ovariectomized rats
The bone sympathetic innervation influences the osteoblastic activity and supports the participation of Autonomic Nervous System on the bone formation regulation. Treatment with guanetidine promotes denervation of the sympathetic system in humans as well as animals. This work aims at investigating participation of the sympathetic system on the femur biology of ovariectomized adult rats. For this purpose, physical and biomechanical parameters, in addition to plasma and femur calcium were analyzed. Forty one, 4-month aged female Wistar rats were divided into the following experimental groups: basal (n=9), intact (n=8) treated with 1ml saline/Kg BW, castrated and treated with 1ml saline/Kg BW (n=7), castrated and treated with 37 mg guanetidine/Kg BW during six weeks (n=9) and castrated and treated with 40 mg guanetidine/Kg BW during eight weeks (n=8). The treatment was performed during six days/week. The animals were housed under controlled temperature (22 ± 1°C) and light
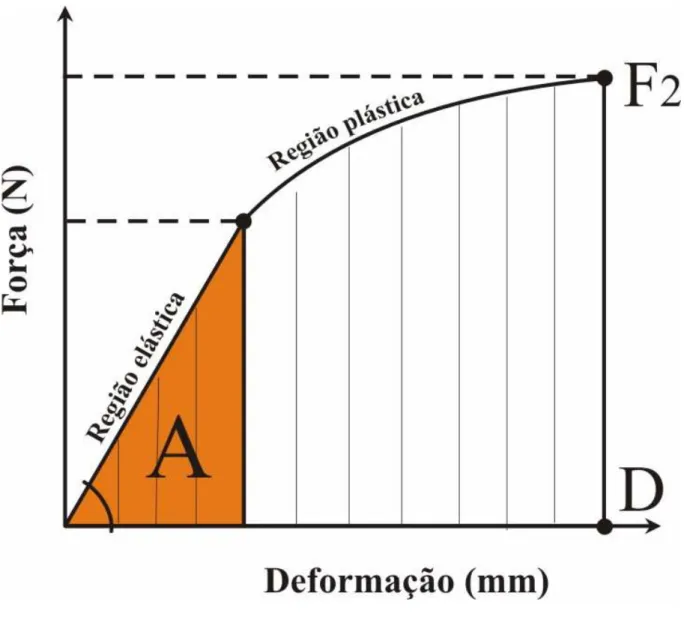
FIGURA 1. Foto da máquina de ensaio universal instron (modelo 4444)
demonstrando um teste de flexão a três pontos em um fêmur de rata... 26 FIGURA 2. Representação do gráfico força-deformação obtido durante o teste de
flexão a três pontos do fêmur de rata. Estão representadas as
definições das propriedades mecânicas analisadas neste estudo. Força máxima, deslocamento máximo, resiliência, tenacidade e rigidez... 27 FIGURA 3. Pesos corporais (iniciais e finais) e ganho de peso corporal das ratas
dos diferentes grupos experimentais... 32 FIGURA 4. Comprimento do fêmur, diâmetros maior e menor da diáfise femural
de ratas dos diferentes grupos experimentais... 34 FIGURA 5. Força máxima, deslocamento máximo, resiliência, tenacidade e
rigidez do fêmur das ratas dos diferentes grupos experimentais... 36 FIGURA 6. Peso das cinzas, volume ósseo, densidade óssea, densidade mineral
dos fêmures de ratas dos diferentes grupos experimentais... 38 FIGURA 7. Porcentagem de água, material mineral e material orgânico do fêmur
de ratas dos diferentes grupos experimentais... 40 FIGURA 8. Cálcio plasmático das ratas dos diferentes grupos experimentais e
TABELA 1. Pesos corporais (iniciais e finais) e ganho de peso... 31 TABELA 2. Comprimento do fêmur, diâmetros maior e menor da diáfise femural. 33 TABELA 3. Força máxima, deslocamento máximo, resiliência, tenacidade e
rigidez do fêmur das ratas dos diferentes grupos experimentais... 35 TABELA 4. Peso das cinzas, volume ósseo, densidade óssea, densidade mineral
dos fêmures de ratas ratas dos diferentes grupos experimentais... 37 TABELA 5. Porcentagem de água, material mineral e material orgânico do fêmur
de ratas dos diferentes grupos experimentais... 39 TABELA 6. Cálcio plasmático das ratas dos diferentes grupos experimentais e
conteúdo total de cálcio do fêmur dos animais experimentais... 41 TABELA 1. Pesos corporais (iniciais e finais) e ganho de peso... 31 TABELA 2. Comprimento do fêmur, diâmetros maior e menor da diáfise femural. 33 TABELA 3. Força máxima, deslocamento máximo, resiliência, tenacidade e
rigidez do fêmur das ratas dos diferentes grupos experimentais... 35 TABELA 4. Peso das cinzas, volume ósseo, densidade óssea, densidade mineral
dos fêmures de ratas ratas dos diferentes grupos experimentais... 37 TABELA 5. Porcentagem de água, material mineral e material orgânico do fêmur
de ratas dos diferentes grupos experimentais... 39 TABELA 6. Cálcio plasmático das ratas dos diferentes grupos experimentais e
ABNT – Associação brasileira de normas técnicas B – Grupo basal
C – Grupo castrado Ca+2 – Cálcio
Comp. – Comprimento ρ - Densidade
φ > - Diâmetro maior φ < - Diâmetro menor DM – Densidade mineral D Máx. – Densidade máxima DO – Densidade óssea EPM – Erro padrão da média Fig. – Figura
F Máx. – Força máxima
HRT – Terapia hormonal substitutiva I – Grupo Intacto
MM – Material mineral MO – Material orgânico n – Tamanho da amostra NBR – Normas brasileiras
OMS – Organização mundial de saúde
8 sem - Grupo castrado e tratado com guanetidina durante 8 semanas P – Peso do osso úmido
Pc – Peso das cinzas do osso PC – Peso corporal
Pi – Peso do osso imerso em água Pm – Peso das cinzas do osso Ps – Peso do osso seco % - Porcentagem
PTH – Hormônio da paratireóide Res – Resiliência
Rig – Rigidez
Sc – Injeção via subcutânea SD – Desvio padrão
6 sem - Grupo castrado e tratado com guanetidina durante 6 semanas SNA – Sistema nervoso autônomo
SNC – Sistema nervoso central Ten – Tenacidade
Trat / 6 sem – Grupo castrado e tratado com guanetidina durante 6 semanas Trat / 8 sem – Grupo castrado e tratado com guanetidina durante 8 semanas UFSCar – Universidade Federal de São Carlos
VO – Volume ósseo vs - Versos
1. INTRODUÇÃO... 11
1.1 Osteoporose... 11
1.2 Sistema nervoso autônomo... 16
1.3 Guanetidina... 17
1.4 Modelo experimental de osteoporose humana... 19
2. OBJETIVOS... 21
3. MATERIAIS E MÉTODOS... 22
3.1 Animais... 22
3.2 Ovariectomia... 22
3.3 Protocolo experimental... 22
3.4 Parâmetros estudados... 23
3.4.1 Propriedades biométricas... 23
3.4.2 Propriedades biomecânicas do fêmur... 24
3.4.3 Propriedades físicas dos fêmures direitos... 28
3.4.4 Cálcio plasmático e do fêmur direito... 29
3.5 Análise estatística... 30
4. RESULTADOS... 31
4.1 Propriedades biométricas... 31
4.2 Propriedades biomecânicas do fêmur... 34
4.3 Propriedades físicas dos fêmures direitos... 37
4.4 Cálcio plasmático e do fêmur direito... 40
5. DISCUSSÃO... 43
5.1 Propriedades biométricas e físicas... 43
5.2 Propriedades biomecânicas... 46
5.3 Cálcio plasmático e femural... 47
6. CONCLUSÕES... 50
7. REFERÊNCIAS BIBLIOGRÁFICAS... 51
1 INTRODUÇÃO
A osteoporose é uma doença que provoca não só um desequilíbrio psicológico no
indivíduo acometido, como também a sua exclusão em papéis sociais cotidianos (GOLD;
DREZNER, 1995).
O risco de sofrer uma fratura osteoporótica ao longo da vida tem sido estimado em
50% (risco elevado), quando comparado a 9% de câncer no seio e 31% de doenças da artéria
coronária. Seis meses após uma fratura de fêmur, idosos necessitam de assistência para suas
atividades diárias. Existe uma preocupação muito grande com a perda da independência
associada a fraturas (MINNICH, 1999).
Fraturas aumentam a morbidade e a mortalidade, impondo uma sobrecarga financeira
à comunidade. Na Austrália, este aumento custa $ 7 bilhões anualmente e isto aumentará em
valores absolutos de acordo com o envelhecimento da população. No Brasil existe escassez de
dados referentes a esses custos. O total de mortalidade é aproximadamente 20% nos primeiros
doze meses após uma fratura de fêmur. Apesar da morbidade, mortalidade e do aumento de
risco a futuras fraturas, mais pessoas com fraturas relacionadas à osteoporose não são tratadas
por falta de condição financeira (SEEMAN; EISMAN, 2004).
Portanto, a osteoporose poderá tornar-se a doença do século, se medidas urgentes não
forem tomadas para reverter este quadro (GOLD; DREZNER, 1995).
1.1 Osteoporose
O tecido ósseo é vital e dinâmico, mantendo-se em constante modificação. Este
dinamismo está ligado a vias metabólicas associadas a homeostasia mineral. O metabolismo é
osteoclastos, respectivamente. Isto ocorre em resposta a sinais químicos, mecânicos, elétricos
e magnéticos. Como conseqüência da maturidade esquelética, o osso tende a remodelar-se
durante toda a vida e adaptar suas propriedades materiais às sobrecargas mecânicas que
recebe. Em condições normais, o equilíbrio entre a formação e a reabsorção se faz através de
um processo chamado remodelagem óssea, que visa garantir a integridade das funções do
esqueleto, mantendo a sua competência biomecânica, prevenindo-o contra o acúmulo de
perigosas fadigas e protegendo os componentes teciduais para que estes estejam sempre
disponíveis para manter o equilíbrio mineral. A remodelagem óssea ocorre durante toda a
vida, sendo um fenômeno de superfície em locais como: periósteo, endósteo, canal haversiano
e superfície trabecular. (EINHORN, 1996; PARFITT; CHIR, 1987; RODAN; RODAN,
1995).
A dureza e rigidez do osso tornam o esqueleto capaz de manter sua forma e contorno,
protegendo os tecidos moles, providenciando um bom trabalho estrutural para a medula óssea
e transmitindo vigor à contração muscular em qualquer parte do corpo (PARFIT; CHIR,
1987).
Durante a vida humana ocorre um declínio gradual da massa óssea que é considerado
o principal constituinte da fragilidade óssea. Mudanças na matriz óssea também devem ser
levadas em conta. Dois fatores determinam o nível de massa óssea em qualquer idade, são
eles: o pico de massa óssea e a proporção e duração da perda óssea relacionada à idade. O
pico de massa óssea é alcançado durante as primeiras três décadas de vida. Fatores genéticos e
nutricionais, bem como o estresse mecânico sobre o esqueleto, também conferem um papel
crucial para a determinação do pico de massa óssea. Em mulheres pode-se distinguir perda
óssea relacionada puramente à idade, que tem como provável característica a diminuição da
pós-menopausal, quando ocorre uma maior ativação da reabsorção óssea, aumentando a atuação
osteoclástica (VÄÄNÄNEM, 1991).
No indivíduo hígido, até aproximadamente 30 anos de idade, a formação supera a
reabsorção, quando a massa óssea máxima é atingida. Entre 35 e 40 anos, a reabsorção e a
formação são equilibradas, sem ganho ou perda real. Após os 40 anos, a reabsorção supera a
formação e tanto mulheres quanto homens perdem todos os anos cerca de 0,3 a 0,5% da
massa óssea (BOGLIOLO, 1993).
Em mulheres após a menopausa, a perda óssea é acelerada. Esta proporção aumentada
de perda é associada ao aumento do turnover ósseo. Existe uma gradual perda de osso cortical
com a idade em ambos os sexos e ocorre uma aceleração deste processo em mulheres após a
menopausa. Dois processos resultam na diminuição do osso cortical: afinamento cortical e
aumento da porosidade cortical. No afinamento cortical o osteoclasto é o maior responsável,
pois ocorre um balanço ósseo negativo devido ao aumento da reabsorção profunda sobre a
superfície endosteal resultando em maiores espaços entre as trabéculas ósseas. Ocorre
também um ligeiro balanço ósseo positivo sobre a superfície periostal, no entanto este não é
suficiente para compensar o resultado anterior, tendo como conseqüência, um diâmetro
endosteal aumentado quando comparado ao diâmetro periostal e à espessura externa do córtex
ósseo. A porosidade aumenta em função de uma variedade de mudanças relacionadas à idade,
incluindo a diminuição da proporção radial de fechamento dos ósteons, um aumento do
diâmetro dos canais haversianos e um aumento do número de unidades de remodelagem que
são eliminadas durante a fase reversa resultando no fechamento das cavidades de reabsorção.
Estas mudanças podem ser classificadas como progressivas incompetências osteoblásticas
relacionadas à idade, que reduz o recrutamento e a capacidade da matriz óssea. (DEMPSTER,
Critérios foram propostos pela Organização Mundial de Saúde (OMS) em 1994, para
quantificar a mensuração da massa óssea, através de valores absolutos como a densidade
mineral óssea. Estes valores são importantes, pois são utilizados para monitorar as mudanças
de densidade mineral óssea ao longo do tempo. Indivíduos normais possuem um desvio
padrão (SD) maior que -1,0, tomando-se como referência a densidade mineral óssea média do
pico de massa óssea em adultos jovens. Indivíduos osteopênicos têm SD entre -1,1 e -2,5.
Indivíduos osteoporóticos possuem SD -2,5. Indivíduos com osteoporose estabelecida têm SD
menor que -2,5 na presença de fraturas (COOPER; MELTON, 1996; NETO et al., 2002;
SEEMAN; EISMAN, 2004).
Fatores de risco, como alcoolismo, fumo exagerado, falta de exercício físico, magreza
excessiva, uso demasiado de corticosteróide, fatores genéticos e também doenças como artrite
reumatóide, espondilite anquilosante, anemia hemolítica, anorexia nervosa entre outras,
podem acelerar a diminuição da massa óssea, tendo como resultado um desequilíbrio entre a
reabsorção e a formação (BOGLIOLO, 1993).
Segundo JOHNSTON & SLEMENDA (1995), a osteoporose pode ser definida como
uma patologia caracterizada pela redução da massa óssea e pela destruição da
microarquitetura do tecido ósseo, provocando um aumento da fragilidade óssea tendo como
conseqüência um aumento do risco de fraturas.
As principais manifestações clínicas da osteoporose são as fraturas, sendo mais
freqüentes em vértebras, fêmur e antebraço, podendo ocorrer como resultado de um trauma
mínimo ou até espontaneamente (NETO et al., 2002; VÄÄNANEM, 1991).
KHOSLA, RIGGS e MELTON (1995) classificam a osteoporose com o termo
“osteoporose involucional”, sendo esta caracterizada com o avanço da idade, admitindo
manifestações em ambos os sexos, sem identificar que a etiologia da doença tenha sido
óssea trabecular após a menopausa e tipo II, representando perda óssea cortical e trabecular,
em ambos os sexos, com o avanço da idade.
MARCUS (1996) classifica osteoporose como sendo primária, que ocorre em
mulheres após a menopausa por deficiência do hormônio esteróide gonadal, ou perda óssea
com o avanço da idade, tanto em homens quanto em mulheres, e secundária, quando
condições específicas, como por exemplo, certas doenças, procedimentos cirúrgicos ou uso de
algumas drogas podem ser responsáveis pela perda óssea.
Geralmente ocorrem severas limitações psico-sociais em pacientes com osteoporose
associadas a dores crônicas e agudas que afetam suas atividades de rotina. Isto compromete o
condicionamento físico destes indivíduos levando-os ao sedentarismo, diminuindo seu papel
social tanto familiar quanto profissional, aumentando a necessidade de suporte físico de
terceiros para sua própria condução. Como conseqüência psicológica temos a exacerbação dos
sintomas depressivos (GOLD & DREZNER, 1995).
Para que o indivíduo acometido com a osteoporose tenha uma melhor qualidade de
vida podem-se citar alguns tratamentos como a terapia hormonal substitutiva (HRT) para
prevenir a osteopenia pós-menopausal. O uso de raloxifene ou de bifosfonatos é apropriado
nos anos que sucedem a menopausa. O hormônio da paratireóide (PTH) pode exercer
estimulação na formação ou reabsorção óssea, a depender da dose e da forma a ser utilizada.
Suplementação de cálcio em indivíduos com idade acima de 65 anos e com deficiência de
1.2 Sistema Nervoso Autônomo
O Sistema Nervoso Autônomo (SNA) exerce papel central na manutenção da
homeostasia, envolvendo-se direta ou indiretamente em quase todos os processos fisiológicos
e fisiopatológicos. Este sistema é dividido em sistema simpático e parassimpático, cujos
principais neurotransmissores são a norepinefrina e acetilcolina, respectivamente. O sistema
nervoso simpático prepara rapidamente o organismo para a defesa física (por luta ou fuga)
frente a situações emergenciais, providencia suprimento sangüíneo com quantidades
necessárias de oxigênio e nutrientes para músculos estriados e sistema nervoso central (SNC).
Ele é ativado com a chegada de estímulo limiar provocando liberação, por exocitose, do
neurotransmissor (norepinefrina) para a fenda sináptica. Em concentrações baixas, a
norepinefrina estimula sua própria liberação, atuando em receptor β pós-sináptico. Em altas
concentrações na fenda sináptica, o neurotransmissor freia sua liberação atuando em receptor
α pré-sináptico, também chamado de auto-receptor (THADDEU; FUCHS, 1972).
Vários estudos demonstram que o periósteo e o tecido ósseo são altamente inervados
por fibras sensoriais e simpáticas, mostrando que esta influência tem importância especial nos
processos de formação e reabsorção óssea. Muitos neuropeptídeos tem sido vistos como
moduladores locais do metabolismo ósseo, influenciando o fluxo sangüíneo medular e
periosteal, angiogênese e nocicepção, em adição a efeitos diretos sobre osteoblastos e
osteoclastos. Sabe-se também que atividades celulares ósseas são moduladas localmente por
neurohormônios através de sinais via nervos simpáticos periféricos (MADSEN et al., 1996).
Durante o crescimento corporal, o sistema nervoso simpático participa da regulação
fisiológica óssea. Sua atuação pode ser exercida centralmente através do hipotálamo com a
cuja função é inibir a formação óssea. Receptores de vários neurotransmissores são expressos
em células ósseas (CHERRUAU et al., 1999, 2003; ADAM et al., 1999).
1.3 Guanetidina
A Guanetidina é a [2-(octaidro-1-azocinil) etil] guanidina, composto sintético que
provoca efeitos de depleção das catecolaminas, em parte semelhantes ao da reserpina
(CORBERTT, 1977).
Guanetidina é uma neurotoxina conhecida por afetar somente neurônios
noradrenérgicos periféricos (VILLANUEVA et al., 2003).
Simpatectomia é definida como a seletiva destruição de neurônios simpáticos
pós-ganglionares usando norepinefrina como seu neurotransmissor primário. Guanetidina tem
vários efeitos sobre neurônios simpáticos periféricos, incluindo o bloqueio da transmissão
neural, depleção do armazenamento neuronal de norepinefrina e bloqueio da recaptação de
norepinefrina para o interior de neurônios, produzindo coletivamente uma simpatectomia
funcional. Esta simpatectomia não é somente uma técnica simples, rápida e econômica
comparada com outros tipos de simpatectomia, mas também é mais efetiva na abolição do
conteúdo norepinefrinérgico do que desnervação cirúrgica ou a desnervação produzida pela
anti-dopamina β-hidroxilase-saporina (DBH-SAP) (DEMAS;BARTNESS,2001).
Ptose palpebral é um sinal clínico que demonstra o sucesso da simpatectomia,
ocorrendo tanto na simpatectomia cirúrgica como na química (CHERRUAU et al.,1999,
Mecanismo de Ação
Guanetidina é atraída unicamente por neurônio adrenérgico periférico, inibindo funções
simpáticas. Ao ligar-se às vesículas de armazenamento no neurônio, alcança seu sítio de ação
através do transporte ativo que é consumado pelo mecanismo de recaptação da norepinefrina.
Inicialmente a guanetidina processa o bloqueio simpático pela inibição da liberação da
norepinefrina que normalmente segue a estimulação do nervo. Depois, a guanetidina processa a
depleção da norepinefrina neuronal. Em algumas ocasiões a guanetidina é evocada como
“neurotransmissor falso”, estando presente em vesículas de armazenamento ocupando o lugar
do transmissor normal, sendo ela, então, liberada pelo estímulo que normalmente liberia a
norepinefrina (GILMAN et al., 1990).
Absorção, Metabolismo e Excreção
A biodisponibilidade da guanetidina é baixa e variável, e apenas 3% da dose oral,
quando administrada em humanos, alcança a circulação sistêmica. A droga é rapidamente
transportada para seu sítio de ação intraneural, sendo eliminada com uma meia-vida de 5
(cinco) dias. Aproximadamente 50% da droga é metabolizada e o restante é excretado,
possuindo a mesma composição na urina. Em função da meia-vida longa, a guanetidina pode
ser administrada em doses diárias. Repetidas doses diárias poderão ficar acumuladas por no
mínimo 2 (duas) semanas (GILMAN et al.,1990).
Em humanos podem ocorrer fenômenos ortostáticos, como atordoamento e adinamia,
que se agravam com exercícios, estes são os efeitos colaterais mais freqüentes. Fraqueza e dor
muscular com tremores dos membros podem ocorrer. A retenção de fluidos pode ser
contornada com diuréticos orais. A diarréia manifesta-se, sendo atribuída à predominância
parassimpática. Perturbações sexuais, como a impotência e a incapacidade ejaculatória são
observadas ocasionalmente. É rara a tolerância à guanetidina (CORBERTT, 1977). Em ratos,
pode ocorrer diarréia intensa e ptose palpebral.
1.4 Modelo experimental de osteoporose humana
Um animal vivo com perda óssea induzida ou espontânea e que possui semelhança de
um ou mais sintomas de seqüelas osteoporóticas encontradas em mulheres após a menopausa,
pode ser definido como um modelo animal adequado (KALU, 1991).
Experimentos animais in vivo são muito usados em pesquisa de osteoporose. Critérios
básicos para modelos animais de osteoporose serem usados, são: conhecimento sobre
osteoporose humana, conhecimento fundamental do esqueleto humano e animal,
experimentos que nos permitam utilizar o mesmo agente em espécies animais diferentes
(KIMMEL, 1996).
O rato pode fornecer bons modelos para estudos sobre osteopenia relacionada à
osteoporose humana e outros importantes problemas relacionados ao esqueleto humano,
embora não haja animal que atenda todos os requisitos de um modelo ideal (FROST & JEE,
1992; KALU, 1991; THOMPSON et al, 1995).
Existe uma variedade de condições endócrinas deficientes ou em excesso que levam a
hiperparatiroidismo, hipertiroidismo, hiperprolactinemia, diabete induzido, falência renal
induzida, aumento de glicocorticóides e adrenalectomia. A ovariectomia é o modelo mais
popular para se estudar os eventos associados à osteopenia pós-menopausal. Após a
ovariectomia, ocorre nas ratas um crescimento endocondral, aposição periostal e turnover
ósseo trabecular com reabsorção excedendo a formação. A ovariectomia tem sido utilizada
para induzir osteopenia e aumentar o turnover ósseo em ratas (WRONSKI et al., 1989). Ratas
ovariectomizadas apresentam deficiência de hormônios sexuais acelerando a perda óssea,
como ocorre em mulheres após a menopausa (KALU, 1991; MILLER; BOWMAN ; JEE,
2 OBJETIVOS
Geral
Verificar a influência da desnervação simpática provocada pela guanetidina sobre as
características ósseas de fêmures de ratas ovariectomizadas, utilizadas como modelo de
osteoporose experimental, observando a correlação entre os parâmetros biomecânicos e as
propriedades físicas e químicas dos ossos.
Específicos
Observar o crescimento ponderal das ratas dos diferentes grupos experimentais;
Verificar a eficácia do procedimento metodológico utilizado para promover osteopenia
em ratas;
Verificar a eficácia do procedimento metodológico utilizado para promover
desnervação simpática;
Analisar a atuação do sistema nervoso simpático sobre parâmetros físicos e
biomecânicos do fêmur sobre a osteopenia induzida pela castração em ratas.
3 MATERIAIS E MÉTODOS
3.1 Animais
Utilizou-se ratas Wistar adultas com quatro meses de idade no início do tratamento,
provenientes do Biotério Central da Universidade Federal de São Carlos – UFSCar.
O experimento realizou-se no laboratório de Neuroendocrinologia do Departamento de
Ciências Fisiológicas da UFSCar. As ratas foram mantidas no biotério deste laboratório, num
regime de luz (10 horas claro e 14 horas escuro) e temperatura controlados (25° ± 2°C). Os
animais receberam ração comercial e água “ad libitum”.
Os animais foram sacrificados por decapitação ao término de cada experimento, o
sangue do tronco foi coletado, e os fêmures foram dissecados e mantidos em salina a 0,9% em
uma temperatura de –20°C até o inicio das análises.
3.2 Ovariectomia
A ovariectomia foi realizada segundo a técnica descrita por ZARROW et al (1964).
A osteopenia aparece dois meses após a ovariectomia (KALU, 1991; THOMPSON et
al, 1995).
3.3 Protocolo Experimental
Analizou-se os efeitos da Guanetidina sobre as características ósseas, dividindo
aleatóriamente os animais em diferentes grupos experimentais.
GRUPO INTACTO (I) – Animais intactos tratados com salina 0,9%, via subcutânea
(sc), com aplicação de 0,1ml / 100g de peso corporal (PC), sacrificados aos 6 meses de idade.
GRUPO CASTRADO (C) – Animais ovariectomizados tratados com salina 0,9%, via
sc, com aplicação de 0,1ml / 100g de PC, sacrificados com 6 meses de idade.
GRUPO TRATADO POR 6 SEMANAS (6 SEM) – Animais ovariectomizados
tratados com guanetidina. Utilizou-se uma dose de 37mg/kg PC, via sc. (CHERRUAU et al.,
1999).
GRUPO TRATADO POR 8 SEMANAS (8 SEM) - Animais ovariectomizados
tratados com guanetidina. Utilizou-se uma dose de 40mg / kg PC, via sc.
Iniciou-se o tratamento, nos diferentes grupos experimentais, 24 horas após a
ovariectomia, sendo feito uma vez por dia, durante o período da manhã (entre 11- 12 horas),
seis dias por semana.
3.4 Parâmetros Estudados
3.4.1 Propriedades Biométricas
Peso Corporal
O peso corporal de cada animal dos diferentes grupos experimentais foi verificado
semanalmente, tanto para a correção do volume da droga ou do veículo utilizado, como para a
Comprimento dos fêmures
Anteriormente à realização do teste de flexão a três pontos (descrita a seguir), com a
utilização de um paquímetro, mediu-se o comprimento dos fêmures.
Diâmetros Externos da Diáfise Femural
Anteriormente ao teste de flexão a três pontos, com a utilização de um paquímetro,
mediu-se os diâmetros maior e menor da diáfise femural, na porção distal do osso.
3.4.2 Propriedades Biomecânicas do Fêmur
Ensaio Mecânico de Flexão a três Pontos
Foi realizado o teste biomecânico (flexão óssea) com o fêmur direito. Doze horas antes
dos ensaios, os ossos foram descongelados à temperatura ambiente e mantidos em solução
salina até o momento que antecedeu ao teste. Os ensaios mecânicos foram realizados em uma
Máquina de Ensaio Universal Instron, modelo 4444 (fig. 1), em temperatura ambiente
(ENGESAETER ;EKELAND & LANGELAND, 1978; PENG et al, 1994). As extremidades
do fêmur ficaram apoiadas em dois roletes com diâmetro de 3,0mm, suportados por apoios
distanciados de 21,70mm.
A força foi aplicada perpendicularmente ao eixo longitudinal do osso, no sentido
póstero-anterior, no meio da distância entre os dois apoios, por uma haste cilíndrica com o
rolete de 3,0mm fixada na sua extremidade, numa velocidade constante de 0,5 cm/min., até a
monitorados e registrados através de um software, próprio do equipamento. Foi utilizada a
célula de carga Instron, modelo CM, com capacidade máxima de 100 Kgf.
Desse modo, foram obtidas as curvas de força-deformação para os diversos ensaios e
os parâmetros relacionados a seguir foram analizados (fig. 2).
Força Máxima (N)
Caracteriza a maior força aplicada no ensaio, também conhecida como última força
(F2).
Resiliência (mJ)
Determinada pela área sob a curva força-deformação até o limite elástico (A).
Tenacidade (mJ)
Determinada pela área sob a curva força-deformação até o ponto de ruptura óssea
( ).
Rigidez (N/mm)
Obtida através da inclinação da reta (R) ajustada aos pontos da curva
força-deformação na fase elástica.
Deslocamento Máximo (cm)
Figura 1. Foto da máquina de ensaio universal Instron (modelo 4444) demonstrando um teste de flexão a três pontos em um fêmur de rata. A: painel de controle; B: haste cilíndrica para a aplicação de carga (força); C: osso; D: suporte; E: célula de carga ligada à ponte de extensiometria.
A B
C
3.4.3 Propriedades Físicas dos Fêmures Direitos
Após o término do teste de flexão a três pontos, os fêmures direitos foram mantidos
em água destilada e colocados no dessecador durante 24 horas com a finalidade de retirar o ar
dos poros ósseos.
Os seguintes parâmetros foram verificados: Peso imerso (Pi) e peso úmido (P). A
seguir, os ossos foram desidratados em uma estufa (marca Funbec) a 100ºC, durante 24 horas,
obtendo-se assim o peso seco (Ps).
Para obtenção do peso das cinzas (Pm), os ossos foram colocados em uma mufla a
800ºC durante 24 horas. Para tais mensurações foi utilizada uma balança eletrônica (marca
Chyo).
A densidade mineral e óssea dos fêmures direitos, bem como os percentuais ósseos,
mineral e orgânico, foram calculados a partir das equações abaixo, que seguem o Princípio de
Arquimedes.
Pu -Pi
Volume Ósseo= _______Pu -Piρ (cm3) Volume Ósseo= _______ρ (cm3) Volume Ósseo= _______ρ (cm3)
Densidade Mineral= ______________Pm Volume ósseo
(g/cm3) Densidade Mineral= ______________Pm
Volume ósseo
(g/cm3)
Pu – Ps Percentual Ósseo da Água = ________
Pu 100 (%) Pu – Ps
Percentual Ósseo da Água = ________ Pu Pu – Ps Percentual Ósseo da Água = ________Pu – Ps Percentual Ósseo da Água = ________ Percentual Ósseo da Água = ________
Pu 100 (%) Densidade Óssea= ______________Pu
Volume ósseo
(g/cm3) Densidade Óssea= ______________Pu
Volume ósseo Densidade Óssea= ______________Pu
Volume ósseo
Onde:
Pm – Peso do Material Mineral (g)
Ps – Peso Ósseo da Amostra Desidratada (g)
Pu – Peso Úmido do Osso (g)
Pi – Peso do Osso Imerso (g)
ρ - Densidade da Água (g/cm3)
3.4.4 Cálcio Plasmático e do Fêmur Direito
Foram analisadas as concentrações plasmáticas de cálcio dos animais com a utilização
de um kit comercial colorimétrico da marca Labtest.
Após a obtenção do material mineral, os ossos foram solubilizados em ácido clorídrico
2N e o conteúdo de cálcio foi determinado utilizando-se o mesmo kit citado anteriormente. Pu
100 (%) Percentual Ósseo de Material Orgânico = ________
Ps - Pm
Pu
100 (%) Percentual Ósseo de Material Orgânico = ________
Ps - Pm
100 (%) Percentual Ósseo de Material Orgânico = ________
Ps - Pm Percentual Ósseo de Material Orgânico = ________ Percentual Ósseo de Material Orgânico = ________ Ps - Pm
Pu 100 (%) Percentual de Material Mineral = ______Pm
Pu 100 (%) Percentual de Material Mineral = ______
Pu 100 (%) Percentual de Material Mineral = ______
3.5 Análise Estatística
Os resultados obtidos foram comparados entre os grupos experimentais e dentro de
cada grupo. Para isto foram utilizados os testes de ANOVA e não-paramétricos de
Mann-Whitney, aplicados pelo Software Instat.
Normas Técnicas referentes à elaboração deste trabalho
A estrutura geral deste trabalho, bem como as referências bibliográficas e citações,
seguem a NBR 6023 e 14724 de março de 2004, de autoria da Associação Brasileira de
4 RESULTADOS
Todos os animais tratados com guanetidina apresentaram ptose palpebral e diarréia intensa.
4.1 Propriedades Biométricas
Peso Corporal
A tabela 1 e figura 3, apresentam os valores de Peso Corporal inicial e final e o ganho
de peso dos animais dos diferentes grupos experimentais.
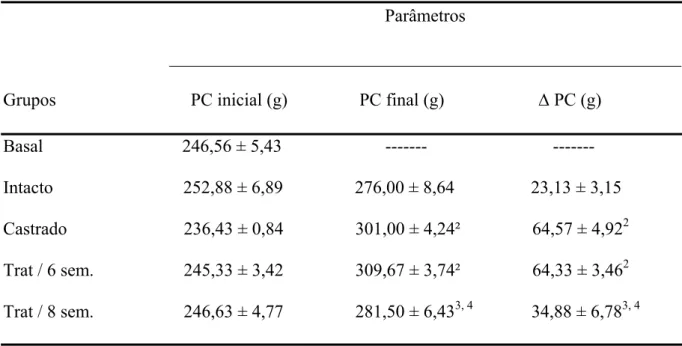
Tabela 1 - Pesos Corporais (PC) iniciais, finais e ganho de peso (∆) dos animais dos diferentes
grupos experimentais.
Parâmetros
_________________________________________________________
Grupos PC inicial (g) PC final (g) ∆ PC (g)
Basal 246,56 ± 5,43 --- ---
Intacto 252,88 ± 6,89 276,00 ± 8,64 23,13 ± 3,15
Castrado 236,43 ± 0,84 301,00 ± 4,24² 64,57 ± 4,922
Trat / 6 sem. 245,33 ± 3,42 309,67 ± 3,74² 64,33 ± 3,462
Trat / 8 sem. 246,63 ± 4,77 281,50 ± 6,433, 4 34,88 ± 6,783, 4
Não se observa diferença do Peso Corporal inicial entre os diferentes grupos
experimentais. Os grupos Castrado e o Trat/ 6 sem. apresentam maior ganho de Peso Corporal
em relação ao grupo Intacto. O grupo Trat/ 8 sem apresenta menor ganho de PC ao ser
comparado com os grupos Castrado e Trat/ 6 sem.
Figura 3. Média ± EPM do ganho de peso corporal (A) e peso corporal inicial e final (B) dos animais dos diferentes grupos experimentais, n=7-9, 2
p< 0,05 vs Intacto, 3vs Castrado, 4 vs Trat / 6 sem.
Comprimento e diâmetros
A tabela 2 e figura 4, apresentam os valores de comprimento do fêmur e diâmetros
Tabela 2 - Comprimento (comp) do fêmur, diâmetro maior (Ø >) e menor (Ø <) da diáfise
femural dos animais dos diferentes grupos experimentais.
Parâmetros
________________________________________________________
Grupos comp. (mm) Ø >(mm) Ø <(mm)
Basal 34,1 ± 0,29 3,7 ± 0,06 2,8 ± 0,02
Intacto 36,0 ± 0,391 4,1 ± 0,091 2,9 ± 0,07
Castrado 36,6 ± 0,181 4,2 ± 0,251 2,8 ± 0,05
Trat / 6 sem 36,7 ± 0,131 4,0 ± 0,051 2,9 ± 0,03
Trat / 8 sem 35,4 ± 0,351,3,4 4,0 ± 0,061 3,0 ± 0,041
Média ± EPM, n= 7-9, para 1 p < 0,05 vs Basal, para 3vs Castrado, para 4vs Trat / 6 sem.
O grupo Basal apresentou diâmetro maior da diáfise e comprimento dos fêmures
menores do que os demais grupos. O diâmetro menor do grupo Trat / 8 sem. foi maior do que
o do grupo Basal. O grupo Trat / 8 sem. apresentou menor valor para comprimento quando
Figura 4. Média ± EPM do Comprimento do fêmur (A), Diâmetros Maior e Menor da diáfise femural (B) de ratas dos diferentes grupos experimentais, n= 7-9, para 1 p < 0,05 vs Basal, 3vs
Castrado, 4vs Trat / 6 sem.
4.2 Propriedades Biomecânicas
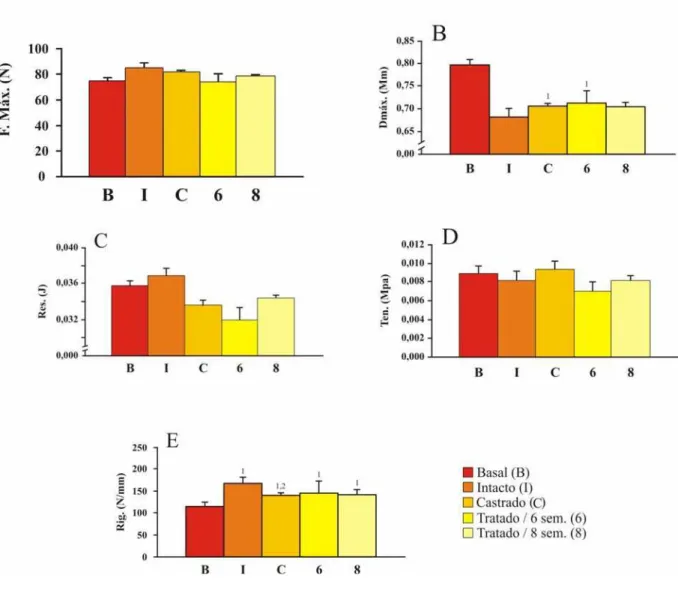
A tabela 3 apresenta os valores de Força Máxima, Deslocamento Máximo, Resiliência,
Tenacidade e Rigidez de fêmures de ratas dos diferentes grupos experimentais, obtidos com o
Tabela 3 - Força Máxima (Fmáx), Deslocamento Máximo (Dmáx), Resiliência (Res),
Tenacidade (Ten) e Rigidez (Rig) obtidos com o teste de flexão a 3 pontos com os fêmures
dos animais dos diferentes grupos experimentais.
Parâmetros
________________________________________________________________
Grupos Fmáx (N) Dmáx (cm) Res (J) Ten (Mpa) Rig(N/cm)
Basal 74,9 ± 2,84 0,795 ± 0,04 0,035 ± 0,002 0,0088 ± 0,0008 115,9 ± 6,82
Intacto 85,2 ± 3,96 0,681 ± 0,021 0,036 ± 0,002 0,0082 ± 0,0008 167,7 ± 9,701
Castrado 81,2 ± 1,81 0,705 ± 0,02 0,033 ± 0,002 0,0093 ± 0,0008 140,4 ±
4,301,2
6 sem 73,6 ± 9,49 0,711 ± 0,081 0,031 ± 0,005 0,0069 ± 0,0010 143,9 ± 19,01
8 sem 78,2 ± 1,75 0,703 ± 0,03 0,034 ± 0,001 0,0082 ± 0,0005 142,0 ± 7,861
Média ± EPM, n=7-9, para 1 p< 0,05 vs Basal, 2 vs Intacto.
Os valores de Fmáx (fig. 5A) não diferiram entre os diferentes grupos experimentais.
Valores menores são observados quando se analisa o Deslocamento Máximo (fig. 5B) dos
grupos Intacto e Trat / 6sem comparando-os ao grupo Basal. Não se observa diferença entre
os grupos nos parâmetros Resiliência (fig. 5C) e Tenacidade (fig. 5D). O grupo Basal
apresentou menor Rigidez (fig. 5E) do que os demais grupos. O grupo Castrado apresentou
4.3 Propriedades Físicas
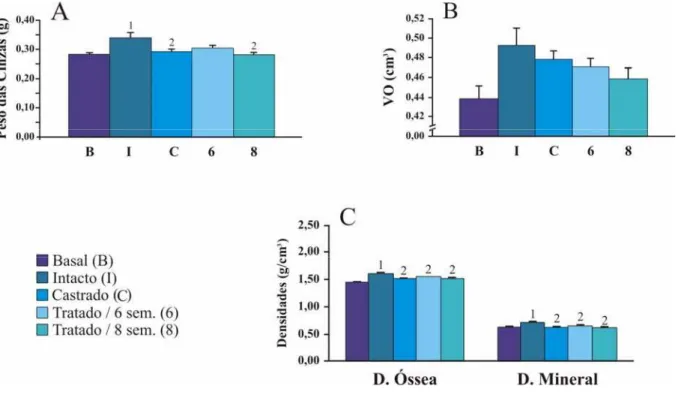
A tabela 4 e a figura 6, apresentam valores para peso das cinzas, volume ósseo,
densidade óssea e densidade mineral de fêmures de ratas dos diferentes grupos experimentais.
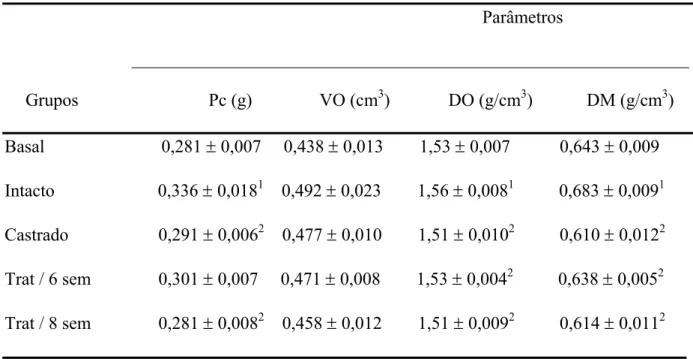
Tabela 4 - Peso das cinzas (Pc), volume ósseo (VO), densidade óssea (DO) e densidade
mineral (DM) dos fêmures de ratas dos diferentes grupos experimentais.
Parâmetros
______________________________________________________________
Grupos Pc (g) VO (cm3) DO (g/cm3) DM (g/cm3)
Basal 0,281 ± 0,007 0,438 ± 0,013 1,53 ± 0,007 0,643 ± 0,009
Intacto 0,336 ± 0,0181 0,492 ± 0,023 1,56 ± 0,0081 0,683 ± 0,0091
Castrado 0,291 ± 0,0062 0,477 ± 0,010 1,51 ± 0,0102 0,610 ± 0,0122
Trat / 6 sem 0,301 ± 0,007 0,471 ± 0,008 1,53 ± 0,0042 0,638 ± 0,0052
Trat / 8 sem 0,281 ± 0,0082 0,458 ± 0,012 1,51 ± 0,0092 0,614 ± 0,0112
Média ± EPM, n=7-9, para 1 p< 0,05 vs Basal, 2 vs Intacto.
O peso das cinzas (fig. 6A) foi maior para o grupo Intacto quando comparado aos
grupos Basal e Castrado e Trat./ 8 sem. Os valores de volume ósseo (fig. 6B) não diferiram
entre os diferentes grupos experimentais. Quanto à densidade óssea e mineral (fig. 6C),
animais do grupo Intacto apresentaram maiores valores quando comparados ao grupo Basal.
Porém, os animais dos grupos Castrado, Trat / 6 sem. e Trat / 8 sem. tiveram valores menores
Figura 6. Média ± EPM do peso das cinzas (A), volume ósseo (VO) (B), densidade óssea e densidade mineral (C), obtidos através de ensaios físicos em fêmures de ratas dos diferentes grupos experimentais, n=7-9, para 1 p< 0,05 vs Basal, 2 vs Intacto.
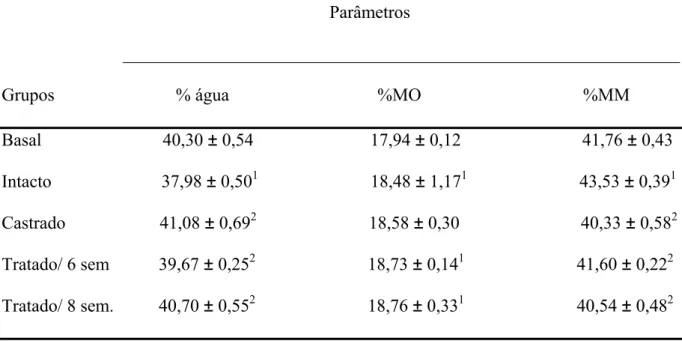
A tabela 5 e a figura 7 apresentam os valores de porcentagem de água, de material
Tabela 5 - Porcentagem de água (% água), de material orgânico (%MO) e de material mineral
(%MM) dos fêmures de ratas dos diferentes grupos experimentais.
Parâmetros
______________________________________________________________
Grupos % água %MO %MM
Basal 40,30 ± 0,54 17,94 ± 0,12 41,76 ± 0,43
Intacto 37,98 ± 0,501 18,48 ± 1,171 43,53 ± 0,391
Castrado 41,08 ± 0,692 18,58 ± 0,30 40,33 ± 0,582
Tratado/ 6 sem 39,67 ± 0,252 18,73 ± 0,141 41,60 ± 0,222
Tratado/ 8 sem. 40,70 ± 0,552 18,76 ± 0,331 40,54 ± 0,482
Média ± EPM, onde n=7-9, para 1 p< 0,05 vs Basal, para 2 p< 0,05 vs Intacto.
O grupo Intacto apresenta menor porcentagem de água (fig. 7A) e maiores
porcentagens de material orgânico e mineral (fig. 7B) do que o Grupo Basal. Os grupos
Trat/6sem. e Trat/8sem. apresentam maior porcentagem de material orgânico que o grupo
Basal. Os grupos Castrado, Tratado/6 sem. e Tratado/8 sem. apresentam maior porcentagem
de água e menor porcentagem de material mineral que o grupo Intacto. As porcentagens de
água, material orgânico e material mineral dos grupos tratados foram semelhantes ao grupo
Figura 7. Média ± EPM da porcentagem de material orgânico e mineral (A) e porcentagem de água (B), obtidos através de ensaios físicos em fêmures de ratas dos diferentes grupos experimentais, n=7-9, para 1 p< 0,05 vs Basal, 2 vs Intacto.
4.4 Cálcio Plasmático e do Fêmur
A tabela 6 e a figura 8 apresentam os valores de cálcio plasmático (Ca+2 Plasmático) e
Tabela 6 – Cálcio Plasmático (Ca+2 Plasmático) e conteúdo total de cálcio do fêmur dos
animais dos diferentes grupos experimentais.
Parâmetros
________________________________________________________________
Grupos Ca+2 Plasmático (mg/dl) Conteúdo Total Ca+2 (mg)
Basal 10,21 ± 0,1804 144,7 ± 4,8348
Intacto 9,26 ± 0,1207¹ 169,9 ± 9,7852¹
Castrado 9,37 ± 0,1366¹ 155,9 ± 3,1503
Trat / 6 sem. 8,87 ± 0,0992¹,²,³ 148,9 ± 5,7059
Trat / 8 sem. 8,89 ± 0,2249¹ 147,8 ± 6,6886
Média ± EPM, n=7-9, 1 p< 0,05 vs Basal, 2vs Intacto, 3vs Castrado.
Valores menores são observados ao analisar cálcio plasmático das ratas dos grupos
Intacto, Castrado, Trat/ 6 sem, Trat / 8 sem comparando-os ao grupo Basal, e ainda, ao
comparar o grupo Trat / 6 sem com os grupos Intacto e Castrado (fig. 8A). O grupo Intacto
Figura 8. Média ± EPM de Cálcio Plasmático (A) e conteúdo total de cálcio (B) do fêmur de ratas dos diferentes grupos experimentais, n= 7-9, para 1 p < 0,05 vs Basal, 2vs Intacto, 3vs Castrado.
5 DISCUSSÃO
5.1 Propriedades Biométricas e Físicas
De acordo com diversos estudos, animais ovariectomizados apresentam maior ganho
de peso corporal, quando comparados a animais intactos (COXAM et al., 1996; ERBEN et
al., 1996; HOCK et al., 1988; KALU,1991; PENG et al., 1994). No presente estudo
encontrou-se resultado semelhante para o grupo castrado e tratado/ 6 sem. em relação aos
Intactos, como observado por vários autores (AKHTER et al., 2002; BREITMAN et al.,
2003; DAÍ et al., 2003; JIANG et al., 1995; KALU et al., 1989; KATSUMATA et al., 1995;
KE et al., 1995; 1997; SATO; ZENG; TURNER, 1997; TURNER et al., 1995). Entretanto, o
aumento do peso corporal dos animais do grupo tratado/ 8 sem. foi menor do que o do grupo
Castrado (tabela 1, figura 3A e 3B). O SNS apresenta ação inibitória sobre a secreção de
Leptina, levando a um aumento de sua concentração no plasma de animais simpatectomizados
(EIKELIS et al., 2003; RAYNER, 2001). Estas maiores concentrações plasmáticas de
Leptina - hormônio com função anorexigênica, segundo ELEFTERIOU et. al. (2004) -
poderia provocar uma diminuição da ingesta alimentar nestes animais, que acarretaria menor
ganho de peso corporal. Porém, como o ganho de peso corporal do grupo Tratado / 6 semanas
não diferiu do grupo apenas castrado, provavelmente esta não seria a explicação. Animais
tratados com guanetidina desenvolvem diarréia, fato que pode dificultar a absorção de
nutrientes e influenciar ganho de peso corporal. Provavelmente este seria o motivo dos
tempo, além de terem recebido guanetidina em maior concentração (40mg/Kg PC) do que os
Trat. / 6 sem (37mg/Kg PC).
O comprimento do fêmur e o diâmetro maior da diáfise femural mostraram-se maiores
para os animais de todos os grupos em relação ao grupo Basal (tabela 2, figura 4A). Estes
dados corroboram com DRIUSSO (2003), cuja metodologia adotada foi semelhante a do
presente estudo, e com KALU (1991), quando demonstra que em modelo de ratos sexualmente
maduros o crescimento ósseo é consideravelmente mais lento, mas não cessa, motivo pelo qual
há necessidade de incluir um grupo de animais sacrificados no início do experimento, como
controle basal. O grupo Trat. / 8 sem. apresentou menor desenvolvimento uma vez que o
ganho de peso corporal (tabela 1, figura 3A) e o comprimento do fêmur (tabela 2, figura 4A)
foram menores, quando comparado aos grupos Castrado e Trat. / 6 sem. Este menor
desenvolvimento provavelmente se deve ao fato que após a desnervação, a leptina periférica
encontra-se em concentrações altas, atuando de forma inibitória sobre a formação óssea, além
da ocorrência da diarréia discutida anteriormente, por isso, cabe aqui mostrar o conceito de que
a via de regulação da massa óssea pela leptina é distinta em relação ao peso corporal (DUCY et
al., 2000; EIKELIS et al., 2003; TAKEDA et. al. , 2002; TAKEDA; ELEFTERIOU;
KARSENTY, 2003; TAKEDA, 2004), e mais, o fato dos animais Trat. / 8 sem. terem recebido
administração de guanetidina em doses mais altas (40mg/Kg PC dia) e durante um tempo maior
que os animais Trat. / 6 sem. (37mg/Kg PC dia), pode ter conduzido uma atuação
anti-osteogênica mais eficaz nos animais que receberam tratamento por mais tempo.
A aparente variabilidade observada dos parâmetros biométricos (peso corporal,
comprimento, diâmetro maior e menor) (tabela 1 e 2, figuras 3A, 3B, 4A, 4B,
respectivamente) talvez possa ser explicada pelo fato de ter sido utilizado ratas sexualmente
maduras avaliadas 8 semanas após a castração como observado por PENG et al. (1994).
apresentar aceleração do crescimento linear ósseo, pois a deficiência de estrógeno pode
acarretar em um aumento potencial do crescimento ósseo, aumentando o volume ósseo
trabecular metafiseal. Quando esse efeito ocorre, é apenas transitório, pois com o passar do
tempo o efeito da deficiência hormonal torna-se dominante sobre o balanço ósseo.
Verificou-se o efeito da idade, nas propriedades físicas (peso das cinzas, volume ósseo,
densidade óssea e densidade mineral) (tabela 4, figura 6A, 6B, 6C, respectivamente) dos
animais dos diferentes grupos experimentais, quando comparados ao grupo Basal. Assim, fica
evidente a necessidade de inclusão do grupo Basal para a averiguação dos efeitos da castração
relacionados ao crescimento corporal.
A castração induziu osteopenia nos animais, quando se verifica a densidade óssea e
densidade mineral dos animais dos grupos Castrado, Trat / 6 sem e Trat / 8 sem,
comparando-os ao grupo Intacto (Tabela 4, figura 6C), como visto na literatura (AKHTER et al., 2002;
BREITMAN et al., 2003; COXAM et al., 1996; JIANG et al., 1995; KATSUMATA et al.,
1995; NORDSLETTEN et al., 1994), confirmando a eficácia do protocolo experimental
utilizado no presente estudo. As análises dos percentuais ósseos (tabela 5, figura 7D, 7E)
também mostram que a castração promove uma diminuição do conteúdo mineral ósseo
compensado pelo aumento do teor de água do osso, fato confirmado por alguns autores na
literatura (COXAM et al., 1996; KALU,1991; PENG et al., 1994).
No modelo periostal de reabsorção dirigida mecanicamente (extração dental
mandibular) utilizado por CHERRUAU et al. (1999), verificou-se que a reabsorção foi
reduzida após a administração da guanetidina em ratos adultos. No presente estudo,
analizando as propriedades físicas, verificou-se que a castração induziu reabsorção óssea
(grupo Castrado) e a desnervação induzida pela guanetidina não modificou esta resposta
terem sido utilizadas diferentes metodologias onde os tecidos ósseos escolhidos são de
origens embriogênicas distintas, admitindo respostas diferentes para tratamentos semelhantes.
5.2 Propriedades Biomecânicas
A fraqueza osteoporótica predispõe a fraturas, o que em humanos pode ocorrer
espontaneamente, ou seguindo um mínimo trauma. Em ratos, a osteopenia não leva a fraturas
(KALU, 1991), mas através da análise de parâmetros biomecânicos pode-se avaliar a
resistência mecânica e a qualidade óssea dos animais estudados (PENG et. al., 1994).
Quando um espécime ósseo é testado sob condições laboratoriais controladas e
conhece-se a força aplicada e a deformação, propriedades mecânicas básicas podem ser
obtidas através da curva força-deformação (BOUXSEIN; MYERS; HAYES, 1996;
EINHORN, 1996).
A porção linear da curva força-deformação representa a fase elástica e o ângulo
formado em qualquer ponto desta linha com a abscissa, define a rigidez do osso. Segundo
MADSEN et al. (1996), não se obteve diferença no ensaio biomecânico para rigidez, na haste
e colo femural de ratos com desnervação cirurgica do nervo ciático após fratura tibial, quando
comparado ao grupo sham, fato também visto por alguns autores na literatura (BREITMAN et
al., 2003; GIAVARESI et al., 1999; KATSUMATA et al., 1995; PENG et al., 1994). No
presente estudo a rigidez (tabela 3, figura 5E) revela que a castração reduz a resistência óssea,
demonstrando mais uma vez sua eficácia em promover osteopenia, corroborando com os
parâmetros físicos e biométricos analisados anteriormente, também visto na literatura por
alguns autores (NORDSLETTEN et al., 1994; SATO; ZENG; TURNER, 1997). O tratamento
Resiliência é a característica óssea de resistir a um esforço sem sofrer deformação
permanente. Neste estudo, verificou-se uma tendência em promover osteopenia nos animais
castrados quando comparados aos intactos nos parâmetros de resiliência e força máxima
(maior esforço que o osso pode suportar sem ocorrer redução da sua secção transversa e danos
permanentes em sua estrutura) (tabela 3, figura 5C e 5A, respectivamente), como observado
por vários autores (BARENGOLTS et al., 1990; BREITMAN et al., 2003; GIAVARESI et
al., 1999; JIANG et al., 1995; PENG et al., 1999). Os animais tratados com guanetidina não
modificaram esta resposta.
O deslocamento máximo e tenacidade (tabela 3, figura 5B, 5D, respectivamente) não
apresentaram comportamento uniforme entre os animais dos diferentes grupos experimentais
oferecendo informações inconsistentes para analisar os efeitos da castração e do tratamento
realizado.
5.3 Cálcio Plasmático e Femural
Verificou-se uma diminuição da concentração plasmática de cálcio em todos os grupos
experimentais em relação ao grupo Basal, mostrando o efeito da idade nas ratas ao observar o
metabolismo de cálcio (NORDIN, 1996) (tabela 6, figura 8A), fato também observado com
parâmetros biomecânicos (rigidez) e os parâmetros físicos (peso das cinzas, densidade óssea e
densidade mineral). Os animais do grupo Trat / 6 semanas tiveram níveis baixos para cálcio
plasmático quando comparado aos grupos Intacto e Castrado (tabela 6, figura 8A). Os animais
do grupo Trat / 8 semanas não alteraram as concentrações plasmáticas de cálcio quando
comparado aos grupos Intacto e Castrado (tabela 6, figura 8B), podendo indicar que os
houve diferença entre os grupos tratados e seu controle, como visto por vários autores na
literatura (ERBER et al., 1996; HOCK et al., 1988; JIANG et al., 2005; KALU et al., 1989;
KATSUMATA et al., 1995; MASON; MORRIS, 1997). Segundo KALU (1991), a existência
de uma discordância entre os resultados mostrados por diversos trabalhos, referentes às
mudanças que ocorrem nos níveis sangüíneos dos hormônios reguladores das concentrações de
cálcio devido à deficiência de hormônios sexuais podem decorrer de fatores que não estão
primariamente relacionados à etiologia da osteoporose, justificando as controvérsias dos
resultados relacionados com a concentração plasmática de cálcio.
Segundo NORDSLETTEN et al. (1994), a ovariectomia resulta em diminuição do
conteúdo de cálcio no fêmur. No presente estudo foi verificada uma tendência em diminuir o
conteúdo de cálcio do fêmur dos animais do grupo Castrado quando comparado ao grupo
Intacto (tabela 6, figura 8B) (JIANG et al., 1995; WHITFIELD et al., 1995). MADSEN et al.
(1996) utilizaram para análise bioquímica o Estrôncio como marcador da formação óssea. O
cálcio e o estrôncio seguem caminhos metabólicos similares. O estrôncio é incorporado no
esqueleto pela simples troca e difusão na maturação óssea, ou pela incorporação ativa no
mineral previamente fornecido ao osso. Seu grupo sham obteve concentração de estrôncio
maior que o grupo com resseção do nervo ciático, refletindo em uma diminuição da
mineralização óssea.
No presente estudo, encontra-se bem caracterizada a perda óssea involucional
relacionada à castração, ao ser analisado o peso das cinzas, densidade mineral, densidade
óssea e o percentual de material mineral dos animais dos diferentes grupos experimentais,
resultados nos valores obtidos para a rigidez no ensaio de flexão em três pontos no fêmur dos
animais dos diferentes grupos experimentais.
Verificou-se o efeito da idade quando analisadas as propriedades fìsicas (Peso das
cinzas, Densidade Óssea, Densidade Mineral) e biomecânicas (Rigidez) e químicas (cálcio
plasmático, conteúdo total de cálcio) no fêmur dos animais dos diferentes grupos
experimentais, quando comparados ao grupo Basal. Assim, fica evidente a necessidade da
inclusão do grupo Basal para a averiguação dos efeitos da castração relacionados ao
crescimento corporal, como preconiza KALU (1991).
Verificou-se que a guanetidina foi eficaz em desnervar periféricamente o sistema
nervoso simpático, pois, todos os animais tratados, apresentaram ptose desde o início do
tratamento até o seu sacrifício (CHERRUAU et al., 1999).
A não-atuação do sistema nervoso simpático periférico sobre o tecido ósseo,
ocasionada pela simpatectomia induzida pela guanetidina, não promoveu proteção aos efeitos
deletérios da castração, como visto nos parâmetros de densidade óssea, densidade mineral,
peso das cinzas, rigidez, porcentagem de água, porcentagem de material mineral e cálcio
6 CONCLUSÕES
• Ocorreu crescimento dos animais de todos os grupos durante o período experimental.
• A castração foi eficaz em promover osteopenia em ratas adultas.
• O tratamento com guanetidina foi eficaz em provocar simpatectomia nos grupos
tratados.
• A desnervação do sistema nervoso simpático periférico não preveniu os efeitos
7 REFERÊNCIAS BIBLIOGRÁFICAS
ADAM, C.; LLORENS, A.; BAROUKH, B.; CHERRUAU, M.; SAFFAR, J.L. Effects of
capsaicin-induced sensory denervation on osteoblastic resorption in adult rats. Physiological
Society, France, v. 85.1, p.61-66, nov. 1999.
AKHTER, M.P.; IWANIEC, U.T; HAYNATZKI, G.R; FUNG, Y.K; CULLEN, D.M.;
RECKER, R.R. Effects of nicotine on bone mass and strength in aged female rats. Journal of
Orthopaedic Research, USA, v. 21, p.14-19, jul. 2002.
BARENGOLTS, E.I; GAJARDO, H. F.; ROSOL, T. J.; D’ANZA, J.J; PENA, M.; BOTSIS,
J.; KUKREJA, S.C. Effects of progesterone on postovariectomy Bone Loss in Aged Rats.
Journal of Bone and Mineral Research, v.5, p.1143-1147, jun. 1990.
BOGLIOLO, L. Ossos e articulações. In:______. Patologia. 3ª edição. Rio de Janeiro:
Guanabara Koogan, 1993, c.26, p.942-951.
BOUXSEIN, M.L.; MYERS, E.R.; HAYES, W.C. Biomechanics of age-related fratures. In:
MARCUS, R.; FELDMAN, D.; KELSEY, J. Osteoporosis. London: Academic Press, 1996,
BREITMAN, P.L.; FONSECA, D.; CHEUNG, A. M.; WARD, W.E. Isoflavones with
supplemental calcium provide greater protection against the loss of bone mass and strength
after ovariectomy compared to isoflavones alone. Bone, Ontario, v.33, p.597-605, jun.2003.
CHERRUAU, M.; FACCHINETTI, P.; BAROUKH, B.; SAFFAR, J.L. Chemical
Sympatectomy Impairs Bone Resorption in Rats: A Role for the Sympathetic System on Bone
Metabolism. Bone, France, v.25, p.545-551, nov. 1999.
CHERRUAU, M.; MORVAN, F.O.; SCHIRAR, A.; SAFFAR,J.L. Chemical
sympathectomy-induced changes in TH-, VIP-, and CGRP-immunoreactive fibers in the rat mandible
periosteum: influence on bone resorption. Journal of Cellular Physiology. France, v.194,
p.341-348, oct. 2003.
CORBERTT, C.E. Drogas adrenérgicas, bloqueadores de neurônios adrenérgicos. In:___.
Farmacologia. Guanabara Koogan , 5º edição, 1977, p.77-78.
COOPER, C.; MELTON, L.J., Magnitude and Impact of Osteoporosis and Fracture. In:
MARCUS, R.; FELDMAN, D.; KELSEY, J. Osteoporosis. London: Academic Express,
1996, c.17, p.419-434.
COXAM, V.; BOWMAN, B.M.; MECHAM, M.; ROTH, C.M.; MILLER, M.A.; MILLER,
S.C. Effects of Dihydrotestosterone Alone and Combined with Estrogen on Bone Mineral
Density, Bone Growth, and Formation Rates in Ovariectomized Rats. Bone, USA, v.19,
DAÍ, R.C.; LIAO, E.Y.; YANG, C.; WU, X.P.; JIANG, Y. Microcracks: an alternative index
for evaluating bone biomechanical quality. Journal Bone and Mineral Metabolism, v.22,
p.215-223, sept. 2003.
DEMAS, G.E.; BARTNESS, T.J. Novel Method for Localized, Functional Sympathetic
Nervous System Denervation of Peripheral Tissue using Guanethidine. Journal of
Neuroscience Methods, Atlanta, v.112, p.21-28, jul. 2001.
DEMPSTER, D.W. Bone remodeling. In: RIGGS, B.L.; MELTON, L.J. Osteoporosis:
Etiology, Diagnosis and Management. New York: Lippincott-Raven Publishers, 1995, 2º
ed., c. 3, p.67-91.
DRIUSSO, P. Efeitos da prolactina sobre a massa óssea de ratas ovariectomizadas. 2003.
87p. Tese (Doutorado em Ciências Fisiológicas) – Universidade Federal de São Carlos, São
Carlos (SP), 2003.
DUCY, P.; AMLING, M.; TAKEDA, S.; PRIEMEL, M.; SCHILLING, A.F.; BEIL, F.T.;
SHEN, J.; VINSON, C.; RUEGER, J.M.; KARSENTY, G. Leptin Inhibits Bone Formation
Through a Hypothalamic Relay: A central Control of Bone Mass. Cell Press, Houston, v.100,
p.197-207, jan. 2000.
EIKELIS, N.; SCHLAICH, M.; AGGARWAL, A.; KAYE, D.; ESLER, M. Interactions
Between Leptin and the Human Sympathetic Nervous System. Hypertension, Melbourne,
EINHORN, T.A. The Bone Organ System: form and function. In: MARCUS, R.; FELDMAN,
D.; KELSEY, J. Osteoporosis. New York: Academic press, 1996, c.1, p.03-22.
ELEFTERIOU, F.; TAKEDA, S.; EBIHARA, K.; MAGRE, J.; PATANO, N.; KIM, C.E.;
OGAWA, Y.; LIU, X.; WARE,S.M.; CRAIGEN, W.J.; ROBERT, J.J.; VINSON, C.;
NAKAO, K.; CAPEU, J.; KARSENTY, G. Serum Leptin level is a regulator of bone mass.
Proceedings of National Academy of Sciences, Strasbourg, France, v. 101, p. 3258-3263,
jan. 2004.
ENGESAETER, L. B., EKELAND, A., LANGELAND, N. Methods for testing the
mechanical properties of the rat femur. Acta Orthopedica Scandinavica, v.49, p.512-518,
1978.
ERBEN, R.G.; BANTE, U.; BIRNER, H.; STANGASSINGER, M. Prophylactic Effects of
1,24,25 – Trihydroxyvitamin D3 on Ovariectomy- Induced Cancellous Bone Loss in the Rat.
Calcified Tissue International, New York, v.60, p.434-440, sept. 1996.
FROST, H.M.; JEE, W.S.S. On the Rat Model of Human Osteopenias and Osteoporoses.
Bone and Mineral, Salt Lake City, USA, v.18, p.227-236, mar. 1992.
GIAVARESI, G.; FINI, M.; GNUD, S.; MONGIORGI, R.; RIPAMONTI, C.; ZATI, A.;
GIARDINO, R. The Mechanical Properties of Fluoride - Treated Bone in the Ovariectomized
GILMAN, A.G.; RALL, T.W.; NIES, A.; TAYLOR, P. Antihypertensive agents and the drug
therapy of hypertension. In:___. The Pharmacological Basis of Therapeutics. Oitava
edição. Pergamon Press, 1990, c. 3, p.794.
GOLD, D.T.; DREZNER, M.K. Quality of life. In: RIGGS, B.L.; MELTON, L.J,
Osteoporosis: Etiology, Diagnosis and Management. 2ª edição. USA: Lippincott-Raven
Publishers, 1995, c.21, p.475-486.
HOCK, J.M.; GERA, I.; FONSECA, J.; RAISZ,L.G. Human Parathyroid Hormone – (1-34)
Increases Bone Mass in Ovariectomized and Orchidectomized Rats. Endocrine Society,
USA, v.122, p.2899-2904, 1988.
JIANG, Y.; ZHAO, J.; AUDEKERCKE, R.V.; DEQUEKER, J.; GEUSENS, P. Effects of
Low-Dose Long-Term Sodium Fluoride Preventive Treatment on Rat Bone Mass and
Biomechanical Properties. Calcified Tissue International, New York, v.58, p.30-39, jun
1995.
JIANG, Y.; ZHAO, J.; GEUSENS, P.; LIAO, E.Y.; ADRIAENSENS, P.; GELAN, J.;
AZRIA, M.; BOONEN, S.; CAULIN, F.; LYNCH, J.A.; OUYANG, X.; GENANT, H.K.
Femoral Neck Trabecular Microstructure in Ovariectomized Ewes Treated With Calcitonin:
MRI Microscopic Evaluation. Journal of Bone and Mineral Research, v.20, p.125-132, jan.
2005.
JOHNSTON, C. C.; SLEMENDA, C. W. Pathogenesis of Osteoporosis. Bone, USA, v.17,
KALU, N. D. The Ovariectomized rat model of post menopausal bone loss. Bone and
Mineral,USA, v.15, p.175-192, 1991.
KALU,D.N.; LIU,C.C.; HARDIN, R.R.; HOLLIS, B.W. The aged Rat Model of Ovarian
Hormone Deficiency Bone Loss. Endocrinology, USA, v.124, p.7-16, 1989.
KATSUMATA, T.; NAKAMURA, T.; OHNISHI, H.; SAKURAMA, T. Intermittent Cyclical
Etidronate Treatment Maintains the Mass, Struture and the Mechanical Property of Bone in
Ovariectomized Rats. Journal of Bone and Mineral Research, v.10, p.921-931, 1995.
KE, H.Z.; CHEN,H.K.; QI, H.; PIRIE, C.M.; SIMMONS, H.A.; MA, Y.F.; JEE, W.S.S.;
THOMPSON, D.D. Effects of Droloxifene on Prevention of Cancellous Bone Loss and Bone
Turnover in the Axial Skeleton of Aged, Ovariectomized Rats. Bone, USA, v.17, p. 491-496,
nov. 1995.
KE, H.Z.; CHEN,H.K.; SIMMONS, H.A.; QI, H.; CRAWFORD, D.T.; PIRIE, C.M.; FRINK,
C.; MA, Y.F.; JEE, W.S.S.; THOMPSON, D.D. Comparative Effects of Droxifene, Tamoxifen,
and Estrogen on Bone, Serum Cholesterol, and Uterine Histology in the Ovariectomized Rat
Model. Bone, USA, v.20, p.31-39, jan. 1997.
KIMMEL, D.B. Animal models for in vivo experimentation in osteoporosis research. In:
MARCUS, R.; FELDMAN, D.; KELSEY, J. Osteoporosis. London: Academic Press, 1996,