Universidade de Lisboa
Faculdade de Farmácia
TIROIDE NA GRAVIDEZ
Ana Crespo Paulino
Relatório de estágio orientado pela Professora Doutora Maria João Monteiro Santos Ferreira Silva e coorientado pela Dra Susana Margarida Caetano Silva e
Doutora Gina Maria Figueiredo Marrão
Mestrado em Análises Clínicas
Universidade de Lisboa
Faculdade de Farmácia
TIROIDE NA GRAVIDEZ
Ana Crespo Paulino
Relatório de estágio orientado pela Professora Doutora Maria João Monteiro Santos Ferreira Silva e coorientado pela Dra Susana Margarida Caetano Silva e
Doutora Gina Maria Figueiredo Marrão
Mestrado em Análises Clínicas
RESUMO
O presente trabalho consiste no relatório do estágio curricular, efetuado como parte integrante e conclusiva do Mestrado de Análises Clínicas da Faculdade de Farmácia da Universidade de Lisboa.
O relatório está estruturado em duas partes. A primeira consiste na apresentação do local de estágio e num registo dos conhecimentos adquiridos na teoria e na prática. A segunda parte consiste na abordagem de um tema específico “Tiroide na gravidez”.
O estágio da fase pré-analítica e da área de Bioquímica Clínica decorreu no Laboratório Alcobia e Santos – RealLab, sob orientação da Dra Susana Silva, no período de 9 de janeiro a 31 de março. A valência de Microbiologia decorreu nos meses de abril e maio, no laboratório do Serviço de Patologia Clínica do Centro Hospitalar de Leiria, sob a orientação da Doutora Gina Marrão. De 5 de junho a 21 de julho, o estágio da valência de Hematologia foi realizado no Laboratório Alcobia e Santos – RealLab, sob orientação da Dra Susana Silva.
O relatório aborda todas as áreas acima referidas, realçando as condições de colheita necessárias para a execução das diferentes análises, os equipamentos e metodologias utilizados e a importância do controlo de qualidade.
ABSTRACT
This work consists of the curricular internship report, which was developed as an integral and conclusive part of the Master of Clinical Analysis of the Faculty of Pharmacy of the University of Lisbon.
The report is structured in two parts. The first one consists of the presentation of the laboratory and a register of the knowledge acquired in theory and practice. The second part is about a specific theme "Thyroid in pregnancy".
The pre-analytical and the Clinical Biochemistry areas took place at the Alcobia e Santos Laboratório – RealLab and the advisor was Dr. Susana Silva. The internship occured the period of 9 January to March 31. The valency of Microbiology occured between the months of April and May, in laboratory of the Service of Clinical Pathology of the Hospital Center of Leiria abd the advisor was Dr. Gina Marrão. Finally, from June 5 to July 21, the valency of Hematology performed at the Alcobia e Santos Laboratório – RealLab with Dr. Susana Silva.
The report addresses all the above areas, highlighting the necessary execution of the different analyzes, the equipment and methodologies of use and the importance of quality control.
ÍNDICE
Introdução ……..………...……….….. 10
1. Fase pré-analítica ………..……….. 12
1.1. Normas gerais para a colheita de produtos biológicos ……..………..….. 13
1.1.1. Colheita de sangue ………..…..…….. 13 1.1.2. Colheita de urina ………..…..……. 14 1.1.3. Colheita de fezes ………. 15 1.1.4. Colheita de expetoração ………..…..…….. 15 1.1.5. Colheita de exsudados ………....………. 15 1.1.6. Colheita de esperma ………..………..…… 17
1.1.7. Colheita de pele, pelos e unhas ………..…………..…... 18
1.2. Triagem ………...………...… 18
2. Fase analítica ………...………..………...…….. 20
2.1. Bioquímica Clínica ………...…….……… 20
2.1.1. Fundamentação teórica dos métodos utilizados pelo equipamento automático COBAS INTEGRA 400 plus ……….. 22
2.1.1.1. Parâmetros bioquímicos determinados pelo equipamento COBAS INTEGRA 400 plus ………. 24
2.1.2. Fundamentação teórica dos métodos utilizados pelo equipamento Pretty Interlab ………. 51
2.1.3. Fundamentação teórica dos métodos utilizados pelo equipamento ADAMS A1c HA-8160 ………... 54
2.1.4. Análise sumária de urina tipo II ……….. 56
2.1.4.1. Exame físico ……… 57
2.1.4.2. Análise química ………... 58
2.1.4.3. Exame microscópico do sedimento urinário ……… 64
2.1.5. Pesquisa de sangue oculto nas fezes ………... 67
2.1.6. Espermograma ……… 68
2.2. Microbiologia ……… 70
2.2.1. Exame bacteriológico ……….. 70
2.2.1.1. Meios de cultura ………... 70
2.2.1.2. Amostras biológicas utilizadas para exame bacteriológico …. 75 2.2.1.3. Técnicas utilizadas na identificação de microrganismos ……. 82
2.2.1.3.1. Coloração de Gram ……….. 82
2.2.1.3.3. Teste da catalase ………... 85
2.2.1.3.4. Teste da coagulase ………... 85
2.2.1.3.5. Teste da oxidase ………... 85
2.2.1.3.6. Teste da optoquina ………... 86
2.2.2. Testes rápidos para deteção de antigénios bacterianos …………... 86
2.2.3. Testes rápidos para deteção de antigénios virais ……… 89
2.2.4. Exame parasitológico ……….. 90
2.2.5. Exame micológico ……….. 90
2.3. Hematologia ……….. 91
2.3.1. Fundamentação teórica dos métodos utilizados pelo analisador automático XS-1000i ………. 91
2.3.1.1. Parâmetros hematológicos determinados no hemograma pelo analisador automático XS-1000i ……… 94
2.3.2. Alterações da linhagem eritrocitária ………... 99
2.3.3. Alterações da linhagem leucocitária ………. 105
2.3.4. Alterações da linhagem megacariocítica ……….. 110
2.3.5. Técnicas manuais utilizadas na coloração de lâminas ………….. 111
2.3.5.1. Coloração de esfregações de sangue periférico para estudo morfológico ……….. 111
2.3.5.2. Coloração para contagem manual de reticulócitos ………… 112
2.3.6. Determinação da velocidade de sedimentação ………. 113
2.3.7. Determinação do grupo sanguíneo ……… 114
2.3.8. Fundamentação teórica dos métodos utilizados pelo equipamento STart4 ………...……… 116
2.3.8.1. Tempo de protrombina ………... 119
2.3.8.2. Razão Normalizada Internacional ……….. 119
2.3.8.3. Tempo de tromboplastina parcial ativado ……….. 120
3. Fase pós-analítica ………... 122
4. Controlo de qualidade ………. 122
4.1. Controlo de Qualidade Interno ……… 122
4.2. Avaliação Externa da Qualidade ………. 123
5. Conclusão ………... 125 6. Bibliografia
ÍNDICE DE FIGURAS
Figura 1 – Equipamento automático utilizado em Bioquímica Clínica ... 21
Figura 2 – Equipamento utilizado para eletroforese de proteínas séricas ... 52
Figura 3 – Proteinograma representativo das bandas proteicas separadas por eletroforese ... 52
Figura 4 – Equipamento para determinação da hemoglobina glicada ... 54
Figura 5 – Equipamento para análise de urina tipo II ... 56
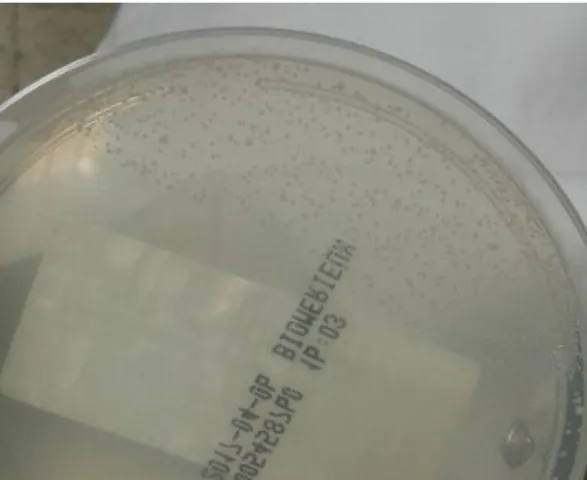
Figura 6 - Cultura bacteriana positiva de Streptococcus agalactiae ………72
Figura 7 - Cultura bacteriana negativa de Streptococcus agalactiae……...……...…72
Figura 8 – Cultura bacteriana de Streptococcus pneumoniae sensível à optoquina... 86
Figura 9 – Teste rápido para a pesquisa de Clostridium difficile ... 88
Figura 10 – Analisador automático de Hematologia ... 91
Figura 11 – Hemograma sem alterações ... 99
Figura 12 - Hemograma característico de Leucemia Linfocítica Crónica ………….108
Figura 13 – Esfregaço sanguíneo característico de Leucemia Linfocítica Crónica ...108
Figura 14 – Gráfico de dispersão representativo dos elementos anormais que podem surgir no hemograma ... 109
Figura 15 – Esquema ilustrativo da cascata da coagulação ... 117
Figura 16 – Equipamento utilizado para o estudo da coagulação ... 118
ABREVIATURAS
ALP – fosfatase alcalina
ALT – enzima alanina aminotransferase
APTT – activated partial thromboplastin time - tempo de tromboplastina parcial ativada
ASO – antiestreptolisina O
AST – enzima aspartato aminotransferase BAAR – bacilos ácido álcool resistentes BASO – canal para contagem de basófilos
BHI – brain heart infusion - caldo cérebro-coração CID – coagulação intravascular disseminada CK – enzima creatinoquinase
CLED – gelose cystine lactose electrolyte deficient
CMHG / MCHC – concentração média da hemoglobina globular / mean cell
hemoglobin concentration
COS – gelose Columbia + 5% sangue de carneiro DC – corrente direta
DGS – Direção-Geral da Saúde
DNA – deoxyribonucleic acid - ácido desoxirribonucleico
EDTA – ethylenediamine tetraacetic acid - ácido etilenodiamino tetra-acético FSH – follicle-stimulating hormone - hormona folículo-estimulante
HbA1c – hemoglobina glicada
HCT – hematócrito
HDL – high density lipoprotein - lipoproteína de elevada densidade HGB / Hb – hemoglobina
HGM / MCH – hemoglobina globular média / mean cell hemoglobin HIV – human immunodeficiency virus - vírus da imunodeficiência humana
HPLC – high performance liquid chromatography - cromatografia líquida de elevada eficiência
HSDA – sódio N-(2-hidroxi-3-sulfopropilo)-3,5-dimetoxianilina
IDL – intermediate density lipoprotein - lipoproteína de densidade intermédia INR – international normalized ratio - razão normalizada internacional ISE – ion selective electrode - elétrodo seletivo de iões
ISI – international sensitivity index - índice internacional de sensibilidade KPC – Klebsiella pneumoniae produtora de carbapenemases
LCR – líquido cefalorraquidiano LDH – enzima lactato desidrogenase
LDL – low density lipoprotein - lipoproteína de baixa densidade LED – light emitting diode - díodo emissor de luz
LH – luteinizing hormone - hormona luteinizante LLC – leucemia linfocítica crónica
MPV – mean platelet volume - volume plaquetário médio MNPT – mean normal prothrombin time
NAD – nicotinamide adenine dinucleotide - dinucleótido de nicotinamida e adenina NADH – nicotinamide adenine dinucleotide reduced - dinucleótido de nicotinamida e adenina reduzido
NEQAS – National External Quality Assessment Service PBS – phosphate buffered saline - tampão fosfato-salino PCR – proteína C reativa
PCT – plaquetócrito
PDW – platelet distribution width - coeficiente de dispersão plaquetária PLT – plaquetas
PTGO – prova de tolerância à glucose oral PTH – parathyroid hormone - paratormona
RBC – red blood cell - contagem total de eritrócitos
RIQAS – Randox International Quality Assessment Sample
RDW – red cell distribution width - coeficiente de dispersão eritrocitária RNA – ribonucleic acid - ácido ribonucleico
SLS – surfactante laurilsulfato de sódio
TIBC – total iron-binding capacity- capacidade total de fixação do ferro
TGO – transaminase glutâmica oxaloacética TGP – transaminase glutâmica pirúvica TP – tempo de protrombina
UIBC – unsaturated iron binding capacity - capacidade de ligação do ferro não saturado
VGM / MCV – volume globular médio / mean cell volume
VS – velocidade de sedimentação globular
WBC – white blood cell - contagem total de leucócitos γ-GT – enzima gama-glutamiltransferase
10 PARTE I
INTRODUÇÃO
O estágio curricular realizado teve como principal objetivo a aplicação dos conhecimentos adquiridos ao longo dos três semestres da componente curricular do IX Mestrado em Análises Clínicas.
O laboratório de análises clínicas desempenha um papel muito importante e, em conjunto com outros meios complementares de diagnóstico, contribui para o diagnóstico, prevenção e monitorização de tratamentos de várias patologias. Para isso, é essencial a aplicação das técnicas de colheita adequadas a cada determinação, a compreensão da fase analítica com conhecimento das metodologias e equipamentos
utilizados e também a correta interpretação e validação de resultados na fase pós- -analítica, tendo sempre em conta a capacidade crítica, identificação de problemas,
apresentação de soluções e compreensão e aplicação dos princípios do controlo e garantia da qualidade.
O presente relatório aborda a fase pré-analítica relativa às colheitas e à triagem das amostras biológicas e as áreas de Bioquímica, Microbiologia e Hematologia. No período de 9 janeiro a 31 de março de 2017 e de 5 de junho a 21 de julho, o estágio decorreu no Laboratório Alcobia e Santos – RealLab, nas valências de Bioquímica Clínica e Hematologia, respetivamente, sob a orientação da Dra Susana Silva. O laboratório iniciou a sua atividade em 1980, em Monte Real – Leiria e encontra-se sob a direção técnica do Dr. Paulo Pedro. O laboratório aposta na melhoria contínua com o objetivo de satisfazer os utentes e aumentar a qualidade do serviço. Prova disso é o investimento em diversos sistemas automatizados que possibilitam um controlo de qualidade eficaz e uma segurança de nível elevado nos resultados obtidos. O sistema informático da Slice® auxilia na organização de todo o trabalho laboratorial e permite a comunicação com os equipamentos automáticos. Para além do laboratório central, existem também nove postos de colheita situados em localidades próximas.
Relativamente ao estágio de Microbiologia, decorreu nos meses de abril e maio no laboratório do Serviço de Patologia Clínica do Centro Hospitalar de Leiria, sob a orientação da Doutora Gina Marrão. O laboratório, dirigido pelo Dr. Ricardo Castro, está organizado nas diferentes áreas analíticas, sendo que a área de receção de produtos biológicos e o serviço de urgência se localizam na zona central. O sistema informático Modulab® assegura a comunicação constante e a partilha de resultados entre o laboratório e o pessoal médico.
11
Com este relatório de estágio pretende-se apresentar toda a prática laboratorial relativa às valências estudadas, os equipamentos e metodologias utilizados e também a importância do controlo de qualidade.
12 1. FASE PRÉ-ANALÍTICA
O estágio relativo à fase pré-analítica decorreu no Laboratório Alcobia e Santos – RealLab, durante todos os dias das 8h às 11h, o que perfaz um total de 279 h.
A fase pré-analítica engloba as colheitas e todo o processo necessário até à análise dos produtos biológicos. Inclui a fase de marcação das análises, preparação do utente, inscrição e recolha, preparação e transporte das amostras até ao laboratório.
É considerada uma das fases mais importantes das análises clínicas e está sujeita a um elevado fator de erro. Desta forma, é necessário padronizar e ter em conta algumas considerações que influenciam a fase analítica. Os resultados podem ser influenciados por várias situações, tais como ingestão prévia de alimentos ou duração do tempo de jejum, uso prolongado de medicamentos, ingestão de grandes quantidades de álcool, posição do utente na altura da colheita, variação circadiana dos valores obtidos para alguns parâmetros. A idade, raça ou género são também parâmetros que afetam os resultados analíticos, mas que não são controláveis. Para além disso, podem surgir requisições médicas incorretas, identificação incorreta da amostra, troca de tubos, quantidade de sangue insuficiente, transporte e armazenamento incorreto das amostras.
Assim, as colheitas das amostras para análise devem efetuar-se em condições padronizadas, nomeadamente com o utente em jejum e sentado corretamente, com exceção dos doentes acamados. A postura é uma variável pré-analítica que pode influenciar os resultados, pois dela dependem concentrações de proteínas, lípidos e elementos celulares. O jejum prolongado aumenta a bilirrubinémia e diminui a glicémia. Contudo, no caso das determinações de lípidos, o jejum deve ser de pelo menos 12 horas.
No Laboratório Alcobia e Santos – RealLab, no momento da colheita procede-se à identificação dos diversos tubos com o código de barras e também com o nome do utente. No caso dos postos de colheita, as amostras biológicas são transportadas em malas térmicas até ao laboratório. É importante ter cuidado com a demora no transporte das amostras, uma vez que há diversos constituintes do sangue que podem alterar a sua concentração dependendo da temperatura. Como forma de exemplo, se a glucose ficar à temperatura ambiente é metabolizada consideravelmente, devido ao processo de glicólise. A perda é menor a temperaturas mais baixas.
Tendo em conta o resultado analítico mais fiável possível, o laboratório apresenta alguns critérios de rejeição de amostras, tais como: colheitas de expetoração com mais de 24 horas; amostras em recipientes não esterilizados, quando para exame
13
microbiológico; amostras visivelmente contaminadas; identificação incorreta do produto ou utente.
1.1. Normas gerais para a colheita de produtos biológicos 1.1.1. Colheita de sangue
Primeiramente, procede-se à preparação da colheita, escolhendo a agulha e a seringa adequadas conforme o volume de sangue necessário ou o tipo de veia existente. Em termos genéricos, as colheitas são efetuadas com seringa descartável de 5 ou 10 mL e a agulha de 0,6x25mm ou 0,8x25mm. Depois, utilizando o garrote, seleciona-se a zona de punção e desinfeta-se com solução alcoólica a 70%. O local ideal para efetuar a colheita é o antebraço. Raramente recorrem-se às veias do pulso ou ao dorso da mão. A seringa deve manter-se num ângulo de 15º com o braço do paciente. Caso haja dificuldade, devem sempre analisar-se perfeitamente os dois braços do utente. É importante ter em conta que o garrote deve ser aplicado imediatamente antes da punção e deve ser aliviado logo que se inicie o fluxo sanguíneo, uma vez que a sua permanência pode provocar alterações de vários parâmetros analíticos, incluindo o potássio. Após a extração do sangue, deve pressionar-se a zona de punção com algodão, durante alguns minutos, de forma a evitar a formação de hematomas.
No caso de surgirem problemas durante a colheita de sangue, devem ter-se em conta várias situações. Se a ponta da agulha não está completamente dentro da veia, deve introduzir-se mais até perfurar a veia. Por outro lado, se a agulha atravessou de mais a veia, deve retroceder-se ligeiramente. Se a agulha foi introduzida junto da veia, mas sem acertar, deve palpar-se a veia e corrigir a posição da agulha. No caso de a veia colapsar totalmente, não se deve exercer força sobre a seringa para não exercer vácuo sobre a veia, que irá recuperar e a extração pode ser recomeçada, utilizando a mesma seringa.
Após a colheita, o sangue é transferido para os respetivos tubos, pela seguinte ordem: tubo de coagulação (com citrato de sódio a 3,8%), tubo de hemograma (com EDTA-3K), tubo de velocidade de sedimentação (com citrato de sódio) e tubo de soro (tubo seco com gel separador). A ordem de distribuição do sangue deve sempre ser respeitada, de modo a evitar contaminações pelo anticoagulante, que pode alterar o resultado das análises.
14
Todos os tubos devem possuir a quantidade de sangue suficiente para que não ocorra desequilíbrio na razão sangue/anticoagulante. É necessária uma agitação ligeira, para que o sangue se misture homogeneamente com o anticoagulante.
1.1.2. Colheita de urina
Na análise de urina tipo II, deve recolher-se a primeira urina da manhã, por ser a mais concentrada e permitir a deteção de analitos que durante o dia podem estar presentes em menor quantidade. É necessário ter em conta que existem variações consideráveis na excreção de algumas substâncias ao longo do dia. Caso não seja possível a primeira da manhã, a urina deve estar armazenada pelo menos 3 horas na bexiga.
Algumas vezes é necessário colher toda a urina eliminada durante um determinado período de tempo, sendo as 24 horas o mais usual. A colheita de urina de 24 horas deve ser obtida rejeitando a primeira urina da manhã e registando a hora. De seguida, toda a urina deve ser recolhida até à mesma hora do dia seguinte, sendo a última micção a que perfaz as 24 horas. Durante a colheita, a urina deve manter-se refrigerada e deve ser enviada ao laboratório o mais rapidamente possível. A urina de 24 horas é utilizada para determinação de albumina, citrato urinário, creatinina, cortisol, fósforo… Certos doseamentos implicam o tratamento da urina de 24 horas com um conservante (ácido), como as catecolaminas.
No caso dos doentes algaliados, a amostra de urina deve ser retirada da junção entre o cateter e o saco coletor e nunca do saco coletor.
Para determinações bacteriológicas, a colheita tem que ser assética. Devem lavar-se muito bem os órgãos genitais e urinar o primeiro jato para a sanita, sendo que o jato intermédio é aproveitado para o frasco esterilizado. O utente deve informar o laboratório se está a tomar algum antibiótico ou a utilizar antisséptico urinário.
Em ambiente hospitalar, a colheita de urina assética pode ser também realizada por um médico, através da punção supra púbica, em crianças ou pacientes imunodeprimidos.
A colheita de urina em crianças com fralda é efetuada para um saco coletor fornecido pelo laboratório. No caso dos meninos, o pénis deve ser introduzido na metade superior da abertura do saco. Esta abertura possui um adesivo autocolante que não magoa e será colado ao períneo. No caso das meninas, a abertura do saco deve ser aplicada na metade superior do órgão genital. Após a colheita, retirar o adesivo e fechar,
15
colando metade do adesivo na outra metade. Se o bebé não urinar num espaço de 30 minutos, o saco deve ser substituído por outro, a fim de evitar contaminação fecal. As amostras devem ser entregues no laboratório num prazo máximo de 2 horas após a colheita.
1.1.3. Colheita de fezes
A colheita de fezes é utilizada no exame parasitológico, pesquisa de sangue oculto e na coprocultura. É importante evitar a contaminação com urina.
Com o auxílio da espátula existente no frasco apropriado, recolhem-se 5 a 10 g de fezes. Normalmente a recolha é efetuada durante três dias diferentes. No caso das mulheres, é importante que a colheita não seja efetuada durante o período menstrual.
Para a pesquisa de ovos de Enterobius vermiculares, normalmente recorre-se à técnica do adesivo. A fita-cola é colocada numa lâmina de microscopia.
Para a realização da coprocultura, deve recolher-se uma porção de fezes onde se observe pus, muco ou sangue. Para fezes formadas ou pastosas é suficiente um volume do tamanho de uma noz, 2 a 4 g. Nas fezes líquidas é suficiente 5 a 10 mL.
1.1.4. Colheita de expetoração
Na colheita de expetoração é essencial que a amostra para exame bacteriológico seja expetoração e não apenas saliva. A expetoração é obtida da profundidade do tórax, por meio de tosse profunda. A colheita deve ser feita para um recipiente estéril adequado, pela manhã (de modo a permitir a acumulação de secreções durante a noite), em jejum e depois de uma lavagem cuidadosa, para diminuir a contaminação pela flora comensal orofaríngea.
1.1.5. Colheita de exsudados 1.1.5.1. Exsudado vaginal
A colheita deve ser efetuada pela manhã, sem que o paciente tenha feito a sua higiene íntima. Não deve também ter urinado pelo menos uma hora antes da colheita. É importante que não seja administrada medicação nas últimas 24 horas, nem antibióticos à pelo menos dois a quatro dias. De preferência, a colheita deve ser realizada antes da menstruação. A amostra é obtida com duas zaragatoas. Uma é posteriormente colocada
16
num tubo contendo meio de conservação, enquanto que a outra é utilizada para fazer dois esfregaços em lâmina.
1.1.5.2 Exsudado nasal
A amostra é obtida em quatro zaragatoas, colhendo o exsudado das duas narinas. As zaragatoas são introduzidas o mais profundamente possível, rodando levemente para facilitar a introdução. Duas são posteriormente colocadas em tubos contendo meio de conservação, destinando-se à cultura.
1.1.5.3 Exsudado faríngeo
Baixar a língua com uma espátula. A colheita é feita com o auxílio de uma zaragatoa, colhendo o exsudado da faringe posterior ou amígdalas, tendo o cuidado de não contactar com a língua, gengiva ou saliva para evitar possíveis contaminações.
São colhidas duas amostras, sendo uma usada para a realização de esfregaços e a outra, com meio de conservação, para a cultura.
1.1.5.4 Exsudado uretral
A colheita deve ser efetuada pela manhã, sem que o paciente tenha feito a sua higiene íntima. É importante que não seja administrada medicação nas últimas 24 horas, nem antibióticos num intervalo de dois a quatro dias.
No caso das mulheres, limpar cuidadosamente a mucosa circundante com compressas esterilizadas. No caso dos homens, lavar a glande e pressionar a parte anterior. A amostra é obtida em duas zaragatoas, fazendo um movimento de rotação por 5 a 10 segundos, friccionando nas paredes da uretra.
Uma das zaragatoas é posteriormente colocada num tubo contendo meio de conservação, enquanto que a outra é utilizada para fazer dois esfregaços em lâmina.
1.1.5.5 Exsudado purulento Lesão purulenta aberta
A zona deve ser primeiro desinfetada com soro fisiológico. Se a quantidade existente assim o permitir, a colheita deve ser feita com seringa. Caso contrário, pode também ser realizada com duas zaragatoas. Uma das zaragatoas é posteriormente colocada num tubo contendo meio de conservação, enquanto que a outra é utilizada para fazer um esfregaço em lâmina.
17
Abcesso fechado
A colheita deve ser feita com agulha e seringa, sendo o produto enviado ao laboratório na própria seringa ou num frasco esterilizado. A desinfeção local é feita com solução iodada.
Caso se pretenda a pesquisar a presença de anaeróbios, deve-se retirar todo o ar da seringa e tapá-la com rolha esterilizada ou injetar o exsudado para um meio de transporte apropriado, evitando-se o contacto com o ar.
Pústula
Procede-se à desinfeção local com álcool e pressiona-se até sair líquido. Colhe--se com duas zaragatoas estéreis. Uma das zaragatoas é posteriormente colocada num tubo contendo meio de conservação, enquanto que a outra é utilizada para fazer um esfregaço de lâmina.
Nota: Frequentemente as colheitas dos exsudados purulentos são efetuadas nas extensões de saúde e enviados posteriormente ao laboratório.
1.1.6 Colheita de esperma Espermocultura
O exame deve ser precedido de uma pausa na ejaculação de três dias.
O paciente deve urinar antes de colher a amostra. Deve fazer a higiene, com água e sabão, das mãos e do pénis, distendendo o prepúcio. Enxaguar com bastante água e depois secar com gaze estéril.
Colher por masturbação diretamente para o frasco esterilizado, que só deve ser aberto no momento da ejaculação e deverá ser fechado logo após a colheita. Deve ter- -se o cuidado de não tocar na parte interna do frasco.
Espermograma
O exame deve ser precedido de uma pausa na ejaculação de três dias.
O esperma poderá ser colhido no laboratório por autoestimulação ou na própria residência. Neste caso, deve ser entregue no laboratório antes de decorridos 30 minutos após a ejaculação. Deve ter-se cuidado para evitar o arrefecimento. A hora da recolha deve ser anotada para, posteriormente, ser referida aquando da entrega.
18 1.1.7 Colheita de pele, pelos e unhas
Antes de se efetuar a colheita deve ser suspenso qualquer tratamento antifúngico, bem como a aplicação tópica de medicamentos, antifúngicos ou não, pois a sua presença dificulta a observação microscópica.
Micoses superficiais
A colheita deve ser feita com material esterilizado (bisturi ou pinça), por raspagem local da lesão. A amostra é guardada numa caixa de Petri, também ela esterilizada e devidamente identificada.
Micoses cutâneas
Os fragmentos de cabelos e raspados de pele e unhas devem ser colhidos utilizando material estéril (bisturi ou pinça) e, se possível, sob luz ultravioleta, uma vez que, em presença de uma dermatomicose provocada por fungos do género
Mycrosporum, a lesão ou os pelos apresentam fluorescência.
As amostras devem ser recolhidas, de preferência dos bordos ativos das lesões, uma vez que são os locais onde a probabilidade de se isolar o agente etiológico é maior. São depois acondicionadas numa caixa de Petri ou lâmina, também estéril.
1.2 Triagem
Após as colheitas das amostras biológicas, procede-se à triagem. Esta fase inclui o registo no sistema informático das amostras entregues, não entregues ou entregues tardiamente. Procede-se também à avaliação da conformidade das amostras, de acordo com o manual de colheitas do laboratório e ao processamento das amostras de acordo com o sector analítico a que se destinam.
Centrifugam-se os tubos de citrato destinados à coagulação a 3000 rpm, durante 15 minutos e dos tubos secos a 3800 rpm, durante 10 minutos. Depois de centrifugados, todos os tubos são organizados por ordem numérica. Os tubos de EDTA e os tubos de citrato para a realização da velocidade de sedimentação são também organizados numericamente e seguem para as diferentes áreas analíticas do laboratório.
Há amostras que são analisadas pelo laboratório subcontratado e estas são acondicionadas devidamente e enviadas em malas térmicas, juntamente com toda a documentação necessária.
19
Procede-se também à triagem das amostras de urinas e fezes. No caso da urina tipo II, homogeneiza-se e recolhe-se uma amostra de urina para um tubo de vidro com o respetivo código de barras, para que seja analisada pelo equipamento automático.
No caso das amostras de urina de 24 horas, é necessária a medição do volume
para que possa ser utilizado no cálculo da depuração da creatinina ou na
20 2. FASE ANALÍTICA
A fase analítica engloba os processos de execução das análises e da validação dos resultados. Atualmente é a fase com menor percentagem de erros ocorridos, uma vez que a maioria das técnicas são automatizadas. Para além disso, os métodos e equipamentos são cada vez mais sensíveis, específicos, exatos e precisos e possuem sistemas de controlo de qualidade que permitem maior segurança nos resultados obtidos. Os programas de avaliação externa da qualidade permitem também diminuir os erros associados à execução das técnicas, uma vez que existe uma comparação de resultados interlaboratoriais, que permite melhorar a qualidade dos resultados.
2.1. BIOQUÍMICA CLÍNICA
Durante a minha permanência no Laboratório Alcobia e Santos – RealLab, no setor de Bioquímica Clínica, tive a oportunidade de aprofundar os conhecimentos teóricos e a sua aplicação prática em métodos analíticos. Aprendi relativamente ao modo de funcionamento e procedimentos de manutenção, calibração e controlos de qualidade dos equipamentos. Para além disso, identifiquei problemas e tentei apresentar soluções, adquirindo assim uma capacidade crítica relativamente a vários assuntos.
O laboratório está equipado com o analisador COBAS INTEGRA 400 plus, da Roche. Este equipamento é um sistema integrado avançado para testes de química clínica de diagnóstico, que realiza testes de química clássica, eletrólitos e proteínas específicas. Estas análises são efetuadas num sistema com um design de cassetes de reagentes. O equipamento possui módulos de medição da fotometria de absorvância, de polarização de fluorescência e permite também a determinação de vários iões, utilizando o módulo ISE (Ion Selective Electrode).
O fotómetro de absorvância mede a intensidade da luz em 12 comprimentos de onda diferentes. O feixe de luz da lâmpada passa através da cuvete e efetua as medições de absorvância e as turbidimétricas.
O fotómetro de polarização de fluorescência efetua as medições baseadas no princípio da fluorescência polarizada. A fonte de luz é de LED azul e as análises baseiam-se no princípio de ligações competitivas.
O módulo do elétrodo seletivo de iões efetua as determinações quantitativas dos eletrólitos sódio, potássio, cloreto e lítio. O analisador COBAS INTEGRA 400 plus dispõe de vários sistemas funcionais. O sistema de fluídos transporta todos os fluídos pelo sistema e distribui as quantidades corretas para as reações, diluições e limpezas.
21
O módulo de pipetagem contém duas seringas de dosagem e duas seringas de lavagem. As primeiras controlam a pipetagem das quantidades certas de amostras e reagentes através das agulhas. Por outro lado, as seringas de lavagem fornecem água e cleaner para limpeza após cada pipetagem, de modo a evitar a existência de resíduos entre os testes. O equipamento possui também um sistema para deteção de fibrina.
No começo do dia, o equipamento efetua automaticamente uma série de ações de manutenção. Seguidamente procede-se ao controlo de qualidade diário e calibrações necessárias. Estas ações devem ser sempre analisadas e validadas antes da realização de qualquer análise. Existe um local específico e refrigerado para colocar as racks de calibradores e controlos de qualidade, de forma a melhorar a sua estabilidade e garantir resultados fiáveis.
Relativamente aos controlos de qualidade, são reconhecidos a exatidão, precisão e limite. No modo de exatidão, o equipamento verifica se os resultados se encontram num intervalo definido pelo valor atribuído de um controlo analisado e um desvio permissível. Caso os resultados do controlo estejam fora do intervalo, pode ter sido gerado um erro sistemático.
No modo de precisão, verifica-se se os resultados de controlo violam as regras de Westgard e, de acordo com as regras violadas, pode ter sido gerado um erro sistemático ou aleatório.
Por fim, o equipamento verifica ainda se os resultados do controlo de qualidade excederam ou limites inferiores ou superiores.
É de referir que todos os controlos dependem de calibrações. Se uma calibração tiver indicadores, os controlos que dependem dela não são aceites automaticamente.
Figura 1 – Equipamento automático COBAS INTEGRA 400 plus, da Roche, utilizado em Bioquímica Clínica; Fonte: Fotografia captada pela autora
22 2.1.1. Fundamentação teórica dos métodos utilizados pelo equipamento
automático COBAS INTEGRA 400 plus 1) Espetrofotometria
Os métodos espetroscópicos baseiam-se na absorção e/ou emissão de radiação eletromagnética ocorrida quando os eletrões se movimentam entre os diferentes níveis de energia.
A movimentação permite a determinação da concentração de uma solução contendo cromóforos. Os cromóforos têm a capacidade de absorver radiação, com base na interação da matéria com a radiação. Uma parte da energia é absorvida e a maior parte é transmitida e refletida pela superfície da cuvete ou pelo solvente. A energia transmitida é depois captada e convertida em energia elétrica, por um fotodetetor. A corrente é diretamente proporcional à energia transmitida. No final, a percentagem de energia transmitida é convertida em valores de absorvância.
A espetrofotometria baseia-se na absorção da radiação nos comprimentos de onda entre o ultravioleta e o infravermelho. No laboratório, os comprimentos de onda usuais situam-se entre os 150 e os 250 nm.
A relação entre a energia absorvida pela solução e a sua concentração é demonstrada pela Lei de Lambert-Beer, segundo a qual a concentração da solução é diretamente proporcional à quantidade de energia absorvida.
Abs = ɛ x c x l
ɛ - absortividade molar
c – concentração da solução absorvente
l – distância percorrida pela luz através da substância
De acordo com os princípios de absorção da luz, a absorção é tanto maior quanto mais concentrada for a solução por ela atravessada e quanto maior for a distância percorrida pelo feixe luminoso através das amostras.
É importante ter em conta que a lei só é seguida se a radiação incidente for monocromática e se a concentração do soluto estiver dentro dos limites da linearidade.
23
Métodos colorimétricos
Quando se pretendem quantificar substâncias em misturas complexas ou que não absorvem significativamente a luz a nenhum comprimento de onda, utilizam-se os métodos colorimétricos. Nestes casos, o composto a quantificar é posto em contacto com um reagente específico e forma-se uma cor, cuja intensidade é diretamente proporcional à concentração da substância na mistura inicial.
Para proceder à quantificação espetrofotométrica, é necessário conhecer o valor de ɛ. Para isso, é necessário preparar uma série de soluções do composto a quantificar, com concentração conhecida. Quando estas soluções estão em contacto com o reagente, medem-se as absorvâncias ao comprimento de onda adequado e obtém-se um gráfico da concentração em função da absorvância. No entanto, a linearidade só se observa até determinada concentração da substância e é necessário diluir a solução para que a absorvância resultante esteja contida no intervalo da reta de calibração.
2) Turbidimetria
A turbidimetria é um método utilizado na medição da luz dispersa. O aumento da turvação devido à presença de partículas em suspensão causa diminuição da intensidade da radiação incidente. A quantidade de luz absorvida depende então da concentração da amostra e do tamanho das partículas.
3) Potenciometria
Como foi referido anteriormente, o equipamento COBAS INTEGRA 400 plus utiliza a tecnologia ISEs para determinar a concentração dos iões. Baseia-se na medida do potencial entre dois elétrodos mergulhados numa solução. A concentração de iões numa solução pode ser calculada pela diferença de potencial entre o elétrodo de referência e o elétrodo indicador, de acordo com a equação de Nernst:
E = Eº + RT log (𝜇𝐶)
nF
E – potencial gerado pela amostra
Eº - potencial gerado pela amostra desenvolvido em condições padrão RT/nF – constante
µ - coeficiente da atividade dos iões da amostra C – concentração iónica que se pretende determinar
24 2.1.1.1. Parâmetros bioquímicos determinados pelo equipamento
COBAS INTEGRA 400 plus LÍPIDOS
1. Colesterol
O colesterol é um esteroide com um grupo hidroxilo secundário na posição C3 e é sintetizado em vários tipos de tecido, mas sobretudo no fígado e na parede intestinal. Depois de sintetizado, o colesterol é hidrolisado por ação de lipases e esterases de colesterol e absorvido ao nível das células da mucosa intestinal. Neste processo intervêm os ácidos biliares, que funcionam como detergentes e permitem a formação de micelas que ajudam na solubilização e facilitam no transporte.
Este lípido existe sob a forma livre ou esterificada e, no sangue, está ligado a apolipoproteínas. Estas moléculas são classificadas de acordo com as suas densidades e mobilidades eletroforéticas como quilomicras, VLDL (very low density lipoprotein), IDL (intermediate density lipoprotein), LDL (low density lipoprotein), HDL (high
density lipoprotein) e lipoproteína A.
O colesterol desempenha importantes funções fisiológicas, entre elas a síntese de ácidos biliares, vitamina D, hormonas esteroides e constituintes da membrana celular.
As determinações do colesterol são utilizadas para a despistagem do risco aterogénico e para diagnóstico e tratamento de doenças que envolvem elevados níveis de colesterol, bem como de doenças do metabolismo dos lípidos e das lipoproteínas.
O colesterol total apresenta-se elevado mais comumente em doentes com síndrome nefrótico, no hipotiroidismo, nos diabéticos e em pessoas com hipoalbuminénia. Por outro lado, níveis mais baixos de colesterol são encontrados na desnutrição e no hipertiroidismo.
O equipamento automático determina o colesterol no soro através de um método colorimétrico enzimático. Primariamente os ésteres de colesterol são clivados pela ação da colesterol esterase e produzem colesterol livre e ácidos gordos. De seguida, é oxidado pela colesterol oxidase, com formação do peróxido de hidrogénio. O peróxido de hidrogénio, pela ação da peroxidase, reage com o 4-aminoantipirina e com o fenol e forma-se um corante vermelho cuja intensidade da cor é diretamente proporcional à concentração do colesterol total presente na amostra, que é determinada pelo aumento da absorvância a 512 nm.
25
Ésteres do colesterol + H2O colesterol + RCOOH
Colesterol + O2 colest-4-en-3-ona + H2O2
2 H2O2 + 4-aminoantipirina + fenol corante quinona-imina + 4 H2O
Valores de referência para adultos: < 190 mg/dL
2. Lipoproteínas plasmáticas – LDL
As lipoproteínas de baixa densidade (LDL) desempenham um papel fundamental na formação e desenvolvimento da aterosclerose e da esclerose coronária em particular. A eliminação das LDL do plasma ocorre sobretudo através das células hepáticas, por meio de recetores específicos.
As concentrações elevadas de LDL no sangue resultam na destruição da função endotelial e na maior captação do colesterol LDL pelos monócitos, macrófagos e células do músculo liso nas paredes dos vasos sanguíneos. As LDL removidas pelos macrófagos levam à acumulação de ésteres de colesterol e à formação de células que são as responsáveis pela quantidade de colesterol na placa de ateroma.
As LDL derivam das VLDL, que são as lipoproteínas de muito baixa intensidade e ricas em triglicéridos.
O teor de colesterol LDL pode ser determinado indiretamente, através da equação de Friedewald, em que se pressupõe que todo o colesterol está nas VLDL, LDL e HDL. É ainda de referir que a fórmula possui limitações para um valor de triglicéridos superior a 400 mg/dL.
LDL (mg/dL) = colesterol total – (HDL + 𝑡𝑟𝑖𝑔𝑙𝑖𝑐é𝑟𝑖𝑑𝑜𝑠
5 )
Contudo, no Laboratório Alcobia e Santos – RealLab, determina-se o LDL no soro através do equipamento automático, através de um ensaio colorimétrico enzimático homogéneo. Este método tira partido da solubilização micelar seletiva do colesterol LDL por um detergente não-iónico e da interação de um composto de açúcar e das lipoproteínas VLDL e quilomicras.
Ésteres do colesterol LDL + H2O colesterol + ácido gordo livre
Colesterol LDL + O2 ∆4-colestenona + H2O2
2 H2O2 + 4-aminoantipirina + HSDA + H+ + H2O pigmento violeta + 5 H2O Colesterol oxidase Peroxidase Colesterol oxidase Peroxidase Detergente colesterol oxidase Colesterol esterase
26
A intensidade da cor do corante formado é diretamente proporcional à concentração de colesterol LDL. Esta concentração é determinada medindo o aumento de absorvância a 583 nm.
Valores de referência para adultos: < 115 mg/dL
3. Lipoproteínas plasmáticas – HDL
As lipoproteínas de alta densidade (HDL) são responsáveis pelo transporte reverso do colesterol das células periféricas para o fígado, onde é transformado em ácidos biliares que são excretados para o intestino através das vias biliares. É clinicamente importante monitorizar os valores de HDL, uma vez que a sua diminuição está relacionada com o risco de doença aterosclerótica e aumentam o risco cardiovascular.
O equipamento automático determina o colesterol HDL no soro através de um método colorimétrico enzimático homogéneo. Na presença de iões magnésio e sulfato de dextrano, formam-se complexos solúveis em água com LDL, VLDL e quilomicras. A concentração do HDL é determinada enzimaticamente através das reações químicas:
Ésteres do colesterol HDL + H2O colesterol HDL + RCOOH
Colesterol HDL + O2 ∆4-colestenona + H2O2
2 H2O2 + 4-aminoantipirina + HSDA + H+ + H2O pigmento violeta + 5 H2O
A intensidade da cor do corante formado é diretamente proporcional à concentração de colesterol HDL. Esta concentração é determinada medindo o aumento de absorvância a 583 nm.
Valores de referência para homens adultos: > 55 mg/dL Valores de referência para mulheres adultas: > 65 mg/dL
4. Triglicéridos
Os triglicéridos são ésteres do glicerol-álcool tri-hidratado com três ácidos gordos de cadeia longa. São os principais lípidos presentes no plasma humano e são
Colesterol oxidase
Peroxidase Colesterol esterase
27
parcialmente sintetizados no fígado e parcialmente ingeridos com os alimentos. A sua função principal é armazenar energia para as células.
A determinação dos triglicéridos é utilizada no diagnóstico e tratamento de doentes com Diabetes mellitus, obstrução hepática, alterações no metabolismo lipídico e doenças endócrinas. Os níveis elevados destes lípidos estão frequentemente associados ao risco de aterosclerose grave.
O equipamento automático determina os triglicéridos no soro, através de um método colorimétrico enzimático, de acordo com as seguintes reações químicas:
Triglicéridos + 3 H2O glicerol + 3 RCOOH
Glicerol + ATP glicerol-3-fosfato + ADP
Glicerol-3-fosfato + O2 di-hidroxiacetona fosfato + H2O2
H2O2 + 4-aminofenazona + 4-clorofenol 4-(p-benzoquinona-monoimino)-fenazona
+ 2 H2O + HCl
No final da reação, forma-se um corante vermelho, cuja intensidade cromática é diretamente proporcional à concentração de triglicéridos, que é determinada medindo o aumento de absorvância a 512 nm.
Valores de referência para adultos: 30 - 200 mg/dL
HIDRATOS DE CARBONO 5. Glucose
A glucose é o principal hidrato de carbono presente no sangue, sendo a dieta a principal via de entrada no organismo. A sua oxidação constitui a principal fonte de energia celular do organismo.
A concentração de glucose no sangue é mantida dentro de certos limites por ação de várias hormonas, sendo as mais importantes produzidas pelo pâncreas – insulina e glucagina. Em situações de abundância de glucose, há libertação de insulina pelas células β do pâncreas, causando o aumento de entrada de glucose nas células. A glicólise é estimulada, bem como a lipogénese e a glicogénese. Por outro lado, a glicogenólise é
Glicerol fosfato oxidase Glicerol cinase
Peroxidase Lipoproteína lipase
28
inibida e a glucose é armazenada no fígado e nas células musculares, sobre a forma de glicogénio. Em situações de jejum, devido à enzima glucose-6-fosfatase, ocorre a glicogenólise no fígado, por ação das hormonas epinefrina e glucagina e o glicogénio é convertido em glucose, sendo distribuída pela corrente sanguínea para todas as células. No caso do jejum ser prolongado, libertam-se cortisol e a hormona do crescimento, estimulando a neoglucogénese. Assim, o fígado produz glucose a partir de compostos não glucídicos, como o glicerol ou o lactato.
O doseamento da glucose é um dos exames mais solicitados no laboratório e tem como objetivo diagnosticar e monitorizar o tratamento de portadores de algum tipo de distúrbio no metabolismo, que levem a situações de hipo ou hiperglicémia. Pode também determinar-se a glucose presente na urina, que auxilia no despiste da diabetes e na avaliação da glicosúria, de modo a detetar defeitos tubulares renais.
A causa mais frequente de hiperglicémia é a Diabetes mellitus. Esta doença é originada por destruição das células β do pâncreas ou por défice na secreção ou na ação da insulina. Contudo, existem outros fatores secundários que contribuem também para a existência de elevados níveis de glucose no sangue, entre eles a pancreatite, disfunções na tiroide e insuficiência renal.
A hipoglicémia ocorre com menor frequência e pode ser causada por insulinoma, hipopituitarismo ou hipoglicémia induzida por insulina. Nestes casos, ocorre degradação do glicogénio em glucose, para se poderem satisfazer as necessidades dos tecidos.
O equipamento automático faz a determinação da glucose no soro através de um método enzimático com hexoquinase, de acordo com as seguintes reações químicas:
D-glucose + ATP D-glucose-6-fosfato + ADP
D-glucose-6-fosfato + NADP+ D-6-fosfogluconato + NADPH + H+
A concentração de NADPH formado é diretamente proporcional à concentração de glucose presente na amostra. Esta concentração é determinada medindo o aumento da absorvância a 340 nm.
Valores de referência para adultos: 60 - 110 mg/dL
Hexoquinase
Glucose-6-fosfato desidrogenase
29
Prova de Tolerância à Glucose Oral
A prova de tolerância à glucose oral (PTGO) é utilizada no diagnóstico de
Diabetes mellitus. Procede-se ao doseamento da glucose em jejum às 0 horas e depois
de uma sobrecarga com 75g de glucose, às 2 horas. No caso das crianças, a glucose administrada deve ser de 1,75g/kg, até uma dose máxima de 75g.
De acordo com a Direção-Geral da Saúde (DGS), o diagnóstico de diabetes é feito com base num dos seguintes parâmetros:
- valores de glicémia em jejum ≥ 126 mg/dL (7,0 mmol/L)
- sintomas clássicos juntamente com valores de glicémia ocasional ≥ 200 mg/dL (11,1 mmol/L)
- glicémia ≥ 200 mg/dL às 2 horas, na PTGO - hemoglobina glicada ≥ 6,5 %
Deve ter-se em conta que, numa pessoa assintomática, o diagnóstico de diabetes não deve ser realizado unicamente com base num valor anormal de hemoglobina glicada ou glicémia em jejum. Deve confirmar-se sempre através de uma segunda análise, após duas semanas.
O diagnóstico de hiperglicémia intermédia baseia-se em valores de glicémia em jejum ≥ 110 (6,1 mmol/L) e < 126 mg/dL (7,0 mmol/L). Além disso, são diagnosticadas pessoas com tolerância diminuída à glucose com base nos valores de glicémia às 2 horas na PTGO ≥ 140 (7,8 mmol/L) e < 200 mg/dL (11,1 mmol/L).
Nas mulheres grávidas, de acordo com a DGS, o diagnóstico de diabetes gestacional envolve duas fases temporais distintas: glicémia em jejum na primeira consulta de vigilância pré-natal e PTGO às 24-28 semanas. O doseamento da glucose no sangue é avaliado em jejum (0 horas) e às 1 e 2 horas. Para além disso, a mulher a quem foi diagnosticada diabetes gestacional, deve realizar uma prova de reclassificação 6 a 8 semanas após o parto com sobrecarga de 75g de glucose com determinações às 0 e às 2 horas. Numa gravidez subsequente, a mulher com antecedentes de diabetes gestacional deve realizar uma avaliação da glicémia pré-concecional.
a) Glicémia em jejum na primeira consulta de vigilância pré-natal
De acordo com a norma da DGS, aquando da primeira consulta de vigilância pré-natal, se o valor de glicémia plasmática em jejum (tempo zero) for ≥ 92 mg/dL
30
(5,1 mmol/L) e < 126 mg/dL (7,0 mmol/L) faz o diagnóstico de diabetes gestacional, não sendo necessário a realização da PTGO.
Por outro lado, se o valor da glicémia plasmática em jejum for < 92 mg/dL (5,1 mmol/L) implica a realização da PTGO com 75g de glucose às 24-28 semanas de gestação.
Um valor de glicémia plasmática em jejum ≥ 126 mg/dL (7,0 mmol/L) ou um valor de glicémia plasmática ocasional > 200 mg/dL (11,1 mmol/L) indicia a existência de uma diabetes provavelmente anterior à gravidez, diagnosticada pela primeira vez na gestação em curso. Estas grávidas devem ser tratadas e seguidas como as mulheres com diabetes prévia. O valor > 200 mg/dL deve ser confirmado numa segunda ocasião em dia diferente, com outra glicémia ocasional ou uma glicémia em jejum.
Para além disso, de acordo com as atuais recomendações da Organização Mundial de Saúde e da Direcção-Geral da Saúde, caso exista uma HbA1c ≥ 6,5%, deve ser interpretada como critério de diagnóstico de provável diabetes prévia. Contudo, este exame não deverá ser incluído entre os que se realizam na vigilância da gravidez de baixo risco.
b) PTGO com 75g de glucose às 24-28 semanas de gestação
Deve ser efetuada a todas as grávidas, excluindo aquelas a quem tenha sido previamente diagnosticada diabetes gestacional ou provável diabetes prévia. A PTGO inclui uma sobrecarga de 75g de glucose diluída em 300 mL de água. A determinação da glicémia deve ser efetuada às 0, 1 e 2 horas. A prova deve ser feita de manhã, após um jejum de pelo menos 8 horas mas não superior a 14, precedida nos 3 dias anteriores de uma atividade física regular e de uma dieta não restritiva contendo uma quantidade de hidratos de carbono de pelo menos 150g diários. Durante a prova, a grávida deve manter-se em repouso.
De acordo com as normas da DGS, é critério de diagnóstico de diabetes gestacional a confirmação de um ou mais valores:
- glicémia ≥ 92 mg/dL (5,1 mmol/L) às 0 horas - glicémia ≥ 180 mg/dL (10,0 mmol/L) à 1 hora - glicémia ≥ 153 mg/dL (8,5 mmol/L) às 2 horas
Se o resultado de PTGO for inferior aos valores de referência descritos, a prova é considerada negativa.
31
Nota: as grávidas que só iniciem a vigilância da gravidez após a 28.ª semana devem realizar o doseamento da glicémia em jejum e, se o valor for < 92 mg/dL, realizam de seguida PTGO com sobrecarga de 75g de glucose.
COMPOSTOS AMINADOS NÃO PROTEICOS 6. Bilirrubinas
A bilirrubina é uma das principais substâncias excretadas pelo fígado, sendo o principal pigmento constituinte da bílis. Forma-se no sistema reticuloendotelial durante a degradação dos glóbulos vermelhos envelhecidos que, ao serem destruídos, causam a libertação de moléculas de hemoglobina. É, portanto, o principal produto do metabolismo do heme da hemoglobina.
A hemoglobina é metabolizada no baço e no sistema reticuloendotelial, dando origem à biliverdina, que é reduzida a bilirrubina pela biliverdina redutase. Essa bilirrubina recém-formada circula no sangue ligada à albumina sérica e é transportada até ao fígado, onde é conjugada com ácido glucorónico para solubilizar. Deste modo, pode ser secretada para os canalículos biliares e para os intestinos, onde é convertida em urobilina e é excretada nas fezes.
Durante o processo metabólico existem dois tipos de bilirrubina que se formam: a conjugada (bilirrubina direta) e a não conjugada (bilirrubina indireta).
A bilirrubina direta é conjugada com ácido glucorónico, sendo a forma solúvel. Os níveis séricos da bilirrubina não conjugada correspondem à bilirrubina ligada à albumina, que é insolúvel e não pode ser eliminada pelo organismo. Estes níveis aumentam quando a velocidade de produção da bilirrubina é superior à velocidade de metabolização do fígado.
A icterícia é um dos principais sinais de disfunção hepática e é causada pela retenção sérica de bilirrubina não conjugada, tanto pelo excesso de produção como por défice de depuração. Esta doença é caracterizada pela presença de cor amarela na pele e escleróticas. Nalguns casos, surge também escurecimento da urina.
A icterícia pode ter origem pré-hepática, hepática ou pós-hepática. A hiperbilirrubinémia pré-hepática ocorre quando a causa se situa antes do metabolismo hepático e caracteriza-se pelo aumento de bilirrubina não conjugada, que acontece nas anemias hemolíticas e icterícia fisiológica do recém-nascido.
32
A icterícia hepática ocorre quando o problema primário se situa no fígado. Pode ser devida a alterações no metabolismo e transporte da bilirrubina, como síndrome de
Crigler-Najjar, síndrome de Gilbert e icterícia fisiológica do recém-nascido (nestes
casos, a bilirrubina total encontra-se aumentada devido ao aumento da bilirrubina não conjugada), síndrome de Dubin-Johnson, síndrome de Rotor (aumento da bilirrubina conjugada devido a erros no transporte de bilirrubina até aos canalículos biliares, após a sua conjugação). Pode ser também causada por patologias que resultem em lesão hepatocelular, como hepatites, cirrose ou colestase intra-hepática.
Por fim, a hiperbilirrubinémia pós-hepática resulta de uma doença biliar obstrutiva, normalmente causada por cálculos biliares ou tumores. Estes impedem o fluxo normal de bilirrubina conjugada nos canalículos biliares e as fezes perdem a sua cor e tornam-se acólicas.
Como forma de determinar a bilirrubina, o equipamento automático utiliza o método Diazo, em que a bilirrubina reage diretamente com o ácido sulfanílico diazotizado em tampão ácido, formando azobilirrubina de cor vermelha. A intensidade da cor é proporcional à concentração de bilirrubina direta presente na amostra de soro e é determinada através do aumento da absorvância a 552 nm.
Ácido sulfanílico + NaNO2 ácido sulfanílico diazotizado
Bilirrubina + ácido sulfanílico diazotizado azobilirrubina (reação com pH 1,4)
Valores de referência para adultos: < 0,30 mg/dL
Outra determinação que se faz frequentemente no laboratório é a bilirrubina total, que engloba a bilirrubina conjugada e a não conjugada. Neste caso, o equipamento realiza um ensaio colorimétrico e a intensidade do corante formado é determinada fotometricamente a 552 nm.
Bilirrubina + ião diazónio azobilirrubina (meio ácido)
Valores de referência para adultos: < 1,20 mg/dL
33
7. Creatinina
Os rins têm como principal função excretar compostos tóxicos e o excesso de substâncias inorgânicas ingeridas na dieta, manter o equilíbrio hídrico, eletrolítico e ácido-base e produzir hormonas, como a eritropoietina. Existem vários produtos de excreção, entre eles a creatinina, ureia e ácido úrico.
A creatinina é um produto de degradação formado pela desidratação espontânea da creatina do organismo. A maioria da creatina do organismo encontra-se no tecido muscular e serve como armazenamento de energia. Em condições normais, é filtrada livremente pelo glomérulo e uma pequena quantidade é secretada ativamente, mas não é reabsorvida pelos túbulos em quantidades relevantes. Além disso, os níveis de creatinina no soro tendem a ser constantes e não são afetados por fatores que fazem alterar os níveis de ureia, pelo que a creatinina sérica é um teste de rastreio da função renal significativamente mais fiável que a ureia.
Os níveis séricos da creatinina aumentam em doentes com filtração glomerular diminuída. Contudo, o aumento só se observa em lesões graves, pelo que no estado inicial da doença, a creatinina não é adequada para detetar doença renal.
O método usado para determinar a creatinina é colorimétrico cinético e baseia- -se no método Jaffé. A taxa de formação do corante é proporcional à concentração de creatinina na amostra de soro e procede-se à leitura da absorvância a 512 nm.
Creatinina + ácido pícrico complexo amarelo-avermelhado (pH alcalino)
Muitas vezes calcula-se também a clearance da creatinina, que é mais sensível e permite detetar mais precocemente casos de falência renal. A creatinina é filtrada livremente e a sua excreção não é influenciada pela dieta. Pela definição, a clearance é o volume de plasma a partir do qual determinada substância pode ser totalmente eliminada na urina, em determinada unidade de tempo. Este processo depende da concentração de creatinina na urina e no soro e da taxa do fluxo urinário. Assim, é necessária uma amostra de urina em tempo determinado (normalmente 24 horas) e uma
de sangue. A diurese é calculada através da fórmula 𝑉 𝑢𝑟𝑖𝑛𝑎
60 𝑥 24
Clearance da creatinina (mL/min)
=
𝑐𝑟𝑒𝑎𝑡𝑖𝑛𝑖𝑛𝑎 𝑢𝑟𝑖𝑛á𝑟𝑖𝑎 (𝑚𝑔/𝑑𝐿)34
Nas situações patológicas de glomerulonefrites agudas, insuficiência renal aguda e crónica, falência renal crónica e obstrução causada por cálculos renais ou carcinomas da bexiga ou próstata, ocorre diminuição do valor da taxa de filtração glomerular. Esta redução surge como consequência da diminuição do número ou alteração estrutural dos glomérulos funcionais.
Valores de referência para homens adultos: 0,60 - 1,20 mg/dL Valores de referência para mulheres adultas: 0,50 – 0,90 mg/dL
8. Ureia
A ureia é o principal produto final do metabolismo do azoto proteico. É sintetizada no ciclo da ureia, no fígado, a partir da amónia. A amónia é produzida por desaminação dos aminoácidos.
A ureia é excretada pelos rins, sendo filtrada no glomérulo. A sua determinação permite avaliar a função renal. A urémia ou síndrome urémico é caracterizada pela presença de elevadas concentrações de ureia no soro e por falência renal. A urémia pré--renal é causada, por exemplo, pela diminuição do fluxo sanguíneo devido ao catabolismo proteico aumentado, ingestão excessiva de proteínas, choque traumático ou hemorrágico, desidratação ou insuficiência cardíaca congestiva. A urémia renal é consequência de doença renal intrínseca, que pode ser causada por doença renal glomerular ou tubular. Por fim, a urémia pós-renal é devida a obstrução do fluxo renal que pode ser causada por cálculos, carcinomas ou hipertrofia da próstata.
Para determinar este composto, realizam-se testes cinéticos de acordo com as reações químicas seguintes. A taxa de diminuição na concentração de NADH é diretamente proporcional à concentração de ureia na amostra, que é determinada pela medição da absorvância a 340 nm.
Ureia + 2 H2O 2 NH4+ + CO32-
NH4+ + 2-oxoglutarato + NADH L-glutamato + NAD+ + H2O
Valores de referência para adultos: < 50 mg/dL
Urease
Glutamato desidrogenase
35
9. Ácido úrico
O ácido úrico é o produto primário de degradação do metabolismo das purinas, nomeadamente da adenina e da guanina. Concentra-se principalmente no fígado e é excretado pela via renal. Apenas uma pequena parcela é eliminada por via gastrointestinal.
A determinação do ácido úrico é importante na avaliação das doenças hereditárias do metabolismo das purinas, na confirmação do diagnóstico e monitorização do tratamento da gota, no auxílio do diagnóstico dos cálculos renais, na prevenção da nefropatia úrica, no tratamento quimioterápico e na deteção da disfunção renal.
Os níveis séricos do ácido úrico são determinados pela relação entre a dieta, a produção endógena e os mecanismos de reabsorção e de excreção por parte do rim. Diversos fatores como a alimentação, predisposição genética, sexo, idade, peso, medicamentos e consumo de álcool podem influenciar os valores.
No equipamento COBAS INTEGRA 400 plus, realiza-se um teste colorimétrico enzimático, em que o peróxido reage na presença de peroxidase e se forma um corante vermelho, cuja intensidade da cor é proporcional à concentração de ácido úrico no soro e é determinada fotometricamente a 552 nm.
Ácido úrico + 2 H2O + O2 alantoina + CO2 + H2O2
2 H2O2 + H+ + N-etil-N-(2-hidroxi-3-sulfopropil)-3-metilanilina + 4-aminofenazona
corante quinona-diimina + 4 H2O
Valores de referência para homens adultos: 3,40 – 7,00 mg/dL Valores de referência para mulheres adultas: 2,40 – 5,70 mg/dL
COMPOSTOS AMINADOS PROTEICOS 10. Albumina
A albumina é uma proteína livre que representa cerca de metade das proteínas plasmáticas totais. Tem como funções transportar e armazenar vários ligandos e funciona como fonte de aminoácidos endógenos. Para além disso, esta proteína liga e solubiliza a bilirrubina, o cálcio, iões de metais pesados tóxicos e muitos fármacos. Deste modo, uma diminuição na albumina no sangue pode ter importantes consequências farmacocinéticas.
Uricase
Peroxidase Peroxidase
36
Pode também determinar-se a albumina presente em amostras de urina de 24 horas ou em amostras aleatórias. Num caso normal, os rins impedem a perda de albumina sérica através da urina, mas é sempre possível encontrar pequenas quantidades de albumina na urina normal. Quando surgem alterações glomerulares, deficiências tubulares ou outras complicações, a excreção desta proteína aumenta, surgindo a microalbuminúria. Esta análise é particularmente importante nos doentes diabéticos, uma vez que apresentam um risco elevado de desenvolver nefropatias, devido ao aumento progressivo da permeabilidade dos glomérulos. Assim, a albumina urinária é considerada um marcador bastante importante para avaliar a disfunção glomerular e tem importância particular no diagnóstico precoce da nefropatia diabética.
A albumina humana forma um precipitado com um antissoro específico, que é determinado pelo equipamento automático através de ensaios imunoturbidimétricos a 340 nm, tanto no soro como na urina.
Valores de referência para adultos: 3,50 – 5,20 g/dL
11. Proteínas totais
As proteínas plasmáticas são sintetizadas sobretudo no fígado, células plasmáticas, gânglios linfáticos, baço e medula óssea e são constituídas por várias frações. As alterações na percentagem relativa de proteínas plasmáticas podem ser provocadas por uma modificação na percentagem de uma só fração proteica e a quantidade de proteínas totais não sofre alteração. A razão albumina/globulina é normalmente utilizada como índice da distribuição das frações. Quando surgem problemas de cirrose hepática, glomerulonefrite, síndrome nefrótico, hepatite aguda ou lúpus, por exemplo, a razão albumina/globulina surge modificada.
A hipoproteinémia pode ser causada por perdas de sangue, queimaduras e síndrome nefrótico. Por outro lado, a hiperproteinémia ocorre em casos de desidratação e em doenças como o mieloma múltiplo.
No equipamento COBAS INTEGRA 400 plus doseiam-se as proteínas totais com ensaios colorimétricos. Em solução alcalina, o cobre reage com as ligações do péptido proteico e forma um composto corado azul, cuja intensidade da cor é diretamente proporcional à concentração de proteínas e esta é determinada medindo o aumento de absorvância a 552 nm.