UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Derrame Pericárdico:
Estudo retrospetivo de uma população de cães de
Barcelona
Dissertação de Mestrado Integrado em Medicina Veterinária
Dora Maria Gomes Silva Andrade
Orientadora: Professora Doutora Maria João Miranda Pires
Co-orientador: Professor Doutor Laín García-Guasch
DECLARAÇÃO
NOME: Dora Maria Gomes da Silva Andrade
C.C: 13933560
TELEMÓVEL: (+351) 917727494
CORREIO ELETRÓNICO: dora.m.andrade@gmail.com
DESIGNAÇÃO DO MESTRADO: Mestrado Integrado em Medicina Veterinária
TÍTULO DA DISSERTAÇÃO DE MESTRADO EM MEDICINA VETERINÁRIA:
Derrame Pericárdico: Estudo retrospetivo de uma população de cães de Barcelona
ORIENTADOR: Professora Doutora Maria João Miranda Pires
ANO DE CONCLUSÃO: 2016
Declaro que esta dissertação de mestrado é resultado da minha pesquisa e trabalho pessoal e das orientações dos meus supervisores. O conteúdo é original e as fontes consultadas estão devidamente mencionadas no texto e na bibliografia final. Declaro ainda que este trabalho não foi apresentado em nenhuma outra instituição parra obtenção de qualquer grau académico.
Vila Real, setembro de 2016 Dora Maria Gomes Silva Andrade
AGRADECIMENTOS
À Professora Maria João por ter aceite orientar esta dissertação, por toda a paciência e dedicação, pelo apoio, simpatia e toda a ajuda que sempre disponibilizou.
Ao Doutor Laín, meu coorientador, pela disponibilidade, conhecimento partilhado e ajuda imprescindível para a realização desta tese.
Ao Doutor Jordi, e a toda a equipa do Hospital Veterinário de Mollins, pela amabilidade e simpatia com que me receberam.
Ao Doutor Carlos Pires pela ajuda imprescindível no processamento e interpretação dos dados estatísticos.
À minha Família, um obrigada especial à Tia Laura e à Madrinha, é impossível agradecer tudo o que fizeram.
Aos meus Avós, sei que estão a olhar por mim, marcaram-me para toda a vida. Ao meu Pai e à minha Mãe, pelo amor e apoio incondicional, por acreditarem sempre em mim, sem vocês nada disto seria possível. Sou uma privilegiada por ser vossa filha.
Ao meu Irmão e á minha Irmã, são para sempre os meus pequeninos e significam o mundo para mim.
Ao Tiago, por estares sempre do meu lado e por tornares tudo mais fácil, é bom saber que fazes parte da minha vida.
Aos meus Amigos, a minha segunda família, sem vocês nada teria sido igual, não há palavras, vocês sabem…
RESUMO
A doença do pericárdio mais frequente no cão é o derrame pericárdico que consiste numa acumulação anormal de fluído no espaço pericárdico. Em consequência do aumento da pressão intrapericárdica resulta o tamponamento cardíaco que causa insuficiência do sistema cardiocirculatório, podendo originar uma doença subclínica ou ser fatal. A sua etiologia é normalmente de origem neoplásica ou idiopática e os sinais clínicos variam de acordo com a rapidez e etiologia do derrame pericárdico. A presença de sons cardíacos diminuídos, pulso femoral fraco ou paradoxal, e distensão e/ou pulsação jugular que constituem a “Tríade de Beck” orientam para um diagnóstico de tamponamento. A radiografia torácica revela normalmente um aumento da silhueta cardíaca e a análise do fluido pericárdico é de diagnóstico limitado. Apesar do diagnóstico definitivo ser obtido por histopatologia ou citologia, esta nem sempre é possível, e, portanto, a ecocardiografia é o método de eleição para o diagnóstico de derrame pericárdico, bem como para tentar determinar a causa subjacente. Assim sendo, a realização desta dissertação de mestrado teve como objetivo estudar retrospetivamente as características epidemiológicas e clínicas do derrame pericárdico, de modo a conhecer melhor a doença.
Neste estudo, foi feita a análise retrospetiva dos dados clínicos de 50 cães que apresentaram o diagnóstico de derrame pericárdico no serviço de cardiologia do Hospital Veterinário de Mollins, em Barcelona, entre o ano de 2009 e 2015.
Os animais do género masculino, de porte grande e de idade adulta foram os mais representados. Os cães sem raça definida foram os mais representados, seguidos do Boxer, do Pastor Alemão, do Cocker Spaniel, do Caniche, do Golden Retrevier, do Yorkshire Terrier e do Labrador Retrevier. Os sinais clínicos mais frequentes foram a presença de sons cardíacos diminuídos, de um pulso femoral fraco, de letargia e apatia, tal como de ascite e intolerância ao exercício. A etiologia foi maioritariamente de origem idiopática e neoplásica. A alternância elétrica foi maioritariamente observada em casos de neoplasia e a presença de sons cardíacos diminuídos foi associada também a uma etiologia neoplásica. A ecocardiografia foi o principal meio de diagnóstico, pelo que o diagnóstico foi maioritariamente presuntivo.
Os resultados obtidos no presente estudo estão de acordo com a literatura e estudos previamente realizados, sendo que a presença de sons cardíacos diminuídos foi fortemente associada a uma etiologia neoplásica.
ABSTRACT
The most common disease in the dog’s pericardium is pericardial effusion, which is an abnormal accumulation of fluid in the pericardial space. As an outcome of increased intrapericardial pressure results cardiac tamponade that causes a failure of the circulatory system, which can cause a subclinical disease or be life-threating. The etiology is often idiopathic or neoplastic and clinical signs are related to the speed and etiology of pericardial effusion. A combination of muffled heart sounds, poor pulse quality or pulsus paradoxus and distension and/or jugular pulsation are referred to as Beck’s Triad, and result in a high index of suspicion for cardiac tamponade. Thoracic radiography usually reveals an increased cardiac silhouette and pericardial fluid analysis is hardly helpful in establishing a diagnosis. Although the definitive diagnosis is obtained by histopathology or cytology, it is not always possible and, as a result, echocardiography is the method of choice for diagnosing presumptively the origin of the pericardial effusion. Therefore, this dissertation’s primary goal was to study retrospectively the epidemiological and clinical features of pericardial effusion, in order to better understand the disease.
This study consists of the retrospective evaluation of clinical cases of 50 dogs diagnosed with pericardial effusion in the cardiology service from Veterinary Hospital Mollins in Barcelona between 2009 and 2015.
Males, large sized and adult dogs were the most observed. Mixed breed dogs were the most represented, followed by the Boxer, German Shepard, Cocker Spaniel, Poodle, Golden Retrevier, Yorkshire Terrier and Labrador Retrevier. The most common clinical signs were the presence of muffled heart sounds, poor pulse quality, lethargy and apathy, ascites and exercise intolerance. The etiology was mostly idiopathic and neoplastic. Electrical alternans and muffled heart sounds were related to neoplastic etiology. Echocardiography was the primary tool of diagnosis, which explains the presumptive diagnosis.
The results of this study are consistent with the literature and previous studies. Muffled heart sounds are strongly associated with a neoplastic etiology.
ÍNDICE
I- REVISÃO BIBLIOGRÁFICA
1. Introdução……….…….…2
2. Anatomia e Função do Pericárdio………..…...2
3. Doenças Pericárdicas………..3
4. Derrame Pericárdico………...4
4.1. Fisiopatologia – Tamponamento Cardíaco……….4
4.1.1. Relação Pressão/Volume………...……....4
4.1.2. Alterações Hemodinâmicas………...……...5
4.2. Etiologia………...6
4.2.1. Neoplasias……….6
4.2.1.1. Hemangiossarcoma………....6
4.2.1.2. Tumor da Base Cardíaca……….…..7
4.2.1.3. Mesotelioma……….8
4.2.1.4. Outros Tumores Cardíacos………8
4.2.2. Derrame Pericárdico Idiopático………..8
4.2.3. Rutura do Átrio Esquerdo………9
4.2.4. Causas Infeciosas………...9
4.2.5. Condições de Hipocoagulação………...9
4.2.6. Doença Pericárdica Constritiva………...10
4.2.7. Outras Etiologias………....10 4.3. Epidemiologia………...…….11 4.4. Apresentação Clínica………...11 4.4.1. Anamnese………..…….11 4.4.2. Exame Físico………..12 4.5. Métodos de Diagnóstico………..13 4.5.1. Testes Laboratoriais………..13 4.5.2. Pressão Sanguínea………...14 4.5.3. Radiografia………...14 4.5.4. Eletrocardiografia………...15 4.5.5. Ecocardiografia………...16 4.5.6. Ecografia………...…………..18
4.5.7. Técnicas de Imagiologia Avançada………...………..……...18
4.5.9. Análise Citológica e Histopatológica………..…20
4.6. Tratamento………...……….20
4.6.1. Tratamento Conservativo……….20
4.6.2. Tratamento Médico………...22
4.6.3. Tratamento Cirúrgico……….22
4.7. Tratamento específico e Prognóstico………...23
4.7.1. Hemangiossarcoma………...23
4.7.2. Tumor da Base Cardíaca………..24
4.7.3. Mesotelioma………...24
4.7.4. Linfoma………...24
4.7.5. Derrame Pericárdico Idiopático………..24
4.7.6. Rutura do Átrio Esquerdo………25
4.7.7. Doença Pericárdica Constritiva………..25
II- ESTUDO RETROSPETIVO DE DERRAME PERICÁRDICO 1. Objetivos………..28
2. Materiais e Métodos……….……….29
2.1. Animais e Recolha de dados………...29
2.2. Análise Estatística……….…….29
3. Variáveis usadas em estudo……….…...30
4. Resultados……….….33
4.1. Análise Estatística Descritiva……….…..33
4.2. Análise Estatística Inferencial………...43
5. Discussão………...45
6. Conclusão………...55
7. Limitações……….……….…….56
ÍNDICE DE FIGURAS
Figura 1- Imagem ilustrativa do pericárdio.
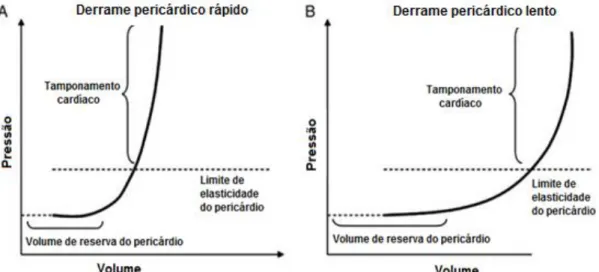
Figura 2- Curva de Pressão/Volume do pericárdio com formação de tamponamento cardíaco agudo com um menor volume de fluido acumulado (A) em comparação com a formação de um tamponamento crónico com um maior volume de fluido (B).
Figura 3- Alterações Hemodinâmicas num cão com tamponamento cardíaco experimental. Figura 4- Tumor da base cardíaca de um cão.
Figura 5- Relação Pressão-Volume do DP num cão com pericárdio normal em comparação com a Doença Pericárdica Constritiva e Derrame Pericárdico.
Figura 6- Cães com ascite.
Figura 7- Cão com distensão e pulso jugular.
Figura 8- Radiografia torácica (projeção lateral direita) de um cão com derrame pericárdico onde é evidente o aumento de dimensão e forma de globo da silhueta cardíaca.
Figura 9- Radiografia torácica (projeção ventrodorsal) de um cão com derrame pericárdico onde se verifica o contacto bilateral da silhueta cardíaca com a parede torácica.
Figura 10- Eletrocardiograma (25mm/s) de um cão com derrame de pericárdio onde é visível a presença de alternância elétrica.
Figura 11- Imagem ecocardiográfica (plano paraesternal direito de eixo curto) de derrame pericárdico onde é evidente o espaço anecoico a rodear o coração e o colapso.
Figura 12- Imagem ecocardiográfica (plano paraesternal direito de eixo longo) de derrame pericárdico onde é evidente o espaço anecoico a rodear o coração e o colapso.
Figura 13- Imagem ecocardiográfica (plano paraesternal direito de eixo longo 4 câmaras) de derrame de pericárdio visualizado como um espaço anecoico a rodear o coração e tamponamento cardíaco evidente pelo colapso do átrio direito.
Figura 14- Massa no átrio direito – Imagem ecocardiográfica (plano paraesternal direito de eixo curto).
Figura 15- Massa da base cardíaca- Imagem ecocardiográfica (plano paraesternal direito de eixo longo).
Figura 16- Pericardiocentese num cão.
ÍNDICE DE TABELAS
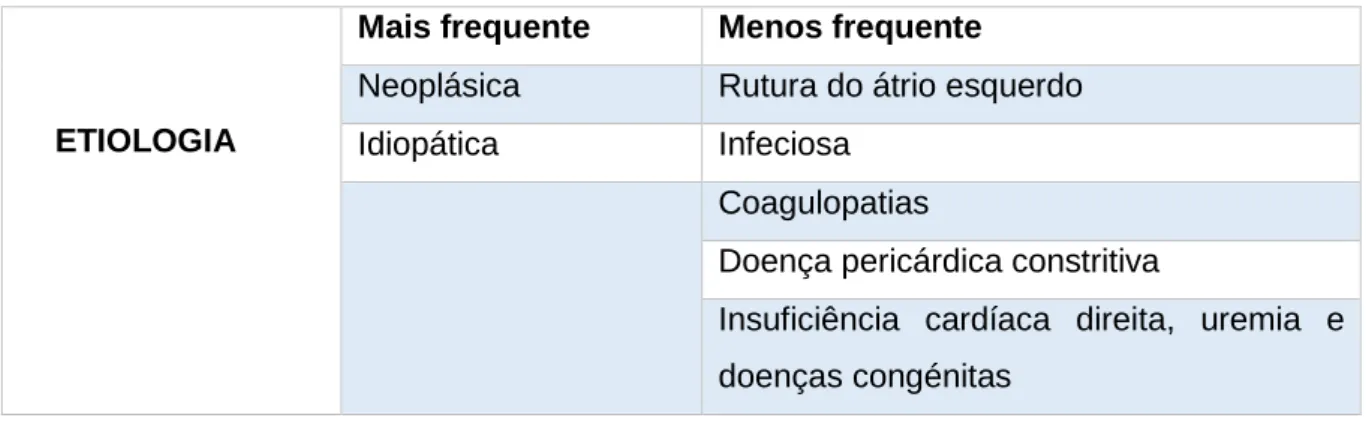
Tabela 1- Etiologia do derrame pericárdico no cão de acordo com a sua frequência. Tabela 2- Tipos de fluidos pericárdicos e a sua etiologia.
Tabela 3- Distribuição percentual e numérica das raças dos 50 cães em estudo.
Tabela 4- Distribuição percentual e numérica dos sinais clínicos da amostra canina em estudo, N=50
Tabela 5- Distribuição percentual e numérica das alterações eletrocardiográficas, radiográficas e ecográficas da amostra canina em estudo (N=50).
Tabela 6- Distribuição percentual e numérica da localização das massas visualizadas na ecocardiografia (N=23).
Tabela 7- Idade e peso médio da população com Hemangiossarcoma e Derrame pericárdico idiopático.
Tabela 8- Distribuição numérica do género da população de acordo com a etiologia neoplásica ou não neoplásica do derrame pericárdico (N=50).
Tabela 9- Distribuição numérica da faixa etária da população de acordo com a etiologia neoplásica ou neoplásica do derrame pericárdico (N=50).
Tabela 10- Distribuição numérica do porte da população de acordo com a etiologia neoplásica ou não neoplásica do derrame pericárdico (N=50).
Tabela 11- Distribuição numérica da faixa etária da população de acordo com a etiologia do derrame pericárdico (N=50).
Tabela 12- Distribuição numérica do tipo dos sinais clínicos da população de acordo com a etiologia neoplásica ou não neoplásica do derrame pericárdico (N=50).
Tabela 13- Distribuição numérica da relação entre a realização ou não de cirurgia com a mortalidade de acordo com a etiologia do derrame pericárdico (N=50).
Tabela 14- Relação entre características epidemiológicas da amostra e a etiologia neoplásica ou não neoplásica do derrame pericárdico (N=50).
Tabela 16- Relação entre os sinais clínicos da amostra e a etiologia neoplásica ou não neoplásica do derrame pericárdico (N=50).
ÍNDICE DE GRÁFICOS
Gráfico 1- Distribuição da amostra em função do género da população em estudo (N=50). Gráfico 2- Distribuição da amostra em função da idade da população em estudo (N=50). Gráfico 3- Distribuição da amostra em função do peso da população em estudo N=50. Gráfico 4- Distribuição da amostra em função da raça da população em estudo N=50.
Gráfico 5- Distribuição da amostra de acordo os sinais clínicos da população em estudo (N=50).
Gráfico 6- Distribuição a amostra em função da visualização de massas na ecocardiografia (N=50).
Gráfico 7- Distribuição da amostra em função da natureza etiológica do derrame pericárdico da população em estudo (N=50).
Gráfico 8- Distribuição da amostra em função da etiologia neoplásica da população em estudo (N=24).
Gráfico 9- Distribuição da amostra em função da etiologia não neoplásica da população em estudo (N=26).
Gráfico 10- Distribuição da amostra em função do tratamento cirúrgico da população em estudo (N=50).
Gráfico 11- Distribuição da amostra em função da mortalidade da população em estudo (N= 50
LISTA DE ABREVIATURAS
%- Por cento AD- Átrio Direito AE- Átrio Esquerdo
ALT- Alanina aminotransferase AST- Aspartato aminotransferase Bpm- Batimentos por minuto CO2- Dióxido de Carbono cc- Centímetros cúbicos DP- Derrame Pericárdio
DP constritiva- Doença Pericárdica Constritiva ICC- Insuficiência Cardíaca Congestiva
Kg- Kilogramas L-Litros HSA- Hemangiossarcoma mmHg – Milímetros de Mercúrio ml- Mililitros mm- Milímetros MST- Mesotelioma O2- Oxigénio pH- Potencial de Hidrogénio PI- Pressão Intrapericárdica PV- Pressão Venosa
TBC- Tumor da Base Cardíaca VD- Ventrículo Direito
VE- Ventrículo Esquerdo TS - Tempo de sobrevivência TMV - Tempo médio de vida
1.
IntroduçãoAs doenças pericárdicas são cada vez mais frequentes e de maior importância na prática clínica de Medicina Veterinária, representando cerca de 8% das cardiopatias caninas. O referido crescimento está relacionado com o também aumento significativo do uso da ecocardiografia e do número de raças predispostas (Tobias, 2005; French, 2010).
2.
Anatomia e Função do PericárdioO pericárdio é uma estrutura relativamente avascular que envolve o coração. Este é composto por uma camada fibrosa externa e uma serosa interna. O pericárdio fibroso está unido à adventícia dos grandes vasos cardíacos, bem como ao diafragma através do ligamento frénico-pericárdico. A camada serosa divide-se ainda em parietal e visceral (Figura 1). O pericárdio parietal encontra-se firmemente aderido à porção fibrosa, sendo constituído por colagénio e elastina. O pericárdio visceral (epicárdio) está firmemente aderido ao miocárdio e é constituído por uma única camada de células mesoteliais (Little, 2006; Nelson e Wendy, 2009; Bezuidenhout, 2012). Entre as duas camadas existe uma pequena quantidade de fluido seroso, em maior quantidade nas zonas atrioventricular e interventricular (Little, 2006), motivo pelo o qual a pressão intrapericárdica (PI) pode não ser uniforme ao redor das quatro câmaras cardíacas (Sisson e Thomas, 1999). Este líquido possibilita a lubrificação do miocárdio e impede a fricção com o pericárdio, sendo a quantidade normal de fluido (0,5 a 1,5ml) assegurada por processos de osmose, difusão e drenagem linfática (Dunning, 2001; Campbell, 2006).
As principais funções do pericárdio relacionam-se com a prevenção de uma dilatação cardíaca excessiva, a fixação anatómica do coração na cavidade torácica e a manutenção de um formato funcional, bem como a lubrificação do miocárdio e a formação de uma barreira física contra infeções e aderências. Este também tem um papel na regulação do volume sistólico entre os ventrículos, o que previne a regurgitação do ventrículo direito (VD) na presença de elevadas pressões ventriculares diastólicas (Ware, 2000; Tobias, 2005).
Figura 1: Imagem ilustrativa do pericárdio (imagem
Apesar da sua importância, o pericárdio não é uma estrutura essencial visto que a sua ausência congénita ou a remoção cirúrgica não parecem estar associadas a efeitos adversos (García-Guasch, 2006).
3.
Doenças PericárdicasUma grande variedade de doenças do pericárdio pode comprometer a função cardíaca (Ware, 2014). Apesar de raras, estas podem ser congénitas, tal como a hérnia diafragmática peritoneo-pericárdica, os quistos pericárdicos e defeitos ou ausência de pericárdio (Sisson e Thomas, 1999); ou adquiridas, como a doença pericárdica constritiva (DP constritiva), a presença de massas e o derrame pericárdico (DP) (Kienle, 1998), sendo o DP a principal manifestação da doença pericárdica adquirida (French, 2010).
Independentemente da etiologia, a doença pericárdica dificulta o enchimento diastólico pelo aumento da PI e pode resultar em tamponamento cardíaco (Kerstetter et al., 1997). Esta situação, em virtude da sua gravidade requer uma rápida identificação e tratamento (Olcott e Sleeper, 2010).
4.
Derrame PericárdicoO DP é a alteração pericárdica mais frequente no cão, sendo definido como a acumulação excessiva de fluido no espaço pericárdico (Parra et al., 2009; Coleman e Rapoport, 2016).
4.1. Fisiopatologia -Tamponamento Cardíaco
A principal alteração hemodinâmica do DP consiste no tamponamento cardíaco (Badiger et al., 2012). Esta síndrome resulta numa falha da função do sistema cardiocirculatório e ocorre como resposta a um aumento da PI (Ameli e Shah, 1991), podendo evoluir de uma doença subclínica para uma grave insuficiência cardíaca (Kienle, 1998).
O tamponamento cardíaco é um fenómeno gradual. Assim, numa primeira fase, enquanto a PI se mantém num valor baixo, o enchimento cardíaco e o débito cardíaco não são muito afetados (Ware, 2014). No entanto, quando esta é igual ou superior à pressão de enchimento cardíaco normal e a PI iguala a do átrio direito (AD) (Reddy et al., 1990; Ware, 2009), ocorre a compressão do coração direito, especialmente do átrio. Como consequência há uma diminuição no enchimento cardíaco, no retorno venoso e no volume sistólico, levando a uma diminuição do débito cardíaco e consequentemente a hipotensão sistémica que pode culminar em choque cardiogénico e morte. Por outro lado, há um
aumento na pressão venosa (PV) sistémica originado sinais de insuficiência cardíaca direita. O DP não afeta diretamente a contractilidade cardíaca, mas a redução da perfusão coronária resultante do tamponamento provoca a falha da função diastólica e sistólica (Sisson e Thomas, 1999; Nelson, 2003; Gugjoo et al., 2013a; Ware, 2014).
O aumento da pressão e rapidez com que ocorre o tamponamento cardíaco são influenciados por fatores tais como o volume total de fluido, a velocidade de acumulação do mesmo e a integridade e distensibilidade do pericárdio (García-Guasch, 2006; Ware, 2009). São estes fatores que ditam se o DP é clinicamente assintomático ou sintomático (Leonard, 2016).
4.1.1. Relação Pressão/Volume
O tamponamento cardíaco agudo ocorre normalmente por traumatismo, rutura do átrio esquerdo (AE) ou hemorragia aguda no pericárdio (DiFruscia et al., 1989), bem como por hemangiossarcoma e coagulopatias (García-Guasch, 2006). Neste caso, 100ml de fluido são o suficiente para despoletar o fenómeno (Corcoran e Martin, 2006). O tamponamento crónico resulta de uma acumulação de fluido lenta e gradual, o que permite uma maior distensão do pericárdio e acomodação de um maior volume de líquido (Laste, 2016). Nesta situação, o volume acumulado varia normalmente entre os 300 e 700 mililitros, podendo de forma gradual atingir valores superiores a 1 litro (Corcoran e Martin, 2006), sem que ocorra tamponamento, pelo menos em estados iniciais da doença (Imazio e Adler, 2013). Este mecanismo crónico está associado a tumores da base cardíaca, mesoteliomas e doença pericárdica idiopática e infeciosa (García-Guasch, 2006).
A gravidade da perturbação hemodinâmica está mais relacionada com a pressão exercida do que com o volume de fluido acumulado (Sisson e Thomas, 1999). Devido às características do tecido parietal, o pericárdio apenas consegue acomodar um determinado volume de fluido, tornando-se não complacente quando esse limite é atingido (Watkins e LeWinter, 1993). Por este motivo, uma curva que relaciona a pressão e o volume pericárdico tem um início plano, em que o volume aumenta com nenhuma ou mínima alteração na pressão. A esta fase segue-se uma mudança na curva que reflete o rápido aumento da pressão com uma mínima ou nenhuma alteração do volume (Kienle, 1998) (Figura 2). Ou seja, embora o pericárdio possa acumular uma quantidade significativa de volume, quando é atingida a porção ingreme da curva, uma pequena quantidade de líquido adicional pode ser fatal (Shabetai et al., 1970). Assim, a dilatação crónica do coração pelo
aumento de volume de fluido requer uma significativa adaptação do pericárdio (Freeman e LeWinter, 1984).
4.1.2. Alterações Hemodinâmicas Um estudo realizado por Leimgruber et al. (1983) permitiu observar as alterações hemodinâmicas provocadas pelo tamponamento cardíaco. Este foi produzido experimentalmente através da administração continua de 10ml de uma solução salina a 0.9% a 37ºC, durante 10 minutos.
Ao analisar a Figura 3 é possível verificar que volume sistólico (VS) e o débito cardíaco (DC) diminuem no momento em que o volume intrapericárdico aumenta. A pressão arterial média (PAM) mantém-se estável, diminuindo quando o volume intrapericárdico atinge os 100ml e a pressão intrapericárdica (PI) se aproximada de 10 mmHg. A partir deste ponto a PAM sofre uma rápida descida com a progressão do tamponamento. O colapso diastólico do ventrículo direito (CDVD) foi visualizado por ecocardiografia quando a PI se aproximou de 10mmHg. A frequência cardíaca (FC) foi
aumentando ao longo do tamponamento (Leimgruber et al., 1983; Tobias, 2005).
Figura 3: Alterações Hemodinâmicas
num cão após tamponamento cardíaco experimental (adaptado de Leimbruger et al., 1983). PI: Pressão intrapericárdica; FC: Frequência cardíaca; PAM: Pressão arterial média; DC: Débito cardíaco; VS Volume sistólico
Figura 2: Curva de Pressão/Volume do pericárdio com formação de tamponamento cardíaco
agudo com um menor volume de fluido acumulado (A) em comparação com a formação de um tamponamento crónico com um maior volume de fluido (B) (adaptado de Imazio e Adler, 2013).
4.2. Etiologia
As causas mais frequentes de DP no cão são de origem neoplásica ou idiopática (Ware, 2014). As etiologias do DP estão descritas na tabela 1 de acordo com a sua frequência.
Tabela 1: Etiologia do derrame pericárdico no cão de acordo com a sua frequência(Adaptado de Gibbs et al., 1982; Dunning, 2001; Sims et al., 2003; Laforcade et al., 2005; Nelson e Wendy, 2009).
4.2.1 Neoplasias
As neoplasias cardíacas e pericárdicas embora pouco frequentes no cão (Kisseberth, 2007;Treggiari et al., 2015) representam a causa de DP em mais de 50% dos casos (Sims et al., 2003). No entanto, por vezes os sinais clínicos devem-se apenas à obstrução do fluxo sanguíneo ou à diminuição da contratilidade do miocárdio (Coleman e Rapoport, 2016).
O hemangiossarcoma (HSA) é a neoplasia reportada com maior frequência (40 a 69%) seguido do tumor da base cardíaca (TBC) (5 a 17%) e do mesotelioma (MST) (5 a 17%) (Boon, 2011).
4.2.1.1. Hemangiossarcoma
O HSA é um tumor maligno das células endoteliais vasculares, de carácter agressivo (Lamerato-Kozicki et al., 2006) e com tendência para metastizar (Hammer et al., 1993; Treggiari et al., 2015). A localização cardíaca preferencial é na aurícula direita, podendo também ser encontrado no átrio e ventrículo direito (Côté, 2011a). Outros locais frequentes incluem o baço, o fígado e o tecido subcutâneo (Hammer et al., 1991; Thamm, 2007).
Esta neoplasia é a principal responsável pela acumulação rápida de fluido hemorrágico (Dunning, 2001), sendo que o DP agudo é normalmente devido à rutura da
ETIOLOGIA
Mais frequente Menos frequente
Neoplásica Rutura do átrio esquerdo Idiopática Infeciosa
Coagulopatias
Doença pericárdica constritiva
Insuficiência cardíaca direita, uremia e doenças congénitas
parede do AD (Campbell, 2006). A mortalidade associada a este tumor deve-se ao tamponamento cardíaco e à rutura do átrio (Noszczyk-Nowak et al., 2014).
Em virtude da elevada probabilidade de metástases no momento do diagnóstico, o seu prognóstico é mau e o tratamento difícil (Clifford et al., 2000; Tobias, 2005).
4.2.1.2. Tumor da Base Cardíaca
O tumor da base aórtica e o tumor da base carótida são ambos quemodectomas (tumores dos órgãos quimiorrecetores) também denominados como paragangliomas ou TBC (Capen, 2002; Ehrhart et al., 2002). Estes localizam-se preferencialmente na parede da aorta ascendente ao nível da base cardíaca (Figura 4) (Treggiari et al., 2015).
Os órgãos quimiorrecetores detetam e respondem a alterações nos níveis de O2, CO2 e
pH na circulação corporal (O’Regan e Majcherczyk, 1982). Os quemodectomas são geralmente associados a cães braquicéfalos (Campbell, 2006), e por isso, alguns autores colocam a hipótese de que a hipoxia crónica comum nestas raças provoque hiperplasia e neoplasia das células quimiorecetoras (Noszczyk-Nowak et al., 2010).
A natureza é normalmente benigna e por isso associada a um bom prognóstico. A ocorrência de metástases é rara, no entanto é possível em 22% dos casos, maioritariamente no pulmão e fígado (Patnaik et al., 1975; Yates et al., 1980; Noszczyk-Nowak et al., 2010). O seu crescimento é lento, contudo, por vezes é localmente invasivo e no momento do diagnóstico pode apresentar uma dimensão grande, responsável pela compressão das estruturas cardíacas, hemorragia e insuficiência cardíaca congestiva (ICC) (Côté, 2011b; Kienle, 1998). Quando não existe sintomatologia associada ao DP, este tumor pode ser apenas encontrado acidentalmente (Ware, 2011).
4.2.1.3. Mesotelioma
O MST pericárdico, anteriormente pouco reportado (McDonough et al., 1992), tem adquirido uma crescente importância como causa de DP no cão (Coleman e Rapoport, 2016). Tem origem nas células serosas da pleura, pericárdio e peritoneu (Machida et al., 2004), e a sua malignidade está relacionada com a capacidade de difusão e formação de derrames de caráter maligno (Kirby, 2003). A dispersão do tumor para o espaço pleural
Figura 4 - Tumor da base cardíaca de um
cão (imagem gentilmente cedida pelo Hospital Veterinário de Mollins).
pode ocorrer após pericardiectomia e o consequente derrame pleural pode ser fatal (Dupre et al., 2001; Fine e Atkinson, 2010).
Uma inflamação crónica provocada por uma anterior doença pericárdica idiopática é sugerida como um fator predisponente para o desenvolvimento de MST pericárdico (Ware, 2014).
4.2.1.4. Outros tumores
O linfoma cardíaco, o rabdomiossarcoma e o fibrossarcoma foram observados no cão em associação com DP (Coleman e Rapoport, 2016), e apesar de o linfoma metastizar no coração com frequência, são raras as vezes que este resulta em DP (Fine e Atkinson, 2010).
4.2.2. Derrame Pericárdico Idiopático
O DP idiopático é a segunda principal etiologia do DP no cão (French, 2010). Na ausência de uma causa concreta, este é considerado um diagnóstico de exclusão. Portanto deve ser um diagnóstico ponderado visto que neoplasias pequenas podem ser indetetáveis, especialmente após pericardiocentese (Tobias, 2005).
O MST não provoca um espessamento significativo do pericárdio, e por isso não é detetado por ecocardiografia. Além disso, a citologia do líquido pericárdico é inconclusiva na diferenciação deste tumor de um derrame idiopático. Com efeito é importante considerar o MST um diagnóstico diferencial (Stepien et al., 2000; Tobias e McNiel, 2008). O MST bem como o DP idiopático provocam fibrose do pericárdico em conjunto com uma resposta inflamatória que inclui um elevado número de células mesoteliais inflamatórias. Assim sendo, a biopsia do pericárdio após cirurgia poderá também induzir em erro (Nelson e Wendy, 2009). De acordo com Coleman e Rapoport (2016), numa amostra de sete cães inicialmente diagnosticados com DP idiopático através de biopsia, foi posteriormente confirmada a presença de MST em três destes animais. Segundo Stepien et al. (2000), o reaparecimento de derrame pleural no intervalo de 120 dias após cirurgia é um fator que acresce a probabilidade de MST na ausência de um diagnóstico definitivo.
A confirmação de DP idiopático é obtida na ausência de evidência de neoplasia após cirurgia e de infeção na cultura bacteriana do fluido pericárdico. Geralmente, a histopatologia revela uma pericardite hemorrágica de natureza inflamatória (Dunning, 2001; Peters et al., 2003). Uma complicação frequente do DP idiopático é a DP constritiva (Ware, 2014).
4.2.3. Rutura do Átrio Esquerdo
A rutura do AE é uma causa pouco frequente de DP e a sua ocorrência está associada à dilatação excessiva do átrio em cães com doença degenerativa da válvula mitral ou a traumatismo (Buchanan e Kelly, 1964; Reineke et al., 2008). Esta condição está associada a sintomatologia de insuficiência cardíaca esquerda e evidência ecocardiográfica de coágulos sanguíneos dentro do pericárdio. Episódios de fraqueza ou colapso são frequentes e a auscultação de um sopro sistólico de intensidade crescente é um indicador de rutura das cordas tendinosas (Sadanaga et al., 1990; Tobias e McNiel, 2008).
4.2.4. Causas Infeciosas
As infeções bacterianas, fúngicas e víricas são casualmente associadas a DP em Medicina Veterinária (Tobias e McNiel, 2008).
O DP de carácter bacteriano é habitual em feridas penetrantes, corpos estranhos e secundário a infeções pulmonares, sendo possível a evolução para uma doença cardíaca constritiva (French, 2010). As infeções de natureza fúngica são raras como causa de DP no cão (Ribas et al., 2015). Contudo, estão descritos dois casos de cães que desenvolveram massas na base cardíaca inicialmente confundidas com TBC devido ao fungo Coccidioides spp (Ajithdoss et al., 2011).
As causas de origem infeciosa podem ser resolvidas através de cirurgia, tratamento médico e monitorização embora haja uma maior probabilidade de morte no pós-operatório (Heinritz et al., 2005).
4.2.5. Condições de Hipocoagulação
O DP relacionado com estados de hipocoagulação é raro no cão (Tobias, 2005). Foram apenas reportados dois casos de DP associados à ingestão de raticidas, ambos tratados com sucesso por pericardiocentese e administração de vitamina K1 (Park et al., 2011; Coleman e Rapoport, 2016).
4.2.6. Doença Pericárdica Constritiva
A DP constritiva consiste num pericárdio fibrótico e espessado que ao tornar-se não distensível compromete o enchimento cardíaco diastólico, como consequência um pequeno volume de derrame é suficiente para formar tamponamento, o que não seria observado num pericárdico normal (Tobias, 2005; Woolley et al., 2006). De acordo com Sisson e Thomas (1999), a curva que relaciona a pressão e volume é alterada quando a
pressão ultrapassa os 10mmHg, o que corresponde ao limite de complacência do pericárdio (Figura 5).
A DP constritiva é considerada um subtipo de DP idiopático, existindo duas variantes, a pericardite efusivo-constritiva, em que pequenas quantidades de derrame originam o tamponamento cardíaco; e a pericardite constritiva pura, quando o mesmo acontece na ausência de derrame (Laste, 2009). Esta pode ocorrer por DP idiopático recorrente, hemorragia traumática, infeções pericárdicas e neoplasias (French, 2010). O seu diagnóstico é difícil, e normalmente é necessário recorrer a cateterismo cardíaco de modo a obter um diagnóstico definitivo (Olcott e Sleeper, 2010) e a análise histopatológica revela proliferação das células mesoteliais, uma elevada quantidade de tecido conjuntivo fibroso e infiltrados de células inflamatórias (Sisson e Thomas, 1999).
4.2.7. Outras Etiologias
Situações de ICC e uremia associadas a DP foram observados em cães, contudo sem alterações hemodinâmicas significativas (Tobias e McNiel, 2008). Os defeitos congénitos do pericárdio são raros (Son et al., 1993). Dentro deste grupo a hérnia diafragmática peritoneo-pericárdica é a mais frequente (Ware, 2011), e o seu prognóstico é bom (Shaw e Rush, 2007).
4.3. Epidemiologia
De acordo com alguns estudos, o DP é mais frequente em raças de porte grande e em machos (Laste, 2016) com uma média de 9 anos de idade (Coleman e Rapoport, 2016). A maioria das neoplasias cardíacas, com a exceção do linfoma ocorre em cães de idade compreendida entre os 7 e os 15 anos (Ware e Hopper, 1999; Kisseberth, 2007).
O HSA é frequente em animais com cerca de 9 anos de idade com peso médio de 32 Kg, tendo sido também reportado em animais mais jovens. Em relação ao género, não existe uma predisposição sexual concreta (Coleman e Rapoport, 2016). As raças predispostas são o Golden Retrevier e o Pastor Alemão (Johnson et al., 2008), apesar de
Figura 5: Relação Pressão-Volume do DP num
cão com pericárdio normal em comparação com a Doença Pericárdica Constritiva e Derrame Pericárdico (adaptado de Sisson e Thomas, 1999).
serem também referidos o Doberman Pincher, Labrador Retrevier, Goden Retrevier, animais sem raça definida, entre outros (Ware e Hopper, 1999; Ware, 2014).
O TBC é mais frequente em cães com 8 anos ou mais, e no macho (Capen, 2002). O Bulldog Francês, Boxer e Boston Terriers são as raças com maior predisposição, no entanto o quemodectoma pode ocorrer também em raças não braquicefálicas (Tobias e McNiel, 2008).
O MST é normalmente reportado em animais mais velhos, entre os 4 e 14 anos de idade, não havendo uma predisposição sexual nem racial concreta, todavia tem vindo a ser notada uma certa prevalência em Golden Retreviers em associação com DP idiopático (Machida et al., 2004; Garrett, 2007; Coleman e Rapoport, 2016). Um fator de risco no Homem é a exposição a um tipo de mineral conhecido como asbesto, sendo também um possível fator no cão (Ledecká et al., 2010; Côté, 2011c; Skammeritz et al., 2011).
O DP idiopático ocorre em raças grandes a gigantes de meia idade entre os 6 a 7 anos, mais usualmente no macho. As raças predispostas são o Golden e Labrador Retrevier em conjunto com Great Danes, Newfoundlands e o São Bernardo (Machida et al., 2004; Nelson e Wendy, 2009; French, 2010).
A rutura do AE é reportada em raças pequenas com doença degenerativa da válvula mitral de idade superior a 10 anos (García-Guasch, 2006; Johnson et al., 2008). Enquanto que a DP constritiva tem sido observada em machos, de idade média e porte grande (Sisson e Thomas, 1999; Woolley et al., 2006)
4.4. Apresentação Clínica 4.4.1. Anamnese
A história de viagens, de um possível traumatismo, da exposição a raticidas e a existência prévia de insuficiência mitral crónica ajudam a determinar se o DP se deve a um processo agudo ou crónico (Laste, 2009). Como já foi mencionado anteriormente, o quadro clínico do DP depende da rapidez de acumulação do fluido, sendo que, por vezes a sintomatologia é inespecífica e de natureza aguda (Tobias e McNiel, 2008; Adler et al., 2015).
O quadro agudo leva a uma diminuição súbita do débito cardíaco originando hipotensão; os animais podem apresentar fraqueza, colapso, choque ou até mesmo morte súbita. Em situação de derrame crónico predomina a sintomatologia de ICC direita, os animais podem exibir letargia, intolerância ao exercício com episódios de síncope, anorexia e dispneia, tal como derrame pleural e distensão abdominal causada por ascite (Figura 6) e hepatomegalia. Os animais frequentemente adotam uma postura ortopneíca de forma a tornar a respiração mais confortável. Os sinais clínicos menos frequentes incluem poliúria
e polidipsia, vómitos, diarreia e tosse (Sisson e Kittleson, 1999; Sisson e Thomas, 1999; Jinks, 2001; Johnson et al., 2004; Shaw e Rush, 2007; Coleman e Rapoport, 2016). No caso de DP constritiva, os sinais clínicos referidos pelos proprietários estão relacionados com a ICC direita (Woolley et al., 2006).
4.4.2. Exame físico
A apresentação clínica do DP pode ser inespecífica e por isso um exame físico minucioso tem uma grande importância na orientação do médico veterinário para um possível diagnóstico (Coleman e Rapoport, 2016).
A presença de um conjunto de alterações denominado por “Tríade de Beck” sugere a existência de DP. Estas são a presença de pulso femoral fraco e de intensidade variável, distensão e ou pulso jugular e sons cardíacos diminuídos (García-Guasch, 2006; Wray, 2014).
Em condições fisiológicas, a pressão arterial sistémica varia em concordância com o ciclo respiratório. No entanto, as variações são exacerbadas quando existe alteração na pressão pleural ou na dinâmica ventricular consequente do tamponamento (Kienle, 1998; Adler et al., 2015). A alteração na intensidade do pulso acontece durante a inspiração quando existe uma diminuição da pressão sistólica superior a 10mmHg, denominando-se assim por pulso paradoxal (Cohn et al., 1967; Khasnis e Lokhandwala, 2002). Durante a expiração o pulso é mais forte e na inspiração é mais fraco (Côté, 2011d), contudo não é patognómico de tamponamento cardíaco (Leimgruber et al., 1983). De modo a confirmar a existência de tamponamento cardíaco é aconselhado que estas alterações no fluxo sanguíneo periférico sejam confirmadas por ecocardiografia (Nogueira et al., 2011).
A distensão ou pulso jugular (Figura 7) ocorre pela ICC direita e os sons cardíacos estão diminuídos pela presença de DP. Por outro lado, os sons pulmonares apenas estão alterados quando há derrame pleural (Jutkowitz, 2008). Em casos mais graves em que o
débito cardíaco é baixo, os animais têm as mucosas pálidas por vasoconstrição e baixa perfusão periférica. A taquicardia está associada à ativação do sistema nervoso simpático (Sims et al., 2003; Jutkowitz, 2008; Nelson e Wendy, 2009). As alterações observadas no exame físico da DP constritiva são semelhantes, apesar de os sons cardíacos poderem estar aumentados em função da pequena quantidade ou ausência de derrame (French, 2010).
4.5. Métodos de Diagnóstico 4.5.1. Testes Laboratoriais
A hipoproteinemia associada a hipoalbuminemia e hipoglobunemia é frequentemente reportada em cães com DP, provavelmente como consequência da ICC direita (Johnson et al., 2004; French, 2010). O DP crónico pode originar hiponatremia e hipercalemia devido à hipoperfusão renal, sendo esta situação facilmente normalizada com a resolução do tamponamento cardíaco (Cole e Drobatz, 2008). Alguns casos reportados de anemia não regenerativa ou pouco regenerativa estão associados a anemia de doença crónica e a atividade sérica das enzimas hepáticas (ALT e AST) pode estar aumentada em caso de congestão do fígado. Uma azotemia pré-renal moderada é possível devido ao baixo débito cardíaco (French, 2010). Os esquizócitos, os acantócitos e os eritrócitos nucleados são maioritariamente encontrados em cães com HSA (Shaw e Rush, 2007). Segundo os mesmos autores, os testes de coagulação são importantes para excluir a toxicidade por raticidas quando existe suspeita do mesmo na história e no exame físico.
As lesões isquémicas e de necrose do miocárdio ocorrem frequentemente em cães com DP, sendo que as troponinas I e T são bastante sensíveis e específicas para as referidas lesões (Shaw et al., 2004). De acordo com Spratt et al. (2005) e Linde et al. (2006), as concentrações plasmáticas de troponina I são mais elevadas em cães com DP em comparação com um grupo controlo de cães saudáveis. Ainda segundo Shaw et al. (2014), a concentração plasmática deste biomarcador foi superior em casos de DP secundário a HSA cardíaco, comparativamente à etiologia idiopática; bem como em relação a HSA não cardíaco e outras neoplasias (Chun et al; 2010).
Figura 7: Cão com distensão e pulso jugular
(imagem gentilmente cedida pelo Hospital Veterinário de Mollins)
4.5.2. Pressão sanguínea
Em caso de suspeita de DP deve-se proceder à medição da PA sanguínea visto a hipotensão estar associada a tamponamento cardíaco (Nelson e Wendy, 2009).
4.5.3. Radiografia
A radiografia torácica é por norma a primeira técnica de imagem utilizada. A posição ventrodorsal (VD) é a que confere menos stresse ao animal cardiopata, embora as projeções dorsoventral (DV) e lateral (LL) sejam importantes para um correto diagnóstico (Campbell, 2006). No entanto, Côté et al. (2013) referem que a imagem radiográfica não é fidedigna para a identificação de alterações atribuídas ao tamponamento cardíaco em animais com DP.
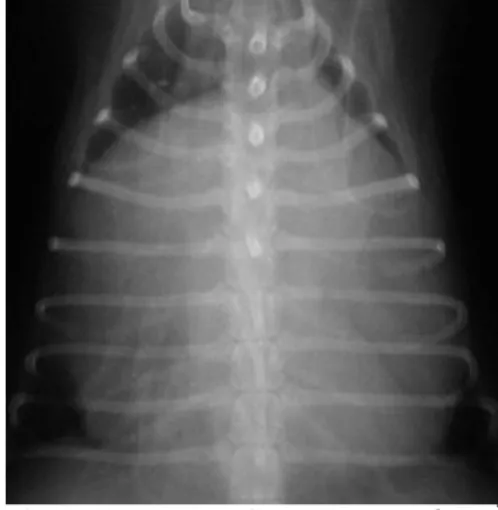
Uma quantidade substancial de DP confere um contorno mais suave à silhueta cardíaca, enquanto que uma menor quantidade pode passar despercebida (Burk e Feeney, 2003). Assim, no caso de DP agudo o coração pode estar relativamente pouco alterado e adquirir uma forma de globo na presença de um derrame crónico (Laste, 2016) (Figura 8). No estudo da imagem, devem ser procuradas massas e ter em conta que o TBC pode provocar um desvio na traqueia. A presença de metástases no pulmão é frequente em animais com HSA (Ware, 2014).
Um estudo retrospetivo concluiu que o uso da radiografia apresenta uma alta especificidade, mas uma menor sensibilidade na deteção de massas da base cardíaca, todavia o seu papel é importante na prática clínica, principalmente quando não é possível o acesso a técnicas de imagiologia avançada (Guglielmini et al., 2016).
O contato bilateral da silhueta cardíaca com a parede torácica é também um sinal de DP (French, 2010) (Figura 9). No caso de ICC é possível encontrar ascite, hepatomegalia, um pequeno derrame pleural, distensão da veia cava caudal e hipoperfusão pulmonar (Johnson et al., 2008; Coleman e Rapoport, 2016). A fluoroscopia
Figura 8: Radiografia torácica (projeção lateral
direita) de um cão com derrame pericárdico onde é evidente o aumento de dimensão e forma de globo da silhueta cardíaca (Imagem gentilmente cedida pelo Hospital Veterinário de Mollins).
permite comprovar a ausência de movimento cardíaco devido ao fluido acumulado (Ware, 2014).
Quando o aumento da silhueta cardíaca é moderado, é importante considerar a cardiomiopatia dilatada como diagnóstico diferencial. Outros diferenciais são a displasia da tricúspide e, por vezes, uma hérnia diafragmática peritoneo-pericárdica, apesar de esta última ter uma imagem distinta na projeção DV (Tobias, 2005; Ware, 2012).
A radiografia da DP constritiva não revela uma silhueta cardíaca em forma de globo nem aumentada (Nelson, 2003).
4.5.4. Eletrocardiografia
As principais alterações eletrocardiográficas do DP consistem em complexos QRS de baixa voltagem ou em alternância elétrica (Sims et al., 2003). Na primeira alteração, a onda R é inferior a 1mV, também característico de animais obesos, com hipotiroidismo, derrame pleural, massas torácicas e de larga conformação torácica. A segunda alteração corresponde a uma variação na amplitude dos complexos QRS em batimentos alternados, consequência do movimento do coração dentro do pericárdio (French, 2010; Kienle, 1998; Martin, 2015). Esta ocorre entre 6 a 60 % dos casos, sendo bastante especifico de DP (Figura 10) (García-Guasch, 2006; Shaw e Rush, 2007).
A taquicardia sinusal é frequente na presença de tamponamento cardíaco. As taquiarritmias ventriculares e atriais são menos observadas (Ware, 2014). Os complexos prematuros ventriculares não são usuais, embora normais durante e após a pericardiocentese, e apesar do baixo número, foram também reportados casos de fibrilhação atrial. Na verdade, um eletrocardiograma (ECG) sem alterações não implica a ausência de DP (Shaw e Rush, 2007; Johnson et al., 2004).
Figura 10: Eletrocardiograma (25mm/s) de um cão com derrame de pericárdio onde é
visível (seta) a presença de alternância elétrica (imagem gentilmente cedida pelo Hospital Veterinário de Mollins).
Figura 9: Radiografia torácica (projeção ventrodorsal) de um cão com derrame pericárdico onde se verifica o contacto bilateral da silhueta cardíaca com a parede torácica (imagem gentilmente cedida pelo Hospital Veterinário de Mollins).
O ECG é um método pouco especifico para o diagnóstico de DP. No entanto, é recomendado em animais com sinais de baixo débito cardíaco, arritmias detetadas no exame físico, bem como com um aumento da silhueta cardíaca na radiografia (Tobias, 2005).
4.5.5. Ecocardiografia
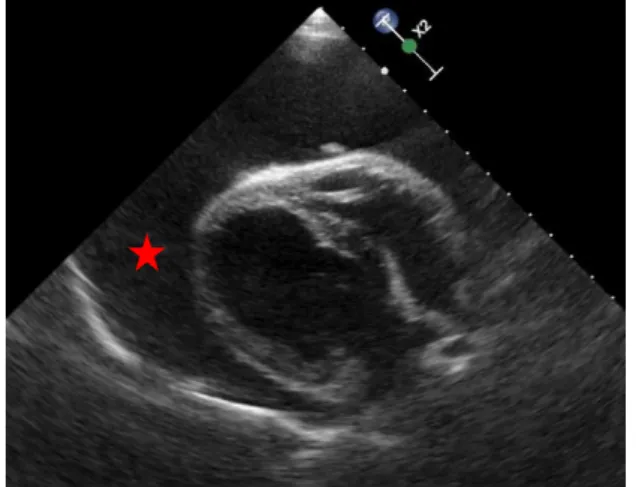
A ecocardiografia é um método de elevada precisão e não invasivo que fornece mais informação do que a radiografia. Por estes motivos, é o principal método de diagnóstico de DP no cão (Dunning, 2001; Campbell A., 2006), tendo vindo a substituir a pneumopericardiografia, a angiocardiografia e a fluoroscopia (Ware, 2000; Tobias, 2005).A imagem ecocardiográfica de DP mostra um espaço anecoico a rodear o coração (Figura 11 e 12) (Nelson, 2003). O tamponamento cardíaco é diagnosticado quando existe colapso da parede livre do AD em diástole e início de sístole e em casos mais graves do VD (Figura 13). As alterações nas velocidades de fluxo das válvulas mitral e tricúspide ocorrem em concordância com o mecanismo do pulso paradoxal (Little, 2006; Ware, 2012; Coleman e Rapoport, 2016)
O colapso do AE e do ventrículo esquerdo (VE) raramente ocorrem, efetivamente o VE é mais rígido e espesso, enquanto que o AE é firmemente aderido pelo pericárdio, no entanto pode ocorrer colapso caso a PI destas câmaras seja relativamente baixa (Gugjoo et al., 2013b). Em casos mais graves pode ocorrer um espessamento da parede livre do VE onde se verifica uma menor capacidade de enchimento do mesmo, tratando-se de uma pseudohipertrofia (García-Guasch, 2006).
Figura 11: Imagem ecocardiográfica (plano
paraesternal direito de eixo curto) de derrame pericárdico onde é evidente o espaço anecoico a rodear o coração ( ) (Imagem gentilmente cedida pelo Hospital Veterinário de Mollins).
Figura 12: Imagem ecocardiográfica (plano
paraesternal direito de eixo longo) de derrame pericárdico onde é evidente o espaço anecoico a rodear o coração ( ) (Imagem gentilmente cedida pelo Hospital Veterinário de Mollins). AD
É importante também a diferenciação entre DP e derrame pleural. Esta última normalmente é mais difusa e apresenta fibrina e na presença de ambas o pericárdio é visualizado com clareza (French, 2010). Além do diagnóstico de DP e tamponamento, a ecocardiografia é o método de eleição na deteção de neoplasias antemortem (Tobias e McNiel, 2008; Rajagopalan et al., 2013). Um estudo ecocardiográfico realizado por um cardiologista experiente teve uma especificidade de 100% e uma sensibilidade de 82% na deteção de massas cardíacas. Sendo que a repetição do exame aumenta a sensibilidade de deteção de massas cardíacas de 80% para 88% (MacDonald et al., 2009).
Segundo o mesmo autor, a maioria das massas não detetadas ocorreu em cães com uma pequena quantidade de DP. Isto vai de acordo com o facto de a visualização de tumores cardíacos ser facilitada na presença de fluido, e por tanto antes da pericardiocentese (Boon, 2011; Ware, 2014). Assim um exame negativo não é suficiente para excluir definitivamente um tumor cardíaco (Mellanby e Herrtage, 2005).
Embora não permita um diagnóstico definitivo, a diferenciação de HSA e TBC é relativamente fácil a partir da localização e aparência das massas (Shaw e Rush, 2007; Bonagura e Fuentes, 2015).
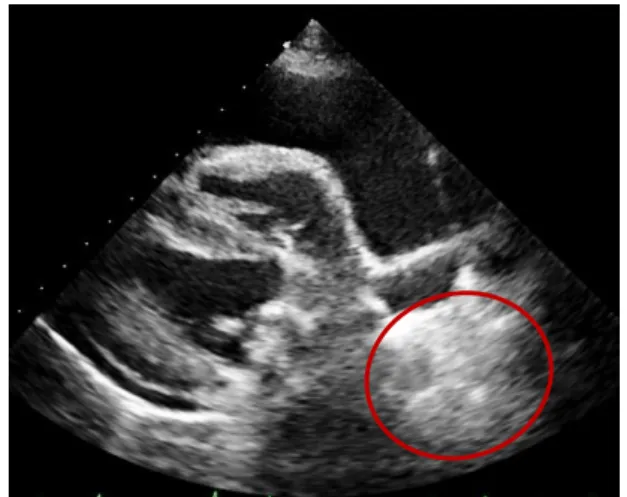
Deste modo, uma massa cavitária originária no AD é fortemente consistente com HSA (Figura 14), enquanto que se tiver origem na aorta descendente ou envolva a aorta e artéria pulmonar é compatível com TBC (Figura 15) (Tobias e McNiel, 2008). O mesmo não é possível no caso de MST pela ausência de efeito massa (Lang, 2006). De facto, segundo Boon (2011), tumores difusos como o MST e o linfoma são de difícil diagnóstico por ecocardiografia. Mesmo que os tumores pericárdicos provoquem o espessamento do pericárdio, a ecocardiografia não permite a distinção entre neoplasia, fibrina depositada ou outra possível doença pericárdica.
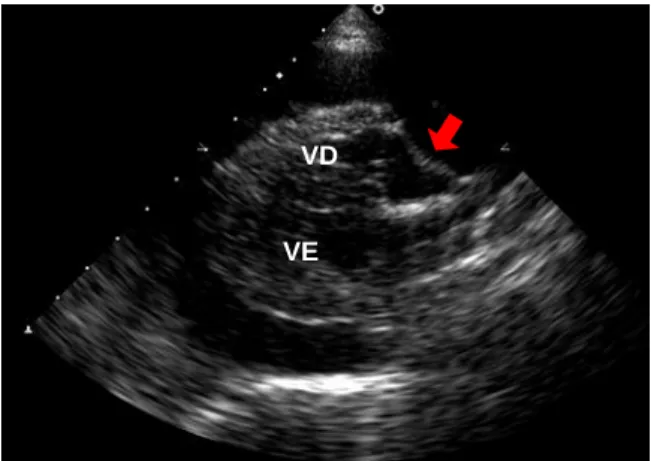
Figura 13: Imagem ecocardiográfica (plano
paraesternal direito de eixo longo 4 câmaras) de derrame de pericárdio visualizado como um espaço anecoico a rodear o coração e tamponamento cardíaco evidente pelo colapso do átrio direito(seta) VD: ventrículo direito; VE; ventrículo esquerdo (imagem gentilmente cedida pelo Hospital Veterinário de Mollins).
VD
A ecocardiografia transesofágica permite uma melhor visualização de massas, no entanto é uma técnica mais invasiva que implica anestesia geral e equipamento específico (Laste, 2016).
O diagnóstico de DP constritiva na ausência de derrame não é fácil, e normalmente é observado um pericárdio espessado e hiperecoico em conjunto com um aplanamento da parede do VE em movimento na diástole, com colapso do AD e distensão da veia cava caudal. A presença de derrame pleural é também frequente (Tobias, 2005; Lang, 2006).
4.5.6. Ecografia
A ecografia abdominal é útil para detetar massas hepáticas e esplénicas, bem como ascite (Olcott e Sleeper, 2010). A visualização de dilatação das veias cava caudal e hepáticas é possível na presença de DP com tamponamento cardíaco (Mannion, 2006).
4.5.7. Técnicas de Imagiologia Avançada
A ressonância magnética cardíaca (RMC) e a tomografia computorizada (TC) são bastante usadas em Medicina Humana (Coleman e Rapoport, 2016). O seu interesse tem vindo a aumentar em Medicina Veterinária (Wisner e Johnson, 2010), apesar da incerteza do papel futuro da RMC nesta área (Gilbert et al., 2010).
Segundo dois estudos, a RMC não facilitou substancialmente o diagnóstico de tumores cardíacos embora transmita informação importante em vários casos de DP, nomeadamente metástases pulmonares, lesões extracardiacas e complicações da pericardiocentese (Boddy et al., 2011; Scollan et al., 2015). Por outro lado, a RMC permite uma melhor visualização da anatomia das estruturas cardíacas (Mai et al., 2010), podendo
Figura 15: Massa da base cardíaca- Imagem
ecocardiográfica (plano paraesternal direito de eixo longo) (Imagem gentilmente cedida pelo Hospital Veterinário de Mollins).
Figura 14: Massa no átrio direito – Imagem
ecocardiográfica (plano paraesternal direito de eixo curto) (Imagem gentilmente cedida pelo Hospital Veterinário de Mollins).
ser útil quando a imagem ecocardiográfica não é clara, como no caso da existência de mesotelioma pericárdico (Gallach e Mai, 2013). No entanto, são técnicas dispendiosas que requerem anestesia geral e equipamento especializado (Laste, 2016).
4.5.8. Análise de Fluido Pericárdico
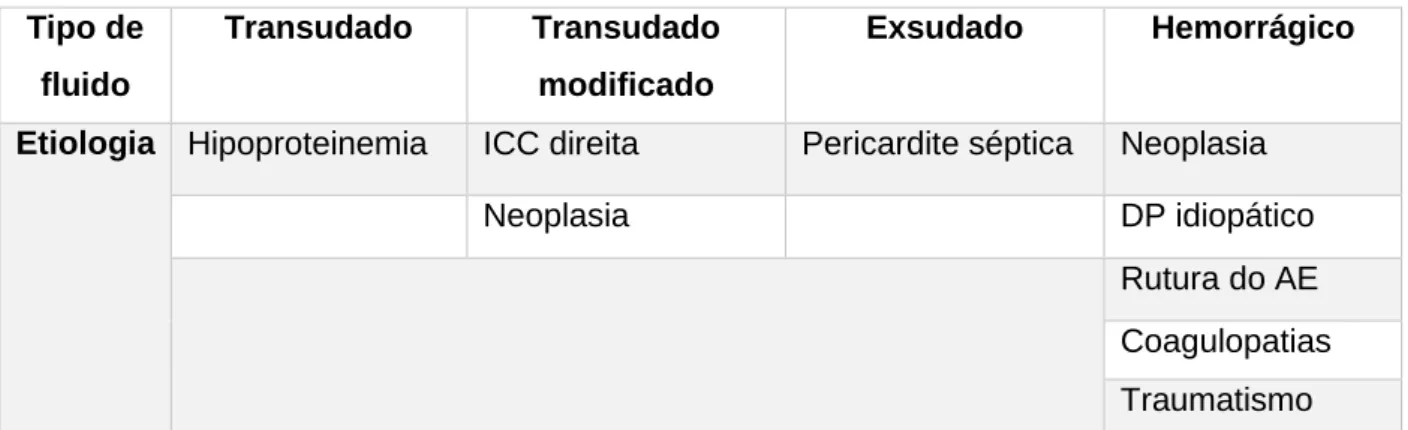
O fluido pericárdico no cão é normalmente serossanguíneo ou sanguíneo, sendo classificado como transudado, transudado modificado, exsudado e hemorrágico tal como indicado na tabela 2.
Tabela 2: Tipos de fluidos pericárdicos e a sua etiologia (adaptado de Ware, 2014; Laste, 2016;
French 2010) Tipo de fluido Transudado Transudado modificado Exsudado Hemorrágico
Etiologia Hipoproteinemia ICC direita Pericardite séptica Neoplasia
Neoplasia DP idiopático
Rutura do AE Coagulopatias Traumatismo
ICC: Insuficiência cardíaca congestiva; DP: Derrame pericárdico; AE: Átrio esquerdo
A análise do líquido pericárdico deve consistir na análise da densidade, da concentração de proteínas totais, do número de leucócitos e eritrócitos, incluindo também um exame citológico (García-Guasch, 2006). Contudo, o HSA e o TBC embora mais frequentes não esfoliam e por isso dificilmente são diferenciados pela citologia (Vicari et al., 2001; Tobias, 2005). Por outro lado, apesar do MST esfoliar, não é possível diferenciar as células neoplásicas das células mesoteliais reativas (French, 2010; Nelson e Wendy, 2009). Por este motivo a citologia está associada a falsos negativos e falsos positivos no diagnóstico de neoplasias (Tobias, 2005). Assim, a citologia do fluido pericárdico não permite distinguir etiologias idiopáticas e neoplásicas. Pelo contrário, é um importante meio de diagnóstico de causas infeciosas e de linfoma (Dunning, 2001; Shaw e Rush, 2007). Segundo Cagle et al. (2014), a utilidade do diagnóstico por citologia varia de acordo com a etiologia, tendo este sido melhor sucedido em amostras com hematócrito inferior a 10% (Cagle et al., 2014).
O fluido pericárdico de origem neoplásica é normalmente associado a um pH igual ou superior a 7, enquanto que no caso de etiologia inflamatória, o pH é inferior (Ware, 2014). Deste modo, foi testado o pH do fluido, porém não é considerado um parâmetro
fiável em virtude dos diferentes resultados obtidos (Fine et al., 2003; Laforcade et al., 2005; Mellanby e Herrtage, 2005). De acordo com Ware (2000), caso a citologia e o pH orientem para uma causa inflamatória ou infeciosa, é aconselhada a cultura do fluido pericárdico.
4.5.9. Análise Citológica e Histopatológica
Apesar das características ecocardiográficas orientarem para o tipo de tumor, o diagnóstico definitivo é apenas obtido após a citologia e histopatologia das massas e do pericárdio; contudo, como anteriormente referido, o diagnóstico de linfoma cardíaco é normalmente efetuado na análise do líquido pericárdico (French, 2010; Ware, 2014). De acordo com Rajagopalan et al. (2013), o diagnóstico presuntivo baseado na localização da massa é de precisão moderada comparativamente com os resultados da análise histológica. O autor ressalva ainda a importância da necrópsia de forma a se promover o conhecimento nesta área. Por outro lado, em virtude do risco associado de arritmias e hemorragia, a dificuldade em obter amostras de massas cardíacas é um obstáculo para a obtenção de um diagnóstico definitivo (Pedro et al., 2015).
4.6. Tratamento
4.6.1. Tratamento Conservativo
Em situações de emergência como choque cardiogénico, é importante a expansão de volume. A administração de fluido cristaloide isotónico promove um aumento na pressão do AD e aumento do volume sistólico e débito cardíaco. É promovida assim uma melhoria clínica enquanto não é realizada a pericardiocentese (Cole e Drobatz, 2008; Brown e Mandell, 2015; Coleman e Rapoport, 2016). A técnica é indicada em todas as situações de tamponamento, exceto quando existe suspeita de hemorragia ativa (Rozanski e Rush, 2007).
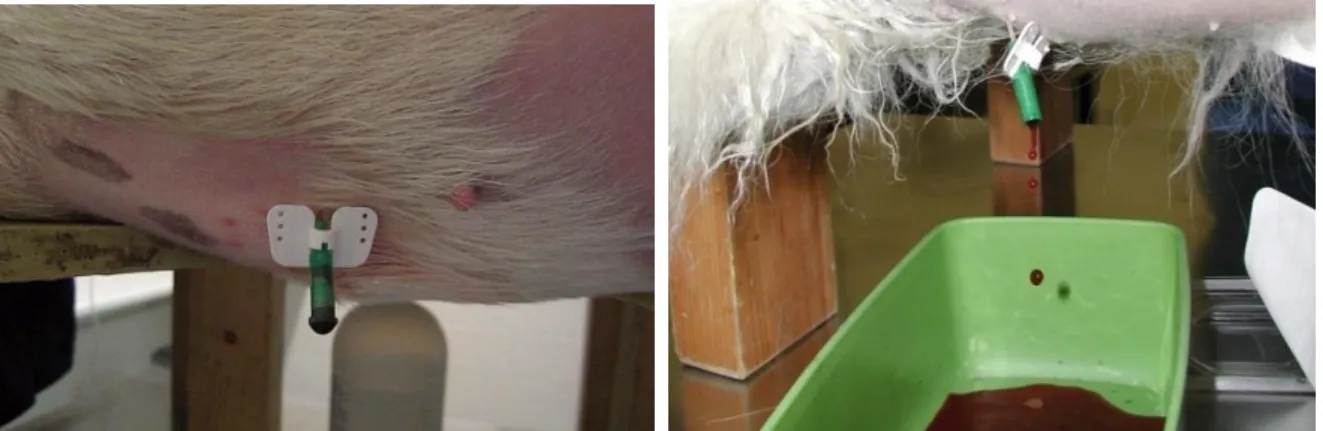
A pericardiocentese quando é efetuada de forma correta é uma técnica segura e simples que resolve os sinais clínicos de tamponamento cardíaco (Gidlewski e Petrie, 2005). A remoção de uma pequena quantidade de fluido resulta numa acentuada descida da PI e como já foi referido anteriormente, a posterior análise do fluido talvez permita obter informação sobre a etiologia (Dunning, 2001; Gidlewski e Petrie, 2003; French, 2010). A técnica deve ser realizada de forma asséptica, ao nível do 5º espaço intercostal, imediatamente a baixo da junção costocondral, e preferencialmente em decúbito lateral esquerdo ou esternal (Figura 16 e 17) (Alleman, 2003; Laste, 2016) . A abordagem pelo
lado direito do animal permite prevenir o traumatismo pulmonar e a laceração da artéria coronária que é mais proeminente do lado esquerdo (Nelson, 2003).
Caso necessário o animal deve ser ligeiramente sedado ou então anestesiado localmente (Shaw e Rush, 2007). Após e durante a pericardiocentese são comuns arritmias cardíacas e embora não necessitem de tratamento é aconselhável uma hospitalização de 12 a 24 horas, monitorizando-se também uma possível recorrência do tamponamento cardíaco (Tobias e McNiel, 2008; Humm et al., 2009). A punção das artérias coronárias e do pulmão, bem como a disseminação de infeções e de células neoplásicas por punção de tumores são alguns riscos associados a esta técnica (French, 2010; Ware, 2011)
O fluido pericárdico é normalmente hemorrágico, não coagula e o seu hematócrito é inferior ao do animal. Ao avaliar o tempo de coagulação ativa do fluido, confirma-se a não punção do coração (Macintire, 2012; Coleman e Rapoport, 2016). Pelo contrário, o derrame pleural varia de coloração transparente a amarelo claro (García-Guasch, 2006).
Em casos de traumatismo, rutura do AE e coagulopatias, apenas deve ser removida uma quantidade de fluido suficiente para aliviar a PI, sendo que o restante fluido é normalmente reabsorvido. Numa rutura do AE e caso não se comprometa a vida do animal é recomendado como tratamento repouso numa câmara de O2 (Campbell, 2006; Ware,
2014).
O plano terapêutico a longo prazo depende da etiologia do DP. Normalmente os animais sem evidência de neoplasia são tratados por pericardiocentese, sendo esta uma opção válida em DP idiopático recorrente (Mellanby e Herrtage, 2005; Laste, 2016). Por
Figura 16: Pericardiocentese num cão (imagem
gentilmente cedida pelo Hospital Veterinário de Mollins).
Figura 17: Pericardiocentese num cão, onde é
possível observar líquido do tipo hemorrágico (imagem gentilmente cedida pelo Hospital Veterinário de Mollins).
outro lado, após mais de 3 punções é aconselhada a cirurgia em virtude de prevenir a fibrose e constrição do pericárdio (Kienle, 1998).
4.6.2. Tratamento Médico
O uso de diuréticos e vasodilatores é contraindicado nestes doentes dado que provocam um agravamento da hipotensão e o risco de choque. A ascite e o derrame pleural resolvem-se espontaneamente após a pericardiocentese (Corcoran e Martin, 2006; Coleman e Rapoport, 2016).
A administração de antibiótico é necessária no caso de etiologia infeciosa. O uso de corticosteroides (1 mg/Kg/dia de prednisolona oral, durante 2-4 semanas) tem sido usado de modo a evitar a inflamação, a fibrose e a formação de adesões. No entanto, não existem dados concretos sobre a sua eficácia na prevenção da reincidência de DP idiopático (Macintire, 2012; Ware, 2014; Wray, 2014).
A quimioterapia poderá ser uma opção válida em algumas neoplasias cardíacas (Shaw e Rush, 2007). Apesar de muitos tumores não serem responsivos à quimioterapia, alguns apresentam sucesso ao tratamento a curto prazo (Ware, 2014).
4.6.3. Tratamento Cirúrgico
A pericardiectomia pode ser total, subtotal ou parcial podendo ser realizada por toracotomia intercostal, estereotomia média ou toracoscopia (MacPhail, 2013). A pericardiectomia subtotal do pericárdio é realizada com mais frequência visto a pericardiectomia total não aparentar ser mais vantajosa (Dunning, 2001; Monnet, 2012)
A técnica por toracoscopia é uma alternativa ao clássico procedimento aberto. As suas vantagens relacionam-se com um melhor quadro pós-operatório, incluído menos dor, morbilidade e uma recuperação mais rápida. Apesar desta abordagem também apresentar desvantagens, o tempo de cirurgia e as complicações associadas diminuem com a experiência do cirurgião (Jackson et al., 1999; Walsh et al., 1999; Dupre et al., 2001; Radlinsky, 2009) De acordo com Atencia et al. (2013), a toracoscopia promove um bom controlo do DP idiopático a longo prazo apesar do tratamento paliativo a curto prazo em caso de neoplasias. Outra técnica menos invasiva é a pericardiectomia percutânea por balão para tratamento paliativo de DP, apesar da recorrência do DP ter sido observada em alguns casos (Cobb et al., 1996; Sidley et al., 2002; Coleman e Rapoport, 2016).
A pericardiectomia pode ser curativa ou paliativa dependendo da etiologia em questão (Orton, 2008), dessa forma, a pericardiectomia pode promover a cura caso o DP seja idiopático e tratar de modo paliativo o DP de origem neoplásica ao prevenir a
reincidência do tamponamento cardíaco (Monnet, 2012). Quando não é possível a ressecção cirúrgica de massas cardíacas, a pericardiectomia é paliativa (Dunning, 2001). De facto, segundo o estudo de Kerstetter et al. (1997), a pericardiectomia promove um maior tempo de sobrevivência, apesar do pior prognóstico das massas tumorais comparativamente a etiologias não neoplásicas. O tempo médio de vida (TMV) dos animais com neoplasia foi de 52 dias contrastando com 792 dias nos casos de DP idiopático. Estes resultados sugerem a vantagem da pericardiectomia em relação ao tratamento único por pericardiocentese (Treggiari et al., 2015).
A cirurgia tem como finalidade a remoção do pericárdio, biopsia e ressecção de massas, sendo que na presença de metástases e massas no AD, esta opção pode ser excluída devido ao mau prognóstico (Shaw e Rush, 2007).
4.7. Tratamento específico e Prognóstico
O bom prognóstico das massas benignas deve-se a um diagnóstico precoce. Pelo contrário, o prognóstico de massas malignas é desfavorável e depende de fatores como a idade, tipo de tumor e o tratamento efetuado (MacGregor et al., 2005; Parra et al., 2009).
4.7.1. Hemangiossarcoma
O tratamento do HSA inclui quimioterapia, pericardiectomia e recessão da massa (Fine e Atkinson, 2009). No entanto, o seu elevado grau de metastização confere um mau prognóstico (Macintire, 2012), motivo pelo qual, nesta situação seja preferível o tratamento paliativo por pericardiocentese, apesar dos sinais clínicos de tamponamento reaparecerem normalmente dentro de poucos dias (Tobias e McNiel, 2008).
Num estudo realizado em 9 cães com massas no AD das quais 8 consistiam em HSA, foi possível a remoção cirúrgica bem-sucedida das mesmas em 8 animais por toracoscopia (Ployart et al., 2013). Um outro estudo em cães com HSA concluiu que a remoção cirúrgica do tumor promove um maior tempo de sobrevivência (TS), sendo possível um TS ainda mais prolongado caso a quimioterapia seja implementada no pós-cirúrgico (Yamamoto et al., 2013), estando em concordância com Weisse et al. (2005) e Crumbaker et al. (2010). O uso de um excerto de pericárdio para reparar o AD após ressecção de um HSA de um cão foi descrito com sucesso (Brisson e Holmberg, 2001). Recentemente, um protocolo de quimioterapia que inclui doxorrubicina revelou-se eficaz como tratamento único de massas do AD e, portanto, uma opção válida caso a cirurgia não seja possível. No entanto, apenas foi confirmado um cão com HSA por histologia, pelo que mais estudos são necessários para a validação destes resultados (Ghaffari et al., 2014). De facto, em virtude da natureza desta neoplasia, a sua análise histológica nem sempre é
possível e portanto, o diagnóstico definitivo não é alcançado (Mullin et al., 2014). Ainda de acordo com os mesmos autores, estudos futuros acerca da administração de doxorrubicina em HSA de origem cardíaca são importantes para a determinação de um tratamento para este tipo de tumor.
De uma forma geral, o TMV de um cão diagnosticado com HSA é de aproximadamente 4 meses após pericardiectomia (MacPhail, 2013).
4.7.2. Tumor da Base Cardíaca
O crescimento e a velocidade de metastização dos quemodectomas é lenta, pelo que a pericardiectomia se apresenta normalmente benéfica (Macintire, 2012). O tratamento definitivo de TBC consiste na sua remoção, no entanto, a sua vascularização, extensão e localização raramente o possibilitam; neste caso a pericardiectomia oferece resultados positivos e uma boa qualidade de vida (Mueller et al., 2014; Coleman e Rapoport, 2016). A pericardiectomia permite um maior TS, estando a cirurgia associada a uma sobrevivência média de 2 anos. (Vicari et al., 2001; Ehrhart et al., 2002). A radioterapia é uma possível opção caso a remoção cirúrgica de TBC não seja viável, emboram mais estudos sejam necessários de modo a confirmar a sua eficácia (Rancilio et al., 2012; Treggiari et al., 2015).
4.7.3. Mesotelioma
O MST é associado a um mau prognóstico, dependendo este da recorrência do derrame pleural. Na verdade, após pericardiectomia poderá ocorrer uma repetida acumulação de fluido pleural possivelmente fatal para o cão (Closa et al., 1999; Brisson et al., 2006; Coleman and Rapoport, 2016). Normalmente, a pericardiectomia confere 1 ano de sobrevivência, podendo a quimioterapia com cisplatina intracavitária melhorar o prognóstico de vida (Seo et al., 2007; MacPhail, 2013).
4.7.4. Linfoma
O linfoma é um tumor com mau prognóstico, mas usualmente com uma boa resposta à quimioterapia (Treggiari et al., 2015). De facto, segundo MacGregor et al. (2005) o tratamento com quimioterapia resultou em uma média de 157 dias de vida, enquanto que os animais que não beneficiaram da mesma sobreviveram apenas 22 dias.
4.7.5. Derrame Pericárdico Idiopático
No caso de DP idiopático, o prognóstico é normalmente bom após pericardiocentese, tendo em conta a capacidade de o espaço pleural para absorver a pequena quantidade de fluido restante (Nelson e Wendy, 2009). Assim sendo, a sua