Universidade de Trás-os-Montes e Alto Douro
Paratuberculose (PTB) nos bovinos leiteiros na ilha de
São Miguel, Açores. Diagnóstico laboratorial e
identificação de fatores de risco
Dissertação de Mestrado em Medicina Veterinária
João Miguel Vieira Flores
Orientadora: Professora Doutora Ana Cláudia Correia Coelho
Coorientador: Doutor Carlos Augusto Pinto
Universidade de Trás-os-Montes e Alto Douro
Paratuberculose (PTB) nos bovinos leiteiros na ilha de
São Miguel, Açores. Diagnóstico laboratorial e
identificação de fatores de risco
Dissertação de Mestrado em Medicina Veterinária
João Miguel Vieira Flores
Orientadora: Professora Doutora Ana Cláudia Correia Coelho
Coorientador: Doutor Carlos Augusto Pinto
Composição do júri:
Professora Doutora Maria da Conceição Medeiros de Castro Fontes
Professor Doutor Nuno Francisco Fonte-Santa Alegria
Resumo
A paratuberculose é uma infeção crónica causada por Mycobacterium avium subsp.
paratuberculosis (Map). As principais espécies afetadas são os ruminantes, provocando
diarreia crónica e perda de condição corporal. Ao nível da exploração traduz-se em redução da produção leiteira e abate prematuro com redução do valor da carcaça. A principal via de infeção é a via feco-oral, estando mais suscetíveis a infeção os animais com menos de um ano de idade.
Esta dissertação focou-se no diagnóstico e identificação fatores de risco da paratuberculose em explorações de bovinos da ilha de São Miguel no arquipélago dos Açores. Realizou-se o estudo de três casos, dois sobre o diagnóstico laboratorial de paratuberculose por métodos diretos e indiretos, e um de identificação de fatores de risco em explorações com casos confirmados de paratuberculose.
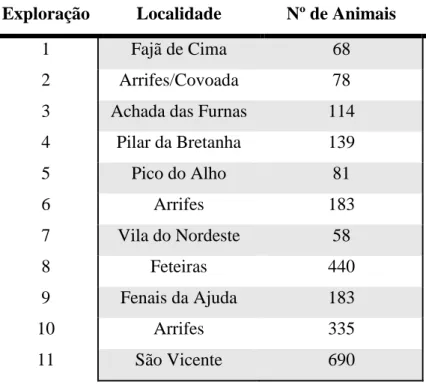
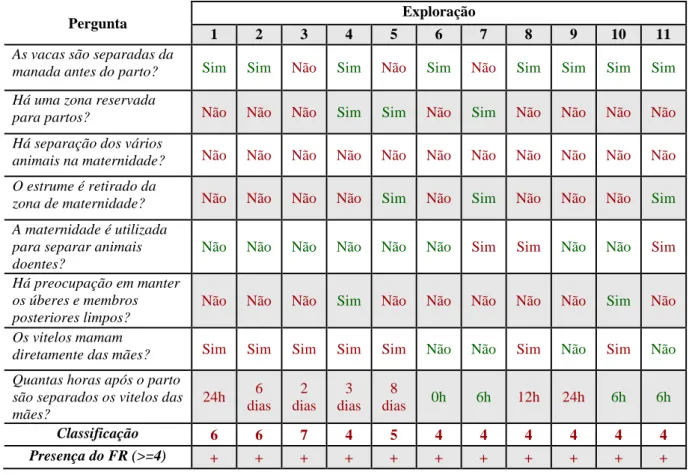
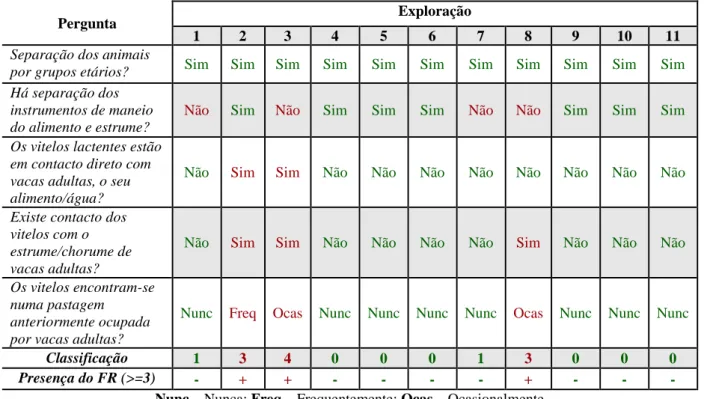
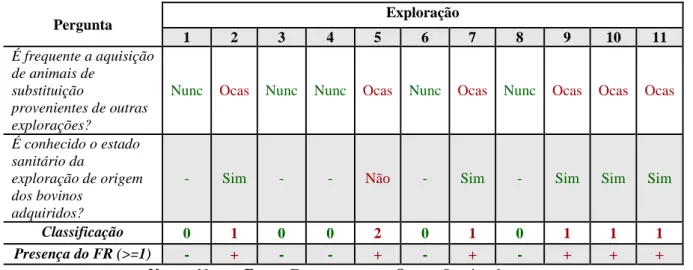
A identificação de fatores de risco da paratuberculose foi feita através da aplicação de um inquérito. Foram inquiridas 11 explorações e foi avaliada a presença de 4 fatores de risco. “Contacto com fezes de adultos no pós-parto” foi identificado em 11 explorações. “Contacto com fezes de adultos antes do desmame” foi identificado em 3 explorações. “Contacto com fezes de adultos após o desmame” foi identificado numa exploração. “Movimento de animais entre explorações” foi identificado em 6 explorações.
O diagnóstico laboratorial por métodos diretos foi feito através de cultura e PCR em tempo real IS900 sobre 72 amostras de fezes colhidas no matadouro e explorações da ilha. Por PCR todas as amostras tiveram resultado positivo. O método de cultura obteve isolamento de Map em 27 amostras, confirmadas posteriormente por PCR em tempo real f57.
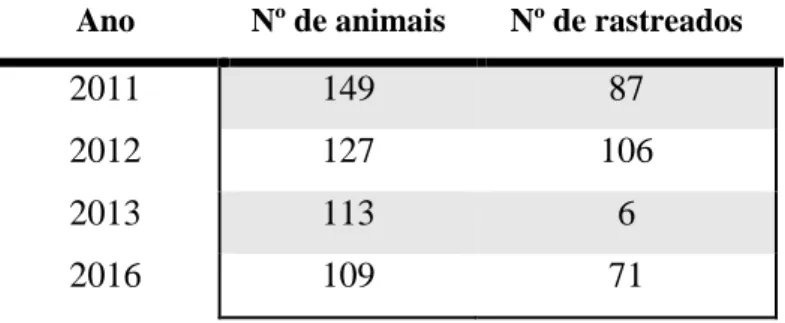
O diagnóstico laboratorial por métodos indiretos foi feito através de ELISA em amostras de sangue colhidas durante um rastreio a uma unidade epidemiológica. Foram rastreados 71 animais, dos quais 11 obtiveram resultado positivo. Calculou-se a seropositividade em 16% e a prevalência real em 27%.
Foi diagnosticada paratuberculose e identificados fatores de risco em explorações espalhadas por toda a ilha. Esta continua, portanto, a ser uma problemática que requer a atenção do proprietário e veterinário responsável de forma a ser possível o seu controlo.
Abstract
Paratuberculosis is a chronical infection caused by Mycobacterium avium subsp.
paratuberculosis (Map). The main species affected by this disease are ruminants. It
causes chronic diarrhea and loss of body weight. It produces loss of revenue in the form of reduced milk production and premature culling, with decreased culled cow weight. Transmission occurs mainly through the fecal-oral route, being more susceptible to infection animals less than a year old.
This dissertation focused on diagnosis and identification of risk factors of paratuberculosis in bovine herds located in the island of São Miguel in the Azores. Three case studies were carried out, two on laboratory assisted diagnosis of paratuberculosis through direct and indirect methods, and one on the identification of risk factors in herds with confirmed cases of paratuberculosis.
The identification of risk factors for paratuberculosis was done through a survey. Eleven herds were surveyed and it was evaluated the presence of four risk factors. “Contact with adult feces in the postpartum” was identified in 11 herds. “Contact with adult feces of pre-weaning animals” was identified in 3 herds. “Contact with adult feces of post-weaning animals” was identified in one herd. “Movement of animals between herds” was identified in 6 herds.
Laboratory assisted diagnosis by direct methods was achieved through culture and real time PCR IS900 of 72 samples of feces collected in the slaughterhouse and herds of the island. In the PCR method, all samples had positive result. In the culture method, there was isolation of Map in 27 samples, confirmed afterwards by real time PCR f57.
Laboratory assisted diagnosis by indirect methods was achieved through ELISA. The blood samples were collected during a screening of an epidemiological unit. Seventy-one animals were screened, of which 11 were positive to paratuberculosis. Seropositivity was 16% and the calculated real prevalence was 27%.
Paratuberculosis was diagnosed and risk factors were found in herds from all around the island. This remains a problem requiring attention from the herd owner and
Índice
Resumo ... II Abstract ... III Índice ... IV Índice de figuras ... VI Índice de tabelas ... VII Lista de abreviaturas ... VIII Agradecimentos ... IX
1 Revisão Bibliográfica ... 1
1.1 Referência histórica ... 1
1.2 Etiologia ... 3
1.2.1 O género Mycobacterium ... 3
1.2.2 Mycobacterium avium subsp. paratuberculosis... 3
1.3 Epidemiologia ... 7
1.3.1 Espécies suscetíveis, distribuição geográfica e prevalência ... 7
1.3.2 Fatores de Risco ... 9
1.3.3 Transmissão ... 10
1.3.4 Importância económica... 12
1.4 Patogenia ... 15
1.5 Imunologia ... 17
1.6 Quadro Clínico e Lesional ... 20
1.6.1 Quadro Clínico ... 20
1.6.2 Quadro Lesional ... 21
1.7 Diagnóstico ... 25
1.7.1 Necrópsia e Histologia... 25
1.7.3 Métodos moleculares ... 28 1.7.4 Provas Imunológicas ... 29 1.8 Controlo e Prevenção ... 32 1.9 Tratamento e Profilaxia ... 36 1.10 Potencial zoonótico ... 39 2 Objetivos ... 42 3 Materiais e Métodos ... 43
3.1 Identificação de fatores de riscos presentes na exploração ... 43
3.2 Identificação e deteção de Mycobacterium avium subsp. paratuberculosis .... 46
3.2.1 Recolha de Amostras ... 46
3.2.2 Preparação das amostras de fezes para cultura e extração de DNA ... 47
3.2.3 Descontaminação e cultura ... 47
3.2.4 Extração de DNA... 47
3.2.5 Reação em cadeia da polimerase ... 47
3.2.6 Reação em cadeia da polimerase em tempo real ... 48
3.3 Caso de estudo numa unidade epidemiológica ... 49
4 Resultados ... 50
4.1 Identificação de fatores de risco presentes na exploração ... 50
4.2 Identificação e deteção de Mycobacterium avium subsp. paratuberculosis .... 55
4.3 Caso de estudo numa unidade epidemiológica ... 57
5 Discussão ... 61
6 Conclusão ... 68
7 Bibliografia ... 69 Anexos ... X
Índice de figuras
Figura 1 – Animais rejeitados na abegoaria... 55
Figura 2 – Animal que apresenta sinais que emaciação e diarreia... 55
Figura 3 – Aspeto geral da manada. Algumas vacas apresentam sinais de diarreia... 57
Figura 4 – Saneamento ao efetivo. Atuação da brigada sanitária... 57
Figura 5 – Os vitelos são criados no pasto presos a uma estaca com uma corrente metálica………... 58
Figura 6 – Vasilha para distribuição de leite e martelo para fixação de estacas... 58
Figura 7 – Vitelo amarrado a estaca, junto a um cabanão com feno………. 59
Figura 8 – Material e equipamento velho que impossibilitam uma higiene adequada no aleitamento. Este cabanão alojava cabras na altura da visita………... 59
Índice de tabelas
Tabela 1 – Freguesias e número de animais das explorações inquiridas... 43 Tabela 2 – Fatores de risco e perguntas associadas... 44 Tabela 3 – Número total de animais e animais rastreados por ano... 49 Tabela 4 – Determinação da presença do fator de risco “Contacto com fezes de adultos no pós-parto”... 52 Tabela 5 – Determinação da presença do fator de risco “contacto com fezes de adultos antes do desmame”... 53 Tabela 6 – Determinação da presença do fator de risco “contacto com fezes de adultos após o desmame”... 53 Tabela 7 – Determinação da presença do fator de risco “movimento de animais entre explorações”... 54 Tabela 8 – Resumo dos fatores de risco identificados em cada exploração... 54 Tabela 9 – Resultados do teste de ELISA... 60
Lista de abreviaturas
µm – micrómetro µM – micromolar
AGID – imunodifusão em gel de agar
CL – células gigantes multinucleadas de Langhans CMA – complexo Mycobacterium avium
DC – doença de Crohn
DNA – ácido desoxirribonucleico
dNTP – desoxirribonucleotídeo fosfatado ELISA – ensaio de imunoabsorção enzimática HEYM – Herrold’s egg yolk medium
HPC – hexadecilpiridínio
INIAV – Instituto Nacional de Investigação Agrária e Veterinária LAM – lipoarabinomanano
LAMP – loop-mediated isothermal amplification LRV – Laboratório Regional de Veterinária
Map – Mycobacterium avium subsp. paratuberculosis mM – milimolar
PCR – reação em cadeia da polimerase
Agradecimentos
À Universidade de Trás-os-Montes e Alto Douro, a todos os professores, técnicos, auxiliares e demais funcionários, o meu muito obrigado.
Muito obrigado também à Dr.ª Ana Cláudia Coelho pela orientação neste trabalho, pela resposta rápida e pela ajuda sempre disponível.
Ao Dr. Carlos Pinto por me ter dado a oportunidade de trabalhar este tema, pelas ideias e pelo entusiasmo.
À Dr.ªSílvia Almeida pelos ensinamentos.
À Dr.ª Ana Botelho, à Dr.ª Célia Leão e à Ana Oliveira pela paciência com que me receberam.
Muito obrigado à ACRIGA, à AASM, ao INIAV e a todos com quem me cruzei durante os meses de estágio.
À Sara e ao Torrão, por não desistirem de mim e me mostrarem que há vida para além da tese.
Aos amigos da Marlene, sem os quais este período teria sido muito mais solitário. Ao meu irmão por não se cansar de ser a melga no meu ouvido.
À minha família e principalmente aos meus pais, pelo apoio incondicional, muito obrigado.
1 Revisão Bibliográfica
1.1 Referência histórica
Em 1894, Johne e Frothingham descreveram as lesões encontradas numa vaca com suspeita de tuberculose intestinal. No trato intestinal era possível identificar grande quantidade de bacilos ácido-álcool resistentes. O diagnóstico de tuberculose intestinal parecia possível. Porém o organismo não crescia em cultura e não produzia a doença em porquinhos-da-Índia quando infetados com tecidos que continham o organismo. Suspeitaram que a doença fosse causada por Mycobacterium avium, causador da tuberculose aviária. Devido às semelhanças com a tuberculose intestinal propuseram o nome de enterite pseudotuberculosa para a doença. Anos mais tarde, Bang chegou à mesma conclusão, que a doença não era causada por Mycobacterium bovis. Concluiu também que os animais afetados não reagiam à tuberculina, respondendo sim a preparados de Mycobacterium avium. Surgiram assim os primeiros testes diagnósticos para a doença. Bang também propôs que a doença se chamasse paratuberculose (Chiodini, 1993).
Twort e Holth conseguiram, em 1910, isolar pela primeira vez o agente. Twort propôs o nome de Mycobacterium enteriditis chronicae pseudotuberculosis bovis johne. Holth simplesmente nomeou o isolado de bacilo paratuberculoso e, como Bang e outros autores, acreditava que não se tratava de uma única espécie. Em 1923, a doença foi oficialmente designada de paratuberculose e o seu agente etiológico foi chamado de
Mycobacterium paratuberculosis. Ainda nessa década se percebeu que a doença tinha
uma distribuição mundial, e se estava a disseminar rapidamente. A partir desta década houve um aumento muito grande nos esforços para estudar esta doença e chegou-se à conclusão que os testes diagnósticos não funcionavam e que as tentativas de erradicação da doença em manadas infetadas saiam sempre frustradas. Conseguia-se apenas controlar a doença, diminuindo a sua prevalência, mas sem a eliminar da exploração (Chiodini, 1993).
Em 1984 foi isolado pela primeira vez M. paratuberculosis num doente humano com doença de Crohn. Desde então que existe muita controvérsia em relação à ligação destas duas doenças e as suas semelhanças. Em 1989 foi identificada uma sequência de
inserção no genoma de M. paratuberculosis, a IS900. Isto permitiu avanços no diagnóstico e identificação da espécie. Um ano mais tarde, Thorel e colaboradores concluíram que M. paratuberculosis fazia parte do complexo M. avium. Foi então proposto que o agente fosse nomeado de M. avium subsp. Paratuberculosis e com a publicação desta proposta no “International Journal of Systematic Bacteriology” passou a ser o nome oficial do organismo (Chiodini, 1993).
1.2 Etiologia
1.2.1 O género Mycobacterium
O género Mycobacterium é o único constituinte da família Mycobacteriaceae. Esta pertence à subordem Corynebacterinae, ordem Actinomycetales, subclasse Actinobacteridae, classe Actinobacteria, divisão Firmacutes, super-reino Bacteria (Stackebrandt et al., 1997). Fazem parte do género Mycobacterium mais de 150 espécies (Tortoli, 2014).
Estas bactérias caracterizam-se morfologicamente como bacilos retos ou ligeiramente encurvados, com dimensões compreendidas entre 0,2 a 0,6 µm de largura por 1,0 a 10,0 µm de comprimento. As células são imoveis, não formam endósporos, conídios ou cápsula. Não formam hifas visíveis a olho nu. As colónias podem variar de branco a cor de creme e algumas colónias produzem pigmentação amarela ou laranja havendo ou não estimulação luminosa. São bactérias álcool-ácido resistentes nalgum ponto do seu crescimento e são consideradas Gram-positivas apesar de dificilmente corarem através deste método (Goodfellow et al., 2012).
As espécies deste género podem ser divididas em dois grandes grupos. Espécies de crescimento rápido e espécies de crescimento lento, consoante demorarem, respetivamente, menos ou mais de 7 dias de incubação a temperaturas ótimas a formar colónias facilmente visíveis. As espécies com relevância clínica encontram-se maioritariamente no grupo das espécies de crescimento lento (Goodfellow et al., 2012).
1.2.2 Mycobacterium avium subsp. paratuberculosis
Mycobacterium avium está atualmente subdividido em três subespécies, M. avium
subsp. avium, M. avium subsp. silvaticum e M. avium subsp. paratuberculosis (Map) (Harris e Barletta, 2001). Esta espécie insere-se no Complexo Mycobacterium avium (CMA), um conjunto de micobactérias cuja composição é alvo de debate e varia consoante o contexto em que está a ser utilizado. Nele inclui-se M. avium, M.
intracellulare e outras espécies relacionadas (Turenne et al., 2007).
Mycobacterium avium subsp. paratuberculosis apresenta-se microscopicamente
em agregados de três ou mais bacilos com 0,5 a 1,5 µm de comprimento, Gram-positivos e altamente álcool-ácido resistentes (Clarke, 1997; OIE - World Organisation for Animal Health, 2012).
As colónias de Map em meio sólido podem aparecer num período de 5 semanas a 6 meses após inoculação. O tamanho pode variar desde uma ponta de agulha até 2 mm consoante a idade. Inicialmente translucidas, vão-se tornando esbranquiçadas a bege. A superfície é convexa, lisa e brilhante e as margens são redondas e regulares. As estirpes ovinas são de crescimento mais difícil e podem apresentar cor amarela (OIE - World Organisation for Animal Health, 2012).
Para que Map cresça em cultura o meio necessita de estar suplementado com micobactina (Thorel et al., 1990). Não se conhece a causa desta dependência. Após a sequenciação do genoma de Map e a sua comparação com outras micobactérias, verificou-se o encurtamento do primeiro gene do grupo responsável pela biossíntese de micobactina, podendo esta ser apontada como uma potencial causa desta dependência (Li et al., 2005). A dependência de micobactina é influenciada pelo pH do meio, a concentração de ferro e a micobactina arrastada da cultura primária (Lambrecht e Collins, 1992).
O genoma de Map tem 4,8 milhões de pares de bases, com um conteúdo de G+C de 69,3% (Li et al., 2005). Já são conhecidas várias sequências específicas para Map. A sequência de inserção IS900 (Green et al., 1989) é utilizada, há vários anos e através de variados métodos, na identificação de Map (Turenne et al., 2007). Os padrões de Polimorfismo no Comprimento de Fragmentos de Restrição da IS900 podem ser utilizados para dividir Map em três grupos, um associado a isolados bovinos de crescimento rápido (C), outro associado a isolados ovinos de crescimento lento (S) e outro designado de intermédio (I) (Collins et al., 1990; De Lisle et al., 1992; Bauerfeind et al., 1996). Estão também a ser estudadas outras sequências específicas e outros métodos genéticos para identificar Map como a ISMav2 (Strommenger et al., 2001; Sung et al., 2004), o hspX (Ellingson et al., 2000, 1998), a f57 (Poupart et al., 1993; Vansnick, 2004; Tasara et al., 2005) e o mptD (Stratmann et al., 2006).
São já conhecidos vários antigénios apresentados por Map, mas ainda não foram caracterizados antigénios padronizados para utilização em testes diagnóstico (Mikkelsen et al., 2011). As alquil hidroperoxido reductases C e D foram identificadas como bons indicadores da resposta imunitária do tipo celular com boa sensibilidade e especificidade
mais especificamente a utilização do polipéptido a362 presente na proteína p34 anteriormente referida num teste de ELISA e este apresentou baixa sensibilidade mas alta especificidade (Vannuffel et al., 1994). Estudos de comparação genómica incidentes em proteínas PE e PPE, presentes na parede celular das micobactérias e de função desconhecida, revelaram a presença de várias proteínas PPE exclusivas de Map, quando comparadas a outros membros do CMA (Mackenzie et al., 2009). Em relação aos antigénios lipoproteicos o mais estudado é o lipoarabinomanano (LAM). O LAM faz parte da parece celular de Map e é altamente imunogénico, tendo já sido utilizado em muitos testes serológicos para deteção de Map (Jark et al., 1997; Reichel et al., 1999). As proteínas de choque térmico estudadas como antigénios não se mostram específicas de Map (Mikkelsen et al., 2011). No entanto, a Hsp70 pode vir a ser muito útil como adjuvante ou mesmo como antigénio em vacinas para a paratuberculose (Koets et al., 2006).
Ainda em relação aos antigénios apresentados por Map, sabe-se hoje que a expressão proteica da bactéria, tanto em estirpes bovinas como ovinas, varia com condições de carência nutritiva, hipoxia e stresse térmico. Isto sugere que os antigénios expressos durante as diferentes fases de infeção podem ser diferentes, uma vez que as condições do meio a que a bactéria está exposta vão variando (Gumber et al., 2009; Gumber e Whittington, 2009).
Mycobacterium avium subsp. paratuberculosis tem uma grande capacidade de
sobreviver no ambiente, tendo sido isolado deste até 55 semanas após inoculação (Whittington et al., 2004), sobrevivendo em água durante 48 semanas, ou até 841 dias (Pickup et al., 2005; Whittington et al., 2005). Map possui a capacidade de resistir a uma grande amplitude de temperaturas, sendo possível o seu isolamento em cultura após o congelamento de amostras a -70oC e havendo registos da sua sobrevivência a alguns processos de pasteurização (Richards e Thoen, 1977; Chiodini e Hermon-Taylor, 1993; Sung e Collins, 1998; Grant et al., 2002). É também resistente a concentrações de cloro utilizadas na desinfeção da água da rede pública (Whan et al., 2001). A origem destas resistências pode advir de vários fatores. Map possui uma parede celular cerosa grossa, constituída na sua maioria por lípidos. Esta interage com protozoários e nemátodes, havendo até a sua multiplicação dentro dos primeiros mesmo na ausência de micobactina. Foi provada a presença no seu genoma de genes responsáveis pela indução de um estado de dormência, que permite a sobrevivência de células bacterianas não esporuladas sem
ser necessária a sua multiplicação (Lloyd et al., 2001; Whan, 2003; Whittington et al., 2004; Mura et al., 2006; Rowe e Grant, 2006).
1.3 Epidemiologia
1.3.1 Espécies suscetíveis, distribuição geográfica e prevalência
Esta doença foi primeiro descrita em bovinos e atualmente o seu impacte maior encontra-se em explorações de bovinos, ovinos e caprinos. Considera-se, no entanto, que todos os ruminantes são suscetíveis de adquirir a doença (Chiodini et al., 1984).
Outros ruminantes e pseudo-ruminantes de onde já se isolou Map são, por exemplo, veados (Murray et al., 2014), búfalos (Brito et al., 2016), bisontes (Ellingson et al., 2005), alces (Forde et al., 2015), renas (Del-Pozo et al., 2013) muflões (Pribylova et al., 2010), antílopes (Dukes et al., 1992), alpacas (Salgado et al., 2016), camelos e dromedários (Haghkhah et al., 2015).
Também há animais monogástricos onde já se identificou Map. Entre outros existem o javali (Kim et al., 2013), cavalo (Larsen et al., 1972), cão (Glanemann et al., 2008), primatas não humanos (McClure et al., 1987; Zwick et al., 2002; Singh et al., 2011), galinha (Van Kruiningen et al., 1991), raposa, doninha, corvo, gralha, rato, lebre, texugo (Beard et al., 2001) e coelho (Greig et al., 1999). O microrganismo é capaz de se multiplicar nestes animais, mas estes não apresentam sinais clínicos grande parte das vezes, excretando o microrganismo silenciosamente. Tornam-se assim um risco de contágio para os ruminantes com quem contactam (Chiodini et al., 1984).
O carácter zoonótico de Map é um assunto não totalmente esclarecido. Há muitos estudos que relacionam Map com a doença de Crohn e a colite ulcerativa, doenças inflamatórias do trato gastrointestinal de humanos. Estes estudos encontraram sinais da presença do microrganismo em vários tecidos de pacientes humanos. Ninguém pode para já afirmar com certeza que Map seja o agente etiológico destas doenças. No entanto, existem fortes evidências de que Map participa de alguma forma na patogenia delas (Uzoigwe et al., 2007; Liverani et al., 2014; Naser et al., 2014; McNees et al., 2015).
A paratuberculose é uma doença diagnosticada em todo o mundo (Chiodini et al., 1984). Em termos de prevalência existem muitos estudos. No entanto grande parte deles não está desenhado de forma a representar a população do país ou da região em estudo (Nielsen e Toft, 2009; Fernández-Silva et al., 2014).
Na Europa, estima-se uma prevalência de 20% entre bovinos (com algumas regiões com um valor mais baixo na ordem dos 3 a 5%), mais de 50% entre explorações bovinas e mais de 20% entre explorações de ovinos e caprinos (Nielsen e Toft, 2009).
Na América do Sul aponta-se para uma prevalência de 16,9% entre bovinos, 75,8% entre explorações bovinas, 16% entre ovinos, 4,3% entre caprinos e 3,7% entre explorações caprinas (Fernández-Silva et al., 2014)
Na América do Norte, em 1996, um estudo de prevalência em explorações de bovinos leiteiros baseado em amostras de sangue submetidas a um teste ELISA obteve resultados de 21,6% entre explorações (USDA, 1997). Em 2007, um estudo de acompanhamento deste último, baseado em cultura de amostras obtidas a partir de fezes, identificou uma prevalência entre explorações de 68,1% (USDA, 2008). Em relação a explorações de Bovinos de carne foi feito um estudo em 1997 com a mesma tipologia do estudo de 1996 que obteve prevalências de 0,4% entre animais e 7,9% entre explorações. Como o estudo estava desenhado para detetar explorações com 10% ou mais de prevalência estes valores estão possivelmente subestimados (Dargatz et al., 2001; Carter, 2012).
Na Ásia existem cenários muito diferentes consoante o país. No Japão pensa-se haver uma prevalência muito baixa. No país é obrigatório que todas as explorações leiteiras sejam testadas para paratuberculose a cada 5 anos e anualmente, do meio milhão de animais testados, apenas cerca de 1000 (0,2%) obtêm resultados positivos (Momotani, 2012). Um estudo no norte da Índia indica uma prevalência de 29% entre bovinos e búfalos (Singh et al., 2008). Na Coreia do Sul foi estimado que a prevalência em bovinos é de 7,1% (Park et al., 2006) e em caprinos da raça preta coreana é de 18,2 a 38,2% entre explorações e 4,6 a 15,3% entre animais (Lee et al., 2006). No norte e nordeste da China um estudo obteve uma prevalência em bovinos de 11,8% entre animais e 20,4% entre explorações (Sun et al., 2015).
Na Austrália estima-se uma prevalência de 2,4 a 4,4% entre rebanhos de ovinos, sendo a Nova Gales do Sul a região mais afetada (Sergeant e Baldock, 2002).
Em Portugal há poucos estudos de prevalência e todos eles em pequenos ruminantes. Na região nordeste um estudo em 3900 ovelhas estimou uma prevalência de 6,4% entre animais e 46,7% entre explorações utilizando um teste ELISA (Coelho et al., 2007). Outro estudo na mesma região utilizando PCR em amostras de sangue ovino obteve prevalências de 6,4 a 15,4% entre animais (Coelho et al., 2008). Um estudo feito
paratuberculose em 39 explorações, em 29 freguesias diferentes, representando 41% das freguesias da ilha (Cruz, 2015).
1.3.2 Fatores de Risco
O contacto de bezerros com fezes de animais adultos é talvez o fator de risco mais importante na transmissão de Map. Este fator é muitas vezes estudado de forma indireta (Doré et al., 2012).
No peri-parto foram identificados vários fatores de risco associados ao acima descrito: contaminação dos úberes com fezes (Ansari-Lari et al., 2009), estabulação em grupo de vacas em pré-parto (Wells e Wagner, 2000), presença de mais que uma vaca na maternidade (Tiwari et al., 2009), relação entre a contaminação da maternidade e o estado de infeção de um animal nascido de vacas Map negativas (Benedictus et al., 2008). Por outro lado, animais nascidos em partos assistidos têm menor probabilidade de ser infetados por Map (Cashman et al., 2008). Um estudo concluiu, ao invés do esperado, que a lavagem do úbere antes do parto estava associado a um risco aumentado de infeção (Johnson-Ifearulundu e Kaneene, 1998).
Para além da exposição de bezerros, a exposição de novilhas a fezes de animais adultos foi também associada a uma maior prevalência de infeção dentro das explorações (Künzler et al., 2014)
Ainda não é claro se a origem do colostro e leite consumido pelos bezerros é ou não um fator de risco para a transmissão de Map. Os estudos são vários, as metodologias distintas e os resultados contraditórios (Doré et al., 2012).
Um estudo concluiu que bezerros que recebiam colostro de um banco de colostro tinham maior probabilidade de ter um teste ELISA positivo em adultos, que bezerros que recebiam colostro da respetiva mãe. Esse mesmo estudo concluiu que bezerros que bebiam leite diretamente de mães adotivas tinham maior risco de vir a ser ELISA positivos que bezerros alimentados com leite de substituição (Nielsen et al., 2008). Outro estudo conclui que explorações que utilizavam o colostro de vacas ELISA positivas tinham maior probabilidade de estar infetadas (Diéguez et al., 2008).
Por outro lado, um estudo que comparou dois grupos de bezerros nascidos de vacas naturalmente infetadas por Map, um que recebeu o colostro e leite das respetivas
mães e, outro que recebeu colostro pasteurizado proveniente de um banco de colostro de animais saudáveis e leite de substituição, concluiu, ao fim de 12 meses, que a única diferença significativa entre os dois grupos foi a maior secreção de interferão γ aos 5 meses do grupo que recebeu colostro das mães (Stabel, 2008).
Um autor, em diferentes estudos, obteve conclusões opostas para a mesma pergunta. No primeiro estudo concluiu que alimentar bezerros com o leite rejeitado estava significativamente associado ao aumento da incidência da infeção por Map. Mais tarde concluiu que o mesmo procedimento diminuía o risco de transmissão de Map (Ridge et al., 2005, 2010).
O número de animais da exploração também sobressai como um fator de risco. Quanto maior o número de animais maior o risco de a exploração estar infetada com Map. Isto poderá dever-se a uma maior expressividade da doença pois mais animais podem mostrar sinais clínicos, ou as práticas de maneio de grandes explorações podem levar a uma maior propagação da doença (Wells e Wagner, 2000; Barrett et al., 2011; Bolton et al., 2011; Künzler et al., 2014; Vilar et al., 2015).
O movimento de animais entre explorações é também um fator de risco bem estabelecido para a transmissão de Map. Como se trata de uma doença que só expressa sinais clínicos quando já se encontra em estado avançado e não está implementada a utilização de testes diagnósticos específicos obrigatórios antes da circulação destes animais, é muito fácil que animais com doença em estado subclínico, mas que já excretam o microrganismo, se movimentem entre explorações. É portanto expectável que explorações que não apliquem nenhuma medida especial de diagnóstico e quarentena fiquem em maior risco de serem infetadas com a doença (Wells e Wagner, 2000; Pillars et al., 2009; Tiwari et al., 2009; Barrett et al., 2011; Künzler et al., 2014).
1.3.3 Transmissão
Atualmente, considera-se que a principal via de transmissão de Map é a via feco-oral, pela ingestão de alimentos contaminados ou pela ingestão acidental quando o meio ambiente se encontra contaminado (Lombard, 2011). Apesar de todas as faixas etárias serem suscetíveis a infeção, os animais mais novos (<6 meses) são os mais facilmente
(Windsor e Whittington, 2010). Pensava-se que esta transmissão se dava através do contacto de animais jovens com fezes de animais adultos, mas já foi provado que bezerros também podem eliminar o microrganismo nas fezes, sendo fonte de infeção para os outros animais com quem partilham o espaço (van Roermund et al., 2007)
A transmissão vertical transplacentária é também possível. O risco é maior quando a vaca já apresenta sinais clínicos de paratuberculose, mas vacas com doença subclínica também podem transmitir o microrganismo à sua descendência por esta via (Whittington e Windsor, 2009). A infeção do feto pode ocorrer em qualquer altura da gestação, exceto talvez antes dos 60 dias, altura em que se formam os cotilédones (Kruip et al., 2003). Esta via de infeção torna difícil a eliminação do microrganismo das explorações mesmo depois da aplicação de boas medidas de higiene, pois vacas em estado subclínico continuam a introduzir animais doentes na manada (Whittington e Windsor, 2009).
O isolamento de Map do colostro e leite de vacas coloca a questão de esta ser também uma possível via de transmissão (Streeter et al., 1995). A administração de colostro nas primeiras 24 a 48 horas de vida e leite materno são práticas comuns. No entanto ainda não se conseguiu confirmar se esta é de facto uma via de transmissão, pois ainda não se reproduziu a infeção quando os bezerros são alimentados com o colostro e leite de animais infetados, sem ter contacto direto com eles (Stabel, 2008; Pithua et al., 2010; Doré et al., 2012).
Mycobacterium avium subsp. paratuberculosis foi isolado do sémen e de órgãos
sexuais de touros (Larsen et al., 1981). Também foi capaz de sobreviver duas semanas dentro de úteros de vacas inoculadas e posteriormente foi isolado de um linfonodo pélvico de uma das vacas (Whittington e Windsor, 2009). Isto indica que há a possibilidade de a via sexual ser uma via disseminadora de Map em explorações que utilizem a monta natural como método reprodutivo.
Alguns estudos também apontam para a possibilidade de transmissão da doença por via aérea. Aerossóis contendo Map viáveis são formados a partir das fezes pela movimentação dos animais e disseminam-se por toda a exploração, contaminando o ar e todas as superfícies (Eisenberg et al., 2010a, 2010b). Após inoculação nasal e transtraqueal com aerossóis isolou-se Map a partir de gânglios linfáticos retrofaringeos e traqueobronqueais respetivamente, resultando também em infeção intestinal (Eisenberg et al., 2011). Existe então a possibilidade de haver uma outra via de transmissão cujo o controlo é mais difícil e não é normalmente contemplado.
1.3.4 Importância económica
As perdas económicas resultantes da paratuberculose advêm de receita não obtida em relação ao verdadeiro potencial da exploração e não de custos adicionais de produção. O objetivo de um plano de controlo de Map é fazer com que a receita se aproxime do seu verdadeiro potencial. O custo deste plano não deve exceder a diminuição de receita que existe devido à paratuberculose e, de facto, alguns planos não acarretam custos adicionais ao produtor (Lombard, 2011).
O cálculo do impacto económico da paratuberculose varia de estudo para estudo. No Reino Unido o custo por animal por ano ronda as 26 libras para vacas de leite e 17 libras para vacas de carne (Gunn et al., 2004). Nos Estados Unidos da América calculou-se que este custo variava em média entre os 22 e 27 dólares por vaca por ano, podendo, no entanto, ultrapassar os 200 dólares em explorações em que os animais já apresentam sinais clínicos (Ott et al., 1999). O impacto da doença na sua indústria leiteira poderia ir até aos 250 milhões de dólares anuais (Ott et al., 1999). Em França estimou-se que, numa produção leiteira, os custos associados a uma animal com doença subclínica eram de 461 euros, atingindo os 1940 euros caso o animal já apresentasse sinais clínicos (Dufour et al., 2004). Na Irlanda estimou-se uma redução dos lucros entre 168 e 253 euros por animal por ano (Barrett et al., 2006).
O impacto económico depende de vários fatores, entre eles, o número de animais infetados, em risco de ser infetados, em fase clínica ou em fase subclínica, o tipo de produção, o tamanho da manada e as práticas de maneio (Dufour et al., 2004; Garcia e Shalloo, 2015).
Animais infetados produzem menos leite, estimando-se que haja uma redução de 500 a 1400 kg de leite por cada lactação (Garcia e Shalloo, 2015), tendo sido já feita a correlação entre a prevalência de paratuberculose na exploração e a redução da produção de leite (Ott et al., 1999). No entanto, esta redução pode não ser notória nas primeiras lactações, piorando à medida que a vaca envelhece e o estado da infeção avança (Johnson et al., 2001).
inferiores. Um estudo referiu que um aumento de 10% na prevalência da doença levava a uma diminuição média de 33,4 kg de peso dos animais para refugo (Johnson-Ifearulundu et al., 1999). Outro estudo referiu uma perda de peso de até 31% e uma perda de valor de carcaça até 48% ao comparar animais Map positivos e Map negativos (Kudahl e Nielsen, 2009).
Outro efeito negativo observa-se no peso de bezerros ao desmame. Um estudo comparou o peso ao desmame (205 dias) de bezerros provenientes de vacas com teste ELISA negativo e vacas com teste ELISA fortemente positivo. Conclui-se que os bezerros das segundas pesavam em média menos 21,48 kg. Ao comparar bezerros de vacas não excretoras de Map com vacas altamente e, moderadamente excretoras concluiu-se que estes pesavam em média menos 58,51 kg e 40,81 kg respetivamente (Bhattarai et al., 2013). Esta perda de peso pode advir da diminuição da produção de leite por parte das mães Map positivas (Garcia e Shalloo, 2015).
Sendo a paratuberculose uma doença crónica, há a possibilidade de esta aumentar a suscetibilidade do animal a outras doenças, levando a refugo prematuro e a taxas de mortalidade superiores (Garcia e Shalloo, 2015). Segundo um estudo, um animal positivo a Map tem maior probabilidade de sofrer de laminite e de desenvolver doenças digestivas ou respiratórias (Villarino e Jordan, 2005). De facto, animais excretores de Map ou ELISA positivos têm maior probabilidade de ser refugados quando comparados com animais que não excretam Map, e nem sempre a deteção de Map ou sinais clínicos de paratuberculose são a razão primária para esse refugo (Lombard et al., 2005; Raizman et al., 2009; Smith et al., 2010). As principais razões para refugo de animais com paratuberculose clínica eram cultura fecal positiva a Map (50%), perda de peso acentuada (33%) e redução da produção de leite (17%). Para animais subclínicos as principais razões de refugo eram a redução da produção de leite (46%), mamite (27%), cultura fecal Map positiva (9%), infertilidade (9%) e teste de fixação do complemento positivo (4%) (Buergelt e Duncan, 1978). Um estudo estimou que a taxa de mortalidade era 3% superior em explorações com paratuberculose (Johnson-Ifearulundu et al., 1999). O refugo prematuro e a taxa de mortalidade aumentada implicam custos maiores na compra de animais de substituição e levam à perda do potencial genético da exploração (Sorge et al., 2010).
A estratégia de refugo mais rentável a longo prazo, no caso da identificação de animais Map positivos, é o envio destes para o matadouro o mais rapidamente possível.
No entanto, esta estratégia pode variar consoante as capacidades produtivas e reprodutivas da exploração e o custo de substituição dos animais (Kudahl et al., 2011).
1.4 Patogenia
Após a exposição oral a Map, este tem a capacidade de entrar no organismo por duas vias. A via menos comum é através das amígdalas. Esta via necessita de doses maiores de Map para resultar em infeção. Uma vez nas amígdalas difunde-se por via linfática ou sanguínea até aos gânglios linfáticos mesentéricos e íleo. A via mais comum consiste nos enterócitos e células M presentes nas placas de Payer, no íleo. Estas células permitem a passagem de Map do lúmen para a submucosa. Uma vez na submucosa é fagocitado por macrófagos (Momotani et al., 1988; Ponnusamy et al., 2013).
A resposta imunitária inicial é do tipo celular. Os macrófagos são ativados através de citocinas como o interferão γ, produzidos por linfócitos Th1 e tentam eliminar os microrganismos (Zurbrick et al., 1988). Alguns animais são capazes de debelar a infeção nesta fase. No entanto, outros animais continuam com infeção persistente.
Mycobacterium avium subsp. paratuberculosis tem a capacidade de sobreviver
dentro dos macrófagos. Esta capacidade advém de mecanismos ainda pouco conhecidos. Map é capaz de sobreviver ao inibir os processos bactericidas dos macrófagos impedindo a maturação e acidificação do vacúolo fagocítico, prevenindo os efeitos das enzimas lisossomais e dos radicais de oxigénio (Hostetter et al., 2003).
Uma particularidade de Map é não ser capaz de produzir micobactina, um sideróforo lipossolúvel presente na parede celular de micobactérias, produzindo apenas exoquelina, um sideróforo hidrossolúvel que é libertado no meio (Barclay e Ratledge, 1983). Os sideróforos são essenciais para o crescimento de micobactérias pois permitem a captação de ferro, tanto que para que Map cresça in vitro é necessário complementar o meio com micobactina (Wang et al., 2016). Este facto, associado à capacidade dos macrófagos ativados diminuírem a concentração de ferro dentro dos lisossomas tornam a sobrevivência de Map no interior de macrófagos um tema que ainda necessita de uma explicação mais clara (Byrd e Horwitz, 1989; Canonne-Hergaux et al., 1999). Alguns estudos recentes apontam para métodos alternativos de aquisição de micobactina e processos de ativação de Map aquando da sua passagem pelo epitélio intestinal que podem explicar a sua sobrevivência e multiplicação (Lamont et al., 2013; Wang et al., 2016).
Apesar de Map sobreviver no interior de macrófagos, a sua presença e as substâncias por si produzidas não têm efeitos tóxicos. As lesões provocadas na
paratuberculose são produto de uma resposta inflamatória exagerada (Clarke, 1997). A presença de antigénios de Map na submucosa intestinal e nos gânglios linfáticos mesentéricos leva a uma chamada de macrófagos e linfócitos, com subsequente formação de granulomas. O avançar deste processo inflamatório leva à perda de estrutura e função principalmente do intestino delgado e gânglios linfáticos associados (Sweeney, 2011).
Nesta primeira fase, o organismo é capaz de conter a infeção, não sendo detetável o microrganismo nas fezes nem anticorpos no sangue. Este período de pode-se estender por dois ou mais anos (Sweeney, 2011).
Com o passar do tempo e por razões ainda pouco conhecidas, a resposta imunitária do tipo celular começa a diminuir e a infeção começa a avançar mais rapidamente. Nesta fase dá-se a transição para uma resposta imunitária do tipo humoral, onde a produção de interleucinas como a IL-4 e a IL-10 por linfócitos Th2 estimula a produção de anticorpos e a diminuição da resposta celular especifica (Stabel, 2000). Os animais começam a libertar Map nas fezes mais regularmente e em quantidades maiores, Map dissemina-se por outros órgãos como o útero e a glândula mamária (Sweeney et al., 1992; Whittington e Windsor, 2009). Nesta fase os animais libertam Map nas fezes, ainda não apresentando sinais clínicos. A duração deste período, desde a primeira deteção de Map até ao aparecimento dos primeiros sinais clínicos, pode ser 6 meses até vários anos (Sweeney, 2011).
As lesões intestinais vão-se agravando, passando de focais ou multifocais para um infiltrado granulomatoso difuso, afetando o jejuno, íleo, ceco e em menor grau o colon. As paredes intestinais tornam-se espessadas e há a rutura dos vasos linfáticos nas vilosidades intestinais com fistulação para o lúmen intestinal. Estas lesões levam a défices na absorção intestinal e a perdas de plasma. Isto por sua vez leva a diarreias muito líquidas que não respondem a tratamento, com perdas elevadas de proteína nas fezes. Os animais começam a perder condição corporal, mesmo tendo apetite saudável, e podem desenvolver edema subcutâneo derivado da hipoproteinemia. Quando estes sinais clínicos se tornam claros os animais são normalmente enviados para abate. Os que ainda assim permanecem na exploração, vão perdendo progressivamente peso até que acabam por morrer de caquexia e desidratação (Sweeney, 2011).
1.5 Imunologia
A resposta pro-inflamatória no intestino depara-se com algumas dificuldades, uma vez que o ambiente intestinal tem de equilibrar mecanismos de tolerância, para evitar respostas inadequadas a componentes alimentares inócuos, e mecanismos de defesa contra organismos patogénicos transportados pelo alimento (Coussens, 2004). O íleo distal dos ruminantes jovens é quase que uma placa de Payer continua, ocupada quase exclusivamente por linfócitos B que vai regredindo durante o primeiro ano de vida. Também nos primeiros meses de vida os mecanismos de re-circulação de linfócitos T ainda não estão estabelecidos, tornando este tipo de imunidade quase inexistente nesta zona. Isto pode ser um dos fatores que explica a maior suscetibilidade dos animais jovens a Map (Hein et al., 1989).
O contacto inicial entre Map e os fagócitos mononucleares é importante, no sentido em que pode determinar o sucesso ou insucesso da resposta imunitária inicial. A absorção seletiva, através de recetores como integrinas, recetor de manose e CD14 pode levar à supressão da explosão oxidativa e à libertação de citocinas pró-inflamatórias (Woo e Czuprynski, 2008). Já a opsonização de Map através de anticorpos específicos ou do recetor de complemento 3 pode levar à indução da explosão oxidativa, alterações no tráfego intracelular e acidificação do fagolisossoma. Estes efeitos são, no entanto, dependentes da ativação prévia dos macrófagos por parte do interferão γ. Caso não haja esta ativação não há inibição da sobrevivência e multiplicação de Map, sendo estas, pelo contrário, melhoradas (Hostetter et al., 2005).
Mycobacterium avium subsp. paratuberculosis vivo no interior dos macrófagos
também impede a fusão do fagolisossoma (Woo et al., 2007). Leva também ao aumento da produção de IL-10 impedindo a maturação do fagócito mononuclear que o leva a não responder aos sinais pró-inflamatórios dos linfócitos T, nomeadamente o interferão γ (Simutis et al., 2007). Foi identificada uma via de sinalização nos monócitos de bovinos, a p38-MAPK, que parece estar envolvida neste processo. Esta via era mais rapidamente fosforilada quando os monócitos eram infetados com Map do que quando infetados com
Mycobacterium avium ssp. avium. O bloqueio químico desta via diminuía a expressão de
IL-10 e aumentava a expressão de IL-12, aumentando também a morte de Map. Isto indica que a p38-MAPK tem um papel importante na sobrevivência de Map no interior de macrófagos (Souza et al., 2006).
Mycobacterium avium subsp. paratuberculosis tem a capacidade de subverter
muitos processos nos macrófagos que infeta: impede a apoptose dos macrófagos que infeta, mantendo o seu hospedeiro vivo; interfere na função fagolisossomal, garantindo a sua sobrevivência; manipula a expressão de genes responsáveis pela produção de citocinas, impedindo a sua deteção e induzindo um ambiente imunossupressor e a separação espacial entre a lesão e o sistema imunitário sistémico; impede a maturação apropriada de células dendríticas intestinais (Koets et al., 2015).
Estas células dendríticas deficientemente ativadas não vão migrar eficientemente para os linfonodos regionais, não fazendo também uma adequada apresentação antigénica e não desencadeando uma resposta inflamatória adequada. Isto vai fazer com que os linfócitos T não sejam prontamente induzidos, dificultando também a sua capacidade migratória (Urdahl et al., 2011; Ehlers e Schaible, 2013). Enquanto isto acontece, Map induz nos macrófagos vias anti-inflamatórias, inibindo também a expressão dos genes responsáveis pela produção das quimiocinas RANTES e MCP, que chamam os linfócitos T ao local de infeção (Buza et al., 2003).
Quando, eventualmente, chegam ao local de infeção, os linfócitos T deparam-se com outra dificuldade. A identificação dos macrófagos infetados está alterada pois Map diminui a expressão do complexo major de histocompatibilidade e a apresentação e ativação dos co-recetores de antigénios (Sommer et al., 2009; Purdie et al., 2012). Também se pensa que haja um mecanismo de interação entre macrófagos infetados por Map e linfócitos T, semelhante ao que acontece na tuberculose, que causa a inibição ou morte dos linfócitos. Isto pode explicar a anergia dos linfócitos T no local de infeção que se observa na fase tardia da doença (Koets et al., 2002, 2015).
Um ponto que ainda não tem explicação clara é o mecanismo que leva, nos estados avançados da doença, a uma diminuição da imunidade celular específica associada a linfócitos Th1 e ao interferão γ, havendo uma aparente mudança para uma imunidade humoral especifica associada a linfócitos Th2 e à IL-4. Esta mudança era associada à fase de transição entre o estado subclínico e clínico da doença e ao aumento da replicação e libertação de Map nas fezes (Sweeney, 2011).
macrófagos na altura em que roturavam ao momento da mudança. No entanto, continua pouco claro o que provoca este efeito (Magombedze et al., 2014; Koets et al., 2015).
Um estudo recente comparou a gravidade das lesões histopatológicas e a resposta imunitária específica. Concluiu que a resposta por interferão γ e anticorpos correlaciona-se com a gravidade geral das lesões, não indicando um aumento na gravidade das lesões antes e depois da mudança de um tipo de resposta para o outro (Vazquez et al., 2013). Este facto apoia a ideia de que esta não é uma verdadeira transição, estando os dois tipos de imunidade em pleno funcionamento. Quando eventualmente a imunidade específica atinge o ponto de exaustão verifica-se é que a primeira a falhar é a imunidade celular (Begg et al., 2011).
1.6 Quadro Clínico e Lesional
1.6.1 Quadro Clínico
A apresentação clínica da paratuberculose foi dividida em 4 fases, de acordo com a gravidade dos sinais clínicos, potencial de disseminação de Map através fezes e a capacidade de detetar a doença por métodos laboratoriais (Whitlock e Buergelt, 1996).
A fase I, ou fase de infeção silenciosa, compreende animais jovens ou recentemente infetados por Map, não apresentando ainda quaisquer sinais clínicos. Estes animais têm crescimento, ganho de peso e aparência externa igual ao de outros animais da manada não infetados. Map pode ser detetado apenas por técnicas que demonstram a sua presença nos tecidos por cultura ou provas histológicas. No entanto, estes animais podem libertar pequenas quantidades de Map nas fezes que são difíceis de detetar por cultura, mas com capacidade de infetar outros animais (Whitlock e Buergelt, 1996; van Roermund et al., 2007).
Na fase II, ou fase de doença subclínica, os animais são normalmente adultos. Não apresentam nenhum dos típicos sinais clínicos, no entanto podem apresentar maior suscetibilidade a outras doenças como mamites, laminites e outras doenças respiratórias ou digestivas, tendo também a sua capacidade produtiva diminuída (Villarino e Jordan, 2005; Garcia e Shalloo, 2015). Nesta fase já se pode detetar a produção de anticorpos, alteração da resposta imunitária celular e Map nas fezes, tendo em atenção que testes consecutivos em animais nesta fase podem não ser concordantes. Estes animais vão muitas vezes para refugo por outras razões que não a paratuberculose, acabando por não ser reconhecida a infeção pelo proprietário ou pelo médico veterinário (Whitlock e Buergelt, 1996).
A fase III, ou fase de doença clínica, caracteriza-se por uma perda de peso gradual, apesar do animal apresentar um apetite saudável. Acompanhando a perda de peso, dá-se também o aumento da fluidez das fezes. Pode haver períodos de diarreia intermitentes e o animal pode apresentar maior sede. A diarreia pode também ser persistente, tendo apenas o aspeto de fezes normais líquidas, não havendo sinais de sangue, excesso de muco ou tenesmo. Esta diarreia não responde aos tratamentos convencionais. O pelo do animal pode ficar com aspeto degradado, com alopécia e despigmentação (Clarke, 1997). Os
maioria dos animais nesta fase, tem testes de cultura, ELISA e AGID positivos (Whitlock e Buergelt, 1996).
Finalmente a fase IV, ou fase de doença avançada, caracteriza-se por um agravar dos sinais clínicos da fase anterior. Os animais ficam fracos, letárgicos e emaciados. Resultado da hipoproteinemia, causada por perdas de proteína no intestino, os animais apresentam edema intermandibular. Continuam também com diarreia muito líquida e eventualmente, devido a caquexia e desidratação acabam por morrer. Os animais que são mandados para refugo nesta fase são muitas vezes rejeitados para consumo humano (Whitlock e Buergelt, 1996).
O tempo de incubação da paratuberculose é muito variável, podendo haver períodos de 2 a 10 anos desde o momento da infeção até ao aparecimento dos primeiros sinais clínicos. Durante este tempo, o animal infetado esteve a excretar Map nas fezes. Isto significa que por cada animal que se encontra na fase III ou IV pode haver até 25 outros animais na exploração com doença subclínica (Whitlock e Buergelt, 1996). Isto causa grandes problemas de produtividade e perpétua a doença na manada sem que o produtor se aperceba, pois apesar de muitos animais estarem doentes e com a produção afetada, só uma pequena percentagem acaba por mostrar sinais clínicos, não ficando o produtor alarmado com a situação (Salem et al., 2013)
A paratuberculose tem como diagnósticos diferenciais, entre outros, o parasitismo gastrointestinal como a coccidiose, peritonite, amiloidose renal, linfossarcoma, falha renal, desnutrição como a deficiência em cobre ou cobalto, fome prolongada, diarreia de inverno, envenenamento crónico por molibdénio e outras doenças infeciosas crónicas como salmonelose (Salem et al., 2013).
1.6.2 Quadro Lesional
1.6.2.1 Lesões Macroscópicas
A gravidade das lesões pode não corresponder à gravidade dos sinais clínicos. O animal pode encontrar-se emaciado com atrofia serosa dos depósitos de gordura, edema intermandibular e efusão serosa nas cavidades corporais (Chiodini et al., 1984; Salem et al., 2013).
As lesões primárias encontram-se no trato gastrointestinal e nos linfonodos regionais associados. Podem aparecer desde o duodeno até ao reto, mas são mais comuns na porção terminal do íleo e podem ter forma segmentar ou difusa. As primeiras lesões são encontradas normalmente na região da válvula ileocecal (Chiodini et al., 1984).
Numa fase precoce da doença, a primeira alteração que se verifica é um ligeiro engrossamento da mucosa ficando esta com um aspeto aveludado. Mais tarde, a parede intestinal engrossa, mostrando-se por vezes edematosa. A mucosa apresenta pregas grossas e largas com disposição transversal e bem compactada. Esta apresentação não desaparece quando o intestino é esticado, sendo denominada de cerebroide por se assemelhar ao córtex cerebral. A mucosa entre as pregas pode estar avermelhada devido a congestão ou ulceração. A superfície peritoneal do íleo pode apresentar pequenos nódulos brancos calcificados ou caseosos (Chiodini et al., 1984; Gilardoni et al., 2012; Salem et al., 2013).
As lesões linfáticas compreendem linfadenite e linfangite. Os linfonodos mesentéricos encontram-se aumentados, edematosos, pálidos, quase sem distinção corticomedular e com vários locais de inflamação granulomatosa. Os linfonodos mais afetados encontram-se na região ileocecal. Os vasos linfáticos assemelham-se a cordões engrossados que percorrem o peritoneu intestinal e o mesentério até aos linfonodos e podem apresentar os mesmos nódulos anteriormente referidos (R. J. Chiodini et al., 1984; Salem et al., 2013).
Também podem ocorrer lesões noutros órgãos, principalmente no fígado, onde podem aparecer granulomas focais que podem passar despercebidos. Também podem ocorrer lesões vasculares, nomeadamente arteriosclerose (R. J. Chiodini et al., 1984).
1.6.2.2 Lesões Microscópicas
Os achados histopatológicos permitem dividir as lesões em três tipos, lesões focais, multifocais e difusas. As lesões difusas em bovinos podem ainda ser subdivididas em lesões difusas multibacilares, linfocíticas ou paucibacilares e intermédias. Os parâmetros que sustentam esta classificação são: presença de lesões granulomatosas; localização dos granulomas nos diferentes tecidos linfóides intestinais; intensidade e
ovinos (Perez et al., 1996) e caprinos (Corpa et al., 2000), tendo sido posteriormente adaptada para bovinos (González et al., 2005).
As lesões focais encontram-se principalmente no íleo distal e nos linfonodos. Consistem em pequenos granulomas bem diferenciados constituídos por macrófagos com citoplasma abundante de aspeto espumoso e núcleo grande e por vezes alguns linfócitos entre os macrófagos e células gigantes multinucleadas de Langhans (CL). Estas últimas podem também aparecer isoladas nas vilosidades intestinais. Não há fibrose nem necrose em torno dos granulomas. Os granulomas localizam-se na zona interfolicular, tanto da região cortical dos linfonodos como do tecido linfóide ileocecal. Com métodos de Ziehl-Neelsen e imunohistoquímica é possível encontrar alguns microrganismos no interior de macrófagos e CL (González et al., 2005).
Nas lesões multifocais aparecem granulomas focais e bem diferenciados não só no tecido linfóide, mas também na lâmina própria do intestino. Neste tipo de lesão encontra-se, geralmente no ápex das vilosidades, granulomas ou CL isoladas, ambos rodeados por um ligeiro infiltrado de linfócitos e plasmócitos. Estes achados não se encontram em número suficiente para causar enterite difusa e alterar a arquitetura intestinal. As lesões distribuem-se pelo jejuno, íleo e respetivos linfonodos. Nestes últimos aparecem em maior número quando comparado com as lesões focais. A presença de microrganismos foi detetada em maior quantidade em relação às lesões focais (González et al., 2005).
As lesões difusas caracterizam-se por uma enterite granulomatosa grave. Encontra-se um infiltrado inflamatório em várias zonas do intestino que causam o espessamento da parede intestinal. Este tipo de lesão é dividido noutros três de acordo com o tipo de células mais frequentemente encontrado no infiltrado e a quantidade de microrganismos encontrado (González et al., 2005).
Lesões difusas multibacilares possuem um infiltrado maioritariamente composto por macrófagos com citoplasma espumoso e também células epitelióides, aparecendo também alguns linfócitos e CL. O infiltrado causa o espessamento da mucosa intestinal, provocando a separação das glândulas e a fusão das vilosidades. Os vasos linfáticos podem estar dilatados no final das vilosidades, contendo no seu interior macrófagos. As glândulas intestinais estão dilatadas preenchidas por detritos necróticos, havendo macrófagos no seu epitélio que se projetam para o lúmen. O infiltrado também afeta a submucosa, havendo edema e por vezes arterite granulomatosa com formação de
trombos. O tecido linfóide também se encontra com infiltrado inflamatório. Identificam-se alguns granulomas no corpo das vilosidades ainda não fundidas e granulomas multifocais no tecido linfóide e serosa, normalmente, associados a vasos linfáticos causando a sua inflamação. Os linfonodos regionais têm linfadenite granulomatosa difusa grave. Encontram-se grandes quantidades de microrganismos no interior dos macrófagos e CL presentes nas lesões (González et al., 2005).
As lesões difusas linfocíticas ou paucibacilares, são compatíveis com enterite difusa granulomatosa grave. Neste caso, o infiltrado inflamatório é constituído maioritariamente por linfócitos, estando também presentes macrófagos e CL. Por entre os linfócitos encontram-se alguns granulomas bem definidos. A mucosa tem a arquitetura alterada, apresentando engrossamento e encurtamento das vilosidades. A submucosa encontra-se menos alterada que no tipo de lesão anterior, apresentando CL isoladas e granulomas cercados por linfócitos. A serosa tem alterações granulomatosas moderadas. Os linfonodos jejunais e ileais estão muito afetados, observando-se linfadenite granulomatosa grave e várias CL, principalmente no córtex. Encontram-se microrganismos nas lesões, mas mais raramente e em quantidades menores que nas lesões multibacilares, não sendo observados na maioria dos granulomas e CL (González et al., 2005).
As lesões difusas intermédias caracterizam-se por uma enterite difusa granulomatosa, em o que o infiltrado é constituído por grandes quantidades de linfócitos, plasmócitos, CL e macrófagos, quer de maneira isolada ou formando granulomas. A composição do infiltrado pode variar entre animais e até entre amostras, sendo os tipos principais de células os macrófagos ou os linfócitos. O infiltrado causa o engrossamento das vilosidades e o deslocamento de glândulas. A submucosa está muito afetada, com edema e infiltrado mononuclear e granulomas. Os linfonodos apresentam lesões semelhantes às outras lesões difusas. Encontram-se microrganismos nos tecidos, em quantidades inferiores às encontradas nas lesões multibacilares (González et al., 2005).
1.7 Diagnóstico
O diagnóstico de paratuberculose num indivíduo apenas pela observação de sinais clínicos pode não ser possível pois estes sinais (emagrecimento, diarreia, diminuição de produtividade) são inespecíficos. Para confirmar o diagnóstico presuntivo é necessário recorrer a testes laboratoriais. Os testes a que se pode recorrer são por exemplo a necrópsia, histologia, esfregaços fecais, cultura fecal e de tecidos, sondas de DNA em amostras de tecidos ou fezes e serologia. No entanto, se houver acesso ao historial da exploração e esta já tenha tido casos confirmados de paratuberculose, pode-se basear o diagnóstico, com algum grau de confiança, apenas nos sinais clínicos demonstrados (OIE - World Organisation for Animal Health, 2012).
Também podem ser aplicados testes laboratoriais a toda a manada de maneira a estimar a prevalência da doença. Este género de testes efetuados periodicamente, cada 6 ou 12 meses, associados à remoção dos animais positivos e aplicação de medidas de higiene e maneio apropriados permitem reduzir a prevalência da paratuberculose. Este tipo de testes também permitem ter um maior grau de segurança quando se quer comercializar animais entre explorações (OIE - World Organisation for Animal Health, 2012).
1.7.1 Necrópsia e Histologia
Durante a necrópsia de animais suspeitos deve-se prestar especial atenção ao trato gastrointestinal e linfonodos associados. Observar apenas o espessamento superficial do intestino não é suficiente. Deve-se proceder à abertura do intestino desde o duodeno até ao reto e analisar a mucosa intestinal, procurando lesões sugestivas anteriormente descritas, nomeadamente o enrugamento e espessamento (aspeto cerebroide) patognomónicos na porção terminal do íleo (OIE - World Organisation for Animal Health, 2012).
Para histologia, recolhem-se amostras de porções do íleo, válvula ileocecal e linfonodos mesentéricos fixando-as em formol. As lâminas devem ser coradas com o método de hematoxilina-eosina e Ziehl-Neelsen (OIE - World Organisation for Animal Health, 2012). As lesões observadas devem corresponder ao anteriormente descrito.
Também podem ser usadas técnicas de imunohistoquímica, que recorrem a anticorpos específicos para Map, marcados por enzimas. Estas técnicas permitem identificar Map nos tecidos com uma maior especificidade (Gilardoni et al., 2012).
1.7.2 Bacteriologia
Durante a necrópsia devem ser recolhidos esfregaços de fezes, lesões na mucosa e superfícies de corte dos linfonodos que são posteriormente submetidos a coloração de Ziehl-Neelsen. Ao microscópio deve ser confirmada a presença de microrganismos álcool-ácido resistentes, com 0,5 a 1,5 µm que formam agregados de três ou mais organismos (OIE - World Organisation for Animal Health, 2012). Este método tem baixa sensibilidade e especificidade. A diarreia, que diminui a concentração do microrganismo nas fezes, e a excreção irregular de Map fazem com que este método resulte facilmente em falsos negativos (Gilardoni et al., 2012).
O método de cultura é ainda o “gold standard” do diagnóstico de paratuberculose, apesar das dificuldades técnicas e do tempo necessário para ter resultados. Considera-se que a especificidade deste método é de 100%. Há autores que referem um possível fenómeno de passagem, em que o microrganismo atravessa o trato gastrointestinal sem causar infeção, sendo detetado nas fezes um a sete dias após a ingestão. Neste caso, que se pensa não acontecer frequentemente, há a possibilidade de serem detetados falsos positivos. Como tal um estudo estima a especificidade deste teste em 98%. A sensibilidade varia com a fase da doença em que o animal se encontra, sendo estimada em 70% no caso de animais em fase clínica, ou ficando pelos 23 a 29% quando se consideram todos os animais infetados (Nielsen e Toft, 2008; OIE - World Organisation for Animal Health, 2012).
As amostras utilizadas neste método podem ter várias origens. No caso de se proceder a necrópsia podem ser utilizadas amostras de linfonodos que apresentem lesões, ou raspagens da mucosa da válvula ileocecal e linfonodos associados. Fezes, leite ou colostro também podem ser utilizados e até no caso de explorações leiteiras podem-se recolher amostras dos filtros do sistema de recolha de leite. Estas amostras podem ser recolhidas por individuo, por lotes de animais ou até de amostras ambientais nos locais
Os meios de cultura sólidos utilizados para a cultura de Map são o Herrold’s Egg Yolk Medium (HEYM), Löwenstein-Jensen ou Middlebrook (7H10, 7H11). Como meios líquidos temos Middlebrook (7H9, 7H12). Para haver crescimento de Map os meios têm sempre de ser suplementados com micobactina J, dado Map não ser capaz de a produzir (Gilardoni et al., 2012; OIE - World Organisation for Animal Health, 2012).
Antes de se proceder à inoculação é necessário fazer a descontaminação das amostras, pois Map é uma população minoritária quando comparado com outras bactérias e fungos presentes. Esta descontaminação é feita recorrendo a hexadecilpiridínio (HPC) ou então ácido oxálico e hidróxido de sódio. De modo a melhorar o processo de descontaminação pode ser adicionada ao meio uma combinação de antibióticos. É preciso ter em atenção que este processo pode durar até um dia e que também afeta Map, diminuindo a quantidade de unidades formadoras de colónias presentes na amostra de maneira significativa (Gilardoni et al., 2012; OIE - World Organisation for Animal Health, 2012).
Os critérios para identificar Map são o tempo de incubação prolongado (5 semanas a 6 meses), a morfologia das colónias (redondas, com 1 mm de diâmetro, lisas e brilhantes), o resultado positivo à coloração Ziehl-Neelsen e a dependência de micobactina das culturas primárias. Este último ponto é testado fazendo duas inoculações de cada amostra, uma em meio com micobactina e outra em meio sem micobactina (Gilardoni et al., 2012; OIE - World Organisation for Animal Health, 2012).
No sentido de aumentar a sensibilidade deste método recorre-se a vários métodos de concentração da amostra como a centrifugação, a sedimentação, filtração e separação imunomagnética (Gilardoni et al., 2012).
O método de cultura tem uma especificidade muito alta e uma sensibilidade razoável quando comparado com outros testes laboratoriais. No entanto, é um método dispendioso que necessita de um período muito grande até serem obtidos resultados. Isto torna-o um teste pouco prático para ser aplicado em programas de controlo em explorações, pois enquanto se espera por resultados, os animais infetados continuam a excretar Map aumentado cada vez mais a contaminação ambiental aumentando o risco de infeção de animais saudáveis (Gilardoni et al., 2012)
1.7.3 Métodos moleculares
O método molecular mais frequentemente utilizado é a deteção de sequências de DNA específicas de Map. Foram já identificadas várias sequências específicas de Map, sendo que a mais utilizada atualmente é a IS900. No genoma de Map pode-se encontrar 14 a 20 cópias da IS900, o que confere a testes que a utilizem uma sensibilidade superior em relação a outras sequências. Outra sequência específica já descrita é a f57, que apenas tem uma cópia no genoma de Map e é utilizada normalmente em conjunto com a IS900 (Timms et al., 2011).
A deteção destas sequências é feita maioritariamente por variações da técnica de reação em cadeia da polimerase (PCR). A nested PCR consiste em duas rondas de amplificação com um par de “primers” diferente em cada, aumentando a sensibilidade do método. Há também a multiplex PCR que utiliza vários pares de “primers” na mesma reação permitindo a identificação de infeções mistas. A real-time PCR utiliza uma sonda, marcada com um fluorocromo, complementar a um segmento intermédio que se liga à sequência que está a ser amplificada. A fluorescência emitida vai ser proporcional à quantidade de DNA a que a sonda se liga, permitindo a quantificação de Map na amostra. Para este fim não pode ser utilizada a IS900 pois existem várias cópias dela no genoma, utilizando-se então a f57 (Gilardoni et al., 2012). Outra variação da técnica de PCR menos utilizada é a loop-mediated isothermal amplification (LAMP). A LAMP tem mostrado uma boa sensibilidade e especificidade, sendo também uma técnica que não necessita de termociclador, o que a torna mais económica e prática de aplicar (Enosawa et al., 2003).
As amostras de DNA podem ser obtidas a partir de colostro, leite, fezes e múltiplos tecidos da parede intestinal e linfonodos. A extração de DNA destas amostras necessita de ser feita utilizando o método mais apropriado, pois este passo tem muita influência na qualidade dos resultados finais obtidos. Dependendo da origem da amostra podem ser utilizados vários métodos, mas pensa-se que um passo mecânico é essencial para maximizar a quantidade de DNA extraído. Este passo também resulta, no entanto, em maior libertação de inibidores da PCR, aumentando a possibilidade de falsos negativos (Timms et al., 2011).