70134829190
Pró-Reitoria de Pós-Graduação e Pesquisa
Pós-Graduação em Ciências Genômicas e Biotecnologia
Centro de Análises Proteômicas e Bioquímicas
PROSPECÇÃO E PURIFICAÇÃO DE PEPTÍDEOS COM
ATIVIDADE ANTIMICROBIANA A PARTIR DE CORAIS DA
COSTA BRASILEIRA
Brasília - DF
2012
LOIANE ALVES DE LIMA
PROSPECÇÃO E PURIFICAÇÃO DE PEPTÍDEOS COM ATIVIDADE ANTIMICROBIANA A PARTIR DE CORAIS DA COSTA BRASILEIRA
Dissertação apresentada ao Programa de Pós-Graduação Stricto Sensu em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília, como requisito parcial para obtenção do Título de Mestre em Ciências Genômicas e Biotecnologia.
Orientadora: Dra. Simoni Campos Dias Co-orientador: Dr. Octávio Luiz Franco
Brasília
Ficha elaborada pela Biblioteca Pós-Graduação da UCB
11/09/2012
L732p Lima, Loiane Alves de.
Prospecção e purificação de peptídeos com atividade antimicrobiana a partir de corais da costa brasileira. / Loiane Alves de Lima – 2012.
127f. il. ; 30 cm
Dissertação (mestrado) – Universidade Católica de Brasília, 2012.
Orientação: Profa. Dra. Simoni Campos Dias Coorientação: Prof. Dr. Octávio Luiz Franco
1. Peptídeos. 2. Bactérias patogênicas. 3. Fungos patogênicos. 4. Coral. I. Dias, Simoni Campos, orient. II. Franco, Octávio Luiz, coorient. III. Título.
AGRADECIMENTOS
Agradeço a Deus pelo dom da sabedoria, decisão, paciência e por me acompanhar, iluminar, proteger e guiar pelos caminhos certos, permitir que as pessoas certas entrassem e permanecessem em minha vida;
A minha família pelo incentivo, amor, cumplicidade, companheirismo, lealdade; As minhas grandes amigas: Dianny, Heloysa, Larissa, Luciana, Quéren e Tatiana;
A minha orientadora Simoni Campos Dias e ao meu co-orientador Octávio Luiz Franco pelo apoio e dedicação de ambos;
Aos colegas e amigos do CAPB e de outros laboratórios da pós. Obrigada pelos dias de trabalho, incentivo e aprendizado, em especial aos que participaram de alguma parte da dissertação: Ludovico, Osmar, Chale e Suzana;
As minhas alunas de Iniciação científica pela oportunidade de orientá-las e também por me auxiliarem no meu crescimento pessoal e profissional: Eveline e Mary Anne;
Aos avaliadores Dr. Thales Lima Rocha e Dra. Paula Andreia Silva por aceitarem participar da banca e contribuir para a avaliação da dissertação;
"Saiba sempre que, a cada momento, você está fazendo uma escolha e você faz justamente aquilo que quer. A cada novo instante, use seu senso de opção, mas: Reserve tempo para trabalhar: este é o preço do êxito. Reserve tempo para pensar: é essa a fonte de poder. Reserve tempo para ler: é essa a base da sabedoria. Reserve tempo para ser amigo: é esse o caminho da felicidade. Reserve tempo para ser útil: é essa vida demasiada curta para sermos egoístas. Reserve tempo para rir: é essa a música da alma. E lembre: é você quem define suas prioridades".
RESUMO
LIMA, Loiane. Purificação de proteínas com atividade antimicrobiana a partir de corais da Costa brasileira. 2012. 127 folhas. Dissertação de Mestrado em Ciências Genômicas e Biotecnologia- Universidade Católica de Brasília, Brasília, 2012.
O ecossistema marinho consiste em uma enorme diversidade de fonte de biomoléculas que pode ser utilizada para tratamento de diversas doenças. Entre os animais presentes nesse ecossistema, os recifes de corais são extremamente importantes para o ambiente marinho sendo o elo inicial na cadeia alimentar que envolve numerosas espécies de moluscos, crustáceos, peixes e outros organismos de grande importância biológica. Nesse ambiente altamente competitivo, os organismos necessitam de barreiras químicas para reduzir ou evitar a contaminação por micro-organismos. Entre as moléculas que protegem esses animais estão inclusos os peptídeos antimicrobianos (PAMs). Em diversos estudos tem sido relatada a descoberta de componentes em diferentes organismos como esponjas, quelicerados, tunicados, crustáceos e outros. Na presente pesquisa, os extratos dos espécimes de corais Palythoa caribaeorum, Carijoa riisei, Neospongodes atlantica, Muriceopsis sulphurea, Plexaurella grandiflora, Phyllogorgia dilatata foram testados contra
inúmeras bactérias Gram-positivas e negativas. Bioensaios mostraram que Muriceopsis sulphurea e Phyllogorgia dilatata causaram a inibição do crescimento da maioria das
bactérias em uma concentração de 200 µg.mL-1. O extrato bruto de
Phyllogorgia dilatata foi
fracionado com sulfato de amônio (0-40%) mostrando elevada atividade contra Escherichia coli e Staphylococcus aureus (30% e 80%, respectivamente). A fração rica foi purificada
utilizando Amicon® Ultra Centrifugal 10.000 MWCO associada com a cromatografia de fase
reversa (C18) possibilitando a obtenção da fração rica Pd1. Pd1 foi capaz de reduzir o
crescimento de Staphylococcus aureus, Escherichia coli e Klebsiella pneumoniae em 100%,
76% e 50%, respectivamente. A análise por espectrometria de massa mostrou um pico de 5.372 Da referente ao peptídeo Pd-AMP1. A sequencia N-terminal do peptídeo Pd-AMP1
mostrou 88% de identidade com a enzima OsmC-like peroxidase da bactéria
Chromohalobacter salexigens que consiste em uma bactéria marinha halófila capaz de
crescer em ambientes hipersalinos. Os dados aqui reportados indicam que esse peptídeo poderá ser utilizado como uma ferramenta biotecnológica no controle de bactérias patogênicas humanas.
ABSTRACT
The marine ecosystem consists in an enormous diversity source of biomolecules that could be used for the treatment of numerous diseases. Among animals belonging to this ecosystem, the coral reefs seems to be extremely important for marine environment since they are the first link in the food chain, which involves different species of mollusks, crustaceans, fishes and other organisms of enormous biological importance. In this highly competitive environment, organisms require chemical barriers to reduce or avoid microrganisms contamination. Among the molecules that are capable of protect these animals the antimicrobial peptides (AMPs) are included. Several studies have reported the discovery of such compounds in different organism like sponges, quelicerates, tunicates, crustaceans and others. In present research, the corals specimens Palythoa caribaeorum, Carijoa riisei, Neospongodes atlantica, Muriceopsis sulphurea, Plexaurella grandiflora,
Phyllogorgia dilatata were challenged against multiple Gram-positive and negative bacteria.
Bioassays showed that Muriceopsis sulphurea and Phyllogorgia dilatata caused growth
inhibitory effects toward the majority of bacteria at a standard concentration of 200 µg.mL-1.
Phyllogorgia dilatata crude extract was ammonium sulfate (0-40%) fractionated showing
higher activity against Escherichia coli and Staphylococcus aureus (30% and 80%
respectively). Rich-fraction was further purified by using Amicon® Ultra Centrifugal 10.000
MWCO associated to reversed-phase HPLC chromatography (C18) allowing the obtation of the rich fraction Pd1. Pd1 was able to decrease Staphylococcus aureus, Escherichia coli and Klebsiella pneumoniae development in 100%, 76% e 50%, respectively. Mass spectrometry
analyses showed a major peak of 5.372 Da concerning the peptide Pd-AMP1. N-termini
peptide Pd-AMP1 sequence showed 88% identity with an OsmC-like peroxidase from Chromohalobacter salexigens consisting of a marine halophilic bacterium able to grow in
hypersaline environments. Data here reported indicated that this peptide could be utilized as biotechnological tool on the control of human pathogenic bacteria.
LISTA DE ILUSTRAÇÕES
Figura 1. Representação dos mecanismos de resistência contra peptídeos
antimicrobianos desenvolvidos por bactérias Gram-negativas...28
Figura 2. Surgimento da resistência aos fármacos antimicrobianos em alguns patógenos de humanos...29
Figura 3. Classificação de peptídeos antimicrobianos...32
Figura 4. Modos de interação dos PAMs com as membranas celulares...34
Figura 5. Mecanismo de ação de peptídeos- Modelo Shai-Matsuaki-Huang...37
Figura 6. Vista aérea dos recifes de corais de Tamandaré, APA Costa dos Corais...40
Figura 7. Porcentagem de inibição da fração Pd1 contra as bactérias selecionadas...75
Figura 8. Cromatograma de HPLC fase reversa (Vydac C18) de Pd1...77
Figura 9. Porcentagem de inibição das frações purificadas de Pd1 contra as bactérias E. coli e M. luteus...78
Figura 10. Porcentagem de inibição das frações purificadas de Pd1 contra a bactéria S. aureus...79
Figura 11. Cromatograma de HPLC fase reversa (Vydac C18) de F6 gerando as frações F6.1 a F6.10...80
Figura 12. Cromatograma de HPLC fase reversa (Vydac C18) de F6 gerando as frações F7.1 a F7.6...80
Figura 13. Cromatograma de HPLC fase reversa (Vydac C18) de F6 gerando as frações F6.1 a F6.10 e cromatogramas MALDI-TOF...82
LISTA DE TABELAS
Tabela 1. Gêneros de micro-organismos bacterianos representativos
da microbiota normal de humanos ...17 Tabela 2. Número de infecções relacionadas à assistência a saúde em unidades de terapia intensiva nos Estados Unidos por local e organismo...21 Tabela 3. Alguns peptídeos antimicrobianos isolados de invertebrados terrestres e marinhos e suas respectivas atividades...46 Tabela 4. Dados informativos sobre os nomes e classificação das espécies...60 Tabela 5. Comparação das quantificações protéicas pelos três métodos
utilizados...69 Tabela 6. Porcentagens de inibição e desvio padrão dos bioensaios
realizados com espécies bacterianas e extratos brutos de animais marinhos...71 Tabela 7. Porcentagens de inibição e desvio padrão dos bioensaios
realizados com as frações de P. dilatata e M. sulphurea...74 Tabela 8. Resultados do Cálculo de CIM para fungos patogênicos humanos
da amostra de Pd1...76 Tabela 9. Número de acesso no NCBI, nome da proteína, nome científico
da espécie, proteínas que relataram similaridade com o peptídeo Pd-AMP1
LISTA DE ABREVIATURAS E SIGLAS
AIDS:Acquired immunodeficiency syndrome ou Síndrome da imunodeficiência adquirida
α: Alfa
AMPs: Antimicrobial peptides
ATCC: American Type Culture Collection AZT: Azidothymidine ou Azidotimidina BA: Estado da Bahia
β: Beta
Blastp: Basic local alignment search tool protein BSA: Albumina do soro bovino
CIM: Concentração mínima inibitória
CLSI: Clinical and Laboratory Standards Institute Cys: Cysteine ou Cisteína
Da: Daltons
DNA: Deoxyribonucleic acid ou Ácido desoxirribonucléico DF: Distrito Federal
EUA: Estados Unidos da América EB: Extrato bruto
ELISA: Enzyme linked immuno sorbent assay
FCTH: Fragmento C-Terminal da Hemocianina ou C-ter ºC: Graus Celsius
h: Hora
HIV: Human immunodeficiency virus ou Vírus da imunodeficiência humana HPLC: High performace liquid cromatography ou Cromatografia líquida de alta performace
IrAS: Infecções relacionadas à assistência a saúde ou Healthcare-associated infection
kDa: KiloDalton
LAO: L- amino oxidase L: Litro
LB: Luria Bertani
LPS: Lipopolissacarídeo
MALDI-TOF: Matrix-assisted laser desorption/ionization ou Ionização e Dessorção a Laser Assistida por Matriz
Me: Membrana externa Mi: Membrana interna MeOH: Metanol
MRSA: Methicillin-resistant Staphylococcus aureus ou Staphylococcus aureus resistente à meticilina
m: Metro
µg: Micrograma µL: Microlitro µM: Micromolar µm: Micrômetro mg: Miligrama mL: Mililitro mm: Milimetro
mAU: Milli absorbance Min: Minuto
M: Molar
MWCO: Molecular weight cut-off OsmC: Osmotically inducible protein C N2: Nitrogênio
NaCl: Cloreto de sódio Nm: Nanômetro
OD: Optical density ou Densidade ótica PAM:Peptídeos antimicrobianos
Pd1: Fração 0-40% purificada em amicon de Phyllogorgia dilatata ≥10 kDa
Pd2: Fração 0-40% purificada em amicon de Phyllogorgia dilatata ≤10 kDa
Pd-AMP1: Fração 6.6 purificada em coluna C18 por cromatografia de fase reversa pH: Potencial hidrogeniônico
RJ: Estado do Rio de Janeiro
RNA: Ribonucleic acid ou Ácido ribonucléico Rpm: Rotação por minuto
RPMI: Roswell Park Memorial Institute medium S: South
SCN: Staphylococcus coagulase negativa SP: Estado de São Paulo
TFA: Ácido trifluoroacético
TR: Enzima transcriptase-reversa
UFRJ: Universidade Federal do Rio de Janeiro UTI: Unidade de terapia intensiva
UCB: Universidade Católica de Brasília UFC: Universidade Federal do Ceará UFG: Universidade Federal do Goiás UV: Radiação ultravioleta
SUMÁRIO
Dedicatória Agradecimentos Epígrafe
Resumo Abstract
Lista de Ilustrações Lista de Tabelas
Lista de Abreviaturas e siglas
1. Introdução...17
1.1. Bactérias patogênicas causadores de infecção hospitalar...17
1.2. Fungos patogênicos causadores de infecção hospitalar...25
1.3. Resistência antimicrobiana...26
1.4. Peptídeos antimicrobianos...30
1.5. Animais marinhos como fonte de biomoléculas...39
2. Justificativa...51
3. Hipótese...53
4. Objetivo Geral...55
4.1. Objetivos Específicos...55
5. Materiais e Métodos...57
5.1. Coleta dos Materiais Biológicos...59
5.2. Preparação das Amostras...62
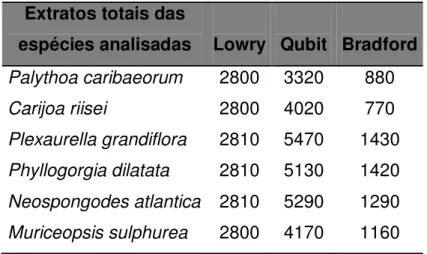
5.3. Determinação da concentração protéica...62
5.4. Bioensaios contra bactérias...64
5.5. Cálculo de Concentração inibitória mínima da fração Pd1 contra fungos patogênicos humanos...65
5.6. Cromatografia de fase reversa...66
5.7. Análise de massa molecular MALDI-TOF...66
5.8. Sequenciamento do N-terminal de Pd-AMP1 por Degradação de Edman...67
6. Resultados: Prospecção...69
6.2. Avaliação funcional dos extratos brutos (Bioensaios 1)...70
6. Resultados: Purificação...73
6.3. Avaliação funcional dos extratos fracionados das espécies P. dilatata e M. sulphurea (Bioensaios 2)...73
6.4. Avaliação funcional da fração rica Pd1 (Bioensaios 3)...75
6.5. Cálculo de CIM para fungos patogênicos humanos...76
6.6. Purificação da fração Pd1 por cromatografia de fase reversa...77
6.7. Avaliação funcional das frações purificadas de Pd1 (Bioensaios 4)....78
6.8. Recromatografia por HPLC das frações 6 e 7...79
6.9. Análise de massa molecular por espectrometria de massa...81
6.10. Sequenciamento do N-terminal por Degradação de Edman e comparação de sequencias...83
7. Discussão...87
8. Conclusões...100
9. Perspectivas...102
10. Referências bibliográficas...104
1. INTRODUÇÃO
1.1. BACTÉRIAS PATOGÊNICAS CAUSADORAS DE INFECÇÃO HOSPITALAR
Os organismos multicelulares de uma maneira geral, vivem em forte cooperação com os micro-organismos ao redor e também com os seres humanos. O corpo humano, por exemplo, pode ser ocupado por um grande número de bactérias, fungos, archaea, vírus e eucariontes unicelulares (Sekirov et al., 2010). A flora bacteriana normalmente encontrada nos seres humanos pode ser extremamente complexa sendo composta por mais de 200 espécies bacterianas. Calcula-se que o ser humano normal possua aproximadamente 1012 bactérias sobre a pele, 1010 na boca e 1014 no trato gastrointestinal (Todar, 2008; 2008-2012; Sekirov et al., 2010). A Tabela 1 exibe alguns dos principais gêneros de micro-organismos normalmente encontrados em associação com as superfícies corporais. As superfícies mucosas, por exemplo, proporcionam a presença de uma microbiota distinta pelo fato de oferecerem um ambiente protegido e úmido, bem como uma grande área superficial total.
Tabela 1. Gêneros de micro-organismos bacterianos representativos da microbiota normal de humanos.
Sítio anatômico Gêneros ou grupos principais
Pele Enterobacter, Klebsiella, Proteus, Pseudomonas, Staphylococcus, Streptococcus
Boca Streptococcus
Trato respiratório Streptococcus, Staphylococcus Trato gastrintestinal Streptococcus, Escherichia, Klebsiella,
Proteus, Staphylococcus, Enterococcus
Trato urogenital Streptococcus, Escherichia, Klebsiella, Proteus, Staphylococcus
Dentre os benefícios desses micro-organismos para o ser humano destacam-se o impedimento da colonização por patógenos competindo por locais de fixação ou por nutrientes essenciais. Adicionalmente, o estímulo do desenvolvimento de determinados tecidos, onde se destacam alguns tecidos linfáticos no trato gastrointestinal e o órgão vestigial ceco. Por fim, o estímulo da produção de anticorpos com reatividade cruzada, ou seja, habilidade de um sítio de combinação de anticorpo em particular de reagir com mais de um determinante antigênico ou a habilidade de uma população de moléculas de anticorpos de reagir com mais de um antígeno (Mayer, 2009).
Por outro lado para muitas bactérias, o corpo humano pode não ser o local ideal para que elas possam se estabelecer, pois algumas necessitam de oxigênio e no interior das células a concentração desse elemento é inferior a do ar. Ainda, existe um grupo de bactérias anaeróbicas obrigatórias que não suportam a presença de oxigênio (Mandigan et al., 2010). Além destes fatores, o nosso organismo possui mecanismos de defesa contra micro-organismos tais como, a presença de sal em nossa pele e a falta de ferro que pode ser inacessível para a maioria dos micro-organismos em nosso corpo consistindo em um elemento essencial uma vez que atua como co-fator para muitas proteínas como a hemoglobina (Wassenaar, 2012). Os micro-organismos encontrados em humanos, em muitos casos não apresentam malefícios sendo muitas vezes necessários na manutenção da saúde e bem estar. Contudo, outros micro-organismos, conhecidos como patógenos são responsáveis por colonizar, invadir e causar danos ao corpo humano por meio de mecanismos diretos e indiretos dando início a processos de doenças infecciosas (Mandigan et al., 2010).
infecções ocorrem mundialmente e comprometem tanto países desenvolvidos quanto aqueles em desenvolvimento (Padoveze et al., 2010).
Essas infecções derivam da interação de vários fatores como a presença de micro-organismos no ambiente hospitalar, a presença de hospedeiros comprometidos (ou enfraquecidos) e a cadeia de transmissão existente no hospital. A presença de um dos fatores isolados aparentemente não é suficiente para que a infecção ocorra, porém a interação dos três fatores representa um risco expressivo de casos de infecções (Tortora et al., 2012).
Ainda que muitos esforços sejam realizados para eliminar ou impedir o crescimento de micro-organismos em hospitais, vale destacar que o ambiente hospitalar é um reservatório importante de uma variedade de patógenos. Alguns micro-organismos da microbiota normal do corpo humano são oportunistas e representam um risco elevado para pacientes internados. De fato, a maioria desses agentes que causam infecções não gera doença em pessoas saudáveis, contudo pode ser patogênica apenas para indivíduos que apresentam defesas comprometidas por doenças ou por terapia (Tortora et al., 2012).
Estas infecções ocorrem de maneira generalizada e têm sido referidas na literatura repetidamente. No ano de 2011, dados hospitalares da cidade de Curitiba indicaram que somente no primeiro semestre ocorreram mais da metade dos casos de infecções relacionadas à assistência a saúde no que se refere ao ano de 2010 em um total de 3% dessas infecções. Nestes dois anos, menos de 1% eram causadas por bactérias multirresistentes (Toledo et al., 2012). A probabilidade de complicações graves nestes casos devido a estas infecções é alta uma vez que, os pacientes encontram-se enfermos. Com relação ao controle de infecção relacionada à assistência a saúde nas UTIs, os esforços têm sido concentrados tipicamente em infecções associadas a dispositivos e a procedimentos invasivos (Pita et al., 2012).
obtidos mais de 48 h após a internação exibiu menor tempo para readmissão hospitalar. Tal fato é recente na investigação da relação entre a presença clínica de uma cultura positiva obtida mais de 48 h após a admissão hospitalar e o tempo para reinternação entre os pacientes admitidos (Emerson et al., 2012).
Os micro-organismos envolvidos em IrAS são comumente encontrados na flora microbiana normal de indivíduos sadios. Entretanto, com alguma frequencia, esses micro-organismos, tornam-se patogênicos quando se multiplicam em locais normalmente estéreis, como o trato respiratório inferior ou o sangue (Lipsitch et al., 2000). Apesar de toda exposição, o trato respiratório inferior, por exemplo, permanece estéril devido a uma abundância de mecanismos que protegem as vias aéreas da aderência bacteriana e dos fatores de virulência como, por exemplo, a presença de células ciliadas das superfícies mucosas ou pêlos (cílios) que dificultam a fixação de micro-organismos (Metersky, 2005; Mandigan et al., 2010).
Tabela 2. Número de IrAS em unidades de terapia intensiva nos Estudos Unidos por local de ocorrência e organismo. (ND): Não detectado; (*) Número total de IrAS foi de 92.454 detectadas em unidades de terapia intensiva em um período de oito anos.
Patógeno Corrente
sanguínea Pulmão Trato urinário
Enterobacter spp. 1.083 4.444 1.560
Escherichia coli 514 1.725 5.393
Klebsiella pneumoniae 735 2.865 1.891
Haemophilus influenzae ND 1.738 ND
Pseudomonas aeruginosa 841 6.752 3.365
Staphylococcus aureus 2.758 7.205 497
Staphylococcus spp. 8.181 ND 838
Enterococcus spp. 2.967 682 4.226
Candida albicans 1.090 1.862 4.856
Outros patógenos 3.774 12.537 8.075
Número total* 21.943 39.810 30.701
Total (%) 23,7 43,1 33,2
Fonte: Registro do Sistema Nacional de Vigilância de Infecções Relacionadas à Assistência a Saúde, Centro de Controle e Prevenção de Doenças, Atlanta, Georgia, EUA. Adaptada de Mandigan (2010).
Estes dados foram confirmados por Rossi, em 2008, que em seu estudo relata que a infecção do trato urinário é responsável por aproximadamente 35% a 45% de todas as infecções contraídas em hospitais. O uso de cateteres vesicais em pacientes internados na UTI pode ser elevado e pode estar ligado à incidência intensificada de infecções do trato urinário (Rossi, 2008).
A pesquisa desenvolvida por O’Neill e colaboradores (2010) mostrou que em hospitais irlandeses 7,18% tiveram uma IrAS de um total de 529 pacientes. As IrAS mais comuns foram infecções do trato respiratório (2,65%) e infecções de sítio cirúrgico (1,7%) (O'neill et al., 2010).
Diversos países como a Escócia têm implementado programas destinados a reduzir as IrAS a partir de medidas destinadas a diminuir essas infecções em UTIs escocesas (Cairns et al., 2010).
O trabalho desses pioneiros em técnicas assépticas reduziu a taxa de ocorrência de infecções. Todavia, ainda que sejam realizadas técnicas de esterelização e uso de materiais descartáveis, as taxas de infecções aumentaram aproximadamente 36% nos últimos 20 anos. Nos EUA, 2 milhões de pessoas adquirem infecções todos os anos e aproximadamente 20.000 pessoas morrem em decorrência delas o que representa a oitava causa de morte nesse país (Tortora et al., 2012).
No Brasil, os casos de ocorrência de micro-organismos isolados de pacientes com infecções consistem naqueles envolvidos em infecções hospitalares confirmados por trabalhos realizados em hospitais públicos. Os pacientes que apresentam uma infecção ou uma colonização servem como reservatórios para esses micro-organismos. Os fatores de risco para colonização incluem idade, gravidade da doença e uso de antibióticos (Johnston e Bryce, 2009).
Alguns gêneros bacterianos têm sido relatados como importantes causadores de infecções relacionadas à assistência a saúde. A principal causa para explicar o fato das bactérias serem os principais patógenos relacionados às IrAS refere-se à rapidez de crescimento destes patógenos que dependendo das características específicas de cada espécie pode produzir 5 x 108 bactérias/indivíduo em apenas 50 min (Hancock e Diamond, 2000; Mandigan et al., 2010).
Diversos estudos têm demonstrado que 60 a 70% das bactérias isoladas em laboratórios clínicos, localizados em hospitais, são representadas por bactérias pertencentes à família Enterobacteriaceae. Nesta família, estão agrupados os gêneros membros da flora intestinal comensal de humanos e de muitos animais tais como Escherichia, Klebsiella, Shigella, Salmonella, Proteus, Enterobacter, Serratia, dentre outros. Essas bactérias também estão associadas a um grande número de infecções da comunidade presente nos hospitais. Algumas se destacam, devido ao fato de pertencerem a microbiota normal humana sendo que parte das espécies de
Enterococcus, Escherichia coli e Klebsiella pneumoniae normalmente podem ser
encontradas somente no corpo humano (Mcfall-Ngai et al., 2005; Mandigan et al., 2010; Adams e Moss, 1997).
anaerobiamente. Ainda é comensal e parasita comum de humanos e animais, com metabolismo respiratório peculiar e frequentemente encontrado em indivíduos não debilitados podendo causar infecção em vários órgãos (Trabulsi et al., 1999; Barretto, 2000; Mandigan et al., 2010; Adams e Moss, 1997). Os seres humanos podem ser um reservatório natural para esta espécie sendo associado a condições patológicas que incluem furúnculos, acne, osteomielite, meninge, artrite e a colonização assintomática que é muito mais comum do que a infecção (Chambers, 2001; Mandigan et al., 2010). Esse micro-organismo também pode ser a causa mais comum de pneumonias, a terceira causa mais frequente de infecções sanguíneas (Mandigan et al., 2010). Ainda consiste em um dos patógenos mais frequentes encontrados nos humanos ocasionando grave morbidade, às vezes com risco de vida e várias doenças relacionadas aos órgãos (Peschel e Collins, 2001). Nesse contexto, esse micro-organismo também pode estar associado à intoxicação alimentar causada por uma das sete toxinas produzidas por essa bactéria (Mandigan et al., 2010). Este micro-organismo pode tornar-se um agente patogênico causando um amplo espectro de infecções devido a um variado conjunto de fatores de virulência (Pantosti e Venditti, 2009).
Em relação às IrAS, a bactéria S. aureus tornou-se importante causa de infecção hospitalar no início da década de 70, quando começaram a ser descritas as primeiras incidências dessa bactéria. No Brasil, a cepa desse patógeno resistente ao antibiótico oxacilina é responsável por 26 a 71% das cepas isoladas em diversos hospitais do país. Acredita-se que esta elevada incidência decorre da grande utilização de antibióticos e a falta de implementação de medidas específicas de controle destas cepas (Moreira et al., 1998; Podschun e Ullmann, 1998).
A bactéria K. pneumoniae apresenta grande importância como patógeno nosocomial, sendo responsavél pela maioria das infecções principalmente pneumonias que estão associadas com a internação hospitalar. Essa espécie pode ser encontrada no solo e na água e a maioria das linhagens é capaz de fixar N2, uma característica não observada em outras bactérias entéricas (Podschun e Ullmann, 1998; Mandigan et al., 2010).
Os carbapenêmicos têm sido considerados a opção terapêutica preferencial para o tratamento de infecções graves de saúde relacionadas à multirresistência de bactérias Gram-negativas, grupo ao qual pertence este gênero bacteriano (Monteiro et al., 2009). As cepas de K. pneumoniae produtora de carbapenemase (KPC) foram relatadas inicialmente nos EUA e posteriormente em todo o mundo. As cepas de K.
pneumoniae conhecidas como KPC estão envolvidas principalmente em infecções
sistêmicas e nosocomiais. O aparecimento de enterobactérias resistentes à carbapenemase consiste em um fato extremamente preocupante, uma vez que, as opções de tratamento antimicrobiano são muito restritas. Essa resistência pode envolver vários mecanismos combinados tais como: modificações na permeabilidade da membrana externa e aumento da regulação dos sistemas de efluxo na qual as bactérias Gram-negativas apresentam uma membrana interior composta por fosfolípideos e a membrana externa formada por lipídios A, responsável pelo início da resposta do hospedeiro à infecção (Nordmann et al., 2009; Giedraitiene et al., 2011).
Outra bactéria do presente estudo consiste na E. coli que representa um modelo clássico de uma bactéria entérica, não patogênica e que tem significativa importância médica. Esta tem sido a causa mais comum de infecções do trato urinário em hospitais como já mostrado nas Tabelas 1 e 2. Diversas linhagens patogênicas aproximadamente 200 linhagens são caracterizadas por sua habilidade em produzir fortes enterotoxinas (Mandigan et al., 2010).
1.2. FUNGOS PATOGÊNICOS CAUSADORES DE INFECÇÃO HOSPITALAR
Os fungos são um grupo diversificado de organismos, com cerca de 250.000 espécies vastamente disseminadas em praticamente todos os ecossistemas. Desse total, menos de 1% são patogênicas para os mamíferos. Desde os anos 1960, quando surgiram as terapias de antibióticos notou-se um aumento das infecções fúngicas e que nos dias de hoje representam uma ameaça à saúde humana. Especialmente nas últimas duas décadas, a incidência de infecções fúngicas no ser humano tem se acentuado, especialmente nos pacientes imunocomprometidos relaciondos com a AIDS, câncer, idade avançada, diabetes, fibrose cística, transplantes de órgãos e outros procedimentos cirúrgicos invasivos (Selitrennikoff, 2001; Vandeputte et al., 2012).
Um dos gêneros de interesse médico e que pode estar frequentemente ligado às infecções em pacientes imunodeprimidos é o gênero Fusarium que causa um amplo espectro de doenças humanas, das quais se destacam as micotoxicoses e infecções que podem ser localmente invasivas ou disseminadas. Este gênero foi responsável por colonizar 17% das amostras retiradas da garganta de 27 adultos saudáveis não hospitalizados (Dignani e Anaissie, 2004). Vale ressaltar que as espécies mais frequentemente isoladas a partir de amostras clínicas foram Fusarium moniliforme, Fusarium solani e Fusarium oxysporum.
Nos EUA, cerca de 80% das infecções hospitalares foram causadas por leveduras do gênero Candida. No período de 1989 a 1999 o sistema de vigilância relatou que houve aumentos significativos nas infecções causadas por Candida
albicans e Candida glabrata. Aproximadamente 200 espécies de Candida são
estado do paciente é de grande importância na determinação do potencial patogênico desses micro-organismos fúngicos oportunistas. Entre as características que possivelmente contribuem com o potencial patogênico se encontram a capacidade de adesão a tecidos, a hidrofobicidade de sua superficie celular e a secreção de proteínas (Dignani e Anaissie, 2004; Murray et al., 2006; Maluche e Santos, 2008).
Mundialmente, Candida parapsilosis, Candida tropicalis e C. glabrata apresentam elevada incidência em vários países como causadoras de infecção hospitalar. Estudos realizados no Brasil mostram que as espécies mais prevalentes
são C. albicans, C. parapsilosis, C. tropicalis e C. albicans. Esta última consiste em
uma espécie típica do trato gastrointestinal, genital e cutâneo dos seres humanos sendo muitas vezes transmitida de forma endógena, geralmente em pacientes que tenham recebido quimioterapia prévia (Maluche e Santos, 2008).
O desenvolvimento de fármacos eficientes no combate a essas infecções causadas por fungos e bactérias revolucionou a terapêutica clínica, acarretando na redução drástica da mortalidade ocasionada por doenças microbianas. Além do surgimento de micro-organismos resistentes, a utilização de antibióticos de forma descontrolada tem efeitos prejudiciais como os custos elevados da droga e efeitos adversos sobre no tratamento do paciente (O'neill et al., 2010).
1.3. RESISTÊNCIA ANTIMICROBIANA
Na definição de resistência bacteriana consideram-se os aspectos clínicos e laboratoriais do uso de antibióticos. A partir de resultados laboratoriais do teste do antibiótico contra a bactéria, a resistência significa que o micro-organismo tem a capacidade de crescer in vitro na existência da concentração que essa droga chega ao sangue (Barros et al., 2008).
A resistência bacteriana pode ser intrínseca (natural) ou adquirida. A intrínseca corresponde a uma característica da espécie bacteriana, que
micro-organismos do gênero Klebsiella resistente à ampicilina, amoxicilina, carbenicilina e ticarcilina e o S. aureus resistente a todos os β-lactâmicos. A resistência bacteriana adquirida corresponde a uma característica da espécie resultante da alteração do material genético existente ou a aquisição de novo material genético de outra fonte. Ela pode ser revelada em apenas algumas cepas de uma mesma espécie bacteriana resultando da mutação ou desrepressão (na inativação do gene repressor, o gene operador torna-se ativo novamente, fazendo com que se manifeste a resistência não só à droga em uso, mas também a outros antibióticos). Este tipo de resistência já foi descrita em praticamente todas as espécies de bactérias, conhecendo-se detalhes dos mecanismos de aquisição e os mecanismos moleculares da manifestação da resistência (Trabulsi et al., 1999; Tavares, 2000; Barros et al., 2008; Todar, 2008).
Ainda que a resistência adquirida para PAMs seja menos provável de acontecer em comparação com as terapias antimicrobianas tradicionais, a resistência contra os peptídeos é dada por meio da evolução de algumas bactérias Gram-negativas que empregam enzimas celulares a fim de alterar bioquimicamente e diminuir a carga líquida negativa de suas membranas celulares (Peters et al., 2010). Outro tipo de resistência consiste na degradação dos peptídeos por atividade proteolítica, que pode ser exemplificado pela ação da bactéria Proteus mirabilis contra o peptídeo antimicrobiano humano LL-37, da família das catelicidinas (Schmidtchen et al., 2002) (Figura 1A). A resistência pode ser dada também pela
eficazes contra a bactéria (Aires e Nikaido, 2005) (Figura 1D). Outras bactérias apresentam supressão da expressão de peptídeos antimicrobianos (Figura 1E) observadas nas exotoxinas de Vibrio cholerae que causaram a supressão da expressão de LL-37 pela célula hospedeira (Chakraborty et al., 2008).
Figura 1. Representação dos mecanismos de resistência contra peptídeos antimicrobianos (PAMs) desenvolvidos por bactérias Gram-negativas. (A) Degradação dos peptídeos por enzimas proteolíticas localizadas na membrana externa (ME). (B) “Escudos” formados por cápsulas de polissacarídeo. (C) Modificações na ME que impedem ou inibem o contato do peptídeo com a membrana interna (MI). (D) Bombas que enviam os peptídeos para dentro ou para fora da bactéria. (E) Supressão da expressão gênica de peptídeos antimicrobianos pela célula hospedeira.
Fonte: Modificada de (Gruenheid e Le Moual, 2012).
determinante genético capaz de expressar resistência ao antibiótico (Paterson, 2006).
A lista de bactérias e fungos que desenvolveram resistência a antibióticos é extensa e relativamente preocupante, satisfazendo mais de 70% das bactérias que causam infecção (Barrett, 2005). Muitos patógenos bacterianos e fúngicos desenvolveram resistência a todos os antimicrobianos conhecidos e desde meados de 1960 cepas resistentes são observadas (S. aureus) e outras mais recentes em 1990 como o fungo Candida albicans. Estas resistências e outras iniciadas ao longo de 60 anos atrás podem ser observadas na Figura 2.
Figura 2. Surgimento da resistência aos fármacos antimicrobianos em alguns patógenos de humanos. Asteriscos indicam que algumas linhagens destes patógenos atualmente não podem ser tratadas com os fármacos antimicrobianos. Legenda: (Verde) Fungos. (Vermelho) Gram-negativo. (Roxo) Gram-positivo. (Azul) Gram positivo/ ácido resistente.
Candida albicans*
Acinetobacer sp
Enterococcus faecium* Streptococcus pneumoniae
Mycobacterium tuberculosis*
Haemophilus ducreyi
Salmonella typhi
Haemophilus influenzae
Neisseria gonorrhoeae
Pseudomonas aeruginosa*
Salmonella sp Shigella dysenteriae
Shigella sp
Outros bacilos Gram negativos
Staphylococcus aureus*
Fonte: Mandigan et. al (2010).
Em muitos casos, estas bactérias e fungos podem desenvolver resistência simultânea de duas ou mais classes de antibióticos o que faz com que o tratamento de infecções causadas por estes micro-organismos se torne extremamente difícil (Alanis, 2005).
As grandes preocupações na utilização de antibióticos para o tratamento de infecções consistem no alto custo de produção do fármaco para ser utilizado por pouco tempo e algumas vezes por poucas pessoas; o mercado onde estes fármacos tem tendência a ser de baixo custo; e o desenvolvimento de resistência que pode ocorrer também com peptídeos antimicrobianos que servem como alternativa ao uso desses medicamentos (Akhtar et al., 2012).
Diante dessa problemática da indústria farmacêutica e como a prevalência de bactérias resistentes aos antibióticos continua a crescer, tornou-se inevitável a busca para o desenvolvimento de novas alternativas e/ou de antibióticos melhores e com baixa toxicidade. Espera-se que tais moléculas sejam capazes de eliminar um micro-organismo vagamente relacionado aos seres humanos que tem desenvolvido grande resistência aos antibióticos convencionais abrandando assim a situação que se estende sobre os sistemas de saúde em todo o mundo (Li et al., 2008; Fischbach e Walsh, 2009; Hadley e Hancock, 2010).
1.4. PEPTÍDEOS ANTIMICROBIANOS
O aparecimento de cepas bacterianas Gram-positivas e Gram-negativas multirresistentes conhecidas como “super bugs” ou superbactérias induziu a necessidade imediata para o desenvolvimento de novas classes de agentes antimicrobianos como, por exemplo, os peptídeos antimicrobianos (Gwynn et al., 2010; Nguyen et al., 2011). Estas moléculas vêm demonstrando a possibilidade de utilização como importantes ferramentas moleculares no uso como antimicrobianos. Exaustivas pesquisas nas últimas décadas, em relação a sua biossíntese, atividade contra microrganismos, mecanismo de ação e potencial aplicação clínica tem sido realizados (Lofgren et al., 2008; Nguyen et al., 2011).
micro-organismo invasor (Bartlett et al., 2002; Huang et al., 2010). A maioria destas moléculas possui cargas líquidas positivas de 2-9, devido à ausência ou pequeno número de resíduos ácidos (glutamato ou aspartato), excesso de resíduos catiônicos (arginina ou lisina e/ou histidina), cerca de 30-50% de resíduos hidrofóbicos e uma baixa frequencia de resíduos de prolina ou glicina (Hancock et al., 2006; Huang et al., 2010).
Apesar das variações na estrutura tridimensional, massa, tamanho e características biológicas, a maioria dos peptídeos antimicrobianos pode ser anfifílica, apresentando superfícies hidrofílicas e hidrofóbicas (Tincu e Taylor, 2004; Brogden e Brogden, 2011). As características anfifílica e catiônica são importantes para sua capacidade antimicrobiana de se ligar a superfícies microbianas aniônicas, tais como, lipopolissacarídeos (LPS) (Wang et al., 2010). Duas características físicas para PAMs são comuns: uma carga catiônica e uma proporção significativa de resíduos hidrofóbicos. A cationicidade dos PAMs requer interações com porções carregadas negativamente sobre outras biomoléculas tais como lipídeos da membrana externa, ácidos nucléicos e proteínas fosforiladas (Nguyen et al., 2011).
sendo quatro resíduos de arginina, dois resíduos de cisteína e seis de outros resíduos hidrofóbicos. Os dois resíduos de cisteína são responsáveis pela ligação dissulfeto formando uma estrutura em loop (Subbalakshmi e Sitaram, 1998; Friedrich et al., 1999; Oren et al., 1999; Wu e Hancock, 1999; Tavares, 2000; Staubitz et al., 2001; Brogden, 2005; Lai e Gallo, 2009; Nguyen et al., 2011).
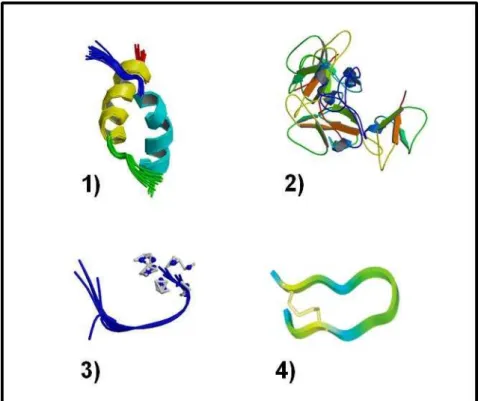
Figura 3. Classificação dos PAMs sugerida por Lai & Gallo (2009) qual é baseada na composição de seus resíduos de aminoácidos, tamanho e estruturas conformacionais. (1) Magainina, peptídeo com estrutura α-hélice; (2) β-Defensina humana, peptídeo com estrutura folha-β estabilizada por pontes dissulfeto; (3) Indolicidina, peptídeo de estrutura estendida; (4) Bactenecina, peptídeo com pontes dissulfeto formando estruturas em loop.
Fonte: Hancock (2001).
Durante o dobramento do peptídeo, sugere-se que PAMs sigam uma orientação paralela à membrana. Para isso, vários mecanismos de ação têm sido propostos para explicar essa permeabilização das membranas lipídicas e membrana alvo de antimicrobianos (Jenssen et al., 2006; Lopez et al., 2006; Bocchinfuso et al., 2009; Huang et al., 2010).
micro-organismos. Esta capacidade de interagir com as membranas lipídicas está relacionada com diversas características dessas moléculas como as propriedades bioquímicas definidas pela sequencia de aminoácidos (carga, estrutura anfipática e hidrofobicidade) e conformação tridimensional (geometria, ângulo polar e conformação molecular). Em todos os modelos clássicos de interação dos PAMs com membranas celulares, aparentemente, pode ser necessária uma atração do peptídeo pela superfície da membrana microbiana por força eletrostática ou devido à presença de cargas residuais presentes na superfície do micro-organismo. Após essa atração, o peptídeo se insere na cápsula polissacarídica e finalmente alcança a membrana citoplasmática. A partir desta interação com os lipídios da bicamada, o peptídeo altera a organização e a permeabilidade da membrana fosfolipídica causando a despolarização e desequilíbrio osmótico celular por meio da sua interação (Brogden, 2005).
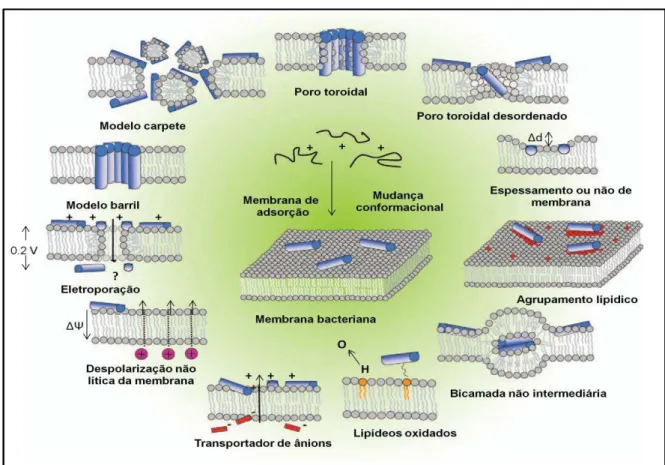
Figura 4. Modos de interação dos PAMs com as membranas celulares.
Fonte: Adaptado de Nguyen et al. (2011).
O modelo barril (Figura 4) também conhecido como “barrel-stave” descreve a topologia global do canal da membrana formado no mecanismo de permeabilização da membrana. Este modelo foi inicialmente descrito para alameticina, um peptídeo do fungo Trichoderma viride descoberto no final dos anos 60 e comercialmente disponível nos anos 1970 (Elgar et al., 2006; Huang, 2006). Nesse modelo, o peptídeo forma um feixe de membrana com o lúmen central, muito parecido com um barril composto por peptídeos. As regiões do peptídeo hidrofóbico alinham com a região do núcleo lipídico da bicamada e regiões peptídicas hidrofílicas formam a região do interior dos poros (Brogden, 2005). A formação de poros ou de canais é um processo dinâmico que segue com a transição de fase conformacional na qual as regiões hidrofóbicas de peptídeos incorporam-se na membrana devido à interação com componentes hidrofóbicos complementares de membrana (Huang et
al., 2010). Neste mecanismo, as superfícies hidrofóbicas de α-hélice ou folha-β
As α-hélices anfipáticas inserem o núcleo hidrofóbico da transmembrana e formam poros (Shai, 1999).
O modelo de poros toroidal ou “toroidal model” (Figura 4) foi proposto pela primeira vez para o peptídeo magainina encontrado na pele de rã da espécie Xenopus laevis (Elgar et al., 2006). Outros peptídeos na qual esse modelo pode ser aplicado são protegrina, LL-37 e MSI-78 (Brogden, 2005). A proposta desse modelo foi construída com base em evidências indiretas, incluindo o tamanho e a densidade dos poros, orientação do peptídeo, dentre outros (Huang, 2000). Este modelo descreve uma das melhores interações observadas e caracterizadas de peptídeo-membrana onde as hélices de peptídeos antimicrobianos são inseridas dentro da membrana e induzem as monocamadas lipídicas a dobrar continuamente por meio dos poros de modo que o núcleo de água seja alinhado pela inserção do peptídeo e grupos lipídicos. Esses poros têm uma curvatura positiva na direção da membrana normal. Nesse modelo os peptídeos são reorientados com a membrana lípidica e na formação de um poro toroidal, as regiões polares dos peptídeos são associadas com a cabeça polar de grupos lipídicos (Matsuzaki, 1999; Yeaman e Yount, 2003; Brogden, 2005; Huang et al., 2010).
formador de poros, altera as suas posições relativas para a membrana da bicamada (Huang et al., 2010).
O modelo formação de carpete ou “carpet model” foi proposto pela primeira vez para descrever o modo de ação da dermaseptina S (Shai, 1999), um peptídeo antimicrobiano isolado a partir de secreções da pele de sapo do gênero
Phyllomedusa (Elgar et al., 2006). Outros peptídeos que apresentam esse tipo de
modo de ação são cecropina, caerina e ovispirina. Este modelo explica a atividade antimicrobiana de peptídeos que orientam paralelamente ("in-plane") na superfície da membrana (Figura 4). Segundo (Huang et al., 2010) a orientação do peptídeo desestabiliza o “pacote” de fosfolípidos gerando uma alteração na fluidez da membrana no que diz respeito à deslocação de fosfolipídios por peptídeos. Dessa forma, a estabilidade da membrana local é instável. Peptídeos são atraídos eletrostaticamente para o fosfolipídeo aniônico em inúmeros locais que cobrem a superfície da membrana como forma de carpete.
Ao contrário do modelo barril, os peptídeos não são inseridos no núcleo da membrana hidrofóbica, nem se reúnem com suas superfícies hidrofílicas voltadas uma para a outra (Shai, 1999). Neste modelo, os peptídeos estão em contato com o grupo de fosfolipídeos em todo o processo de permeação da membrana. A permeabilidade da membrana ocorre quando a sua superfície inteira é coberta com monômeros do peptídeo ou quando alternativamente, existe uma associação entre os peptídeos ligados à membrana, formando um carpete (Elgar et al., 2006). Neste modelo os peptídeos não precisam, necessariamente, adotar a estrutura α-hélice, pois estão em contato com a cabeça de grupo de lipídios durante todo o processo de permeação da membrana e não se inserem no núcleo hidrofóbico da membrana (Shai, 1999). Em altas concentrações, a superfície orientada de peptídeos é disposta a fim de interromper a bicamada como um detergente, eventualmente levando à formação de micelas (Brogden, 2005).
reduz a atividade da maioria dos peptídeos antimicrobianos pelo enfraquecimento das interações de carga eletrostática necessária para a interação inicial (Zasloff, 2002).
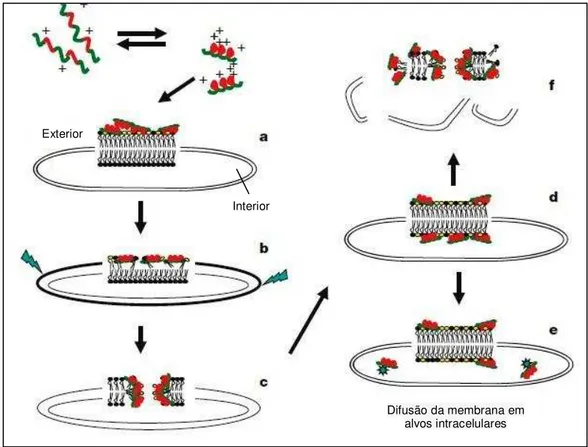
Figura 5. Mecanismo de ação de peptídeos-Modelo Shai-Matsuaki-Huang. Um peptídeo em α-hélice é representado em equilíbrio. As partes catiônicas estão em vermelho e as regiões hidrofóbicas em verde. (A) Interação superficial do peptídeo com a superfície externa da membrana; (B) Adsorção do peptídeo na membrana. As setas verdes indicam uma expansão da face externa em relação à interna, resultado da tensão dentro da bicamada; (C) Formação de poros transientes; (D) Transporte de peptídeos da face externa para a face interna da membrana; (E) Difusão de peptídeos com alvos internos (em alguns casos); (F) Colapso e fragmentação da membrana celular. Fosfolipídios com cabeças amarelas são ácidos ou com carga negativa enquanto os neutros estão representados em preto.
Fonte: Adaptada de Zasloff (2002).
Desta maneira, independente do modelo, a maioria dos PAMs aparentemente age diretamente contra micro-organismos por meio de um mecanismo que abrange a ruptura da membrana e a formação de poros, o que permite o efluxo de íons e nutrientes fundamentais. O efluxo é um mecanismo de defesa celular generalizada com consequencias clínicas para tratamentos antimicrobianos. A interação inicial entre os peptídeos e a membrana da célula microbiana permite adentrar na célula
Exterior
Interior
para se unir a moléculas intracelulares, resultando na inibição da biossíntese da parede celular inibição da atividade enzimática, DNA, RNA e síntese de proteínas (Peters et al., 2010; Wood e Cluzel, 2012).
Uma condição necessária para qualquer agente antimicrobiano consiste na presença de toxicidade seletiva para o alvo microbiano, sendo uma característica importante assim como o seu contato com células microbianas não apresenta toxicidade para as células de mamíferos (Peters et al., 2010). Muitos PAMs mostram especificidade notável para procariontes com baixa toxicidade para as células eucarióticas (Zasloff, 1992; Tincu e Taylor, 2004). A toxicidade de PAMs contra células eucarióticas pode ser o principal obstáculo para a sua aplicação clínica (Huang, 2000). Muitos peptídeos atuam em membranas bacterianas ou outros alvos generalizados, contrariando a maioria dos antibióticos que geralmente têm como alvo proteínas específicas (Nguyen et al., 2011).
Com o passar dos anos, foram realizadas diversas pesquisas e novos PAMs foram descobertos e identificados. Dependendo do tamanho e estrutura primária do peptídeo, é possível por meio de técnicas moleculares sintetizá-los em laboratório e utilizá-los como fármacos. Uma das estratégias utilizadas na síntese de PAMs é o desenho in silico baseado em sequencias de PAMs depositados em bancos de dados. Outra forma de obtê-los é retirando-os de uma proteína maior, como foi realizado por Okubo e colaboradores (2012). A proteína BmLAO, uma enzima multifuncional L-amino oxidase (LAO) com ação antibacteriana foi isolada da serpente Bothrops mattogrosensis e possui elevada atividade contra as bactérias Gram-negativas K. pneumoniae e P. mirabilis. Os autores por intermédio de análises
in silico estruturais desta molécula demonstraram que a atividade da enzima era
devido a três peptídeos que eram importantes para a atividade da mesma. Estes, depois de sintetizados continuaram a ser funcionais contra as mesmas bactérias. É importante ressaltar que os peptídeos oriundos da enzima são fortes candidatos a produtos biotecnológicos, devido ao baixo custo e por seu pequeno tamanho podendo ser facilmente sintetizado (Okubo et al., 2012).
evolução de proteínas com novas funções. Com isso, a promiscuidade protéica é uma concorrente atrativa a ser adicionada ao complexo de defesa que é usado por organismos superiores, como as plantas, para combater e/ou controlar patógenos e pragas da lavoura (Franco, 2011; Silva et al., 2011).
Ainda que uma significativa função dos PAMs seja a sua capacidade para matar ou inibir o crescimento de micro-organismos, outros estudos indicam que o papel dos PAMs não é restringido a antibacteriano efetores da resposta imune inata, mas também como peptídeos antivirais (Wang et al., 2010). Alguns PAMs também apresentam uma tendência a serem hemolíticos, e outros podem ainda ter atividade inseticida e para células cancerígenas (Hancock et al., 2006; Lai e Gallo, 2009; Nguyen et al., 2011). Além disto, alguns apresentam atividade imunomodulatória como observada em hepicidina amplamente distribuído nos tecidos e sintetizada no osso do peixe pargo dourado, que desempenha um papel fundamental na imunidade inata contra bactérias patogênicas (Cuesta et al., 2008) apud (Otero-Gonzalez et al., 2010). A atividade imunomodulatória também foi observada em PAMs denominados crustinas extraídas do camarão Litopenaeus vannamei (Shockey et al., 2009) apud (Otero-Gonzalez et al., 2010).
A utilização de imunomoduladores para controle e prevenção de infecções parece ser promissora uma vez que existe um interesse significativo gerado na pesquisa sobre moléculas bioativas de origem marinha designada como agentes imunomoduladores em sistemas alternativos na medicina (Chandraraj et al., 2010).
1.5. ANIMAIS MARINHOS COMO FONTE DE BIOMOLÉCULAS
recifes abrigam uma fauna associada riquíssima que incluem desde bactérias a peixes sendo estes organismos fontes de novas drogas para a indústria farmacêutica. Vários desses organismos relacionados aos corais dependem fundamentalmente da saúde destes para a sobrevivência (Mcfall-Ngai et al., 2005; Chimetto et al., 2010).
Figura 6.Vista aérea dos recifes de corais de Tamandaré, APA Costa dos Corais.
Fonte: (Ferreira e Maida, 2006).
Apesar da sua importância como fonte de alimentos relacionados com os recursos da medicina, energia, dentre outros, ainda se conhece muito pouco sobre as espécies de micro-organismos vivos que se encontram nesse ambiente (González-Párraga et al., 2011).
O número crescente de estudos sobre a heterogeneidade da microbiota em corais nos últimos 10 anos mostrou que eles desempenham um papel-chave na construção dos recifes, pois auxiliam a formação da fauna bentônica e possuem um papel fundamental para a saúde dos oceanos. Além disso, como mencionado breviamente, tem sido extremamente importante para a economia de vários países por meio da pesca, ecoturismo e “berçário” para diversos organismos (Chimetto et al., 2009).
água. Animais como os bivalvos marinhos como os mexilhões e moluscos podem prender em seus tecidos uma grande quantidade de bactérias nativas e não nativas dos oceanos e que são de significativa importância do ponto de vista da saúde pública. Esses animais estão sujeitos ao controle microbiano centrado na detecção da bactéria entérica E. coli como um indicador de poluição fecal, bem como membros dos gêneros Vibrio ou Aeromonas, que podem ser patogênicos para humanos ou animais (Romanenko et al., 2008).
Diversas interações estão presentes nesse ambiente e tem sido amplamente difundidas nesse ecossistema como, por exemplo, as associações mutuamente benéficas entre bactérias e animais. As interações de bactérias hospedeiras no ambiente marinho são tradicionalmente caracterizadas como simbiótica, comensal ou patogênica. Estas colaborações de certa forma ampliam o potencial de sobrevivência de ambos envolvidos. Na simbiose, as interações das bactérias hospedeiras, por exemplo, são equilibradas com benefício recíproco tanto para elas quanto para os organismos na qual elas se associam. Nas interações comensais há a coexistência de pelo menos dois organismos diferentes, sem prejuízo mas também sem benefício evidente. As definições de interações de bactérias hospedeiras são confluentes e muitas podem apresentar-se em duas categorias de interação (Mcfall-Ngai et al., 2005).
Outros estudos têm demonstrado que espécies da bactéria Gram-negativa Photobacterium associada a corais têm sido capazes de produzir antibióticos que protegem o coral (Chimetto et al., 2010). Por outro lado, o motivo na qual os corais obtiveram, durante milhares de anos, a produção de estruturas maiores e biológicas tem sido muitas vezes atribuído à simbiose característica entre o coral e microalgas endossimbióticas, conhecidas como zooxantelas (Symbiodinium sp.). Mais que 50% dos nutrientes dos corais são derivados dos produtos fotossintéticos das zooxantelas (Mcfall-Ngai et al., 2005).
O rompimento de simbioses entre algas e corais gera uma das doenças mais graves dos corais que resulta no clareamento ou branqueamento (descoloração) do coral (Mcfall-Ngai et al., 2005). Acredita-se que as mudanças climáticas e interferência antrópica poderia ser uma das causas do branqueamento de corais no mundo todo. Além do branqueamento, a doença da banda negra tem sido descrita em 70 espécies de corais, incluindo tanto escleratinas quanto gorgônias podendo causar a mortalidade da colônia toda por lise instantânea dos tecidos. Esta doença na maioria das vezes tem como alvo, espécies recifais de corais ecologicamente importantes. Estudos anteriores acerca das bactérias associadas a corais revelaram que os corais visivelmente saudáveis contêm menos comunidades bacterianas diferenciadas do que em áreas saudáveis contendo corais doentes e que as composições das duas populações são diferentes.
Nos últimos anos, o estudo de micro-organismos associados a corais tem ampliado o foco no papel de tais micro-organismos na saúde e doença do coral. Um destes micro-organismos é a bactéria Photobacterium rosenbergii que foi encontrada associada com a saúde e a doença em corais brasileiros. Alguns estudos revelaram a atividade antibacteriana entre bactérias associadas ao coral e também atividade antimicrobiana dos corais propriamente ditos (Gantar et al., 2011). Estudos revelam
que P. rosenbergii aparentemente dotada de motilidade, aparece de forma
considerável na microbiota de espécies de corais saudavéis e doentes (Chimetto et al., 2009).
Pesquisadores acreditam que existem milhares de bactérias marinhas desconhecidas, pois a quantidade de espécies isoladas até então, não reflete a heterogeneidade de formas presentes no mar. As bactérias presentes na água do mar podem ter origem nos rios ou por meio de esgotos, aterros sanitários e se adaptar ao ambiente marinho. Desta maneira, um grande número de agentes patogênicos pode ser levado para o mar. A adaptação destes micro-organismos ao ambiente marinho está relacionada à forma de alimentação de alguns organismos por meio da filtragem destas águas contaminadas ingerindo esses micro-organismos que podem se tornar patogênicos para os seres humanos (González-Párraga et al., 2011).
orgânica disponível e a densidade de organismos planctônicos dentro das águas, visivelmente as causas básicas desta distribuição. No trabalho de González-Párraga (2011), foi citado apenas patógenos encontrados em todos os domínios de vida, Archaea, Eucarya e Bacteria, destacando-se os gêneros Alcaligenes sp na qual faz parte da microbiota natural bacteriana não patogênica isolado a partir da água, bem como nas amostras de mexilhões; Pseudomonas sp encontrado em crustáceos, peixes e bivalvos; Pseudoalteromonas sp comumente associados com organismos marinhos mas somente alguns relacinados a doenças; Shewanella sp isolado de peixes e moluscos; Vibrio sp isolados de pepinos do mar da espécie Apostichopus
japonicus; Photobacterium sp encontrado na microbiota do camarão Nephrops
norvegicus e de alguns corais; Aeromonas sp encontrado em moluscos bivalvos e
Tenacibaculum mesophilum isolados de esponjas e macroalgas (González-Párraga
et al., 2011).
Em 1951, Bergmann e Feeny relataram o isolamento dos nucleosídeos espongouridina e espongotimidina a partir da esponja Cryptotethya crypta indicando um dos primeiros relatos na literatura com produtos naturais químicos marinhos. Com base na sua estrutura química, estes produtos naturais são separados em sete classes: terpenoides, esteroides (incluindo saponinas), alcaloides, éteres (incluindo cetais), fenois (incluindo quinonas), estrigolactonas e peptídeos. Até meados de 2008, a maioria dos novos compostos isolados a partir de organismos marinhos foi proveniente de invertebrados, na qual 75% dos compostos foram isolados a partir de animais pertencentes ao filo Porifera (principalmente esponja) e celenterados (a maior parte de corais). No mesmo estudo, foi comprovada que a quantidade de terpenoides e alcaloides isolados foi superior a quantidade de peptídeos isolados (Hu et al., 2011).
secundários na qual a pesquisa por estas moléculas representa crescimento nos últimos anos. O ambiente marinho dispõe de enormes recursos para novos e diferentes compostos na qual foi considerado o maior reservatório de moléculas naturais remanescentes a serem avaliados para a atividade de fármacos (Aneiros e Garateix, 2004). Além disto, é importante destacar que este consiste em um ambiente repleto de micro-organismos e o uso de moléculas de defesa contra patógenos é uma realidade neste ecossistema.
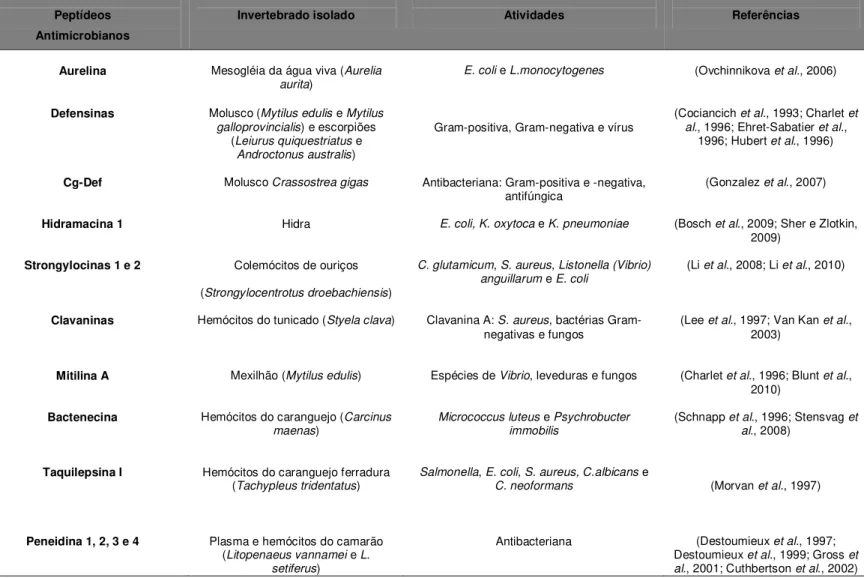
Nos últimos anos, buscando novas alternativas para a redução do número de micro-organismos patogênicos aos seres humanos e também para a defesa de animais e plantas, os PAMs se destacaram como prováveis substitutos para os antibióticos convencionais (Jenssen et al., 2006) e uma variedade de PAMs provenientes de invertebrados terrestres e marinhos foi e ainda está sendo descrita e caracterizada. Estes peptídeos podem ser extraídos de esponjas marinhas, anelídeos, moluscos, quelicerados, crustáceos e tunicados e apresentam atividade contra diferentes micro-organismos e outras atividades que incluem antitumorante, anticoagulante, inseticida, entre outras (Tabela 3).
Em relação aos PAMs que podem desempenhar atividade antimicrobiana no organismo do animal, os isolados do filo Echinodermata conhecidos como strongylocinas foram os primeiros PAMs a serem isolados de colemócitos de ouriços (Strongylocentrotus droebachiensis) (Li et al., 2008). Estes se dividem em strongylocinas 1 e 2 na qual constituem peptídeos catiônicos ricos em cisteína e que apresentam 48 resíduos de aminoácidos (5.6 kDa) e 51 resíduos de aminoácidos (5.8 kDa), respectivamente. Eles exibem baixa atividade hemolítica e atividade contra as bactérias Gram-positivas como Corynebacterium glutamicum e S. aureus e também Gram-negativas, por exemplo, Listonella anguillarum e E. coli (Li et al., 2008; Li et al., 2010).
No filo Arthropoda, peptídeos conhecidos como Taquilepsinas I foram isolados de hemócitos do caranguejo-ferradura japonês Tachypleus tridentatus e mostraram inibição do crescimento de bactérias Gram-negativas (Salmonella e E. coli) e bactérias Gram-positivas (S. aureus), bem como o crescimento de fungos como C.albicans e Cryptococcus neoformans. Estas possuem duas pontes dissulfeto e formas antiparalelas de folhas-β, com resíduos hidrofóbicos em um lado da
No filo Chordata, tem-se exemplos de peptídeos do tipo α-hélices com atividade antibacteriana das quais podem ser citados as clavaninas que foram originalmente isoladas de hemócitos do tunicado Styela clava. Estes peptídeos possuem 23 resíduos de aminoácidos, com porção C-terminal rica em histidina, glicina e fenilalanina (Lee et al., 1997). Estes peptídeos atuam em nível de membrana por meio de um mecanismo dependente do pH na qual são mais ativos em elevadas concentrações de sal em pH ácido do que em pH neutro quando o peptídeo apresenta uma carga ligeiramente positiva, atuando de forma inespecífica e desestabilizando a bicamada lipídica (Lee et al., 1997; Van Kan et al., 2003).
Na hidra, espécie de cnidário foram isolados diversos PAMs sendo o mais conhecido o hidramacina 1. A presença de PAMs neste animal era esperada nos epitélios ectodermal e endodermal que são bem dispostos para sobreviver em um ambiente cheio de agentes patogênicos e impedem a entrada de agentes infecciosos no organismo (Bosch et al., 2009; Sher e Zlotkin, 2009). A hidralisina, uma proteína paralisante que exibe células com atividade citolítica seletiva, não proteolíticas ou atividade fosfolipase, encontrada na hidra verde Chlorohydra
viridissima compreende um grupo distinto de outras toxinas de Cnidários, mas
Tabela 3. Alguns peptídeos antimicrobianos isolados de invertebrados marinhos e suas respectivas atividades.
Peptídeos Antimicrobianos
Invertebrado isolado Atividades Referências
Aurelina Mesogléia da água viva (Aurelia
aurita) E. coli e L.monocytogenes (Ovchinnikova et al., 2006)
Defensinas Molusco (Mytilus edulis e Mytilus
galloprovincialis) e escorpiões (Leiurus quiquestriatus e
Androctonus australis)
Gram-positiva, Gram-negativa e vírus (Cociancich et al., 1993; Charlet et al., 1996; Ehret-Sabatier et al., 1996; Hubert et al., 1996)
Cg-Def Molusco Crassostrea gigas Antibacteriana: Gram-positiva e -negativa,
antifúngica (Gonzalez et al., 2007)
Hidramacina 1 Hidra E. coli, K. oxytoca e K. pneumoniae (Bosch et al., 2009; Sher e Zlotkin,
2009)
Strongylocinas 1 e 2 Colemócitos de ouriços
(Strongylocentrotus droebachiensis)
C. glutamicum, S. aureus, Listonella (Vibrio)
anguillarum e E. coli (Li et al., 2008; Li et al., 2010)
Clavaninas Hemócitos do tunicado (Styela clava) Clavanina A: S. aureus, bactérias
Gram-negativas e fungos (Lee et al., 1997; Van Kan et al., 2003)
Mitilina A Mexilhão (Mytilus edulis) Espécies de Vibrio, leveduras e fungos (Charlet et al., 1996; Blunt et al.,
2010)
Bactenecina Hemócitos do caranguejo (Carcinus
maenas) Micrococcus luteus e Psychrobucter immobilis
(Schnapp et al., 1996; Stensvag et al., 2008)
Taquilepsina I Hemócitos do caranguejo ferradura
(Tachypleus tridentatus) Salmonella, E. coli, S. aureus, C.albicans e C. neoformans (Morvan et al., 1997)
Peneidina 1, 2, 3 e 4 Plasma e hemócitos do camarão
(Litopenaeus vannamei e L. setiferus)