UNIVERSIDADE FEDERAL DO CEARÁ FACULDADE DE MEDICINA DEPARTAMENTO DE CIRURGIA
PROGRAMA DE PÓS-GRADUAÇÃO STRICTU SENSU EM CIRURGIA
PETRÚCIA MARIA ANTERO PINHEIRO
PRÉ-CONDICIONAMENTO NUTRICIONAL COM MISTURAS DE ÓLEOS ÔMEGA-3, 6 E 9 NA ISQUEMIA E REPERFUSÃO CEREBRAL EM RATOS
PETRÚCIA MARIA ANTERO PINHEIRO
PRÉ-CONDICIONAMENTO NUTRICIONAL COM MISTURAS DE ÓLEOS ÔMEGA-3, 6 E 9 NA ISQUEMIA E REPERFUSÃO CEREBRAL EM RATOS
Dissertação submetida à Coordenação do Programa de Pós-Graduação Srictu Sensu em
Cirurgia do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, como requisito parcial para a obtenção do grau de Mestre em Cirurgia.
Orientador: Prof. Dr. Paulo Roberto Leitão de Vasconcelos
PETRÚCIA MARIA ANTERO PINHEIRO
PRÉ-CONDICIONAMENTO NUTRICIONAL COM MISTURAS DE ÓLEOS ÔMEGA-3, 6 E 9 NA ISQUEMIA E REPERFUSÃO CEREBRAL EM RATOS
Dissertação submetida à Coordenação do Programa de Pós-Graduação Srictu Sensu em
Cirurgia do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, como requisito parcial para a obtenção do grau de Mestre em Cirurgia.
Aprovada em 30/09/2011
Aos meus pais, Petrônio Augusto Pinheiro e Maria Lúcia Antero Pinheiro, pelo exemplo, além de todo o incentivo e apoio.
Ao meu querido Ronaldo de Matos Esmeraldo, companheiro de todas as horas, fonte incessante de inspiração.
AGRADECIMENTOS
Ao Professor Doutor Paulo Roberto Leitão de Vasconcelos, Coordenador do Programa de Pós-Graduação Strictu Sensu do Departamento de Cirurgia da Faculdade de
Medicina da Universidade Federal do Ceará, pela disponibilidade e atenção, exímia competência e gentil orientação.
Ao Professor Doutor Sérgio Botelho Guimarães, Coordenador do Laboratório de Cirurgia Experimental e professor do Programa de Pós-Graduação Strictu Sensu do
Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, pela revisão crítica desta dissertação.
Aos Professores do Departamento de Patologia e Medicina Legal da Faculdade de Medicina da Universidade Federal do Ceará, Doutor José Telmo Valença Junior e Mestre Régia Maria Vidal do Patrocínio, pela imprescindível colaboração na execução desta pesquisa.
Ao Professor Doutor Francisco Vagnaldo Fechine Jamacaru, Pesquisador da Unidade de Farmacologia Clínica da Faculdade de Medicina da Universidade Federal do Ceará, pela ajuda decisiva na conclusão deste trabalho.
Ao Professor Doutor Reinaldo Barreto Oriá, Coordenador do Laboratório da Biologia da Cicatrização, Ontogenia e Nutrição de Tecidos da Faculdade de Medicina da Universidade Federal do Ceará, pelas boas sugestões e por todo o apoio na análise deste trabalho.
Ao Dr. Ronaldo de Matos Esmeraldo, Mestre em Ciências pela Universidade de Oxford, pela partilha de experiências nos árduos caminhos da pós-graduação e valiosos conselhos sobre Medicina, Cirurgia e Vida.
À Dra. Maria Neide Antero Pinheiro Buarque, aluna do Curso de Mestrado em Saúde Pública da Faculdade de Medicina da Universidade Federal do Ceará, ao Ms. Petronio Augusto Pinheiro, Jr. e Sra. Kristen Lynn Keener, bacharela em Língua Inglesa, pelas contribuições na revisão desta dissertação.
Aos colegas do Programa de Pós-Graduação Strictu Sensu do Departamento de
Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, doutorando Márcio Wilker Soares Campelo, pela participação em todas as fases desta pesquisa, notadamente durante a condução do experimento no Laboratório de Cirurgia Experimental, e mestranda Ana Paula Bomfim Soares, por toda a sua contribuição, desde a elaboração do Projeto de Pesquisa até a busca das referências bibliográficas, e principalmente por sua postura de apoio e incentivo nos momentos difíceis do trabalho experimental.
À nutricionista Aline Matos Cunha, pelo preparo das misturas de óleos ômega-3, 6 e 9 empregadas no experimento e a extrema delicadeza em prestar esclarecimentos, sempre que necessário.
À bióloga Susana Moreira de Souza, técnica de laboratório do Departamento de Patologia e Medicina Legal da Faculdade de Medicina da Universidade Federal do Ceará, pela ajuda no preparo das soluções utilizadas no experimento.
À aluna Beatrice Nuto Nóbrega, do Curso de Medicina da Universidade Federal do Ceará, pela ajuda durante os procedimentos experimentais.
Às Senhoras Maria Luciene Vieira de Oliveira e Magda Maria Gomes Fontenele, secretárias do Programa de Pós-Graduação Strictu Sensu do Departamento de Cirurgia da
“Se esperamos o que não vemos, é na perseverança que o aguardamos”.
RESUMO
Pré-condicionamento com misturas de óleos ômega-3, 6 e 9 na isquemia e reperfusão cerebral em ratos. PETRÚCIA MARIA ANTERO PINHEIRO. Pós-Graduação Srictu Sensu em Cirurgia, Departamento de Cirurgia, Faculdade de Medicina, Universidade Federal do Ceará (Grau de Mestre em Cirurgia). Setembro, 2011. Orientador: Prof. Dr. Paulo Roberto Leitão de Vasconcelos.
Os ácidos graxos insaturados ômega-γ (ω-3) e ômega-9 (ω-9) possuem ação anti-inflamatória e antioxidante, enquanto os ômega-6 (ω-6) são pró-inflamatórios. Este estudo verificou os efeitos do pré-condicionamento com misturas de óleos contendo baixa relação ω-6/ω-3 e elevada relação ω-9/ω-6, em modelo experimental de isquemia-reperfusão cerebral. Foram utilizados 42 ratos Wistar, divididos em dois grupos: Controle (n=24) e Teste (n=18). O grupo
Controle foi subdividido em 4 grupos de 6 animais, cada: Simulado - Água (Sim-Água), Reperfusão - Água (IR-Água), Simulado - Isolipídico (Sim-Isolipídico) e Isquemia-Reperfusão - Isolipídico (IR-Isolipídico). Os animais receberam água ou uma mistura isolipídica com relações ω-6/ω-γ = 8:1 e ω-9/ω-6 = 0,4:1 por via orogástrica, durante sete dias, conforme seus grupos. O grupo Teste foi subdividido em 3 grupos de 6 animais: IR-Mix1, IR-Mix2 e IR-Mix3. Os animais do grupo Teste receberam misturas oleosas com relações ω-6/ω-γ = 1,4:1 e ω-9/ω-6 = 3,4:1 , diferindo apenas na fonte de ω-3: Mix1, contendo o ácido ω-γ α-linolênico; Mixβ, contendo os ácidos ω-γ α-linolênico, eicosapentaenóico e docosaexaenoico, e Mix γ, contendo os ácidos ω-γ α-linolênico e docosaexaenóico, administradas por via orogástrica, durante sete dias. No sétimo dia, os animais dos grupos IR-Água, IR-Isolipídico, IR-Mix1, IR-Mix2 e IR-Mix3 foram submetidos à isquemia cerebral com oclusão bilateral das artérias carótidas comuns por 1 hora, seguida de reperfusão por 3 horas. Os animais dos grupos Sim-Água e Sim-Isolipídico foram submetidos à operação simulada. Ao final do experimento, todos os animais foram decapitados e seus cérebros fatiados para análise histopatológica da área CA3 do hipocampo. A morte neuronal foi quantificada pela contagem de neurônios vermelhos (NV). Constatou-se que a quantidade de NV no grupo IR-Água (36,83 ± 9,79) foi maior (P = 0,0046) que a observada do grupo Sim-Água (17,67 ± 8,48), bem como a quantidade de NV no grupo IR-Isolipídico (29,83 ± 12,19) foi maior (P = 0,0459) que a observada no grupo Sim-Isolipídico (14,17 ± 11,62). Não foi constatada diferença na quantidade de NV entre os grupos Sim-Água (17,67 ± 8,48) e Sim-Isolipídico (14,17 ± 11,62), ou entre os grupos IR-Água (36,83 ± 9,79) e IR-Isolipídico (29,83 ± 12,19). A quantidade de NV no grupo IR-Mix1 (12,33 ± 6,31) foi menor que a verificada nos grupos IR-Água (36,83 ± 9,79; P < 0,01) e IR-Isolipídico (29,83 ± 12,19; P < 0,05). As quantidades de NV nos grupos IR-Mix2 (10,67 ± 2,81) e IR-Mix3 (7,33 ± 6,47) também foram menores que as verificadas nos grupos IR-Água (36,83 ± 9,79; P < 0,001) e IR-Isolipídico (29,83 ± 12,19; P < 0,01). Não foram constatadas diferenças nas quantidades de NV entre os grupos IR-Mix1 (12,33 ± 6,31), IR-Mix2 (10,67 ± 2,81) e IR-Mix3 (7,33 ± 6,47). Conclui-se que, independentemente da fonte de ω-3, o pré-condicionamento com misturas de óleos contendo baixa relação ω-6/ω-γ e elevada relação ω-9/ω-6, protege os neurônios contra as lesões de isquemia-reperfusão cerebral em modelo experimental.
ABSTRACT
Preconditioning with Omega-3, 6 and 9 fatty acids mixes in brain ischemia and reperfusion in rats. PETRÚCIA MARIA ANTERO PINHEIRO. Srictu Sensu Post-graduation in Surgery, Department of Surgery, School of Medicine, Federal University of Ceara (Degree of Master of Surgery). September, 2011. Advisor: Prof. Paulo Roberto Leitão de Vasconcelos, Dphil.
Omega-3 (ω-3) and omega-9 (ω-9) unsaturated fatty acids are anti-inflammatory and antioxidant, while omega-6 (ω-6) fatty acids are pro-inflammatory. This study investigated the preconditioning effects of fatty acids mixes with low ratio ω-6/ω-3 and high ratio ω-9/ω-6, in a brain ischemia-reperfusion experimental model. Forty-two Wistar rats were aleatory
assigned to two groups: Control (n=24) and Test (n=18). Control group was divided into 4 groups, each with 6 animals: Water-Simulated (Water-Sim), Water - Ischemia-Reperfusion (Water-IR), Isolipid-Simulated Sim) and Isolipid - Ischemia-Reperfusion (Isolipid-IR). The animals received water or a isolipid mix with ω-6/ω-3 ratio of 8:1 and ω-9/ω-6 ratio of 0,4:1 by gavage, for 7 days, according to their groups. Test group was divided into 3 groups of 6 animals: Mix1-IR, Mix2-IR, and Mix3-IR. All animals from Test group received oil mixes with ω-6/ω-3 ratio of 1,4:1 and ω-9/ω-6 ratio of 3,4:1 , differing only on the ω-3 source: Mix1, with ω-3 linolenic acid; Mix2, with ω-3 linolenic, eicosapentaenoic and docosahexaenoic acids, and Mix 3, with ω-3 linolenic and docosahexaenoic acids, by gavage, for 7 days. At the 7th day, animals from Water-IR, Isolipid-IR, Mix1-IR, Mix2-IR, and Mix3-IR groups were subjected to 1-hour brain ischemia by occlusion of both common carotid arteries, followed by a 3-hour reperfusion. Animals from Water-Sim and Isolipid-Sim groups were submitted to a simulated operation. At the end of the experiment, all animals were decapitated and their brains were sliced and sent to histological analysis of the CA3 hippocampal region. Neuronal death was quantified by the red neurons (RN) count. It was found that the number of RN in Water-IR group (36.83 ± 9.79) was higher (P = 0.0046) than the number observed in Water-Sim group (17.67 ± 8.48), and similarly, the number of RN in Isolipid-IR group (29.83 ± 12.19) was higher (P = 0.0459) than the number observed in Isolipid-Sim group (14.17 ± 11.62). There was no difference between the amount of RN from Water-Sim (17.67 ± 8.48) and Isolipid-Sim (14.17 ± 11.62) groups, nor between Water-IR (36.83 ± 9.79) and Isolipid-IR (29.83 ± 12.19) groups. The number of RN in Mix1-IR group (12.33 ± 6.31) was lower than the number seen in Water-IR (36.83 ± 9.79; P < 0.01) and Isolipid-IR (29.83 ± 12.19; P < 0.05) groups. The amounts of RN in Mix2-IR (10.67 ± 2.81) and Mix3-IR (7.33 ± 6.47) groups were also lower than the amounts observed in IR-Water (36.83 ± 9.79; P < 0.001) and IR-Isolipid (29.83 ± 12.19; P < 0.01) groups. There were no differences between the Mix1-IR (12.33 ± 6.31), Mix2-IR (10.67 ± 2.81) and Mix3-IR (7.33 ± 6.47) groups. In conclusion, regardless of the source of ω-3, preconditioning with fatty acids mixes with low ratio ω-6/ω-3 and high ratio ω-9/ω-6, protects the neurons against brain ischemia-reperfusion injuries in this experimental model.
LISTA DE ILUSTRAÇÕES
FIGURA 1 Estrutura química de moléculas de ácidos graxos 26 FIGURA 2 Representação do ácido oléico, C18:1(9) 27 FIGURA 3 Representação do ácido linoléico, C18:2(9,12) 27 QUADRO 1 Representação e abreviação de ácidos graxos insaturados 27 FIGURA 4 Estrutura química dos ácidos eicosapentaenóico (EPA) e
docosaexaenóico (DHA) 28
FIGURA 5 Representação de membrana celular, com incorporação preferencial de EPA e DHA nos fosfolipídios, em relação ao AA, que por sua vez é
superior ao AO 29
FIGURA 6 O metabolismo dos AGPIs: ω-6 produzem PG da série 2 e LT da série 4; ω-3 produzem PG da série 3 e LT da série 5, que são menos inflamatórios que os produtos finais pró-inflamatórios dos ácidos ω-6 30 FIGURA 7 Grupos Controle: Simulado-Água (Sim-Água) e Isquemia-Reperfusão
-Água (IR-Água); Simulado-Isolipídico (Sim-Isolipídico) e
Isquemia-Reperfusão - Isolipídico (IR-Isolipídico) 35
QUADRO 2 Composição da mistura isolipídica 36
FIGURA 8 Grupos Teste: Isquemia-Reperfusão – Mix 1 (IR-Mix 1), Isquemia-
Reperfusão – Mix 2 (IR-Mix 2) e Isquemia-Reperfusão – Mix 3 (IR-Mix 3) 36
QUADRO 3 Composição do Mix 1 37
QUADRO 4 Composição do Mix 2 37
QUADRO 5 Composição do Mix 3 37
FIGURA 9 Ratos Wistar anestesiados, com termômetro retal e sob luz incandescente 38
FIGURA 10 Artérias carótidas comuns isoladas bilateralmente, com preservação dos
nervos vagos 39
FIGURA 11 Linha do tempo dos procedimentos cirúrgicos realizados nos grupos
Sim-Água e Sim-Isolipídico 39
FIGURA 12 Oclusão das artérias carótidas comuns 40 FIGURA 13 Aplicador e clipes microvasculares 40 FIGURA 14 Linha do tempo dos procedimentos cirúrgicos realizados nos grupos
FIGURA 17 Posicionamento do cérebro na matriz 41 FIGURA 18 Fatias de cérebro sobre lâminas retiradas da matriz 42 FIGURA 19 Fotografias digitais do hipocampo, em menor aumento 43 FIGURA 20 Fotografia digital de neurônio isquêmico (na ponta da seta) em meio a
neurônios normais, em CA3, com aumento de 400x 43 FIGURA 21 Fotografias digitais de neurônios vermelhos em áreas CA3 44 FIGURA 22 Contagem de neurônios vermelhos na área CA3 realizada nos grupos
IR-Água e Sim-Água 43
FIGURA 23 Contagem de neurônios vermelhos na área CA3 realizada nos grupos
IR-Isolipídico e Sim-Isolipídico 44
FIGURA 24 Contagem de neurônios vermelhos na área CA3 realizada nos grupos submetidos à operação simulada, que receberam água (Sim-Água) ou
a mistura isolipídica (Sim-Isolipídico) 45 FIGURA 25 Contagem de neurônios vermelhos na área CA3 realizada nos grupos
submetidos ao procedimento de isquemia-reperfusão, que receberam
água (IR-Água) ou a mistura isolipídica (IR-Isolipídico) 45 FIGURA 26 Contagem de neurônios vermelhos na área CA3 realizada nos grupos
IR-Água, IR-Isolipídico e IR-Mix 1 49
FIGURA 27 Contagem de neurônios vermelhos na área CA3 realizada nos grupos
IR-Água, IR-Isolipídico e IR-Mix 2 50
FIGURA 28 Contagem de neurônios vermelhos na área CA3 realizada nos grupos
IR-Água, IR-Isolipídico e IR-Mix 3 51
FIGURA 29 Contagem de neurônios vermelhos na área CA3 realizada nos grupos submetidos ao procedimento de isquemia-reperfusão e tratados com
LISTA DE ABREVIATURAS E SIGLAS
AA Ácido araquidônico
AIT Acidente Isquêmico Transitório AGPIs Ácidos graxos poliinsaturados AL Ácido linoléico (AL)
ALA Ácido α-linolênico AO Ácido oléico
ATP Adenosina-trifosfato AVC Acidente Vascular Cerebral
CEPA Comissão de Ética em Pesquisa Animal
cm Centímetro
COBEA Colégio Brasileiro de Experimentação Animal DHA Ácido docosaexaenóico
DNA Ácido desoxirribonucleico DOU Diário Oficial da União EPA Ácido eicosapentaenóico EROs Espécies Reativas de Oxigênio FIO2 Fração Inspirada de Oxigênio HNEj Anticorpo 4-hidroxinonenal HSP Proteínas do Choque Térmico IL Interleucina
Kg Quilograma
LABCEX Laboratório de Cirurgia Experimental
LT Leucotrieno
MDA Malondialdeído
mg Miligrama
ml Mililitro
mm Milímetro
NFκB Fator de transcrição nuclear kapa B NO Óxido nítrico
SOD Superóxido dismutase
TBARS Substâncias Reativas do Ácido Tiobarbitúrico TNF-α Fator de Necrose Tumoral alfa
TNF- Fator de Necrose Tumoral beta
LISTA DE SÍMBOLOS
α Alfa
O2- Ânion superóxido Beta
C Carbono
-COOH Carboxila
Δ Delta
Gama
ºC Graus Celsius OH- Hidroxila
= Igual a
κ Kapa
> Maior que
+ Mais
± Mais ou menos
® Marca Registrada < Menor que CH3- Metila
ω Ômega
H2O2 Peróxido de hidrogênio
SUMÁRIO
1 INTRODUÇÃO 19
1.1 Pré-Condicionamento 19
1.2 Isquemia-Reperfusão Cerebral 20
1.3 Isquemia Cerebral Experimental 24
1.4 Ácidos Graxos 26
1.4.1 Classificação e Nomenclatura dos Ácidos Graxos 26
1.4.2 Ácidos Graxos e Inflamação 29
1.4.3 Ácidos Graxos e Estresse Oxidativo 31
1.5 Justificativa 32
2 OBJETIVO 33
2.1 Objetivo Geral 33
2.2 Objetivo Específico 33
3 MÉTODO 34
3.1 Aspectos Éticos 34
3.2 Animais 34
3.3 Delineamento Experimental 35
3.3.1 Divisão dos Grupos de Estudo 35
3.3.2 Técnica Anestésica 37
3.3.3 Procedimentos Cirúrgicos 38
3.3.4 Estabelecimento da Isquemia-Reperfusão Cerebral 40
3.3.5 Morte dos Animais e Extração Cerebral 41
3.4 Avaliação do Dano de Isquemia-Reperfusão 41
3.4.1 Preparação das Amostras 41
3.4.2 Análise das Amostras 42
3.4.3 Análise Estatística 44
4 RESULTADOS 46
4.1 Validação do Modelo 46
4.2 Avaliação dos Efeitos 49
4.2.1 Comparações entre os Grupos que Receberam Água e Mistura Isolipídica
e o Grupo que Recebeu Mix 1 49
4.2.2 Comparações entre os Grupos que Receberam Água e Mistura Isolipídica
4.2.3 Comparações entre os Grupos que Receberam Água e Mistura Isolipídica
e o Grupo que Recebeu Mix 3 51
4.3 Comparações entre os Grupos que Receberam Mix 1, Mix 2 e Mix 3 52
5 DISCUSSÃO 53
6 CONCLUSÃO 65
REFERÊNCIAS 66
APÊNDICES 81
1 INTRODUÇÃO
1.1Pré-Condicionamento
Pré-condicionamento é um conceito geral em que um organismo é intencionalmente exposto a um estímulo, seja este nocivo ou não, a fim de que possa alcançar uma maior resiliência, tolerância ou proteção contra uma situação adversa subsequente. O pré-condicionamento implica, portanto, no estabelecimento de uma condição prévia a uma dada situação. A vacinação e a prática de atividade física são exemplos comuns de pré-condicionamento.
Pré-condicionamento isquêmico é o processo por meio do qual uma isquemia breve e subletal protege um tecido de lesões isquêmicas subsequentes mais graves (BHUIYAN; KIM, 2010; STAGLIANO et al., 1999). Foi primeiramente descrito por Murry,
Jennings e Reimar (1986) em um modelo experimental de oclusão intermitente de artérias coronárias (5 minutos de oclusão seguidos por reperfusão), que ocasionou uma proteção miocárdica contra um evento isquêmico mais intenso (40 minutos de oclusão). Posteriormente, o conceito de pré-condicionamento isquêmico foi aplicado ao cérebro por Pérez-Pinzón et al. (1996) e por diversos outros autores desde então.
Há algumas publicações que remetem ao conceito de pré-condicionamento que não seja o pré-condicionamento isquêmico, como trabalhos que discorrem sobre os efeitos do exercício da natação associado à suplementação dietética com ácidos graxos ω-3 em ratos
Wistar (GARCIA et al., 2010; MORITZ et al., 2008). Já Mcguinness et al. (2006) observaram
1.2 Isquemia-Reperfusão Cerebral
O termo “isquemia” (do grego, iskhein, restrição + haema ou hema, sangue)
significa, literalmente, a restrição do aporte de sangue a um determinado órgão ou tecido. A interrupção do fluxo sanguíneo para o cérebro ou parte(s) dele é conhecida como isquemia cerebral (BHUIYAN; KIM, 2010).
A doença aterosclerótica das artérias carótidas pode acarretar agravos como amaurose fugaz, cefaléia ou Acidente Isquêmico Transitório (AIT). A complicação mais temida é o Acidente Vascular Cerebral (AVC), não apenas pelas sequelas que podem ocorrer, mas, principalmente, pelo risco de óbito (TARDINI et al., 2003).
Deve-se ressaltar que, no primeiro ano após a ocorrência de um episódio de AIT, há um risco de, aproximadamente, 10% de o paciente vir a apresentar um AVC. Também é importante assinalar que pacientes assintomáticos portadores de estenose carotídea superior ou igual a 75% têm um risco de 3 a 5 % de virem a apresentar AVC, por ano de seguimento (CINELLI JR; SACIOLTTO, 2002; MOORE, 1995).
O AVC é a terceira maior causa de morte em todo o mundo, após as doenças cardíacas e o câncer (BHUIYAN; KIM, 2010; BOYKO et al., 2011). Além disso, o AVC é a
principal doença incapacitante do adulto (AMERICAN HEART ASSOCIATION, 2008; WARLOW, 1998), haja vista que dentre os pacientes que sobrevivem por mais de seis meses, cerca de um terço permanece dependente de cuidados de terceiros (WARLOW, 1998).
O Acidente Vascular Cerebral é comumente classificado em hemorrágico ou isquêmico. A isquemia cerebral é causada por uma redução transitória ou permanente do fluxo sanguíneo (NISHIZAWA, 2001). O AVC isquêmico é responsável por aproximadamente 87% dos diagnósticos de AVC e geralmente resulta de uma interrupção do suprimento sanguíneo para o cérebro, decorrente de uma parada cardíaca ou de uma oclusão arterial, embólica ou trombótica (LEHOTSKÝ et al., 2009; LLOYD-JONES et al., 2009).
Quando o fluxo sanguíneo para o cérebro é reduzido, a sobrevida do tecido, sob risco, depende de vários fatores modificadores: da disponibilidade de circulação colateral, da duração do tempo de isquemia e da intensidade e rapidez da redução do fluxo (LEHOTSKÝ
et al., 2009; MIYASAKA et al., 2000; SCHALLER; GRAF, 2004). Tais fatores determinam,
por sua vez, o local e o tamanho da lesão (BEDERSEM et al., 1986). As alterações
provocadas pela falta de aporte sanguíneo cerebral desencadeiam processos metabólicos celulares e moleculares, que induzem a autodestruição de células neuronais (TOLDY et al.,
apoptose celular (FATOKUN; STONE; SMITH, 2008; LIOU et al., 2003; LO; DALKARA;
MOSKOWITZ, 2003; MARTIN et al., 1998).
Quatro componentes estruturais e funcionais são particularmente sensíveis à hipóxia decorrente da isquemia: a membrana celular, responsável principal pelo equilíbrio iônico e osmótico; a respiração aeróbica, que compreende, entre outros eventos, a fosforilação oxidativa e a produção de adenosina-trifosfato (ATP); a síntese de proteínas estruturais e enzimáticas e a reprodução celular (COTRAM; KUMAR; ROBBINS, 1996).
Durante a fase de isquemia, devido à diminuição da concentração de oxigênio para o tecido cerebral, ocorre inibição da fosforilação oxidativa mitocondrial e a queda de produção de ATP (BERNARDI, 1996).
O retorno do fluxo de sangue oxigenado aos tecidos previamente desprovidos de oxigênio é fundamental para o reinício do metabolismo aeróbico (HALLIWELL, 1992; TARDINI et al., 2003). Entretanto, quando o fluxo sanguíneo é restaurado, células isquêmicas
que ainda permaneciam viáveis sofrem um aumento paradoxal da lesão, que pode prosseguir em velocidade acentuada. A reperfusão de um tecido isquêmico está associada a uma resposta inflamatória aguda que pode exacerbar danos vasculares e teciduais (THIAGARAJAN; WINN; HARLAN, 1997). Lesão de reperfusão é o termo utilizado para descrever as alterações funcionais e estruturais que se tornam aparentes durante o restabelecimento do fluxo sanguíneo após um período de isquemia (TARDINI et al., 2003).
Destarte, associado ao efeito benéfico da reperfusão, ocorrem fenômenos deletérios: células irreversivelmente lesadas, acentuado edema celular e restauração não uniforme do fluxo sanguíneo para todas as porções de um órgão ou tecido. Essa restauração inadequada do fluxo tissular é conhecida como fenômeno do “não refluxo”, no qual interagem múltiplos fatores, tais como um círculo vicioso de disfunção endotelial vascular, redução da perfusão local e acentuação do edema local (EVORA et al., 1996). Assim, os danos causados
pela reperfusão sobrepõem-se aos danos pela isquemia. A miríade de alterações decorrentes de todo esse processo é chamada de lesão por isquemia-reperfusão (MIYASAKA et al. 2000).
A reperfusão cerebral após a isquemia culmina com perda neuronal por apoptose ou necrose celular (KIRAY et al., 2008).
de meias-vidas relativamente curtas e quimicamente muito reativas (FERREIRA; MATSUBARA, 1997).
Em suma, a redução do fluxo sanguíneo para o cérebro acarreta uma falha no suprimento de oxigênio e glicose para o parênquima cerebral. Essa deficiência desencadeia múltiplos eventos, incluindo uma grave depleção de ATP, perda da homeostase e a liberação e ativação de muitas enzimas citotóxicas. A liberação do glutamato, neurotransmissor excitatório, ocasiona uma estimulação excessiva de seus receptores em neurônios privados de energia. A excitotoxicidade é um dos principais mecanismos de lesão nos estágios iniciais (minutos) da isquemia cerebral. Outros eventos deletérios incluem a inflamação e a apoptose. Uma resposta inflamatória mais intensa se inicia nas primeiras horas após a isquemia e durante a reperfusão, tornando-se então um importante mecanismo de lesão cerebral. Na isquemia-reperfusão cerebral, a resposta inflamatória exerce o papel de eliminar os debris
celulares; todavia, isto piora o dano tecidual. A resposta imune local se caracteriza pela infiltração, acúmulo e ativação de células inflamatórias. Em poucas horas de isquemia-reperfusão, leucócitos aderem ao endotélio cerebral e atravessam as paredes dos vasos sanguíneos, invadindo o parênquima afetado. Astrócitos e micróglia se tornam ativados. Uma vez ativadas, as células passam a secretar uma grande variedade de agentes citotóxicos, como citocinas e quimiotáticos, e promovem a expressão de moléculas de adesão, com aumento na produção de RLs. Vias de sinalização do estresse oxidativo então são ativadas. Essas alterações em cadeia acabam por levar à apoptose e à necrose, com expansão do dano inicial, inclusive podendo envolver tecidos potencialmente viáveis (BENAKIS; LORENZ, DU PASQUIER, 2009).
O estresse oxidativo é um estado de desequilíbrio entre a produção de RLs, em particular espécies reativas de oxigênio, (EROs), e a capacidade de defesa do organismo contra essas espécies, levando a um progressivo dano oxidativo (MORO et al., 2005).
Alguns órgãos ou tecidos, em especial o cérebro, são mais vulneráveis ao estresse oxidativo devido ao seu elevado consumo de oxigênio e, conseqüentemente, à geração de EROs em grande quantidade (CUI et al., 2004). Nos mamíferos, o cérebro corresponde a
aproximadamente 3% da massa corpórea, mas recebe 15% do débito cardíaco e utiliza 20% do oxigênio corporal (PEREZ-PINZON, 2007).
cadeia respiratória em mitocôndrias isoladas de cérebro produzem ânion superóxido (O2-) e peróxido de hidrogênio (H2O2) (HALLIWELL, 1992).
Acredita-se que o estresse oxidativo é um dos mecanismos que desempenha papel central no processo patofisiológico durante o evento isquêmico, e a degeneração neuronal resultante vem sendo associada com o aumento da produção de RLs. Durante a isquemia cerebral, inúmeros eventos predispõem o encéfalo à produção de EROs, como o rápido decréscimo dos níveis de ATP, perda da homeostase do Ca2+, excitotoxicidade, metabolismo e liberação do ácido araquidônico, disfunção mitocondrial, acidose e edema (ALEXANDROVA; BOCHEV, 2005).
Durante a reperfusão, após isquemia cerebral, há uma formação excessiva de radicais livres nas células neuronais, endoteliais e da glia (LEFER, A; LEFER, D, 1993). A elevada produção de espécies pró-oxidantes no tecido encefálico pode contribuir para a lesão neuronal por atacar diretamente macromoléculas, incluindo proteínas, lipídeos e ácido desoxirribonucléico (DNA), ou indiretamente atingindo os caminhos de sinalização celular e regulação da expressão gênica (MORO et al., 2005).
Dentre os efeitos lesivos dos RLs, têm maior importância as lesões de DNA, que ocorrem a partir de reações com a timina no DNA nuclear e mitocondrial; a modificação oxidativa das proteínas, que acentua a degradação multicatalítica, causando dano em toda a célula; e a peroxidação lipídica nas membranas plasmáticas e organelares, que é desencadeada quando as ligações duplas entre os ácidos graxos insaturados dos lipídios das membranas são atacados por RLs derivados principalmente do oxigênio, particularmente pelo radical hidroxila (OH-), acentuando assim a perda da permeabilidade seletiva das membranas celulares e, com isso, acarretando uma desordem iônica (FABER, 1990, 1994).
O equilíbrio entre a geração e a neutralização de oxidantes por diferentes mecanismos de defesa intra e extracelular ajuda a proteger os componentes vitais da célula (ZIMMERMANN et al., 2004). A atividade enzimática antioxidante do tecido afetado pela
isquemia-reperfusão é particularmente importante como defesa endógena primária contra as espécies pró-oxdidantes que induzem a lesão (HOMI et al., 2002). Portanto, a capacidade
1.3 Isquemia Cerebral Experimental
Vários modelos experimentais têm sido desenvolvidos para mimetizar as alterações estruturais e funcionais decorrentes da isquemia cerebral. A grande variedade de modelos ensejou, inclusive, a publicação de revisões de isquemia experimental, e, mais recentemente, guias para a aplicação de modelos animais para o estudo da isquemia cerebral (GARCIA, 1984; GARCÍA-BONILLA et al. 2011; LIU et al., 2009).
Os modelos animais de isquemia cerebral podem ser classificados, de uma forma geral, em duas categorias: modelos de isquemia cerebral focal (com oclusão de vasos intracranianos; geralmente a artéria cerebral média) e modelos de isquemia cerebral global (com oclusão das artérias carótidas comuns e/ou vertebrais) (TARDINI et al., 2003).
Alguns modelos adicionais de isquemia cerebral envolvem mecanismos especiais para induzir oclusão arterial/isquemia, como os modelos tromboembólico, endotelínico e fotoquímico (LIU et al., 2009).
Os modelos de isquemia global mimetizam as condições clínicas de isquemia cerebral decorrentes de parada cardíaca, hipotensão arterial sistêmica profunda ou doença aterosclerótica grave das artérias carótidas, especialmente na circunstância de endarterectomia, pela necessidade de oclusão temporária da artéria carótida (LIU et al., 2009;
TARDINI et al., 2003).
Diversos animais têm sido utilizados em estudos experimentais, mas a preferência recai sobre o rato, em parte devido ao seu pequeno porte e maior disponibilidade (CAMPELO, 2009). Mamíferos roedores como ratos constituem promissor recurso experimental por apresentarem semelhanças anatomo-fisiológicas com a espécie humana e relativa homogeneidade interespécie (MUNIZ; FARIA; VASCONCELOS, 2004).
O primeiro modelo de isquemia cerebral foi publicado em 1960 e consistiu na ligadura da artéria carótida comum direita em ratos Wistar, seguida de vinte e quatro horas de
exposição gradual a um ambiente progressivamente anóxico por até 45 minutos, sem monitoramento fisiológico. O hipocampo foi descrito como a região mais freqüentemente lesada (LEVINE, 1960).
O controle da temperatura corporal do animal é necessário para a eliminação do efeito protetor da hipotermia ou o potencial aumento da lesão cerebral pela hipertermia (ZAREBA, 2004). O monitoramento da temperatura corporal após o procedimento cirúrgico é tão importante quanto o seu monitoramento durante a instituição da isquemia cerebral, porque o pleno retorno da regulação da temperatura requer tempo (JIA et al., 2006). A própria
isquemia cerebral afeta a regulação da temperatura corporal, que por sua vez pode influenciar a extensão e a severidade da lesão cerebral (COLBOURNE et al., 2000). A manutenção da
temperatura corporal pode ser alcançada através da utilização de uma fonte de calor sobre os animais, como uma lâmpada incandescente (LIU et al., 2009).
Sabe-se que os ratos têm o Polígono de Willis bem desenvolvido. Por este motivo, quando submetidos à isquemia cerebral global pela oclusão de apenas dois vasos (ambas as artérias carótidas comuns ou ambas as artérias vertebrais), há uma diminuição do aporte sanguíneo cerebral em somente cerca de 50%. Uma maior redução do aporte sanguíneo pode ser alcançada pela instituição de hipotensão arterial sistêmica. A oclusão dos quatro vasos (ambas as artérias carótidas comuns e ambas as artérias vertebrais) acarreta uma diminuição do fluxo sanguíneo cerebral entre 90 a 95% (ÁBRAHAM; LAZAR, 2000; LIPTON, 1999).
1.4 Ácidos Graxos
1.4.1 Classificação e Nomenclatura dos Ácidos Graxos
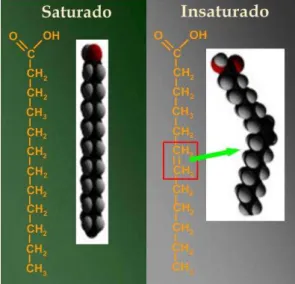
Ácidos graxos são moléculas orgânicas constituídas por átomos de carbono, hidrogênio e oxigênio (ver figura 1), que podem ser classificados de acordo com:
a) o número de átomos na cadeia carbônica: os ácidos graxos podem ser de cadeia curta (até 4 átomos de carbono), média (6 a 12 átomos de carbono) ou longa (a partir de 14 átomos de carbono);
b) o número de duplas ligações na molécula: saturados (ausência de duplas ligações), monoinsaturados (uma dupla ligação) ou poli-insaturados (mais de uma dupla ligação);
c) a posição da primeira dupla ligação contada a partir de seu radical metila (CH3-): ômega-γ (ω-3 ou n-3) quando a primeira insaturação ocorre entre o terceiro e o quarto átomos de carbono, ômega-6 (ω-6 ou n-6) quando a primeira insaturação ocorre entre o sexto e o sétimo átomos de carbono e ômega-9 (ω-9 ou n-9) quando a primeira insaturação ocorre entre o nono e o décimo átomos de carbono (BABAYAN, 1987).
Figura 1 - Estrutura química de moléculas de ácidos graxos.
Figura 2 – Representação do ácido oléico, C18:1(9).
Figura 3 – Representação do ácido linoléico, C18:2(9,12).
A posição da dupla ligação na cadeia carbônica dos ácidos graxos é indicada entre parênteses, pela identificação do átomo de carbono implicado em cada insaturação, em relação ao radical carboxila (-COOH). A tabela 1 mostra a representação numérica de ácidos graxos insaturados e sua classificação em famílias, dependendo da localização da primeira dupla ligação contada a partir de seu radical metila (CH3-).
Quadro 1 – Representação e abreviação de ácidos graxos insaturados
Nome descritivo Representação numérica n Família ω
Ácido oléico 18:1(9) 18:1 n-9 ω-9
Ácido linoléico 18:2(9,12) 18:2 n-6 ω-6 Ácido linolênico 18:3(9,12,15) 18:3 n-3 ω-3
O posicionamento e a quantidade das duplas ligações ao longo da cadeia carbônica designam a qual família determinado ácido graxo pertence, bem como suas diferentes propriedades bioquímicas, nutricionais e funcionais (FAROOQUI, 2009).
Os mamíferos geralmente utilizam ácidos graxos obtidos da dieta para suas necessidades diárias. Contudo, quando necessário, o fígado, o tecido adiposo e as glândulas mamárias são capazes de sintetizar ácidos graxos (saturados e monoinsaturados) a partir de glicose e aminoácidos, por meio de reações enzimáticas específicas. As reações enzimáticas que ocorrem durante a síntese de ácidos graxos podem ser:
a) alongamento, através da inserção de novos átomos de carbono na cadeia carbônica;
Entretanto, devido à deficiência de enzimas como a Δ-9 e a Δ-15 dessaturases, os mamíferos não são capazes de produzir os ácidos graxos poli-insaturados (AGPIs) ácido linoléico (AL) e ácido α-linolênico (ALA). Estes são fornecidos exclusivamente pela dieta, e por isso são ditos essenciais, mas podem ser convertidos a outros ácidos graxos da mesma família dentro do organismo (CALDER, 2003).
Os ácidos graxos da família ω-6 são derivados do ácido graxo essencial linoléico (AL, 18:2) e a família ω-3 é toda derivada do ácido graxo essencial α-linolênico (ALA, 18:3). Uma vez ingeridos, os ácidos graxos essenciais são metabolizados por um conjunto de enzimas, em que novos carbonos e insaturações são adicionados à cadeia carbônica original, produzindo AGPIs da mesma família (INNIS, 2009). O ALA dá origem a outros dois AGPIs ω-3, o eicosapentaenóico (EPA), C20:5(5,8,11,14,17), e o docosaexaenóico (DHA), C22:6(4,7,10,13,16,19). A estrutura química destes dois AGPIs pode ser visualizada na figura 4. É importante ressaltar que as duas famílias de ácidos graxos competem pelo mesmo sistema enzimático (FAROOQUI et al., 2007).
Figura 4 – Estrutura química dos ácidos eicosapentaenóico (EPA) e docosaexaenóico (DHA).
1.4.2 Ácidos Graxos e Inflamação
Os ácidos graxos mais incorporados às membranas fosfolipídicas são os ω-3 EPA e DHA, o ω-6 ácido araquidônico (AA), e o ω-9 ácido oléico (AO), conforme mostra a figura 5 (CHAN; McCOWEN; BISTRIAN, 1998). O EPA e o DHA têm efeitos diretos sobre a fluidez, a estrutura e a função das membranas celulares (CALDER, 2002).
Figura 5 – Representação de membrana celular, com incorporação preferencial de EPA e DHA nos fosfolipídios, em relação ao AA, que por sua vez é superior ao AO.
Ao se incorporar nos fosfolipídios das membranas celulares, os ácidos graxos influenciam a resposta inflamatória e imunológica atuando na fluidez das membranas (facilitando ou dificultando a aderência de receptores e moléculas de superfície e a apresentação de enzimas), na síntese de moduladores inflamatórios (eicosanóides e resolvinas) e na transdução de sinais, com maior ou menor produção de citocinas inflamatórias (WAITZBERG; TORRINHAS, 2009).
Figura 6 – O metabolismo dos AGPIs: ω-6 produzem PG da série 2 e LT da série 4; ω-3 produzem PG da série 3 e LT da série 5, que são menos inflamatórios que os produtos finais pró-inflamatórios dos ácidos ω-6.
A capacidade dos ácidos graxos ω-3 em antagonizar a produção de eicosanóides derivados do metabolismo de ácidos graxos ω-6 constitui um ponto-chave do efeito anti-inflamatório atribuído aos ácidos graxos ω-3. Contudo, não é a única maneira, uma vez que eles exercem outros efeitos que parecem ser independentes da modulação da produção de eicosanóides. Evidências indicam que ácidos graxos ω-3 podem influenciar diretamente a produção de citocinas, inibindo a produção de fator de necrose tumoral alfa (TNF-α) e interleucinas IL-1beta e IL-6 por células imunocompetentes, em modelos de cultura celular (SIMOPOULOS, 2002).
A inibição da liberação de citocinas pró-inflamatórias por ácidos graxos ω-3 parece estar associada com sua participação na ativação de receptores nucleares que antagonizam vias de sinalização do fator de transcrição nuclear kapa B (NFκB). Este fator nuclear é responsável pela transcrição de genes envolvidos na resposta inflamatória que incluem citocinas, moléculas de adesão e outros mediadores pró-inflamatórios (MULLER-LADNER; GAY, R; GAY, S, 2002).
1.4.3 Ácidos Graxos e Estresse Oxidativo
O organismo humano está bem adaptado para se proteger dos danos oxidativos induzidos por uma fração inspirada de oxigênio (FIO2) de 21% à pressão atmosférica normal e em condições fisiológicas. Os mecanismos de proteção utilizados pelo organismo incluem os antioxidantes não enzimáticos, como a glutationa, vitamina E, vitamina C, -caroteno, N-acetilcisteína, proteínas de ligação do heme, e EPA/DHA, entre eles. Os sistemas enzimáticos endógenos removedores de resíduos incluem superóxido dismutase (SOD), catalase e glutationa peroxidase, com seus cofatores associados, selênio, zinco, manganês e ferro. A capacidade dos mecanismos endógenos em desintoxicar as EROs produzidas pela exposição aos elevados níveis de oxigênio é sobrepujada durante o aporte de uma elevada FIO2 ventilatória, durante a reperfusão de uma isquemia, em estados de baixo fluxo e alguns estados hiperdinâmicos. EROs não eliminadas e outros radicais livres podem produzir danos oxidativos a praticamente todos os componentes celulares, incluindo proteínas, ácidos graxos poli-insaturados, polissacarídeos e ácidos nucléicos, causando a morte celular e danos subsequentes aos órgãos (HEYLAND; DHALIWAL; DAY, 2006).
A suplementação oral de antioxidantes encontra-se bem indicada em diversas situações clínicas, como no câncer, na sepse, no pré-operatório de cirurgias de grande porte e em pacientes mal nutridos ou criticamente enfermos (GRIMBLE, 2005).
O azeite de oliva é rico em ácidos graxos ω-9 e vitamina E, conhecido por suas propriedades antioxidantes. O fato de a estrutura molecular do AO ter somente uma dupla ligação, juntamente com a presença de vitamina E, confere uma maior proteção contra a peroxidação lipidíca (GRIMBLE, 2001). O AO reduz o acúmulo de EROs (OH et al., 2009).
Recentemente foi descrito que o DHA é precursor de um mediador denominado neuroproctectina D1 (NPD1), a partir de sua lipoxigenação e ulterior hidrólise. A síntese de NPD1 é induzida como uma resposta de alarme ao estresse oxidativo e/ou ativação de neurotrofinas, acionando a sinalização para a manutenção da homeostase e integridade celular (NIEMOLLER; BAZAN, 2010; PALACIOS-PELAEZ; LUKIW; BAZAN, 2010).
1.5 Justificativa
Devido à alta incidência do AVC, que pode se tornar em breve a principal causa de morte em todo o mundo, associada à elevada prevalência de suas sequelas nos pacientes sobreviventes, estudos sobre a isquemia-reperfusão cerebral adquirem uma maior relevância (BOYCO et al., 2011).
A partir da década de 1970, um número progressivamente maior de estudos prospectivos, com enfoque na prevenção primária e secundária, tem reportado uma relação inversa entre a suplementação oral de ácidos graxos ω-3 e a ocorrência de AVC. Publicações a respeito dos efeitos benéficos do óleo de peixe ou sobre a suplementação oral de ácidos graxos ω-3 já foram objeto de revisões sistemáticas (BISCIONI et al., 2007; WANG et al.,
2006). Os mecanismos de proteção atribuídos a esses ácidos graxos incluem: inibição da atividade plaquetária, diminuição da viscosidade sanguínea, supressão da formação de leucotrienos e modulação da inflamação, redução do fibrinogênio plasmático, da pressão arterial e da resistência insulínica, dentre outros (ISO et al., 2001). Recentemente, a American
Heart Association/American Stroke Association publicou um guia para a prevenção primária do AVC, que contempla estes aspectos (GOLDSTEIN et al., 2011).
Nas últimas duas décadas surgiram vários trabalhos dedicados à obtenção de proteção neuronal, utilizando diferentes modelos experimentais (BHUIYAN; KIM, 2010). Trabalhos que utilizam modelos animais de isquemia-reperfusão cerebral contribuem para o entendimento de sua fisiopatologia e possibilitam o desenvolvimento de novas estratégias terapêuticas (MUNIZ; FARIA; VASCONCELOS, 2004). Já existem centenas de trabalhos, incluindo revisões de estudos experimentais, que discorrem sobre os efeitos antiateroscleróticos, anti-inflamatórios e antioxidantes de ácidos graxos insaturados, como os ω-3, associados à proteção neuronal (BISCIONI et al., 2007). Porém, não há na literatura
2 OBJETIVO
2.1 Objetivo Geral
Avaliar se ocorre pré-condicionamento com três diferentes misturas de óleos contendo elevada relação entre ácidos graxos ômega-9/ômega-6 e baixa relação entre ácidos graxos ômega-6/ômega-3, por via orogástrica, contra as lesões de isquemia e reperfusão cerebral em modelo experimental utilizando ratos.
2.2 Objetivo Específico
3 MÉTODO
3.1 Aspectos Éticos
Este estudo foi de caráter experimental, conduzido em animais vivos, em conformidade com a Resolução nº 879 do Conselho Federal de Medicina Veterinária, de 15 de fevereiro de 2008, publicada no DOU de 25 de abril de 2008, nº 79, seção 1, página 109, que dispõe sobre o uso de animais no ensino e na pesquisa e regulamenta as Comissões de Ética no Uso de Animais no âmbito da Medicina Veterinária e da Zootecnia brasileiras e dá outras providências.
O estudo foi realizado em animais de laboratório, do biotério do Laboratório de Cirurgia Experimental (LABCEX) da Faculdade de Medicina, pertencente à Universidade Federal do Ceará. As condições, desde o alojamento, alimentação, até o bem estar geral dos animais, foram controladas pela direção do biotério.
A utilização dos animais neste experimento baseou-se no Princípio dos Três “Rs” (Replacement, Reduction, Refinement) e está de acordo com os Princípios Éticos na
Experimentação Animal adotados pelo Colégio Brasileiro de Experimentação Animal (COBEA).
O Projeto de Pesquisa intitulado “Efeitos do Pré-Condicionamento com Mix de Óleos de Ômega-3, 6 e 9 na Isquemia e Reperfusão Cerebral em Ratos” sob protocolo nº 09/10 foi avaliado pela Comissão de Ética em Pesquisa Animal (CEPA) da Universidade Federal do Ceará e aprovado em reunião realizada em 07 de abril de 2010 (ANEXO A).
3.2 Animais
Foram utilizados 42 ratos machosda linhagem Wistar (Rattus norvegicus albinus, Rodentia Mammalia), com massa corporal entre 260-290 gramas, procedentes do Biotério
Central da Universidade Federal do Ceará e mantidos no LABCEX.
Todos os animais receberam ração padrão e água ad libitum, e permaneceram
3.3 Delineamento Experimental
3.3.1 Divisão dos Grupos de Estudo
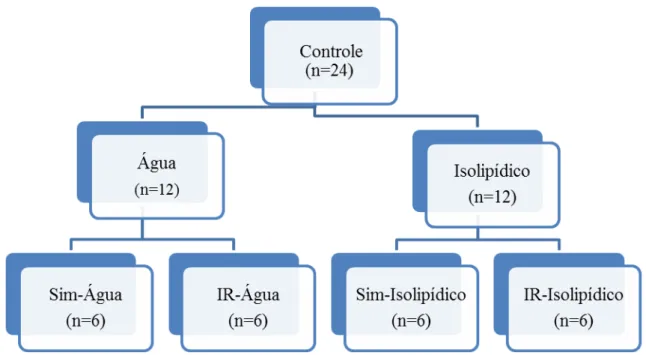
Os 42 ratos foram aleatoriamente divididos em dois grandes grupos: Controle, com um número de 24 animais (n=24) e Teste, com um número de 18 animais (n=18).
O grupo Controle (n=24) foi subdividido nos grupos Água (n=12) e Isolipídico (n=12). O grupo Água foi subsequentemente dividido em dois grupos de 6 animais, o grupo Simulado - Água (Sim-Água) e o grupo Isquemia-Reperfusão - Água (IR-Água), e o grupo Isolipídico foi subsequentemente dividido em dois grupos de 6 animais, o grupo Simulado - Isolipídico (Sim-Isolipídico) e o grupo Isquemia-Reperfusão - Isolipídico (IR-Isolipídico), conforme mostra a figura 7:
Figura 7 – Grupos Controle: Água (Sim-Água) e Isquemia-Reperfusão - Água (IR-Água); Simulado-Isolipídico (Sim-Simulado-Isolipídico) e Isquemia-Reperfusão - Simulado-Isolipídico (IR-Simulado-Isolipídico).
Os ratos pertencentes ao grupo Água receberam água potável na dose de 0,01 ml/g de peso, administrada por via orogástrica, durante sete dias consecutivos, sempre no mesmo horário no período da manhã.
Quadro 2 – Composição da mistura isolipídica Mistura Isolipídica = Óleos de Milho e Soja Óleo de milho
Óleo de soja
ALA (ωγ) 67,6mg/ml
Relação ω6:ω3 8:1
Relação ω9:ω6 0,4: 1
O grupo Teste (n=18) foi subdividido em três grupos de 6 animais: grupo Isquemia-Reperfusão-Mix 1 (IR-Mix 1), grupo Isquemia-Reperfusão-Mix 2 (IR-Mix 2), e grupo Isquemia-Reperfusão-Mix 3 (IR-Mix 3), conforme mostra a figura 8:
Figura 8 - Grupos Teste: Isquemia-Reperfusão – Mix 1 (IR-Mix 1), Isquemia-Reperfusão – Mix 2 (IR-Mix 2) e Isquemia-Reperfusão – Mix 3 (IR-Mix 3).
Os ratos pertencentes aos grupos IR-Mix 1, IR-Mix 2 e IR-Mix 3 receberam, conforme cada grupo, misturas oleosas respectivamente denominadas Mix1, Mix2 e Mix3, cujas composições se encontram descritas nos quadros 3, 4 e 5. Cada Mix foi administrado por via orogástrica, na dose de 1,2 g/Kg de peso/dia (correspondente à administração de 0,01 ml da formulação/g de peso), durante sete dias consecutivos, sempre no mesmo horário no período da manhã.
Quadro 3 – Composição do Mix 1
Mix 1 = Oliva + Canola + Linhaça (ALA) Azeite de oliva
Óleo de canola Óleo de linhaça
Fonte de ωγ ALA (100%) = 116,7mg/ml
Relação ω6:ω3 1,4: 1
Relação ω9:ω6 3,4: 1
Quadro 4 – Composição do Mix 2
Mix 2 = Oliva + Canola + Peixe (ALA + EPA + DHA) Azeite de oliva
Óleo de canola Óleo de peixe
Fonte de ωγ ALA (35%) + EPA (39%) + DHA (26%)
Relação ω6:ω3 1,4: 1
Relação ω9:ω6 3,4: 1
Quadro 5 – Composição do Mix 3
Mix 3 = Oliva + Canola + Linhaça +DHA (ALA + DHA) Azeite de oliva
Óleo de canola Óleo de linhaça DHA (algas marinhas)
Fonte de ωγ ALA (84%) + DHA (16%)
Relação ω6:ω3 1,4: 1
Relação ω9:ω6 3,4: 1
Após 60 minutos da sétima (última) administração orogástrica, tanto os animais que receberam água potável quanto os animais que receberam misturas oleosas, foram submetidos à técnica anestésica e aos procedimentos cirúrgicos propostos para cada grupo.
3.3.2 Técnica Anestésica
na face ventral do membro pélvico traseiro esquerdo. Os animais foram considerados anestesiados quando ocorreu a perda dos reflexos córneo-palpebrais, bem como a perda do reflexo de retirada ao estímulo de preensão em membros pélvicos e torácicos.
Durante todo o procedimento, os ratos foram mantidos com temperatura retal entre 36,5ºC e 37,5ºC, conforme sugerido por Ozen et al. (2008), sob calor de lâmpada
incandescente, quando necessário (ver figura 9). Os animais também foram observados em relação à ocorrência de cianose de extremidades ou de mucosas, ou ocorrência de hipersecreção.
Ao final do procedimento, 15 minutos antes da decapitação, foi repetido o ato anestésico com as mesmas drogas, nas mesmas doses, administradas simultaneamente por via intramuscular, na face ventral da pata traseira direita.
Figura 9 – Ratos Wistar anestesiados, com termômetro retal e sob luz incandescente.
3.3.3 Procedimentos Cirúrgicos
Os animais foram acomodados em bancada cirúrgica durante todo o procedimento. Na técnica cirúrgica foi utilizado instrumental microcirúrgico adequado.
cuidado de evitar uma estimulação indesejável ou uma lesão inadvertida dos nervos vagos (ver figura 10).
Figura 10 – Artérias carótidas comuns isoladas bilateralmente, com preservação dos nervos vagos.
Nos grupos Sim-Água e Sim-Isolipídico, as artérias carótidas comuns foram isoladas com fios nylon 4-0, porém não se prosseguiu com o estabelecimento da isquemia.
Após uma hora (período de tempo durante o qual foi mantida a isquemia nos demais grupos), foi realizada a sutura da incisão cervical com fio de nylon 4-0 e aguardado o período
equivalente à “reperfusão”, por mais três horas, conforme demonstra a figura 11:
Figura11 – Linha do tempo dos procedimentos cirúrgicos realizados nos grupos Sim-Água e Sim-Isolipídico.
3.3.4 Estabelecimento da Isquemia-Reperfusão Cerebral
Nos grupos IR-Água, IR-Isolipídico, IR-Mix 1, IR-Mix 2 e IR-Mix 3, foi realizada a individualização e oclusão bilateral simultânea das artérias carótidas comuns com clipes vasculares tipo bulldog, mantidos durante uma hora (ver figuras 12 e 13).
Figura 12 – Oclusão das artérias carótidas comuns. Figura 13 – Aplicador e clipes microvasculares.
Após o período de isquemia, os clipes vasculares foram removidos para permitir a reperfusão e foi realizada a sutura da incisão cervical com fio de nylon 4-0. A reperfusão
perdurou por três horas, após a qual foi realizada a craniectomia (ver figura 14).
3.3.5 Morte dos Animais e Extração Cerebral
A craniectomia levou à morte dos animais pela decapitação. Imediatamente, procedeu-se à craniotomia (abertura da caixa craniana) com delicada extração dos cérebros para análise (ver figura 15).
Figura 15 – Exposição do cérebro logo após a craniotomia.
3.4 Avaliação do Dano de Isquemia-Reperfusão
3.4.1 Preparação das Amostras
O cérebro de cada animal foi delicadamente retirado do crânio com o auxílio de uma espátula e colocado na matriz fatiadora para cérebro de ratos (Adult Rat Brain Slicer Matrix; Zivic Instruments ®), com sua superfície ventral voltada para cima e sua superfície dorsal voltada para baixo (ver figuras 16 e 17).
Enquanto a matriz fatiadora permaneceu sobre uma plataforma de gelo, foram introduzidas, em suas ranhuras, lâminas metálicas cortantes previamente molhadas com solução salina a 0,9% gelada. As lâminas metálicas foram introduzidas nas ranhuras da matriz a partir do pólo encefálico anterior, em direção à região occipital, obedecendo a um espaçamento de 2 mm entre elas, com exclusão do cerebelo e do tronco encefálico.
O alinhamento das lâminas cortantes na matriz produziu fatias cerebrais coronais de 2 mm de espessura (ver figura 18). Todas as lâminas foram retiradas da matriz de uma só vez, em bloco, e cada fatia de cérebro foi delicadamente removida da superfície de cada lâmina e individualmente posicionada em cassete histológico previamente identificado.
Figura 18 – Fatias de cérebro sobre lâminas retiradas da matriz.
Os cassetes histológicos contendo as fatias de cérebro foram imediatamente imersos em solução tamponada de formaldeído a 10%. O modo de preparo da solução tamponada de formaldeído a 10% encontra-se descrita no Apêndice A.
3.4.2 Análise das Amostras
As fatias do cérebro de cada rato foram processadas histologicamente, tendo sido confeccionadas lâminas com cortes coronais de 5 micra de espessura, corados por Hematoxilina-Eosina (HE) conforme a técnica convencional. O processamento histológico das fatias de cérebro se encontra descrito no Apêndice B.
isto é, sem o conhecimento prévio da correlação entre cada lâmina e o grupo de estudo ao qual cada rato pertenceu.
O hipocampo de cada rato foi localizado (ver figura 19) e em seguida analisado sob aumento de 400x, tendo sido realizada a contagem do número de neurônios isquêmicos (em apoptose ou necrose) na área CA3 (ver figura 20).
Figura 19 – Fotografias digitais do hipocampo, em menor aumento.
Figura 20 – Fotografia digital de neurônio isquêmico (na ponta da seta) em meio a neurônios normais, em CA3, com aumento de 400x.
Figura 21 – Fotografias digitais de neurônios vermelhos em áreas CA3.
3.4.3 Análise Estatística
As variáveis quantitativas foram inicialmente analisadas pelo teste de Kolmogorov-Smirnov para verificar a normalidade da distribuição. Para a estatística descritiva, calcularam-se, então, a média e o desvio padrão. Comparações entre três grupos foram feitas mediante o uso da análise de variância (ANOVA) para um fator de classificação, associada ao teste de comparações múltiplas de Tukey, para verificar diferenças entre os grupos dois a dois. O teste de t para variáveis não emparelhadas, por sua vez, foi utilizado
Em todos os casos, estabeleceu-se em 0,05 (5%) a probabilidade α do erro tipo I (nível de significância), sendo considerado como estatisticamente significante um valor P
menor que 0,05.
O software GraphPad Prism® versão 5.00 para Windows® (GraphPad Software,
4 RESULTADOS
4.1 Validação do Modelo
Em relação ao grupo Controle, foi realizada a contagem de neurônios vermelhos na área CA3 do hipocampo dos ratos que receberam Água, tanto do grupo submetido ao procedimento de isquemia-reperfusão (IR-Água), quanto do grupo submetido à operação simulada (Sim-Água). Foi calculada a média com desvio padrão das contagens efetuadas nos 6 ratos de cada grupo. O teste de t para variáveis não emparelhadas foi usado para comparar
os dois grupos.
Constatou-se que a quantidade de neurônios vermelhos verificada no grupo IR-Água (36,83 ± 9,79) foi significantemente maior (P = 0,0046) que a observada do grupo Sim-Água (17,67 ± 8,48), conforme demonstra a figura 22:
Sim-Água IR-Água 0 10 20 30 40 50
**
Co n ta g em d e n eu rô n io s ve rm el h o sFigura 22 – Contagem de neurônios vermelhos na área CA3 realizada nos grupos IR-Água e Sim-Água. Dados expressos como média e desvio padrão das contagens efetuadas em 6 ratos de ambos os grupos. **P = 0,0046
Também em relação ao grupo Controle, foi realizada a contagem de neurônios vermelhos na área CA3 do hipocampo dos ratos que receberam a mistura isolipídica, tanto do grupo submetido ao procedimento de isquemia-reperfusão (IR-Isolipídico), quanto do grupo submetido à operação simulada (Sim-Isolipídico). Foi calculada a média com desvio padrão das contagens efetuadas nos 6 ratos de cada grupo. O teste de t para variáveis não
Constatou-se que a quantidade de neurônios vermelhos verificada no grupo IR-Isolipídico (29,83 ± 12,19) foi significantemente maior (P = 0,0459) que a observada no grupo Sim-Isolipídico (14,17 ± 11,62), conforme demonstra a figura 23:
Sim-Isolipídico IR-Isolipídico 0 10 20 30 40 50
*
Co n ta g em d e n eu rô n io s ve rm el h o sFigura 23 – Contagem de neurônios vermelhos na área CA3 realizada nos grupos IR-Isolipídico e Sim-Isolipídico. Dados expressos como média e desvio padrão das contagens efetuadas em 6 ratos de ambos os grupos. *P = 0,0459
Ainda em relação ao grupo Controle, considerou-se a contagem de neurônios vermelhos na área CA3 do hipocampo dos ratos pertencentes aos grupos submetidos à operação simulada, comparando-se o grupo que recebeu Água (Sim-Água), com o grupo que recebeu a mistura isolipídica (Sim-Isolipídico). Foi calculada a média com desvio padrão das contagens efetuadas nos 6 ratos de cada grupo. O teste de t para variáveis não emparelhadas
foi usado para comparar os dois grupos.
Sim-Água Sim-Isolipídico 0 10 20 30 40 50 Co n ta g em d e n eu rô n io s ve rm el h o s
Figura 24 – Contagem de neurônios vermelhos na área CA3 realizada nos grupos submetidos à operação simulada, que receberam água (Sim-Água) ou a mistura isolipídica (Sim-Isolipídico).
Dados expressos como média e desvio padrão das contagens efetuadas em 6 ratos de ambos os grupos.
Finalmente em relação ao grupo Controle, considerou-se a contagem de neurônios vermelhos na área CA3 do hipocampo dos ratos submetidos ao procedimento de isquemia-reperfusão, comparando-se o grupo que recebeu Água (IR-Água), com o grupo que recebeu a mistura isolipídica (IR-Isolipídico). Foi calculada a média com desvio padrão das contagens efetuadas nos 6 ratos de cada grupo. O teste de t para variáveis não emparelhadas foi usado
para comparar os dois grupos.
Não foi constatada diferença estatisticamente (P = 0,2984) entre a quantidade de neurônios vermelhos verificada no grupo IR-Água (36,83 ± 9,79) e no grupo IR-Isolipídico (29,83 ± 12,19), conforme se observa na figura 25.
IR-Água IR-Isolipídico 0 10 20 30 40 50 Co n ta g em d e n eu rô n io s ve rm el h o s
Figura 25 – Contagem de neurônios vermelhos na área CA3 realizada nos grupos submetidos ao procedimento de isquemia-reperfusão, que receberam água (IR-Água) ou a mistura isolipídica (IR-Isolipídico).
4.2 Avaliação dos Efeitos
4.2.1 Comparações entre os Grupos que Receberam Água e Mistura Isolipídica e o Grupo que Recebeu Mix 1
Foi realizada a contagem de neurônios vermelhos na área CA3 do hipocampo dos ratos submetidos ao procedimento de isquemia-reperfusão, que receberam Água (IR-Água), mistura isolipídica (IR-Isolipídico) e Mix 1 (IR-Mix 1). Foi calculada a média com desvio padrão das contagens efetuadas nos 6 ratos de cada grupo. A análise de variância (ANOVA) foi usada para comparar os três grupos, associada ao teste de comparações múltiplas de Tukey, para verificar diferenças entre os grupos dois a dois.
Constatou-se que a quantidade de neurônios vermelhos verificada no grupo IR-Mix 1 (12,33 ± 6,31) foi significantemente menor que a observada nos grupos IR-Água (36,83 ± 9,79) e IR-Isolipídico (29,83 ± 12,19), conforme atesta a figura 26:
IR-Água IR-Isolipídico IR-Mix1 0 10 20 30 40 50
**
*
Co n ta g em d e n eu rô n io s ve rm el h o sFigura 26 – Contagem de neurônios vermelhos na área CA3 realizada nos grupos Água, Isolipídico e IR-Mix 1. Dados expressos como média e desvio padrão das contagens efetuadas em 6 ratos de cada grupo.
*P < 0,05 – IR-Mix 1 versus IR-Isolipídico
4.2.2 Comparações entre os Grupos que Receberam Água e Mistura Isolipídica e o Grupo que Recebeu Mix 2
Foi realizada a contagem de neurônios vermelhos na área CA3 do hipocampo dos ratos submetidos ao procedimento de isquemia-reperfusão, que receberam Água (IR-Água), mistura isolipídica (IR-Isolipídico) e Mix 2 (IR-Mix 2). Foi calculada a média com desvio padrão das contagens efetuadas nos 6 ratos de cada grupo. A análise de variância (ANOVA) foi usada para comparar os três grupos, associada ao teste de comparações múltiplas de Tukey, para verificar diferenças entre os grupos dois a dois.
Constatou-se que a quantidade de neurônios vermelhos verificada no grupo IR-Mix 2 (10,67 ± 2,81) foi significantemente menor que a observada nos grupos IR-Água (36,83 ± 9,79) e IR-Isolipídico (29,83 ± 12,19), conforme se visualiza na figura 27:
IR-Água IR-Isolipídico IR-Mix2 0 10 20 30 40 50
***
**
Co n ta g em d e n eu rô n io s ve rm el h o sFigura 27 – Contagem de neurônios vermelhos na área CA3 realizada nos grupos Água, Isolipídico e IR-Mix 2. Dados expressos como média e desvio padrão das contagens efetuadas em 6 ratos de cada grupo.
**P < 0,01 – IR-Mix 2 versus IR-Isolipídico
4.2.3 Comparações entre os Grupos que Receberam Água e Mistura Isolipídica e o Grupo que Recebeu Mix 3
Foi realizada a contagem de neurônios vermelhos na área CA3 do hipocampo dos ratos submetidos ao procedimento de isquemia-reperfusão, que receberam Água (IR-Água), mistura isolipídica (IR-Isolipídico) e Mix 3 (IR-Mix 3). Foi calculada a média com desvio padrão das contagens efetuadas nos 6 ratos de cada grupo. A análise de variância (ANOVA) foi usada para comparar os três grupos, associada ao teste de comparações múltiplas de Tukey, para verificar diferenças entre os grupos dois a dois.
Constatou-se que a quantidade de neurônios vermelhos verificada no grupo IR-Mix 3 (7,33 ± 6,47) foi significantemente menor que a observada nos grupos IR-Água (36,83 ± 9,79) e IR-Isolipídico (29,83 ± 12,19), conforme se visualiza na figura 28:
IR-Água IR-Isolipídico IR-Mix3 0 10 20 30 40 50
***
**
Co n ta g em d e n eu rô n io s ve rm el h o sFigura 28 – Contagem de neurônios vermelhos na área CA3 realizada nos grupos Água, Isolipídico e IR-Mix 3. Dados expressos como média e desvio padrão das contagens efetuadas em 6 ratos de cada grupo.
**P < 0,01 – IR-Mix 3 versus IR-Isolipídico
4.3 Comparações entre os Grupos que Receberam Mix 1, Mix 2 e Mix 3
Em relação ao grupo Teste, foi realizada a contagem de neurônios vermelhos na área CA3 do hipocampo dos ratos submetidos ao procedimento de isquemia-reperfusão, que receberam Mix 1 (IR-Mix 1), Mix 2 (IR-Mix 2) e Mix 3 (IR-Mix 3). Foi calculada a média com desvio padrão das contagens efetuadas nos 6 ratos de cada grupo. A análise de variância (ANOVA) foi usada para comparar os três grupos, associada ao teste de comparações múltiplas de Tukey, para verificar diferenças entre os grupos dois a dois.
Não foram constatadas diferenças estatisticamente significantes (ANOVA: F = 1,3020; P = 0,3010) entre a quantidade de neurônios vermelhos verificada nos grupos IR-Mix1 (12,33 ± 6,31), IR-Mix2 (10,67 ± 2,81) e IR-Mix3 (7,33 ± 6,47), conforme evidencia a figura 29:
IR-Mix1 IR-Mix2 IR-Mix3
0 5 10 15 20 Co n ta g em d e n eu rô n io s ve rm el h o s