Universidade de Trás-os-Montes e Alto Douro
Doença da Dilatação Proventricular
Dissertação de Mestrado em Medicina Veterinária
João Nuno Mendonça Esteves
Orientador:
Professor Doutor Nuno Francisco Fonte Santa Alegria
Co-orientador:
Professor Doutor Filipe da Costa Silva
Universidade de Trás-os-Montes e Alto Douro
Doença da Dilatação Proventricular
Dissertação de Mestrado em Medicina Veterinária
João Nuno Mendonça Esteves
Orientador:
Professor Doutor Nuno Francisco Fonte Santa Alegria
Co-orientador:
Professor Doutor Filipe da Costa Silva
Composição do Júri:
Presidente: Doutora Maria da Conceição Medeiros de Castro Fontes
Vogais: Doutora Ana Cláudia Coelho
Doutor Nuno Fonte Santa Alegria
Vila Real, 2013
Agradecimentos
• À Universidade de Trás-Os-Montes e Alto Douro, na pessoa do Magnífico Reitor, Professor Doutor António Fontainhas Fernandes, pela possibilidade de elaborar esta dissertação de mestrado;
• Ao meu orientador, Professor Doutor Nuno Francisco Fonte Santa Alegria, por me ter aceitado como orientando e por me ter orientado na elaboração desta dissertação, bem como ao meu co-orientador, Professor Doutor Filipe da Costa Silva;
• Ao Mestre Joel Ferraz, pela disponibilidade em me receber no Centro Veterinário de Exóticos do Porto como estagiário, por todas as oportunidades que me proporcionou durante o estágio, pelos seus ensinamentos, e pelo fornecimento dos casos clínicos, bem como de toda a informação relativa a estes;
• A toda a equipa do Centro Veterinário de Exóticos do Porto, por todo o apoio e conhecimentos adquiridos durante o estágio;
• A toda a equipa da Clínica Veterinària Exòtics, em Barcelona, por todos os ensinamentos que me transmitiram;
• Aos meus pais, por todo o apoio que me têm dado para a concretização dos meus sonhos;
• Aos meus amigos, por todo o apoio, quer durante a elaboração da dissertação, quer durante o curso. Muito obrigado: Luzia Gomes, Marta Rebelo, Cátia Sousa, Marta Cunha, Luís Marinho, José Carlos Almeida, Aldo Andrade, Alexandre Anjos, Teresa Raposo, Caroline Gonçalves, e a todos aqueles que, apesar de não figurarem na lista, contribuíram para que todos estes anos se tornem inesquecíveis;
• À Vanessa Tavira, por todo o carinho e dedicação que me tem fornecido em todos os momentos, bem como por todo o apoio na revisão da dissertação. Um muito obrigado!;
Resumo
Descrita desde a década de 70, a Doença da Dilatação Proventricular ou PDD é uma doença infeciosa fatal, reportada em mais de 80 espécies de psitacídeos, bem como noutras aves não pertencentes à Ordem Psittaciformes. Já foi descrita na Europa, Estados Unidos da América, América do Sul, Austrália, Médio Oriente, África e Japão.
Em 2008, foi identificado o agente etiológico desta doença, o bornavírus aviário, por dois estudos independentes. Desde então já foram relatados 7 genótipos relacionados com os psitacídeos, um genótipo associado a canários (Serinus canaria) e um associado a gansos do Canadá (Branta canadensis).
Esta doença é caracterizada pela presença de infiltrados linfoplasmocitários no cérebro e nos nervos das aves infetadas, e manifesta-se com quadros clínicos neurológicos e/ou gastrointestinais. Os sintomas são a perda de peso, regurgitação, excreção de sementes não digeridas, atrofia muscular, ataxia, convulsões e défices propriocetivos e motores, entre outros. À necropsia evidencia-se, na maioria dos casos, uma distensão do proventrículo, com sementes no seu interior e paredes finas. Além do proventrículo, o duodeno pode também estar distendido, assim como as glândulas adrenais podem estar aumentadas. Microscopicamente, verificam-se infiltrados linfoplasmocitários no proventrículo e/ou ventrículo, duodeno e outras partes do intestino, bem como papo, esófago, glândulas adrenais, coração, cérebro, medula espinal, cerebelo, tronco cerebral, nervos periféricos, olho e pele.
O diagnóstico pode ser feito com base nos sinais clínicos, radiografia, métodos moleculares e serológicos, e ainda por necropsia e histopatologia.
Não existe, até à data, tratamento específico para PDD, sendo que a ajuda na digestão e o tratamento de infeções secundárias são as únicas formas de melhorar a condição geral das aves infetadas.
Nesta dissertação são apresentados 9 casos clínicos suspeitos de PDD, com destaque para o caso de uma arara escarlate (Ara macao), sem apresentação típica de PDD, mas confirmada por PCR e por histopatologia.
Abstract
Described since the 1970s, the Proventricular Dilatation Disease or PDD is a fatal infectious disease, reported in more than 80 species of parrots and other birds outside the
Psittaciformes Order. It has been described in Europe, United States of America, South
America, Australia, Middle East, Africa and Japan.
In 2008, the etiologic agent of this disease was identified, the avian bornavirus, by two independent studies. Since then it has been reported 7 genotypes of the virus associated with parrots, one genotype associated with canaries (Serinus canaria) and one associated with Canada geese (Branta canadensis).
Characterized by the presence of lymphoplasmacytic infiltrates in the brain and nerves of infected birds, this disease manifests with neurologic and/or gastrointestinal signs. The symptoms are weight loss, regurgitation, droppings with undigested seeds, muscle atrophy, ataxia, convulsions and proprioceptive and motor deficits. At necropsy it’s shown, in most of the cases, a distention of the proventriculus, with seeds inside and thin walls. In addition to the proventriculus, duodenum may also be distended, as well as the adrenal glands may be increased. Microscopically, it’s seen lymphoplasmacytic infiltration on proventriculus and/or ventriculus, duodenum and other parts of the intestine, as well as the crop, esophagus, adrenal glands, heart, brain, spinal cord, cerebellum, brainstem, peripheral nerves, eye and skin.
The diagnosis can be made based on clinical signs, X-ray, molecular and serological tests, as well as necropsy and histopathology.
There’s no specific treatment to PDD, to the date, as the aid in digestion and the treatment of secondary infections is the only way to improve the general condition of the infected birds.
In this dissertation it’s presented 9 suspected clinical cases of PDD, highlighting the case of a scarlet macaw (Ara macao), without typical presentation of PDD, but confirmed by PCR and histopathology.
Índice Geral
1 Introdução ... 1
2 Doença da dilatação proventricular ... 2
3 Etiologia ... 3
4 Epidemiologia ... 7
5 Patogenia ... 12
6 Sinais clínicos e lesões ... 14
7 Diagnóstico ... 18 8 Tratamento ... 24 9 Controlo ... 26 10 Casos clínicos ... 27 10.1 Caso clínico nº 1 ... 27 10.2 Caso clínico nº 2 ... 30 10.3 Caso clínico nº 3 ... 32 10.4 Caso clínico nº 4 ... 34 10.5 Caso clínico nº 5 ... 35 10.6 Caso clínico nº 6 ... 36 10.7 Caso clínico nº 7 ... 37 10.8 Caso clínico nº 8 ... 38 10.9 Caso clínico nº 9 ... 39 11 Discussão ... 40 12 Conclusão ... 42 13 Bibliografia ... 43
Índice de figuras
Figura 1 - Divergência dos ABV-C e ABV-GC relativamente aos restantes ABV ... 4
Figura 2 - Diferenças entre o genoma do ABV e do BDV ... 5
Figura 3 - Diferenças entre ABV2-4, ABV5 e BDV ... 6
Figura 4 - Necropsia de animal de controlo e de animal com PDD ... 15
Figura 5 - Secção histológica do proventrículo de um animal são e de um animal com PDD 16 Figura 6 - Secção histológica de cérebro de uma ave sã e de uma ave com PDD ... 16
Figura 7 - Fluoroscopia de contraste de um animal normal e de um animal com PDD ... 19
Figura 8 - Imunohistoquímica no sistema nervoso central de animais com PDD ... 21
Figura 9 – Imunohistoquímica em tecidos extracerebrais em animais com PDD ... 22
Figura 10 - Radiografia de contraste com evidência do contraste no intestino e proventrículo com dimensões normais ... 28
Figura 11 - Conteúdo no proventrículo, de cor escura, compatível com melena ... 31
Figura 12 - Proventrículo dilatado e conteúdo com sementes não digeridas ... 33
Figura 13 - Radiografia de contraste evidenciando atraso no esvaziamento do papo, com contraste já nos intestinos e no papo ... 34
Figura 14 - Presença de sementes em todo o trato gastrointestinal ... 38
Índice de tabelas Tabela 1 - Tabela indicativa dos géneros afetados pelo ABV e por PDD ... 9
Tabela 2 - Distribuição celular da coloração imunohistoquímica intranuclear para a proteína N do ABV ... 22
Lista de abreviaturas, siglas, símbolos ou acrónimos ABV – Avian Bornavirus; Bornavirus Aviário
ARN/RNA – Ácido Ribonucleico
ARNm – Ácido Ribonucleico mensageiro AST – Aspartato Aminotransferase
BDV – Borna Disease Virus; Vírus da Doença de Borna BID – Duas vezes por dia
CK – Creatina Quinase
DNA – Ácido Desoxirribonucleico
DNAc – Ácido Desoxirribonucleico complementar
ELISA – Enzyme Linked Immunosorbent Assay; Ensaio Imunosorvente Ligado à Enzima EUA – Estados Unidos da América
Ic – Intracerebral IM – Intramuscular Iv – Intravenoso
ORF – Open Reading Frame; Grelha Aberta de Leitura
PCR – Polymerase Chain Reaction; Reação em Cadeia da Polimerase
PDD – Proventricular Dilatation Disease; Doença da Dilatação Proventricular PO – per os
RT-PCR – Reverse Transcriptase Polymerase Chain Reaction; Reação em Cadeia da Polimerase com Transcrição Reversa
SID – Uma vez por dia TID – Três vezes por dia
Introdução
1 Introdução
Esta dissertação é baseada numa revisão bibliográfica, acerca da doença da dilatação do proventrículo, complementada com a apresentação de casos clínicos ocorridos no Centro Veterinário de Exóticos do Porto.
A escolha deste tema surgiu, pelo meu interesse na clínica de animais exóticos, pelo aumento da incidência de casos clínicos suspeitos no dia a dia, e pelo facto de ser uma doença de diagnóstico recente, e ainda pouco estudada.
Relativamente à doença, e tal como referido anteriormente, é uma doença cujo diagnóstico etiológico só recentemente foi estabelecido, por isso ainda pouco estudada, e que começa a surgir com alguma frequência, despertando assim interesse para o desenvolvimento de uma dissertação de mestrado acerca deste tema.
Os casos clínicos descritos complementam a revisão bibliográfica, permitindo verificar uma diversidade de quadros clínicos, com características descritas na bibliografia utilizada. Dos casos clínicos descritos, só 3 foram observados e seguidos por mim, sendo que os restantes são casos clínicos anteriores ao meu estágio.
Doença da dilatação proventricular
2 Doença da dilatação proventricular
A doença da dilatação proventricular ou PDD é uma doença inflamatória fatal de carácter infecioso que foi relatada a primeira vez na década de 70 em araras. Desde então, já foi reportada em mais de 80 espécies de psitacídeos (Gancz et al., 2010; Gregory et al., 1994;
Hoppes et al., 2013; Keller et al., 2010; Kistler et al., 2008; Raghav et al., 2010; Rinder et al.,
2009; Ritchie et al., 2004; Sullivan et al., 1997; Weissenbock et al., 2009a), bem como
noutros géneros que não pertencentes à Ordem Psittaciformes (Daoust et al., 1991; Delnatte
et al., 2011; Delnatte et al., 2013; Hoppes et al., 2010; Payne et al., 2011a; Perpiñan et al.,
2007; Rubbenstroth et al., 2013; Weissenbock et al., 2009b).
A doença foi descrita nos EUA, Europa, América do Sul, Austrália, Médio Oriente,
África do Sul e no Japão (Gancz et al., 2010; Last et al., 2012; Ogawa et al., 2011; Sassa et
al., 2013). O seu nome deriva da principal característica da doença nos psitacídeos, que é a
dilatação do proventrículo por acumulação de alimento, secundária a uma alteração da motilidade intestinal. É considerada como uma doença infeciosa, uma vez estabelecida a sua etiologia e a fácil propagação nos aviários (Hoppes et al., 2013).
Desde a sua descoberta foram atribuídos diferentes designações a esta doença, entre os quais, dilatação gástrica neuropática, síndrome da dilatação proventricular, ganglioneurite mientérica, “macaw wasting syndrome”, hipertrofia proventricular, neuropatia esplâncnica infiltrativa, encefalomielite dos psitacídeos e “macaw fading syndrome” (Ritchie and Carter, 1995; Ritchie et al., 1994).
Em 2000, Berg e colaboradores, levantaram a hipótese de as aves selvagens serem os reservatórios naturais do vírus da doença de Borna ou BDV após a descoberta do agente vírico nas fezes destas. Encontraram igualmente diferenças no genoma dos vírus resultantes
das diferentes amostras (Berg et al., 2001). Sabendo hoje em dia que o bornavírus aviário ou
ABV já foi descrito em aves que não psitaciformes, fica a dúvida se este poderá ter surgido a partir destes reservatórios selvagens.
Etiologia
3 Etiologia
Como já referido anteriormente, PDD é uma doença de carácter infecioso, cuja etiologia era desconhecida até há bem pouco tempo. A suspeita de que era uma doença de natureza vírica já tinha sido descrita por muitos investigadores, levando-os à pesquisa do agente etiológico, mas sem sucesso. Vários vírus foram apontados para a origem desta doença, entre eles, o vírus da encefalite equina do leste, paramixovírus aviário, herpesvírus aviário, poliomavírus e o vírus da encefalite aviária, no entanto as aves revelavam ausência de anticorpos para estes agentes. Outros vírus foram esporadicamente descritos em aves afetadas,
como por exemplo, adenovírus, enterovírus, coronavírus e reovírus (Deb et al., 2008; Gancz
et al., 2010).
Em 2008, dois estudos independentes identificaram um novo vírus pertencente ao género bornavírus em aves dos EUA e de Israel. Este vírus foi designado como bornavírus aviário
(Honkavuori et al., 2008; Kistler et al., 2008). Até hoje vários estudos, envolvendo diferentes
métodos quer de pesquisa do vírus quer de anticorpos, demonstraram que este vírus está realmente associado a esta doença. Estudos de indução da doença através da inoculação de vírus em caturras (Nymphicus hollandicus) e conures da Patagónia (Cyanoliseus patagonus) foram realizados com resultados positivos, bem como estudos de pesquisa do vírus em populações aleatórias, em aviários com suspeita da doença ou em casos singulares suspeitos (Gancz et al., 2009; Gray et al., 2010; Heffels-Redmann et al., 2011; Keller et al., 2010;
Kistler et al., 2010; Mirhosseini et al., 2011; Ogawa et al., 2011; Weissenbock et al., 2009a).
Os bornavírus, pertencentes à Ordem Mononegavirales, são uma família de vírus não segmentados, com genoma RNA com sentido complementar ao RNAm. Apresentam como característica principal a capacidade de realizarem a transcrição a nível do núcleo das células. No seu genoma ocorre “splicing” alternativo e usam diferentes codões de iniciação e de finalização, quando comparados com outros vírus. A esta família pertence o vírus da Doença de Borna, agente que causa encefalites maioritariamente em equinos e ovelhas e que, embora a sua transmissão tenha sido experimentalmente descrita em várias espécies, há pouca
informação acerca da transmissão deste a aves (Honkavuori et al., 2008; Hoppes et al., 2013;
Kistler et al., 2008).
O agente responsável pela PDD, embora pertença à família Bornaviridae, diverge filogeneticamente dos restantes membros desta família, partilhando apenas cerca de 81% do
Etiologia
genoma e 64% a nível dos nucleótidos com todos os genomas conhecidos de bornavírus de mamíferos (Kistler et al., 2008).
De acordo com os estudos iniciais, foram descobertos 5 genótipos distintos de ABV, partilhando cerca de 84% do genoma a nível dos nucleótidos. Mais recentemente foram identificados dois novos genótipos em psitacídeos (ABV6 e ABV7), bem como em canários (Serinus canaria) identificados como ABV-C, e em gansos do Canadá (Branta canadensis)
identificados como ABV-CG (Delnatte et al., 2011; Payne et al., 2011a; Rubbenstroth et al.,
2012; Weissenbock et al., 2009a; Weissenbock et al., 2009b). Estudos mais recentes
demonstraram que o ABV-C e o ABV-CG são filogeneticamente mais próximos do BDV do
que dos restantes genótipos do ABV que afetam psitacídeos (Payne et al., 2011a;
Rubbenstroth et al., 2013). Esta divergência é demonstrada na figura 1. Dos 7 genótipos
descobertos em psitacídeos, os genótipos 2 e 4 são os que mais vezes foram identificados (Keller et al., 2010; Kistler et al., 2010; Ogawa et al., 2011; Raghav et al., 2010;
Weissenbock et al., 2009a; Weissenbock et al., 2010).
Etiologia
Em termos genéticos foram identificadas algumas diferenças no genoma, quer entre o BDV e o ABV quer entre os diferentes genótipos de ABV.
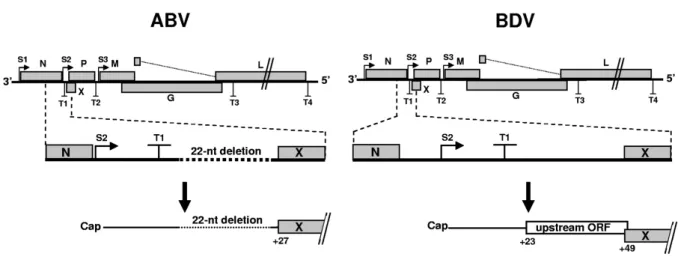
Rinder e colaboradores demonstraram que existem diferenças entre o ABV e o BDV, nomeadamente no ABV a região entre os genes N e X é mais curta que no BDV. No BDV o codão de iniciação S2 para a síntese do ARNm dos genes X/P está localizado a montante do codão de finalização T1, enquanto no ABV está localizado imediatamente a jusante do codão de finalização da grelha aberta de leitura (ORF) de N. Além disso, um fragmento com 22 nucleótidos, encontrado entre o codão T1 e a orf x no BDV, está ausente no ABV. Esta deleção remove uma ORF localizada a montante da região de codificação de X que se encontra presente em todas as estirpes de BDV (Rinder et al., 2009). Estas diferenças são
visíveis na figura 2.
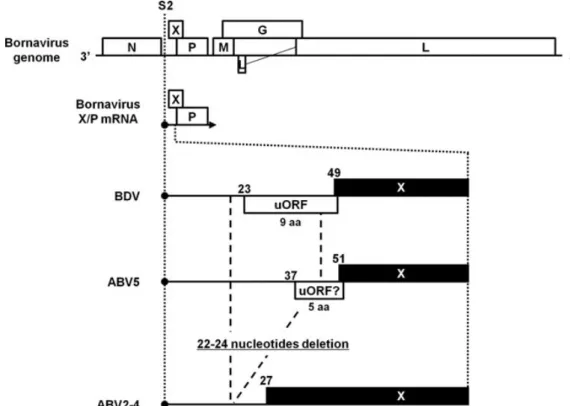
Horie e colaboradores demonstraram que existem diferenças no genoma entre o ABV2 e ABV4 e o ABV5. Enquanto o ABV2 e o ABV4 tem uma deleção de 22 nucleótidos, o ABV5 por sua vez apresenta uma pequena uORF de X/P, assemelhando-se assim ao BDV e ao
ABV-CG (Horie et al., 2012; Payne et al., 2011a). É possível ver estas diferenças na figura 3.
Dados mais recentes demonstraram que a região intergénica N/X do ABV1 diferia do ABV2 por 1 nucleótido, do ABV4 por 2 nucleótidos e do ABV3 por 3 nucleótidos. O mesmo estudo demonstrou igualmente que, o ABV1 à semelhança do ABV5, do BDV e do ABV-CG,
possui uma pequena uORF (Mirhosseini et al., 2012).
Etiologia
Figura 3 - Diferenças entre ABV2-4, ABV5 e BDV (Horie et al., 2012)
M. Horie et al.
Fig. 2. Structure of the 5! UTR of bornavirus X/P mRNA. A schematic representation of the structure of the bornavirus genome and X/P mRNA
from BDV, ABV5 and ABV2–4. S2 shows the transcription start site of the X/P mRNA. The numbers indicate nucleotide positions in the X/P mRNA. aa, amino acid.
did not detect ABV RNA and protein after one month’s passage.
Because only partial sequences of the N and M genes of ABV5 have been established so far, we tried to determine the nucleotide sequence from the N to M gene (Fig. 2). We carried out PCR with MH192 and 193 primers and amplified the target region successfully. Sequence anal-ysis showed that the genomic structure of ABV5 (Acc. No. AB519144) is almost identical to that of other bor-naviruses. Interestingly, however, the upstream sequence of the X of ABV5 appears to differ from those of other bornaviruses (Fig 2). The bornavirus X and P genes are transcribed as a bicistronic X/P mRNA (11). In BDV, a mammalian bornavirus, the 5! UTR of the X/P mRNA contains a short uORF, which plays a critical role in trans-lational regulation of the X and P (12–16). On the other hand, 22 nucleotides in this region are absent from ABV2 and 4, resulting in a lack of the uORF (17). Interestingly, al-though the 5! UTR sequence of ABV5 X/P mRNA is almost the same length as that of BDV, only the shorter uORF is found in ABV5 (Fig. 2). These observations suggest that, in ABV5, the strategy for regulation of expression of X and P proteins differs from those of other bornaviruses. Of
note: during the preparation of this manuscript, a novel genotype of ABV was detected in Canada geese (Branta
canadensis) (18). Intriguingly, the 5! UTR sequence of the
X/P mRNA of the Canada geese ABV was shown to encode an uORF three amino acids longer than ABV5. It would be of interest to determine the nucleotide sequences of other genotypes of ABV and to compare the mechanisms of reg-ulation of X and P gene expression among bornaviruses.
In this study, although we detected ABV5 RNA in an
Eclectus roratus with FPD, it remains unclear whether
ABV5 infection was the cause of the disease. Thus far, several possible causes of FPD have been proposed: in-fection with microorganisms and parasites, organopathy and psychogenic factors (19). Intriguingly, one of three birds reportedly developed FPD after injection of a brain homogenate containing ABV (7). In the case of BDV in-fection, two types of clinical course have been identified in a rat model (20). Adult rats inoculated with BDV develop immune cell mediated fatal non-suppurative encephali-tis, which is histopathologically similar to PDD. On the other hand, in neonatal rats BDV causes chronic infec-tions, which lead to a milder behavioral syndrome with-out overt encephalitis. Therefore, it is plausible that ABV
Epidemiologia
4 Epidemiologia
A elevada prevalência de PDD nos psitacídeos foi descrita em estudos de surtos da doença em animais em cativeiro (Kistler et al., 2010; Lublin et al., 2006) e em todos os
continentes (Hoppes et al., 2013).
Várias vias de transmissão são referidas para esta doença, sendo a principal a via feco-oral através da ingestão de excrementos. No entanto, também se admite que a via respiratória poderá ser uma das possíveis vias de transmissão, uma vez que foi detetada a presença do
vírus nos filtros de ar de um aviário afetado pela doença (Hoppes et al., 2010; Kistler et al.,
2010). Esta via de transmissão pode estar associada à presença do vírus no cálamo das penas (de Kloet et al., 2011). Outros estudos propõem a via urinária como uma possível via de
excreção do vírus, uma vez que este foi detetado tanto nas células renais, bem como na urina
de animais infetados (Heatley and Villalobos, 2012; Payne et al., 2011b).
Além da transmissão horizontal, a transmissão vertical do vírus foi igualmente descrita. Lierz e colaboradores detetaram ABV em 2 embriões mortos, enquanto Monaco e colaboradores encontraram ABV por RT-PCR em ovos viáveis e inviáveis, sendo que além da presença do vírus nos conteúdos do ovo (albumina e gema), este pode estar igualmente presente no tecido embrionário, nomeadamente no cérebro de embriões (Lierz et al., 2011;
Monaco et al., 2012).
A doença da dilatação proventricular além de ter sido descrita em psitacídeos, foi também descrita noutras aves. Foi relatada a primeira vez fora da Ordem Psittaciformes em 1991, em dois gansos do Canadá (Branta canadensis), como uma impactação proventricular associada a uma encefalomielite e ganglioneurite não supurativas compatíveis com PDD. Mais tarde veio a confirmar-se que o ABV afeta esta espécie, bem como afeta gansos
trombeteiros (Cygnus buccinator) e cisnes brancos (Cygnus olor) (Daoust et al., 1991;
Delnatte et al., 2011; Delnatte et al., 2013; Payne et al., 2011a).
Além destas espécies, num estudo datado de 2007 foram reveladas lesões de ganglioneurite linfoplasmocítica mientérica, subepicardial e pulmonar compatíveis com PDD, em 4 espécies da Ordem Passeriformes, sendo elas um canário (Serinus canaria), um verdilhão (Carduelis chloris), um Cephalopterus penduliger e um Lybius dubius. Posteriormente, vários estudos referiram os canários como espécie afetada pelo ABV (Perpiñan et al., 2007; Rubbenstroth et al., 2013; Weissenbock et al., 2009b). Outras aves
Epidemiologia
como tucanos (Ramphastos sp.) e o falcão-peregrino (Falco peregrinus) foram igualmente
descritos como espécies afetadas por esta doença (Hoppes et al., 2010).
Como é comum nas viroses, o estado de portador é igualmente observado na PDD. Esta situação foi primeiramente descrita por Lierz e colaboradores, num estudo em que 19 em 52
aves aparentemente sãs, demonstraram possuir ABV-RNA na cloaca (Lierz et al., 2009). Um
outro estudo refere que aves com evidência histológica de PDD podem não manifestar sinais clínicos, mesmo por longos períodos de tempo (Raghav et al., 2010). Isto foi confirmado
posteriormente quando foram testadas 14 aves aparentemente sãs, sendo que 12 delas libertavam o agente intermitentemente, mas permaneceram sem sinais clínicos durante mais
de 3 meses (Payne et al., 2011b). Villanueva e colaboradores detetaram anticorpos específicos
para o vírus, através da técnica de Western Blot, em aves aparentemente sãs (Villanueva et
al., 2010). Assim, é possível admitir que esta doença pode ocorrer de forma subclínica em
animais que não vão manifestar a doença, apesar de estarem infetados com o ABV.
De acordo com estudos realizados, nesta doença não ocorre predisposição de género nem
etária, sendo que afeta tanto fêmeas como machos, bem como juvenis e adultos (Gregory et
al., 1994; Kistler et al., 2010). Um destes estudos refere ainda que, apesar da doença ocorrer
com maior prevalência em algumas espécies, este facto não deriva destas serem mais predispostas para contrair a doença, mas apenas por serem mais comuns (Gregory et al.,
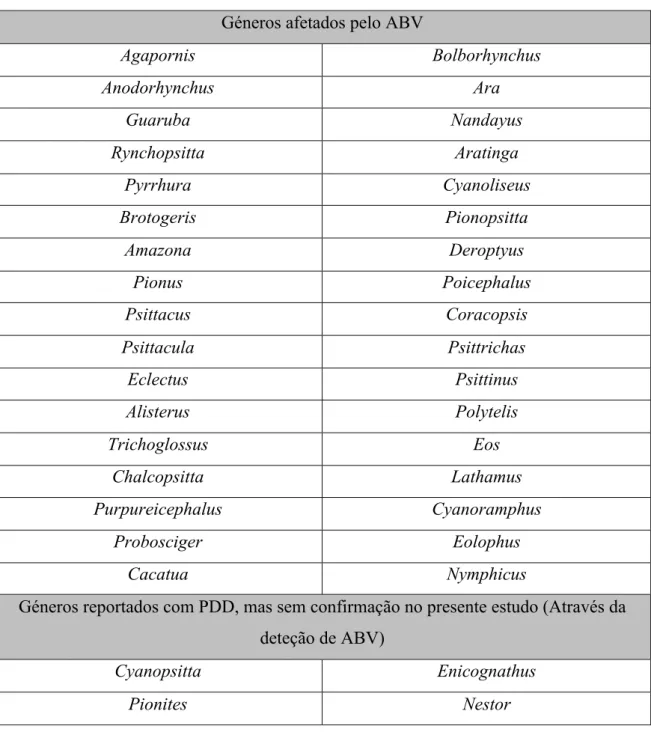
1994). No entanto, um estudo mais recente demonstra que, apesar de serem comuns, alguns géneros são menos afetados pela doença, como sejam, Aratinga, Pyrrhura, Psittacula e
Agapornis. Nas aves destes géneros, apesar de serem comummente encontradas em cativeiro,
a incidência é aparentemente menor. No caso do género Aratinga foram detetados apenas 6 positivos numa população de 134 aves, correspondendo a 4,5% de animais infetados. Já os géneros Poicephalus, Psittacus, Cacatua, Eclectus e Amazona foram os mais afetados, sendo que no caso do género Psittacus foram detetados 47 positivos num total de 101 aves, correspondente a 46,5% de aves infetadas (Heffels-Redmann et al., 2011). Na tabela 1 são
apresentados os géneros de aves onde a doença já foi notificada. Curiosamente, no periquito australiano (Melopsittacus undulatus) nunca foi descrito nenhum caso de PDD, pelo que esta
Epidemiologia
Géneros afetados pelo ABV
Agapornis Bolborhynchus Anodorhynchus Ara Guaruba Nandayus Rynchopsitta Aratinga Pyrrhura Cyanoliseus Brotogeris Pionopsitta Amazona Deroptyus Pionus Poicephalus Psittacus Coracopsis Psittacula Psittrichas Eclectus Psittinus Alisterus Polytelis Trichoglossus Eos Chalcopsitta Lathamus Purpureicephalus Cyanoramphus Probosciger Eolophus Cacatua Nymphicus
Géneros reportados com PDD, mas sem confirmação no presente estudo (Através da deteção de ABV)
Cyanopsitta Enicognathus
Pionites Nestor
Tabela 1 - Tabela indicativa dos géneros afetados pelo ABV e por PDD (Heffels-Redmann et al., 2011)
A evolução desta doença tem vindo igualmente a ser descrita nos últimos anos. Gancz e colaboradores demonstraram, a partir da inoculação de caturras com homogeneizado de cérebro contendo ABV-4, que os animais mostravam sinais clínicos de PDD por volta dos 64 e 95 dias pós-inoculação. No entanto, verificou-se que uma das aves 95 dias pós-inoculação não demonstrava sintomatologia, apesar de ter uma distensão moderada do proventrículo (Gancz et al., 2009).
Epidemiologia
sinais clínicos de PDD cerca de 15 dias após a introdução de uma ave infetada, acabando por morrer 10 dias após o aparecimento de sinais clínicos. Além desta cria, várias morreram num espaço de um mês após a introdução da ave infetada nesta coleção. Igualmente, no mesmo espaço de tempo, outras aves demonstraram sinais clínicos compatíveis com PDD. Três crias foram introduzidas nesta coleção, por um período de uma semana, e duas semanas após voltarem ao efetivo inicial começaram a demonstrar sinais clínicos, e acabaram por morrer após uma aparente recuperação. Neste segundo aviário, para onde retornaram as aves que contactaram com as do primeiro, em 5 de 8 aves foi possível detetar o ABV em zaragatoas cloacais, 4 semanas após a exposição às crias infetadas (Kistler et al., 2010).
Piepenbring e colaboradores inocularam ABV-4 em caturras (Nymphicus hollandicus) por duas vias diferentes, via intracerebral (Ic) e intravenosa (Iv) . Seis aves num total de 19 apresentaram sinais clínicos neurológicos, gastrointestinais ou ambos simultaneamente. Uma das aves, inoculada via Ic, apresentou sinais clínicos gerais por volta dos 33-41 dias após a inoculação, sendo que a sintomatologia gastrointestinal manifestou-se mais cedo que a sintomatologia neurológica, 116-126 dias pós-inoculação para a sintomatologia gastrointestinal via Iv versus 159 dias (via Iv) e 199 dias (via Ic) para a sintomatologia neurológica. Os sinais gastrointestinais e neurológicos foram observados em aves de ambos os grupos (Piepenbring et al., 2012).
Um outro estudo usou o ABV-2 como inóculo e obteve resultados diferentes dos anteriormente descritos. Os animais testados apresentaram uma deterioração do estado clínico entre 36 e 45 dias levando a que, por razões humanitárias, a eutanásia fosse praticada. Admite-se assim, que o ABV-2 é mais virulento que o ABV-4. No entanto, apesar desta especulação acerca da virulência desta estirpe, as lesões observadas nestas aves eram menos graves do que nas aves inoculadas com ABV-4. Considera-se que as diferenças encontradas nas lesões podem ser devidas à mais rápida evolução no caso da infeção experimental pelo
ABV-2 (Mirhosseini et al., 2011).
Vários estudos recentes demonstraram que o vírus é excretado de forma irregular e aleatória, podendo não ser detetado através de zaragatoas das coanas e da cloaca, mesmo após
confirmação de PDD por histopatologia (Hoppes et al., 2010; Payne et al., 2011b; Raghav et
al., 2010). Lierz e colaboradores referem a ocorrência de viremia, uma vez que o RNA viral,
além de ter sido detetado em todos os órgãos testados e nas zaragatoas cloacais, foi também no plasma (Lierz et al., 2009).
Epidemiologia
Rinder e colaboradores demonstraram que o ABV só se propaga em células de aves e não em células de mamíferos. Os autores tentaram cultivar o vírus em linhas celulares de fibroblastos de codorniz (CEC32), músculo esquelético de codorniz (QM7), hepatoma de galinha (LMH), rim de macaco (Vero), glioma de rato (C6) e rim de cão (MDCK). Os resultados obtidos demonstraram que o agente apenas se propagou nas culturas CEC32, QM7 e LMH, no entanto com diferentes resultados consoante a linha celular e a estirpe viral utilizada. Neste caso, o ABV-2 proveniente do papo de uma ave infetada não foi propagado na linha celular LMH. Deste estudo concluíram que a linha celular CEC32 (de fibroblastos de codorniz) é a melhor para o isolamento do ABV, e que este tem elevada preferência para
células de origem aviária, embora de forma seletiva (Rinder et al., 2009).
De forma semelhante para o que já foi estudado no BDV, Reuter e colaboradores estudaram a capacidade de o ABV escapar à imunidade inata, e concluíram que o ABV consegue evadir à resposta imunitária do hospedeiro de uma forma semelhante ao BDV. Para tal, o ABV desenvolveu uma estratégia muito eficiente de evasão ao reconhecimento por parte
dos recetores do sistema imunitário inato, como é o caso dos recetores RIG-I.A estratégia é
simples, o vírus cliva as terminações 5’ do seu RNA genómico e anti-genómico e remove quaisquer resíduos tri-fosforilados que possam ser detetados pelos recetores, omitindo-se assim a síntese de interferões (Reuter et al., 2010).
Patogenia
5 Patogenia
A PDD é caracterizada pela presença de infiltrados linfoplasmocitários no cérebro e nos nervos das aves afetadas. Os infiltrados são especialmente evidentes nos gânglios nervosos entéricos e nos nervos do plexo mioentérico no trato gastrointestinal superior, e são facilmente detetados nos nervos vago, braquial e isquiático (Berhane et al., 2001). Há
destruição dos gânglios nervosos no plexo gástrico e, numa menor extensão, no plexo
mioentérico do duodeno (Mannl et al., 1987).
É de referir que, esta destruição leva a uma anomalia na motilidade dos segmentos afetados e consequente atonia local, daqui resultando um bloqueio da passagem do alimento. A perda de neurónios pode resultar de lesão direta das células nervosas ou da destruição das suas células de suporte, como resultado da infeção pelo ABV. Embora no cerebelo das aves infetadas, seja comum uma perda significativa de células de Purkinje, por imunohistoquímica não se consegue demonstrar que estas se encontrem infetadas. Já as células de Bergmann encontram-se altamente infetadas e é provável que estas sejam necessárias como suporte à função e viabilidade das células de Purkinje, podendo justificar assim a sua perda
significativa (Ouyang et al., 2009). A teoria de que o ABV danifica diretamente as células não
é suportada pelo facto de o ABV não ser citolítico, uma vez que este consegue infetar as células em culturas, mas não afeta a sua viabilidade numa extensão significativa, nem as destrói (Rinder et al., 2009).
É mais provável que a lesão neuronal observada nesta doença seja secundária a atividades citotóxicas dos linfócitos T. Esta evidência é baseada exclusivamente em estudos acerca do BDV. Igualmente se verificou que a imunização ou remoção seletiva dos linfócitos T com antissoros ou imunossupressores, como por exemplo, a ciclosporina, promove a sobrevivência do animal. É uma hipótese que os linfócitos T citotóxicos promovam a apoptose das células que exprimam o antigénio do BDV. Se isto acontecer igualmente nas aves infetadas com ABV, então é possível prever que protocolos imunossupressivos, especialmente os de eliminação seletiva dos linfócitos T, como a ciclosporina, podem ser uma opção terapêutica (Hoppes et al., 2013).
Tem sido sugerido que as lesões nos nervos causadas pelo ABV podem condicionar uma irritação local e desencadear picacismo. No entanto, nunca foi observada nenhuma associação entre a infeção por ABV e picacismo, não existindo evidências que o ABV o possa causar
Patogenia
(Hoppes et al., 2013). Uma vez que só existe um caso descrito, não pode ser tomado como
Sinais clínicos e lesões
6 Sinais clínicos e lesões
As aves podem manifestar sintomas gastrointestinais ou neurológicos, ou por vezes uma
associação de ambos (Gancz et al., 2010). Os sinais clínicos mais frequentes são a perda de
peso, com ou sem diminuição do apetite, a apatia, a regurgitação contínua ou intermitente e a excreção de sementes não digeridas. Estão igualmente descritas impactação do proventrículo e do papo, atrofia muscular, distensão abdominal, letargia, fraqueza, poliúria, hipotensão e, em casos raros, diarreia ou fezes escassas. Os sintomas neurológicos podem ser a ataxia,
movimentos anormais da cabeça, convulsões e défices propriocetivos e motores (Gregory et
al., 1994; Ritchie and Carter, 1995). Um caso de amaurose foi descrito num papagaio
cinzento (Psittacus erithacus) (Steinmetz et al., 2008). A morte súbita sem apresentação de
sinais clínicos também foi descrita (Gancz et al., 2010).
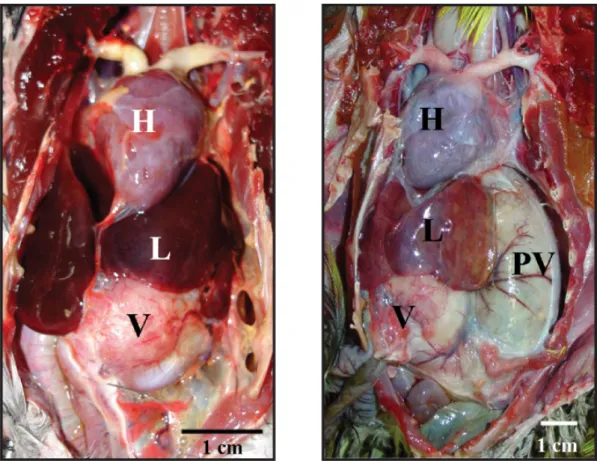
Ao exame macroscópico, as aves afetadas por PDD podem apresentar desidratação e emaciação moderada a grave. A atrofia dos músculos peitorais pode ser observada em aves com história prolongada de regurgitação ou defecação de sementes não digeridas. O proventrículo pode estar distendido, com paredes finas e sementes no seu interior. Em alguns casos, a parede proventricular pode sofrer de rutura com saída do alimento para a cavidade celómica, resultando em peritonite. O duodeno pode, da mesma forma, estar distendido e as glândulas adrenais aumentadas. Em alguns casos é ainda possível observar áreas pálidas no epicárdio. Ocasionalmente podem não se evidenciar lesões significativas, e a ave morrer sem
Sinais clínicos e lesões
Figura 4 - Necropsia de animal de controlo (esquerda) e de animal com PDD (direita). É percetível uma dilatação evidente do proventrículo (PV), com deslocação do lobo esquerdo do fígado (L) para a direita do
animal. A letra V corresponde ao ventrículo e a letra H ao coração (Kistler et al., 2008).
As lesões microscópicas podem ser observadas em vários órgãos do trato gastrointestinal, nos sistemas nervoso central, periférico e autónomo, coração, glândulas adrenais, e ocasionalmente nos nervos e gânglios nervosos de vários órgãos viscerais. Deve salientar-se que as lesões em vários órgãos podem não estar presentes em todos os casos de PDD. Num estudo, em que os casos foram selecionados com base nas lesões no proventrículo e/ou ventrículo e comparados com outros órgãos, foi possível observar que as glândulas adrenais foram o segundo órgão mais afetado, seguido do intestino, coração, cérebro/medula espinal, esófago/papo, nervos periféricos, olho e pele (Shivaprasad et al., 1995). No proventrículo,
existe frequentemente uma atenuação das glândulas e fibrose da mucosa e, em muitos casos, existe uma infiltração de linfócitos e plasmócitos nos e à volta dos nervos da túnica muscular do ventrículo. Este tipo de infiltrado é igualmente observado nos nervos da serosa do proventrículo e/ou ventrículo, duodeno e outras partes do intestino. Lesões similares podem ser observadas nos gânglios nervosos da serosa e subserosa e nervos do papo e esófago, mas que tendem a ser menos frequentes que as restantes lesões. Uma grande percentagem de aves
Sinais clínicos e lesões
de poucos linfócitos nas regiões medulares até infiltrados com um grande número de linfócitos, plasmócitos e heterófilos. Com frequência, as células do córtex adrenal estão vacuolizadas e hipertrofiadas. Os gânglios nervosos, subjacentes à glândula adrenal, podem igualmente apresentar infiltrados linfocitários. No coração, observam-se infiltrados de células similares nos gânglios nervosos e nervos do epicárdio e à volta das fibras de Purkinje a nível subendocárdico, miocárdico e subepicárdico. O cérebro e a medula espinal podem apresentar lesões semelhantes caracterizadas por um infiltrado perivascular de linfócitos, localizados no córtex cerebral, cerebelo, tronco cerebral e medula espinal, que pode ser moderado a grave. Os gânglios nervosos vestibulococleares, juntamente com os nervos e gânglios nervosos espinais, podem também apresentar infiltrados linfoplasmocitários. Da mesma forma, os nervos isquiático, braquial, vago e outros nervos periféricos podem apresentar infiltrados a nível perivascular (Berhane et al., 2001).
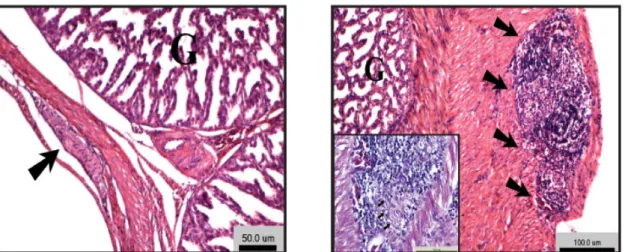
Figura 5 - Secção histológica do proventrículo de um animal são (esquerda) e de um animal com PDD (direita). Observa-se um infiltrado linfoplasmocitário no gânglio nervoso mioentérico, na imagem da direita, representado
Sinais clínicos e lesões
As lesões no olho, quando presentes, são caracterizadas por um infiltrado perivascular moderado a grave nos nervos óticos, na coroide, corpo ciliar e, ocasionalmente, na íris e no
pécten (Gancz et al., 2010). Multiplas lesões na retina foram igualmente descritas,
nomeadamente a perda de fotorrecetores, ablação parcial da retina, ativação da microglia e
um moderado infiltrado linfoplasmocitário (Steinmetz et al., 2008). As lesões na pele incluem
o infiltrado linfoplasmocitário perivascular, necrose ocasional e infiltração de linfócitos nos
músculos eretores das penas (Gancz et al., 2010).
Para além dos sinais clínicos e lesões descritas, é possível verificar alterações a nível hematológico e bioquímico. Num estudo realizado foi possível verificar uma diminuição das proteínas totais e da albumina, bem como do cálcio total, que pode ser explicado pela reduzida absorção de nutrientes devido às alterações existentes no trato gastrointestinal. As enzimas fosfatase alcalina e amílase encontravam-se elevadas, especialmente a primeira, que apresentava um aumento muito significativo. Este poderá estar associado à inflamação gastrointestinal e o aumento de amílase poderá estar associado a alterações a nível
pancreático, resultantes do mau funcionamento do trato gastrointestinal (Lublin et al., 2006).
Um outro estudo publicou valores de hematologia e bioquímica alterados relativos a 4 casos clínicos, sendo possível observar anemia, leucocitose, heterofilia, hipoproteinemia, aumento do ácido úrico, da amílase, da AST e da CK, devendo-se estas últimas às lesões musculares (Doneley et al., 2007).
Diagnóstico
7 Diagnóstico
Existem vários métodos de diagnóstico descritos para a deteção de PDD e de ABV em animais infetados. Estes podem ser divididos em métodos de diagnóstico em vida ou
intravitam e após a morte ou postmortem.
Quando em vida, os sinais clínicos serão o método de diagnóstico menos trabalhoso e dispendioso, e também o mais prontamente disponível para avaliação pelo médico veterinário. A hematologia e a bioquímica sanguínea seguem-se aos sinais clínicos em termos de diagnóstico, sendo uma opção fácil de realizar. No entanto, nem sempre a mais recomendável, porque, em grande parte dos casos, o animal não está estável o suficiente para se recolher amostras de sangue para a realização destes testes.
É importante realizar citologias fecais e do papo. Apesar de não permitirem um diagnóstico definitivo de PDD, permitem diagnosticar a presença de outros agentes patogénicos secundários à infeção por ABV, ou outro diagnóstico diferencial. É de salientar que estes últimos métodos de diagnóstico não são eficazes per si para detetar a doença, sendo
sempre necessário conjugá-los com outros métodos (Gancz et al., 2010).
Os métodos imagiológicos podem fornecer mais alguma informação no diagnóstico da doença. Nestes estão incluídos a radiografia, a radiografia de contraste e a fluoroscopia de contraste. O achado mais consistente de PDD é uma distensão, moderada a marcada, do proventrículo contendo ingesta e uma variável quantidade de gás. Porém, esta distensão não é exclusiva de PDD. O papo, ventrículo e o intestino delgado podem estar igualmente
distendidos, sendo que o grau de distensão varia de ave para ave (Gancz et al., 2010). Deve-se
ter sempre em mente que a distensão do papo e do proventrículo podem ser fisiológicas em neonatos, suscitando erros de interpretação (Ritchie et al., 2004).
Para a maioria dos casos de PDD, a radiografia é o método imagiológico com melhor relação custo-benefício, providenciando informação suficiente acerca do tamanho dos compartimentos gastrointestinais. Nas situações em que a radiografia normal não coincide com as alterações visíveis em PDD, pode realizar-se uma radiografia com contraste baritado ou iodado. O contraste baritado fornece melhor qualidade de contraste e dura mais tempo que o contraste iodado, mas pode, no entanto, causar irritação das vias aéreas se acidentalmente aspirado, e deve ser evitado se houver suspeita de perfuração gastrointestinal. Este exame permite não só ver o tamanho e a posição relativa dos órgãos contrastados, como também
Diagnóstico
cloaca em menos de 3 horas após a sua administração. No entanto, o tempo de trânsito gastrointestinal alterado não pode ser considerado como um indicador específico ou sensível de PDD. A fluoroscopia de contraste pode igualmente auxiliar ao diagnóstico de PDD, com a vantagem de ser possível observar a motilidade do trato gastrointestinal em tempo real (Gancz
et al., 2010).
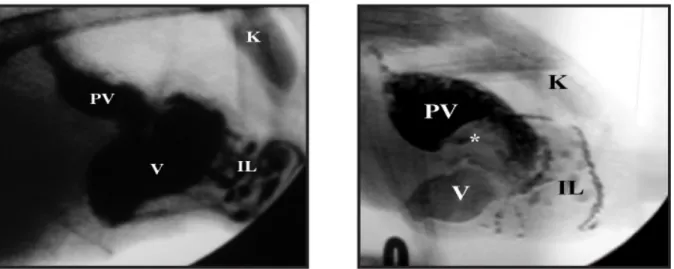
Figura 7 - Fluoroscopia de contraste de um animal normal (esquerda) e de um animal com PDD (direita). É percetível, na imagem da direita, uma distensão do proventrículo (PV), com contraste no seu interior. O ventrículo (V) e o intestino (IL) apresentam contraste mas em menor quantidade. O asterisco (*) encontra-se
sobre material alimentar impactado. O rim (K) serve apenas como orientação (Kistler et al., 2008).
A biópsia do papo é um método que foi usado com muita frequência, antes da descoberta do ABV, mas atualmente há muita controvérsia na sua utilização, com estudos a reportar
prevalência de ganglioneurite no papo de aves com PDD entre os 22% e os 76% (Gancz et al.,
2010). Para aumentar a sensibilidade do teste é sugerido que se selecione o local da biópsia e que se realize múltiplas secções (Ritchie et al., 2004). A biópsia deve conter um vaso
sanguíneo proeminente, aumentando assim a probabilidade de se obter na mesma amostra uma secção de nervo (Gregory et al., 1996; Harrison and Lightfoot, 2006; Ritchie et al.,
2004). Devem obter-se duas amostras, uma maior e elíptica, para histopatologia, conservada em formol a 10%, e outra mais pequena, para RT-PCR, conservada num frasco estéril e congelada (Gancz et al., 2010).
As técnicas biomoleculares e serológicas vieram facilitar o diagnóstico de PDD, quer em vida como após a morte do animal. Estas baseiam-se em técnicas como o RT-PCR, imunohistoquímica, Western Blot, imunofluorescência, ELISA.
Diagnóstico
devem ser testadas várias amostras por cada ave (Heatley and Villalobos, 2012). O recurso às penas também é possível, tendo já sido detetada a presença de RNA viral no cálamo das penas de revestimento, e descrito como mais fiável do que a pesquisa de material genético viral nas
zaragatoas cloacais (de Kloet et al., 2011). O sangue também pode ser utilizado, mas como
nem sempre há viremia, a sensibilidade pode ser reduzida (Hoppes et al., 2013).
A imunohistoquímica é uma técnica eficaz para a deteção do antigénio viral nas células,
podendo ser aplicada na biopsia do papo (Raghav et al., 2010). Pode ainda fazer-se
isolamento do vírus nas linhas celulares anteriormente descritas, como por exemplo a CEC32, no entanto, para a sua deteção é necessário recorrer a imunofluorescência, imunohistoquímica ou Western Blot. Este método resulta melhor em amostras frescas de tecido, pelo que não é
prático o seu uso em fezes ou zaragatoas cloacais (Hoppes et al., 2013).
Villanueva e colaboradores, recorreram ao Western Blot como método de diagnóstico de PDD. No seu estudo, apontam como antigénio dominante a proteína N do ABV. Porém, demonstrou-se que o Western Blot não deteta todas as aves infetadas com ABV, tendo apenas 33% de sensibilidade e 30% de especificidade, quando comparado com o PCR na deteção de aves infetadas (Villanueva et al., 2010).
A imunofluorescência indireta é outro método utilizado no diagnóstico de PDD, que permite a quantificação de anticorpos contra o ABV. Neste estudo, além de se detetarem anticorpos nas aves positivas ao ABV, também se observaram anticorpos em 17 das 49 aves negativas no RT-PCR. Os autores referem que devido à variabilidade genética, é possível que as técnicas de PCR não detetem todos os genótipos de ABV, ou o agente pode não estar presente na amostra, devido à sua excreção irregular. A conjugação destes dois métodos é,
segundo os autores, a eleita para o diagnóstico intravitam de infeção por ABV (Herzog et al.,
2010).
O recurso ao teste ELISA permite a deteção de anticorpos contra a proteína da nucleocápside p40 do ABV, e os resultados foram mais consistentes do que relativamente à proteína de matriz p16 e à fosfoproteina p24. Apesar de identificar animais infetados, apresenta baixa sensibilidade (75%) e especificidade (75%) quando comparado com o PCR fecal. Assim, existe uma fraca relação entre a presença de anticorpos, a eliminação fecal do ABV e a doença clínica (de Kloet et al., 2011).
Relativamente aos métodos postmortem, é possível realizar necropsias, verificando se as lesões presentes se enquadram com as lesões descritas na doença; realizar histopatologia,
Diagnóstico
podendo ser executado em vários órgãos como, cérebro, cerebelo, medula espinal, tronco cerebral, nervos periféricos, olho, glândulas adrenais, papo, proventrículo, ventrículo,
coração, rim, fígado e pele (Honkavuori et al., 2008; Lierz et al., 2009; Raghav et al., 2010;
Rinder et al., 2009). A imunohistoquímica também pode ser usada após a morte do animal, e
é possível, recorrendo à tabela 2, ver a distribuição celular da coloração específica intranuclear para a proteína N, em aves positivas (Raghav et al., 2010). As imagens 8 e 9
mostram alguns padrões observados através da imunohistoquímica.
Segundo Raghav e colaboradores, se usarmos a histopatologia como gold standard, a especificidade e sensibilidade da imunohistoquímica é de 100%. Seguindo o mesmo raciocínio, a especificidade e sensibilidade do RT-PCR para a proteína M e para a proteína N
é de 87,5% e 100%, respetivamente (Raghav et al., 2010).
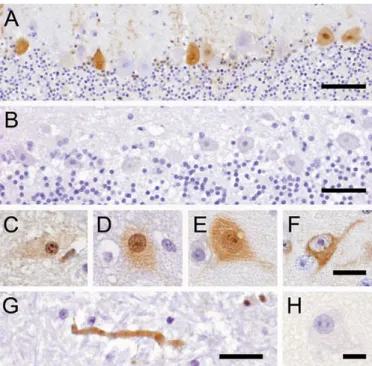
Figura 8 - Imunohistoquímica no sistema nervoso central de animais com PDD. A) presença da proteína no núcleo, citoplasma e dendrites das células de Purkinje no cerebelo; B) controlo negativo nas células de Purkinje; C) corpos de inclusão intranuclear; D) coloração difusa no núcleo e mais esbatida no citoplasma; E) no núcleo e no citoplasma, com corpos de inclusão intranucleares mais marcados; F) apenas no citoplasma; G) num axónio
da substância branca do bolbo raquidiano; H) controlo negativo num neurónio cerebral (Weissenbock et al., 2009a)
Diagnóstico
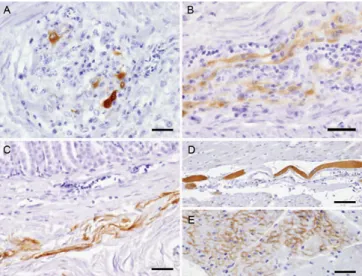
Figura 9 – Imunohistoquímica em tecidos extracerebrais em animais com PDD. A) em neurónios com infiltrado inflamatório dos gânglios nervosos do proventrículo; B) em fibras nervosas do plexo mientérico do ventrículo;
C) nas fibras do músculo liso na parede do proventrículo; D) numa fibra muscular modificada do sistema de condução do coração; E) nas células do miocárdio (Weissenbock et al., 2009a)
Tecido Células que exibem coloração intranuclear
Cérebro Neurónios, células da glia
Cerebelo Neurónios e células de Purkinje, células da glia
Tronco cerebral Neurónios, células da glia
Medula espinal Neurónios, células da glia, células ependimais
Glândulas Adrenais Células corticais e cromafins, neurónios dos gânglios nervosos
adjacentes
Papo Neurónios dos gânglios nervosos da serosa
Proventrículo Neurónios dos gânglios nervosos da serosa
Ventrículo Neurónios dos gânglios nervosos da serosa
Duodeno Neurónios dos gânglios nervosos da serosa
Rim Células epiteliais dos túbulos contornados proximais e distais e tubos
coletores
Coração Neurónios dos gânglios nervosos pericárdicos
Pâncreas Células das ilhotas de Langerhans e dos ácinos
Testículos Células de revestimento dos túbulos seminíferos e células intersticiais
Ovários Células foliculares
Diagnóstico
No que respeita ao diagnóstico diferencial, é possível enumerar outros agentes e doenças que levam ao aparecimento de quadros neurológicos em aves, nomeadamente, a doença de Newcastle, a gripe aviária, a febre do Nilo ocidental, encefalite por agentes bacterianos ou
micóticos e clamidiose (Lublin et al., 2006). Além destas enfermidades há outras que podem
levar a alterações na passagem do alimento, como, proventriculite fúngica, megabacteriose, enterite parasitária, corpos estranhos, neoplasias, intoxicações por metais pesados, enterites bacterianas, papilomatose do proventrículo/ventrículo ou qualquer massa intra ou extraluminal a nível do trato gastrointestinal. Estes processos podem, de forma semelhante ao PDD, levar a uma alteração radiográfica do trato gastrointestinal. É de salientar que nos neonatos o proventrículo está dilatado de forma fisiológica (Ritchie and Carter, 1995). A deficiência em vitamina E e em selénio podem levar a distrofia do músculo esquelético, podendo afetar o coração e o ventrículo. A afeção do ventrículo leva ao aparecimento de sementes não digeridas nas fezes (Ritchie et al., 1994).
Tratamento
8 Tratamento
Não havendo tratamento específico, e dado tratar-se de uma doença infeciosa que causa inflamação do sistema nervoso central e periférico, e também do sistema digestivo, é primordial ajudar a digestão e controlar as infeções secundárias. Há possibilidade de as aves voltarem a uma boa condição física se a doença for detetada precocemente e rapidamente
iniciado tratamento. No entanto, não se pode prever o tempo de sobrevida da ave (Gancz et
al., 2010).
O uso de anti-inflamatórios não esteroides tem sido uma opção amplamente utilizada no tratamento de PDD, recorrendo maioritariamente a inibidores seletivos da COX-2, como o
caso do celecoxib (Gancz et al., 2010). Este tem vindo a ser utilizado com sucesso, em doses
orais entre os 10 e os 20 mg/kg SID. Dado que este protocolo terapêutico tem uma duração que pode ir até às 12 semanas, é possível esta situação causar stress no animal. A melhoria
clínica só é observável a partir da 2ª semana de tratamento (Dahlhausen et al., 2002; Gancz et
al., 2010).
O uso de tepoxalina, um inibidor da COX-1, COX-2, e 5-lipoxigenase (LOX), foi usado com sucesso num grupo de aves. A inibição das enzimas LOX, ao reduzir a produção de leucotrienos, especialmente o leucotrieno B4, leva a uma diminuição da inflamação do trato gastrointestinal. Outro estudo conjugou o uso de tepoxalina com uma dieta extrusionada hipoalergénica, obtendo resultados favoráveis. Segundo o autor, estes resultados podem estar associados ao uso de uma dieta extrusionada que facilita a absorção da medicação, uma vez
que é hipoalergénica, e também à eficácia melhorada da tepoxalina com esta dieta (Gancz et
al., 2010).
O meloxicam também tem sido usado no tratamento, uma vez que em doses mais elevadas inibe a COX-2, mas com resultados muito inferiores aos anti-inflamatórios anteriormente referidos (Gancz et al., 2010; Hoppes et al., 2013).
Os anti-inflamatórios não esteroides inibidores da COX-2 têm como efeitos secundários melena e sangue fresco nas fezes, pelo que quando algum destes sinais aparece deve suspender-se a sua administração. Como estes têm eliminação urinária, devem ser usados com
precaução em animais com doença renal (Gancz et al., 2010).
O uso de fármacos antivirais também está descrito no tratamento de PDD, em especial nos animais com sintomatologia neurológica severa e pouco responsiva ao uso isolado de
Tratamento
vírus influenza, quando usada nas doses 10 mg/kg PO SID, isoladamente, ou 20 mg/kg na comida, apresentou bons resultados. Esta, em combinação com o celecoxib, mostrou-se igualmente eficaz, com raras reações adversas, que facilmente eram resolvidas quando se
terminava o tratamento (Gancz et al., 2010).
Outros fármacos podem ser utilizados para controlo das infeções secundárias ou para melhorar a digestão. A metoclopramida é uma ajuda preciosa no tratamento de casos graves de PDD, que apresentem redução da motilidade ou estase intestinal, na dose 0,5 mg/kg BID PO ou intramuscular. Este tratamento deve ser iniciado por via injetável e só mais tarde por via oral. Em casos de animais anémicos ou hipoproteinémicos, a administração de vitaminas, especialmente as do complexo B, é benéfica (0,25-0,5 mg/kg IM cada 7 dias). Aves com gás no trato gastrointestinal ou vómito respondem bem a uma terapia combinada, como por exemplo, claritromicina (60 mg/kg PO SID), metronidazole (20 mg/kg PO BID) e sucralfato (25 mg/kg PO TID) (Carpenter et al., 2012; Gancz et al., 2010).
Para além do recurso a fármacos, é possível melhorar o estado geral das aves infetadas recorrendo a melhorias no maneio. A considerar, as aves devem ser mantidas no exterior onde a luz solar e o ar fresco vão permitir uma diminuição da transmissão do vírus, bem como uma melhoria no bem-estar dos animais. O stress deve ser evitado e a dieta deve ser facilmente digerível, pois a função ventricular e proventricular vão estar afetadas. Inicialmente pode optar-se por dietas líquidas ou em “pellets”, indicadas para aves infetadas por PDD, ou então recorrer a dietas formuladas para aves jovens criadas à mão. Este tipo de alimentos são os mais apropriados, pois são mais fáceis de digerir do que as sementes. No entanto, é preciso ter em conta que podemos estar a alterar os hábitos alimentares de uma ave doente, habituada a sementes, para dietas formuladas. As dietas extrusionadas, como referido anteriormente, permitem uma melhor absorção medicamentosa, podendo ser uma mais-valia, ao permitir tratamentos prolongados e livres de stress (Gancz et al., 2010).
A suplementação da dieta com vegetais ricos em fibra pode ser benéfica em estados iniciais de PDD, estimulando a motilidade intestinal. A associação de suplementos nutricionais à terapêutica, pode ser uma mais-valia nas aves com sinais clínicos neurológicos. Nestes estão incluídos o ginkgo biloba, vitamina E, ácido alfa-lipoíco, acetil-L-carnitina, e vitaminas do complexo B. Embora descritos, não existem estudos relativamente à sua eficácia (Gancz et al., 2010).
Controlo
9 Controlo
O controlo de ABV deve ser feito, recorrendo ao isolamento, controlo de entradas e saídas de aves no aviário, desinfeção e limpeza dos espaços. Até à data, não é conhecida a capacidade de sobrevivência do ABV no meio ambiente. Sabe-se, no entanto, que este vírus é semelhante, em termos de dimensões, ao vírus da doença de Newcastle, sendo expectável que a sensibilidade destes a desinfectantes como fenóis, formaldeído e hipocloritos, de que é exemplo a lixívia, seja similar (Hoppes et al., 2010).
Além da desinfeção, devem isolar-se todas as aves novas, doentes, ou seropositivas ao ABV, separar as aves provenientes de bandos positivos (PCR) e controlar a entrada e saída de aves. As aves existentes e as novas aves devem ser testadas, recorrendo a testes serológicos e múltiplos testes de PCR (até 3), e separadas ou isoladas consoante os resultados dos testes. Como existe transmissão vertical, as crias de aves infetadas devem ser criadas à mão, separadamente das restantes, e monitorizadas relativamente ao desenvolvimento da doença. Tendo em conta que a eliminação do vírus é irregular e os resultados dos testes serológicos podem ser inconclusivos, pode demorar anos até ter uma exploração livre de ABV. Embora em menor número, existem aves cuja eliminação do vírus é persistente, e que, quando
detetadas, devem ser removidas do bando (Hoppes et al., 2013).
A monitorização regular da condição corporal e das fezes das aves inseridas em bandos em que se sabe que a doença existe, é um método mais simples de detetar casos clínicos de PDD. No entanto, este método não deteta aves em estados iniciais da doença ou que possam ser portadoras assintomáticas (Gancz et al., 2010).
Devem efetuar-se necropsias para diagnóstico (incluindo histopatologia) a todas as aves que morrem e deve evitar-se a sobrelotação dos aviários, uma vez que esta facilita a transmissão do vírus (Gancz et al., 2010).
Casos clínicos
10 Casos clínicos
Esta dissertação é complementada com a apresentação retrospectiva de casos clínicos de PDD do Centro Veterinário de Exóticos do Porto, desde a sua abertura, em 2009, até à data de término do estágio, em abril de 2013. Contam-se 9 casos suspeitos dos quais 3 foram acompanhados.
10.1 Caso clínico nº 1
Nome: Barranquilha
Classe: Aves
Ordem: Psittaciformes
Espécie: Ara macao
Género: Feminino
Data de Nascimento: Em 2012-02
Entrada: 2013-01-15
Saída: 2013-01-18
Motivo de consulta: Vómito, apatia
Peso: 740-750g
A ave deu entrada na clínica com história de apatia, vómito e anorexia, por episódios. Tinha estado em contacto com um macho que apresentou quadro semelhante e acabou por morrer, num outro centro veterinário.
Foi realizado tratamento de suporte com fluidoterapia e alimentação forçada, e administração de metoclopramida. Os primeiros exames identificaram uma infeção do papo por bacilos Gram positivos, e o hemograma foi sugestivo de infeção bacteriana/fúngica.
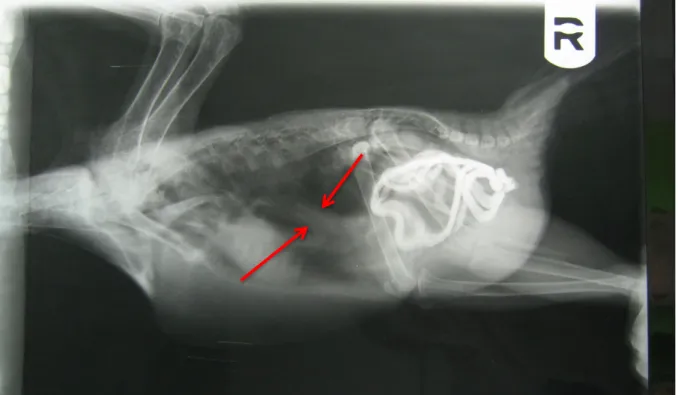
No 2º dia iniciou-se tratamento com enrofloxacina, meloxicam, ranitidina, multivitamínico, tendo como diagnóstico provisório ingluvite bacteriana. O raio-x de contraste demonstrou atraso no trânsito gastrointestinal, sem evidência de dilatação do proventrículo, que levaria a suspeitar de infeção por ABV. Ao fim do 2º dia mostrou sinais evidentes de melhoria, cessando os vómitos/regurgitação e começando a comer sozinha, evidenciando boa atitude e movendo-se pelas grades da gaiola.
Casos clínicos
Ao 3º dia o animal continuou estável, com boa atitude e bom estado geral. As análises da bioquímica sanguínea não deram pistas relevantes para o diagnóstico. Entretanto aguardava- -se o resultado de microbiologia da zaragatoa de papo (bacteriológico e micológico).
No final do 3º dia e durante o 4º dia, a Barranquilha piorou o seu estado geral, deixando de aceitar a alimentação, mostrando-se muito fraca e prostrada. As fezes apresentaram presença de sangue e bactérias compatíveis com Clostridium. O hematócrito desceu para 12%. Tentou estabilizar-se a ave com fluidoterapia intraóssea, com recurso a coloides, e outros procedimentos, incluindo a oxigenoterapia, ventilação assistida, ressuscitação cardiorrespiratória com atropina e adrenalina, sem sucesso, acabando por falecer no dia 18 de janeiro.
Foi realizada necropsia, confirmando-se apenas infeção digestiva, no papo e no intestino. Foram recolhidas amostras de vários órgãos e enviados para histopatologia e para pesquisa de bornavírus por PCR. Ambos os resultados confirmaram infeção por ABV.
Figura 10 - Radiografia de contraste com evidência do contraste no intestino e proventrículo com dimensões normais (setas). Foto gentilmente cedida por Centro Veterinário de Exóticos do Porto.
Casos clínicos
Resultados da histopatologia:
• Ventrículo: alguns gânglios nervosos na serosa celómica estão infiltrados por muito poucos linfócitos e plasmócitos; Diagnóstico microscópico: ganglioneurite linfoplasmocitária leve;
• Cérebro: escassos vasos sanguíneos do neuropilo com infiltrado perivascular leve de linfócitos e plasmócitos; Diagnóstico microscópico: encefalite perivascular linfoplasmocitária leve;
• Papo, ventrículo: observa-se inflamação linfoplasmocitária de grau muito baixo, com padrão perivascular e periganglionar, na serosa celómica visceral; Diagnóstico microscópico: celomite visceral linfoplasmocitária periganglionar/perivascular leve; • Fígado, rim: com padrão difuso, evidenciam hipoperfusão tecidular intensa;
Diagnóstico microscópico: hipoperfusão tecidular difusa grave;
• Fígado: as células de Kupffer contêm eritrócitos fagocitados degenerados e pigmento granular castanho, compatível com hemossiderina; Diagnóstico microscópico: eritrofagocitose leve com hemossiderose moderada a grave das células de Kupffer; • Tecido adiposo: apresenta atrofia difusa intensa dos adipócitos; Diagnóstico
microscópico: atrofia difusa grave;
• Rim: dilatação leve a moderada dos túbulos, principalmente os tubos coletores; Diagnóstico microscópico: dilatação tubular leve a moderada;
• Pâncreas, proventrículo, músculo esquelético, baço, nervo periférico, esófago e uréter não apresentaram alterações microscópicas dignas de registo.
Casos clínicos
10.2 Caso clínico nº 2
Nome: Chico
Classe: Aves
Ordem: Psittaciformes
Espécie: Psittacus erithacus
Género: Indefinido
Data de Nascimento: Em 2006
Entrada: 2012-02-28
Saída: 2012-02-28
Motivo: Anorexia, apatia
Peso: 220g
A ave deu entrada na clínica com história de apatia e anorexia. Vivia numa gaiola na sala dos proprietários. Não tinha história de tóxicos inalatórios ou metais pesados. Proprietário teve um grupo de caturras que faleceram de um dia para o outro, cerca de 2 semanas antes da vinda do animal à consulta.
Foi internado e instituiu-se uma terapêutica de suporte, com recurso a coloides através de cateter intravenoso. Apresentava-se muito dispneico e fraco, com fezes muito escuras. Realizou-se hemograma e hematócrito, suspeitando-se de anemia grave. Fezes reagiam à água oxigenada, indicando possível presença de sangue nas fezes. Faleceu aquando da troca de sistema de soro com crise dispneica.
Realizou-se necropsia e foi possível observar dilatação do proventrículo e hemorragia da parede do mesmo. O seu conteúdo era escuro e tinha alimento por digerir. Esta coloração do conteúdo proventricular era idêntica à coloração das fezes, levando à confirmação de melena. As porções distais do proventrículo possuíam também conteúdo com a mesma coloração. Os sacos aéreos apresentavam ligeira opacidade, e identificou-se uma ligeira antracose nos sacos aéreos abdominais. Num dos sacos aéreos torácicos caudais era também visível uma lesão inflamatória focal circunscrita. Foi observada nefromegália e lesão hepática, sem hepatomegália.
Foram recolhidas algumas penas do peito para um possível estudo relacionado com bornavírus. O proventrículo foi também conservado em formol com este intuito. No entanto,
Casos clínicos
Figura 11 - Conteúdo no proventrículo, de cor escura, compatível com melena. Imagem gentilmente cedida por Centro Veterinário de Exóticos do Porto.