DEGRADAÇÃO FOTOCATALÍTICA DO CORANTE TÊXTIL
LARANJA II USANDO TiO
2E ZnO IMOBILIZADOS EM
PEÇAS CERÂMICAS
DISSERTAÇÃO DE MESTRADO EM ENGENHARIA DO AMBIENTE
MARTA ALEXANDRA CUNHA DUARTE PEREIRA
Dissertação apresentada à Universidade de Trás-os-Montes e Alto Douro, como parte dos requisitos para a obtenção do grau de Mestre em Engenharia do Ambiente.
Agradecimentos
A elaboração de uma dissertação de mestrado requer conhecimentos específicos e um grande esforço pessoal. O desenvolvimento deste trabalho não seria possível sem a colaboração de várias pessoas que me ajudaram e apoiaram ao longo das diversas fases. Gostaria, assim, de agradecer a todos os que de alguma forma, directa ou indirectamente, contribuíram para que a sua realização fosse possível:
- Aos meus orientadores científicos, Prof. Dr. José Alcides Peres e Doutor Marco Paulo Lucas, pelo estímulo, apoio, disponibilidade que sempre demonstraram, pela orientação no decorrer deste trabalho e também pela compreensão, paciência e conselhos.
- Ao Prof. Dr. João Labrincha e Doutora Paula Seabra, do Departamento de Engenharia de Materiais e Cerâmica da Universidade de Aveiro, pelo fornecimento das peças cerâmicas com TiO2 e ZnO depositados por serigrafia plana.
- Ao grupo do Laboratório de Águas do Departamento de Química da UTAD, pelo bom ambiente de trabalho que me proporcionou, em particular a ajuda voluntária do Sr. Carlos Matos. Ao Laboratório de Microbiologia Ambiental, o meu obrigado pela disponibilização das instalações laboratoriais e por toda a cooperação prestada pelo Sr. Luís Fernando. - À minha família pelo apoio fundamental, pela calma, por toda a confiança que depositaram em mim e pelo grande esforço tornando possível a realização desta dissertação de mestrado.
- A todos os meus amigos e colegas pelo apoio nos momentos menos bons, incentivando e estando sempre disponíveis sabendo dar um verdadeiro sentido à palavra amizade.
Resumo
A indústria têxtil caracteriza-se por gerar efluentes com uma elevada carga orgânica devido à manipulação de diversas soluções coradas envolvendo compostos químicos sintéticos resistentes em geral a tratamentos biológicos convencionais. A descarga deste tipo de efluentes pode causar grandes mudanças no meio receptor, traduzindo-se num grave problema ambiental.
Os corantes têxteis são compostos normalmente aplicados em solução e que se fixam de alguma maneira a um substrato. Podem ser classificados de acordo com a sua cor, natureza química e o método de aplicação. Os corantes azo são caracterizados pela dupla ligação entre átomos de azoto (-N=N-). Esta ligação define a cor do corante sendo o tipo de corante mais produzido a nível mundial e, consequentemente, o mais estudado no que diz respeito à sua remoção de efluentes líquidos. O corante Laranja II é um dos corantes azo com mais aplicabilidade na indústria têxtil, devido à sua fácil solubilidade em água e ao seu baixo preço.
Este trabalho teve como objectivo geral estudar a capacidade fotodegradativa do corante Laranja II, em solução aquosa, por camadas de TiO2 e ZnO depositadas por serigrafia plana em peças cerâmicas vidradas de uso comum. Para isso foram realizados ensaios para avaliar o efeito de diferentes variáveis como o pH, a temperatura, o tipo de fotocatalisador, a quantidade de fotocatalisador, a concentração de corante, a presença de agentes oxidantes e a intensidade de radiação UV.
O processo de descoloração do Laranja II envolveu soluções preparadas em laboratório sob o efeito de radiação UV. Os ensaios realizaram-se num reactor cilíndrico, construído para o efeito, onde foram dispostas previamente as peças cerâmicas. Foram avaliadas duas lâmpadas de vapor de mercúrio Heraeus (TNN 15/32 e TQ 150) como fonte de radiação.
O uso de catalisadores depositados em azulejos cerâmicos é uma técnica muito promissora, obtendo-se descolorações do Laranja II superiores a 90 %, revelando que sob radiação UV, com a lâmpada de vapor de mercúrio TNN 15/32, o TiO2 apresenta melhor desempenho com uma descoloração máxima de 98 % a uma taxa de 14,8x10-3 min-1 em 300 minutos à temperatura ambiente (≈ 20ºC). Com ZnO foi obtida uma descoloração máxima de 94 % a uma taxa de 9,7x10-3 min-1. A variação de pH não influenciou de forma significativa a capacidade fotodegradativa do TiO2. O desempenho das camadas activas é tanto mais eficaz quanto mais baixa a concentração inicial do corante a degradar. A adição de uma quantidade de H2O2 conduz a uma melhoria na descoloração do Laranja II, diminuindo o tempo reaccional para 120 minutos.
A deposição de óxidos em peças cerâmicas apresenta-se como uma boa alternativa ao uso de óxidos em suspensões, evitando a etapa de remoção dos óxidos no final do tratamento. Além disto são materiais de fácil limpeza e resistentes, apresentando uma grande fiabilidade podendo ser usados de forma sucessiva sem comprometer de forma significativa a capacidade fotodegradativa dos óxidos.
Palavras-chave: Efluentes têxteis, TiO2, ZnO, camadas serigrafadas, radiação UV, fotocatálise, descoloração de soluções aquosas de Laranja II, TNN 15/32 e TQ 150.
Abstract
Photocatalytic degradation of textile dye Orange II using TiO2 and ZnO immobilized
on ceramic tiles
The textile industry is characterized by producing effluents with a high organic content due to the manipulation of various solutions involving colored synthetic chemical compounds that are in general resistant to conventional biological treatments. The discharge of such effluents can cause major changes in the receptor, resulting in serious environmental problems.
The dyes are compounds usually applied in solution which are fixed in some way to a substrate. They can be classified according to its color, chemical nature and method of application. The azo dyes are characterized by a double bond between nitrogen atoms (-N = N-). This connection defines the color of the dye being the dye type most produced worldwide and consequently the most studied regarding their removal from wastewater. The dye Orange II is one of the azo dyes with large application in the textile industry, due to its solubility in water and its low price.
This study aimed to describe the overall photodegradation capacity of dye Orange II in aqueous solution by screen printing TiO2 and ZnO layers deposited on common glazed ceramic pieces. These assays were performed in order to study the effects of different parameters such as pH, temperature, type of photocatalyst, amount of photocatalyst, dye concentration, presence of oxidizing agents and UV radiation.
The decolorization process of solutions involved Orange II was prepared in laboratory under the influence of UV radiation. The assays were carried out in a cylindrical reactor, where there were previously arranged ceramic parts, and two Heraeus mercury vapor lamps were tested (TNN 15/32 and TQ 150) as radiation source.
The use of catalysts deposited on ceramic tiles is a very promising technique, resulting in an Orange II discoloration above 90%. UV radiation, with mercury vapor lamp TNN 15/32, shows the best performance with TiO2, achieving a maximum discoloration of 98% at 14.8 x10-3 min-1 in 300 minutes at room temperature (≈ 20 ° C). Using ZnO was obtained a maximum discoloration of 94% at 9.7 x10-3 min-1. The variation of pH did not influence significantly the ability of TiO2 photodecolourization. The performance of the active layer increases with the lowering of the initial dye concentration to degrade. Adding H2O2 to the precess leads to an improvement in the Orange II fading, reducing the reaction time to 120 minutes.
The deposition of oxides in ceramic tiles presents a good alternative to oxide suspensions, avoiding the removal step at the end of the treatment. Moreover, these materials are easily clean, resistant, presenting a high reliability which allows its continuous use without significant compromise of the photodegradative capacity.
Keywords: Textile effluents, TiO2, ZnO, screen-printed layers, UV radiation, photocatalysis, decolorization of Orange II aqueous solutions, TNN 15/32 and TQ 150.
Índice
Página
Índice de tabelas xv
Índice de figuras xvii
Lista de abreviaturas e símbolos xxi
1. Introdução 3
1.1. A importância da água 3
1.2. Os efluentes têxteis e a sua problemática 4
1.3. Corantes têxteis 6
1.3.1. Classificação dos corantes 6
1.4. Tratamentos convencionais de efluentes têxteis 9
1.5. Processos de Oxidação Avançados 10
1.5.1. Fotocatálise Heterogénea 12
1.5.2. Actividade fotocatalítica do TiO2 e ZnO 16
1.5.2.1. Dióxido de titânio (TiO2) 16
1.5.2.2. Óxido de zinco (ZnO) 20
1.6. Radiação ultravioleta (UV) 21
1.7. Objectivos do trabalho 23
2. Materiais e Métodos 27
2.1. Caracterização das camadas depositadas nas peças cerâmicas 27
2.2. Estudo de fotodescoloração 28
2.2.1. Corante Laranja II 28
2.2.2. Desenvolvimento experimental 30
2.2.3. Reactor experimental 32
2.2.4. Lâmpadas de vapor de mercúrio de baixa e média pressão 33
2.3. Técnicas de caracterização 35
2.3.1. Microscopia electrónica de varrimento (MEV) 35
2.3.3. Microscopia de força atómica (MFA) 36 2.3.4. Distribuição de tamanho de partículas (DTP) 37
2.3.5. Área superficial específica (BET) 37
2.3.6. Espectroscopia UV/Vis 38
3. Resultados e Discussão 43
3.1. Organização de resultados 43
3.2. Caracterização dos pós de ZnO e TiO2 44
3.2.1. Difracção de raio X (DRX) 44
3.2.2. Actividade fotocatalítica das suspensões de ZnO e TiO2 45 3.2.2.1. Efeito da concentração de dióxido de titânio 46 3.2.2.2. Efeito da concentração de óxido de zinco 50
3.3. Caracterização das camadas fotocatalíticas 52
3.4. Descoloração de soluções coradas de Laranja II por camadas fotocatalíticas
56
3.4.1. Ensaios com lâmpada de mercúrio de baixa pressão TNN 15/32 56
3.4.1.1. Comparação entre fotocatalisadores 56
3.4.1.2. Efeito do pH 60
3.4.1.3. Efeito da temperatura 62
3.4.1.4. Efeito da concentração inicial do Laranja II 64 3.4.1.5. Efeito da adição de peróxido de hidrogénio 66 3.4.2. Ensaios com lâmpada de mercúrio de média pressão TQ 150 69
3.4.2.1. Comparação entre fotocatalisadores 69
3.4.3. Comparação entre as lâmpadas utilizadas 71 3.5. Comparação entre suspensões de catalisador e azulejos serigrafados
com catalisador
73
4. Conclusões e sugestões de trabalho futuro 77
Índice de tabelas
Tabela 1.1 – Valores legais admissíveis para alguns parâmetros de descarga de
efluentes têxteis.
Tabela 1.2 – Potenciais de redução de alguns oxidantes químicos habitualmente usados. Tabela 1.3 – Processos de Oxidação Avançados.
Tabela 1.4 – Sistemas de fotocatálise heterogénea.
Tabela 3.1 – Ensaios realizados para o estudo da descoloração de soluções coradas de
Laranja II.
Tabela 3.2 – Resultados obtidos para a descoloração da solução Laranja II (20 mg/L)
com suspensões de TiO2.
Tabela 3.3 – Resultados obtidos para a descoloração da solução Laranja II (20 mg/L)
com suspensões de ZnO.
Tabela 3.4 – Comparação da actividade fotocatalítica dos catalisadores.
Tabela 3.5 – Composição química típica do vidrado de monoporosa que contacta com a
camada activa serigrafada.
Tabela 3.6 – Resultados obtidos para a descoloração da solução Laranja II (20 mg/L)
com catalisadores serigrafados em peças cerâmicas.
Tabela 3.7 – Resultados obtidos para a descoloração da solução Laranja II (20 mg/L)
para diferentes valores iniciais de pH, com camadas activas de TiO2.
Tabela 3.8– Comparação entre catalisadores na descoloração da solução Laranja II (20
mg/L) para pH básico.
Tabela 3.9 – Resultados obtidos para a descoloração da solução Laranja II (20 mg/L) a
diferentes temperaturas.
Tabela 3.10 – Resultados obtidos para a descoloração da solução Laranja II (20 mg/L)
com diferentes concentrações iniciais do corante com camadas activas de TiO2
.
Tabela 3.11 – Resultados obtidos para a descoloração da solução Laranja II (20 mg/L)
com adição de H2O2.
Tabela 3.12 – Resultados obtidos para a descoloração da solução Laranja II (20 mg/L)
com catalisadores serigrafados em peças cerâmicas sob o efeito de radiação UV (TQ 150).
Tabela 3.13 – Resultados obtidos para a descoloração da solução Laranja II (20 mg/L)
com lâmpada de vapor de mercúrio TNN 15/32 e TQ 150.
Tabela 3.14 – Resultados obtidos para a descoloração da solução Laranja II (20 mg/L)
com TiO2 e ZnO em suspensão e serigrafados em peças cerâmicas, sob o efeito de radiação UV (TNN 15/32).
Índice de figuras
Figura 1.1 – Esquema representativo do mecanismo de fotoactivação Figura 1.2 – Estruturas alotrópicas do TiO2: a) anatase; b) rutilo.
Figura 1.3 – Espectro de absorção do dióxido de titânio. Figura 1.4 – Dióxido de titânio.
Figura 1.5 – Óxido de zinco.
Figura 1.6 – Espectro de radiação electromagnética
Figura 2.1 – Azulejo cerâmico com camada de TiO2 depositada por serigrafia plana.
Figura 2.2 – Pormenor do azulejo cerâmico com camada de TiO2 depositada por serigrafia plana.
Figura 2.3 – Corante Laranja II.
Figura 2.4 – Estrutura molecular do corante Laranja II.
Figura 2.5 – Espectro de absorção UV-Vis do corante Laranja II.
Figura 2.6 – Disposição das peças cerâmicas com a fonte de radiação e agitador
magnético.
Figura 2.7 – Recolha de amostras de solução aquosa Laranja II. Figura 2.8 – Pormenor da colocação dos azulejos.
Figura 2.9 – Fotoreactor cilíndrico UV
Figura 2.10 – Pormenor da cobertura do reactor UV.
Figura 2.11 – Espectro de emissão da lâmpada de mercúrio de baixa pressão Heraeus
TNN 15/32 (Heraeus Noblelight GmbH).
Figura 2.12 – Espectro de emissão da lâmpada de mercúrio de média pressão Heraeus
TQ 150 (Heraeus Noblelight GmbH).
Figura 2.13 – Espectro electromagnético
Figura 2.14 – Relação entre a concentração de uma solução e a luz absorvida. Figura 3.1 – Curva de calibração do corante Laranja II.
Figura 3.2 – Difractograma do TiO2 Kronos (A – anatase).
Figura 3.4 – Fotodegradação da solução corada de Laranja II (20 mg/L), a pH 3,6 e a
uma temperatura de 20 ºC, com diferentes concentrações de TiO2, sob radiação UV (TNN 15/32).
Figura 3.5 – Linearização da curva correspondente à concentração 0,5 g/L de TiO2, da figura 3.4.
Figura 3.6 – Fotodegradação da solução corada de Laranja II (20 mg/L), a pH 3,6 e a
uma temperatura de 20 ºC, com diferentes concentrações de ZnO, sob radiação UV (TNN 15/32).
Figura 3.7 – Comparação entre as suspensões de catalisadores na descoloração do
Laranja II (20 mg/L), à temperatura ambiente e a pH 3,6.
Figura 3.8 – Difractograma da camada de ZnO serigrafada calcinada a 850 ºC (Z –
zincite).
Figura 3.9 – Difractograma da camada de TiO2 serigrafada calcinada a 850 ºC (A – anatase; R – rutilo).
Figura 3.10 – Micrografias de MEV das camadas activas serigrafadas de ZnO (50 g/m2) calcinadas a 850 ºC.
Figura 3.11 – Micrografias de MEV das camadas activas serigrafadas de TiO2 (50 g/m2) calcinadas a 850 ºC.
Figura 3.12 – Imagem de MFA das camadas de ZnO (50 g/m2), calcinadas a 850 ºC.
Figura 3.13 – Imagem de MFA das camadas de TiO2 (50 g/m2), calcinadas a 850 ºC.
Figura 3.14 – Fotodegradação da solução corada de Laranja II (20 mg/L), a pH 3,6 e a
uma temperatura de 20 ºC com lâmpada de Hg de baixa pressão (TNN 15/32).
Figura 3.15 – Exemplo de descoloração das soluções de Laranja II ao longo do tempo. Figura 3.16 – Descoloração da solução do corante Laranja II (20 mg/L) com camada
serigrafada de TiO2, sob irradiação de luz UV.
Figura 3.17 – Descoloração da solução do corante Laranja II (20 mg/L) com camada
serigrafada de ZnO, sob irradiação de luz UV.
Figura 3.18 – Fotodegradação da solução corada de Laranja II (20 mg/L) com lâmpada
de baixa pressão, a uma temperatura ambiente (≈ 20 ºC) por camada serigrafada de TiO2.
Figura 3.20 – Fotodegradação da solução corada de Laranja II (20 mg/L), a pH 3,6 e a
uma temperatura de 20 ºC.
Figura 3.21 – Fotodegradação da solução corada de Laranja II com várias
concentrações, a pH 3,6 a uma temperatura de 20 ºC por camada serigrafada de TiO2.
Figura 3.22 – Fotodegradação da solução corada de Laranja II (20 mg/L) com adição de
peróxido de hidrogénio, a pH 3,6 e a uma temperatura de 20 ºC.
Figura 3.23 – Fotodegradação da solução corada de Laranja II (20 mg/L) com adição de
peróxido de hidrogenio, a pH 3,6 e a uma temperatura de 20 ºC.
Figura 3.24 – Fotodegradação da solução corada de Laranja II (20 mg/L), a pH 3,6 e a
uma temperatura de 20ºC com lâmpada de média pressão (TQ 150).
Figura 3.25 – Fotodegradação da solução corada de Laranja II (20 mg/L), a pH 3,6 e a
uma temperatura de 20ºC com lâmpada de média pressão (TQ 150).
Figura 3.26 – Fotodegradação da solução corada de Laranja II (20 mg/L), a pH 3,6 e a
uma temperatura de 20ºC.
Figura 3.27 – Comparação entre catalisadores em suspensão (1,0 g/L), numa solução
Laranja II de 20 mg/L e catalisadores serigrafados em peças de cerâmica comuns, sujeitas a radiação UV com lâmpada de mercúrio de baixa pressão (TNN 15/32), a pH 3,6.
Lista de abreviaturas e símbolos
AFM Microscopia de Força Atómica
BC Banda de Condução
BET Brunauer, Emmett, Teller BV Banda de Valência
CAS Chemical Abstracts Service
CBO5 Carência Biológica de Oxigénio ao fim de 5 dias C.I. Color Index
Cps Contagens por segundo CQO Carência Química de Oxigénio C0 Concentração inicial do corante C Concentração do corante DRX Difracção de raios X
DTP Distribuição de Tamanhos de Partículas eV electrão volt
e-/h+ Electrão/lacuna k’a Constante cinética
ka Taxa aparente de reacção
kad Constante de equilíbrio de adsorção MEV Microscopia Electrónica de Varrimento pHzpc Ponto de carga zero
POA Processos de Oxidação Avançados r Velocidade de reacção de fotodegradação t1/2 Tempo de meia vida
UV Ultravioleta
Letras gregas
Comprimento de onda
1. Introdução
1.1. A importância da água
A água desempenha um papel fundamental nas funções vitais dos organismos vivos, sendo a sua qualidade crucial para a sobrevivência das espécies. É um recurso natural essencial, seja como componente bioquímico de seres vivos, como meio de vida de várias espécies vegetais e animais, como elemento representativo de valores sociais e culturais e até como fator de produção de vários bens de consumo final e intermediário.
A água é, provavelmente, o único recurso natural que está envolvido em todos os aspectos da civilização humana. Os recursos hídricos são utilizados para um grande número de actividades, como produção de energia e produção de alimentos, bem como para o desenvolvimento industrial, agrícola e económico.
A água ocupa cerca de 73 % da superfície da Terra, distribuindo-se pelos oceanos, biosfera, continentes, calotes polares e camadas da atmosfera. A maior percentagem de água é salgada correspondendo a cerca de 97 %. A massa de água doce representa apenas cerca de 3 % distribuídos pelas calotes polares, águas subterrâneas e superfície terrestre, na biomassa, lagos, solo e na forma de vapor na atmosfera. A maior parte da água doce existe como gelo nos pólos ou encontra-se inacessível devido à profundidade a que se encontra (Lucas, 2005).
Os processos antropogénicos têm uma grande influência na qualidade da água em todo o planeta, isto porque o homem utiliza, geralmente, os sistemas aquáticos como destino final dos resíduos gerados nas suas várias actividades. O uso da água pelo homem, desde a agricultura até às mais diversas actividades industriais, traduz-se no aumento de substâncias químicas nela dissolvidas, promovendo a diminuição da qualidade da água com a consequente produção de efluentes líquidos.
A indústria constitui um dos sectores de actividade que mais polui a água. Nos circuitos de produção, a água é utilizada como solvente ou reagente químico, na lavagem (com adição de detergentes), na tinturaria e no arrefecimento, acabando forçosamente por perder qualidade, de tal maneira que frequentemente se torna imprópria para quaisquer usos. Com elevadas cargas orgânicas, múltiplos compostos químicos e substâncias tóxicas essa água é lançada, directa ou indirectamente, nos rios, ribeiros, lagos e albufeiras, onde pode provocar graves desequilíbrios ecológicos e a morte de muitas espécies. Por outro lado, pode infiltrar-se no solo, contaminando as águas subterrâneas, cujas consequências para a saúde pública podem ser muito delicadas.
Os sectores industriais que mais contribuem para a geração de poluentes e consequente contaminação da água são a indústria de refinação de petróleo, a indústria química, têxtil e agro-alimentar, bem como a utilização de óleos para transporte e aquecimento, a utilização de pesticidas, de fertilizantes e de detergentes. Além destes sectores há a considerar os efluentes de estações de tratamento de águas residuais (ETAR), o lançamento descontrolado de resíduos perigosos e os derrames acidentais (Ollis et al., 1989).
Na tentativa de resolver estes problemas tem aumentado a procura de novas tecnologias, aplicáveis ao tratamento de efluentes domésticos e industriais, que sejam mais eficientes, com menores custos e que privilegiem a componente ambiental.
1.2. Os efluentes têxteis e a sua problemática
As principais causas de poluição das águas que se enfrentam actualmente estão associadas às descargas de efluentes sem qualquer tratamento ou com tratamento deficiente. A indústria têxtil é um sector particularmente crítico, devido à manipulação de diversas soluções coradas, envolvendo compostos químicos sintéticos resistentes a tratamentos biológicos convencionais.
A principal origem dos efluentes gerados pela indústria têxtil é proveniente dos processos de lavagem, tingimento e acabamento. Estima-se que 12% dos corantes têxteis utilizados anualmente são perdidos durante o processo de tingimento, 20% dessas perdas entram nos meios hídricos naturais (Santos, 2001), sendo uma das principais fontes de poluição desses meios. O sector de acabamentos da indústria têxtil merece um destaque especial, pois utiliza grandes quantidades de água e de produtos químicos, produzindo enormes volumes de efluentes corados (Geada, 2006).
Os efluentes provenientes da indústria têxtil são caracterizados por possuírem uma cor bastante acentuada, uma vez que parte do corante inicial não é fixado na fibra durante o processo de tingimento, e uma elevada concentração de compostos orgânicos dificilmente biodegradáveis, de natureza química variada e elevada carência química em oxigénio (CQO). Podem ainda apresentar concentrações elevadas de metais pesados como, por exemplo, crómio, cobre ou mercúrio usados, por vezes, na formulação de corantes (Lucas, 2005).
Os efluentes têxteis são constituídos por diversas substâncias que podem ser agrupadas da seguinte forma (Rego, 2008):
Substâncias flutuantes: óleos e gorduras que em pequena quantidade se vão fixando e mantendo nas fibras através do processo produtivo;
Substâncias suspensas sedimentáveis: pequenos e grandes restos de fibras e malhas, restos de produtos de acabamento;
Substâncias suspensas não sedimentáveis: detergentes, solventes;
Substâncias dissolvidas: sais inorgânicos (cloretos, sulfatos), sais orgânicos (sais de ácido acético e ácido fosfórico), reagentes oxidantes e redutores;
Diferentes tipos de corantes.
As características dos efluentes têxteis são bastante variáveis quanto aos tons e concentrações de cor, o que torna mais difícil quantificar a cor de um efluente industrial.
A descarga deste tipo de efluentes pode causar acentuadas mudanças de coloração dos rios, originando alterações nos ciclos biológicos, afectando os processos de fotossíntese devido à redução da penetração da luz. Isto traduz-se em graves problemas, não só do ponto de vista estético, mas também devido à sua toxicidade para a vida aquática bem como ao potencial carácter mutagénico para os seres humanos (Geada, 2006; Lucas, 2005).
Neste contexto, é de grande importância investir em estudos dedicados ao desenvolvimento de novos processos para o tratamento adequado de efluentes industriais, como são o caso dos efluentes têxteis, e no qual se integra esta dissertação. Para além do tratamento é necessário haver um controlo do uso de água neste sector, com vista a reduzir o volume e a toxicidade dos efluentes produzidos, e introduzir modificações nos processos de produção e reutilização das águas.
Relativamente à legislação em vigor, as águas residuais da indústria têxtil são reguladas pela Portaria nº 423/97, de 25 de Junho. Esta portaria define os limites admissíveis de descarga para os parâmetros: pH, CBO5, CQO e cor (Tabela 1.1). Aos restantes parâmetros são aplicáveis as normas gerais de descarga reguladas pelo Decreto-Lei nº 236/98, de 1 de Agosto.
Tabela 1.1 – Valores legais admissíveis para alguns parâmetros de descarga de efluentes têxteis
(Lucas, 2005).
Parâmetro Valor médio
pH 5,5 – 9
CBO5 100 mg O2/L
CQO 250 mg O2/L
1.3. Corantes têxteis
Os corantes são materiais normalmente aplicados em solução e que se fixam de alguma maneira a um substrato, podendo ser classificados de acordo com a sua cor, natureza química e método de aplicação. Podem ser, por exemplo, divididos em dois grandes grupos: naturais e sintéticos.
O uso de corantes pelo Homem é, desde o início da Humanidade, uma realidade. Desde a pintura e coloração das suas roupas, da sua pele bem como dos ambientes por ele ocupados, como rochas, cavernas, etc. A larga disponibilidade de pigmentos inorgânicos, de origem natural, como óxidos de manganês, hematite e ocre, facilitou a utilização por parte dos primeiros seres humanos de “corantes” usados para as mais diversas funções. Os corantes orgânicos naturais, originários principalmente de plantas, insectos, fungos e líquenes, foram desde sempre utilizados preferencialmente como corantes de tecidos.
No ano de 1856 iniciou-se, pelo químico inglês William Perkin, a produção de corantes sintéticos. Perkin, numa tentativa de sintetizar quinina, fármaco muito importante no tratamento da malária (paludismo), obteve inadvertidamente uma substância azulada com excelentes propriedades de coloração que posteriormente veio a ser apelidada de anilina púrpura. Assim se deu início a uma linha de produção do referido corante, tendo posteriormente surgido novos corantes artificiais. No início do século XX o mercado de corantes sintéticos estava muito próximo de suplantar o mercado de corantes naturais.
Segundo Immich (2006), actualmente mais de 90% dos corantes utilizados são sintéticos, sendo a indústria têxtil o sector que mais utiliza estes corantes. Idealmente, os corantes devem ser estáveis à luz, apresentarem uma distribuição uniforme, propiciarem um elevado grau de fixação, resistirem ao processo de lavagem e à transpiração, tanto inicialmente como após uso prolongado.
Em geral uma molécula de corante aplicada no tingimento de fibras têxteis pode ser dividida em dois grupos: o cromóforo e o funcional. O grupo cromóforo dá a cor ao composto pela absorção de uma parte de energia radiante, proveniente da presença das ligações duplas conjugadas. O grupo funcional é responsável pela fixação à fibra.
1.3.1. Classificação dos corantes
Existem vários tipos de corantes com as mais diversas aplicações. Alguns exemplos são os corantes reactivos, directos, ácidos, de cuba, dispersos, pré-metálicos, sulfurosos entre outros, encontrando-se compilados no Color Index (C.I.) que é editado desde 1924 pela Society of Dyers and Colourists. Os corantes também podem ser
classificados consoante a sua estrutura química (azo, antraquinona, etc). De entre os vários tipos de corantes existentes, a família azo constitui a maior e mais importante classe de corantes orgânicos sintéticos usados na indústria têxtil, sendo utilizados no tingimento de fibras celulósicas, seda, viscose e poliamida (Miranda, 2009).
1.3.1.1. Corantes ácidos
Estes corantes representam o maior grupo de corantes, usados principalmente no tingimento de fibras contendo azoto. São compostos aniónicos, com elevada solubilidade em água. A fixação do corante à fibra é moderada, e como não sofrem degradação química no final do processo podem ser reutilizados. O adjectivo ácido refere-se ao pH adquirido pelo banho de tingimento na presença destes corantes, devido aos seus grupos ácidos da estrutura molecular (Rego, 2008; Lucas, 2005).
1.3.1.2. Corantes reactivos
Esta classe de corantes é a mais usada actualmente pois são compostos coloridos e têm uma elevada solubilidade em água. Após hidrólise formam ligações covalentes com grupos -OH, -NH, ou -SH presentes nas fibras (algodão, lã, seda e poliamidas). Isto assegura uma excelente fixação e estabilidade da cor no substrato, impedindo a sua reutilização (Rego, 2008; Lucas, 2005).
1.3.1.3. Corantes directos
São corantes constituídos por moléculas grandes com elevada afinidade para fibras de celulose. São moléculas aniónicas, planas, longas e são solúveis em água sendo estas moléculas retidas nas fibras por ligações de van der Waals e pontes de hidrogénio. Durante o processo de aplicação, grande parte do corante é consumido, contribuindo para uma diminuição do seu conteúdo no efluente final (Rego, 2008; Lucas, 2005).
1.3.1.4. Corantes básicos
São compostos catiónicos, usados para corar fibras contendo grupos ácidos (fibras sintéticas), resultando numa fixação elevada. A sua acção concretiza-se através da ligação aos grupos ácidos dos corantes. Estes corantes apresentam uma solubilidade moderada em água (Rego, 2008; Lucas, 2005).
1.3.1.5. Corantes dispersos
Estes compostos são neutros e hidrofóbicos ou pouco solúveis em água à temperatura dos banhos de tingimento. Formam soluções coloidais dispersas, tornando necessário a dilatação das fibras para que ocorra coloração: por aumento da temperatura (>120ºC) ou através do auxílio de um adjuvante. As moléculas não sofrem alterações químicas, daí poderem ser reutilizadas em novos processos de tingimento (Rego, 2008; Lucas, 2005).
1.3.1.6. Corantes de cuba
São insolúveis em água, amplamente usados para o tingimento de fibras de celulose. O método de coloração é baseado na solubilidade dos corantes na sua forma reduzida. Reduzidos com hidrogenossulfito de sódio, a forma reduzida solúvel impregna os tecidos efectuando-se assim o tingimento. Seguidamente é promovida a oxidação do corante para regressar à sua forma insolúvel e permanecer, assim, aderente às fibras (Rego, 2008; Lucas, 2005).
1.3.1.7. Corantes pré-metálicos
São caracterizados por apresentarem um ião metálico (crómio, níquel, cobre, etc) ligado à molécula do corante numa proporção de 1:1 ou 1:2. Estes compostos têm uma percentagem de fixação muito elevada, podendo o corante residual ser reutilizado. A sua aplicação é feita geralmente em poliamidas. A elevada presença de metais nos efluentes provenientes do processo de tingimento constitui um problema a nível ambiental (Rego, 2008).
1.3.1.8. Corantes sulfurosos
São complexos aromáticos poliméricos com anéis heterocíclicos contendo enxofre. O tingimento com corantes sulfurosos envolve, tal como para os corantes de cuba, fenómenos de redução e oxidação, facilitando a sua aplicação. São principalmente usados para o tingimento de fibras de celulose. A desvantagem a nível ambiental associada a este tipo de corantes consiste na elevada concentração de sulfuretos (Lucas, 2005).
Os corantes que não são completamente esgotados nas operações de tingimento, e os não fixados nas fibras e removidos pelas lavagens pós tingimento, irão contribuir para a cor e permanecer no efluente final.
Os corantes azo são caracterizados pela dupla ligação entre átomos de azoto (-N=N-) que se unem aos grupos benzeno e naftaleno presentes na estrutura molecular do corante. A ligação azo define a cor do corante e está associada aos grupos cromóforos. Tendo em consideração o número de grupos azo os corantes podem ser classificados ainda em diazos (dois grupos), triazos (três grupos), ou poliazos (mais do que três grupos).
Este tipo de corante é o mais produzido a nível mundial e consequentemente o mais estudado no que toca à sua remoção dos efluentes líquidos. A dificuldade em ser degradado por bactérias aeróbias e a sua cor faz com que a libertação destes compostos seja prejudicial ao ambiente, constituindo uma potencial fonte cancerígena. Neste sentido é necessário promover uma eficaz eliminação de corantes azo em efluentes líquidos.
1.4. Tratamentos convencionais de efluentes têxteis
Devido à complexidade, variedade e natureza química dos corantes presentes nos efluentes têxteis, não há um método universal para o seu tratamento. A escolha da estratégia a utilizar no tratamento de efluentes têxteis depende de vários factores: o(s) tipo(s) de corante(s) a remover, a composição química do efluente e respectivas concentrações, o destino dos subprodutos formados, o caudal a tratar, entre outros. Cada método possui limitações, pelo que a combinação de vários processos é a mais adequada devido à presença nos efluentes de corantes que, normalmente, são resistentes à degradação e são fotoestáveis (Geada, 2006).
Os métodos utilizados para o tratamento de efluentes têxteis envolvem um tratamento preliminar, sobretudo de natureza físico-química, tendo em vista a remoção de sólidos grosseiros, material inerte sedimentável, óleos e gorduras. Genericamente os tratamentos convencionais podem ser classificados como primários, secundários ou biológicos e terciários. Os mais utilizados são tecnologias de adsorção (carvão activado, adsorventes inorgânicos, resinas de permuta iónica e bioadsorventes naturais e sintéticos), coagulação/floculação e processos de membranas (osmose inversa + ultrafiltração). No entanto, a eficiência destes métodos depende do tipo de corantes presentes nas águas residuais, sendo assim limitada a sua aplicação (Lucas, 2005).
Entre os processos físicos existentes para a remoção de corantes em efluentes têxteis, a adsorção suscita grande interesse por associar baixos custos a elevadas taxas de remoção. Por não se tratar de um método destrutivo, a adsorção possibilita a
recuperação do corante sem perda da sua identidade química. No entanto, as tecnologias de adsorção encontram-se ainda limitadas ao volume de caudal produzido, pois para caudais elevados estas tecnologias são inviáveis dado que os adsorventes utilizados saturariam em muito pouco tempo, obrigando à sua regeneração.
A coagulação/floculação química consiste na desestabilização das partículas coloidais presentes na água por adição de um reagente, que é constituído por catiões polivalentes livres ou ligados a uma macromolécula orgânica, e posterior aglomeração em flocos que facilitam um posterior processo de sedimentação.
O tratamento biológico por lamas activadas permite uma remoção eficiente da carga de corantes presentes no efluente têxtil. Infelizmente existe o problema do tratamento e destino das lamas, pois o teor de corantes adsorvido é bastante elevado, inviabilizando qualquer hipótese de valorização das mesmas. O tratamento biológico anaeróbio tem apresentado bons resultados na remoção de cor dos efluentes têxteis. Contudo, estes processos apresentam como principal desvantagem a potencial conversão dos corantes têxteis em subprodutos mais tóxicos do que os corantes iniciais. Este aumento de toxicidade deve-se à quebra das ligações azo com a consequente formação de aminas aromáticas cancerígenas.
Algumas destas técnicas limitam-se à transferência de fase dos contaminantes, não permitindo a eliminação definitiva dos corantes, gerando uma grande quantidade de lamas que necessitam de tratamento específico e/ou posterior deposição em locais adequados. Assim, é conveniente a selecção de um processo de tratamento que permita a remoção total da cor do efluente final, de preferência sem a produção de lamas, com evidentes vantagens do ponto de vista económico, estético e ambiental. Neste sentido os processos de oxidação avançados aparecem como métodos de remoção de corantes dos efluentes têxteis com elevado potencial (Lucas, 2005).
1.5. Processos de Oxidação Avançados
Os Processos de Oxidação Avançados (POA) são uma metodologia emergente e promissora para a degradação de poluentes orgânicos fortemente persistentes, refractários a outros tratamentos de remediação/descontaminação ambiental. O conceito foi inicialmente estabelecido, em 1987, por Glaze, que definiu como POA o processo de tratamento de água, a temperaturas e pressões próximas das normais, que envolvem a geração de espécies radicais muito reactivas e com elevada capacidade oxidante, principalmente radicais hidroxilo (HO).
Os POA são capazes de produzir alterações profundas na estrutura química dos comtaminantes, procurando atingir uma degradação definitiva do poluente. Em alguns
casos é suficiente ocorrer uma oxidação parcial dos poluentes, possibilitando a sua posterior degradação através de processos biológicos. Poderão também ser utilizados como métodos de pós-tratamento para efectuar uma afinação final das águas antes da respectiva descarga nos meios receptores. Têm potencialidade para se integrar nos tratamentos biológicos provocando uma degradação oxidativa de substâncias tóxicas ou refractárias que entram ou deixam a fase biológica.
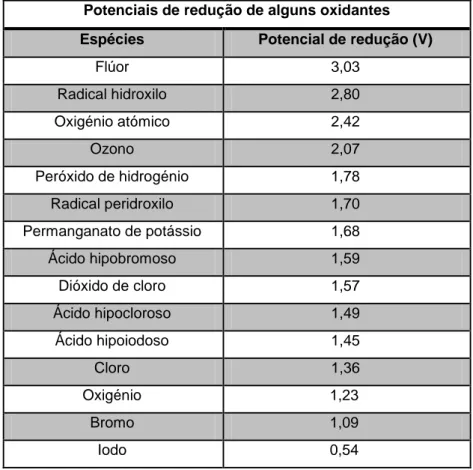
A eficiência destes sistemas é baseada na produção de espécies oxidantes fortes, como os radicais hidroxilo (HO•) que apresentam um potencial de redução padrão de +2,80 V (Tabela 1.2), e que são responsáveis pela degradação dos compostos orgânicos presentes em efluentes. O mecanismo de reacção envolve normalmente a abstracção de um átomo de hidrogénio ou a adição a ligações insaturadas carbono-carbono, iniciando uma sequência de reacções oxidativas que podem conduzir à mineralização completa do contaminante orgânico (Lucas, 2005). A versatilidade destes processos é reforçada pelo facto de oferecerem diferentes possibilidades de produção de radicais hidroxilo, permitindo um melhor cumprimento com os requisitos específicos de tratamento.
Tabela 1.2 – Potenciais de redução de alguns oxidantes químicos habitualmente usados (Legrini et al., 1993; Domènech et al., 2001).
Potenciais de redução de alguns oxidantes
Espécies Potencial de redução (V)
Flúor 3,03 Radical hidroxilo 2,80 Oxigénio atómico 2,42 Ozono 2,07 Peróxido de hidrogénio 1,78 Radical peridroxilo 1,70 Permanganato de potássio 1,68 Ácido hipobromoso 1,59 Dióxido de cloro 1,57 Ácido hipocloroso 1,49 Ácido hipoiodoso 1,45 Cloro 1,36 Oxigénio 1,23 Bromo 1,09 Iodo 0,54
Para formar os radicais hidroxilo é comum estes processos envolverem a utilização de poderosos oxidantes, como ozono (O3) e peróxido de hidrogénio (H2O2), sendo também usual a sua combinação com catalisadores e/ou radiação. Considera-se que a utilização destes compostos fica muito dispendiosa, pelo que devem substituir, sempre que possível, os tratamentos mais económicos como a degradação biológica. Existe uma lista de diferentes possibilidades de POA que podem ser observados na seguinte tabela (Andreozzi, 1999):
Tabela 1.3 – Processos de Oxidação Avançados
H2O2/Fe2+ (Fenton) H2O2/Fe3+
H2O2/Fe2+ (Fe3+)/UV (Foto-Fenton) H2O2/Fe3+ - Oxalato Mn2+/ácido oxálico/O3 Óxido/h/O2 (Fotocatálise) O3/H2O2 O3/UV H2O2/UV
Processos de degradação fotocatalítica, assistidos por um óxido semicondutor (fotocatalisador), têm ganho importância no tratamento de efluentes, por serem considerados tecnologias limpas, podendo em muitas situações garantir a total mineralização dos poluentes, sem o problema de gerar resíduos após o processo. Os POA permitem a remoção de compostos orgânicos poluentes, recalcitrantes e outros, por conversão destes em produtos finais inorgânicos (CO2, H2O, etc) (Rego, 2008; Pires, 2010).
1.5.1. Fotocatálise heterogénea
Uma das opções entre os POA é a fotocatálise heterogénea (Tabela 1.4), onde a solução e o fotocatalisador se encontram em fases distintas, geralmente em sistemas líquido/sólido (suspenso ou fixo num material de suporte). Já foram realizados vários estudos no âmbito da fotocatálise heterogénea, obtendo-se resultados muito promissores para a degradação de poluentes (Rego, 2008; Pires, 2010; Marcos et al, 2008).
Tabela 1.4 – Sistemas de fotocatálise heterogénea (Tarelho, 2011). Fotocatálise Heterogénea
Com radiação Sem radiação
*Semicondutor/UV Reagente Fenton
*Semicondutor/UV/H2O2
*Semicondutor (TiO2, ZnO, CdS, ZnS, WO3, entre outros).
A origem da fotocatálise heterogénea remonta à década de setenta do século passado, quando pesquisas com células fotoelectroquímicas começaram a ser desenvolvidas tendo como objectivo a produção de combustível a partir de materiais baratos. A primeira vez que foi possível a aplicação da fotocatálise na descontaminação foi através de trabalhos realizados por Pruden e Ollis, que demonstraram a total mineralização de clorofórmio e tricloroetileno em iões inorgânicos durante a iluminação de suspensões de um semicondutor. Devido à sua potencialidade na descontaminação de poluentes, a fotocatálise heterogénea tem vindo a ser alvo de interesse por diversos grupos de pesquisa por todo o mundo (Colpini et al, 2006)
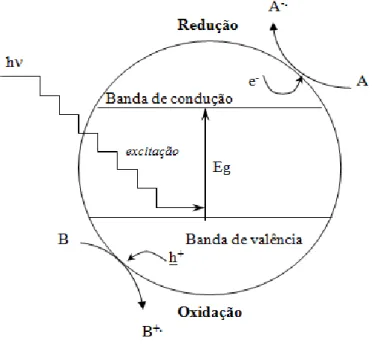
O princípio da fotocatálise heterogénea consiste na iluminação de um fotocatalisador por uma fonte de luz (natural ou artificial), com energia superior ou igual à da banda proibida (“band-gap”), formando um par electrão/lacuna (e-/h+). Os pares electrão/lacuna podem recombinar-se ou migrar para a superfície do fotocatalisador, reagindo com espécies adsorvidas, e originando sítios oxidantes e redutores (Figura 1.1). Nestes sítios podem ocorrer reacções com as espécies do meio, actuando tanto na degradação de poluentes orgânicos e formar dióxido de carbono e água, como na redução de metais presentes sobre a superfície do óxido (Miranda, 2009; Santos, 2007).
Figura 1.1 – Esquema representativo do mecanismo de fotoactivação
A fotocatálise heterogénea tem sido amplamente estudada para decompor corantes orgânicos dissolvidos em água usando semicondutores sob irradiação. Entre esses semicondutores, têm sido estudados especialmente o dióxido de titânio (TiO2) e o óxido de zinco (ZnO) na degradação de poluentes, devido à sua não toxicidade, fotossensibilidade e estabilidade química numa ampla faixa de pH (Daneshvar et al, 2007; Marto et al, 2009; Colpini et al, 2006).
Portanto, tomando como catalisador o TiO2, quando irradiado promove electrões da banda de valência para a banda de condução ( ), originando lacunas na banda de valência ( ) (equação 1.1).
(1.1)
Podem então ocorrer dois tipos de reacções de oxidação que envolvem a transferência de um electrão a partir do substrato adsorvido (equação 1.2) ou a partir de moléculas de solvente adsorvidas à superfície do TiO2 (H2O e HO-) produzindo, neste caso, radicais hidroxilo (equações 1.3 e 1.4).
(1.2)
(1.4)
A possibilidade de haver uma elevada concentração de moléculas de H2O e de HO- adsorvidas à superfície do semicondutor, parece ter grande importância no processo de degradação oxidativa. A adsorção destas moléculas ao semicondutor origina radicais hidroxilo, que por sua vez, desencadeiam as reacções de oxidação que resultam na degradação dos compostos orgânicos presentes no meio.
A competição entre o processo em que o electrão é retirado da superfície do semicondutor e o processo de recombinação do par electrão/lacuna, do qual resulta na libertação de calor, (equação 1.5) vai determinar a eficiência da fotocatálise.
(1.5)
Os processos de fotocatálise heterogénea surgem como métodos promissores porque não envolvem temperaturas nem pressões elevadas, necessitam de uma quantidade de energia relativamente pequena e constituem processos ambientalmente “limpos”.
A equação seguinte (1.6) mostra o processo de degradação de compostos orgânicos, conduzindo à mineralização em dióxido de carbono e água.
Poluentes orgânicos + O2
radiação UV or
semicondut
CO2 + H2O + sais inorgânicos (1.6)
Em função das dificuldades impostas pela necessidade de remover o fotocatalisador no final do processo, muitos estudos têm sido realizados com o objetivo de desenvolver sistemas que operem com semicondutores imobilizados. Têm sido reportados sistemas de imobilização em vidro (na forma de placas, esferas e anéis), aço, titânio e materiais cerâmicos diversos. Além disso, o uso de partículas em suspensão pode diminuir a eficiência da radiação UV.
Um suporte adequado deve apresentar boa estabilidade mecânica, ser transparente à radiação UV, favorecer forte ligação físico-química com as partículas de TiO2 e ZnO, sem afectar negativamente a reactividade delas, apresentar uma elevada área superficial, apresentar boa capacidade de adsorção para os compostos orgânicos a serem degradados e ser quimicamente inerte. Para este trabalho, o dióxido de titânio e o
óxido de zinco foram depositados em peças cerâmicas, devido ao seu baixo custo e facilidade de fabricação.
1.5.2. Actividade fotocatalítica do TiO2 e ZnO
As principais características de um semicondutor fotocatalítico para a degradação de contaminantes orgânicos são a libertação de radicais hidroxilo associada à energia de “band-gap” e a sua estabilidade por um período de tempo prolongado. Os semicondutores que actuam como fotocatalisadores possuem uma região de baixa energia, conhecida como banda de valência (BV), onde os electrões não possuem movimento livre, e a outra região de alta energia, chamada de banda de condução (BC), produzindo condutividade eléctrica similar aos metais. Entre essas duas regiões, existe a zona de “band-gap”, a qual é a energia mínima necessária para excitar o electrão e promovê-lo da banda de valência para a banda de condução (Santos, 2007).
De entre os vários semicondutores, o TiO2 e o ZnO são os mais aplicados em estudos de uma grande variedade de problemas ambientais, com o objectivo de tratar a água, mostrando-se bastante eficientes.
1.5.2.1. Dióxido de titânio (TiO2)
O impulso para o uso do dióxido de titânio como fotocatalisador foi dado por Fujishima e Honda em 1972. Segundo estudos realizados, de entre os vários semicondutores disponíveis, o TiO2 (anatase) é considerado o mais eficiente dada a sua grande eficiência, insolubilidade em fase aquosa e não toxicidade.
O TiO2 possui três formas alotrópicas: rutilo, anatase e brookite, sendo o rutilo e a anatase as fases mais comuns. A anatase e o rutilo (Figura 1.2) possuem estrutura tetragonal, com o átomo de Ti coordenado octaedricamente por seis átomos de oxigénio equidistantes (Campos, 2009).
Figura 1.2 – Estruturas alotrópicas do TiO2: a) anatase; b) rutilo (Campos, 2009).
As energias da banda proibida, para a anatase e rutilo, são estimadas em 3.2 e 3.0 eV, respectivamente. A forma anatase é preferível para a fotodegradação, visto a forma rutilo apresentar uma baixa reacção fotocatalítica, isto é, a região da banda de condução na forma anatase é mais favorável para conduzir reacções conjugadas envolvendo electrões (Campos, 2009).
Para usar a anatase em fotocatálise heterogénea é necessário que o comprimento de onda da radiação ultravioleta seja inferior a 388 nm (Pires, 2010). A intensidade da radiação também é importante na reacção fotocatalítica.
Apesar de ser dos fotocatalisadores mais eficientes, o TiO2 apresenta algumas limitações, tais como a taxa de degradação lenta devido à recombinação dos electrões e lacunas e o facto de, de acordo com os valores de energia da banda proibida da anatase e do rutilo, o processo de fotodegradação ser activado somente pela radiação UV. A radiação solar também é pouco eficiente pois possui apenas 5% de radiação UV (Neppolian et al, 2001) (Figura 1.3). A solução para isto poderá passar pela dopagem do TiO2 com iões metálicos.
Figura 1.3 – Espectro de absorção do dióxido de titânio.
Na maioria dos estudos realizados de tratamento de águas, utiliza-se como fotocalisador suspensões de TiO2 (Figura 1.4). Isto requer uma posterior filtração ou centrifugação do TiO2 da solução, aumentando assim os custos e a dificuldade no tratamento de águas. Dos resultados obtidos por diversos autores, deduz-se que existe uma relação directa entre a velocidade de degradação e a concentração do catalisador, pelo menos até a um valor limite de concentração do catalisador, a partir do qual as velocidades se tornam independentes. A explicação para a existência desse valor limite consiste nas condições de operação e a opacidade resultante de uma elevada concentração de catalisador tendo como consequência a diminuição da eficiência de absorção dos fotões pelas partículas do catalisador (Santos, 2001).
Figura 1.4 – Dióxido de titânio.
A imobilização em vidro (na forma de placas, esferas e anéis), aço, titânio e materiais cerâmicos diversos tem sido reportada, geralmente recorrendo ao método sol-gel como preparação dos pós. Este tipo de materiais apresenta grande potencial uma vez que garantem uma elevada eficiência na fotodegradação, contornando o problema da posterior extracção do óxido.
Os parâmetros ideais na degradação de corantes usando o TiO2 como fotocatalisador são geralmente: pH baixo, elevada intensidade de luz, baixa concentração inicial e adição de peróxido de hidrogénio como aceitador de electrões (Gupta et al, 2011; Liu et al, 2005).
Um outro parâmetro importante é o oxigénio dissolvido. É atribuído ao oxigénio dissolvido um papel importante na inibição do processo de recombinação dos pares electrão-lacuna formados pela excitação das partículas de TiO2.
A forma comercial do TiO2 (Degussa P25), produzido pela Evonik Degussa (Essen, Alemanha), tornou-se o fotocatalisador padrão nos estudos da fotocatálise heterogénea para aplicação ambiental, devido à sua elevada taxa observada na degradação de vários poluentes orgânicos. Segundo Seabra et al (2011), a actividade fotocatalítica de um pó é directamente proporcional à sua área superficial específica. Através de imagens MEV de vários tipos de titânia, verificaram que o Degussa P25 apresentava o tamanho mais baixo de partículas, tendo uma maior área superficial específica e daí poder apresentar uma melhor actividade fotocatalítica.
Por outro lado, a prevalência da fase anatase é crucial para assegurar a actividade fotocatalítica. Este aspecto deve ser considerado quando as camadas depositadas nas peças cerâmicas sofrem um tratamento térmico para assegurar a adesão desejável da camada ao substrato, uma vez que a transformação de anatase para rutilo deve ocorrer a qualquer instante. Tendo isto em conta o TiO2 Kronos parece ser o mais adequado, pois a fase de rutilo aparece a partir dos 750 ºC, sendo a sua quantidade significativa a partir dos 1050 ºC (Seabra el al, 2011).
Nos dias de hoje, as aplicações comerciais com o dióxido de titânio podem ser diversas, destancando-se:
Superfícies auto-limpantes - onde são aplicadas em materiais de construção utilizados em superfícies externas, uma vez que estão expostos à luz solar e precipitação;
Purificação do ar - na descontaminação, desodorização e desinfecção do ar interior;
Superfícies auto-esterilizantes - que são particularmente utilizados em hospitais e instituições para idosos, onde o controlo de vírus e bactérias é de grande importância (Campos, 2009).
Os materiais de construção onde o catalisador é aplicado podem ser vários, desde cerâmicas, vidros, filmes plásticos, materiais para telhados, cimento, entre outros. Estes
materiais revestidos com catalisador vêm sendo comercializados no Japão desde a década de 90, e recentemente noutros países. Os benefícios associados a esta técnica consistem na protecção dos edifícios contra poeiras, chuvas ácidas e estragos causados por poluentes e pela radiação, mantendo-os limpos e com aparência de novos (Campos, 2009).
Geralmente os sistemas convencionais de purificação do ar interior filtram os poluentes, que se acumulam nos filtros levando a uma redução da sua capacidade de uso. Os filtros fotocatalíticos são capazes de decompor as substâncias orgânicas ao invés de acumulá-las, além de possuir em capacidade bactericida. No Japão já existem empresas especializadas em purificadores de ar fotocatalíticos. O público-alvo desse mercado inclui hospitais, instituições para idosos, lojas de animais, escritórios, salas para fumadores, hotéis, escolas, restaurantes, indústrias alimentares, além de outros ambientes que necessitam de purificação do ar interno (Campos, 2009).
Azulejos revestidos com TiO2 já são comercializados no Japão para uso auto-esterilizante. Espera-se que em pouco tempo, materiais deste tipo possam ter diversas aplicações médicas como em paredes de hospitais, instrumentos médicos, uniformes, entre outros (Campos, 2009).
1.5.2.2. Óxido de zinco (ZnO)
Como alternativa ao TiO2 tem sido estudado o ZnO (Figura 1.5) como fotocatalisador. O semicondutor ZnO apresenta uma capacidade fotocatalítica similar. Assim como o TiO2, apresenta como características principais a grande disponibilidade, baixo custo e não ser tóxico.
Figura 1.5 – Óxido de zinco.
A sua aplicação no tratamento de efluentes com diferentes poluentes pode resultar na completa degradação dos contaminantes. A grande vantagem do ZnO é que absorve mais o espectro solar do que o TiO2, o que faz com que seja considerado o fotocatalisador ideal para a utilização da energia solar (Santos, 2007). Um dos problemas
relacionados com este fotocatalisador é a fotocorrosão que geralmente ocorre ao ser iluminado pela radiação UV, o que resulta na queda da atividade fotocatalítica em solução aquosa.
Vários autores relatam que a eficiência da descoloração aumenta com a diminuição da concentração inicial do corante e com o aumento da intensidade de luz UV. Estudos realizados também revelaram que o método de preparação do ZnO era um factor decisivo para a actividade fotocatalítica, ao contrário do tamanho e a morfologia dos pós de ZnO (Marto et al, 2008).
Estudos já realizados mostraram que as camadas de TiO2 e ZnO serigrafadas em peças cerâmicas de uso comum têm um comportamento bastante promissor na degradação de compostos corados. Rego (2008) observou que sob radiação visível artificial com 10 horas de exposição, o ZnO originou uma descoloração máxima do Laranja II de 80 % a uma taxa de 3,0x10-3 min-1, e para o TiO2 foi obtido um valor de 70 % de descoloração a uma taxa de 1,9x10-3 min-1, provando que as camadas são eficazes na fotodegradação de soluções coradas simples. Por exposição à radiação solar também foram obtidos resultados interessantes por volta dos 75 % para os dois óxidos ao fim de 10 horas.
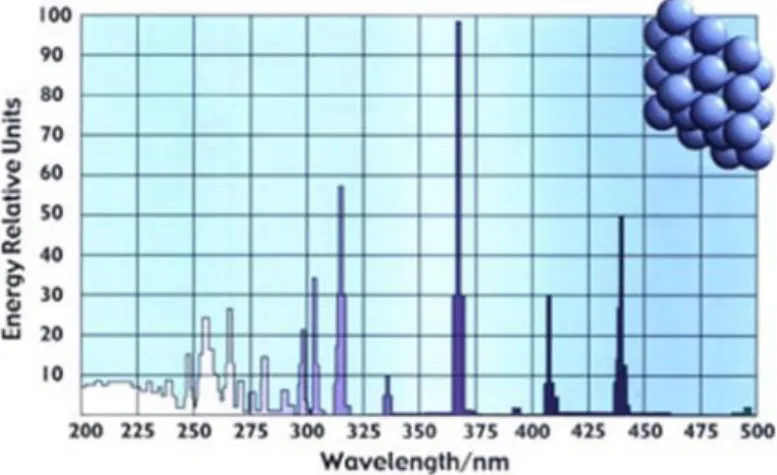
1.6. Radiação ultravioleta (UV)
A radiação UV é a parte do espectro eletromagnético (Figura 1.6) referente aos comprimentos de onda entre 100 e 400 nm e ocupa no espectro a região entre os raios-X e o visível. Pode ser classificada nos seguintes tipos: UV-A, UV-B, UV-C e UV-Vácuo.
A região UV-Vácuo, situada entre os 100 e os 200 nm, tem particular interesse para os POA, uma vez que estas radiações são absorvidas pela água de acordo com a seguinte equação:
(1.7)
formando espécies altamente reactivas capazes de oxidar poluentes presentes na água. A radiação UV produz os fotões necessários para iniciar as reacções fotocatalíticas. A energia destes fotões depende da intensidade da luz fornecida e do seu comprimento de onda, quanto maior essa energia, maior a quantidade de radicais oxidantes libertados no meio onde se dá a reacção. Para um comprimento de onda fixo, a taxa de degradação aumenta com o aumento da intensidade da luz, podendo esta relação ser linear, para baixas intensidades, ou não linear.
As lâmpadas mais utilizadas nos processos fotoquímicos de degradação de poluentes em solução aquosa são as de arco de vapor de mercúrio, que por sua vez se dividem em arcos de baixa, média e elevada pressão.
A activação/ionização por colisão dos electrões e o seu retorno para um estado de energia inferior é o princípio de produção de luz no sistema. Neste tipo de lâmpadas, os átomos de mercúrio excitados por uma descarga eléctrica entre dois eléctrodos, emitem radiação quando regressam ao seu estado fundamental. Este processo pode ser expresso como E1 – E0 = h, isto é, os comprimentos de onda obtidos dependem da diferença de energia entre o estado excitado (E1) e o estado fundamental (E0).
A aplicação da radiação ultravioleta ao tratamento de águas resume-se principalmente ao tratamento terciário do efluente. Isto devido à baixa eficiência da fotodissociação, resultante da necessidade de absorção da radiação incidente pelo contaminante, limitando a aplicação desta tecnologia à escala industrial. O emprego de lâmpadas de UV tem-se verificado na maximização da acção de outras tecnologias de geração de radicais hidroxilo. São exemplo os sistemas UV/H2O2, UV/O3, UV/H2O2/Fe, UV/TiO2, entre outros (Lucas, 2005).
Durante o processo de absorção da radiação UV por parte de um óxido, juntamente com a presença de moléculas de água, há formação de substâncias que possuem um forte poder oxidante (radicais hidroxilos), as quais vão reagir com compostos orgânicos e inorgânicos, provocando a sua dissociação e assim contribuindo para a sua degradação. A este efeito oxidante junta-se o facto do dióxido de titânio quando sujeito à radiação ultravioleta reduzir o ângulo de atrito interno da água nalguns
casos, tornando a superfície do material hidrofílica, o que contribui para o aumento do efeito-autolimpante. A energia da radiação UV é maior comparada com a energia de “band gap” do catalisador, por isso o problema da recombinação do par electrão/lacuna pode ser evitado usando a radiação UV como fonte luminosa.
O óxido de zinco possui quase a mesma energia de “band-gap” que o dióxido de titânio. No entanto, sua capacidade fotocatalítica poderá não ser a mesma, visto que frequentemente ocorre fotocorrosão diante de iluminação UV, e este fenómeno é considerado como uma das principais razões resultantes da diminuição da atividade fotocatalítica do óxido de zinco em soluções aquosas.
1.7. Objectivos do trabalho
Como a legislação ambiental está cada vez mais severa, é necessário o desenvolvimento de tecnologias eficientes e baratas para o tratamento de efluentes.
Neste trabalho o objectivo fundamental será verificar a capacidade de fotodegradação do corante Laranja II, em solução aquosa, por camadas de TiO2 e ZnO depositadas por serigrafia plana em peças cerâmicas vidradas de uso comum. Com este propósito serão estudados os efeitos de diferentes variáveis como o pH, a temperatura, o tipo de fotocatalisador, a dosagem de fotocatalisador, a concentração do corante e a intensidade de radiação UV.
2. Materiais e métodos
2.1. Caracterização das camadas depositadas nas peças cerâmicas
No Departamento de Engenharia de Materiais e Cerâmica da Universidade de Aveiro depositaram-se, em azulejos cerâmicos convencionais, camadas activas de dióxido de titânio (Kronos) (Figuras 2.1 e 2.2) e de óxido de zinco pela técnica de serigrafia plana. A caracterização dos pós foi feita por difracção de raios X e a distribuição granulométrica foi obtida por dispersão laser. Os pós de TiO2 e ZnO têm um tamanho médio de partícula de 0,29 μm e 0,50 μm respectivamente. Através da técnica de BET foi possível determinar a área superficial específica dos pós, sendo a do TiO2 de 12,94 m2/g e a de ZnO 1,56 m2/g.
Figura 2.1 – Azulejo cerâmico com camada de TiO2 depositada por serigrafia plana.
A técnica de serigrafia plana consiste em vazar uma tinta com o agente suspenso sobre uma tela e sobre a qual é exercida pressão com uma espátula de borracha ao longo da peça. Para depositar as camadas activas, de TiO2 e ZnO, colocaram-se os pós em suspensão (1:1 % m/m) num meio orgânico apropriado (NF 1281 – CERANDRO) e serigrafaram-se as camadas através de diferentes aberturas de malha (55 e 136 μm). De seguida, as camadas depositadas (50 g/m2) sofreram um processo de cozedura à temperatura de 850 ºC considerada a temperatura ideal de acordo com trabalhos já realizados (Rego, 2008).
A morfologia das camadas serigrafadas foi avaliada por microscopia electrónica de varrimento (MEV), difracção de raio X (DRX) e microscopia de força atómica (AFM). Este processo anterior ao estudo da fotodegradação do Laranja II foi realizado no Departamento de Engenharia de Materiais e Cerâmica da Universidade de Aveiro.
2.2. Estudo de fotodegradação
2.2.1. Corante Laranja II
Para avaliar a capacidade fotocatalítica dos azulejos com camadas serigrafadas de dióxido de titânio e óxido de zinco, efectuaram-se estudos com um composto modelo. Seleccionou-se um corante têxtil bastante utilizado: o corante Laranja II (Figura 2.3).
Figura 2.3 – Corante Laranja II.
Informações adicionais acerca do Laranja II:
Designações alternativas: Laranja II, 2-naphthol orange, C.I. 15510
Número CAS: 633-96-5
Fórmula molecular: C16H11N2NaO4S (sal de sódio)
Aspecto físico: pó alaranjado
Ponto de fusão: 164 ºC
Solubilidade em água: 116 g/L (30 ºC)
O corante Laranja II é um corante monoazo aniónico com muita aplicabilidade na indústria têxtil devido a ser solúvel em água e relativamente barato. É utilizado amplamente para tingir lã, fibras de algodão, seda, papel e couro. É um corante razoavelmente fotoestável se for submetido à luz solar, por isso o uso de um fotocatalisador na presença de luz solar ou UV parece bastante promissor (Bansal, 2009). A sua estrutura molecular é representada a seguir (Figura 2.4).
Figura 2.4 – Estrutura molecular do corante Laranja II.
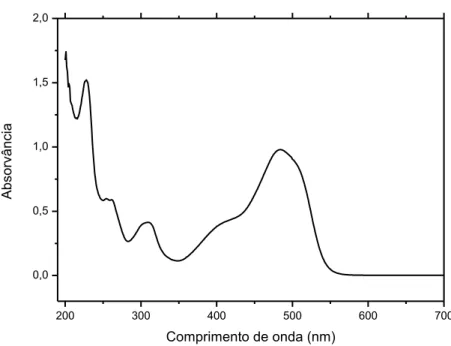
Em fase aquosa, existem duas formas em equilíbrio, a forma azo e a forma hidrazona como mostra a figura 2.4, devido a uma transferência protónica intramolecular muito rápida. Analisando o espectro UV-Vis deste corante (Figura 2.5) observa-se que o Laranja II apresenta três picos de absorção característicos a 228, 254 e 310 nm provenientes dos anéis aromáticos e um ombro a 430 nm. O pico a 484 nm sugere a presença da forma hidrazona enquanto o ombro a 430 nm indica a presença da forma azo reflectindo a estrutura conjugada formada pela ligação azo (Pinto, 2008).
200 300 400 500 600 700 0,0 0,5 1,0 1,5 2,0 Ab so rvâ n ci a Comprimento de onda (nm)
Figura 2.5 – Espectro de absorção UV-Vis do corante Laranja II.
2.2.2. Desenvolvimento experimental
Na realização das experiências foram preparadas soluções aquosas de Laranja II de concentração 20 mg/L, dissolvendo o corante em água destilada.
Entretanto, no reactor cilíndrico colocavam-se duas peças cerâmicas, com camadas de dióxido de titânio ou óxido de zinco, dispostas frente a frente, tendo em posição intermédia a lâmpada UV (Figura 2.6) e deitava-se a solução aquosa de Laranja II. Considerando que se depositou inicialmente um teor de 50 g de TiO2 (ou ZnO) por m2 de azulejo, é possível deduzir o valor de TiO2 aproximadamente depositado a partir das dimensões de cada azulejo. Assim, para azulejos com as dimensões de 10 cm x 19,9 cm que foram utilizados neste estudo, obtém-se uma área de 0,0199 m2 e um teor de 0,995 g de TiO2, ou seja, um valor aproximado de 1,0 g de TiO2 por azulejo. Para os azulejos de ZnO o raciocínio e os resultados são similares.