Universidade de Trás-os-Montes e Alto Douro
Aplicação do inibidor da tirosina cinase, fosfato de
toceranib, no mastocitoma canino
Dissertação de Mestrado em Medicina Veterinária
Olga Violante Vieira de Sousa Orientador:
Professora Doutora Felisbina Luísa Pereira Guedes Queiroga Co-orientador:
Professor Doutor Pachi Clemente Vicario
Universidade de Trás-os-Montes e Alto Douro
Aplicação do inibidor da tirosina cinase, fosfato de
toceranib, no mastocitoma canino
Dissertação de Mestrado em Medicina Veterinária
Olga Violante Vieira de Sousa Orientador: Professora Doutora Felisbina Luísa Pereira Guedes Queiroga Co-orientador: Professor Doutor Pachi Clemente Vicario
Composição do Júri:
Doutora Isabel Cristina Ribeiro Pires Doutora Felisbina Luísa Queiroga
Doutora Paula Alexandra Martins de Oliveira
ii RESUMO
O mastocitoma é uma neoplasia comum no cão, representando cerca de 7 a 21% de todas as neoplasias cutâneas e 11 a 27 % de todos os tumores malignos nesta espécie. O seu comportamento biológico é extremamente variável, podendo tratar-se de uma simples massa perfeitamente localizada ou de uma grave doença metastática.
Apesar das inúmeras pesquisas efetuadas, a etiopatogenia do mastocitoma canino não se encontra totalmente esclarecida. Sabe-se no entanto que esta é provavelmente multifatorial. Ao longo dos últimos anos, vários investigadores sugeriram que as mutações no proto-oncogene c-kit, que codifica o recetor c-kit, podem estar associadas com a patogénese desta neoplasia.
O fosfato de toceranib (Palladia®, Pfizer) é um inibidor da tirosina cinase administrável por via oral que exibe uma potente atividade inibidora contra os membros da
split-kinase receptor family, incluindo o recetor para o fator de crescimento do endotélio
vascular (VEGFR), o recetor para o fator de crescimento derivado das plaquetas (PDGFR) e o recetor c-kit. A sua ação sobre o mastocitoma canino foi demonstrada em vários artigos.
Neste estudo realizou-se uma revisão bibliográfica atualizada sobre o mastocitoma canino, dando mais ênfase às novas técnicas terapêuticas. No entanto, o objetivo fundamental deste trabalho consistiu na análise de cinco cães com mastocitomas múltiplos de grau II e III que foram tratados com fosfato de toceranib (Palladia®). Após a análise, concluiu-se que o Palladia® tem atividade biológica contra o mastocitoma, sugerindo que a sua adição ao tratamento deste tumor pode melhorar o seu resultado global.
iii ABSTRACT
Dogs have an unique risk of developing cutaneous mast cell tumor which account for 7% to 21% of all skin tumors and 11% to 27% of all malignant tumors in this species. Their biological behavior is extremely variable, it may be a simple mass perfectly located or a serious metastatic disease.
Despite numerous researches, the etiopathogenesis of canine mast cell tumors is not fully understood. It is known however that it is probably multifactorial. Over the past few years, several investigators have suggested that mutations in proto-oncogene c-kit, encoder of the the c-kit receptor, may be associated with the pathogenesis of this cancer.
The toceranib phosphate (Palladia®, Pfizer) is a tyrosine kinase inhibitor, orally bioavailable compound, which exhibits a potent inhibitory activity against members of the split-kinase receptor family, including vascular endothelial growth factor receptor (VEGFR), platelet derived growth factor receptor (PDGFR) and c-kit receptor. Its action on the canine mast cell tumor has been demonstrated in several articles.
In this study the canine mast cell tumor was reviewed using all available literature, assuming more emphasis on the new therapeutic techniques. Nevertheless, the primary objective of this study was the analysis of five dogs with multiple mast cell tumors of grade II and III that were treated with toceranib phosphate (Palladia®). After the analysis it was concluded that the Palladia® has biologic activity against mast cell tumor, suggesting that its addition to the treatment of this tumor may improve overall outcome.
iv ÍNDICE GERAL
ÍNDICE DE FIGURAS ...vii
ÍNDICE DE QUADROS...vii
LISTA DE ABREVIATURAS, SIGLAS E ACRÓNIMOS ... viii
AGRADECIMENTOS... x 1. INTRODUÇÃO ... 1 1.1. O Mastócito ... 1 1.1.1. Diferenciação ... 1 1.1.2. Recetores membranares ... 2 1.1.3. Funções biológicas ... 3 1.2. Mastocitoma canino ... 4 1.2.1. Etiopatogenia ... 4 1.2.2. Epidemiologia... 5 1.2.2.1. Idade ... 5 1.2.2.2. Raça ... 6 1.2.2.3. Sexo ... 6
1.2.3. Localização e aspeto clínico ... 7
1.2.4. Diagnóstico ... 8
1.2.4.1. Síndromes paraneoplásicos ... 8
1.2.4.2. Citologia tumoral ... 9
1.2.4.3. Citologia dos gânglios linfáticos regionais ...10
1.2.4.4. Imagiologia ...10
1.2.4.5. Análise hematológica, bioquímica e análise de urina...11
1.2.4.6. Esfregaço da camada flogística (buffy coat smear) ...11
1.2.4.7. Citologia da medula óssea ...12
1.2.4.8. Graduação histológica ...12
1.2.4.9. Estadiamento clínico ...14
1.2.5. Prognóstico ...16
1.2.5.1. Localização e aspeto tumoral ...16
1.2.5.2. Raça, sexo e idade ...17
1.2.5.3. Taxa de crescimento e tamanho da massa tumoral ...17
1.2.5.4. Metastização e reincidência ...18
1.2.5.5. Sinais sistémicos ...18
v
1.2.5.7. Grau histológico ...19
1.2.5.8. Proliferação tumoral ...20
1.2.5.8.1. Índice mitótico ...20
1.2.5.8.2. Regiões organizadoras nucleolares argirófilas (AgNORs) ...20
1.2.5.8.3. Antigénio proliferativo celular nuclear (PCNA) ...21
1.2.5.8.4. Ki-67 ...21
1.2.5.8.5. C-kit ...21
1.2.6. Tratamento ...23
1.2.6.1. Mastocitomas de grau I e II sem envolvimento dos linfonodos ...23
1.2.6.2. Mastocitomas de grau I e II com envolvimento dos linfonodos ...25
1.2.6.3. Mastocitomas de grau III ...25
1.2.6.4. Mastocitomas metastáticos ou recidivantes ...26
1.2.6.5. Quimioterapia oncológica ...27
1.2.6.6. Radioterapia ...29
1.2.6.7. Tratamento médico dos sinais sistémicos ...30
1.2.6.8. Outros tratamentos ...30
1.2.6.8.1. Eletroquimioterapia ...30
1.2.6.8.2. Terapia fotodinâmica ...31
1.2.6.8.3. Modificadores da resposta biológica (BRM) ...32
1.2.6.8.4. Instilação de soluções hipotónicas ...32
1.2.6.8.5. Inibidores da tirosina cinase (TKIs) ...33
1.2.6.8.5.1. Fosfato de toceranib (Palladia® ) ...34
1.2.6.8.5.2. Masitinib (Kinavet® ou Masivet®) ...35
1.2.6.8.5.3. Mesilato de imatinib (Gleevec®) ...36
1.2.6.8.5.4. Toxicidades dos inibidores da tirosina cinase ...36
1.2.6.8.6. Tratamentos futuros ...37
2. OBJETIVOS ... 39
3. CASOS CLÍNICOS ... 40
3.1. Caso clínico número 1 ...40
3.1.1. Anamnese ...40 3.1.2. Exame físico ...40 3.1.3. Diagnósticos diferenciais ...41 3.1.4. Exames complementares ...41 3.1.5. Diagnóstico ...42 3.1.6. Tratamento ...42
vi
3.1.7. Evolução clínica ...42
3.2. Caso clínico número 2 ...45
3.2.1. Anamnese ...45 3.2.2. Exame físico ...46 3.2.3. Exames complementares ...46 3.2.4. Diagnóstico ...47 3.2.5. Tratamento ...47 3.2.6. Evolução clínica ...47
3.3. Caso clínico número 3 ...48
3.3.1. Anamnese ...48 3.3.2. Exame físico ...49 3.3.3. Exames complementares ...50 3.3.4. Diagnóstico ...50 3.3.5. Tratamento ...51 3.3.6. Evolução clínica ...51
3.4. Caso clínico número 4 ...52
3.4.1. Anamnese ...52 3.4.2. Exame físico ...53 3.4.3. Exames complementares ...54 3.4.4. Diagnóstico ...54 3.4.5. Tratamento ...54 3.4.6. Evolução clínica ...54
3.5. Caso clínico número 5 ...56
3.5.1. Anamnese ...56 3.5.2. Exame físico ...56 3.5.3. Exames complementares ...57 3.5.4. Diagnóstico ...57 3.5.5. Tratamento ...57 3.5.6. Evolução clínica ...58
4. DISCUSSÃO DOS CASOS CLÍNICOS ... 59
5. CONCLUSÃO ... 67
vii ÍNDICE DE FIGURAS
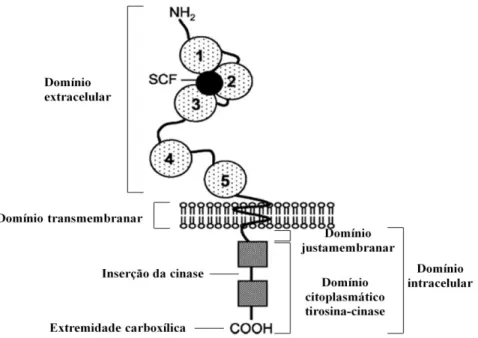
Figura 1: Representação esquemática do recetor c-kit (adaptado por Voytyuk et al., 2003). ... 2
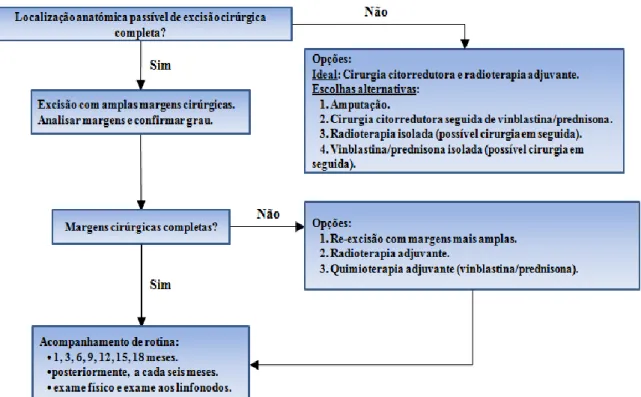
Figura 2: Abordagem terapêutica em mastocitomas de grau I ou II de estádio 0 e I (adaptado por Thamm e Vail, 2007). ...24
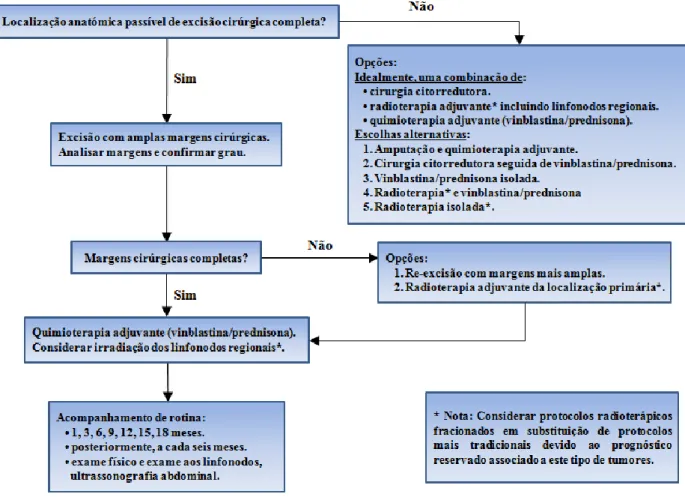
Figura 3: Abordagem terapêutica em mastocitomas de grau III (adaptado por Thamm e Vail, 2007). ...26
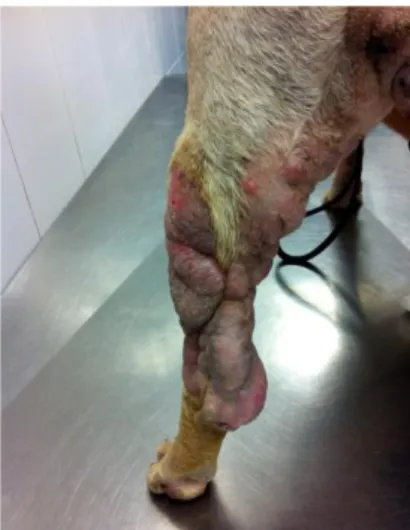
Figura 4: Aspeto clínico dos nódulos cutâneos da Lusitânia. ...41
Figura 5: Citologia da massa tumoral da Lusitânia. ...42
Figura 6: Aspeto clínico dos nódulos cutâneos da Lusitânia na primeira reavaliação (19/10/2011). ...43
Figura 7: Aspeto clínico dos nódulos cutâneos da Lusitânia na quarta reavaliação (28/11/2011). ...43
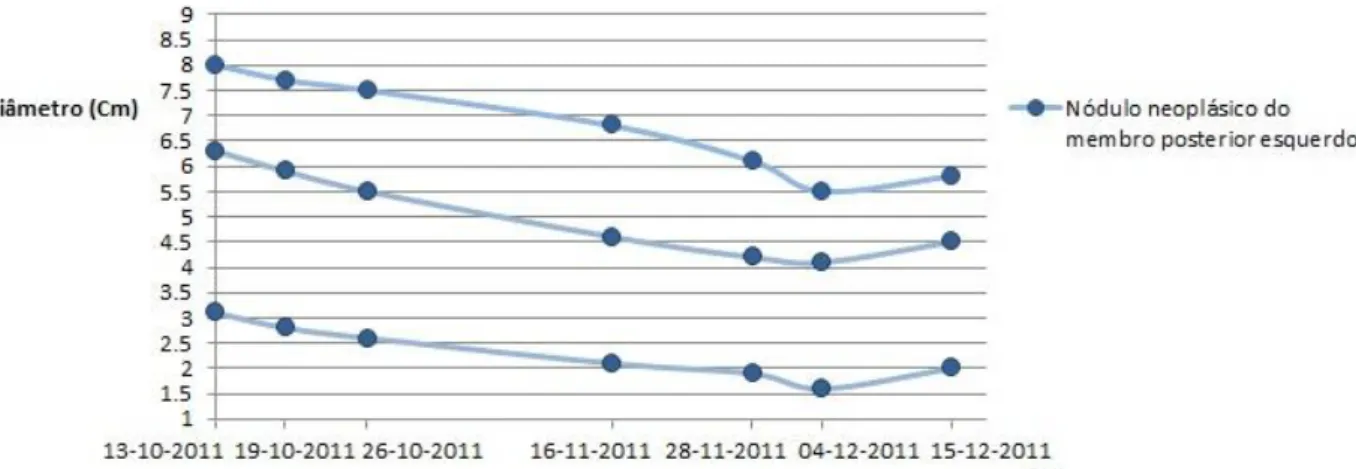
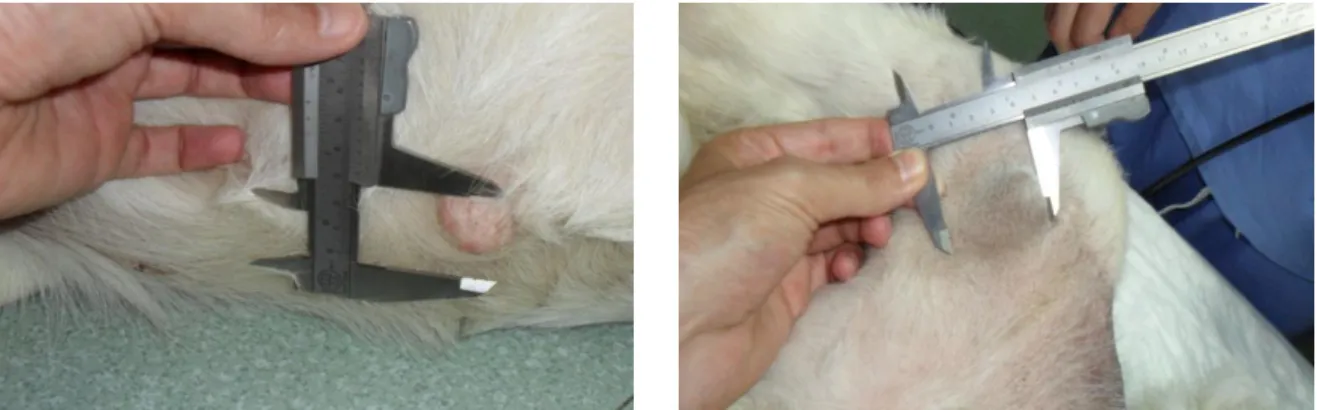
Figura 8: Evolução do diâmetro dos nódulos neoplásicos da Lusitânia. ...43
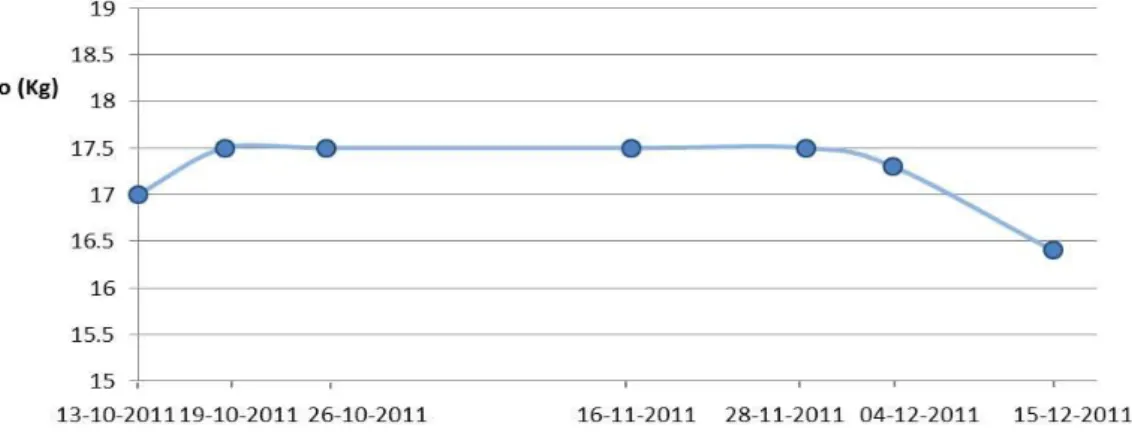
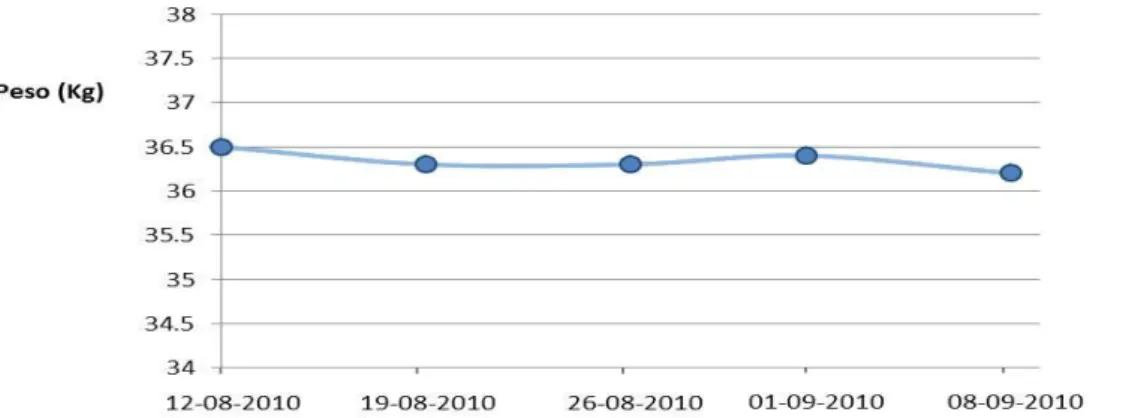
Figura 9: Evolução do peso da Lusitânia. ...44
Figura 10: Imagem ecográfica do baço da Lusitânia. ...45
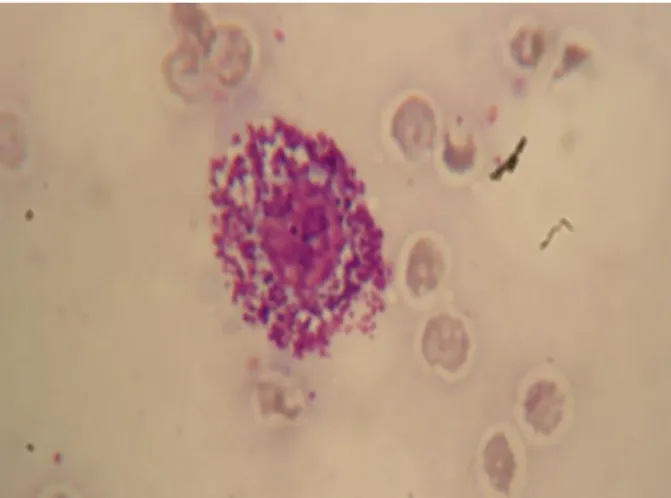
Figura 11: Esfregaço da camada flogística da Lusitânia. ...45
Figura 12: Aspeto clínico dos nódulos cutâneos da Luna. ...46
Figura 13: Evolução do peso da Luna. ...48
Figura 14: Evolução do diâmetro dos nódulos neoplásicos da Luna. ...48
Figura 15: Aspeto clínico dos nódulos cutâneos da Daisy. ...50
Figura 16: Evolução do peso da Daisy. ...52
Figura 17: Evolução do diâmetro dos nódulos neoplásicos da Daisy. ...52
Figura 18: Aspeto clínico dos nódulos cutâneos da Maya. ...53
Figura 19: Evolução do peso da Maya. ...55
Figura 20: Evolução do diâmetro dos nódulos neoplásicos da Maya. ...55
Figura 21: Aspeto clínico dos nódulos cutâneos da Sam. ...57
Figura 22: Evolução do peso da Sam...58
Figura 23: Evolução do diâmetro dos nódulos neoplásicos da Sam. ...58
ÍNDICE DE QUADROS Quadro 1: Sistema de estadiamento da Organização Mundial de Saúde para mastocitomas (Welle et al., 2008). ...15
Quadro 2: Sistema de estadiamento clínico para mastocitomas proposto por London (2010b). ...16
Quadro 3: Relação entre o prognóstico do mastocitoma e o sistema de Patnaik et al. (1984). ...19
Quadro 4: Principais fármacos utilizados como tratamento de suporte no mastocitoma canino (Welle et al., 2008)...30
Quadro 5: Inibidores da tirosina cinase em cães e gatos (adaptado por London, 2009). ...33
viii
LISTA DE ABREVIATURAS, SIGLAS E ACRÓNIMOS
ADN Ácido desoxirribonucleico
AgNOR’s Regiões organizadoras nucleolares ALT Alanina aminotransferase
ATP Adenosina trifosfato
ATRA All-trans retinoic acid (ácido retinóico all-trans) BCG Bacilo de Calmette-Guérin BID Duas vezes ao dia
BRM Modificadores da resposta biológica
CCNU 1-[2-chloroethyl]3-cyclohexyl-1-nitrosurea (Lomustina) cm Centímetro
ex. Exemplo
FAS Fosfatase alcalina sérica
FcεRI Recetor de alta afinidade para a porção FC da Imunoglobulina E
g Grama
Gy Gray
hCG Gonadotrofina coriónica humana
HVCEU Hospital Veterinário Clínico da Universidade Cardenal Herrera IgE Imunoglobulina E IgG Imunoglobulina G IL Interleucina IV Via intravenosa IM Índice mitótico IM Via intramuscular
ITD Duplicações internas em tandem MCT Mast cell tumor (mastocitoma)
mg Miligrama
mg/cm3 Miligrama por centímetro cúbico n Número de observações
OMS Organização Mundial de Saúde PAAF Punção Aspirativa por Agulha Fina PCNA Antigénio proliferativo nuclear das células
ix
PDGFR Recetor para o fator de crescimento derivado das plaquetas PO Via per os
QID Quatro vezes ao dia QOD A cada 48 horas RC Resposta completa RNA Ácido ribonucleico RP Resposta parcial SC Via subcutânea SCF Stem cell Factor SID Uma vez por dia TID Três vezes ao dia
TKI Inibidor da tirosina cinase TLR Recetores toll-like
TRC Tempo de repleção capilar
VEGFR Recetor para o fator de crescimento do endotélio vascular ® ou TM Marca registada
µg/kg Micrograma por quilograma µl Microlitro
x AGRADECIMENTOS
À Universidade de Trás-os-Montes e Alto Douro, particularmente ao excelentíssimo Senhor Reitor, Professor Doutor Carlos Alberto Sequeira.
À minha orientadora, Professora Doutora Felisbina Luísa Queiroga, pelo seu caráter e exigência, pelo constante apoio e dedicação tão necessários nesta última etapa do meu percurso académico.
Ao meu co-orientador, Professor Doutor Pachi Clemente Vicario, pela sua boa disposição, positivismo e por ter partilhado comigo a sua experiência e sabedoria.
Ao Hospital Veterinário Clínico da Universidade Cardenal Herrera, que me acolheu de braços abertos, contribuindo para a minha formação profissional e crescimento pessoal.
A todos os professores e médicos veterinários da Universidade de Trás-Os-Montes e Alto Douro, por me terem dado os pilares da minha formação académica.
À equipa de médicos veterinários e estagiários que me acompanharam durante o estágio no Hospital Veterinário Clínico da Universidade Cardenal Herrera.
À Vera Pereira e Hélia Ferreira, as minhas eternas companheiras de estágio, por me apoiarem e tornarem este último ano bem mais divertido.
A todos os meus amigos, pelos bons momentos passados, pela entreajuda e amizade. Ao meu namorado, por estar sempre ao meu lado tanto nos bons como nos maus momentos, o amor realmente faz milagres.
Às minhas irmãs, por serem o meu porto de abrigo, por acreditarem em mim e por me ensinarem que na vida sempre que se fecha uma porta abre-se uma janela.
Aos meus pais, por me apoiarem sempre, por todos os sacrifícios que fizeram por mim, e por me ensinarem que tudo é possível para quem acredita.
“Por vezes, a nossa luz apaga-se e é reacendida por uma faísca de outra pessoa. Todos nós temos motivos para pensar com profunda gratidão naqueles que acenderam a chama dentro de nós” Albert Schweitzer (1875-1965).
1 1. INTRODUÇÃO
1.1. O Mastócito
A descoberta do mastócito foi efetuada em 1877 por Paul Ehrlich, que ao investigar a afinidade tintorial de diversos tecidos se deparou com células altamente granuladas as quais inicialmente denominou de “mastzellen”. O primeiro mastócito canino foi identificado por Bashford em 1905 e o termo “mastocitoma” foi mencionado pela primeira vez por Bloom em 1952 (Strefezzi et al., 2009). O mastócito é uma célula relativamente grande (8 a 20 µm), pleomórfica (redonda, oval, poligonal ou fusiforme), com um núcleo esférico, central ou ligeiramente descentrado e que possuí grânulos citoplasmáticos que variam entre 0,2 a 1,5 µm de diâmetro. Os mastócitos podem ser facilmente reconhecidos nos tecidos quando adequadamente fixados e corados metacromaticamente com corantes catiónicos, como o azul de toluidina e o Giemsa, que se ligam aos proteoglicanos presentes nos seus grânulos cioplasmáticos (Strefezzi et al., 2009; Tizard, 2009). Estes grânulos contêm mediadores inflamatórios incluindo aminas bioativas (histamina e serotonina), proteases (triptase, β-hexoaminidase, β-glucuronidase, β-D-galactosidase, Catepsina G e carboxipeptidase), prostaglandinas D2, citocinas, interleucinas e metabolitos de ácidos araquidónicos. Conferindo aos mastócitos um papel importante nas reações imunológicas, inflamatórias e alérgicas (Metcalfe et al., 1997; Tizard, 2009; London, 2010).
Os mastócitos estão amplamente distribuídos pelo organismo, encontrando-se em maior número no tecido conjuntivo, mucosas e em locais que interagem com o ambiente como a pele, o pulmão e o trato gastrointestinal. Estima-se que se todos os mastócitos fossem reunidos formariam um órgão do tamanho de um baço (Welle et al., 2008).
1.1.1. Diferenciação
Os mastócitos derivam de células hematopoiéticas pluripotenciais CD34+ localizadas na medula óssea. Ainda imaturos, os percursores dos mastócitos abandonam a medula óssea e circulam como células mononucleares, agranulares, CD34+, CD13+ e c-kit+. Posteriormente, completam a sua maturação e proliferação nos tecidos conjuntivos e na superfícies das mucosas, onde assumem a sua aparência granular. A diferenciação dos mastócitos é influenciada por dois mecanismos: um depende do fator de crescimento derivado dos
2
fibroblastos (stem cell factor – SCF), e o outro depende de interleucinas (IL) produzidas por linfócitos T: IL-3, IL-4, IL-6, IL-8, IL-9 e IL-10 (Welle et al., 2008; London, 2010).
1.1.2. Recetores membranares
Os mastócitos apresentam na sua superfície vários recetores que lhes permitem reconhecer agentes patogénicos, como os recetores Toll-like (TLR1, TLR2, TLR3, TLR4, TLR6, TLR7 e TLR9) e o recetor de manose (CD48). Os mastócitos, tal como os basófilos, neutrófilos e eosinófilos, expressam recetores para IgE de alta afinidade (FcεRI) que são constituídos por quatro cadeias: α, β e duas γ. Também possuem recetores para algumas proteínas do complemento, neuropéptidos, opióides, IgG e recetores c-kit (Metcalfe et al., 1997; London, 2010).
O recetor transmembranário c-kit (figura 1), também conhecido como CD117 ou KIT, pertence a uma classe de proteínas celulares designada por tirosina cinase, e é codificado pelo proto-oncogene c-kit. Este proto-oncogene foi inicialmente identificado no genoma vírico do sarcoma felino de Hardy-Zucherman 4 (Voytyuk et al., 2003; Welle et al., 2008).
Figura 1: Representação esquemática do recetor c-kit. Constituído por: um domínio extracelular (local onde ocorre a ligação com o SCF, formulado por cinco pontes similares a imunoglobulinas); um domínio transmembranar (local de ancoragem do recetor à membrana celular); um domínio justamembranar (região que controla o c-kit por feedback negativo) e um domínio citoplasmático tirosina cinase (dividido por um conjunto de regiões de ligação de ATP e fosfotransferases) (adaptado por Voytyuk et al., 2003).
3
O ligando deste recetor é uma citocina denominada Stem cell factor (SCF), também conhecida por Steel factor, ligando de KIT ou fator de crescimento dos mastócitos. Vários estudos em medicina humana demonstram que o SCF é sintetizado por fibroblastos, queratinócitos, células endoteliais, células do estroma da medula óssea, células das vias respiratórias, células do músculo liso dos brônquios, bexiga, útero e trato gastrointestinal (Lammie et al., 1994; De Paulis et al., 1999). A ligação do SCF ao c-kit promove a sua ativação, desencadeando uma série de procedimentos incluindo a homodimerização e autofosforilação do recetor e a união do c-kit a moléculas de Adenosina trifosfato (ATP), utilizando os seus grupos fosfato para efetuar a fosforilação de certas proteínas do citosol e gerando uma cascata de sinalização que origina várias respostas celulares. Destas destacam-se a proliferação, migração, maturação e sobrevivência das células mãe hematopoiéticas, mastócitos, melanócitos e células germinativas (Welle et al., 2008). Para além do desenvolvimento e diferenciação dos mastócitos, o SCF promove a quimiostase, a produção de mediadores, inibe a apoptose dos mastócitos maduros, regula a desgranulação e é importante na sua adesão à matriz extracelular (Broudy, 1997; Gagari et al., 1997; Kiupel et
al., 2004). No cão, para além dos mastócitos, o recetor c-kit é expresso nas células
intersticiais de Cajal do sistema digestivo, nas células Purkinje do cerebelo, no endométrio e nas células epiteliais luminais da glândula mamária. No homem, a mesma proteína foi identificada por imunohistoquímica nos mastócitos tissulares, nos melanócitos, no cerebelo, no hipocampo, na medula espinhal, nas células germinativas dos testículos, nas células ováricas e nas células epiteliais das glândulas mamárias e parótida (Lammie et al., 1994).
1.1.3. Funções biológicas
Os mastócitos desempenham um papel crucial na defesa do organismo, participando ativamente em mecanismos celulares, humorais e imunológicos. Atuam num amplo conjunto de reações imunológicas inatas e adquiridas, como reações de hipersensibilidade do tipo I, do tipo IV e doenças auto-imunes. Como por exemplo dermatites, artrite reumatóide, psoríase, doenças inflamatórias intestinais, asma, desordens fibróticas, neurofibromatose e esclerose múltipla (Metcalfe et al., 1997; London, 2010). Apesar das inúmeras funções biológicas que desempenha, o mastócito geralmente é reconhecido pelo seu papel crítico nas reações de hipersensibilidade do tipo I. Tal como os basófilos, os mastócitos apresentam recetores FcεRI que ao entrarem em contacto com a associação antigénio-IgE ativam a célula provocando a
4
libertação de mediadores pré-formados e posteriormente neoformados. Este fenómeno induz o recrutamento de células inflamatórias, vasodilatação, aumento da permeabilidade vascular, aumento da secreção de muco, estimulação nervosa, broncoconstrição e aumento da motilidade gastrointestinal. Estas células modulam ainda a resposta imunitária através da estimulação de células T e atuam na defesa do hospedeiro contra parasitas. Promovem a resposta inflamatória aguda e crónica, estimulando a migração de leucócitos, a adesão dos leucócitos ao endotélio, a angiogénese, a deposição de fibrina, a proliferação de fibroblastos e a fibrose (Magro et al., 1988). Mais recentemente, os mastócitos foram identificados como leucócitos dos tecidos com funções chave na defesa do hospedeiro, inflamação, remodelação de tecidos, fibrose e a coagulação (London, 2010).
1.2. Mastocitoma canino
O mastocitoma (MCT) é uma neoplasia comum no cão, representando cerca de 7 a 21% de todas as neoplasias cutâneas (Bostock, 1986; O’Keefe, 1990; Welle et al., 2008) e 11 a 27 % de todos os tumores malignos nesta espécie (Bostock, 1986; Thamm e Vail, 2007). O seu comportamento biológico é extremamente variável, podendo tratar-se de uma simples massa perfeitamente localizada ou de uma grave doença metastática (Patnaik et al., 1984).
1.2.1. Etiopatogenia
Apesar das inúmeras pesquisas efetuadas, a etiopatogenia do MCT canino não se encontra totalmente esclarecida. Sabe-se no entanto que esta é provavelmente multifatorial (Welle et al., 2008). Em alguns casos os MCTs foram associados a inflamações crónicas e a aplicações de irritantes na pele. Vários autores sugeriram ainda a possibilidade de uma causa vírica estar na origem do seu desenvolvimento. Contudo, ainda não existem certezas em relação à sua influência na etiologia desta neoplasia (Lombard e Moloney, 1959; Thamm e Vail, 2007).
Em medicina humana, a expressão de uma fragilidade cromossómica está intimamente relacionada com uma maior predisposição genética para o desenvolvimento de certos tumores. Este fenómeno também foi verificado em boxers portadores de MCT. Contudo o grupo controlo deste estudo era formado por animais jovens não portadores de neoplasia, e este aumento da expressão está provavelmente relacionado com a grande diferença etária entre ambos os grupos (Stone et al., 1991).
5
Em 1982 Elling e Ungemach comprovaram a presença de recetores citosólicos de estrogénio e progesterona nos MCTs caninos (Thamm e Vail, 2007). O seu papel na etiopatogenia é desconhecido, mas existem evidências de uma certa influência por parte do estrogénio e da progesterona na funcionalidade do MCT (Macy, 1986).
A possibilidade de existência de um componente genético na patogenia do MCT canino é justificada pela bem documentada predisposição racial observada neste tipo de neoplasias (Welle et al., 2008). A predisposição genética, as alterações moleculares e as mutações genéticas têm sido apontadas como causas mais prováveis de indução da génese neste tipo de tumor. O gene p53 codifica uma proteína que atua como um fator de transcrição nuclear capaz de parar o ciclo celular de células que possuam erros no seu ADN, ativar enzimas reparadoras de ADN e induzir a apoptose celular em caso de alterações irreparáveis. Estudos recentes demonstraram que o MCT canino apresenta alterações no gene p53 e na expressão das proteínas p21 e p27. Estas últimas são proteínas supressoras de tumores que regularizam o ciclo celular, inibindo as cinases dependentes de ciclinas, CDK4 e CDK2 respetivamente (Thamm e Vail, 2007). Ao longo dos últimos anos, vários investigadores sugeriram que as mutações no proto-oncogene c-kit, que codifica o recetor c-kit, podem estar associadas com a patogénese desta neoplasia (Kiupel et al., 2004; Welle et al., 2008; London, 2009). O recetor tirosina cinase c-kit, normalmente expresso nos mastócitos, é fundamental para a sua proliferação, migração, maturação e sobrevivência. Similarmente à espécie humana, vários autores identificaram mutações ativadoras do c-kit em MCTs caninos, tais como duplicações internas em tandem (ITD), que provocam uma proliferação celular descontrolada e estão relacionadas com o potencial agressivo do tumor (London, 2009). Diferentes padrões de expressão do c-kit têm sido descritos em mastócitos normais e neoplásicos, estando a expressão citoplasmática aberrante do c-kit associada a tumores com pior prognóstico (Kiupel et al., 2004).
1.2.2. Epidemiologia
1.2.2.1. Idade
O MCT é uma neoplasia que afeta maioritariamente cães mais velhos, com uma idade média entre os 7,5 e os 9 anos (Howard et al., 1969; Patnaik et al., 1984; Scott et al., 2001; Govier, 2003; Mullins et al., 2006). Está comprovado que a incidência deste tumor aumenta com a idade do animal (Bensignor et al., 1996). No entanto, esta neoplasia já foi descrita em
6
animais com apenas 3 e 7 semanas de idade até adultos de 19 anos, o que significa que o MCT pode desenvolver-se em qualquer idade (Patnaik et al., 1984; Davis et al., 1992).
1.2.2.2. Raça
As raças com maior predisposição são: Boxer, Boston Terrier, Bull Terrier, Bullmastiff, Stradfordshire Terrier, Terrier Escocês, Bulldog Inglês, Dachshund, Labrador Retriever, Golden Retriever, Beagle, Pug, Shar Pei, Cocker Spaniel, Schnauzer, Pointer, Pastor Alemão, Leão da Rodésia, Cão de Gado Australiano e Weimaraner (Patnaik et al., 1984; Bostock, 1986; Gross et al., 2005). Ainda que os Boxers apresentem maior risco de desenvolver MCT, representando cerca de 50% dos animais afetados em alguns estudos, estes desenvolvem formas cujo grau histológico varia entre o baixo e o moderado, apresentando desta forma melhor prognóstico (Bostock, 1986; Thamm e Vail, 2007). A elevada incidência do MCT em Boxers, Boston Terriers, Bulldogs Ingleses e Bullmastiffs pode ser justificada pela existência de um ancestral comum Bulldog, indicando uma predisposição genética (Welle et al., 2008).
Vários estudos reportam ainda uma propensão na localização do MCT em certas raças: membros posteriores e lesões múltiplas em Boxers e Pugs; membros posteriores em Bonton Terriers e American Staffordshire Terriers; cauda no Leão da Rodésia; lesões múltiplas em Golden Retrievers e Weimaraners; e, por fim, cabeça e membros posteriores no Setter Inglês (Murphy et al., 2006; Welle et al., 2008).
1.2.2.3. Sexo
A maioria dos estudos realizados nega a existência de predisposição sexual no desenvolvimento deste tumor, assim como qualquer associação entre o sexo do animal e a sua sobrevivência (Howard et al., 1969; Patnaik et al., 1984; Thamm e Vail, 2007). Apenas um estudo refuta os anteriores demonstrando que fêmeas tratadas com quimioterapia apresentam um prognóstico mais favorável quando comparadas com machos na mesma situação (Gerritsen et al., 1998). No entanto, os estudos realizados posteriormente não obtiveram resultados que permitissem corroborar estes dados (Thamm e Vail, 2007).
7 1.2.3. Localização e aspeto clínico
A maioria dos animais com MCT apresenta-se à consulta devido ao aparecimento de massas cutâneas e apenas muito raramente devido a sinais clínicos originados pela libertação de mediadores presentes nos mastócitos (O’Keefe, 1990; Lemarie et al., 1995; Welle et al., 2008). Cerca de 50 a 60% destas neoplasias estão localizadas no tronco, 25 a 40% nas extremidades e 10% na cabeça e pescoço (Bostock, 1973; Sfiligoi et al., 2005). Geralmente, os MCTs caninos surgem na derme e no tecido subcutâneo. Contudo, estes podem ocasionalmente apresentar localizações extra-cutâneas incluindo conjuntiva, glândula salivar, nasofaringe, laringe, cavidade oral, trato gastrointestinal, uretra e canal espinhal (Welle et al., 2008).
O aspeto clínico do MCT pode variar amplamente conseguindo mimetizar qualquer lesão dérmica primária ou secundária incluindo nódulos, máculas, pápulas, tumores e crostas. Assim sendo, este deve ser considerado como diagnóstico diferencial de qualquer nódulo cutâneo (Scott et al., 2001).
Os MCTs bem diferenciados (grau I) são normalmente massas solitárias, elásticas, com 1 a 4 cm de diâmetro, tipicamente não ulceradas e, por vezes, alopécicas. O seu crescimento é lento, estando frequentemente presente no animal há mais de 6 meses antes do diagnóstico. Os MCTs subcutâneos são moles à palpação e a pele que os recobre move-se livremente podendo facilmente ser confundidos com um lipoma (Thamm e Vail, 2007). Os MCTs indiferenciados (grau III) podem apresentar-se como massas de grande dimensão, ulceradas e de rápido crescimento. Ocasionalmente, o tecido adjacente pode tornar-se edematoso, inflamado e apresentar pequenos nódulos satélite (Bostock, 1986; Thamm e Vail, 2007). A aparência do tumor de grau intermédio (grau II) varia entre os dois graus referidos anteriormente. A maioria dos MCTs não são pigmentados mas, por vezes, podem surgir nódulos eritematosos e hiperpigmentados (Welle et al., 2008).
Por vezes, a palpação e a manipulação deste tumor pode causar desgranulação de mastócitos com subsequente libertação de histamina e substâncias vasoativas que produzem vasodilatação, eritema e edema dos tecidos adjacentes. Este fenómeno é conhecido como sinal de Darier (Scott et al., 2001; Welle et al., 2008).
A maioria dos animais apresenta lesões solitárias, contudo, 5-25% dos casos podem desenvolver tumores múltiplos que surgem de forma simultânea ou sequencial (Welle et al.,
8
2008). Raças como o Boxer, o Pug, o Weimaraner, o Golden Retriever e o Shar Pei apresentam maior predisposição ao desenvolvimento deste tipo de lesões (Murphy et al., 2006).
Um estudo relatou a regressão espontânea de um MCT cutâneo, múltiplo e prurítico num Jack Russell Terrier de 3 semanas de idade (Davis et al., 1992). No entanto, é possível que ao invés de uma verdadeira neoplasia se trate antes de um caso de proliferação mastocitária hiperplásica ou uma condição similar à urticaria pigmentosa humana (Welle et
al., 2008).
Existe ainda uma forma visceral, também conhecida como mastocitose sistémica ou disseminada, que normalmente resulta da disseminação sistémica de um tumor cutâneo primário indiferenciado. Contudo, pode ainda ocorrer MCT visceral primário sem envolvimento cutâneo. Nestes casos, é comum observar linfadenopatia, esplenomegalia, hepatomegalia e presença de mastócitos neoplásicos na medula óssea e sangue (Takahashi et
al., 2000; Thamm e Vail, 2007).
1.2.4. Diagnóstico
O plano diagnóstico de um animal com suspeita de MCT apresenta 3 objetivos: o diagnóstico definitivo realizado através de citologia e/ou histologia, o estadiamento clínico e a documentação de síndromes paraneoplásicos (Welle et al., 2008).
1.2.4.1. Síndromes paraneoplásicos
Mais de 50% dos animais com MCT podem apresentar complicações relacionadas com a libertação de substâncias bioativas (como a histamina, heparina, enzimas proteolíticas e fatores quimiotáticos eosinofílicos) presentes nos grânulos dos mastócitos (O’Keefe, 1990; Welle et al., 2008).
Após a excisão cirúrgica do tumor, é frequente observar atrasos na cicatrização devido à libertação de aminas vasoativas e enzimas proteolíticas (Lemarie et al., 1995; Dobson e Scase, 2007; Thamm e Vail, 2007). Um estudo realizado em ratos sugere que a histamina libertada pelo MCT liga-se aos recetores H1 e H2 dos macrófagos provocando a libertação de fatores supressores fibroblásticos que prejudicam a cicatrização. Está ainda comprovado que a
9
histamina e a human mast cell leukaemia lysatesdiminuem a proliferação de queratinócitos e inibem a epitelização das feridas (Thamm e Vail, 2007).
Durante a excisão cirúrgica, a punção aspirativa por agulha fina (PAAF) e a manipulação excessiva do MCT, podem surgir hemorragias locais devido à libertação de heparina que afeta a cascata de coagulação (Macy, 1986; Lemarie et al., 1995).
A ulceração gastrointestinal é outra síndrome frequentemente observada que pode causar vómito, anorexia, melena, hematoquézia, anemia, dor abdominal e, por vezes, perfuração intestinal e peritonite (Dobson e Scase, 2007; Thamm e Vail, 2007). Os principais responsáveis pela ulceração são: a hipermotilidade, o dano vascular e a excessiva secreção de ácido clorídrico resultante da ação estimulante da histamina nos recetores H2 das células parietais (Thamm e Vail, 2007). Na realidade, está comprovado que um mastócito neoplásico contém 25 a 50 vezes mais histamina do que um mastócito normal, e que cães com MCTs possuem níveis plasmáticos de histamina mais altos e de gastrina mais baixos quando comparados com cães saudáveis (Macy, 1985; Welle et al., 2008).
Os choques anafiláticos súbitos capazes de ameaçar a vida do animal, originados por libertações massivas de histamina, raramente são observados. No entanto, episódios de colapso poderão ser presenciados em caso de MCT extensivo, criocirurgia ou cirurgia hipertérmica(Macy, 1985; Lemarie et al., 1995; Dobson e Scase, 2007).
1.2.4.2. Citologia tumoral
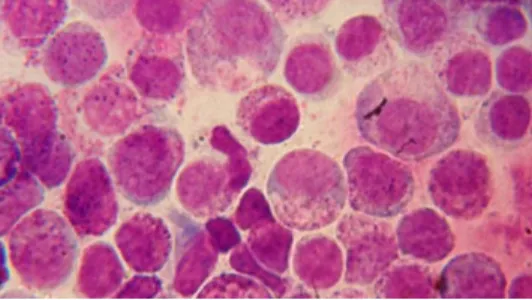
A punção aspirativa por agulha fina (PAAF) e o esfregaço por aposição são duas técnicas que permitem efetuar um diagnóstico de MCT. A PAAF da massa tumoral é uma técnica simples que deve ser realizada previamente à cirurgia. Isto porque, um diagnóstico pré-operatório de MCT pode influenciar não só no tipo mas também na amplitude da intervenção cirúrgica (Govier, 2003). Normalmente, estes tumores são diagnosticados através da avaliação citológica de esfregaços corados resultantes da PAAF. De facto, em 92-96% dos casos, a PAAF conduz a um diagnóstico correto (Thamm e Vail, 2007). A citologia de um MCT revela uma população de células redondas, com núcleos ovais ou arredondados e grânulos citoplasmáticos púrpura-avermelhados de vários tamanhos. Por vezes, o número de grânulos é tão elevado que chega mesmo a camuflar o seu núcleo. Outra característica que apoia o diagnóstico de um MCT é a presença de um infiltrado de eosinófilos. Pode-se observar ainda células fusiformes, que na sua maioria são fibroblastos (Macy, 1985; Welle et
10
al., 2008). Várias colorações como Wright, Giemsa, Leishman ou o Diff Quik TM coram os grânulos dos mastócitos. Embora a PAAF seja um excelente método de diagnóstico, a graduação tumoral só é possível através da avaliação histológica. A lista de diagnósticos diferenciais do MCT deve incluir outros tumores de células redondas tais como o linfoma, o melanoma amelanocítico, o plasmocitoma, o histiocitoma, o carcinoma anaplasmático e o tumor venéreo transmissível (Welle et al., 2008).
1.2.4.3. Citologia dos gânglios linfáticos regionais
Numa fase inicial, o MCT pode metastizar para os seus gânglios linfáticos regionais sem causar linfadenopatia concomitante, ou seja, sem alterar as suas dimensões. Razão pela qual se deve efetuar uma PAAF dos linfonodos drenantes independentemente do seu tamanho (Rogers, 2010). A interpretação da citologia de um gânglio linfático nem sempre é fácil. É bastante comum observar mastócitos em baixo número numa citologia ganglionar de um animal saudável, o que complica acentuadamente a realização de um correto diagnóstico de metastização ganglionar (Dobson e Scase, 2007).
As diretrizes da Organização Mundial de Saúde (OMS) referem que a amostra citológica deve ser avaliada apenas em relação à presença ou ausência de mastócitos, o que levaria a inúmeros diagnósticos de metástases incorretos (Seguin et al., 2001).Atualmente só se efetua um diagnóstico de doença metastática se numa citologia os mastócitos representarem mais de 3% da população celular do aspirado (Dobson e Scase, 2007). No entanto, mesmo respeitando este critério, cerca de 25% de animais saudáveis são diagnosticados como tendo metástases de MCTs. Sendo assim, devem ser avaliados outros fatores, como o grau de indiferenciação e a agregação celular, uma vez que estes representam fortes indícios de metastização. Se um animal apresentar gânglios linfáticos suspeitos, deve-se considerar a sua extirpação cirúrgica procedida por uma avaliação histológica (Thamm e Vail, 2007).
1.2.4.4. Imagiologia
No MCT, a metastização ocorre principalmente por via linfática para os linfonodos satélites da região afetada. A ecografia, assim como outras técnicas imagiológicas, são uma mais-valia neste tipo de tumores uma vez que permitem avaliar estes gânglios linfáticos. Se estes se encontrarem aumentados de tamanho, deve-se supor que ocorreu metastização. A
11
seguir aos linfonodos, o baço (46%) e o fígado (41%) são os órgãos mais afetados. Nestes casos, a ecografia abdominal pode auxiliar na procura de metástases. A PAAF ecoguiada deve ser efetuada sempre que se observam alterações ecográficas (Welle et al., 2008). No entanto, tanto o fígado como o baço metastizado podem apresentar uma imagem ecográfica normal. Sendo assim, para obter um diagnóstico mais conclusivo, deve-se efetuar sempre uma PAAF ecoguiada destes órgãos (Stefanello et al., 2009). Contudo, nem sempre é fácil interpretar os aspirados celulares destes órgãos, visto que se podem observar mastócitos não malignos em citologias de animais saudáveis, o que complica acentuadamente a realização de um correto diagnóstico de metastização (Thamm e Vail, 2007).
A radiografia torácica raramente é recomendada, isto porque, o MCT normalmente não metastiza no pulmão. E quando metastiza, geralmente apresenta-se sob a forma de infiltrados intersticiais difusos. Ainda assim, a radiografia torácica pode ser vantajosa em animais velhos, permitindo a exclusão de doenças concomitantes que poderiam complicar a anestesia (Thamm e Vail, 2007).
1.2.4.5. Análise hematológica, bioquímica e análise de urina
Qualquer animal com MCT deve realizar um perfil completo de análises hematológicas e bioquímicas. É raro observar mastocitose, mesmo nos esfregaços da camada flogística, mas pode detetar-se eosinofilia provocada pelos fatores quimiotáticos libertados pelos mastócitos. Estes animais podem apresentar anemia devido a hemorragias provocadas pela ulceração gastrointestinal. A avaliação destes parâmetros permite ainda decifrar se existe ou não comprometimento do sistema hepático ou renal, informação de grande valor aquando da decisão do tipo de tratamento a seguir (London et al., 2003).
1.2.4.6. Esfregaço da camada flogística (buffy coat smear)
Inicialmente esta técnica era utilizada em cães que possuíam MCTs com o intuito de avaliar o envolvimento sistémico através da observação de mastócitos no sangue periférico. Atualmente, sabe-se que a mastocitémia é mais frequente em certos casos de doença inflamatória e infeciosa do que em MCTs (Thamm e Vail, 2007). Além do mais, a forma visceral do MCT canino é rara e o seu diagnóstico normalmente não altera o protocolo terapêutico uma vez que esta é extremamente agressiva. Por todas estas razões, vários
12
médicos veterinários deixaram de realizar este método rotineiramente, reservando-o apenas para situações específicas (Govier, 2003; Dobson e Scase, 2007; Thamm e Vail, 2007).
1.2.4.7. Citologia da medula óssea
Um aspirado normal de medula óssea raramente contém mastócitos. Num estudo efetuado em 157 cães com MCT, a incidência de infiltração medular foi apenas 2,8% numa fase inicial (London, 2010b). O envolvimento medular é sem dúvida alguma um sinal de forma disseminada do MCT. Contudo, é mais fácil encontrar evidências de envolvimento sistémico avaliando outros órgãos tais como o fígado e o baço. Esta técnica, similarmente ao esfregaço da camada flogística, também não é utilizada rotineiramente como meio de diagnóstico auxiliar. A forma visceral do MCT apresenta um prognóstico bastante reservado, e a presença ou ausência de mastócitos na medula óssea raramente altera o plano terapêutico (London, 2010b).
1.2.4.8. Graduação histológica
Embora a citologia por PAAF seja um excelente método de diagnóstico, a graduação tumoral só é possível através da avaliação histológica de biópsias incisionais ou excisionais (Dobson e Scase, 2007; Thamm e Vail, 2007). A graduação histológica é frequentemente utilizada pelos médicos veterinários para determinar o prognóstico e o tratamento a instituir. Atualmente, o sistema de graduação de Patnaik et al. (1984) é o mais usado pelos patologistas. Este sistema classifica os mastocitomas em três graus, sendo o grau III o mais agressivo com uma alta taxa de metastização.
Geralmente, os MCTs caninos são massas dérmicas e/ou subcutâneas, não encapsuladas, constituídas por células redondas organizadas em cordões densos ou em toalha. Raramente se estendem até à junção derme-epiderme, e não se visualizam agregados de mastócitos intra-epidermicamente (Gross et al., 2005). A epiderme sobrejacente geralmente apresenta-se intacta em pequenas lesões, contudo, em massas maiores esta pode-se encontrar ulcerada (Welle et al., 2008; London, 2010b). O estroma de colagénio pode ser escasso ou abundante, e variar entre o edematoso ou o hialinizado. É possível observar eosinófilos dispersos por toda a massa tumoral ou formando agregados celulares. Estes infiltrados eosinofílicos podem originar hialinizações perivasculares, depósitos de mucina e vasculites
13
eosinofílicas. Podem ainda surgir “figuras em chama” que na realidade são eosinófilos desgranulados unidos a feixes de colagénio (colagenólise) (Welle et al., 2008).
Os MCTs bem diferenciados (grau I) são massas bastante circunscritas, mas não encapsuladas, compostas por células redondas, monomórficas, com um pequeno núcleo central, um único nucléolo impercetível, citoplasma abundante granulado e bordos citoplasmáticos distintos. As figuras mitóticas raramente são observadas. As células neoplásicas estão organizadas em fileiras ou em camadas separadas por feixes de colagénio, e a epiderme sobrejacente normalmente permanece intacta (Patnaik et al., 1984; Welle et al., 2008). Segundo Patnaik et al (1984), estes tumores estão confinados à derme interfolicular, no entanto, vários autores defendem que estes tumores podem invadir o tecido subcutâneo (Bostock et al., 1989).
Os MCTs de grau intermédio (grau II) geralmente são massas menos circunscritas cujas células estão agregadas de forma compacta. Quando comparados com tumores de grau I, as suas células são maiores, ligeiramente mais pleomórficas e menos granuladas. O seu núcleo é moderadamente maior, uniforme e vesicular, com pequeno mas evidente nucléolo. Podem apresentar ainda células gigantes, binucleadas e, ocasionalmente, células fusiformes. Algumas figuras mitóticas podem ser observadas, geralmente 0 a 2 por campo de ampliação. As células tumorais estão organizadas em grupos separados por estroma de colagénio que pode ser espesso ou hialinizado, com áreas de edema e necrose (Patnaik et al., 1984; Welle et
al., 2008; London, 2010b; Kiupel et al., 2011). Por definição, os tumores de grau II da
classificação de Patnaik et al. (1984) estendem-se até à derme profunda e podem invadir o tecido subcutâneo.
Os MCTs indiferenciados (grau III) são geralmente massas maiores, altamente celulares, mal delimitadas, constituídas por grupos compactos de células que apresentam pleomorfismo, anisocitose e anisocariose. Os seus bordos celulares são indistintos e os grânulos citoplasmáticos escassos. Os núcleos são grandes, redondos a ovais, e podem apresentar um ou vários nucléolos proeminentes. Pode-se observar células binucleadas ou multinucleadas. As figuras mitóticas são frequentes, 3 a 6 por campo de ampliação. O tumor pode invadir tanto o tecido subcutâneo como os tecidos subjacentes e apresentar áreas de hemorragia, edema, necrose e ulceração (Patnaik et al., 1984; Welle et al., 2008; Kiupel et al., 2011).
14
Em 2011, Kiupel e seus colaboradores elaboraram um estudo onde 95 MCTs cutâneos foram avaliados, segundo o sistema de Patnaik et al. (1984), por 28 patologistas. Os seus resultados demonstraram que 74% dos patologistas concordaram no diagnóstico dos MCTs de grau III, mas apenas 63% concordaram no diagnóstico dos MCTs de grau I e II. Este estudo menciona ainda que 53% dos MCTs foram diagnosticados como tumores de grau II, informação de baixo valor prognóstico uma vez que estes apresentam comportamento biológico imprevisível, sendo a sua sobrevivência aproximadamente 50/50 dentro de 5 anos (Kiupel et al., 2011). Para além da falta de consonância entre patologistas, outras críticas são apontadas ao sistema de Patnaik et al. (1984). O exagerado número de figuras mitóticas (3 a 6 por campo de ampliação) exigido na graduação III, exclui alguns tumores de comportamento agressivo desta categoria (Kiupel et al., 2011). Várias pesquisas demonstram ainda que não existe associação entre a profundidade da lesão tumoral e a sobrevivência dos doentes, sugerindo que os MCTs subcutâneos não estão necessariamente associados a um pior prognóstico (Thompson et al., 2011). Com o objetivo de eliminar as ambiguidades demonstradas, Kiupel propôs um novo sistema de graduação que classifica os tumores em apenas 2 graus: grau baixo e grau alto. Ao contrário do sistema de Patnaik et al. (1984), este sistema não engloba a profundidade da infiltração dos mastócitos neoplásicos nos seus critérios de graduação, tendo antes como base achados morfológicos. O diagnóstico de um MCT de grau alto baseia-se na presença de qualquer um dos seguintes critérios: pelo menos 7 figuras mitóticas por campo de ampliação (10x); 3 ou mais células multinucleadas (3 ou mais nucléolos) por campo (10x); pelo menos 3 núcleos atípicos por campo de ampliação (10x); cariomegália (pelo menos 10% dos mastócitos tumorais apresentam diâmetro nuclear até 2 vezes maior do que o tamanho normal). Este sistema revelou maior consistência no estabelecimento do prognóstico e maior concordância entre patologistas (Kiupel et al., 2011).
1.2.4.9. Estadiamento clínico
O sistema de estadiamento clínico da Organização Mundial de Saúde (OMS) (quadro 1) é muito utilizado, juntamente com o grau histológico, em decisões prognósticas e seleção de tratamentos (Lemarie et al., 1995; Scott et al., 2001; Govier, 2003). No entanto, estudos recentes questionam a utilidade deste sistema especialmente em relação a tumores de estádio III (Thamm et al., 1999; Murphy et al., 2006). Em geral, os tumores de estádio clínico 0 e I apresentam um melhor prognóstico relativamente a estádios mais elevados. De acordo com o
15
sistema de estadiamento da OMS, tanto os tumores múltiplos como os tumores infiltrativos pertencem ao estádio III. Contudo, vários estudos demonstram que os tumores múltiplos não apresentam um pior prognóstico quando comparados com os tumores solitários (Mullins et
al., 2006; Murphy et al., 2006). Sendo assim, muitos autores defendem que a categoria
“tumores múltiplos” deve ser removida da definição de estádio III (Dobson e Scase, 2007; Thamm e Vail, 2007). Além do mais, o termo “infiltrativo” é enganoso uma vez que, de acordo com o sistema de graduação histológico de Patnaik et al. (1984), os tumores de grau II e III podem invadir o tecido subcutâneo, e desta forma, qualquer tumor de grau II ou III seria incluído no estádio III, embora diversos estudos indiquem que geralmente os tumores de grau II apresentam um melhor prognóstico quando comparados com tumores de grau III (Dobson e Scase, 2007). Está ainda comprovado que a grande maioria dos MCTs subcutâneos apresentam um prognóstico mais favorável, elevado tempo de sobrevivência e baixas taxas de recorrência e metástases (Thompson et al., 2011). Como consequência das fraquezas mencionadas anteriormente, muitos cães são tratados de forma mais agressiva do que realmente seria necessário. Assim sendo, é essencial atualizar este sistema de estadiamento (Dobson e Scase, 2007).
Quadro 1: Sistema de estadiamento da Organização Mundial de Saúde para mastocitomas (Welle et al., 2008). Estádio clínico Descrição
0
Um tumor extirpado da derme de forma incompleta, identificado histologicamente, sem envolvimento do gânglio linfático regional.
a. Sem sinais sistémicos; b. Com sinais sistémicos.
I
Um tumor confinado à derme, sem envolvimento do gânglio linfático regional. a. Sem sinais sistémicos;
b. Com sinais sistémicos.
II
Um tumor confinado à derme, com envolvimento do gânglio linfático regional. a. Sem sinais sistémicos;
b. Com sinais sistémicos.
III
Tumores dérmicos múltiplos ou grandes tumores infiltrativos, com ou sem envolvimento do gânglio linfático regional.
a. Sem sinais sistémicos; b. Com sinais sistémicos.
IV Qualquer tumor com metástases à distância ou recorrente com metástases (incluindo envolvimento do sangue periférico ou medula óssea).
16
O quadro seguinte resume o novo sistema de estadiamento clínico para MCTs proposto por London em 2010b.
Quadro 2: Sistema de estadiamento clínico para mastocitomas proposto por London (2010b).
Estadiamento Tumor (es) Gânglio linfático
regional Metastização
IA 1 tumor, confinado à pele, <3cm e bem
circunscrito. Negativo Negativa
IB
>1 tumor, confinado à pele, bem circunscrito e distância inter-lesional
>10cm.
Negativo Negativa
II
1 ou mais tumores na pele, com >3cm, mal circunscrito, ou ulcerado, ou com
nódulos satélites.
Negativo Negativa
III Qualquer uma das anteriores. Positivo Negativa IV Qualquer uma das anteriores. Positivo ou
Negativo Positiva A, sem sinais sistémicos; B, com sinais sistémicos.
1.2.5. Prognóstico
Para prever corretamente o prognóstico de um doente com MCT, deve-se ter em conta todos os fatores clínicos que têm a capacidade de influenciar o comportamento biológico do tumor ou a resposta ao tratamento. Entre eles temos: a localização, o aspeto tumoral, a taxa de crescimento, o tamanho, a presença de síndromes paraneoplásicos, a raça, o sexo e o estadiamento clinico (Macy, 1986; Govier, 2003; Mullins et al., 2006; Thamm e Vail, 2007). Estudos recentes demonstram que diversos marcadores genéticos e imunohistoquímicos podem também ser uma mais-valia na previsão do curso clínico. No entanto, o grau histológico continua a ser o fator prognóstico mais valioso e coerente (Welle et al., 2008).
1.2.5.1. Localização e aspeto tumoral
Os MCTs localizados na zona inguinal, nos dígitos, na área prepucial, no períneo, na cavidade oral e noutras regiões mucocutâneas estão descritos como tendo um caráter mais agressivo, maior tendência para metastizar, e como tal, um prognóstico mais reservado (Macy, 1986; Thamm et al., 2006; Thamm e Vail, 2007). Contudo, outros autores afirmam que não foram encontradas alterações significativas no prognóstico, ao comparar tumores
17
inguinais/perineais com tumores localizados noutras regiões (Cahalane et al.,2004; Sfiligoi et
al., 2005). Este tema permanece bastante controverso uma vez que diferentes estudos
demonstram resultados contraditórios, no entanto, a maioria dos autores recomenda um cuidado redobrado ao lidar com tumores neste tipo de localização. Os MCTs localizados nos membros estão associados a maiores taxas de sobrevivência comparativamente aos tumores presentes no tronco. Já os localizados na cabeça e pescoço demonstraram um maior risco de desenvolver novos tumores (Dobson et al., 2004).
Normalmente, os tumores que apresentam ulceração, eritema e prurido estão associados a pior prognóstico (Thamm et al., 1999; Mullins et al., 2006). Estudos recentes comprovam que a grande maioria dos MCTs subcutâneos apresenta um prognóstico mais favorável, elevado tempo de sobrevivência e baixas taxas de recorrência e metastização (Thompson et al., 2011). Apesar de muitos autores associarem os tumores múltiplos a um pior prognóstico (Kiupel et al., 2005; Thamm et al., 2006), novos estudos defendem que, se tratados adequadamente, estes apresentam taxas de sobrevivência semelhantes aos tumores solitários (Mullins et al., 2006; Murphy et al., 2006).
1.2.5.2. Raça, sexo e idade
Embora os Boxers demonstrem elevado risco de apresentar MCTs, desenvolvem formas cujo grau histológico varia entre o baixo e o moderado, estando desta forma associados a um melhor prognóstico. Nesta raça, é comum observar esta neoplasia em idades precoces (Welle et al., 2008). Os Shar Peis geralmente apresentam MCTs mais agressivos e em idades jovens (média de 4 anos) (Murphy et al., 2006). Curiosamente os MCTs dos Labradores Retrievers também apresentam um comportamento mais ofensivo quando comparados com as outras raças (Murphy et al., 2006; Welle et al., 2008).
Apenas um estudo demonstra que as fêmeas tratadas com quimioterapia têm um prognóstico mais favorável quando comparadas com o sexo masculino (Gerritsen et al., 1998).
1.2.5.3. Taxa de crescimento e tamanho da massa tumoral
A taxa de crescimento (tamanho tumoral dividido pelo tempo em semanas a qual o tumor está presente) é um importante fator prognóstico. Num estudo, os cães que apresentavam MCTs há mais de 7 meses demonstraram um prognóstico mais favorável
18
quando comparados com animais que tinham tumores com menos de 7 meses (Bostock, 1973). Por sua vez, tumores de grandes dimensões estão associados a um pior prognóstico (Mullins et al., 2006).
1.2.5.4. Metastização e reincidência
A taxa de metastização é menor que 10% nos tumores diferenciados e varia entre os 55-96% nos tumores indiferenciados. Estes últimos também apresentam uma elevada capacidade de infiltração local (Bostock, 1973; Lemarie et al., 1995; Thamm e Vail, 2007). A metastização ocorre principalmente por via linfática para os linfonodos satélite da região afetada, podendo posteriormente atingir o baço (46%), o fígado (41%) e outros órgãos viscerais (Welle et al., 2008). A metastização pulmonar é rara neste tipo de neoplasia. O envolvimento da medula óssea está associado a pior prognóstico e a menor tempo de sobrevivência, mesmo realizando diferentes tipos de tratamento, com ou sem quimioterapia (Marconato et al., 2008).
A recorrência tumoral, após a excisão cirúrgica, representa um sinal de mau prognóstico. Sendo assim, o tratamento mais adequado deve ter início logo após o diagnóstico e não apenas aquando da recidiva. Esta medida poderá melhorar significativamente o prognóstico do animal com MCT (Thamm et al., 1999; Thamm e Vail, 2007).
1.2.5.5. Sinais sistémicos
Frequentemente os animais que apresentam sinais clínicos tais como anorexia, vómito, melena, ulceração gastrointestinal, edema e eritema generalizado, ostentam a forma visceral do MCT e como tal, um prognóstico mais reservado (Mullins et al., 2006; Thamm e Vail, 2007). Ao analisar 16 casos de MCT visceral verificou-se que o tempo médio de sobrevivência foi de 90 dias e todos os animais morreram durante o período de acompanhamento (O’Keefe, 1990).
1.2.5.6. Estadiamento clínico
Animais com MCTs de estádio clínico 0 ou I apresentam um melhor prognóstico quando comparados com tumores de estádios mais elevados (Bostock, 1973). A observação de metástases no momento do diagnóstico diminui indiscutivelmente o tempo de
19
sobrevivência (Sfiligoi et al., 2005). No entanto, alguns estudos demonstram que MCTs de estádio II podem ser tratados com relativo êxito, de tal forma que os seus tempos de sobrevivência e intervalos livres de doença chegam a aproximar-se aos do estádio 0 (Thamm
et al., 2006).
1.2.5.7. Grau histológico
O grau histológico é um valioso fator prognóstico altamente preditivo do tempo de sobrevivência e recorrência. No entanto, este não prevê o comportamento biológico do MCT (Thamm e Vail, 2007). O sistema de graduação histológico mais amplamente utilizado foi desenvolvido por Patnaik et al. (1984). Este sistema classifica os MCTs em 3 graus, sendo o grau III o mais agressivo com uma alta taxa de metastização. Em geral, à medida que a graduação de Patnaik aumenta, diminui o tempo médio de sobrevivência e piora o prognóstico. O quadro 3 apresenta vários estudos que estabelecem uma relação entre o prognóstico e o sistema de graduação de Patnaik.
Quadro 3: Relação entre o prognóstico do mastocitoma e o sistema de Patnaik et al. (1984). Referências
Bostock, 1973
O tempo médio de sobrevivência é de 51 semanas para mastocitomas de grau I, 28 semanas para tumores de grau II e 18 semanas para tumores indiferenciados (grau III). Patnaik et al.,
1984
Reportam taxas de sobrevivência até aos 1500 dias de 93% para o grau I, 44% para o grau II e 6% para o grau III.
Dernell, 2005
Afirma que os animais com tumores de grau III ou que se encontram em fase de metastização, possuem períodos de sobrevivência inferiores a 6 meses.
Thamm e Vail, 2007
Cerca de 80 a 90% dos animais que apresentam mastocitomas de grau I e aproximadamente 75% dos que possuem tumores de grau II, exibem um longo período de sobrevivência após a sua completa excisão cirúrgica. Por sua vez, cães que possuem tumores indiferenciados tratados cirurgicamente, normalmente morrem dentro de um ano devido a recidivas locais ou metastização.
O novo sistema de graduação de Kiupel et al. (2011), que classifica os tumores em apenas 2 graus, conseguiu eliminar as ambiguidades e fraquezas observadas no sistema de Patnaik et al. (1984), revelando maior consistência no estabelecimento do prognóstico e maior concordância entre patologistas. Este estudo demonstrou que os MCTs de grau mais elevado foram associados a menor tempo de sobrevivência, maior risco de desenvolver novos tumores/metástases e elevado risco de mortalidade. O tempo médio de sobrevivência é menor
20
que 4 meses para tumores de elevado grau e maior que 2 anos para tumores de baixo grau. O risco de mortalidade de um MCT de grau alto é 53,8 vezes maior que o de um tumor de grau baixo. Não foi encontrada nenhuma relação entre qualquer um dos graus e a ocorrência de tumores múltiplos (Kiupel et al., 2011).
1.2.5.8. Proliferação tumoral
1.2.5.8.1. Índice mitótico
O índice mitótico (IM) é utilizado para avaliar a proliferação celular de inúmeras neoplasias em medicina humana. Atualmente, vários estudos demonstraram o seu valor prognóstico no MCT canino. Esta técnica é simples uma vez que não necessita de nenhum tipo de coloração especial. A contagem das figuras mitóticas por campo pode ser efetuada através da coloração por Hematoxilina-Eosina (Romansik et al., 2007; Thompson et al., 2011). Recentemente, foi publicado um artigo que demonstrou que o IM está relacionado com o grau histológico, a taxa de metastização e o tempo de sobrevivência (Thompson et al., 2011). Os cães com IM ≤ 5 apresentam maior tempo de sobrevivência média (70 meses) do que aqueles que apresentam IM ˃ 5 (2 meses), independentemente do grau histológico (Romansik et al. 2007). No entanto, este método apresenta problemas de reprodutividade devido a diferentes seleções do campo microscópico a avaliar, variações do tamanho do campo segundo diferentes objetivas e diferentes avaliações entre patologistas (Strefezzi et al., 2010).
1.2.5.8.2. Regiões organizadoras nucleolares argirófilas (AgNORs)
As regiões organizadoras nucleolares argirófilas (AgNORs) são áreas do núcleo associadas a proteínas tais como a nucleonina e a nucleoplasmina, que estão envolvidas na transcrição do RNA ribossomal (Derenzini, 2000). Foi demonstrado que o número de AgNORs por núcleo é proporcional à taxa de proliferação celular in vitro e à taxa de crescimento tumoral in vivo. Vários estudos mencionam que os MCTs com maiores contagens de AgNORs estão associados a elevada mortalidade, recorrência local e ocorrência de metástases (Welle et al., 2008). No estudo de Bostock et al. (1989), os três graus de malignidade de Patnaik et al. (1984) apresentaram diferenças significativas no número de AgNORs por célula, estando as contagens mais elevadas associadas a tumores pouco diferenciados e, portanto, a um pior prognóstico. Esta diferença foi salientada no estudo de
21
Kravis et al. (1996) onde tumores de grau III apresentaram valores de AgNORs/célula notoriamente superiores quando comparado com tumores de grau I e II.
1.2.5.8.3. Antigénio proliferativo celular nuclear (PCNA)
O PCNA é uma proteína que interage com a ADN polimerase, agindo como um fator auxiliar na replicação e reparação do ADN. Apresenta uma semi-vida bastante longa e uma expressão máxima durante a fase de síntese de ADN (fase S) do ciclo celular (Welle et al., 2008). Dois estudos efetuados em cães com MCTs demonstraram que existe uma associação entre a expressão do PCNA e a diminuição do tempo de sobrevivência (Simoes et al., 1994; Webster et al., 2007). Simoes e os seus colaboradores referem ainda que o índice proliferativo medido pelo PCNA é mais elevado em tumores recorrentes e metastáticos (Simoes et al., 1994). No entanto, vários autores discordam e questionam estes resultados, afirmando que o índice de PCNA não se demonstrou eficaz na previsão da sobrevivência e mortalidade do
animal (Abadie et al. 1999; Scase et al. 2006; Strefezzi et al., 2010).
1.2.5.8.4. Ki-67
O Ki-67 é uma proteína nuclear não histónica que está presente nas células durante as fases ativas do ciclo celular: G1, S, G2 e M. O artigo de Scase et al. (2006) confirmou a utilidade do Ki-67 como indicador prognóstico independente da graduação histológica, demonstrando-se útil principalmente na subdivisão dos MCTs de grau II segundo a sua agressividade. Segundo os autores, os animais com MCTs de grau II que apresentavam índice de Ki-67 maior que 1,8 tinham menor probabilidade de sobrevivência (Scase et al., 2006). A expressão elevada de Ki-67 está associada ao aumento da mortalidade, a altas taxas de recorrência e metastização. Está ainda comprovado que o Ki-67 é melhor que o AgNORs a
identificar MCTs com menores taxas de sobrevivência (Simoes et al., 1994; Webster et al.,
2007). Recentemente foi publicado um estudo cujos resultados corroboram com os investigadores citados anteriormente provando que o Ki-67 é sem dúvida alguma um indicador prognóstico bastante promissor (Strefezzi et al., 2010).
1.2.5.8.5. C-kit
Similarmente à espécie humana, vários autores identificaram mutações no proto-oncogene c-kit em MCTs caninos. Na maioria desses animais (30-50%) essa mutação consiste
22
numa duplicação interna em tandem (ITD) nos exões 11 e 12 que codificam o domínio justamembranar do recetor c-kit. Como já foi mencionado anteriormente, esta região controla o c-kit por feedback negativo, e sendo assim, esta mutação origina a ativação constitutiva do recetor mesmo na ausência do seu ligando (London, 2009). Este fenómeno provoca uma proliferação celular descontrolada e está relacionado com o potencial agressivo do tumor (Strefezzi et al., 2009). Foi ainda descrito no exão 11 a deleção de um nucleótido e a substituição de outro (Riva et al., 2005), e verificou-se que um pequeno número de MCTs apresentava mutações ativadoras do recetor no domínio extracelular. Estas mutações estão associadas a diminuições de sobrevivência e à recorrência tumoral (London, 2009). Vários estudos relatam que 15% a 40% dos MCTs caninos apresentam mutações no c-kit (Welle et
al., 2008). Recentemente, foram publicados dois trabalhos que descrevem uma associação
significativa entre as mutações KIT e o grau tumoral. Segundo os autores, as mutações raramente foram observadas em tumores bem diferenciados, mas cerca de 35% dos tumores menos diferenciados apresentavam ITD (Welle et al., 2008; London, 2009).
Diferentes padrões de expressão do c-kit têm sido descritos. Os mastócitos normais e alguns mastócitos neoplásicos exprimem KIT principalmente na membrana celular, enquanto que a maioria dos mastócitos neoplásicos apresenta um padrão citoplasmático geralmente em redor do núcleo (Kiupel et al., 2004). Kiupel e seus colaboradores propuseram uma nova classificação do MCT canino baseada em três diferentes padrões de imunomarcação para o c-kit: o padrão membranar (padrão I) apresenta marcação membranar com marcação citoplasmática mínima; o padrão citoplasmático focal (padrão II) apresenta marcação citoplasmática focal ou pontilhada; e o padrão citoplasmático difuso (padrão III) apresenta marcação citoplasmática difusa podendo mascarar as restantes características citoplasmáticas. Neste estudo comprovou-se que os padrões II e III estão relacionados com taxas mais elevadas de recorrência local e menor tempo de sobrevivência (Kiupel et al., 2004).
O artigo de Webster et al. (2007) defende que para obter uma melhor caracterização do comportamento biológico do MCT deve-se avaliar conjuntamente a graduação histológica, o padrão de localização do c-kit, o número de AgNORs e Ki-67.