INSTITUTO SUPERIOR DE CIÊNCIAS DA SAÚDE
EGAS MONIZ
MESTRADO INTEGRADO EM MEDICINA DENTÁRIA
O ÓXIDO NÍTRICO E A DOENÇA PERIODONTAL
Trabalho submetido por
Mariana Mendes Perestrelo Guanilho
para a obtenção do grau de Mestre em Medicina Dentária
INSTITUTO SUPERIOR DE CIÊNCIAS DA SAÚDE
EGAS MONIZ
MESTRADO INTEGRADO EM MEDICINA DENTÁRIA
O ÓXIDO NÍTRICO E A DOENÇA PERIODONTAL
Trabalho submetido por
Mariana Mendes Perestrelo Guanilho
para a obtenção do grau de Mestre em Medicina Dentária
Trabalho orientado por
Prof. Doutora Maria Gabriela Almeida
Dedicatória
Aos meus pais,
AGRADECIMENTOS
Gostaria de expressar os meus sinceros agradecimentos à minha orientadora, Prof.
Doutora Maria Gabriela Almeida, pelo apoio na realização desta monografia e por me
ter dado a conhecer um tema que desconhecia e pelo qual desenvolvi interesse.
Ao corpo docente do Mestrado Integrado em Medicina Dentária, pela dedicação e
vontade de transmitir aos alunos os melhores conhecimentos, com rigor e excelência. A
toda a equipa de funcionários presente na faculdade, por nos proporcionarem um
ambiente relaxado e de convívio, que tanta falta faz durante o decorrer de um curso.
Aos meus amigos, que foram uma presença constante durante o meu percurso
académico; à Nádia, à Sofia e ao Pedro, por serem os melhores companheiros para a
vida. Especialmente, agradeço à Mariana, minha colega de box, que diariamente
partilhou comigo angústias e alegrias, o que permitiu aliviar a carga emocional deste
processo.
Ao João, por nunca duvidar das minhas capacidades, por ser uma presença assídua em
todas as vertentes da minha vida e por me convencer sempre de que eu seria capaz, ao
longo de todo o curso. Obrigada por todas as palavras, amor e carinho.
Por último, mas não menos importante, agradeço à minha família, que não duvidou de
mim por um segundo. Particularmente, agradeço aos meus enormes pais, Luís e Dulce,
que são a causa deste meu percurso. Sem eles, não teria sido possível a concretização
deste curso. Obrigada por desejarem sempre o melhor para mim, por acreditarem e
confiarem cegamente em mim e por terem seguido ao meu lado durante toda esta
viagem, com o carinho e preocupação que vos é característico.
1
RESUMO
A doença periodontal é uma das doenças do corpo humano com maior prevalência
a nível mundial e que, por apenas desenvolver sinais num estado mais avançado, é
considerada uma doença silenciosa. Dadas estas características, urge a necessidade de
entender e definir com clareza os intervenientes no desenvolvimento desta patologia. O
óxido nítrico é uma molécula que tem sido fortemente associada ao processo
fisiopatológico da doença periodontal e, por esse motivo, esta monografia centra-se na
compreensão dos mecanismos através dos quais esta molécula interfere no
desenvolvimento da doença.
Apesar de já se terem publicados vários trabalhos nesta temática, os mecanismos
pelos quais o óxido nítrico modula o progresso da doença periodontal e as condições em
que este se torna patológico ainda não estão claramente identificados e esclarecidos.
Como tal, é necessário aprofundar e realizar novos estudos com a perspectiva de se
conseguir, no futuro, implementar correcta e atempadamente medidas terapêuticas de
combate à doença. Por outro lado, importa investigar com clareza, a presença (ou não)
do óxido nítrico na doença periodontal, de modo a comprovar a hipótese de este ser um
biomarcador da mesma. Se se confirmar a associação do óxido nítrico à doença
periodontal, o desenvolvimento e aplicação de um teste rápido para detecção desta
molécula poderia facilitar o diagnóstico da doença periodontal e assim, evitar uma
progressão irreversível da mesma.
3
ABSTRACT
The periodontal disease is one of the most prevalent diseases of the human body
worldwide, being considered a silent disease that develops signs at a late stage only. As
so, there is an urgent need to better understanding the molecular mechanisms underlying
the disease onset and development. Nitric oxide is a molecule that has been strongly
associated to the patophysiological process of the periodontal disease. Therefore, the
aim of this monography is to describe the current state-of-the-art regarding the
mechanisms involving nitric oxide with/on the periodontal disease.
Despite many studies have been already published, the mechanisms by which
nitric oxide modulates the progression of periodontal disease and the conditions in
which it becomes pathological have not yet been clearly understood. Thus, new studies
on this topic should be performed in order to properly implement new therapies against
the disease. In addition, one should investigate the correlation between nitric oxide and
periodontal disease to prove its potential role as biomarker. In such a case, the
development of a point-of-care tests for nitric oxide would be very helpful for the
periodontal disease diagnosis, thereby avoiding its irreversible progression.
5
ÍNDICE GERAL
I. INTRODUÇÃO ... 15
II. DESENVOLVIMENTO ... 17
1. DOENÇA PERIODONTAL ... 17
1.1. Anatomia do Periodonto ... 17
1.2. Classificação da Doença Periodontal ... 20
1.3. Mecanismos da Doença Periodontal ... 22
2. ÓXIDO NÍTRICO ... 25
2.1. Características do Óxido Nítrico ... 25
2.2. Biossíntese do NO ... 26
2.2.1. Via L-Arginase – NO ... 26
2.2.2. Via Nitrato – Nitrito – Óxido Nítrico ... 27
2.3. Sintases do Óxido Nítrico - NOS ... 29
3. ÓXIDO NÍTRICO E DOENÇA PERIODONTAL ... 34
3.1. Formação de Agentes Oxidantes ... 35
3.2. Citotoxicidade do peroxinitrito ... 36
3.3. Modificação de proteínas – Nitração da tirosina ... 36
3.4. Peroxidação lipídica ... 37
3.5. Produção de metaloproteinases da matriz ... 38
3.6. Danos no ADN ... 39
3.7. Reabsorção Óssea ... 41
4. MEDIÇÃO DOS NÍVEIS DE ÓXIDO NÍTRICO ... 44
4.1. Medição de produtos do NO ... 44
4.2. Medição de iNOS ... 48
III. CONCLUSÃO ... 49
7
ÍNDICE DE FIGURAS
Figura 1. Composição da gengiva e área de contacto entre esta e o esmalte (Adaptado
de Lindhe et al., 2003)……….……….……..18
Figura 2. Medição com sonda periodontal de sulco gengival em gengiva saudável
(Adaptado de Lindhe et al., 2003) ………...………...18
Figura 3. Orientação das fibras do ligamento periodontal (Adaptado de Lindhe et al.,
2003). ……….19
Figura 4. Corte seccional do osso alveolar da maxila que suporta as raízes dentárias
(indicadas pelas setas) (Adaptado de Lindhe et al., 2003) ………….……..20
Figura 5. Medição de bolsa periodontal com sonda periodontal graduada. (Adaptado de
Nyman & Lindhe, 2003)……….…21
Figura 6. Várias fases da doença periodontal (Traduzido e adaptado de Kinane et al.,
2017) ………. 22
Figura 7. Imagem da arcada inferior de paciente periodontal antes (A) e após (B)
destartarização (Adaptado de Nyman & Lindhe, 2003) …………..………..23
Figura 8. Formação de Óxido Nítrico a partir de L-arginina, numa reacção catalisada
pela NOS (Adaptado de Dusse et al., 2003) ………. 26
Figura 9. Ciclo do nitrato – nitrito – NO (Adaptado e traduzido de Lundberg et al.,
2009)………...28
Figura 10. Estrutura molecular da enzima NOS. (Traduzida e adaptada de Lorin et al.,
2013) ………..29
Figura 11. Isoformas da NOS (Adaptado de Dusse et al., 2003)……….30
Figura 12. NOS e as suas funções (Traduzido e adaptado de Förstermann & Sessa,
2012) ………..33
Figura 13. Estímulo da produção de prostaglandinas através da activação da COX-2
pelo NO (Traduzido e adaptado de Needleman & Manning, 1999) ….…….42
Figura 14. O peroxinitrito é sintetizado através da reacção entre o óxido nítrico e o
superóxido e activa a COX-2, que sintetiza PGE2 a partir do araquidonato
9
ÍNDICE DE TABELAS
Tabela 1. Características de estudos que comparam os níveis de NO na doença
11
LISTA DE ABREVIATURAS, SIGLAS E ACRÓNIMOS
8-oxo-dG– 8-Hidroxidesoxiguanosina
ADN – Ácido Desoxirribonucleico
ATP –Adenosina Trifosfato
BH4– Tetrahidrobiopterina
CaM– Calmodulina
COX-2 –Cicloxigenase-2
DesoxiHb –Desoxihemoglobina
eNOS – Sintase do Óxido Nítrico Endotelial, do inglês Endothelium Nitric Oxide
Synthase
FAD - Dinucleótido de Flavina e Adenina, do inglês Flavin Adenine Dinucleotide
FMN – Mononucleótido de Flavina, do inglês Flavin Mononucleotide
cGMP – Monofosfato de Guanosina Cíclico, do inglês Cyclic Guanosine
Monophosphate
GSNO – S-nitrosoglutationa
HbFe3+– Metahemoglobina
HbFe3+–NO– Hemoglobina Nitrosil Ferrosa
iNOS– Sintase do Óxido Nítrico Induzida, do inglês Induced Nitric Oxide Synthase
L-arg –L-Arginina
L-NA– NG-nitro-L-arginina
12
L-Name– NG-nitro-L-arginina-metil-éster
L-NIO– N-imino-etil-L-ornitina
L-NMMA– NG-monometil-L-arginina
LOO• – Radical Peroxil Lipídico
LOOH –Hidroperóxido Lipídico
MDA –Malondealdeído
MMP –Metaloproteinase da Matriz, do inglês Matrix Metalloproteinase
NAD+ – Dinucleótido de Nicotinamida e Adenina Oxidado, do inglês Oxidized
Nicotinamide Adenine Dinucleotide
NADPH –Fosfato de Dinucleótido de Nicotinamida e Adenina Reduzido, do inglês
Reduced Nicotinamide Adenine Dinucleotide Phosphate
NFкB– Factor Nuclear кB, do inglês Nuclear Factor кB
nNOS– Sintase do Óxido Nítrico Neuronal, do inglês Neuronal Nitric Oxide Synthase
NOS– Sintase do Óxido Nítrico, do inglês Nitric Oxide Synthase
OxiHb– Oxihemoglobina
PARP– Poli(ADP-ribose) Polimerase
PGE2 – Prostaglandina E2
PMN –Neutrófilo Polimorfonuclear, do inglês Polimorphonuclear Neutrophil
RANK–Activador do Receptor do Factor Nuclear кB, do inglês Receptor Activator of
Nuclear Factor кB
RANKL–Activador do Receptor do Ligando do Factor Nuclear кB, do inglês Receptor
Activator of Nuclear Factor кB Ligand
13
ROS –Espécie Reactiva do Oxigénio, do inglês Reactive Oxygen Specie
SOD –Dismutase do Superóxido, do inglês Superoxide Dismutase
O Óxido Nítrico e a Doença Periodontal
Introdução
15
I. INTRODUÇÃO
A doença periodontal é uma doença progressiva e inflamatória associada à
destruição dos tecidos que suportam os dentes na cavidade oral, denominados por
periodonto (Nanci & Bosshardt, 2006; Antonini, Cancellier, Ferreira, Scaini & Streck,
2013).
Esta doença afecta mais de 50% da população com idade superior a 50 anos e
inicia-se com a presença de placa bacteriana junto à margem gengival. Existem duas
formas de expressão da doença periodontal: a gengivite e a periodontite. A presença de
bactérias desencadeia um processo inflamatório na gengiva, e, nesta fase, a doença é
denominada por gengivite. Quando a presença de placa bacteriana não é eliminada, a
doença progride e a inflamação atinge não só a gengiva como o resto dos tecidos que
circundam o dente, levando à destruição destes tecidos e à perda de inserção do dente
nos mesmos. Nesta fase, quando existe destruição tecidular, a doença é designada por
periodontite (Antonini et al., 2013; Larsen & Fiehn, 2017; Kinane, Stathopoulou &
Papapanou, 2017). Actualmente, distinguem-se duas formas de periodontite: crónica e
agressiva. A primeira decorre de modo lento, enquanto a segunda tem uma evolução
rápida (Antonini et al., 2013).
Esta patologia, apesar de ser despoletada apenas quando existe placa bacteriana,
é multifactorial e relaciona-se também com a qualidade imunitária do hospedeiro. Numa
fase inicial, ocorre uma inflamação em resposta à presença de bactérias, apesar de esta
ser totalmente reversível. Caso não se remova o estímulo bacteriano, a resposta
imunitária é excessiva, a inflamação persiste e existe perturbação da homeostase, o que
promove a evolução e agravamento da doença (Cekici, Kantarci, Hasturk & Van Dyke,
2014).
A doença periodontal não provoca dor quando é iniciada e pode nem vir a
provocar dor numa fase mais avançada, uma vez que as vias de sinalização nervosa
estão desreguladas. Por este motivo, o hospedeiro provavelmente não se aperceberá da
sua condição a menos que faça visitas regulares ao médico dentista que, clinicamente e
após breve análise, pode identificar a presença da doença. Visto que é uma das
patologias com maior prevalência a nível mundial, seria importante compreender
claramente os mecanismos adjacentes ao início e propagação da doença, bem como
existir um método de diagnóstico de uso fácil e prático que permitisse identificar
O Óxido Nítrico e a Doença Periodontal
16
inflamação tecidular até uma fase irreversível (Kim, Kim & Camargo, 2013; Hasturk &
Kantarci, 2015).
O óxido nítrico (NO) está associado ao desenvolvimento da doença periodontal,
pois a sua concentração aumenta devido ao processo inflamatório que decorre durante a
evolução da patologia. Se por um lado, o óxido nítrico tem uma função de defesa contra
os microrganismos periodontais, por outro lado, tem também um papel na destruição
dos tecidos quando em quantidades excessivas, levando a um descontrolo e aumento da
gravidade da doença (Borkar, Buthada & Pandagale, 2016).
O óxido nítrico é uma molécula com múltiplas funções de extrema importância
no corpo humano, onde se encontra em pequenas concentrações. Além da actividade
citotóxica contra bactérias, fungos e organismos protozoários (Borkar et al., 2016), tem
a capacidade de fornecer imunidade ao hospedeiro, e desempenha um papel como
mediador em diversos processos fisiológicos e fisiopatológicos (Sundar, Krishnan,
Krishnaraj, Hemalatha & Alam, 2013). Entre os fisiopatológicos destaca-se, nesta
monografia, a já referida resposta destrutiva do óxido nítrico em relação à placa
bacteriana que acaba por levar, directa ou indirectamente, à osteoclasia do osso que
circunda o dente (Herrera et al., 2011).
Por ser uma molécula altamente reactiva na presença de oxigénio, a medição
directa de óxido nítrico nos fluídos humanos está dificultada. O nitrito e o nitrato são
produtos finais da oxidação do óxido nítrico e são, claramente, mais estáveis do que
este. Como tal, podem ser utilizados como indicadores da presença do óxido nítrico,
tornando esta molécula um biomarcador indirecto da doença periodontal. Refira-se que
definir biomarcadores de uma doença permite não só identificá-la precocemente como,
Desenvolvimento
17
I. DESENVOLVIMENTO
1. DOENÇA PERIODONTAL
1.1. Anatomia do Periodonto
O periodonto é definido pelo conjunto de tecidos presentes na cavidade oral que
oferecem suporte aos dentes, permitindo-lhes manter a sua posição e função. Esses
tecidos são a gengiva (ou junção dentogengival), o cimento, o ligamento periodontal e o
osso alveolar (Nanci & Bosshardt, 2006).
Gengiva – Junção dentogengival
A junção dentogengival é compreendida como a porção de gengiva que se
encontra virada para o dente, constitui a mucosa oral mastigatória, e é formada por
tecido epitelial e por uma camada de tecido conjuntivo abaixo desta (Lindhe, Karring &
Araújo, 2003; Nanci & Bosshardt, 2006).
O epitélio juncional é constituído por epitélio escamoso estratificado e abraça a
porção cervical do dente. O tecido conjuntivo suporta o epitélio juncional e é bastante
vascularizado. A alta vascularização do tecido conjuntivo explica o facto de existir no
local, mesmo em condições de saúde, um infiltrado de células inflamatórias como
neutrófilos polimorfonucleares (PMNs) e linfócitos T. Estas células, bem como os
monócitos característicos do tecido conjuntivo, vão passando para o epitélio juncional e
ocupam os seus espaços intercelulares. Após a sua passagem para o epitélio juncional,
os PMNs e monócitos passam para o sulco gengival e, aí, actuam na defesa contra a
população microbiana. Assim, o epitélio representa uma barreira entre a cavidade oral e
o resto dos tecidos periodontais, sendo considerado a primeira linha de defesa física
contra os organismos patogénicos (Nanci & Bosshardt, 2006).
A gengiva apresenta duas porções: a sua porção livre, denominada gengiva livre,
O Óxido Nítrico e a Doença Periodontal
18
Figura 1. Composição da gengiva e
área de contacto entre esta e o esmalte
(Adaptado de Lindhe et al., 2003).
Numa condição de saúde, existe um espaço de pequenas dimensões, denominado
sulco gengival, entre a margem da gengiva livre e o dente, que pode ser medido através
de sonda periodontal (Lindhe et al., 2003).
Figura 2. Medição com sonda periodontal de sulco gengival em gengiva saudável (Adaptado de Lindhe
Desenvolvimento
19 Cimento:
O cimento é um tipo de tecido conjuntivo que se encontra na superfície da raiz do
dente e tem como principal função a ligação às fibras do ligamento periodontal.
Classifica-se em dois tipos, diferenciados pela ausência ou presença de células: cimento
acelular e cimento celular. O primeiro tipo, acelular, representa uma importante fonte de
suporte periodontal por ter em si inseridas as principais fibras do ligamento periodontal,
conhecidas como fibras de Sharpey. O segundo tipo, celular, está principalmente
presente no terço apical ou na metade apical da raiz, bem como nos locais de furca da
raiz, apesar de se poder encontrar também ao longo de toda a raiz, devido à sua função.
Como tem na sua constituição cimentoblastos, que produzem colagénio, e cimentócitos,
retidos na matriz formada pelo colagénio, o cimento celular é considerado um reparador
de tecidos por ter capacidade de preencher pequenas falhas na raiz (Lindhe et al., 2003;
Nanci & Bosshardt, 2006).
Ligamento periodontal:
O ligamento periodontal é o tecido conjuntivo especializado e altamente
vascularizado que faz a ligação entre o cimento e a parede óssea alveolar (Lindhe et al.,
2003). Tem como função primordial o suporte do dente no seu espaço no osso alveolar
e actua como receptor sensorial, permitindo perceber qual é a correcta posição da
mandíbula durante a mastigação. Para além disso, reserva células que permitem a
reparação ou regeneração tecidular (Nanci & Bosshardt, 2006). As fibras do ligamento
periodontal têm diferentes disposições e organizam-se espacialmente da seguinte forma:
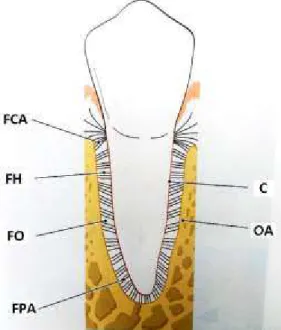
Figura 3. Orientação das fibras do ligamento
periodontal (Adaptado de Lindhe et al., 2003).
FCA = fibras da crista alveolar;
FH = fibras horizontais;
FO = fibras horizontais;
FPA = fibras de posição apical;
C = cimento;
O Óxido Nítrico e a Doença Periodontal
20 Osso alveolar:
O processo alveolar é o local no osso maxilar e mandibular onde estão presentes
espaços onde se alojam as raizes dentárias, chamados alvéolos. O osso da maxila e da
mandíbula é constituído por corticais de osso compacto, um centro esponjoso e osso
alveolar, que circunda o alvéolo. O osso alveolar, importante no suporte do dente, é
constituído por várias fibras intrínsecas e apresenta, quase perpendiculares à sua
superfície, as fibras de Sharpey, que são a extremidade das fibras extrínsecas que
provêm do ligamento periodontal (Nanci & Bosshardt, 2006).
Figura 4. Corte seccional do osso alveolar da maxila que suporta as raízes dentárias (indicadas pelas
setas) (Adaptado de Lindhe et al., 2003).
1.2. Classificação da Doença Periodontal
A doença periodontal é uma doença progressiva e imuno-inflamatória causada
pela presença de bactérias que levam à destruição dos tecidos do periodonto (Silva et
al., 2015; Meyle & Chapple, 2015; Harvey, 2017; Nedzi-Góra, Kowalski, & Górska,
2017). A inflamação dos tecidos leva à perda do tecido conjuntivo e osso, que dá
origem a um espaço onde outrora ocorria a ligação entre tecidos periodontais e dente,
Desenvolvimento
21
epitélio juncional na direcção apical da raiz (Nanci & Bosshardt, 2006; Silva et. al,
2015).
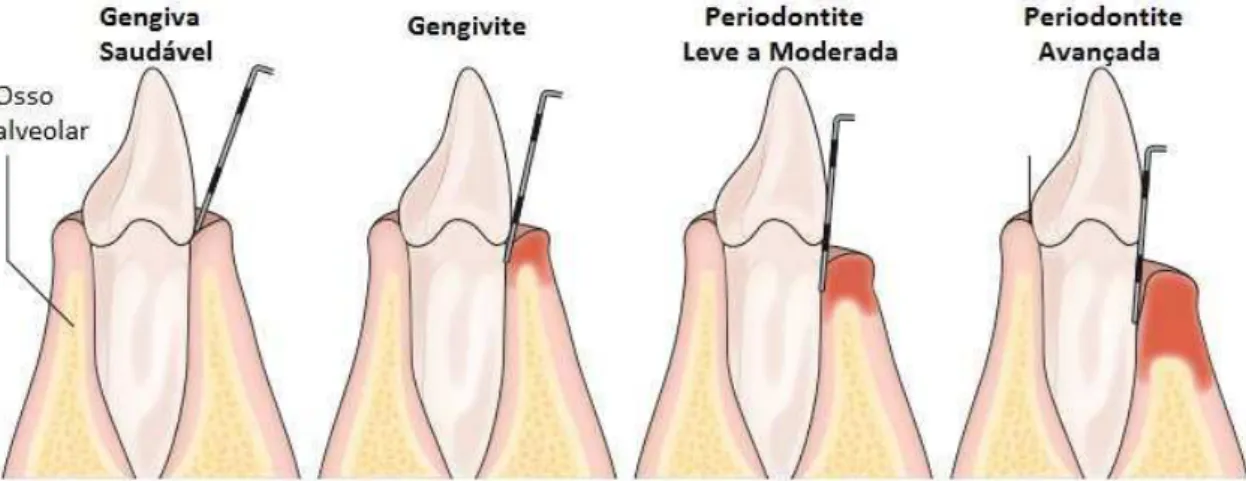
Doença periodontal é um termo que compreende duas condições patológicas:
gengivite e periodontite. Na primeira, existe apenas uma inflamação gengival causada
pelas bactérias presentes na margem gengival. Se estas bactérias não forem removidas
por um meio mecânico, a doença progride para a forma mais avançada da doença, a
periodontite. Nesta condição, ocorre perda irreversível dos tecidos periodontais devido à
progressão da inflamação e surgem, assim, as bolsas periodontais (Antonini et al., 2013;
Kinane et al., 2017; Harvey, 2017).
Figura 5. Medição de bolsa periodontal com sonda periodontal graduada (Adaptado de Nyman & Lindhe,
2003).
A gengivite não tem, obrigatoriamente, de evoluir para periodontite, mas a
periodontite é precedida pela gengivite. A periodontite pode apresentar variadas formas:
de progressão mais lenta e menos invasiva, em que é considerada crónica, ou numa
versão em que a destruição tecidular é mais rápida e invasiva e, neste caso, designa-se
O Óxido Nítrico e a Doença Periodontal
22
Figura 6. Várias fases da doença periodontal (Traduzido e adaptado de Kinane et al., 2017).
O depósito de bactérias nos locais onde existe doença periodontal pode levar a
uma bacterémia que causa outras doenças sistémicas. Sabe-se, por ter sido largamente
estudado, que as bactérias localizadas nas bolsas periodontais estão amplamente
associadas a endocardite infecciosa, doenças cardiovasculares através da formação de
ateromas nos vasos sanguíneos, diabetes mellitus, infecções respiratórias e até
nascimento prematuro de bebés com baixo peso (Harvey, 2017).
1.3.Mecanismos da Doença Periodontal
O principal factor etiológico da doença periodontal é a presença do biofilme
bacteriano, muito embora se saiba que não é consequência única para a doença se iniciar
já que o biofilme, por si só, não consegue causar a doença. Entre os factores
responsáveis pela iniciação da doença periodontal estão também a genética, o sistema
imunitário, o ambiente, os comportamentos e a medicação tomada, o que faz desta
doença uma condição multifactorial e de elevada complexidade (Meyle & Chapple,
2015; Harvey, 2017).
A formação da placa bacteriana inicia-se, essencialmente, com bactérias aeróbias
que aderem, através de adesinas, às superfícies duras da cavidade oral – como o
esmalte, dentina ou cimento – quando não se procede à higienização local.
Posteriormente, com o aumento das camadas bacterianas, a quantidade de oxigénio vai
Desenvolvimento
23
através de uma ligação entre bactérias aeróbias e anaeróbias provavelmente conseguida
através da Fusobacterium nucleatum, que tem capacidade de ligação a todas as
moléculas da placa bacteriana. Se esta última não for removida, sofre uma calcificação e
passa a chamar-se tártaro. O tártaro, tanto sub- como supra-gengival, está bastante
associado à doença periodontal e não se consegue remover com a escovagem simples.
Para além disso, esta calcificação, devido à sua localização e rugosidades, funciona
como depósito de mais bactérias, o que provoca o seu aumento (Larsen & Fiehn, 2017;
Harvey, 2017).
Figura 7. Imagem da arcada inferior de paciente
periodontal antes (A) e após (B) destartarização
(Adaptado de Nyman & Lindhe, 2003).
Entre as bactérias anaeróbias mais conhecidas da doença periodontal estão a
Porphyromonas gingivalis, Aggregatibacter actinomycetemcomitans, Tannerella
forsythia e a Treponema denticola, que são consideradas periopatogénicas e
desencadeiam processos de imunidade inata, adaptativa e inflamatória (Silva et. al,
2015; Nedzi-Góra et al., 2017). A resposta do sistema imunitário do hospedeiro
desencadeia libertação de mediadores pró-inflamatórios como o factor de necrose
tumoral α (TNF-α), interleucina 1β (IL-1β) e prostaglandina E2 (PGE2), cujo papel tem vindo a ser conhecido na destruição do osso alveolar na doença periodontal (Nedzi-Góra
et al., 2017; Harvey, 2017). Também actuam, associados à imunidade adaptativa,
O Óxido Nítrico e a Doença Periodontal
24
ligando do factor nuclear кB (RANKL, do inglês receptor activator of nuclear factor
kappa-B ligand). O RANKL permite a activação do RANK, que participa na
diferenciação dos osteoclastos, responsáveis pela reabsorção do osso alveolar
característica da periodontite (Cekici et al., 2014; Harvey, 2017).
Quando há um estímulo inflamatório, os neutrófilos polimorfonucleares são das
primeiras células a chegar ao local inflamado. Têm uma capacidade de fagocitose das
células bacterianas e a sua desgranulação no local provoca a libertação de enzimas que
têm a capacidade de degradar tecidos adjacentes e matriz extracelular (Silva et. al,
2015), como as metaloproteinases da matriz extracelular (MMPs). Numa situação
equilibrada, estas MMPs ligam-se a receptores chamados tecidos inibidores de
metaloproteinases (TIMPs); caso haja desequilíbrio, as MMPs iniciam a decomposição
do tecido conjuntivo (Nedzi-Góra et al., 2017).
Os macrófagos, que têm capacidade fagocitária, são outro tipo de células que se
deslocam até ao local de inflamação periodontal. Para além da função previamente
conhecida de fagocitose realizada por estas células, sabe-se agora que estas têm
receptores que permitem a ligação a antigénios patogénicos. Esta ligação desencadeia,
no local, a secreção pelas células do hospedeiro de mais mediadores pró-inflamatórios,
propagando a inflamação (Nedzi-Góra et al., 2017).
A destruição tecidular característica desta patologia deve-se, resumidamente, a um
Desenvolvimento
25
2. ÓXIDO NÍTRICO
2.1. Características do Óxido Nítrico
O óxido nítrico é uma molécula radicalar altamente reactiva. Em condições
normofisiológicas, desempenha o seu papel como mensageiro em processos de
neurotransmissão, regulação do tónus vascular e participa na imunidade do hospedeiro,
desempenhando, portanto, um importante papel a nível cardiovascular, a nível do
sistema nervoso central e a nível imunológico. Assim, prevê-se que quando existem
alterações na quantidade desta molécula mensageira, possam ser desencadeados
processos fisiopatológicos. O que distingue o seu carácter fisiológico ou nocivo são as
condições em que este é sintetizado, as células que o produzem ou com as quais entra
em contacto, as quantidades em que é produzido e qual o seu destino químico (Barreto,
Correia & Muscará, 2005; Çanarçi & Doğan, 2014).
O óxido nítrico é um gás no seu estado puro, apesar de ter solubilidade elevada
em meios apolares, pelo que, em meio biológico, é encontrado em membranas e
proteínas. Ao reagir com o oxigénio (O2), o NO dá origem a dióxido de nitrogénio
(NO2). (Reacção A) O NO2, por sua vez, reage com NO ou com outra molécula de NO2
e dá origem a trióxido de dinitrogénio (N2O3) (Reacção B) ou tetróxido de dinitrogénio
(N2O4) (Reacção C), respectivamente. O N2O3 e o N2O4 são espécies que reagem
rapidamente com a molécula de água (H2O) e dão origem a nitrito (NO2-) e a nitrato
(NO3-) (Reacção D e E, respectivamente). Por conseguinte, os nitratos e nitritos são
considerados os metabolitos finais da oxidação do NO (Cerqueira & Yoshida, 2002;
Barreto et al., 2005).
(A) 2 NO + O2 → 2 NO2
(B) NO + NO2 → N2O3
(C) NO2 + NO2 → N2O4
(D) N2O3 → 2 NO2- + 2 H+
O Óxido Nítrico e a Doença Periodontal
26
Actualmente, sabe-se que existem duas vias de produção do óxido nítrico: a via
clássica L-arginase – NO, realizada pelas sintases do óxido nítrico, e a via alternativa
nitrato – nitrito – óxido nítrico (Zhao, Vanhoutte & Leung, 2015).
2.2. Biossíntese do NO
2.2.1. Via L-Arginase – NO
A L-arginina é o aminoácido do qual provem o óxido nítrico sintetizado pela via
clássica L-arginina – NO. Este processo resulta na conversão deste aminoácido em
L-citrulina e NO e envolve duas fases. Na primeira, ocorre a hidroxilação de um dos
nitrogénios da L-arginina, gerando N-hidroxi-L-arginina. Como co-substratos desta
hidroxilação temos o oxigénio molecular e o dinucleotido nicotinamida adenina na sua
forma reduzida e fosfatada (NADPH), que funciona como fornecedor de electrões. Na
etapa que se segue, a N-hidroxi-arginina sofre uma oxidação e é convertida em
L-citrulina, com a consequente libertação de NO. Para que ocorra a produção de NO
através da conversão da L-arginina em L-citrulina são necessários vários co-factores
redox como o mononucleótido de favina (FMN), o dinucleótido de favina e adenina
(FAD), a tetrahidrobiopterina (BH4) e um grupo heme (Förstermann & Sessa, 2012;
Lorin et al., 2013; Zhao et al., 2015). Este processo de síntese do NO depende de uma
família de enzimas citosólicas conhecidas como sintases do óxido nítrico (NOS, do
inglês Nitric Oxide Synthase) (Förstermann & Sessa, 2012; Lorin et al., 2013).
Figura 8. Formação de Óxido Nítrico a partir de L-arginina, numa reacção catalisada pela NOS
Desenvolvimento
27
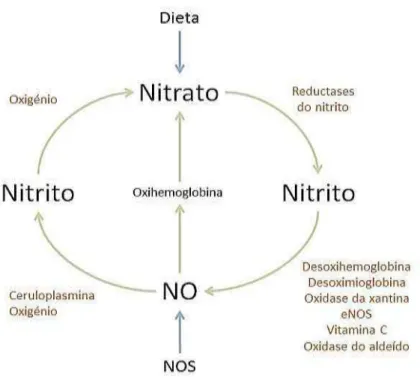
2.2.2. Via Nitrato – Nitrito – Óxido Nítrico
O nitrato e o nitrito foram, até determinada altura, considerados produtos da
oxidação do óxido nítrico com propriedades indesejadas para o organismo (Lundberg,
Weitzberg & Gladwin, 2008). Contudo, sabe-se hoje em dia, que estes iões não só
produzem óxido nítrico, como se reconhece que têm funções fisiológicas importantes no
organismo. Por exemplo, desempenham um papel na regulação da pressão sanguínea e
têm um efeito vasodilatador em condições de hipóxia (Kim-Shapiro & Gladwin, 2014).
Tal como visto na secção anterior, na via clássica de formação de óxido nítrico
(via L-arginina – óxido nítrico), o oxigénio é um co-substrato essencial à reacção.
Porém, se o sistema entrar num estado de hipoxia, é progressivamente activada a via
nitrato – nitrito – óxido nítrico. Apesar de não se saber exactamente em que momento e
com que níveis de oxigénio a última via é activada, esta tem vindo a ser considerada um
complemento à via clássica de formação de óxido nítrico por permitir manter os níveis
deste necessários ao funcionamento fisiológico dos organismos num meio com falta de
oxigénio. Esta via caracteriza-se pela redução do nitrato a nitrito e, em seguida, pela
redução deste a óxido nítrico (Lundberg et al., 2008).
Redução do Nitrato a Nitrito:
Inicialmente, o NO3- é convertido em NO2-. A sialina, expressa em vários tecidos,
é uma proteína membranar que funciona como transportadora de aniões inorgânicos e
tem principal destaque nas glândulas parótida, submandibular, tiróide, no cérebro,
fígado, rim e pâncreas. Esta proteína permite o transporte do nitrato desde a circulação
sanguínea até às glândulas salivares (Qu et al., 2016).
As bactérias presentes na cavidade oral são essenciais para o início da via nitrato –
nitrito – óxido nítrico (Bryan & Loscalzo, 2011). São as bactérias anaeróbicas que se
encontram nas criptas profundas da região posterior da língua que reduzem o nitrato a
nitrito através de redutases do nitrato (Qu et al., 2016).
Redução do Nitrito a Óxido Nítrico:
Em condições de hipóxia, onde existe uma redução da tensão de oxigénio, a
O Óxido Nítrico e a Doença Periodontal
28
mudança na sua estrutura quaternária (Zhao et al., 2015). A desoxiHb funciona como
uma enzima redutase de nitrito. O nitrito reage com o ferro presente na
desoxihemoglobina (HbFe2+) e com um protão (H+) para formar o óxido nítrico (NO) e
metahemoglobina (HbFe3+). (Reacção I)
I. NO2- + HbFe2+ + H+ → NO + HbFe3+ + OH
-Posteriormente, o NO formado através da redução do nitrito, reage com uma nova
desoxihemoglobina e forma a hemoglobina nitrosil ferrosa (HbFe3+–NO). (Reacção II)
II. NO + HbFe2+ → HbFe2+–NO
Após análise destas reacções, é possível considerar-se a hemoglobina como uma
enzima que, em situações em que a concentração de oxigénio está diminuída, tem uma
acção na sinalização e vasodilatação hipóxicas, uma vez que permite a formação de NO
através da redução do nitrito (Lundberg et al., 2008).
Desenvolvimento
29
Para além da hemoglobina, também outras proteínas como a neuroglobina,
citoglobina e mioglobina actuam como redutases do nitrito com o objectivo de formar
NO de uma maneira independente das sintases do óxido nítrico, através de mecanismos
idênticos aos referidos anteriormente. No entanto, a produção de NO pela
desoximioglobina é concisamente superior à produzida pelas outras globinas
(Kim-Shapiro & Gladwin, 2014).
Outras proteínas como a oxidase do citocromo c mitocondrial, a eNOS, a oxidase
do aldeído e ainda a oxirredutase da xantina (esta última em anoxia) têm capacidade de
participar na manutenção da concentração de NO formado a partir da redução do nitrito
(Lundberg et al., 2008; Zhao et al., 2015).
Apesar de estes produtos finais do óxido nítrico serem considerados como
estáveis e inertes, percebe-se agora que, em condições específicas, eles tem a
capacidade de se reciclarem e produzirem, novamente, óxido nítrico (Bryan & Loscalzo,
2011).
2.3. Sintases do Óxido Nítrico – NOS
As enzimas NOS são dímeros que funcionam como dioxigenases formados por
dois domínios: o domínio redutase (C-terminal) e o domínio oxigenase (N-terminal)
(Förstermann & Sessa, 2012; Lorin et
al., 2013).
Figura 10. Estrutura molecular da enzima NOS
O Óxido Nítrico e a Doença Periodontal
30
É o domínio N-terminal (oxigenase) que se liga ao substrato L-arginina, ao grupo
heme, ao co-factor BH4 e ao oxigénio molecular. No domínio C-terminal (redutase),
dá-se a união aos co-factores FMN, FAD e ao co-substrato NADPH, do qual são
transferidos electrões para o domínio amino-terminal (oxigenase) (Förstermann &
Sessa, 2012; Lorin et al., 2013).
São conhecidas três isoformas destas enzimas: a sintase do óxido nítrico neuronal
(nNOS ou NOS1), a sintase do óxido nítrico induzida (iNOS ou NOS2) e a sintase do
óxido nítrico endotelial (eNOS ou NOS3). As isoformas nNOS e eNOS são
consideradas sintases constitutivas. Todas as isoformas utilizam a L-arginina como
substrato, o NADPH e o O2 como co-substrato e FMN, FAD, BH4, calmodulina (CaM)
e um grupo heme como co-factores (Lorin et al., 2013).
Figura 11. Isoformas da NOS (Adaptado de Dusse et al., 2003).
Nas sintases nNOS e eNOS, a ligação à calmodulina é maior na presença de
concentrações elevadas de Ca2+ (entre 200 a 400nM), e, por isso, considera-se que estas
sintases constitutivas são cálcio-dependentes. Considera-se activada a enzima que está
ligada à CaM uma vez que é esta que permite uma maior afluência dos electrões cedidos
pelo NADPH, desde o domínio C-terminal ao domínio N-terminal. Já a enzima iNOS
consegue com facilidade uma ligação à calmodulina, independentemente da presença ou
ausência de Ca2+, uma vez que esta enzima não depende do aumento da concentração
deste ião. Esta independência permite-lhe funcionar em perfeitas condições em
Desenvolvimento
31
Até à data, sabe-se que as moléculas com estruturas análogas à L-arginina servem
como inibidoras das isoformas da enzima NOS e, destas, conhece-se:
NG-monometil-L-arginina (L-NMMA), N-imino-etil-Lornitina (L-NIO), NG-amino-L-NG-monometil-L-arginina (L-NAA),
NG-nitroL-arginina (L-NA) e o metil éster correspondente, o
NG-nitro-L-arginina-metil-éster (L-Name). Para além destes análogos da L-arg, que se ligam à NOS em vez
da arginina, também a aminoguanidina tem afinidade para a enzima iNOS. Uma vez que
se associam quantidades de óxido nítrico elevadas a patologias do organismo, seria
extremamente importante compreender profundamente o funcionamento das isoformas
da enzima NOS, de modo a ser possível utilizar inibidores com funções terapêuticas
(Dusse, Vieira & Carvalho, 2003).
Sintase do óxido nítrico neuronal – nNOS:
A nNOS é encontrada em neurónios específicos do cérebro e produz óxido nítrico
tanto no sistema nervoso central como no sistema nervoso periférico. Para além de ser
encontrada em tecidos do cérebro, encontra-se também em células da mácula densa do
rim e células pancreáticas, músculo esquelético, gânglios simpáticos e glândulas
suprarrenais, nervos nitrérgicos periféricos, células epiteliais, região sexual masculina e
medula espinhal (Cerqueira & Yoshida, 2002; Förstermann & Sessa, 2012).
O óxido nítrico produzido pela nNOS tem funções na regulação de
neurotransmissores como a acetilcolina, histamina e serotonina e na vasodilatação
através de nervos periféricos (Zhao et al., 2015). Regula a excitabilidade ou depressão
neuronal e, assim, trabalha sobre a plasticidade sináptica, o que interfere nos processos
de memória e aprendizagem (Förstermann & Sessa, 2012; Zhao et al., 2015). Os nervos
nitrérgicos com presença de nNOS provocam um relaxamento do corpo cavernoso e por
isso permitem a erecção peniana. Por este motivo, quando se detectam indivíduos com
níveis de nNOS diminuídos, é comum estes sofrerem de disfunção eréctil (Förstermann
& Sessa, 2012).
Sintase do óxido nítrico induzida – iNOS:
A iNOS é uma enzima raramente expressa em situações fisiológicas, estando
presente em condições de inflamação, causada principalmente por lipopolissacáridos
bacterianos e citocinas pro-inflamatórias. Este estímulo inflamatório tem como
O Óxido Nítrico e a Doença Periodontal
32
Sayed, 2013). É uma enzima independente da concentração de cálcio e, depois de
activada, a sua actividade não cessa (Förstermann & Sessa, 2012).
A iNOS é encontrada inicialmente em macrófagos e a expressão destes gera
grandes quantidades de óxido nítrico, durante um longo período de tempo (Förstermann
& Sessa, 2012). Presume-se que esta enzima sintetize óxido nítrico com diferentes
funções e em concentrações 1000 vezes maiores do que as produzidas pelas restantes
NOS (Cerqueira & Yoshida, 2002). Altas concentrações de óxido nítrico podem
interferir com o ADN celular e provocar a sua fragmentação, o que lhe confere uma
propriedade citoestática e citotóxica. As propriedades tóxicas do óxido nítrico permitem
não só uma acção contra os microrganismos patológicos e células tumorais, mas
também contra células vizinhas que não constituem o alvo inicial de defesa
imunológica. É por este motivo que a actividade fisiopatológica do óxido nítrico está
relacionada com a iNOS (Förstermann & Sessa, 2012). A transcrição do gene da iNOS,
que produz óxido nítrico inflamatório, é activada pelas citocinas IL-1, TNF-α e IFN-ỿ,
que são produzidas por macrófagos activados ou por LPS, sendo estas as responsáveis
pela sua síntese. Como depende de transcrição genética, a activação da iNOS é muito
mais lenta do que a activação das outras NOS, que são constitutivas. Enquanto as
enzimas constitutivas, eNOS e nNOS, conseguem produzir óxido nítrico com rapidez e
de uma maneira controlada e pontual em pequenas concentrações, a iNOS tem uma
resposta mais lenta na formação de grandes quantidades de óxido nítrico que, por serem
elevadas, são consideradas citotóxicas (Kendall, Marshall & Bartold, 2001; Guzik,
Korbut & Adamek-Guzik, 2003).
Sintase do óxido nítrico endotelial – eNOS:
A eNOS é uma das enzimas constitutivas que está presente nas células do
endotélio, embora também tenha sido detectada em plaquetas, células epiteliais
tubulares do rim, neurónios e músculo cardíaco (Förstermann & Sessa, 2012).
O óxido nítrico proveniente da eNOS está associado a um aumento do
monofosfato cíclico de guanosina (cGMP, do inglês cyclic Guanosine Monophosphate)
e da guanilil ciclase, o que provoca a dilatação de todos os vasos sanguíneos, e que lhe
confere uma característica reguladora da pressão sanguínea. Tem uma actividade
protectora relativamente à formação de ateromas: inibe ou impede a união da molécula
CD11/CD18 – molécula de adesão dos leucócitos – às paredes dos vasos sanguíneos
Desenvolvimento
33
Quando existe uma disfunção do endotélio – nas doenças cardiovasculares, por
exemplo – ocorre uma diminuição na actividade da eNOS e na consequente
bioactivação de óxido nítrico, o que provoca a desregulação da homeostase da pressão
sanguínea. Para além disso, nas doenças cardiovasculares há produção de espécies
reactivas de oxigénio (ROS, do inglês Reactive Oxygen Specie) como enzimas da cadeia
respiratória mitocondrial, oxidases de NADPH, eNOS desacopladas e oxidases de
xantina. Para além desta condição de stress oxidativo, o óxido nítrico tem, ainda,
tendência a reagir com o superóxido (O2-), o que diminui a sua biodisponibilidade
(Lorin et al., 2013).
Esta eNOS consegue produzir óxido nítrico de uma forma dependente e
independente de cálcio. A acetilcolina, bradiquinina e histamina aumentam a
concentração de cálcio intracelular através da sua união a um receptor específico da
sintase e assim, como previamente conhecido, é provocada a ligação à calmodulina e a
consequente activação da enzima. Por outro lado, as cinases conseguem regular a
actividade da eNOS ao ligarem-se a sítios específicos de fosforilação desta.
Dependendo do local, a enzima é activada ou inibida (Zhao et al., 2015).
O Óxido Nítrico e a Doença Periodontal
34
3. ÓXIDO NÍTRICO E DOENÇA PERIODONTAL
Quando existem toxinas microbiológicas ou um estímulo nocivo, inicia-se um
processo de defesa pela parte do organismo que se caracteriza por inflamação. Este
processo inactiva ou destrói os organismos nocivos e inicia uma reparação do tecido
afectado através de respostas imunitárias de carácter específico e não-específico. Numa
primeira fase da inflamação, a permeabilidade vascular aumenta e são libertados
péptidos como a interleucina-1, bem como aminas como a histamina ou a
5-hidroxitriptamina. Contudo, se existir uma desregulação ao nível das células imunitárias
e inflamatórias, a resposta aos organismos patogénicos é exacerbada e pode provocar
destruição não só dos agentes microbianos como das células saudáveis do hospedeiro
(Guzik et al., 2003).
A doença periondontal é iniciada por uma inflamação dos tecidos que circundam
o dente e nos quais se desenvolve uma resposta imune excessiva em relação à presença
de placa bacteriana. Numa fase inicial, existe uma resposta das células endoteliais e dos
leucócitos ao biofilme bacteriano, o que provoca modificações histológicas nos tecidos
que não são observáveis clinicamente. Depois, o epitélio juncional produz óxido nítrico
em resposta aos produtos metabólicos das bactérias, através de monócitos, citocinas e
neuropéptidos, o que induz a vasodilatação local. A vasodilatação permite que os
neutrófilos, macrófagos e linfócitos migrem até ao tecido conjuntivo e possam dar
continuação à resposta inflamatória. Por tal motivo, no tecido inflamado é característico
encontrarem-se as citocinas pró-inflamatórias IL-1β e TNF-α, bem como células
inflamatórias como neutrófilos e macrófagos, que são grandes produtoras de ROS e
RNS. Entre estas espécies reactivas de oxigénio e azoto, encontramos o óxido nítrico
(Kinane et al., 2017).
Como referido anteriormente, o óxido nítrico, para além das suas funções como
neurotransmissor, relaxante muscular e inibidor de agregação plaquetária, é um radical
de grande importância na imunidade e nos processos inflamatórios, e desempenha
acções protectoras, reguladoras e destrutivas. Pode ter um papel benéfico na defesa
contra microrganismos, mas, se em grandes quantidades, tem um desempenho nocivo
contra as células do hospedeiro. Neste campo, a actividade do NO considera-se bem
Desenvolvimento
35
3.1. Formação de Agentes Oxidantes
Tal como já foi referido, o óxido nítrico é citotóxico em quantidades elevadas,
porque se mostra disponível para reagir com outras biomoléculas e, assim, formar
compostos tóxicos para as células (Kendall et al., 2001). A produção de grandes
quantidades de óxido nítrico “inflamatório”, produzido pela iNOS, é, geralmente,
acompanhada por uma grande produção do anião superóxido (Guzik et al., 2003). As
oxidases de NADPH e as oxidases de xantina são as responsáveis pela produção desta
espécie nos macrófagos, a qual é obtida através de uma reacção de redução do oxigénio.
O superóxido, assim formado, apenas é desactivado pela enzima dismutase do
superóxido (SOD, do inglês superoxide dismutase). No entanto, o óxido nítrico e o
superóxido tem a capacidade de reagir um com o outro, com extrema rapidez, sem ser
necessário qualquer tipo de enzimas, que retardariam o processo. Isto faz do óxido
nítrico a única molécula que, devido às grandes concentrações e à rapidez da reacção
com o O2-, consegue competir com a SOD. Note-se que o óxido nítrico e o superóxido
reagem entre si mesmo que não tenham sido produzidos na mesma célula, uma vez que
o NO tem uma alta capacidade de se difundir entre elas. Da reacção resulta uma espécie
reactiva do azoto (RNS, do inglês Reactive Nitrogen Specie) com actividade citotóxica:
o peroxinitrito (Reacção 1) (Guzik et al., 2003; Pacher, Beckman & Liaudet, 2007).
(1) NO + O2- → ONOO-
O peroxinitrito pode apresentar-se na sua forma não protonada (ONOO-) ou
protonada (ONOOH), caso se encontre em pH neutro, e assim originar novas moléculas
com funções em mecanismos fisiológicos e patológicos (Reacção 2)
(Virág, Szabó, Gergely & Szabó, 2003; Barreto et al., 2005):
O Óxido Nítrico e a Doença Periodontal
36
3.2. Citotoxicidade do peroxinitrito
A maior parte das moléculas radicalares influencia os processos biológicos ao
alterarem a formação, estrutura e função das células. Isto acontece porque os radicais
são altamente capazes de reagir com lípidos, proteínas, hidratos de carbono e ácidos
nucleicos. O peroxinitrito é um desses radicais que, tal como descrito na secção anterior,
é formado pela reacção entre o NO e o O2- em tecidos onde decorre uma inflamação,
como é o caso de tecidos periodontais durante a doença periodontal, sendo apontado
como a principal causa de citotoxicidade do óxido nítrico (Ahmad, Rasheed & Ahsan,
2009). Em particular, o peroxinitrito é responsável por danos oxidativos, nitração e S
-nitrosilação em biomoléculas como lípidos, proteínas e ADN, revelando ter um efeito
citotóxico e mutagénico nas células, o que conduz a processos de morte celular –
apoptose, necrose, ou um processo misto (Ahmad et al., 2009; Förstermann & Sessa,
2012). Para além disso, o peroxinitrito ainda aumenta a biossíntese de IL-8, que é uma
citocina produzida por leucócitos responsável pela activação de neutrófilos, sendo
responsável por propagar a inflamação já existente (Pacher et al., 2007).
3.3. Modificação de proteínas – Nitração da tirosina
Os PMNs e os macrófagos são uma fonte importante de NO e O2-, ou seja, de
peroxinitrito. É também nos PMNs que se produz a enzima mieloperoxidase, que
interage com o peroxinitrito para dar início ao processo de modificação proteica. A
tirosina é um aminoácido que sofre nitração pelo peroxinitrito, dando origem à
nitrotirosina, que está presente no tecido gengival quando existe doença periodontal
(Lohinail et al., 2001). A nitrotirosina forma-se através da adição de um grupo nitro
(NO2-) ao grupo hidroxila do anel aromático da tirosina presente numa proteína (Pacher
et al., 2007). Este é um processo complexo que depende de alguns factores no local
como: o pH, a concentração de CO2 e a presença de glutationa. Após estudos in vitro
realizados para testar a nitração de tirosina, deBoer et. al (2014) demonstrou que, na
presença de glutationa, a produção de nitrotirosina aumenta ligeiramente. Para explicar
este aumento, propôs-se a hipótese de ocorrer uma nitrosilação da glutationa pelo óxido
nítrico, formando-se S-nitrosoglutationa (GSNO) que serve de armazém de NO no local
Desenvolvimento
37
tirosina. Também na presença de concentrações de CO2 elevadas, a produção de
nitrotirosina é aumentada. O CO2 reage com o peroxinitrito para formar
nitrosoperoxicarbonato (ONOOCO2-). Parte deste ONOOCO2- sofre uma decomposição
por enzimas homolíticas e dá origem ao radical carbonato (CO3-) e ao dióxido de
nitrogénio (NO2), que participam na produção da nitrotirosina ao reagir com o resíduo
de tirosina, em condições fisiológicas. No entanto, quando há diminuição de pH, como
em situações de inflamação, existe predominância da forma protonada do peroxinitrito,
o ácido peroxinitroso (ONOOH), em detrimento do ONOOCO2-, e passa a ser este ácido
o precursor da nitrotirosina através da sua decomposição em radical hidroxilo (OH•) e
dióxido de nitrogénio (NO2) (Pacher et al., 2007; deBoer, Palomino, Idiga, Millhauser
& Mascharak 2014). As modificações oxidativas causadas pelo peroxinitrito que dão
origem a nitrotirosina fazem com que esta seja um indicador de oxidações indesejadas
nas proteínas do organismo e um marcador biológico da presença de ONOO- (Ahmad et
al., 2009). Ao sofrer nitração, a proteína sofre uma modificação na sua estrutura e
consequentemente, da sua função. Isto pode originar, directamente, uma desintegração
do ligamento periodontal, bem como a formação de antigénios no tecido periodontal, o
que induz a formação de auto-anticorpos contra o periodonto. Para além disso, ao
ocorrer nitração do resíduo tirosina presente na enzima superóxido dismutase, esta
enzima, que tem como função inactivar o O2-, fica automaticamente modificada e
inactiva, permitindo uma maior disponibilidade do superóxido para reagir com o óxido
nítrico, formar peroxinitrito e, deste modo, levar a um ciclo inflamatório (Lohinail et al.,
2001; Pacher et al., 2007).
3.4. Peroxidação lipídica
O peroxinitrito é responsável pela peroxidação de lípidos, o que origina radicais
lipídicos que, por sua vez, levam à destruição da membrana lipídica (Pacher et al.,
2007).
O peroxinitrito pode ser apresentado na sua forma protonada, e assim,
decompor-se nos radicais altamente reactivos OH• e NO2, os quais iniciam a peroxidação lipídica
ao reagir com a membrana dos ácidos gordos polinsaturados. O ácido gordo contém na
sua fórmula um carbono alílico cujo hidrogénio é, inicialmente, capturado por um
O Óxido Nítrico e a Doença Periodontal
38
de propagação, o L• reage com o oxigénio molecular e forma um radical peroxil lipídico
(LOO•). Este radical reage, novamente, com o hidrogénio de outro lípido e gera um ciclo de peroxidação lipídica. Ao reagirem, H+ e LOO• formam um hidroperóxido
lipídico (LOOH). Este ciclo chega ao fim quando deixa de existir substrato disponível,
ou quando existe emparelhamento de radicais lipídicos com formação de produtos mais
estáveis (Hall, Wang, Bosken & Singh, 2016).
O malondealdeído (MDA) é um produto final do processo de peroxidação dos
lípidos e tem sido detectado, em vários estudos, na presença de doença periodontal.
Uma vez que nos estudos realizados se encontra sempre MDA na saliva, fluido gengival
crevicular (FGC) e sangue de indivíduos com periodontite, tal facto permite concluir
que a peroxidação lipídica está associada à doença periodontal e que este composto
pode vir a ser futuramente considerado um dos biomarcadores desta (Fentoğlu et al.,
2015).
3.5. Produção de metaloproteinases da matriz
As metaloproteinases da matriz (MMPs) são uma família de endopeptídases com
características estruturais e catalíticas bem definidas; representam um dos factores mais
importantes no desenvolvimento da doença periodontal porque têm um desempenho
activo na destruição dos constituintes da matriz extracelular. No ser humano, são
conhecidas 23 formas que são divididas em seis grupos: colagenases, gelatinases,
estromelisinas, matrilisinas, metaloproteinases tipo membrana e outras
metaloproteinases (Sapna, Gokul & Bagri-Manjrekar, 2014).
Apesar do mecanismo não ter sido, ainda, profundamente estudado, reconhece-se
que o peroxinitrito é capaz de induzir a produção de MMPs ao interagir com a
glutationa (Pacher et al., 2007). O colagénio tipo-I é um dos principais componentes do
tecido conjuntivo gengival e da matriz extracelular dos tecidos periodontais e a sua
degradação representa uma forte actividade da doença periodontal. Mesmo nas
primeiras fases da doença, onde apenas existe inflamação gengival, o colagénio já sofre
degradação para dar lugar ao infiltrado inflamatório. As colagenases 8 e a
MMP-13 têm os principais papéis na doença periodontal, e contam com o contributo das
MMP-9 e MMP-14 (Sapna et al., 2014; Cavalla, Hernández-Ríos, Sorsa, Biguetti &
Desenvolvimento
39
Na doença periodontal existe um grande afluxo de neutrófilos e leucócitos, que
são a maior fonte de MMP-8. A MMP-8 é responsável por degradar colagénio tipo-I e
tipo-III e está associada à severidade da doença periodontal, sendo maior a sua presença
quando se verificam bolsas periodontais com maior profundidade, o que significa maior
perda de tecido e inserção periodontal (Gupta, Gupta, Gupta, Khan & Bansal, 2015). É
nesta fase que se percebe que a resposta exagerada do hospedeiro aos microrganismos
bacterianos leva à destruição tecidular, já que há uma produção exacerbada de
neutrófilos polimorfonucleares, cujo aumento implica uma maior presença de MMP-8
no fluido gengival crevicular (Sapna et al., 2014; Cavalla et al., 2017). Esta MMP-8 não
está presente em locais saudáveis mas, quando existe periodontite, induz o
processamento de algumas citocinas, agravando a inflamação já existente, e degrada o
colagénio da gengiva e do ligamento periodontal, no decorrer na doença (Gupta et al.,
2015). A forte presença da MMP-8 na doença periodontal pode fazer com que, no
futuro, esta possa vir a ser considerada como um biomarcador da doença, uma vez que é
a enzima com maior capacidade catalítica de degradar do colagénio. Também a
MMP-13 actua numa fase mais avançada da doença periodontal: causa reabsorção óssea e
activa a produção de pró-MMP-9. Por conseguinte, estas duas enzimas (MMP-13 e
MMP-9) estão associadas à destruição do osso alveolar (Sapna et al., 2014; Cavalla et
al., 2017).
3.6. Danos no ADN
O peroxinitrito proveniente do NO é responsável pela morte celular através de
modificações provocadas nas moléculas de ADN (Lohinai et al., 2003; Pacher & Szabo,
2008; Ahmad et al., 2009; Islam et al., 2015).
O ADN tem na sua base purinas, que são bastante reactivas com oxidantes, e as
desoxirriboses, que sofrem clivagem (Islam, Habib, Ali, Moinudinn & Ali, 2016). O
peroxinitrito, principalmente formado através de macrófagos, tem a capacidade de se
difundir por membranas celulares e atingir o núcleo, onde causa dano. Reage com uma
purina presente na base do ADN, nomeadamente a guanina (G), para formar
nitroguanina. Esta transformação leva a guanina a abandonar a base do ADN a qual fica,
O Óxido Nítrico e a Doença Periodontal
40
que não seja a guanina, como a adenina, citosina ou timina. Estas modificações podem
levar a mutações ou mesmo à ruptura da molécula de ADN (Islam et al., 2015).
No contexto da doença periodontal, a acção do peroxinitrito sobre os processos
fisiológicos do ADN culmina na activação da polimerase poli(ADP-ribose) (PARP). A
PARP é uma enzima envolvida em vários processos fisiológicos, como a reparação do
ADN, diferenciação celular, transcrição genética, estabilidade genómica e morte celular.
Por danificar o ADN, o peroxinitrito é considerado um impulsionador fisiopatológico
desta enzima, que é, então, hiperactivada e actua na patologia de duas maneiras: por um
lado, promove a extensão da inflamação através de mecanismos pró-inflamatórios e, por
outro lado, provoca a morte celular, ao retirar do sistema energia que é necessária à vida
das células (Lohinai et al., 2003; Pacher & Szabo, 2008). Com efeito, para tentar reparar
os danos causados no ADN, a PARP liga-se aos locais de ruptura da cadeia de
nucleótidos e divide a NAD+ em nicotinamida e ADP-ribose, que depois é adicionada a
proteínas nucleares, como a histona, e à própria PARP (Virág et al., 2003; Lohinai et al.,
2003; Pacher & Szabo, 2008; Islam et al., 2016). Ou seja, a hiperactivação da PARP
causa o consumo exagerado de NAD+ intercelular, o que inibe os processos de glicólise
e transporte de electrões, daí que se considere que a reparação dos danos de ADN seja
um mecanismo energeticamente exaustivo. Como é conhecido, a glicólise é um
processo que representa uma grande fonte de energia para o organismo. Com a inibição
da glicólise, a quantidade de adenosina trifosfato (ATP) é drasticamente reduzida e
consequentemente, as células tornam-se disfuncionais e, posteriormente, necróticas.
Quando existe apoptose, a célula programa a sua morte e esse processo dá-se de
maneira controlada. Na necrose celular, que ocorre quando existe falta de ATP, as
membranas celulares perdem a sua integridade e a célula fica incapacitada de remover
os seus produtos indesejados, libertando-os descontroladamente, o que pode afectar as
células vizinhas (Islam et al., 2016).
Diversos estudos mostraram que quando se bloqueia a PARP, reduz-se a morte
celular consequente da falta de ATP. Para além disso, o bloqueio da PARP resulta numa
menor concentração de células inflamatórias e numa menor extensão de células
necróticas, por diminuição da resposta das células imunitárias. Isto significa uma
redução da actividade da iNOS, o que se traduz numa produção de óxido nítrico
diminuída e, consequentemente, numa diminuição do dano de ADN (Islam et. al, 2016;
Adachi et al., 2017). Os mesmos trabalhos permitiram concluir que, na presença de um
Desenvolvimento
41
macrófagos e ligeira queda da concentração de células gengivais com presença de
nitrotirosina, sendo todos eles indicadores da periodontite. Desta maneira, com a
inibição da PARP prevê-se uma melhoria na doença periodontal (Adachi et al., 2017).
Os níveis de PARP não são os únicos a ser utilizados para medir o dano oxidativo
do ADN na doença periodontal. Também a 8-hidroxidesoxiguanosina (8-oxo-dG), que é
considerada o melhor marcador de danos no ADN, apresenta níveis elevados em
estudos que comparam indivíduos saudáveis com pacientes periodontais (Fentoğlu et
al., 2015). A 8-oxo-dG é formada através da mutação do ADN por associação com
hidroperóxidos, que têm origem na reacção entre peroxinitrito e proteínas nos núcleos
celulares (Ahmad et al., 2009).
3.7. Reabsorção Óssea
A reabsorção do osso alveolar, característica da periodontite, tem sido fortemente
relacionada com a presença de iNOS e com a actividade do óxido nítrico. No entanto, tal opinião é controversa já que alguns estudos apontam para o facto de o óxido nítrico
ser um potencial inibidor da reabsorção óssea, quando em grandes concentrações,
enquanto que, em baixas concentrações, regula a actividade dos osteoclastos. A
controvérsia deve-se também ao facto de se associar o óxido nítrico a uma regulação do
ciclo de formação e destruição óssea mas, ao mesmo tempo, este ser estimulado pelas
citocinas que estão associadas à reabsorção óssea (Ralston et al., 1995; van’t Hof et al.,
2000).
A IL-1 é uma citocina característica da doença periodontal conhecida por ser uma
grande fonte de óxido nítrico e está bastante associada à perda óssea através da
activação de uma cascata de eventos que culmina na activação de NFкB, um complexo
proteico que desencadeia a diferenciação dos osteoclastos. Van’t Hof et al. (2002)
mostraram que, na ausência de IL-1, o óxido nítrico não tem capacidade de reabsorção
óssea, mas que para existir reabsorção óssea induzida pela IL-1 é necessário que a iNOS
não seja inibida, ou seja, é necessária a presença de óxido nítrico. Isto indica que o
óxido nítrico produzido pela iNOS tem uma função moduladora na IL-1 quando se trata