P . b . b . 0 2 Z 0 3 1 1 0 5 M , V e r l a g s p o s t a m t : 3 0 0 2 P u r k e r s d o r f , E r s c h e i n u n g s o r t : 3 0 0 3 G a b l i t z
Indexed in EMBASE/Excerpta Medica/Scopus
www.kup.at/kardiologie
Member of the ESC-Editors’ Club
Member of the
Offizielles Organ des
Österreichischen Herzfonds
Homepage:
www.kup.at/kardiologie
Online-Datenbank mit
Autoren- und Stichwortsuche
Das Ösophagus-EKG: Neue
Einsatzmöglichkeiten durch eine
neue Technik
Mächler H, Bergmann P, Huber S
Lueger A, Rehak P, Stark G
Journal für Kardiologie - Austrian
Journal of Cardiology 1999; 6 (6)
Jetzt in 1 Minute
Früh-erkennung der PAVK: boso
ABI-system 100
PAVK – Die unterschätzte Krankheit Die periphere arterielle Verschlusskrank-heit (PAVK) ist weitaus gefährlicher und verbreiteter als vielfach angenommen. Die getABI-Studie [1] zeigt, dass 20 % der > 60-Jährigen eine PAVK-Prävalenz aufweisen. Die PAVK wird oft zu spät diagnostiziert. Das liegt vor allem da-ran, dass die Betroffenen lange Zeit be-schwerdefrei sind und eine entsprechen-de Untersuchung daher meist erst in akuten Verdachtsfällen erfolgt. Mit dem Knöchel-Arm-Index („ankle- brachial in dex“ [ABI]) ist die Diagnose einer PAVK durchführbar. Der Knöchel-Arm-Index (ABI) ist ein wesentlicher Marker zur Vorhersage von Herzinfarkt, Schlag-anfall und Mortalität.
PAVK-Früherkennung mit dem boso ABI-system 100: Ein Gewinn für alle. Eine präzise und schnelle, vaskulär orientierte Erst untersuchung. Der entscheidende Wert für die Dia-gnose der PAVK ist der Knöchel-Arm-Index („ankle-brachial index“ [ABI]). Das boso ABI-system 100 ermittelt die-sen Wert zeitgleich und oszillometrisch an allen 4 Extremitäten. Die eigentliche Messung dauert dabei nur ca. 1 Minu-te. Ein ABI-Wert < 0,9 weist im
Ver-gleich mit dem Angiogramm als Gold-standard mit einer Sensitivität von bis zu 95 % auf eine PAVK hin und schließt umgekehrt die Erkrankung mit nahezu 100 % Spezifität bei gesunden Perso-nen aus.
Das boso ABI-system 100 wurde wei-terentwickelt und ist jetzt optional mit der Messung der Pulswellenge-schwindigkeit ausgestattet.
Optional ist das boso ABI-system 100 ab sofort auch mit der Möglichkeit zur Messung der
Pulswellengeschwindig-keit (ba) verfügbar. Mit der Messung der Pulswellengeschwindigkeit („pulse wave velocity“ [PWV]) kann eine arteri-elle Gefäßsteifigkeit diagnostiziert wer-den. Die Steifigkeit der arteriellen Ge-fäße nimmt mit einer fortschreitenden Arteriosklerose zu, was sich durch eine Erhöhung der Pulswellengeschwindig-keit darstellt. PWV und ABI-Wert er-möglichen eine noch fundiertere Risi-kostratifizierung von kardiovaskulären Ereignissen.
Literatur:
1. http://www.getabi.de
Weitere Informationen: Boso GmbH und Co. KG Dr. Rudolf Mad
A-1200 Wien
Handelskai 94–96/23. OG E-Mail: rmad@boso.at
303
J KARDIOL 1999; 6 (6)
D
as Konzept eines aus dem Ösophagus abgeleiteten EKG ist nicht neu. Die ersten Daten über die Verwendung eines Ösophagus-EKG stammen aus dem Jahre 1906, als Cremer eine Elektrode in den Ösophagus eines Schwert-schluckers einführte [1]. Seit damals haben zahlreiche Stu-dien die Nützlichkeit dieser Technik bestätigt. Das unipolare Ösophagus-EKG wurde vorerst zur Detektion von T-Wellen und Extrasystolen [2, 3] verwendet. Mitte der 70er wurden erstmals Sonden mit „pseudo-bipolaren“ Elektroden ein-gesetzt, um Vorhofarrhythmien zu analysieren [4–6]. Zur Langzeitregistrierung wurde eine in Gelatine eingebettete Elektrodenkapsel [6] entwickelt, die vom Patienten ge-schluckt werden konnte.Bislang wurden ösophageal ableitende „pseudo-bipo-lare“ Elektroden an herkömmliche Oberflächen-EKG-Ver-stärker angeschlossen, die mit den bekannten Filtertech-niken ausgestattet sind [7].
Die Signale des Ösophagus-EKG können jedoch durch die räumliche Nähe zwischen Herz und Elektrode, aufgrund des geringen elektrischen Widerstandes und aufgrund der besseren Leitungseigenschaften ungefiltert und frei von Artefakten abgeleitet werden. Daher wurden die Signale unseres neuentwickelten Ösophagus-EKG über eine selbst-gebaute, mit 3 silberchlorierten Ableiteelektroden verse-hene Ösophagus-Sonde (Durchmesser 7 mm) „bipolar“ abgeleitet, wobei die Sonde durch ein Rückzugmanöver so positioniert wurde, daß sie am Ort des größten
ventriku-Das Ösophagus-EKG: Neue Einsatzmöglichkeiten
durch eine neue Technik
H. Mächler, A. Lueger*, St. Huber, P. Bergmann, P. Rehak, G. Stark*
Eingegangen am: 22. 10. 98, angenommen am: 26. 03. 99.
Von der Universitätsklinik für Chirurgie Graz, Department für Herzchirurgie, und der *Medizinischen Universitätsklinik Graz. Korrespondenzadresse: Univ.-Prof. Dr. med. Heinrich Mächler, Universitätsklinik für Chirurgie Graz, Department für Herzchirurgie, A-8036 Graz, Auenbruggerplatz 1
lären Potentials zu liegen kam. Über einen selbstentwik-kelten, filterlosen, hochauflösenden und batteriebetriebe-nen Vorverstärker (0,01–2000 Hz, IEC-601 Norm) (Zusam-menarbeit mit dem Institut für med. Physik Graz und der Fa. Paar®, Graz) wurden die Signale über ein
Analog-Digi-tal-Board (Axotape®, Axon Instruments, Inc., USA) direkt
in einem PC visualisiert und verarbeitet.
Das ösophageale, bipolare Elektrokardiogramm
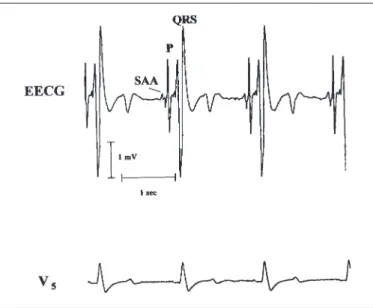
Die Signale des Ösophagus-EKG zeigten eine schmale, niedrig-amplitudige, atriale Aktivität (SAA) mit einem diastolischen Vorhofpotential, welche vor der P-Welle im Oberflächen-EKG auftrat und eine steile, prominente, hoch-amplitudige, biphasische Welle (P-Komponente), zeitgleich mit der P-Welle im Oberflächen-EKG (Abb. 1). Jede der schmalen, niedrig-amplitudigen elektrischen Vorhof-aktivitäten wurde während eines normalen Sinusrhythmus immer von der biphasischen P-Komponente gefolgt und war im Oberflächen-EKG nie erkennbar. Die mittlere Amplitu-denhöhe der frühen Vorhofaktivität betrug 0,15 ± 0,014 mV (0,12–0,25 mV), die mittlere Dauer betrug 0,057 ± 0,002 sec (0,049–0,064 sec.). Die mittlere Amplitudenhöhe der biphasischen P-Komponente im Ösophagus-EKG be-trug 2,1 ± 0,095 mV (1,8–2,55 mV), die mittlere Dauer der P-Komponente betrug 0,075 ± 0,007 sec (0,072–0,08 sec). Die Amplitude der P-Komponente verhielt sich am Punkt des maximalen Ausschlages zur Amplitude des QRS plexes wie 1:2. Die mittlere Amplitudenhöhe des QRS
Kom-Einleitung: Das Ösophagus-EKG wurde aufgrund einer suboptimierten Ableite- und Verstärkertechnik bislang lediglich zur Detektion von atrialen Arrhythmien verwendet. Eine ösophageale Ableitetechnik wäre aber zur Detektion von intraoperativ auftretenden Myokardischämien gut geeignet. Methodik: Die ösophagealen EKG-Signale werden über eine bipolare Ösophagussonde abgeleitet, gelangen über einen hochauflösenden, batterie-betriebenen Vorverstärker (0,01–2000 Hz) zu einem Analog-Digital-Board, und werden letztlich auf einem PC visualisiert und ausgewertet. Ergebnisse: Mit dem Ösophagus-EKG konnten im Vergleich zum Oberflächen-EKG signifikant mehr ischämische Episoden sowohl im Tierversuch (93 % versus 47 %) (n = 18) als auch im Rahmen von aorto-koronaren Bypassoperationen (CABG) detektiert werden. Zum Zeitpunkt der Narkose-einleitung hatten 85 % der Hochrisiko-CABG Patienten (n = 18) ein ischämisch verändertes Ösophagus-EKG (18 % Detektionsrate im Oberflächen-EKG), wobei solche Ereignisse mit einem negativen, postoperativen Outcome korreliert werden konnten (p < 0,05). Zusätzlich konnten mit der ösophagealen Ableitung bei 8 von 18 CABG-Patienten im Mittel 483 ± 119 hochamplitudige, biphasische Vorhof-Komponenten während des kardioplegieinduzierten Herzstillstandes detektiert werden, im Oberflächen-EKG hatte nur ein Patient 26 Vorhof-Potentiale. Solche auch visuell nicht erkennbaren Vorhofaktivitäten waren zu 88 % mit postoperativen, supraventrikulären Arrhythmien korreliert. Schlußfolgerung: Das Ösophagus-EKG stellt eine für den klinischen Routinebetrieb einfach einsetzbare und sensitive Monitoringtechnik dar, um intraoperative Myokardischämien erkennen zu können. Zusätzlich kann durch die Detektion von Vorhofpotentialen die Effektivität der Kardioplegie überprüft werden.
plexes betrug 3,9 ± 3,5 mV (1,9–5,1 mV), die mittlere Dauer des QRS Komplexes betrug 0,051 ± 0,028 sec. (0,028–0,089 sec.). Die mittlere Amplitudenhöhe der T-Welle war 1,4 ± 1,7 mV (0,4–4,3 mV), die mittlere Dauer der T-Welle be-trug 0,120 ± 0,032 sec. (0,076–0,160 sec.).
Tierexperimenteller Nachweis von
Myokardischämien mit dem Ösophagus-EKG
Einleitung
Das Ziel des Tierversuches war es, iatrogen induzierte Myokardischämien auszulösen, um die Assoziation zwi-schen ST-Segment-Alternationen und der Myokardischämie zu evaluieren und um Kriterien für ischämische Veränderun-gen im Ösophagus-EKG zu standardisieren. Dazu wurden 18 Schafe anästhesiert und monitorisiert. Der antero-late-rale Ast des R. interventricularis anterior wurde ligiert [8].
Ergebnisse
Das nicht-ischämische Ösophagus-EKG zeigt homogene ST-Segmente ohne Schlag-zu-Schlag-Alternationen. Zwei Minuten nach der Okklusion kam es im Ösophagus-EKG in 93% (p < 0,01) der Versuche zu Inhomogenitäten im ST-Segment, in 47% der Versuche erfüllte das Oberflächen-EKG die Ischämiekriterien. Zur Kalkulation der dynami-schen ST-Segmentveränderungen wurde der Unterschied der Amplituden im ST-Segment von jeweils 5 Schlägen im Vergleich zum folgenden Schlag und dies für 200 konseku-tive Schläge errechnet (Hodges-Lehmann Point Estimator). Die zentrale Tendenz der Summe dieser Werte war vor der Okklusion 2000 mV/ms, nach der Okklusion 5000 mV/ms (p < 0,05) (Konfidenzintervall 1700/2500 versus 3350/ 9250). Damit konnte der enge Zusammenhang zwischen dem Ausmaß der ST-Segment-Alternationen und der Myokardischämie gezeigt werden.
Detektion von intraoperativen
Myokard-ischämien mit dem Ösophagus-EKG im
Vergleich zum Oberflächen-EKG während
koronarchirurgischer Eingriffe
Einleitung
Der Zusammenhang zwischen perioperativ auftreten-den Myokardischämien und schlechtem postoperativem
Outcome ist bekannt [9–12]. Die klassischen klinischen Symptome der akuten Myokardischämie sind intraoperativ aber nicht eindeutig feststellbar, hämodynamische und serumdiagnostische Parameter sind im Rahmen eines ope-rativen Eingriffes unspezifisch und nicht sensitiv. Endo- und epikardiale Ableiteverfahren [13, 14] oder Signal-Averaging-Methoden sind technisch aufwendig und im Routinebetrieb nicht einsetzbar [15, 16]. Das intraoperativ eingesetzte transösophageale Echokardiogramm wäre sehr sensitiv, ist als Monitoring jedoch zu personalintensiv.
Somit blieb das Oberflächen-EKG für den klinischen Routinebetrieb bislang die beste Möglichkeit, intraoperative Myokardischämien zu detektieren. Die höchste Sensitivi-tät zur Ischämiedetektion zeigten die Ableitungen V5 und
V4 (75 % bzw. 61 %,) [9], eine Kombination einzelner
Ableitungen (V3/V4/V5 oder II/V4/V5) erhöht die Sensitivität
weiter [9, 10], die Ableitungen V1, V2 und V3 sind jedoch
bei herzchirurgischen Eingriffen aus Gründen der Sterilität nicht durchführbar.
Daher besteht die Notwendigkeit, neue sensitivere Me-thoden zur intraoperativen Ischämiedetektion zu finden. Aufgrund der günstigen anatomischen Verhältnisse zwi-schen Ösophagus und Herz würde sich die EKG-Ableitung aus dem Ösophagus gut eignen.
Methodik
Bei 18 CABG-Patienten mit einem hohen Operations-risiko (instabile Angina Braunwald Klasse III) wurde vom Einleiten der Narkose bis zum Operationsende das her-kömmliche Oberflächen-EKG (I, II, III, aVR, aVL, aVF, V4,
V5, V6, V2R, V3R, V4R) kontinuierlich mit einem 12-Kanal EKG Schreiber (HP Page Writex Xli®, USA, Frequenz Rate:
0,05–150 Hz) registriert und mit dem Ösophagus-EKG vi-suell verglichen und statistisch analysiert. Es wurden die Kriterien von London [9] zur Feststellung einer Ischämie im 12-Kanal EKG verwendet.
Ergebnisse
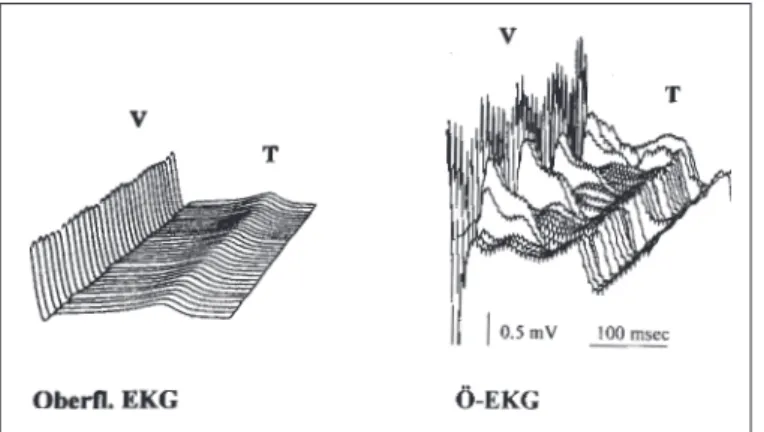
Um den zeitlichen Ablauf der ST-Strecken-Veränderun-gen im Ösophagus-EKG zu verdeutlichen, wurden jeweils 30 aufeinanderfolgende ST-Strecken unter Zuhilfenahme eines Wasserfalldiagramms sichtbar gemacht.
1. Unauffällige ST-Strecken im Oberflächen-EKG und homogene ST-Strecken im Ösophagus-EKG (Abb. 2).
Abbildung 1: Darstellung einer Sequenz von unauffälligen Schlägen im Oberflächen-EKG (V5, unten) im Vergleich zum Ösophagus-EKG (EECG, oben) während eines normalen Sinusrhythmus. Beachte die schmalen, niedrig-amplitudigen, atrialen Aktivitäten (SAA) vor den hoch-amplitu-digen, biphasischen P-Komponenten (P).
306
J KARDIOL 1999; 6 (6)2. Unauffällige ST-Strecken im Oberflächen-EKG, jedoch ischämische Episoden mit inhomogenen ST-Strecken im Ösophagus-EKG (Abb. 3): Morphologisch zeigte das Öso-phagus-EKG von Schlag zu Schlag variierende ST-Strecken im Sinn von gekerbten und gespaltenen ST-Strecken mit Höckern, Buckel und Ausbuchtungen vor oder unmittel-bar nach dem Gipfel der T-Welle bzw. im deszendieren-den Schenkel. Gelegentlich traten die Schwankungen (Inhomogenitäten) im aszendierenden Schenkel der T-Welle auf. Mit der Fortdauer der Ischämie kam es in 28 % zum Auftreten von zweiten, manchmal sogar dritten T-Wellen bzw. biphasischen T-Wellen im Ösophagus-EKG.
3. Episoden mit ischämischen ST-Strecken im Oberflä-chen-EKG und gleichzeitig ischämische Episoden mit in-homogenen ST-Strecken im Ösophagus-EKG (Abb. 4): Die Signale des Ösophagus-EKG zeigten eine deutliche Zunah-me der ST-Strecken-Schwankungen im Verlauf der ischämischen Episoden. Im Oberflächen-EKG waren ST-Strecken-Hebungen bzw. -Senkungen im Sinn von akuten Ischämien erkennbar.
72% der Patienten hatten ischämische Episoden (Dau-er > 30 sec) mit inhomogenen ST-Strecken im Ösophagus-EKG (11% im Oberflächen-Ösophagus-EKG, p < 0,05) von der Narkose-einleitung bis zum Beginn des Aortenklemmens. Zwei Patienten hatten ischämische Episoden sowohl im Ober-flächen-EKG, als auch im Ösophagus-EKG. Bezüglich der klinischen Relevanz eines pathologisch veränderten Öso-phagus-EKG im Zeitraum von der Narkoseeinleitung bis zum Beginn des kardiopulmonalen Bypass zeigte sich, daß wiederkehrende, ischämische Episoden im Ösophagus-EKG zu 85% mit einem schlechteren postoperativen Outcome (Notwendigkeit für Gabe von hochdosierten Katecho-laminen, Rhythmusstörungen der LOWN Klasse IV b, Not-wendigkeit zur Implantation einer intraaortalen Ballon-pumpe, Tod) korreliert sind. Das Auftreten von ischämischen Episoden im Ösophagus-EKG im Zeitraum von der Been-digung der extrakorporalen Zirkulation bis zu Operations-ende zeigte keine Korrelation zum postoperativen Outcome. Diskussion
In den letzten Jahren wurde der Monitorisierung zur Detektion intraoperativer Myokardischämien mehr Beach-tung geschenkt [9–12]. Die Dipoltheorie über den elektro-magnetischen Strom [17] besagt, daß eine Reduktion des Abstandes zwischen den ableitenden EKG-Elektroden und den Signalen des Herzens in einer verbesserten Detektion von dynamischen Veränderungen der EKG-Kurvenverläufe
resultieren würde. Die Konsequenz daraus ist, daß die wei-ter vom Herz entfernten Oberflächen-EKG-Ableitungen weniger effektiv in der Erkennung von ST-Strecken-Verände-rungen sind als Ösophagus-EKG-Elektroden nahe der ischämischen Zone. In der Literatur werden die Vorteile des Ösophagus-EKG für die Ischämiedetektion vernachläs-sigt, bislang existieren nur zwei Fallberichte von Patienten mit Myokardischämien [18, 19].
Das Konzept der Messung der ST-Strecken-Veränderun-gen im Ösophagus-EKG basiert auf der Vorstellung, daß von Schlag zu Schlag auftretende morphologische Ände-rungen der ST-Strecke vermehrte StöÄnde-rungen im Gleichge-wicht der myokardialen Repolarisation reflektieren. Alter-nierende T-Wellen sind als Indikator für die Verletzlichkeit des Myokards im Zusammenhang mit Ischämien bzw. Infarzierungen bekannt [20–22]. Warum das pathologische Ösophagus-EKG nur vor dem kardiopulmonalen Bypass eine Auswirkung auf das postoperative Ergebnis zeigt, kann nur so erklärt werden, daß der Risikopatient zum Zeitpunkt der Narkoseeinleitung oder kurz danach besonders stress-und damit ischämiegefährdet ist stress-und daß Patienten mit ei-ner bislang uei-nerkannten, präoperativ eingetretenen Myo-kardischämie operiert werden.
Die Limitationen der Studie bestehen darin, daß es un-möglich ist, Aussagen über den Zeitraum zwischen dem Ischämiebeginn und dem Auftreten von inhomogenen ST-Streckenverläufen zu treffen. Zusätzlich ist es nicht mög-lich, die Lokalisation des Ischämieareales zu diagnostizie-ren. Zukünftige Arbeiten könnten klären, ob der Grad der Inhomogenitäten der ST-Strecken im Ösophagus-EKG mit dem Ischämie- bzw. Infarktvolumen korreliert.
Die klinische Bedeutung der vorliegenden Studie liegt darin, daß das Ösophagus-EKG ein guter Indikator für die Detektion von Myokardischämien ist. Anhand der Ergeb-nisse zeigt sich, daß die Ableitung mit dem vorgestellten, semiinvasiven, hochauflösenden Ösophagus-EKG, im Ver-gleich mit den Oberflächen-EKG (12-Kanal) Ableitungen, eine sensitivere Methode darstellt, um intraoperative Myokardischämien zu detektieren. Diese Methode hat den Vorteil, daß ischämische Veränderungen von Schlag zu Schlag online visualisiert werden können. Durch die Detektion von gefährdeten Patienten kurz nach der Narkose-einleitung wäre es möglich, das perioperative Management individuell zu verbessern (Blutkardioplegie, kurze Ischämie-zeit, ev. Operation am schlagenden Herzen).
Abbildung 3: Darstellung unauffälliger ST-Strecken im Oberflächen-EKG, jedoch inhomogener ST-Strecken in einer ischämischen Episode im Öso-phagus-EKG. Das Bild im Ösophagus-EKG erscheint ungleichmäßig („in-homogen“). Der deszendierende Teil der T-Welle bleibt aber gleichmä-ßig. Im Oberflächen-EKG sind keine Veränderungen erkennbar.
Monitoring von Vorhofaktivitäten im
Ösophagus-EKG während des
Kalium-induzierten Herzstillstandes
Einleitung
Atriale elektrische Aktivitäten während des hypother-men, Kalium-induzierten Herzstillstandes werden mit einer erhöhten Inzidenz von postoperativen supraventrikulären Dysrhythmien korreliert [23]. Das Oberflächen-EKG zur Detektion ist insuffizient, invasive Methoden sind im Routi-nebetrieb unpraktikabel.
Ergebnisse
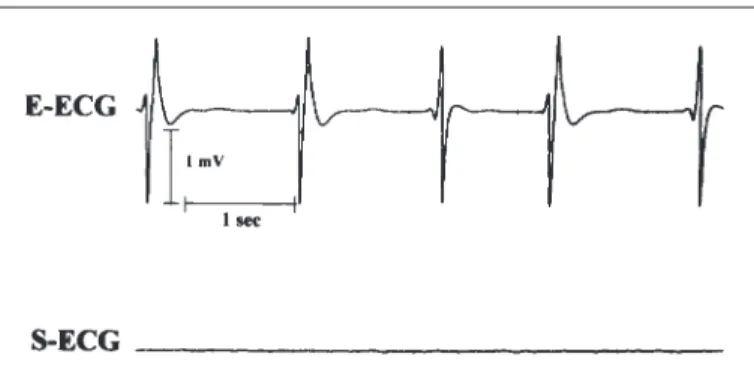
Acht von 18 Patienten zeigten während des Kardio-plegie-induzierten Herzstillstandes pro Patient im Mittel 483 ± 119 biphasische Vorhofkomponenten (mittlere Amplitu-de: 0,7 ± 0,1 mV) (Abb. 5). Im Mittel stellten sich 36 ± 6 Potentiale/min dar. Sechs der 8 Patienten zeigten zusätz-lich im Mittel pro Patient 29 ± 11 niedrig-amplitudige, atriale Aktivitäten, vermutlich Ausdruck der Schrittmacher-zellen des Sinusknotens (SAA in Abb. 1). Im Oberflächen-EKG kamen lediglich bei einem Patienten 26 P-Wellen zur Darstellung. 88% der Patienten mit Vorhofaktivitäten (ge-gen 30% der Patienten ohne Vorhofaktivitäten) während des kardioplegischen Herzstillstandes entwickelten in den ersten 5 postoperativen Tagen supraventrikuläre Tachy-arrhythmien (p < 0,05).
Diskussion
Die atriale Aktivität während des hypothermen, kardio-plegieinduzierten Herzstillstandes entsteht u. a. durch eine schlechte atriale Protektion der kardioplegischen Lösung. Die sinoatrialen Zellen sind resistenter gegen Kalium als das atriale Myokard, die Zellen des Reizleitungsgewebes sind auch resistenter gegen die Hypothermie. Mit der ge-wöhnlichen Kardioplegie (Kaliumkonzentration von 20 mmol/L) können die Zellen des Sinusknoten solange aktiv bleiben, bis ihre energiereichen Substrate verbraucht sind. Gegen Ende des induzierten Herzstillstandes kommt es wieder zu Vorhofpotentialen, da die kardioplegische Lö-sung ausgewaschen und die Hypothermie aufgehoben wird. Der protektive und paralytische Effekt der Kardioplegie und Hypothermie gehen verloren, die elektrische Aktivität des Vorhofs wird zum Indikator für eine inadäquate Vorhof-protektion. Durch eine ischämische Schädigung der Vor-hofzellen und des supraventrikulären Reizleitungssystems kommt es zur verlängerten Wiedererholungszeit des Sinus-rhythmus und offenbar auch zur Entwicklung von supra-ventrikulären Tachyarrhythmien. Der Grund könnte in der gesteigerten Automatizität der atrialen Zellen liegen, z. B. in der verzögerten Depolarisation als Resultat der ischämischen Schädigung.
Abbildung 5: Darstellung atrialer elektrischer Aktivitäten (P-Komponenten) im Ösophagus-EKG (E-ECG, oben) während des hypothermen, Kalium-induzierten Herzstillstandes. Im Vergleich dazu sind im Oberflächen-EKG (S-ECG, unten) keinerlei Aktivitäten zu sehen (Flatline).
Durch die vorgestellte Methode könnten verschiedene kardioplegische Lösungen oder retrograde, normotherme und kontinuierliche Perfusionsregime klinisch verglichen werden.
Literatur:
1. Cremer M. Über die direkte Ableitung der Aktionsströme des mensch-lichen Herzens vom Ösophagus und über das EKG des Föten. Münch Med Wschr 1906; 53: 87–93.
2. Brown WH. A study of the esophageal lead in clinical electrocardio-graphy. Part I. Am Heart J 1946; 12: 1–45.
3. Baur L, Böhme A. Untersuchung über das Elektrokardiogramm des Menschen bei Ableitung vom Ösophagus. Verh Dtsch Ges Inn Med 1923; 35: 96.
4. Zanoni G, Scholer H. Die sechspolare Ösophaguselektrode mit Wilson-Ableitung. Herz-Kreislauf 1973; 5: 369.
5. Beck BL, Jorgensen EO, Saunamäki KI. A new approach to simultanous multiple unipolar and bipolar esophageal electrocardiograms, and the finding in normal sinus rhythm. Europ J Cardiol 1976; 4: 313. 6. Jenkins JM, Wu D, Arzbaecher RC. Computer diagnosis of
supra-ventricular and supra-ventricular arrhythmias. A new esophageal technique. Circulation 1979; 60: 977.
7. London MJ, Kaplan JA. Advances in electrocardiographic monitoring. In: Kaplan JA (ed). Cardiac Anesthesia. 3rd ed. WB Saunders, Phil-adelphia, 1993; 306.
8. Mächler HE, Lueger A, Rehak P, Berger J et al. A new high-resolution esophageal electrocardiography recording technique: an experimen-tal approach for the detection of myocardial ischemia. Anesth Analg 1998; 86: 34–9.
9. London MJ, Hollenberg M, Wong MG, Levenson L, Tubau JF, Browner W, Mangano DT and the S.P.I. Reasearch Group. Intraoperative myocardial ischemia: Localization by continous 12-lead electrocardiography. Anesthesiology 1988; 69: 232–41.
10. Jain U. An electrocardiographic lead system for coronary artery bypass surgery. J Clin Anesth 1996; 8: 19–24.
11. Thomson IR. Intraoperative myocardial ischemia is not benign. J Cardiothorac Vasc Anesth 1994; 8: 593–5.
12. Perrino AC Jr, McCloskey G. Detection of intraoperative myocardial ischemia. Int Anesthesiol Clin 1996; 34: 37–56.
13. Landymore RW, Marble AE, Cameron CA. Spectral analysis of small-amplitude electrical activity in the cold potassium-arrested heart. Ann Thorac Surg 1986; 41: 372–7.
14. Camann W, Trunfiio GV, Kluger R, Steinbrook RA. Automated ST-segment analysis during cesarean delivery: effects of ECG filtering modality. J Clin Anesth 1996; 8: 564–7.
15. Marble AE, Landymore RW, Church DW. A miniature voltmeter for small amplitude electrical activity in the hypothermic arrrested myocardium. Med Prog Technol 1990; 16: 19–29.
16. Seipel L. Endokardiale Ableitung und Stimulation. Klinische Elektro-physiologie des Herzens. 2., neubearb. u. erw. Aufl. Georg Thieme Verlag, Stuttgart; New York, 1987; 11–172.
17. Gulrajani RM. Models of the electrical activity of the heart and com-puter simulation of the electrocardiogram. CRC Crit Rev Biomed Engl 1988; 16: 1–66.
18. Kates RA, Zaidan JR, Kaplan JA. Esophageal lead for intraoperative electrocardiographic monitoring. Anesth Analg 1982; 61: 781–5. 19. Jain U, Rao TLK, Dasari M, Wallis D, Moran JF. Suitability of
esopha-geal electrocardiogram for intraoperative monitoring. Anesthesiology 1989; 71: A342.
20. Smith J, Clancy E, Valeri R. Electrical alternans and cardiac electrical instability. Circulation 1988; 77: 110–21.
21. Verrier RV, Nearing BD. T wave alternans as a Harbinger of ischemia induced sudden c cardiac death. In: Zipos DP, Jalife J (eds). Cardiac Electrophysiology: From cell to bedside. 2nd edition. WB Saunders Company, Philadelphia, 1995; 468.
22. Münzer T, Stimming G, Brücker B, Geel A, Heim Ch, Kreienbühl G. Perioperativer Myokardinfarkt und weitere kardiale Komplikationen nach nichtkardialen Wahloperationen bei Patienten nach Myokard-infarkt. I: Klinische Daten und Diagnostik, Inzidenz. Anaesthesist 1996; 45: 213–20.
Die neue Rubrik im Journal für Kardiologie:
Clinical Shortcuts
In dieser Rubrik werden Flow-Charts der Kardiologie kurz und bündig vorgestellt
Zuletzt erschienen:
Interventionelle kathetergestützte
Diagnostik der Synkope
Aortenklappenimplantation (TAVI)
J Kardiol 2015; 22 (5–6): 132–4.
J Kardiol 2014; 21 (11–12): 334–7.
Einsatz einer perioperativen Blockertherapie
Kardiologische Rehabilitation nach
zur Reduktion von Morbidität und Mortalität
akutem Koronarsyndrom (ACS)
J Kardiol 2015; 22 (1–2): 38–40.
J Kardiol 2015; 22 (9–10): 232–5.
Besuchen Sie unsere Rubrik
P
聺
Medizintechnik-Produkte
boso ABI-system 100 Boso GmbH & Co KG IntelliSpace Cardiovascular
Philips Austria GmbH, Healthcare
BioMonitor 2
BIOTRONIK Vertriebs-GmbH CT TAVI Planning mit
syngo.CT Cardiac Function-Valve Pilot Siemens AG Österreich
STA R Max
Stago Österreich GmbH