Universidade de Lisboa
Faculdade de Farmácia
Caracterização das reações adversas
associadas a antibacterianos (J01)
reportadas à Unidade de
Farmacovigilância do Sul durante o
período de 2012 a 2016 (5 anos)
Catarina Valente Monteiro Marques
Mestrado Integrado em Ciências Farmacêuticas
Universidade de Lisboa
Faculdade de Farmácia
Caracterização das reações adversas
associadas a antibacterianos (J01)
reportadas à Unidade de
Farmacovigilância do Sul durante o
período de 2012 a 2016 (5 anos)
Catarina Valente Monteiro Marques
Monografia de Mestrado Integrado em Ciências Farmacêuticas
apresentada à Universidade de Lisboa através da Faculdade de
Farmácia
Orientadora: Professora Doutora Ana Paula Martins
Co-Orientadora: Drª Paula Barão
Resumo
IntroduçãoAs reações adversas a medicamentos são uma importante causa de mortalidade e morbilidade e apresentam um elevado impacto na saúde pública. Os antibacterianos de uso sistémico são um dos grupos de medicamentos que mais reações adversas motivam, sendo importante conhecer o perfil de reações adversas associadas a este grupo.
Objetivo
Caracterizar as reações adversas associadas a antibacterianos de uso sistémico, notificadas à Unidade de Farmacovigilância do Sul entre 2012 e 2016.
Métodos
Estudo observacional descritivo, de orientação transversal, para análise das reações adversas associadas a antibacterianos de uso sistémico (grupo ATC J01), reportadas à Unidade de Farmacovigilância do Sul por profissionais de saúde ou utentes, entre 1 de janeiro de 2012 e 31 de dezembro de 2016 (5 anos).
Resultados
Durante o período alvo de estudo foram recebidas 137 notificações associadas a antibacterianos de uso sistémico, tendo os anos de 2012 e 2015 registado o número mais elevado (26,28%) e, 2016 assinalado o número mais baixo de notificações (15,33%). O farmacêutico foi o profissional de saúde que mais notificou (76,07%), com destaque para o farmacêutico hospitalar (42,85%), preferindo na maioria das vezes a via online (58,79%). O farmacêutico hospitalar de Évora foi o profissional que reportou mais notificações de antibacterianos de uso sistémico (21,90%). 34% das reações adversas aos antibacterianos de uso sistémico foram consideradas graves. Os doentes mais afetados no grupo em estudo foram os adultos do sexo feminino (34,31%), evoluindo na maioria dos casos para cura (61,31%).
Os antibacterianos de uso sistémico foi o 3º grupo que motivou mais reações adversas, durante o período em análise, com destaque para os fármacos amoxicilina com inibidor enzimático, azitromicina, ciprofloxacina, cefazolina e claritromicina. O SOC mais afetado foi Doenças Gastrointestinais e as reações adversas mais frequentes foram vómitos e náuseas.
Conclusões
As reações adversas aos antibacterianos de uso sistémico apresentam um considerável impacto a nível da saúde pública, sendo um dos grupos de fármacos que mais reações
adversas motivam, associado a uma elevada morbilidade e a uma acrescida necessidade de cuidados de saúde. Assim, é importante entender o perfil de notificação a este grupo na região Sul de Portugal, bem como, conhecer as áreas onde é necessária uma intervenção prioritária através de medidas de promoção da notificação para um melhor conhecimento do perfil de segurança destes medicamentos.
Palavras-chave
Antibacterianos de uso sistémico; Reação adversa a medicamentos; Unidade de Farmacovigilância do Sul; Farmacovigilância
Abstract
IntroductionAdverse drug reactions are a major cause of mortality and morbidity with a high impact on public health. Antibacterials for systemic use are one of the groups of drugs that cause the most adverse reactions, and it is important to understand the profile of adverse reports associated with this group.
Purpose
Characterize the adverse drug reactions associated with antibacterials for systemic use reported to Unidade de Farmacovigilância do Sul between 2012 and 2016.
Methods
A cross-sectional, observational study to analyse adverse reactions associated with antibacterials for systemic use (ATC group J01), reported to Unidade de Farmacovigilância do Sul by health professionals or patients between January 1 2012 and December 31 2016 (5 years).
Results
Of the 137 reports associated with antibacterials for systemic use, 2012 and 2015 have the highest (26,28%) and 2016 have the lowest number of reports (15,33%). The pharmacist was the healthcare professional who reported the most (76.07%), especially the hospital pharmacist (42.85%), most of whom preferred the online route (58.79%). The hospital pharmacist from Évora was the professional who reported more notifications of antibacterials for systemic use (21.90%). 34% of adverse reactions to antibacterials for systemic use were considered serious. The most affected patients in the study group were female adults (34.31%), most evolving to cure (61.31%).
Antibacterials for systemic use were the third group to cause more adverse reactions, especially amoxicillin with enzyme inhibitor, azithromycin, ciprofloxacin, cefazolin and clarithromycin. The most affected SOC was Gastrointestinal Diseases and the most frequent adverse reactions were vomits and nauseas.
Conclusions
Adverse reactions to antibacterials for systemic use have a considerable impact on public health and are one of the groups with the most adverse reactions, associated with high morbidity and an increased need for health care. Thus, it is important to understand the notification profile to this group in the southern region of Portugal as well as the areas where
priority intervention is necessary through measures to promote notification for a better knowledge of the safety profile of these medicines.
Keywords
Antibacterials for systemic use; Adverse drug reaction; Unidade de Farmacovigilância do Sul; Pharmacovigilance
Abreviaturas
AIM – Autorização de Introdução no Mercado ATC – Anatomical Therapeutical Chemical
DGRM – Direção de Gestão do Risco do Medicamento EMA – Agência Europeia do Medicamento
FDA – Food and Drug Administration HLGT – High Level Group Team HLT – High Level Term
ICH – International Conference on Harmonisation
INFARMED – Autoridade Nacional do Medicamento e Produtos de Saúde LLT – Lowest Level Term
MedDRA – Medical Dictionary for Regulatory Activities NE – Notificação/notificações espontânea(s)
OMS – Organização Mundial de Saúde PASS – Post-Authorization Safety Studies
PPCIRA - Programas de Prevenção e Controlo de Infeção e de Resistência aos
Antimicrobianos
PT – Prefered Term
RAM – Reação/reações adversa(s) ao medicamento RCM – Resumo das Características do Medicamento SNF – Sistema Nacional de Farmacovigilância SOC – System Organ Class
UE – União Europeia
UF – Unidade(s) de Farmacovigilância
UFC – Unidade de Farmacovigilância do Centro
UFLVT – Unidade de Farmacovigilância de Lisboa e Vale do Tejo UFN – Unidade de Farmacovigilância do Norte
Índice Geral
Página 1. Introdução ...14 Segurança do medicamento ...14 Farmacovigilância ...14 Notificação espontânea ...17Sistema Nacional de Farmacovigilância ...20
Unidade de Farmacovigilância do Sul ...21
A classe dos antibacterianos ...22
2. Pertinência do estudo ...25 3. Objetivos ...26 Objetivo Geral ...26 Objetivos Específicos ...26 4. Metodologia ...27 Desenho do Estudo ...27
Recolha de Informação e Tratamento de Dados ...27
Variáveis de Estudo ...28
5. Apresentação de Resultados ...30
Caracterização das notificações e sua origem ...30
5.1.1 Via de notificação ...31
5.2 Caracterização do notificador de reações adversas ...31
5.2.1 Categoria Profissional ...31
5.2.2 Instituição de Saúde ...35
5.2.3 Distrito ...38
5.3.1 Idade e grupo etário ...41
5.3.2 Género ...42
5.4 Caracterização das reações adversas ...43
5.4.1 Gravidade ...43
5.4.2 Critérios de gravidade ...46
5.4.3 Conhecimento prévio da RAM (Descrição no RCM) ...46
5.4.4 Evolução da RAM ...48
5.4.5 Imputação de Causalidade ...49
5.4.6 System Organ Class (SOC) mais afetados ...51
5.5 Caracterização do(s) medicamento(s) suspeito(s) ...53
5.5.1 Número de medicamentos suspeitos ...53
5.5.2 Grupo ATC 1º nível ...53
5.5.3 Grupo ATC 2º nível ...55
5.5.4 Grupo ATC 3º nível (Subgrupo terapêutico) ...57
5.5.5 Grupo ATC 5º nível (Entidade química) ...58
6. Discussão dos Resultados ...62
6.1 Caracterização das notificações e sua origem ...62
6.2 Caracterização do notificador de reações adversas ...63
6.3 Caracterização do perfil do doente ...65
6.4 Caracterização das reações adversas ...65
6.5 Caracterização do(s) medicamento(s) suspeito(s) ...67
7. Limitações do estudo ...70
8. Conclusão ...71
9. Referências Bibliográficas ...72
Índice de Figuras
Figura 1 - Notificações de RAM recebidas no SNF entre 1992 e 2016 ... 18
Figura 2 - Índice NE/ano/milhão de habitantes para as 4 UF em 2016 ... 22
Figura 3 - Distribuição anual do número de NE totais e do grupo ATC J01 ... 30
Figura 4 - Vias de notificação associadas às NE totais e do grupo ATC J01 ... 31
Figura 5 - Distribuição anual do número de NE totais, por categoria profissional ... 32
Figura 6 - Distribuição anual do número de NE do grupo ATC J01, por categoria profissional ... 33
Figura 7 - Instituições de saúde associadas às NE totais e do grupo ATC J01 ... 35
Figura 8 - Distribuição anual do número de NE do grupo ATC J01, por instituição de saúde ... 36
Figura 9 – Distritos associados às NE totais e do grupo ATC J01 ... 38
Figura 10 - Distribuição anual do número de NE totais e do grupo ATC J01, realizadas por delegados de farmacovigilância ... 40
Figura 11 – Grupos etários associados às NE totais e do grupo ATC J01 ... 41
Figura 12 - Distribuição anual do número de NE totais, por gravidade da RAM ... 43
Figura 13 - Distribuição anual do número de NE do grupo ATC J01, por gravidade da RAM... 43
Figura 14 - Distribuição anual do número de NE totais e do grupo ATC J01, por descrição no RCM ... 47
Figura 15 – Imputação de causalidade associada às NE totais e do grupo ATC J01 ... 50
Figura 16 - Top 5 dos SOC mais afetados nas NE do grupo ATC J01 ... 52
Figura 17 - Distribuição anual do número de NE dos grupos ATC 1º nível J, L e N ... 55
Figura 18 - Top 10 dos grupos ATC 2º nível mais associados às NE analisadas ... 55
Figura 19 - Distribuição do número de NE por grupo ATC 2º nível, dentro do ATC 1º nível J ... 56
Figura 20 - Distribuição anual do número de NE totais, do grupo ATC 1º nível J e ATC 2º nível J01 ... 57
Figura 21 - Distribuição do número de NE por grupo ATC 3º nível, dentro do ATC 2º nível J01 . 58 Figura 22 - Top 5 dos grupos ATC 5º nível, dentro do grupo ATC 2º nível ... 59
Índice de Tabelas
Tabela 1 - Evolução anual do número total de NE recebidas pela UFS entre 2012 e 2016 ... 30 Tabela 2 - Cruzamento das variáveis categoria profissional e via de notificação para as NE totais ... 34
Tabela 3 - Cruzamento das variáveis categoria profissional e via de notificação para as NE do grupo ATC J01 ... 34 Tabela 4 - Cruzamento das variáveis categoria profissional e tipo de instituição, para as NE totais ... 36 Tabela 5 - Cruzamento das variáveis categoria profissional e tipo de instituição para as NE do grupo ATC J01 ... 37 Tabela 6 - Cruzamento das variáveis distrito, tipo de instituição e categoria profissional para as NE totais e do grupo ATC J01 ... 39 Tabela 7 - Cruzamento das variáveis género e grupo etário para as NE totais e do grupo ATC J01 ... 42 Tabela 8 – Cruzamento das variáveis gravidade e tipo de instituição para as NE totais e do grupo ATC J01 ... 44 Tabela 9 - Cruzamento das variáveis gravidade e categoria profissional para as NE totais e do grupo ATC J01 ... 45 Tabela 10 - Cruzamento das variáveis gravidade e grupo etário para as NE totais e do grupo ATC J01 ... 45 Tabela 11 - Número de NE totais e do grupo ATC J01, por critério de gravidade ... 46
Tabela 12 - Cruzamento das variáveis descrição no RCM e gravidade, para as NE totais e do grupo ATC J01 ... 47 Tabela 13 - Número de NE totais e do grupo ATC J01, por evolução da RAM ... 48 Tabela 14 - Cruzamento das variáveis gravidade e evolução da RAM, para as NE totais e do grupo ATC J01 ... 49 Tabela 15 - Cruzamento das variáveis descrição no RCM e imputação de causalidade, para as NE totais e do grupo ATC J01 ... 50 Tabela 16 - Top 10 dos SOC mais afetados nas NE totais ... 51 Tabela 17 - Top 6 das RAM mais frequentes nas NE do grupo ATC J01 ... 52 Tabela 18 - Número de medicamentos suspeitos associados às NE totais e do grupo ATC J01 53
Tabela 19 – Número de NE totais por grupo ATC 1ºnível ... 54
Tabela 20 - Fármacos mais associados a reações adversas dentro dos vários grupos J01 ... 60 Tabela 21 - Cruzamento das variáveis gravidade e entidade química para as RAM associadas ao grupo ATC J01 ... 60 Tabela 22 - Reações adversas mais comuns para os fármacos ATC 5º nível, dentro do grupo J01 ... 61
1. Introdução
Segurança do medicamento
No momento em que é concedida uma Autorização de Introdução no Mercado (AIM) para um novo medicamento, os dados disponíveis sobre este são escassos a nível de segurança, e não extrapoláveis para a população em geral, por terem sido gerados em ambiente controlado, num período de tempo relativamente curto e minimizados os fatores de confundimento, assim, a sua validade externa é baixa (1).
Apesar de estar comprovada a qualidade, eficácia e segurança do medicamento na fase de AIM, há ainda nessa altura muita informação de que não dispomos (2). Só em fase de pós-comercialização é que conseguimos ter acesso a outro tipo de dados, tais como, informação sobre reações adversas ao medicamento (RAM) de baixa frequência, em certos grupos populacionais, como resultado de interações fármaco/fármaco e fármaco/alimento, e outras RAM efeito da utilização a longo prazo do medicamento que, pelo tempo limitado dos ensaios clínicos, não são detetadas, como reações do tipo C (chronic) e do tipo D (delayed) (3). Assim, não conhecemos igualmente a efetividade do medicamento na prática clínica (4).
Estes dados, obtidos na fase pós-comercialização vão permitir completar o perfil de segurança do medicamento, com informações em contexto real de utilização do mesmo. Nesta fase, recorre-se a outro tipo de estudos para avaliar a relação benefício/risco, entre os quais estudos PASS (Post-Authorization Safety Studies) (5).
Importa referir que, para um medicamento ser considerado seguro, isso não significa que há ausência de risco. Significa sim que os riscos conhecidos naquele momento são considerados aceitáveis tendo em conta as alternativas terapêuticas existentes e os benefícios esperados, ou seja, a relação benefício/risco para aquele medicamento é favorável. Além disso, é também uma relação dinâmica, já que pode ser alterada em qualquer fase do ciclo de vida do medicamento (6).
Farmacovigilância
Segundo a Organização Mundial de Saúde (OMS), uma RAM era definida como: “Qualquer resposta prejudicial e indesejada a um medicamento que ocorre com doses habitualmente usadas para profilaxia, diagnóstico ou tratamento ou para modificação de funções fisiológicas” (5).
A Diretiva Europeia 2010, veio complementar esta definição, tornando-a mais abrangente, já que diz que uma RAM é “uma resposta nociva e não intencional a um medicamento” e inclui
as diferentes vertentes de risco associadas à utilização de medicamentos, nomeadamente, “de acordo com a sua AIM; e em situações não abrangidas pela respetiva AIM, em off label, overdose, mau uso do medicamento, abuso, erros de medicação e exposição ocupacional/acidental” (7).
No que concerne à gravidade, as RAM são classificadas como graves desde que cumpram, em qualquer dose administrada, um ou mais dos seguintes critérios: causem a morte, coloquem a vida em risco, motivem ou prolonguem a hospitalização, resultem em incapacidade persistente ou significativa, provoquem anomalia congénita ou má formação ou outra reação adversa “medicamente importante”. Estes critérios foram propostos na Guideline E2D pela International Conference on Harmonisation (ICH) e adotados pela OMS (8).
Atualmente, a Farmacovigilância é definida como a “ciência e atividades relacionadas com a deteção, avaliação, compreensão e prevenção de reações adversas ou de outro problema relacionado com os medicamentos”. A coordenação dos diferentes sistemas de Farmacovigilância da União Europeia (UE) é da responsabilidade da Agência Europeia do Medicamento (EMA), que apoia as Autoridades Reguladoras dos vários Estados Membros em matéria de segurança do medicamento (9).
Contudo, até ao início do século XX, a utilização do medicamento era meramente vista pela sua aplicabilidade terapêutica. Só em finais dos anos 30, surgiu a primeira legislação pela
Food and Drug Administration (FDA) devido à ocorrência de mortes associadas à utilização
de dietilenoglicol. Esta legislação impôs práticas mais responsáveis ao nível de todo o processo que antecede a comercialização já que, para existir a comercialização de novas substâncias tinha que ser comprovada a segurança das mesmas. Apenas no final dos anos 50, com a tragédia associada à talidomida e aos mais de 10.000 casos de focomélia reportados em mais de 46 países, aconteceu o primeiro marco na história que motivou o início da Farmacovigilância mundial (10). Para tal, foi fundamental o contributo do médico
McBride, que através de uma carta dirigida ao editor da revista Lancet, relatou e alertou para
os vários casos que havia observado (11). No início dos anos 60, este fármaco foi retirado do mercado (10).
Só após este desastre, foram dados os primeiros passos a nível internacional no sentido de discutir os problemas relacionados com a segurança dos medicamentos e preencher o vazio legislativo existente na altura (12).
Em 1963, na 16ª Assembleia da OMS, foi reafirmada a necessidade de atuar precocemente em matéria de segurança do medicamento, onde os Estados Membros foram incentivados a reportar à OMS as decisões sobre interdições ou limitações por efeitos nocivos associados à
utilização de um medicamento O objetivo era desenvolver um sistema internacional para a deteção de RAM desconhecidas ou pouco conhecidas (12).
Nas Assembleias Mundiais de Saúde seguintes, houve uma elevada preocupação em incitar os vários Estados-Membros a criar o seu sistema de farmacovigilância mas só na 19ª Assembleia Mundial de Saúde, em 1966, foi concebido o primeiro projeto piloto para a criação de um sistema de farmacovigilância a implementar em 10 países (Austrália, Canadá, Checoslováquia, Estados Unidos da América, Irlanda, Nova-Zelândia, Países Baixos, Reino Unido, República Federal da Alemanha e Suécia) (5).
Destas bases surgiram mais tarde os atuais sistemas de farmacovigilância, adotados por cada Estado Membro da UE, responsáveis pela recolha de casos individuais de RAM e avaliação dos mesmos. Atualmente a recolha destas informações, numa base de dados central alimentada pelas RAM reportadas aos diferentes sistemas, sustenta a necessidade de cooperação das autoridades reguladoras de forma a evitar desastres futuros e melhorar o conhecimento que dispomos sobre os fármacos (5).
A nova era legislativa está orientada no sentido de se adotar uma atitude mais pró-ativa relativamente à segurança do medicamento, razão pela qual todas as indicações relativas à segurança do mesmo estão contempladas no plano de gestão de risco. O plano de gestão de risco pode ser submetido em qualquer fase do ciclo de vida do medicamento e deve ser capaz de identificar ou caracterizar o perfil de segurança de um medicamento, documentar medidas de minimização do risco (e uma avaliação da efetividade dessas medidas) e documentar as obrigações para a fase pós-comercialização, impostas como condição de entrada no mercado. Este plano de gestão de risco deve incluir, entre outros, de um modo geral, todo o conhecimento de que se dispõe sobre o medicamento, resultado dos ensaios clínicos, mas também dados de utilização do medicamento em populações não estudadas nos ensaios clínicos, especificações de segurança requeridas pela UE, um plano de farmacovigilância, medidas de minimização do risco e um plano para estudos de eficácia pós-autorização (6).
O peso que as reações adversas exercem sobre os Sistemas de Saúde não deve ser descurado. Num estudo realizado por Pirmohamed et al. 2004, no Reino Unido foi avaliada a prevalência de admissões hospitalares devido a RAM, duração do internamento, evitabilidade e resultado final em 18 820 doentes. Concluiu-se que 1225 admissões hospitalares deveram-se a uma RAM (6,5%), sendo a maioria delas, definitiva ou provavelmente evitáveis (13).
À semelhança do que acontece no Reino Unido, em Portugal, no estudo realizado por Miguel et al. 2013, no período de análise compreendido entre 2000 e 2009, as RAM motivaram 1,26% de todas as hospitalizações (14).
Corroborando os dados anteriores, nas meta-análises realizadas por Hakkarainen et al
2012. e Miguel et al 2012., verificou-se, respetivamente, que cerca de 2% das
hospitalizações ou internamentos nas urgências eram devidos a RAM e que cerca de metade de todas as reações adversas eram evitáveis (15) e que 16,88% dos doentes hospitalizados têm maior probabilidade de desenvolverem uma RAM (16), o que demonstra a importância de estratégias de prevenção.
Estima-se que as RAM, devido à inadequada utilização de medicamentos, tragam aos sistemas de saúde elevados encargos, tanto a nível financeiro, como indicadores desfavoráveis de mortalidade e morbilidade (15). Para reduzir estes encargos é necessária uma maior vigilância sobre o uso do medicamento e são necessárias medidas de modo a melhorar a relação benefício/risco dos fármacos para que desta forma reduzam o impacto sobre os sistemas de saúde (17).
Notificação espontânea
Entre as várias fontes de informação para o Sistema Nacional de Farmacovigilância (SNF), nomeadamente métodos geradores e confirmadores de hipóteses, a notificação espontânea (NE) assume o papel mais importante. Trata-se de uma metodologia passiva, de custos reduzidos, que permite a cobertura da totalidade dos medicamentos no mercado, durante todo o tempo de vida destes e em populações alargadas (18).
A NE consiste num relato simplificado de um evento adverso, com suspeita de associação a um medicamento, usado por um individuo (doente) e reportado pelo mesmo ou por outro notificador (19).
Analisando os dados de notificações espontâneas de RAM recebidas no SNF entre 1992 e 2016 (Figura 1) verificamos que globalmente existe uma tendência crescente. Assim, os anos do período de análise do presente estudo (2012 a 2016) correspondem aos anos onde se verifica o maior número de notificações a nível nacional (20).
Figura 1 - Notificações de RAM recebidas no SNF entre 1992 e 2016 (20)
A ficha de notificação usada atualmente é um formato único para todas as classes profissionais (farmacêutico, médico, enfermeiro). Os titulares de AIM reportam à Autoridade Nacional do Medicamento e Produtos de Saúde (INFARMED) por transmissão eletrónica e os doentes possuem uma ficha própria ou, assim como os profissionais de saúde, podem utilizar outros meios, nomeadamente telefone, fax, e-mail ou plataformas eletrónicas. Os principais campos a preencher correspondem a dados da RAM, do(s) medicamento(s) suspeito(s), do(s) medicamento(s) concomitante(s), do doente e do notificador (21) (Anexo 1).
A metodologia de NE permite a geração de sinais precoces que vão levantar hipóteses sobre a possibilidade de uma relação causal entre o medicamento e a RAM, que se poderão traduzir na adoção de medidas regulamentares e de minimização do risco, para uma utilização mais segura do medicamento por parte da população (5).
Apesar das suas limitações, nomeadamente ser um método de baixa sensibilidade, resultante da notificação seletiva e da subnotificação (22), a NE é muitas vezes o processo, que por si só, gera as evidências que sustentam a tomada de decisões/ações regulamentares, particularmente a necessidade de retirar um medicamento do mercado (23).
Já em 1983, Venning descreveu que entre as 18 RAM identificadas como mais importantes desde o desastre da talidomida, em apenas 3 casos as evidências para retirar os medicamentos do mercado surgiram através de estudos caso-controlo ou estudos cohort (24).
clínicos e séries de casos (25) e no Reino Unido, mais de um terço (36%) dos medicamentos foram retirados do mercado devido exclusivamente à informação de NE (26).
As limitações apresentadas por esta metodologia são transversais a todos os Sistemas de Farmacovigilância (19) e devem ser contrariadas através da divulgação de informação, não só aos profissionais de saúde, mas também aos doentes (que a partir da nova legislação europeia de 2012, podem notificar), no sentido de responsabilizar os mesmos neste processo (7). A realização de formações de carácter regular é também importante para incentivar a população notificadora e potencialmente notificadora a manter-se participativa no SNF (27).
O farmacêutico comunitário, pela sua proximidade com a população, deve estar alerta para o aparecimento de RAM e para a importância da notificação (28). A título de exemplo, no ano de 2014, o farmacêutico comunitário foi responsável por 24% das notificações à Unidade de Farmacovigilância do Sul (UFS) (29) e no ano de 2015, o número desceu ligeiramente para 22% (30), mostrando claramente uma possibilidade de melhoria nesta área. Em 2016 o número volta a aumentar (28%), embora ainda relativamente distante do números de NE provenientes do hospital (49%) (31).
Contudo, como verificado no estudo realizado por Duarte et al 2015., apenas 38,3% dos farmacêuticos comunitários entrevistados pertencentes à região Sul de Portugal, tinham já reportado alguma RAM, relatando que sentiam dificuldades em estabelecer uma relação causal entre esta e a utilização do medicamento (32).
Relativamente à notificação por parte dos doentes, Matos et al 2015., verificou que os doentes mais provavelmente irão notificar apenas as reações adversas severas, cujos sintomas são evidentes e preocupantes para os mesmos (33). Contudo, poderão incluir descrições mais detalhadas, além de contribuírem para o aumento do número de notificações (34).
Após a receção das notificações, estas são validadas, processadas, analisadas e finalmente é realizada a atribuição de um grau de causalidade, que define a probabilidade de determinado medicamento ser responsável por uma RAM (5). Os graus de probabilidade definidos pelo Programa Uppsala da OMS são: definitiva, provável, possível, improvável, condicional/não classificada ou não classificável (35) e constituem uma forma de harmonizar e avaliar as NE (5).
Em Portugal, o método de imputação de causalidade mais comummente utilizado é a introspeção global, sendo que podem ser usados outros métodos, nomeadamente algoritmos decisionais e métodos baysianos (36), que apresentam baixa especificidade
apesar de serem métodos sensíveis. Assim, não se consideram alternativas à introspeção global, mas sim um complemento a este método (37).
Toda a informação que constitui uma notificação é submetida pelos notificadores, diretamente ao INFARMED, às Unidades de Farmacovigilância (UF) ou aos titulares de AIM. Tanto as UF como os titulares de AIM têm como obrigação remeter estes dados ao INFARMED, integrando assim a base de dados nacional de suspeitas de reações adversas a medicamentos de uso humano (SVIG). Na base de dados SVIG as RAM são classificadas segundo o dicionário MedDRA (Medical Dictionary for Regulatory Activities), uma terminologia médica internacional com o objetivo de harmonizar a classificação atribuída às reações adversas (38). A classificação MedDRA apresenta níveis hierárquicos associados, nomeadamente, níveis SOC (System Organ Class), HLGT (High Level Group Term), HLT (High Level Term), PT (Prefered Term) e LLT (Lowest Level Term) (38).
Os medicamentos suspeitos são classificados segundo o sistema ATC (Anatomical
Therapeutical Chemical) de acordo com o órgão/sistema em que atuam e as suas
propriedades a nível anatómico, terapêutico e químico (36).
A informação inscrita nesta base de dados é também partilhada com outras bases de dados, nomeadamente com a VigiBase, base de dados mundial operada pela OMS, e com a
EudraVigilance, base de dados da EMA para medicamentos comercializados no espaço da
UE (36), garantindo um acesso global à informação na área da segurança do medicamento, tanto a nível europeu como a nível mundial.
Sistema Nacional de Farmacovigilância
O SNF foi criado em 1992, resultante da transposição de várias Diretivas Europeias para o Decreto-Lei n.º 72/91, que através do seu artigo 94º refere que: “Os titulares de Autorização de Introdução no Mercado (AIM), médicos, diretores técnicos de farmácia e outros técnicos de saúde devem comunicar ao INFARMED as reações adversas de que tenham conhecimento, resultantes da utilização de medicamentos” (39).
Inicialmente projetado para operar de forma centralizada (21), a fraca participação por parte dos profissionais de saúde, por desconhecimento ou baixa motivação, resultou no insucesso deste Sistema. Assim, só a partir de 2000 e 2004, a criação das UF do Norte (UFN), Centro (UFC), Lisboa e Vale do Tejo (UFLVT) e Sul (UFS) permitiu a descentralização e uma maior e mais alargada cobertura do território nacional, com uma maior proximidade com os profissionais de saúde e as instituições de saúde (36).
Atualmente o SNF opera entre o INFARMED, através da Direção de Gestão do Risco do Medicamento (DGRM), as UF e a EMA. Em colaboração com estas entidades estão outras Agências, tal como a OMS, todos os profissionais de saúde e instituições, titulares de AIM e doentes, no sentido de detetar problemas relacionados com o uso dos medicamentos (40) (41).
Unidade de Farmacovigilância do Sul
As UF são definidas como “entidades especialmente vocacionadas para a área da farmacologia e da farmacoepidemiologia, designadamente estabelecimentos universitários e hospitalares e unidades prestadoras de cuidados de saúde primários, ou entidades a eles associadas” (41).
São responsáveis por receber, classificar, processar, validar e verificar a imputação de causalidade das notificações espontâneas de RAM (36). Apresentam autonomia científica e levam a cabo a realização de estudos na área da farmacoepidemiologia e segurança do medicamento (21), rececionam e analisam as notificações espontâneas de suspeitas de reações adversas e promovem e divulgam o SNF e a NE na área geográfica adstrita, junto de profissionais de saúde e doentes (41). Para promover o Sistema de Farmacovigilância adotam diferentes estratégias, muitas vezes combinadas, desde criação de websites, distribuição de panfletos, palestras, boletins de alerta, pesquisa científica, entre outras metodologias (42).
No ano de 2000, com a intenção de descentralizar o SNF, foram criadas inicialmente quatro UF: do Norte, Sul, Açores e Núcleo de Farmacovigilância do Centro. Estas Unidades sofreram uma reestruturação, em 2003, passando nesse ano a UFS a UFLVT, e sendo criada uma nova Unidade do Sul para o Alentejo e Algarve (19).
Atualmente denominada Unidade de Farmacovigilância de Setúbal e Santarém, a anterior UFS foi criada em 2004 numa colaboração entre o INFARMED e a Faculdade de Farmácia da Universidade de Lisboa. Esta Unidade compreende toda a região Sul, Alentejo e Algarve (distritos de Portalegre, Évora, Beja, Faro e parte do distrito de Setúbal), com aproximadamente 939.445 habitantes, 5 hospitais distritais gerais públicos, 3 hospitais de nível I, 44 centros de saúde no Alentejo, 16 centros de saúde no Algarve e 274 farmácias comunitárias (30).
A equipa da UFS é constituída por diversos profissionais, designadamente técnicos de farmacovigilância, peritos de diferentes valências e delegados de farmacovigilância das áreas hospitalar e comunitária (10 no total). Estes profissionais são responsáveis por
Figura 2 - Índice NE/ano/milhão de habitantes para as 4 UF em 2016 (31)
divulgar e promover a notificação espontânea e encarregues de desenvolver atividades de formação e divulgação a outros profissionais e a utentes (31).
Em 2016, a UFS alcançou o objetivo de 314 NE por milhão de habitantes, o que supera a meta aconselhada pela OMS para um sistema de farmacovigilância eficaz, 200 a 300 NE por milhão de habitantes por ano (Figura 2) (31).
Os dados a analisar no presente trabalho de campo correspondem a suspeitas de RAM reportadas à UFS entre 2012 e 2016 (5 anos), abrangendo as áreas geográficas de intervenção desta Unidade nesse período, compreendidas entre o Alentejo e Algarve.
A classe dos antibacterianos
Os antibacterianos constituem um grupo de fármacos que teve o seu desenvolvimento exponencial no início do século XX, abrindo novos caminhos na medicina moderna. Nos dias de hoje, o paradigma é diferente. A resistência é transversal a quase todos os antibacterianos, o que por vezes limita as opções terapêuticas disponíveis (43).
O contínuo desenvolvimento de novos antibacterianos é crucial, por um lado para fazer face às necessidades individuais do doente, por outro para dar resposta a esta problemática, que ameaça a saúde pública e que exige uma responsabilização geral, tanto de profissionais de saúde como de doentes (44).
Para combater a resistência microbiana, os vários países do mundo devem fazer um esforço global, estar unidos e caminhar no sentido de implementar legislação que restrinja a utilização destes fármacos (43). Tal como defendido por Sousa JC 2010, a melhor política é restringir o seu uso apenas às situações em que estes sejam mesmo necessários, evitar a sua eliminação para o ambiente, evitar a automedicação e definir regras restritas no seu uso para fins profiláticos (45).
Para além da questão da resistência microbiana, a má utilização de antibacterianos tem consequências a nível do prolongamento do período de doença, aumento do período e
número de hospitalizações, elevado risco de complicações com importante influência na morbilidade e mortalidade e encargos para os sistemas de saúde (46) (47).
Os antibacterianos, sendo um grupo muito vasto de fármacos, podem apresentar mecanismos de ação distintos. Para dar alguns exemplos, estes podem atuar a nível da inibição da síntese da parede bacteriana (β-lactâmicos, glicopéptidos), alterar a permeabilidade da membrana plasmática (polipéptidos), inibir a síntese proteica (macrólidos, aminoglicosídeos, tetraciclinas) ou inibir a atividade enzimática essencial à sobrevivência bacteriana (quinolonas) (48).
Analisando alguns dados dos anos 2000 a 2009, apesar de se notar uma redução do consumo de antibacterianos na globalidade de Portugal Continental, os números de consumo continuam ainda a apresentar um valor elevado quando em comparação com outros países da Europa. Entre as diferentes classes de antibacterianos, no período acima mencionado, ocorreu um aumento no consumo de macrólidos (19,58%), sendo que as classes de tetraciclinas (53,96%), cefalosporinas (43,50%) e quinolonas (15,31%) sofreram uma redução acentuada no consumo. A nível regional, no período acima mencionado, os distritos do Alentejo mantiveram o valor de consumo num nível inferior ao da média nacional e Faro apresentou um valor ligeiramente superior ao da média nacional. Contudo, apesar de considerarmos o consumo de antibacterianos em Portugal como um dos mais elevados da Europa, temos que ter em consideração que estes números serão subestimados, uma vez que não entraram em linha de conta com os antibacterianos usados em automedicação e dispensados sem prescrição médica (49).
De facto, as políticas aplicadas entre os vários países da Europa nesta matéria apresentam diferenças, sendo que a forma como encaramos esta classe terapêutica deve ser apenas uma: o acesso deve ser limitado e o seu uso monitorizado (50).
No período entre 2009 a 2011, das 6.622 suspeitas de casos de RAM, de todos os grupos ATC 1º nível, responsáveis por reações adversas notificadas, o grupo J (Anti-infeciosos gerais para uso sistémico) encontra-se em primeiro lugar. No 2º nível ATC os medicamentos suspeitos mais frequentemente reportados foram os agentes antineoplásicos (12,45%), as vacinas (9,90%) e os antibacterianos para uso sistémico (8,42%). Nos 10 medicamentos mais frequentemente associados a suspeitas de RAM, o antibiótico amoxicilina com inibidor enzimático encontra-se em 4º lugar (36).
A evidência do uso excessivo e inadequado dos antibacterianos justifica claramente a necessidade de conhecer os padrões de utilização destes medicamentos no período seguinte ao dos dados apresentados. Assim, e aliado ao facto deste ser um grupo
heterogéneo de fármacos e em elevado número, será importante conhecer o impacto das reações adversas na saúde pública.
A informação gerada poderá ser importante para promover atividades educativas junto da população e dos profissionais de saúde e identificar oportunidades de melhoria.
2. Pertinência do estudo
Os antibacterianos são uma das classes responsáveis por um maior número de RAM reportadas no período de 2009 a 2011 (36). Além de serem um grupo muito vasto de fármacos, é também um grupo heterogéneo.
Neste sentido, será relevante perceber se a tendência verificada se mantém ou se há alterações no perfil de notificações no período agora em estudo, especificamente entre os anos 2012 e 2016 e encontrar razões para essas diferenças. Será também importante relacionar estes dados, obtidos regionalmente, com dados nacionais e internacionais.
3. Objetivos
Objetivo Geral
Caracterizar as reações adversas associadas a antibacterianos (ATC J01) reportadas à Unidade de Farmacovigilância do Sul, no período de 2012 a 2016 (5 anos).
Objetivos Específicos
Analisar as reações adversas a antibacterianos reportadas à UFS no período mencionado, no que se refere a:
Dimensão do número de notificações de RAM a este grupo terapêutico, em comparação com outros grupos terapêuticos e evolução ao longo do período em análise;
Via de notificação mais frequentemente usada para reportar;
Profissionais de saúde mais responsáveis pelas notificações, quanto ao grupo profissional, instituição e distrito a que pertencem, e comparar com os dados de notificação por parte de doentes e delegados de farmacovigilância;
Perfil dos doentes, relativamente a idade, grupo etário e género, em que as RAM a antibacterianos foram mais frequentes;
RAM notificadas quanto à sua gravidade e critérios de gravidade, conhecimento prévio da RAM/Descrição no Resumo das Características do Medicamento (RCM), evolução, imputação de causalidade e classificação MedDRA/SOC;
Medicamento suspeito potencialmente causador de RAM, quanto ao número de medicamentos suspeitos, classificação ATC Medicamento Suspeito 1º, 2º 3º e 5º nível;
Comparação com dados de outras regiões do país (Norte e Centro) e com dados internacionais;
4. Metodologia
Desenho do Estudo
Estudo observacional descritivo, de orientação transversal, para análise das reações adversas associadas a antibacterianos (grupo ATC J01), reportadas à Unidade de Farmacovigilância do Sul por profissionais de saúde ou utentes, entre 1 de janeiro de 2012 e 31 de dezembro de 2016 (5 anos).
Recolha de Informação e Tratamento de Dados
Os dados em que este trabalho de campo se baseou constam na base de dados SVIG do INFARMED, e foram exportados para um ficheiro Excel pelos órgãos competentes da UFS. Esta base de dados contém notificações de reações adversas, reportadas por qualquer notificador, à UFS, através de um dos vários meios de notificação disponíveis, entre 2012 e 2016.
De notar que, uma notificação de suspeita de reação adversa (uma entrada na base de dados) é relativa a um notificador e a um doente, mas pode não corresponder a uma única reação adversa ou apenas a um medicamento suspeito. Isto significa que para uma notificação podem estar envolvidos uma ou mais RAM para um ou mais medicamentos suspeitos.
Para classificação das RAM foi utilizado o dicionário MedDRA para codificar por SOC (System Organ Class) e LLT (Lowest Level Term) e a classificação dos medicamentos suspeitos baseou-se no Sistema ATC (Anatomical Therapeutical Chemical).
Os dados disponibilizados no ficheiro Excel foram alvo de uma revisão prévia, de forma a que os mesmos termos estejam codificados de igual forma e foram selecionadas as variáveis de interesse para o presente estudo, de acordo com os objetivos definidos anteriormente.
O tratamento da informação foi efetuado através do software Epi Info™, uma ferramenta de tratamento estatístico de dados, que permite caracterizar as principais variáveis e fazer o cruzamento entre estas. Foi utilizado como critério de significado estatístico, um nível de significância de 5% (p<0,05 e IC 95%)
Variáveis de Estudo
Para as notificações totais e para as notificações associadas ao grupo dos antibacterianos de uso sistémico foram analisadas as seguintes variáveis:
Relativas à notificação e sua origem:
o Distribuição anual do número de notificações
o Via de notificação (INFARMED, online, portal RAM, telefone, e-mail, correio, fax, UFLVT, UFN)
Relativas ao notificador:
o Categoria Profissional (médico, enfermeiro, farmacêutico, utente, técnico de enfermagem, técnico de farmácia, técnico de radiologia)
o Instituição de Saúde (hospital público, farmácia comunitária, centro de saúde, utente, hospital privado)
o Distrito (Portalegre, Évora, Beja, Faro, Setúbal)
o Delegado de Farmacovigilância (não delegado, delegado) Relativas ao doente:
o Idade
o Grupo Etário:
Recém-nascido: < 28 dias; Lactentes: 28 dias a < 2 anos; Criança: 2 a 11 anos;
Adolescente: 12 a 17 anos; Adulto: 18 a 64 anos; Idoso: > 64 anos. o Género (masculino, feminino) Relativas à reação adversa:
o Grau de gravidade (não grave, grave)
o Critérios de avaliação da gravidade (morte, perigo de vida, hospitalização, prolongou a hospitalização, critério clínico, incapacidade)
o Conhecimento prévio da RAM – Descrição no RCM (descrita, não descrita) o Evolução da RAM (cura, cura com sequelas, em recuperação, morte, morte sem
reação com a RAM, persiste sem recuperação)
o Imputação de Causalidade (definitiva, provável, possível, improvável, desconhecida)
o Tipo de efeito/órgão afetado (classificação MedDRA/SOC) o Classificação MedDRA/LLT
Relativas ao medicamento suspeito: o Número de medicamentos suspeitos o Grupo ATC 1º nível
o Grupo ATC 2º nível o Grupo ATC 3º nível o Grupo ATC 5º nível
5. Apresentação de Resultados
Caracterização das notificações e sua origem
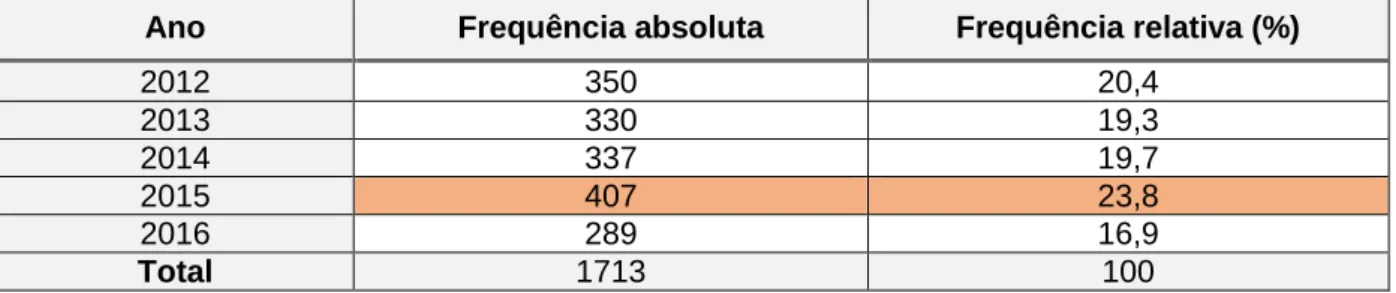
Foram analisadas 1713 notificações de RAM reportadas à UFS no período compreendido entre 2012 e 2016 (5 anos).
De acordo com os dados apresentados na Tabela 1, verificamos que o número de notificações de RAM não sofreu grandes oscilações nos três primeiros anos do período de análise. No ano de 2015 registou-se o máximo de notificações (23,8%) e em 2016 o mínimo (16,9%).
Tabela 1 - Evolução anual do número total de NE recebidas pela UFS entre 2012 e 2016
Considerando o período em análise, as RAM reportadas com suspeita de associação a medicamentos antibacterianos sistémicos constituíram 8% do total de notificações rececionadas pela UFS. Comparando a distribuição anual de notificações totais e referentes ao grupo terapêutico em estudo (neste caso os antibacterianos de uso sistémico (J01)), recebidas pela UFS, podemos verificar que este último (n=137) se mantém praticamente constante e acompanha a variação do número total de notificações (n=1713), com os anos em que se verificam mais notificações totais a corresponder aos anos onde foram notificadas mais RAM ao grupo J01 (2012 e 2015) (Figura 3).
Ano Frequência absoluta Frequência relativa (%)
2012 350 20,4 2013 330 19,3 2014 337 19,7 2015 407 23,8 2016 289 16,9 Total 1713 100 350 330 337 407 289 36 22 22 36 21 0 50 100 150 200 250 300 350 400 450 2012 2013 2014 2015 2016 Notificações totais
1126 234 144 114 37 21 16 13 8 83 30 10 9 3 1 1 0 0 0 200 400 600 800 1000 1200 Online Portal RAM
Infarmed Correio Telefone E-mail Fax UFLVT UFN
Notificações totais Notificações associadas ao grupo ATC J01
5.1.1 Via de notificação
Para a totalidade das notificações (n=1713), a principal via de notificação à UFS foi claramente a via online (65,73%), nomeadamente através do site desta Unidade. O Portal RAM (13,66%) e a notificação através do INFARMED (8,41%) foram a segunda e terceira vias mais utilizadas nas notificações analisadas, respetivamente. O correio foi utilizado como via de notificação em 6,65% dos casos, e com menor expressão as restantes vias de notificação, como o telefone (2,16%), o e-mail (1,23%), o fax (0,93%), a UFLVT (0,76%) e a UFN (0,47%) (Figura 4). No contexto geral, as últimas vias de notificação apresentam ainda pouca expressão quando comparadas com as duas primeiras.
Particularizando para o grupo terapêutico em estudo, nos 5 anos do período de análise, as RAM associadas ao grupo J01 (n=137) acompanharam a utilização destas vias relativamente às notificações totais. As vias mais usadas foram a via online (60,58%), de seguida o portal RAM (21,90%), INFARMED (7,30%) e correio (6,57%). Por fim, o telefone (2,19%), e-mail (0,73%) e fax (0,73%) foram vias com menor expressão de utilização (Figura 4).
Figura 4 - Vias de notificação associadas às NE totais e do grupo ATC J01
5.2 Caracterização do notificador de reações adversas
5.2.1 Categoria Profissional
Na totalidade das notificações (n=1713), o profissional de saúde que mais notificou à UFS foi o farmacêutico (76,07%). O médico foi responsável por 13,72%, o enfermeiro por 5,90% e o utente por 3,85% das notificações. Outros técnicos de saúde (nomeadamente técnicos de farmácia, radiologia e enfermagem) contribuíram para 0,47% dos casos.
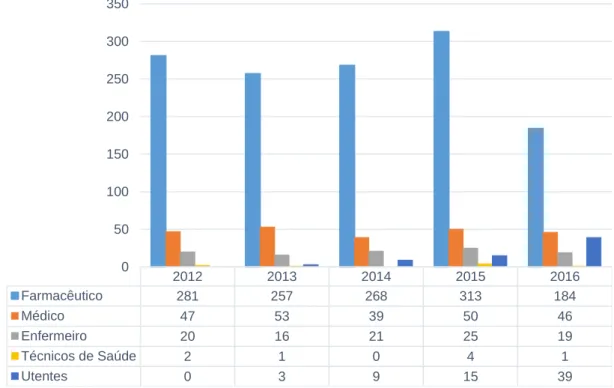
2012 2013 2014 2015 2016 Farmacêutico 281 257 268 313 184 Médico 47 53 39 50 46 Enfermeiro 20 16 21 25 19 Técnicos de Saúde 2 1 0 4 1 Utentes 0 3 9 15 39 0 50 100 150 200 250 300 350
Na Figura 5, observa-se a distribuição anual do número de notificações realizadas pelos diferentes profissionais de saúde e utentes. Corroborando os dados apresentados anteriormente, o farmacêutico destaca-se claramente como o profissional de saúde que mais notificou e é possível agora observar que foi também o profissional que mais notificou em cada um dos 5 anos do período de análise, apresentando uma distância considerável dos outros notificadores.
Realça-se que, no ano de 2015, houve um aumento no número de notificações realizadas pelo farmacêutico, e em 2016 este número decresceu consideravelmente, o que também se verifica para o número total de notificações à UFS nesses anos. As outras categorias profissionais não apresentam grandes oscilações.
Apesar da ainda pequena contribuição do utente como notificador comparativamente a algumas categorias profissionais, é de destacar a evolução no número de notificações, apresentando consecutivamente uma tendência crescente. Em 2016 estas notificações ultrapassam as que foram realizadas por enfermeiros e técnicos de saúde e aproximam-se das notificações realizadas por médicos.
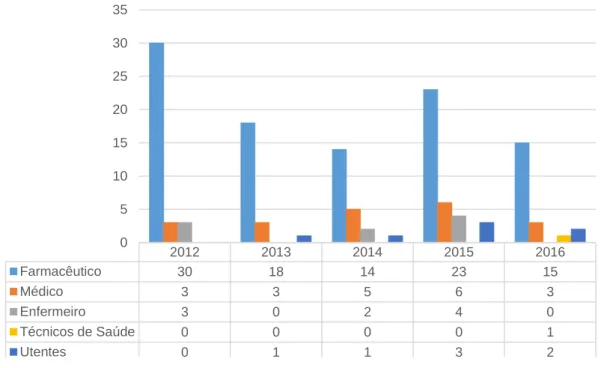
2012 2013 2014 2015 2016 Farmacêutico 30 18 14 23 15 Médico 3 3 5 6 3 Enfermeiro 3 0 2 4 0 Técnicos de Saúde 0 0 0 0 1 Utentes 0 1 1 3 2 0 5 10 15 20 25 30 35
Figura 6 - Distribuição anual do número de NE do grupo ATC J01, por categoria profissional
Relativamente aos antibacterianos de uso sistémico (n=137) (Figura 6), o farmacêutico também foi o profissional que mais se destacou como notificador (72,99%) em cada um dos anos. A contribuição do médico como notificador de RAM associadas ao grupo J01 (14,60%) aumentou consecutivamente entre 2013 e 2015, decrescendo de seguida no ano de 2016. O contributo dos enfermeiros (6,57%), utentes (5,11%) e técnicos de saúde (0,73%) para a notificação de RAM a este grupo terapêutico foi mais discreto.
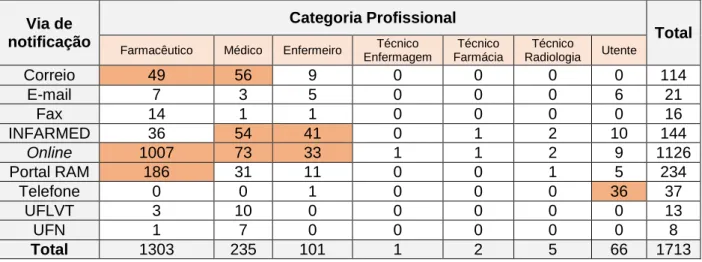
Na Tabela 2 observamos que os farmacêuticos, na sua larga maioria, preferiram notificar pela via online (através do portal da UFS), embora usem com frequência outras vias, nomeadamente o portal RAM e o correio.
Os médicos optam na sua maioria entre a notificação online, correio e notificação ao INFARMED. O enfermeiro opta pela notificação diretamente ao INFARMED e a via online. Outros profissionais de saúde, nomeadamente técnicos de enfermagem, de farmácia e de radiologia têm ainda um papel pouco expressivo na notificação de RAM à UFS, preferindo a via online ou através do INFARMED, quando o fazem.
De destacar que, ao contrário do que acontece com as diferentes categorias profissionais, os utentes, na sua maioria, preferiram notificar pelo telefone.
Tabela 2 - Cruzamento das variáveis categoria profissional e via de notificação para as NE totais
Relativamente às notificações do grupo J01 (
Tabela 3), podemos concluir que o farmacêutico também preferiu notificar estas RAM através da via online, seguindo-se o portal RAM. Ao contrário do que acontece para as notificações totais, a via online foi a via mais utilizada por enfermeiros para notificar RAM aos antibacterianos de uso sistémico e o médico optou entre notificação ao INFARMED e via online. As notificações realizadas por utentes foram na sua maioria realizadas por telefone, o que também acontecia para as notificações totais.
Tabela 3 - Cruzamento das variáveis categoria profissional e via de notificação para as NE do grupo ATC J01
Via de notificação
Categoria Profissional
Total
Farmacêutico Médico Enfermeiro Técnico Enfermagem Técnico Farmácia Técnico Radiologia Utente Correio 49 56 9 0 0 0 0 114 E-mail 7 3 5 0 0 0 6 21 Fax 14 1 1 0 0 0 0 16 INFARMED 36 54 41 0 1 2 10 144 Online 1007 73 33 1 1 2 9 1126 Portal RAM 186 31 11 0 0 1 5 234 Telefone 0 0 1 0 0 0 36 37 UFLVT 3 10 0 0 0 0 0 13 UFN 1 7 0 0 0 0 0 8 Total 1303 235 101 1 2 5 66 1713 Via de notificação Categoria Profissional Total
Farmacêutico Médico Enfermeiro Técnico
Farmácia Utente Correio 4 5 0 0 0 9 E-mail 1 0 0 0 0 1 Fax 1 0 0 0 0 1 INFARMED 2 6 0 0 2 10 Online 69 6 7 1 0 83 Portal RAM 23 3 2 0 2 30 Telefone 0 0 0 0 3 3 Total 100 20 9 1 7 137
890 541 207 66 9 67 49 12 7 2 0 100 200 300 400 500 600 700 800 900 1000
Hospital Farmácia Centro de Saúde Utentes Privado
Notificações totais Notificações associadas ao grupo ATC J01
5.2.2 Instituição de Saúde
Mais de metade das notificações recebidas pela UFS foram realizadas por profissionais de saúde pertencentes a hospitais públicos (51,96%). A farmácia comunitária assume um papel importante, uma vez que 31,58% das notificações são realizadas por farmacêuticos e técnicos de farmácia destas instituições. Segue-se o centro de saúde (12,08%), utentes (3,85%) e por fim, o privado com 0,53% das notificações totais (Figura 7).
Relativamente ao grupo J01, proporcionalmente, a farmácia tem um contributo ligeiramente superior (35,77%), quando comparado com as notificações totais. O hospital diminuiu o seu contributo (48,91%), bem como o centro de saúde (8,76%), enquanto os utentes (5,11%) e o privado (1,46%) apresentam maior destaque.
Figura 7 - Instituições de saúde associadas às NE totais e do grupo ATC J01
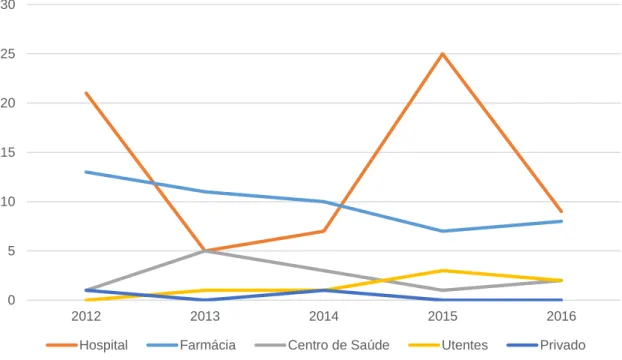
Entre 2014 e 2015, o hospital aumentou consideravelmente o número de notificações a antibacterianos de uso sistémico e decresceu no ano seguinte. A farmácia foi diminuindo o seu contributo, aumentando ligeiramente em 2016. O centro de saúde, os utentes e o privado não apresentaram grandes oscilações no número de notificações e paralelamente são os três grupos que menos notificaram (Figura 8), tal como exposto anteriormente.
0 5 10 15 20 25 30 2012 2013 2014 2015 2016
Hospital Farmácia Centro de Saúde Utentes Privado
Figura 8 - Distribuição anual do número de NE do grupo ATC J01, por instituição de saúde
Dentro das várias instituições de saúde (Tabela 4), o farmacêutico destaca-se claramente a nível hospitalar, tendo também uma importante expressão a nível comunitário no que diz respeito ao número de notificações.
O médico, a nível hospitalar, supera em número de notificações o médico de centro de saúde e o enfermeiro que trabalha no centro de saúde tem um papel importante em termos de notificação.
Das 541 notificações realizadas na farmácia verificamos que apenas 2 foram realizadas por técnicos de farmácia e as restantes 539 por farmacêuticos.
Tabela 4 - Cruzamento das variáveis categoria profissional e tipo de instituição, para as NE totais
Tipo de Instituição
Categoria Profissional
Total
Farmacêutico Médico Enfermeiro Técnico Enfermagem Técnico Farmácia Técnico Radiologia Utente Centro de Saúde 28 97 81 0 0 1 0 207 Farmácia 539 0 0 0 2 0 0 541 Hospital 734 134 20 1 0 1 0 890 Utentes 0 0 0 0 0 0 66 66 Privado 2 4 0 0 0 3 0 9 Total 1303 235 101 1 2 5 66 1713
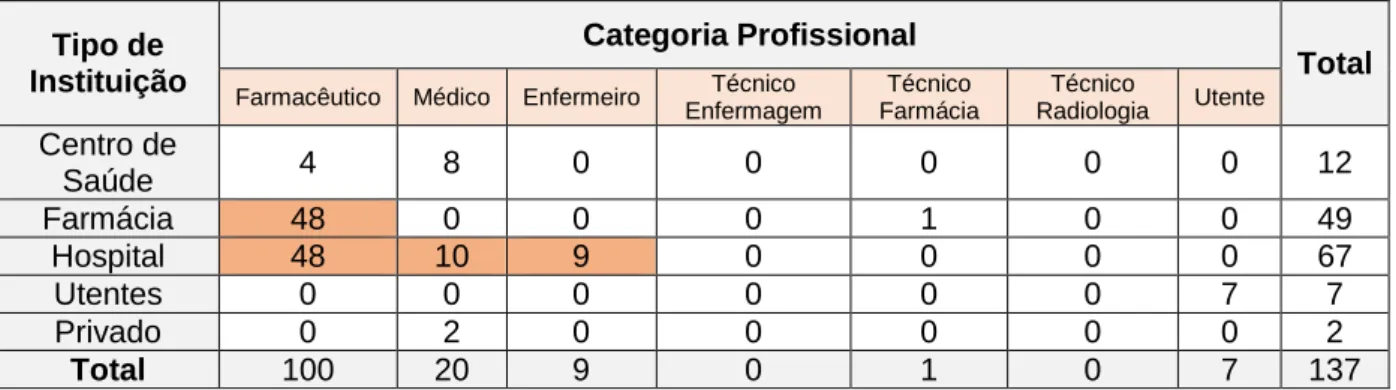
No grupo J01 (Tabela 5), o hospital destaca-se também como a instituição de onde surgem mais notificações realizadas por farmacêuticos e médicos.
O farmacêutico comunitário teve o mesmo contributo que o farmacêutico hospitalar.
Ao contrário do que acontece com as notificações totais, neste caso particular, o enfermeiro de centro de saúde não contribuiu para nenhuma notificação de RAM aos antibacterianos de uso sistémico, tendo sido o enfermeiro de hospital que mais notificou dentro desta categoria profissional.
Tabela 5 - Cruzamento das variáveis categoria profissional e tipo de instituição para as NE do grupo ATC J01
Tipo de Instituição
Categoria Profissional
Total
Farmacêutico Médico Enfermeiro Técnico Enfermagem Técnico Farmácia Técnico Radiologia Utente Centro de Saúde 4 8 0 0 0 0 0 12 Farmácia 48 0 0 0 1 0 0 49 Hospital 48 10 9 0 0 0 0 67 Utentes 0 0 0 0 0 0 7 7 Privado 0 2 0 0 0 0 0 2 Total 100 20 9 0 1 0 7 137
732 483 356 122 20 56 55 14 12 0 0 100 200 300 400 500 600 700 800
Faro Évora Beja Portalegre Setúbal
Notificações totais Notificações associadas ao grupo ATC J01
Figura 9 – Distritos associados às NE totais e do grupo ATC J01
5.2.3 Distrito
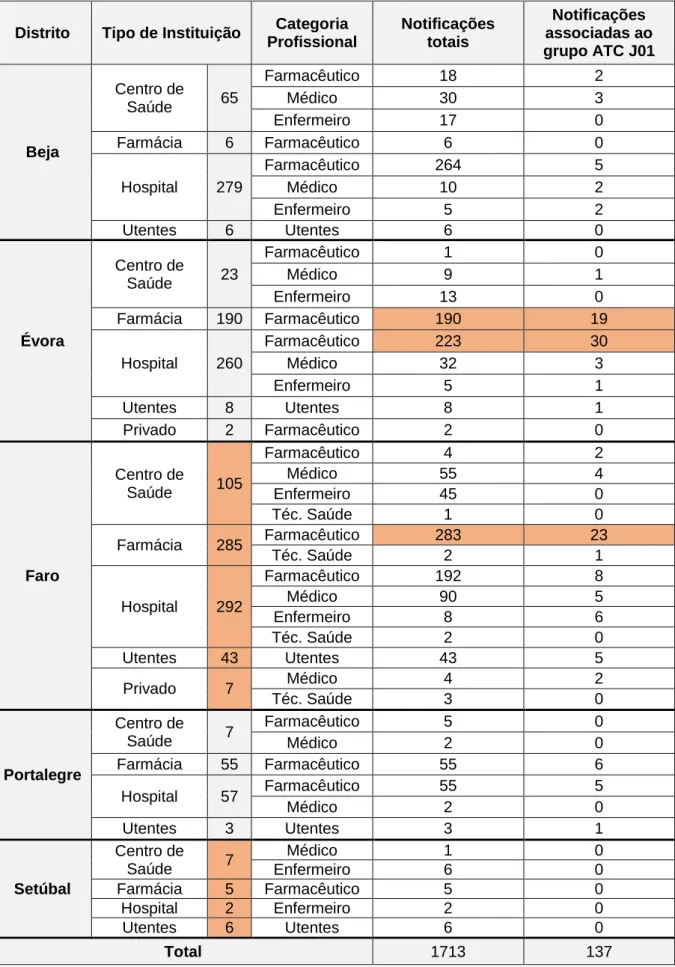
Relativamente às notificações totais (n=1713), o distrito que mais notificou foi Faro (42,73%), seguido de Évora (28,20%), Beja (20,78%), Portalegre (7,12%) e por fim, Setúbal (1,17%). Relativamente aos antibacterianos de uso sistémico (n=137), a distribuição é semelhante, sendo que não foram reportadas notificações referentes ao distrito de Setúbal (Figura 9).
De acordo com a Tabela 6, todas as instituições de saúde e utentes apresentam um maior número de notificações provenientes do distrito de Faro.
É possível verificar que os farmacêuticos de Évora, sendo apenas superados pelos farmacêuticos de Faro, apresentam um contributo muito significativo para o número de notificações totais e associadas ao grupo J01. O distrito de Setúbal foi de onde chegaram menos notificações, sendo o enfermeiro de centro de saúde e os utentes quem mais contribuiu para a notificação neste distrito.
No grupo dos antibacterianos de uso sistémico, é também do distrito de Faro de onde chegaram mais notificações em todas as categorias profissionais, à exceção do farmacêutico. Neste grupo profissional, o farmacêutico hospitalar do distrito de Évora foi o maior notificador de RAM à UFS, seguido do farmacêutico comunitário do distrito de Faro e do farmacêutico comunitário do distrito de Évora. Assim, o farmacêutico do distrito de Évora destaca-se com um maior número de notificações associadas a este grupo terapêutico, o que não acontece para as notificações totais à UFS entre 2012 e 2016. Do distrito de Setúbal não chegou nenhuma notificação referente aos antibacterianos de uso sistémico.
Distrito Tipo de Instituição Categoria Profissional Notificações totais Notificações associadas ao grupo ATC J01 Beja Centro de Saúde 65 Farmacêutico 18 2 Médico 30 3 Enfermeiro 17 0 Farmácia 6 Farmacêutico 6 0 Hospital 279 Farmacêutico 264 5 Médico 10 2 Enfermeiro 5 2 Utentes 6 Utentes 6 0 Évora Centro de Saúde 23 Farmacêutico 1 0 Médico 9 1 Enfermeiro 13 0 Farmácia 190 Farmacêutico 190 19 Hospital 260 Farmacêutico 223 30 Médico 32 3 Enfermeiro 5 1 Utentes 8 Utentes 8 1 Privado 2 Farmacêutico 2 0 Faro Centro de Saúde 105 Farmacêutico 4 2 Médico 55 4 Enfermeiro 45 0 Téc. Saúde 1 0 Farmácia 285 Farmacêutico 283 23 Téc. Saúde 2 1 Hospital 292 Farmacêutico 192 8 Médico 90 5 Enfermeiro 8 6 Téc. Saúde 2 0 Utentes 43 Utentes 43 5 Privado 7 Médico 4 2 Téc. Saúde 3 0 Portalegre Centro de Saúde 7 Farmacêutico 5 0 Médico 2 0 Farmácia 55 Farmacêutico 55 6 Hospital 57 Farmacêutico 55 5 Médico 2 0 Utentes 3 Utentes 3 1 Setúbal Centro de Saúde 7 Médico 1 0 Enfermeiro 6 0 Farmácia 5 Farmacêutico 5 0 Hospital 2 Enfermeiro 2 0 Utentes 6 Utentes 6 0 Total 1713 137
Tabela 6 - Cruzamento das variáveis distrito, tipo de instituição e categoria profissional para as NE totais e do grupo ATC J01
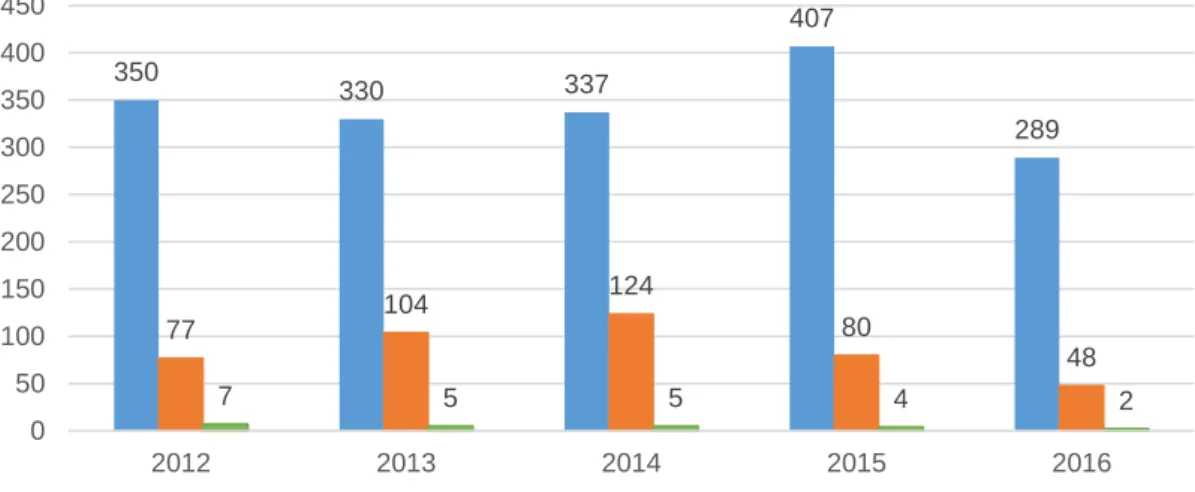
350 330 337 407 289 77 104 124 80 48 7 5 5 4 2 0 50 100 150 200 250 300 350 400 450 2012 2013 2014 2015 2016 Notificações totais
Notificações totais realizadas por delegados de farmacovigilância
Notificações associadas ao grupo ATC J01 realizadas por delegados de farmacovigilância
Figura 10 - Distribuição anual do número de NE totais e do grupo ATC J01, realizadas por delegados de farmacovigilância
5.2.4 Delegados de Farmacovigilância
Pela análise da Figura 10, podemos concluir que os delegados de farmacovigilância contribuíram de forma relevante para o número total de notificações (n=1713). Em cada um dos anos entre 2012 e 2016, estes foram responsáveis por 22,0%, 31,5%, 36,8%, 19,7% e 16,6% das notificações totais, respetivamente.
Além disso, a contribuição dos delegados faz-se notar com uma crescente evolução no número de notificações realizadas, nos 3 primeiros anos do período de análise. Nos 2 anos seguintes, esse contributo diminuiu consideravelmente.
As notificações de RAM aos antibacterianos de uso sistémico (n=137) realizadas por delegados de farmacovigilância foram diminuindo ao longo do período de análise, não acompanhando a tendência de crescimento verificada relativamente às notificações totais por parte destes profissionais.
5.3 Caracterização do perfil do doente
5.3.1 Idade e grupo etário
Das 1713 notificações analisadas, em 13 destas, a idade do doente era desconhecida. Das restantes 1700 notificações, a média etária corresponde a 54,78 anos, com um desvio padrão de 22,20 anos. Os valores mínimos e máximos assumidos foram respetivamente 0 e 99 anos, a mediana tem o valor de 58 anos e a moda de 61 anos.
Em todas as notificações (n=1713) era conhecido o grupo etário do doente e em mais de metade dos casos (53,12%) estas reações ocorreram em adultos. No idoso verificou-se um número bastante considerável de RAM (38,94%), enquanto nos restantes grupos etários, nomeadamente lactentes (2,74%), crianças (3,27%) e adolescentes (1,17%), o número de notificações tem pouca expressão, quando comparado com os grupos referidos anteriormente (Figura 11).
Relativamente aos antibacterianos de uso sistémico, a média etária corresponde a 54,11 anos, com um desvio padrão de 24,68 anos. Os valores mínimos e máximos assumidos foram respetivamente 1 e 94 anos, a mediana tem o valor de 57 anos e a moda de 28 anos.
As RAM associadas a este grupo terapêutico (n=137) também ocorreram com maior frequência em adultos (48,18%) e idosos (43,80%), seguindo-se os outros grupos etários como as crianças (5,84%), adolescentes (1,46%) e lactentes (0,73%) (Figura 11).
Figura 11 – Grupos etários associados às NE totais e do grupo ATC J01
910 667 56 47 20 66 60 8 1 2 0 100 200 300 400 500 600 700 800 900 1000
Adulto Idoso Criança Lactente Adolescente
5.3.2 Género
Da totalidade das reações analisadas, em apenas uma notificação é desconhecido o género do doente. Das restantes 1712 notificações, 1111 RAM diziam respeito a doentes do sexo feminino (64,86%) e 601 a doentes do sexo masculino (35,08%).
Relativamente aos antibacterianos de uso sistémico, as RAM associadas a este grupo terapêutico (n=137) ocorreram com maior frequência em doentes do sexo feminino (67,15%) constituindo o sexo masculino 32,85% das notificações, o que se equipara aos dados das notificações totais relativas ao género.
Pela Tabela 7 podemos concluir que tanto no grupo etário dos adultos como dos idosos, é no sexo feminino que se verifica o maior número de notificações totais e associadas ao grupo J01.
Verifica-se que em todos os grupos etários, à exceção dos lactentes, o sexo feminino apresenta um maior número de notificações associadas. A diferença entre géneros nos vários grupos não apresenta grandes discrepâncias, à exceção do grupo adultos e idosos.
Assim, o doente mais afetado por RAM alvo de notificação no período em análise foi o adulto feminino quer para a totalidade dos medicamentos quer especificamente para o grupo dos antibacterianos de uso sistémico.
Tabela 7 - Cruzamento das variáveis género e grupo etário para as NE totais e do grupo ATC J01
Grupo etário Notificações totais Total Notificações associadas ao grupo ATC J01 Total Género Género
Feminino Masculino Desconhecido Feminino Masculino
Lactentes 20 27 0 47 0 1 1 Crianças 31 25 0 56 5 3 8 Adolescentes 12 8 0 20 1 1 2 Adultos 641 269 0 910 47 19 66 Idosos 399 267 1 667 39 21 60 Desconhecido 8 5 0 13 0 0 0 Total 1111 601 1 1713 92 45 137
270 264 245 238 206 80 66 92 169 83 0 50 100 150 200 250 300 350 400 450 2012 2013 2014 2015 2016
RAM não graves RAM graves
Figura 12 - Distribuição anual do número de NE totais, por gravidade da RAM
26 16 17 15 16 10 6 5 21 5 0 5 10 15 20 25 30 35 40 2012 2013 2014 2015 2016
RAM não graves associadas ao ATC J01 RAM graves associadas ao ATC J01
5.4 Caracterização das reações adversas
5.4.1 Gravidade
Analisando as 1713 RAM, no período dos 5 anos de estudo, 490 reações foram classificadas como graves (28,60%) e as restantes 1223 como não graves (71,40%). Ao longo dos 5 anos (Figura 12), as reações não graves tiveram tendência para decrescer sucessivamente. As reações graves sofreram um aumento considerável no ano de 2015, registando-se o mínimo no ano de 2013.
Nas notificações referentes ao grupo J01 (n=137), as reações graves no total dos 5 anos, correspondem a 34,3% dos casos e as não graves a 65,7%. O número de reações não graves ao longo dos 5 anos foi sempre superior às graves, exceto em 2015 (Figura 13).