L'implication de l'ozone est évidente à partir du transfert de son anomalie isotopique (∆17O), dû au fractionnement isotopique indépendant de la masse au cours de sa réaction de formation (Thiemens et Heidenreich III, 1983 ; Thiemens, 2006). La composition isotopique de l'azote, conservée lors des réactions de conversion des NOx en nitrate (Kendall et al., 2007), indique la nature des sources de NOx (modulées par les fractionnements qui se produisent lors du transport des NOx). Cela permet également de relier la situation observée dans les régions polaires à la chimie de l’atmosphère à l’échelle mondiale.
La composition chimique de l'atmosphère revêt une importance décisive pour l'habitabilité de la surface de la planète Terre. La plupart des radicaux qui participent au pouvoir oxydant de l’atmosphère sont liés à la chimie de l’ozone. Dans la nature, la fixation de l'azote moléculaire se produit également lors de la foudre (Schumann et Huntrieser, 2007).
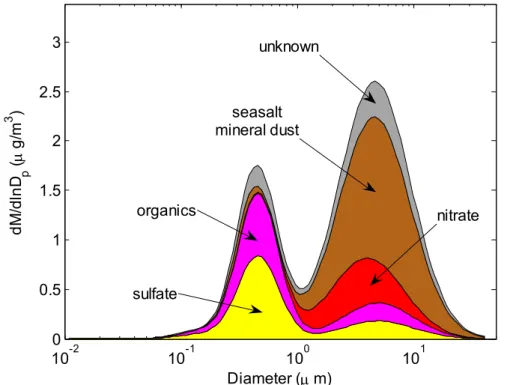
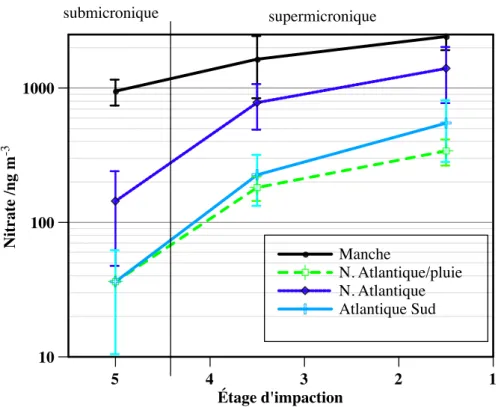
La figure 1.2 présente un résumé de la composition chimique des aérosols dans la couche limite marine en fonction de la taille des particules considérées. Les figures 1.5 et 1.6 montrent schématiquement la structure nucléaire des isotopes de l'oxygène et de l'azote, respectivement. Dans le cas de l'oxygène, ce matériau de référence est appelé SMOW (Standard Mean Ocean Water).
La formule de changement de référence est dérivée de la définition du taux d'enrichissement isotopique.
Mass-Independent Mechanism
Applications
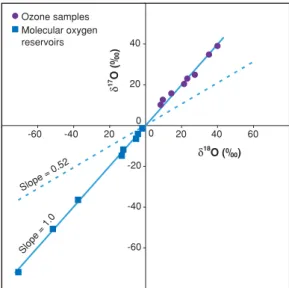
La découverte du fractionnement des isotopes indépendant de la masse au cours de la réaction de formation de l'ozone a ouvert un nouvel univers de recherche isotopique (Thiemens et Heidenreich III, 1983). Avant d’approfondir l’étude de la composition isotopique de l’ozone atmosphérique, le concept d’anomalie isotopique devrait être introduit et clarifié sur la base de l’expérience pratique. Compte tenu de la multitude de mesures isotopiques de l'oxygène dans les réservoirs terrestres, la composition isotopique de l'ozone doit donc être définie comme anormale.
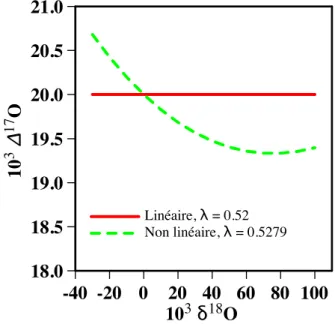
Récemment, une série d’études ont remis en question cette expression mathématique de l’anomalie isotopique de l’oxygène. La définition non linéaire de ∆17O a été appliquée aux paires de données générées, pour des valeurs de 0,5279 (Kaiser et al., 2007). Cette valeur représente la différence maximale qui peut exister entre deux ensembles de données, du fait du choix exclusif de la définition mathématique de l'anomalie isotopique.
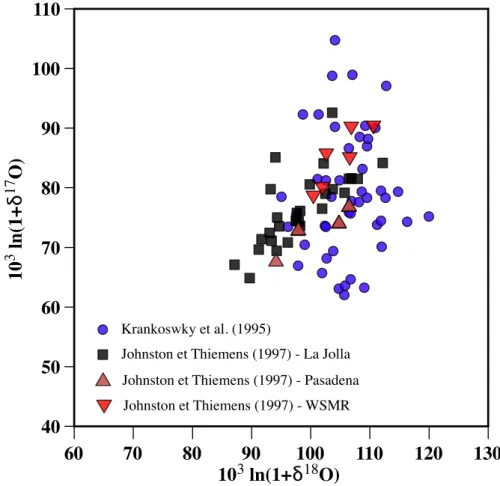
En effet, une caractéristique clé de l’anomalie isotopique est qu’elle est préservée au cours de tout processus dépendant de la masse : dans un diagramme à trois isotopes et un réservoir. À ce jour, seules deux études font état de mesures d’anomalies isotopiques de l’ozone troposphérique (Krankowsky et al., 1995, Johnston et Thiemens, 1997).
Pasadena La Jolla White Sand - year-round spring Alerta) Surface ozone
Cependant, en raison des anomalies isotopiques véhiculées par l'ozone et les oxydes d'azote, l'anomalie isotopique de l'oxygène dans l'air est négligeable (Barkan et Luz, 2003). La réaction NO+O3→NO2+O2 est essentielle pour étudier la transmission de l'anomalie isotopique de l'ozone aux oxydes d'azote, puis au nitrate atmosphérique. Bhattacharya (du Laboratoire de recherche physique, Ahmedabad, Inde), nous avons déterminé les caractéristiques de transfert de l'anomalie isotopique de l'ozone vers les oxydes d'azote.
Par exemple, Sheppard et Walker (1983) ont montré cela dans le cas de la photodissociation de l'ozone (O3+hν). La modélisation chimique permet d'accéder aux variations de la valeur de α en fonction des conditions atmosphériques étudiées (voir section 1.6). La teneur en vapeur d'eau dans l'atmosphère peut être calculée en fonction de l'humidité relative et de la température (Bolton, 1980) (c.-à-d.
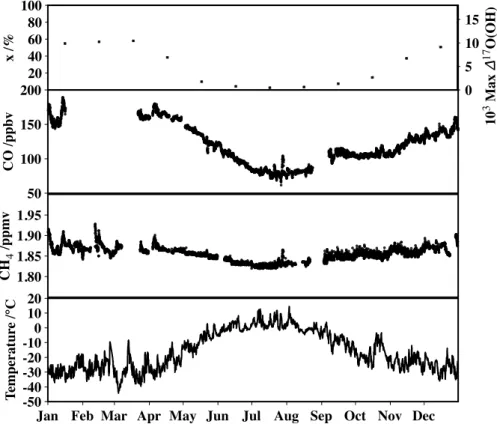
Les valeurs de x peuvent donc être calculées en fonction de la température ambiante, de l'humidité relative et de la teneur en CO2 et CH4. Toutes les autres sources d’OH devraient produire une déviation isotopique inférieure au cas extrême de l’ozone. La valeur maximale de ∆17O(prod.OH) correspond à un mode de production constitué exclusivement de photolyse de l'ozone, suivie de la réaction de O(1D) avec la vapeur d'eau atmosphérique.
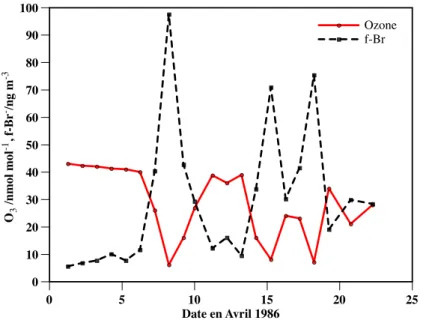
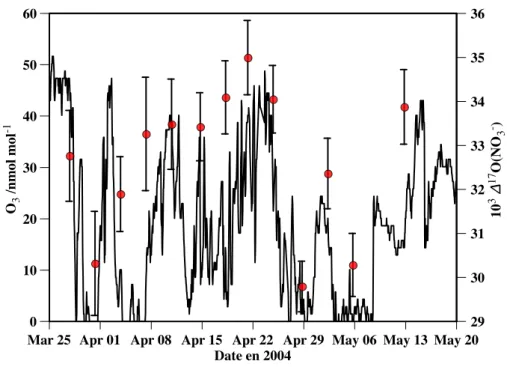
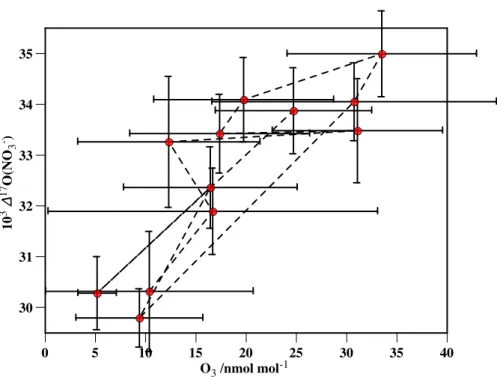
À titre d'illustration de ces épisodes, la figure 2.2 présente un aperçu de l'évolution du profil vertical de l'ozone à Alert au printemps 2000 (Bottenheim et al., 2002). La figure 2.6 montre l'évolution temporelle de l'ozone de surface dans Alert et ∆17O(NO−3). De plus, les valeurs de ∆17O(NO−3) semblent suivre les valeurs de l'ozone pendant l'ODE.
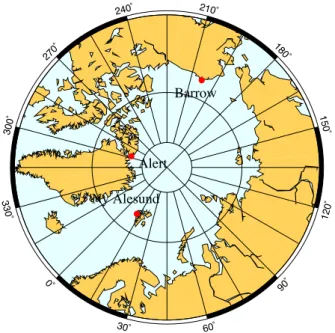
L'interprétation de ces observations a été initiée dans deux publications (Morin et al., 2007a, b), traitant respectivement de la présentation et de l'interprétation des données recueillies à Alert et Barrow. Les détails techniques liés au calcul de la masse des précipitations carbonatées sont présentés dans un article rédigé lors de cette thèse (Morin et al., 2008a). Comme l'ont initié Michalski et al. 2003), l’interprétation des variations de ∆17O(NO−3) repose sur l’analyse de l’importance de deux cycles superposés de formation de nitrates atmosphériques.
Dans un premier temps, le NO2 acquiert une composition isotopique partiellement dérivée de celle de l'ozone (voir page 48). En revanche, lors des réactions Br+O3 et NO+O3, un seul des atomes d’oxygène est transféré de l’ozone vers BrO et NO2, respectivement.
DDUDome C
Dans ces conditions, Patris et al. 2007) ont obtenu un écart moyen d'environ 1,5 h entre les deux modes considérés, ce qui correspond à nos observations dans la même plage de latitude. Widory (2007) a mesuré la composition isotopique de l'azote total dans les particules inférieures à 10 µm (PM10) à Paris. Ce comportement vient probablement de la contribution importante de l'ammonium à la quantité d'azote dans ces particules : en général, les valeurs de δ15N dans l'ammonium atmosphérique sont plus élevées que dans l'ammonium.
En revanche, l'écart entre la composition isotopique des nitrates atmosphériques et de l'eau de pluie est constant, de l'ordre de 9 heures. Il est depuis généralement admis que le δ15N des oxydes d'azote produits lors de la foudre est de l'ordre de 0 h, ce qui correspond à la composition isotopique de l'azote de l'air. Au contraire, lors de la même étude, la composition isotopique des NOx issus du combustible (notamment du charbon) a été déterminée de l'ordre de 15 heures.
Cette dernière valeur peut varier en fonction de la composition isotopique de l'azote du carburant et de sa réactivité vis-à-vis de l'oxygène (plus le carburant est réactif, plus le fractionnement est faible). Cette classification est cohérente avec les conclusions d'Elliott et al. 2007), suggérant que le δ15N dans les nitrates des eaux de pluie est essentiellement lié à la proximité des centrales thermiques. Ainsi, Elliott et al. 2007) expliquent la structure spatiale de leurs données (voir Figure 4.2) en reliant les mesures de δ15N dans le nitrate d'eau de pluie.
La raison de l’existence du cycle annuel du δ15N dans les nitrates atmosphériques (et les eaux de pluie) doit donc impliquer la combinaison d’effets de source et de fractionnements atmosphériques en fonction des conditions physiques de l’atmosphère. Plusieurs mécanismes ont été proposés par Freyer (1991) pour expliquer la tendance saisonnière mesurée des nitrates dans les eaux de pluie. Au-dessus de l'Atlantique, le profil latitudinal de δ15N(NO−3) est très stable, montrant des valeurs d'environ -3 h, couvrant la majeure partie de la plage de latitude étudiée.
La différence de composition isotopique de l'oxygène entre ces deux modes est donc due au fractionnement (chimique et/ou isotopique) agissant au niveau de la conversion entre NOx et nitrate atmosphérique (voir page 125). Les premières mesures du δ15N dans les nitrates atmosphériques des régions polaires ont été présentées par Freyer et al. Cette question trouve une réponse plus loin dans cet article concernant l'interprétation des mesures du cycle annuel du δ15N à Alert (voir page 173).
Cela permettra d'affiner le profil théorique de l'impact de la photolyse (France et al., 2007) sur la composition isotopique des nitrates restant dans le manteau neigeux. Le rendement quantique de cette réaction est de l'ordre de 0,01 (c'est-à-dire que la réaction conduit à une rupture de liaison dans 1% des cas d'absorption de photons UV, Grannas et al., 2007). Ce raisonnement simpliste explique pourquoi les fractionnements isotopiques en termes de δ15N et δ18O ont des significations opposées dans le cas de la destruction photochimique des nitrates dans le manteau neigeux.
Au-dessus de la courbe principale se trouve le cycle annuel des concentrations atmosphériques de nitrates dans le DDU (Savarino et al., 2007). La figure 4.10 montre cette évolution en fonction de la distance aux côtes Antarctiques et de l'altitude du lieu d'échantillonnage, ainsi que l'évolution des concentrations en nitrates. Le cycle annuel des concentrations atmosphériques en nitrates dans le DDU (Savarino et al., 2007) et dans le Dôme C est rappelé au-dessus de la courbe principale.
La différence entre ces deux comportements est riche d’informations en termes de dynamique de perte de nitrates dans le manteau neigeux et de son impact atmosphérique. En effet, comme le montre la figure 4.12, la composition isotopique du nitrate atmosphérique libéré dans la neige par un processus de perte de nitrate dépend de la vitesse d'avancement de la réaction de perte ainsi que du devenir du nitrate atmosphérique. Par ailleurs, il est à noter qu'au Dôme C la composition isotopique du nitrate atmosphérique et de la couche superficielle de la couverture neigeuse (avec la plus forte concentration) sont presque similaires, de l'ordre de 0 à 10 heures au mois de janvier (mesures du Dôme C C) en 2007 et Blunier et al., 2005).
Le mélange de la source stratosphérique et l'activation du mécanisme de réémission contrôlent la pente de désintégration du δ15N dans le nitrate atmosphérique. De plus, nous présentons des preuves de la nature photochimique du mécanisme de perte de nitrate dans le manteau neigeux à la section 4.4, indiquant que la constante de fractionnement déterminée empiriquement par Blunier et al. Le tableau 4.1 montre donc les quantités de nitrate dans les réservoirs après l'évolution de la perte de nitrate dans le manteau neigeux.
Ces conclusions diffèrent quelque peu de celles de Savarino et al. 2007), qui attribue la majeure partie de la source de nitrate atmosphérique au plateau antarctique lors du pic de concentration observé sur les sites côtiers. Ce cycle a la même amplitude que celui dérivé des observations de Hastings et al. Un autre processus fortement dépendant de la température est la volatilisation du nitrate d'ammonium (NH4NO3), comme le montrent Stelson et Seinfeld (1982) et Bai et al.