Je tiens à remercier Stéphane Lourdel et Marc Paulais pour leur attention, leur gentillesse et les précieux conseils qu'ils m'ont prodigués durant ces trois années. Enfin, je remercie ma famille et mes amis qui ont été là et m'ont soutenu tout au long de ces trois années.
Les canaux et transporteurs de la famille des CLC
Famille des CLC
C'est le cas du canal CLC-2, qui nécessite GlialCAM, des canaux CLC-K, qui nécessitent du barttin, et de l'échangeur CLC-7, qui nécessite ostm1 (Jeworutzki et al. Les 9 CLC décrits dans Man, avec en vert le canal de l'organe électrique du faisceau torpille, et en bleu les CLC de différents organismes : Caenorhabditis elegans (Ce), Saccharomyces cerevisiae (sc), Arabidopsis thaliana (At) et Escherichia coli (ec) (d'après Teulon et al. 2002 ).
Structure et propriétés biophysiques
En particulier, la mutation du glutamate 763 de CLC-0 abolit le déclenchement général du gate sans interférer avec le déclenchement des protopores ( Estévez et al. 2004 ). De plus, CLC-0 et CLC-1 voient leur activité augmenter lorsque le pH externe devient acide (Rychkov et al. 1996).

Fonctions physiologiques des CLC et leur implication pathologique
Il a récemment été démontré que CLC-2 interagit avec la sous-unité protéique GlialCAM (Jeworutzki et al. 2012). Les courants CLC-4 se dirigent fortement vers l'extérieur et sont similaires aux courants CLC-5 (Friedrich et al. 1999).
Vues actuelles sur les propriétés et fonctions du canal chlorure CLC-KB
Clonage du CLC-KB et de la barttine
La co-expression du barttin avec CLC-5 ou ROMK n'a aucun effet sur les courants de type sauvage, le barttin semble donc spécifique du CLC-K (Waldegger et al. 2002). Il a été récemment suggéré que la barttine se lie aux hélices B et J de chaque monomère CLC-K (Tajima et al. 2007), ce qui est cohérent avec la cristallographie des CLC bactériennes et eucaryotes car ces hélices, situées en périphérie des monomères, sont accessibles aux bartine.
Propriétés du CLC-KB
La coexpression de la barttine avec CLC-KB augmente significativement son ciblage sur la membrane plasmique (Scholl et al. Plusieurs bloqueurs classiques des canaux chlorure ont été testés sur CLC-KA et CLC-KB (9-AC, CPP, DPC, NFA, NPPB). , DIDS et SITS) (Liantonio et al. 2004).

Localisations et fonctions du CLC-KB
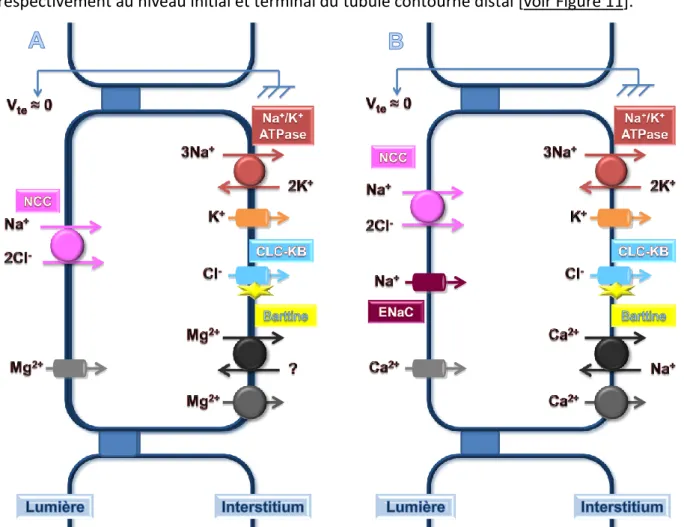
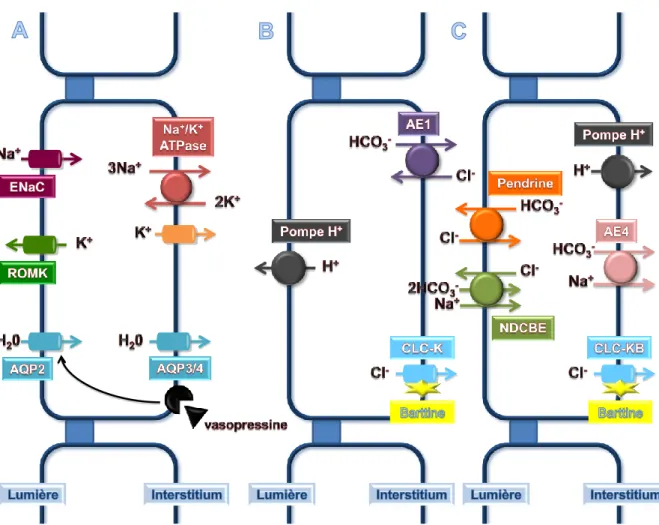
CLC-KB et barttin sont exprimés, dans le rein, au niveau de la membrane basolatérale de la large branche ascendante de l'anse de Henle, du tubule contourné distal et des cellules intercalées du canal collecteur (Estévez et al. L'expression barttin se retrouve dans ces ) les mêmes cellules (Birkenhäger et al.

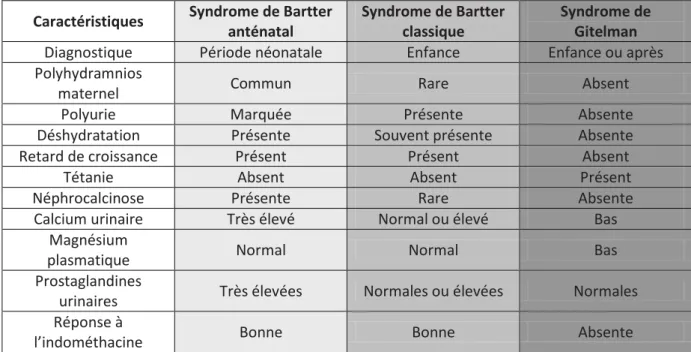
Le syndrome de Bartter
- Phénotypes et traitements
- Données génétiques
- Apports des modèles animaux
- Physiopathologie du syndrome de Bartter de type III
Le syndrome de Bartter classique est généralement provoqué par des mutations dans le gène CLCNKB codant pour le canal chlorure CLC-KB (syndrome de Bartter de type III) (Simon et al. 1997) [voir Figure 14A]. Un autre cas extrêmement rare de syndrome de Bartter classique avec insuffisance rénale chronique a été enregistré (Lin et al. 2009).
Objectifs du travail de thèse
Biologie moléculaire
- ADNc et vecteurs d’expression
- Mutagenèse dirigée
- Transformation des bactéries compétentes
- Purification des plasmides
- Transcription in-vitro
Cette technique consiste à produire un brin d'ADN plasmidique muté à l'aide d'un oligonucléotide synthétique, complémentaire de l'un des deux brins du plasmide, contenant la mutation souhaitée. L'oligonucléotide va s'hybrider puis être prolongé avec une très haute fidélité par l'ADN polymérase PfuTurbo. Le produit PCR résultant est ensuite digéré par l'enzyme de restriction DpnI qui reconnaît spécifiquement l'ADN méthylé et hémi-méthylé ; l'ADN parental qui ne porte pas la mutation est donc digéré.
Tout d’abord, la sélection est effectuée pendant la nuit à 37 °C sur un milieu gélose LB solide contenant de l’ampicilline (50 µg/mL) ou de la kanamycine (25 µg/mL). Les clones d'intérêt sont ensuite repiqués dans du milieu LB liquide en présence de l'antibiotique de sélection et cultivés à 37°C pendant 12 à 16 heures sous agitation. Le principe de cette technique repose sur la lyse alcaline des bactéries, suivie d'une purification de l'ADN plasmidique sur colonne de silice, complétée par une élution des plasmides.
Méthodes liées à l’expression hétérologue au sein d’ovocytes de Xenopus laevis
Injection
Voltage-clamp en double microélectrodes
Une microélectrode mesure le potentiel de membrane (V), tandis qu'une autre connectée au système électronique collecte le courant total généré (I), enfin l'électrode de référence ferme le circuit utilisé pour l'ovocyte de Xenopus. Les microélectrodes ont été préparées à partir de tubes capillaires en borosilicate (Harvard Apparatus, Edenbridge, Kent, Royaume-Uni), tirées avec une micropipette Puller horizontale modèle P97 (Sutter Instrument Company, Novato, Californie, États-Unis) et remplies de solution conductrice 3M KCl. Les microélectrodes sont connectées à un amplificateur TEC-10CX (npi electronic GmbH, Tamm, Allemagne) via des fils de chlorure d'argent.
La chambre de perfusion est posée sur une table anti-vibratoire sur laquelle est posée une cage de Faraday. La table anti-vibration amortit les vibrations mécaniques qui pourraient perturber l'enregistrement et/ou casser les microélectrodes sur l'ovocyte. La cage de Faraday isole électriquement l'appareil de toute interférence provoquée par les appareils électriques environnants nécessaires à l'enregistrement et placés à l'extérieur de la cage.

Luminescence
Méthodes liées à l’expression hétérologue au sein des lignées rénales HEK293 et
Culture et transfection
Enregistrements en cellule entière (HEK293)
WT ClC-Kb currents at pH 6.0 (Figure 2a, open squares) were indistinguishable from those observed in non-injected oocytes (data not shown). The contribution of the Ca 2+ -independent fraction of ClC-Kb conductance was similar between WT and mutants (see Table 2 ). In contrast, we only observed such a possible mutation in the case of ClC-Kb (G246R in α-helix I).
Paramètres de sensibilité au pH externe et au calcium des canaux ClC-Kb sauvages et mutants. Cela signifie peut-être que Val 170 est plus important que Val 166 dans le déclenchement du canal ClC-Kb. En revanche, toutes les mutations CLC-κB que nous avons analysées par luminescence modifient l'expression au niveau de la membrane plasmique.

Immunofluorecence (MDCK)
Statistiques
Première publication: CLCNKB mutations causing Bartter-Gitelman syndrome affect
Résumé
Nous avons ensuite tenté de déterminer l’expression de canaux mutés dans la membrane plasmique des ovocytes de Xenopus. En utilisant la technique de luminescence, nous avons démontré que trois mutants présentant un courant résiduel présentent une diminution de leur expression au niveau de la membrane plasmique proportionnellement à une diminution de leur conductance. De même, les quatre mutants non actuels ne sont pas exprimés au niveau de la membrane plasmique.
En conclusion, cette étude des mutations pathogènes CLC-KB suggère qu'une altération de l'expression au niveau de la membrane plasmique semble être le défaut fonctionnel majeur provoqué par ces mutations. Cette observation contraste avec les études fonctionnelles des mutations CLC-1 et CLC-5 (Pusch et al. Une stratégie de réparation de ces canaux mutés pourrait être l'utilisation de chaperons voire d'activateurs CLC-KB, même si ce n'est jusqu'à présent que un activateur CLC-KA a été décrit (Liantonio et al.
Article
Stimulation by external Ca2+ and inhibition by external H+, two characteristic properties of the ClC-Kb channel, were not altered in the three mutants showing residual activity. It appears that Barttin is required to target ClC-Kb and ClC-Ka to the plasma membrane ( 11 – 14 ), a function that is altered in diseases caused by BSND mutations, at least in some cases ( 12 , 15 ). The same studies also measured the currents generated by some pathogenic mutants of ClC-Kb (5, 6, 8) in the oocyte expression system.
These mutations have the same functional consequences when ClC-Kb mutants are expressed in HEK293 cells. All mutations altered the expression of ClC-Kb at the plasma membrane, albeit to variable extents. For cell surface expression, values (measured in RLU, Relative Light Units) were normalized to those of WT ClC-Kb in the same batch of oocytes.

Seconde publication: Reduced surface expression and blunted pH-dependent gating
Résumé
Le remplacement de la méthionine par la valine 170 ne supprime donc pas la sensibilité au calcium externe, mais modifie plutôt la sensibilité au pH externe. La substitution de la valine 170 à la sérine ou à l'isoleucine présente un profil intermédiaire par rapport à la substitution de la méthionine. Cela démontre l’impact clé du remplacement de la valine 170 par la méthionine sur la sensibilité externe au pH du CLC-KB.
La Valine 170 étant très proche de la valine 166, qui dans tous les autres CLC correspond à la « porte glutamate » responsable de la porte des protopores, il a semblé nécessaire d'étudier les conséquences fonctionnelles de la substitution de la valine 166 à la méthionine et à l'alanine. Nous avons constaté que ces mutations n'entraînent pas les conséquences fonctionnelles spectaculaires que nous avons observées en substituant la valine 170 à la méthionine. Les courants véhiculés par la combinaison des deux mutations ne diffèrent pas significativement des courants véhiculés par la mutation V170M dont la quantité d'ARN est réduite de moitié.
Article
ClC-Kb is a member of the ClC family of Cl- channels/transporters and is involved in NaCl absorption in the distal renal nephron. When investigating the surface expression of WT and mutant ClC-Kb in the oocyte expression system with ClC-Kb–FLAG (see methods), we observed that V170M membrane expression was 50% lower than WT ( Fig. 1C ). As expected, the signal for V170M ClC Kb/G433E ClC-Kb FLAG (5 ng cRNA/oocyte each) was indistinguishable from the luminescence signal obtained with G433E ClC-Kb FLAG alone (10 ng cRNA/oocyte).
ClC-Kb and the closely related ClC-Ka belong to the same ClC family of Cl- channels and transporters. Cell surface expression (measured in RLU, Relative Light Units) was expressed relative to the value obtained for WT ClC-Kb in the same batch of oocytes. Voltage-clamp traces of WT and V170M ClC-Kb measured at different pH values as indicated, 3 mM [Ca2+]e.
Voltage-clamp traces of V170I and V170S ClC-Kb measured at different pH as indicated in the presence of 3mM [Ca2+]e. The figure shows the molecular context of V170 in the selectivity filter of a homology model of CLC-Kb.

Résultats complémentaires
La réduction de l'expression membranaire de CLC-KB est la principale conséquence des mutations du gène CLCNKB. Nos études démontrent qu'un changement d'expression au niveau de la membrane plasmique constitue le défaut fonctionnel majeur provoqué par des mutations pathogènes de CLC-κB. En effet, les mutations pathogènes de CLC-1 qui induisent la myotonie altèrent la conductance et le déclenchement des canaux plus souvent que l'expression au niveau de la membrane plasmique (Pusch et al.
Dans le cas de CLC-5, 20 % des mutations semblent modifier non pas le ciblage, mais plutôt la modification (Lourdel et al. 2012). Cependant, nous n’avons observé qu’un seul cas similaire pour les mutations CLC-KB. De plus, l'expression hétérologue de CLC-KB est difficile par rapport à l'expression de CLC-KA (Gradogna et al. 2010 ; données non publiées).
Une possibilité de tester cette hypothèse résiderait dans le remplacement simultané de la valine 166 dans le glutamate de CLC-KB (qui remplacerait un des sites inhibiteurs dans un site activateur) et de l'histidine 497 proposé par l'équipe de Pusch (Gradogna et al. 2010). . . ClC-6 et ClC-7 sont deux nouveaux membres largement exprimés de la famille des canaux chlorure CLC.