PEBP/RKIP, UNE PROTEINE SUPPRESSEUR DE METASTASES
Localisation et caractéristiques physico-chimiques
- Localisation
- Caractéristiques physico-chimiques
Dans le cerveau, rPEBP1 est présent dans les oligodendrocytes, les cellules de Schwann, les cellules de Purkinje du cervelet, ainsi que dans les six couches cellulaires spécifiques du cortex et de l'hippocampe (12). Son point pH isoélectrique théorique est de 7,6, mais le calcul ne prend pas en compte la répartition des charges à la surface de la molécule.
Structure
- Structure primaire
- Famille PEBP
- PEBP/RKIP humaine
- Structure secondaire
- Structure tertiaire
- hPEBP1
- Comparaison avec d’autres PEBPs
- Alignements de structure
Un feuillet ȕ composé de 6 brins (ȕC, ȕJ, ȕI, ȕF, ȕG et ȕH) constitue la structure centrale de la protéine. Les deux régions hautement conservées de la famille PEBP sont intimement impliquées dans la détermination de la structure locale de ce site.

Ses fonctions
- Inhibition de protéases
- Inhibition de kinases
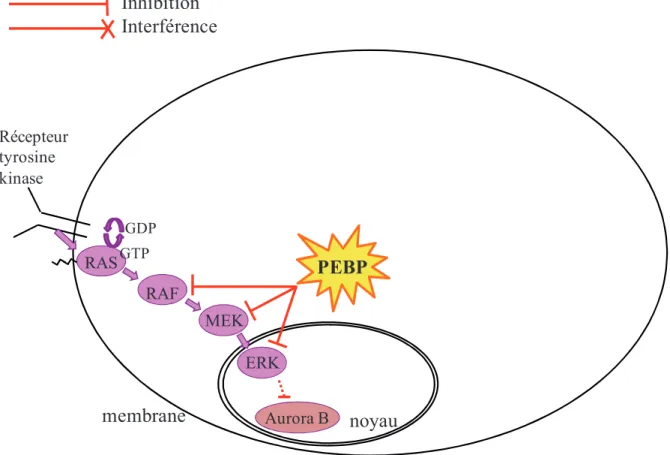
- Inhibition de la voie des MAP kinases Raf/MEK/ERK
- Inhibition de la voie NF-țB
- Inhibition de la voie des récepteurs couplés aux protéines G
- Régulation de l’activité de PEBP1 par phosphorylation
- Au niveau de l’organisme
- Suppresseur de métastases
- Rôle dans la maladie d'Alzheimer
- Rôle dans l’apoptose et la sensibilité aux chimiothérapies
- Autres fonctions
La modulation du niveau d'expression de PEBP1 affecte la voie NF-B indépendamment de la voie Raf/MEK/ERK. L'exposition de cellules humaines cancéreuses du sein et de la prostate à des agents chimiothérapeutiques induit l'expression et l'apoptose de PEBP1 (47).
Interactions PEBP1 – ligand
- Interaction covalente avec la locostatine
- La locostatine
- Protéine cible : PEBP1
- Mécanisme de liaison
- Interaction non-covalente avec des nucléotides
- Structure des nucléotides
- Interactions avec PEBP1
- Analogues de nucléotides dans les traitements contre le cancer
- Interactions protéine-protéine
- Interactions avec des lipides membranaires ou des molécules hydrophobes
- Interaction avec des molécules tampon
- Autres interactions
- Avec un inhibiteur de phosphodiestérase-5 (PDE5)
- Avec des dérivés morphiniques
- Avec des composés portant un groupement 4-nitrophényl
- Structure connue d’interaction avec des ligands : la poche à anion
- Description de la poche
- Rôles physiologiques de la poche chez les plantes et la levure
- Plasticité conformationnelle et rôles possibles
Etude cinétique : Cas de la formation de l'hétérodimère Įȕ de la protéine HU Įȕ de la protéine HU. L'effet de l'augmentation de la force ionique a donc été testé sur l'agrégation du GTP sur hPEBP1 (Figure 79).

L A SPECTROMETRIE DE MASSE SUPRAMOLECULAIRE
Les interactions non-covalentes impliquées dans les complexes supramoléculaires
- Interactions ioniques
- Forces de Van Der Waals
- Forces de Keesom
- Forces de Debye
- Forces de London
- Cas particulier des forces de van der Waals dans les protéines
- Liaisons hydrogènes
- Interactions résultant de l’effet hydrophobe
Sous le nom de forces de Van der Waals, nous incluons trois types d'interactions moléculaires [d, e]. Les forces de Debye sont des forces intermoléculaires résultant de l'interaction entre un dipôle permanent et un dipôle induit.

Etude d’interactions non-covalentes par spectrométrie de masse
- Historique
- Spectromètre de masse à ionisation électrospray
- Schéma général d'un spectromètre de masse
- Principe de l’ionisation électrospray
- L'interface
- Principe de l’analyse des ions
- Compatibilité des tampons avec l’ESI
- Mécanisme de réduction des adduits de sodium sur la protéine avec un tampon acétate
- Mécanisme de charge de la protéine en phase gazeuse avec un tampon ammonium, à pH
- Informations déduites du spectre de masse
- Conformation de la protéine
- Spécificité de l’interaction observée
- Stœchiométrie apparente du complexe
- Constantes cinétiques du complexe
- Reflet de l’équilibre en solution lors de l’analyse en phase gazeuse
- Conservation de l’équilibre chimique en phase gazeuse
- La conservation des interactions non-covalentes dépend du type d’interactions
Ͳ l'interface, qui complète la désolvatation et permet le transfert des ions de la pression atmosphérique vers le vide. La seconde est la tension accélératrice, qui contrôle l’énergie cinétique transférée aux ions de la source. Les adduits de sodium résultent de la formation en solution de paires d'ions entre les résidus acides de la protéine et du sodium.
Étant donné que les résidus basiques ou les groupes amide en phase gazeuse à la surface des protéines sont plus élevés que pour l'ammoniac, les protéines sont facilement protonées avec des tampons d'ammonium (136). Les modifications de la longueur de la chaîne carbonée de l'acyle, qui affectaient fortement la liaison en solution, ne semblent plus affecter la stabilité du complexe en phase gazeuse.

Cas particulier d’interactions non-covalentes: les systèmes à faible affinité
- Limites de l’étude par spectrométrie de masse de systèmes à faible affinité
- Problème de l’agrégation en phase gazeuse
- Problème de dissociation en phase gazeuse (GPD)
- Superposition des deux problèmes
- Stratégies développées pour pallier les limites des systèmes à faible affinité
- Stratégies pour s’affranchir de l’agrégation en phase gazeuse
- Stratégies pour s’affranchir de la dissociation en phase gazeuse
À l’inverse, le complexe hPEBP1-GTP est beaucoup moins sensible à l’ajustement de la tension d’accélération. Plus la stabilité est faible, plus la tension de plafond de sortie est réduite. La dissociation du dimère est minime lorsque la tension de plafond de sortie est d'environ 200 V (Figure 52).
L'étude cinétique à 27°C a mis en évidence un comportement distinct, la formation d'hétérodimères ayant un comportement biphasique. L'augmentation de la force ionique peut éventuellement réduire la stabilité des complexes non spécifiques et ainsi les éliminer de l'échantillon gazeux.

P RESENTATION DU TRAVAIL DE THESE
Contexte : projet METASUPP
- Objectifs du projet
- Organisation
Au début de ce projet, il n'existait aucune information sur les sites de liaison de la locostatine et des nucléotides sur hPEBP1. Par conséquent, le projet prévoyait également de caractériser les sites de liaison de la locostatine et des nucléotides et de déterminer s'ils sont intriqués. Par conséquent, la conception rationnelle de molécules activatrices de hPEBP1 a été initiée en se basant d’une part sur la locostatine et d’autre part sur les structures nucléotidiques.
Le projet METASUPP est financé par l'Agence Nationale de la Recherche (ANR), le Cancééropole Grand Ouest et la Ligue contre le Cancer. Pour caractériser les sites de liaison aux protéines, des synthèses et des criblages pour les deux types de ligands (analogues de nucléotides et de locostatine) sont effectués indépendamment.

Objectifs du travail de thèse
- Approfondir la relation structure-fonction de PEBP1 humaine
- Fournir des éléments pour la synthèse raisonnée d’activateurs des propriétés antimétastatiques
- Développer une méthode de suivi MS des complexes reflétant le comportement en solution
- Retombées potentielles
Apporter des éléments pour la synthèse raisonnée d'activateurs des propriétés antimétastatiques naturelles de hPEBP1. propriétés antimétastatiques naturelles de hPEBP1. Dans le cadre du projet Métasupp, la synthèse raisonnée d'analogues nucléotidiques activant les propriétés antimétastatiques naturelles de la hPEBP1 nécessite de cribler les ligands par MS pour leur affinité pour la PEBP1 humaine et de corréler les résultats de la MS avec les résultats du criblage cellulaire. Développer une méthode de surveillance MS pour les complexes qui reflète le comportement en solution.
Pour limiter la consommation d’échantillons, la perfusion a été miniaturisée en réduisant au maximum le débit de perfusion et en développant une méthode originale de « perfusion sandwich ». Il est montré que le choix du solvant utilisé pour assembler le sandwich est crucial pour maintenir la conformation native de hPEBP1 et de ses complexes non covalents.
Mise au point d’une méthode d’injection directe « en sandwich »
- Choix du type d’infusion directe
- Débit d’infusion
- Méthode d’infusion directe ESI originale
- Effet du solvant du sandwich
- Sur hPEBP1/RKIP seule
- Sur le complexe hPEBP1 - BLA-C-04
La tension de l'aiguille a été réglée à -4 000 V et l'effet du débit de perfusion ESI sur l'intensité du signal de myoglobine a été étudié (Figure 44). Selon la figure 45, à un débit de perfusion de 1,3 µL par minute, les intensités des pics de PEBP 9+ et 10+ sont maximales lorsque la tension appliquée à l'aiguille est de -3 400 V. L'utilisation d'un solvant de sandwich non dénaturant permet donc de préserver la conformation native du PEBP.
Deux spectres ESI-IT de PEBP, enregistrés dans différentes plages m/z, ont été fusionnés. a) PEBP non dénaturé avec un sandwich dénaturant, b) PEBP dénaturé avec . un sandwich dénaturant, c) du PEBP non dénaturant avec un sandwich non dénaturant. De plus, l'utilisation d'un solvant sandwich non dénaturant assure la préservation de la conformation native de la protéine.

Optimisation des paramètres instrumentaux
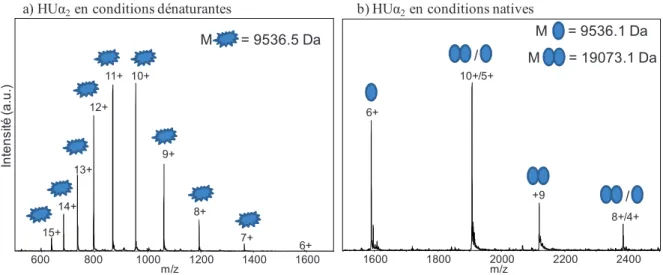
- Application à HU
- Optimisation de la tension d’accélération
- Optimisation de la température de désolvatation
- Application à hPEBP1 – GTP
Pour valider cette hypothèse, l'intensité relative du pic à 2 120 m/z par rapport à celui à 1 900 m/z a été surveillée en faisant varier la tension de sortie de la hotte avec une tension de mousseur fixe de 100 V. Lorsqu'on tente de détecter des ions autour de m/z 2250, plus on augmente le voltage de sortie de la coque, plus on augmente l'intensité du signal du complexe et de hPEBP1 (Figure 56). L'intensité du signal augmente fortement dès que la tension de plafond de sortie est supérieure à 200 V (Figure 56) et est maximale à VCE = 360 V.
Lorsque la tension de mousse est fixée à 100 V, l'intensité relative des deux composés change de manière significative avec la tension de plafond de sortie (Figure 57). L'augmentation de la tension de sortie du capuchon entraîne la dissolution du complexe, phénomène qui n'a quasiment pas été observé avec une tension de skimmer de 40 V.
Etudes qualitatives
- PR3-azapeptide
- Contexte général
- Etude du complexe
- Fpg-Zn / NEIL2-Zn
- Contexte
- Objectifs
- Optimisations pour les complexes protéine/métal
- Confirmation d’édifices non-covalents protéine-zinc
- Interaction avec la drogue 2-thioxanthine
- Bilan
Le complexe apparaît sous une forme homogène, ce qui signifie que la méthionine initiale de la protéine est clivée à 100 %. Il semble que l’ajout du médicament diminue la solubilité de la protéine et provoque son agrégation. Dans notre cas, le double brin d’ADN endommagé est de 8 501 Da, ce qui représente environ un quart de la masse de la protéine (Figure 67).
La contribution de la masse d'ADN restant minoritaire à la masse du complexe protéine-ADN, le complexe a d'abord été analysé dans les mêmes conditions que la protéine sans ADN. Ceci suggère que, en ce qui concerne le complexe Fpg-Zn, l'ajout du médicament provoque également une agrégation du complexe.

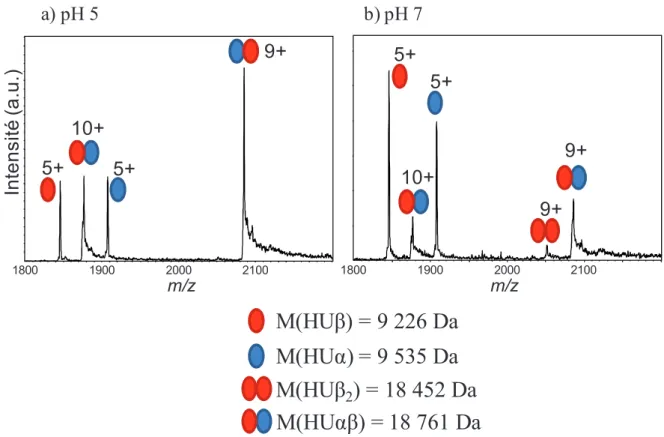
Etude cinétique : Cas de la formation de l’hétérodimère Įȕ de la protéine HU
- Contexte
- Objectif
- Résultats
- Optimisation des conditions expérimentales pour observer les dimères HU
- Formation d’hétérodimères à partir des deux homodimères
- Bilan
First, the protein-ligand complex may be susceptible to partial dissociation at the interface of the instrument. As a consequence, the picture of the equilibrium observed in the gas phase does not directly reflect the equilibrium in solution. However, this does not allow direct detection of the bound fraction at saturation.
In the "fast dissociation" case, nonlinear regression with equation (13) provides direct access to the KDin solution and to the fsat-linked to MS measurement of the system under study. However, the stability of nonspecific complexes is sensitive to the nature of the protein ions. This means that there is apparently no appreciable dissociation in the gas phase during the analysis.
The fsat constant reflects the type of interaction in the protein-ligand complex, which provides insight into the nature of the complex.
Validation du modèle
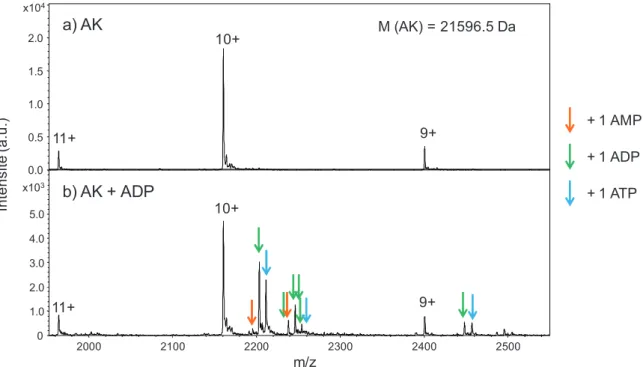
- La myokinase ou adénylate kinase (AK) en complexe avec deux molécules d’ADP
- La concanavaline A avec le méthyl-Į-D-mannopyranoside
L'ajout d'ADP pur entraîne l'apparition de plusieurs pics correspondant aux complexes AK-AMP, AK-ADP, AK-ATP, AK-AMP-ADP, AK-2ADP, AK-ADP-ATP. Contrairement aux résultats MS publiés par Jecklin (192), malgré l'analyse rapide de l'échantillon, l'AK semble avoir catalysé la formation d'ATP et d'AMP à partir de l'ADP. L'analyse de l'ADP seul donne un pic majoritaire correspondant à l'ADP protoné, et deux pics très mineurs correspondant à un adduit de sodium sur l'ADP et une molécule d'AMP protonée.
L'AMP observé correspond probablement à une dégradation chimique en solution ou à une contamination du stock d'ADP. En présence d'AK, un pic correspondant à l'ATP protoné apparaît, et l'intensité relative du pic d'AMP protoné par rapport à l'ADP protoné augmente fortement.
Effet de la force ionique sur l’agrégation
Le KD du système AK-ADP ne pouvant être déterminé en raison de cette réaction enzymatique, ce système n'a pas pu être utilisé pour valider notre modèle. Parce que la présence de manganèse a élargi les pics de concanavaline A, il n’a pas été possible de voir avec précision la liaison du méthyl-Į-D-mannopyranoside à la protéine. À mesure que la force ionique augmente, une diminution de la stœchiométrie apparente est observée, ce qui correspond au moins à une diminution de l'agrégation.
Ainsi, même si l’agrégation de biomolécules chargées est un processus purement statistique et donc indépendant de la nature des biomolécules, ce processus reste néanmoins dépendant de la force ionique. Il est possible que des complexes spécifiques soient également déstabilisés par l’augmentation de la force ionique.
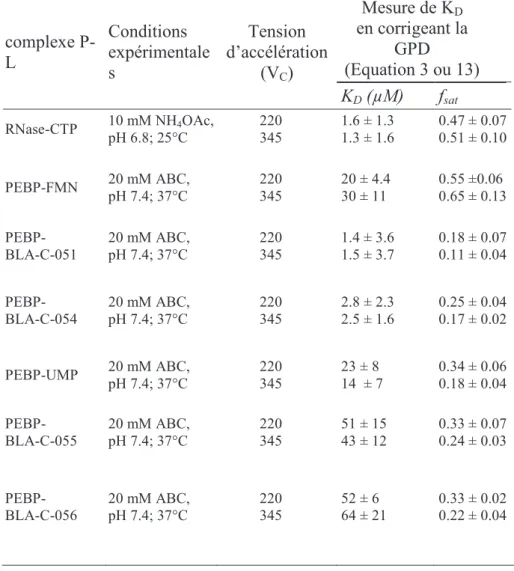
Les KD ont été déterminés pour 7 systèmes dans des conditions de dissociation, avec une tension accélératrice élevée (Vc = 345 V) ou dans des conditions de dissociation faible, avec une tension accélératrice standard (Vc = 220 V) (Tableau 5). Ces expériences permettent de tester l'influence d'un paramètre instrumental, la tension d'accélération, sur la dissociation en phase gazeuse des complexes. Les résultats montrent que les valeurs KD déterminées avec une tension d'accélération de 220 ou 345 V sont très proches.
Au contraire, le paramètre fsat varie entre les deux conditions, absorbant ainsi les variations instrumentales sans affecter la valeur KD. Il serait intéressant de savoir si la sensibilité de fsat à la tension accélératrice est en corrélation avec le type de liaison protéine-nucléotide.
Recommandation
Le dépistage rapide est effectué par mesure MS d'une fraction de liaison à hPEBP1. Le criblage d'analogues nucléotidiques et de nucléotides de référence met en évidence des critères structurels essentiels pour qu'une molécule se lie à hPEBP1 : la présence d'un groupe chargé ou de type NO2, une structure liée à une base azotée et d'un cycle. Les résultats du criblage d'affinité et leur corrélation avec le logP calculé des ligands montrent qu'une partie importante de l'affinité est associée au caractère hydrophobe du ligand.
D'après une expérience de compétition, les sites d'interaction du GTP et de la locostatine sont indépendants. Les résultats MS combinés aux résultats RMN prouvent que contrairement à la rPEBP1, la PEBP1 humaine est capable de se lier au GTP et mettent en évidence une influence de la force ionique sur l'affinité du GTP et du FMN pour hPEBP1.
Recherche de ligands nucléotidiques par criblage
- Principe de la synthèse raisonnée d’analogues nucléotidiques
- Protocole de criblage
- Criblage rapide avec les fractions de liaison
- Analogues d’UMP
- Nucléotides de référence
- Variation de la longueur de chaîne de BLA-C-04
- Deuxième série d’analogues d’UMP
- Analogues de FMN
- Analogues sans uracile
- Analogues de GTP
- Molécules du criblage de Shemon
- Détermination de K D pour les meilleurs ligands
- Analogues d'UMP
- Dérivés de FMN
- Dérivés de GTP
- Classement général des K D
- Bilan du criblage
- Relation entre l’hydrophobicité des meilleurs ligands et les paramètres de liaison
Selon des études d'homologie structurale, les chaînes à 4 carbones portant une insaturation imitent la structure du ribose du GTP, tandis que celles à 5 carbones imitent la structure du ribitol, le sucre acyclique du FMN. Pour le motif D, la longueur de la chaîne carbonée portant l'insaturation varie (entre 3 et 5 atomes de carbone). Dans le projet METASUPP, il a été défini que tous les analogues nucléotidiques devaient d'abord être criblés par MS pour leur capacité à se lier au PEBP.
Les phosphononucléosides acycliques de cette série contiennent tous la base uracile, qui se trouve dans la structure FMN. Ils comprennent une base uracile substituée en position 5 par un groupe halogène ou non benzénique et une chaîne carbonée de 3 atomes de carbone portant une insaturation et se terminant par un phosphonate.
Localisation du site de liaison nucléotidique
- Indépendance des sites de liaison de nucléotide et de la locostatine
- Parallèle avec la RMN : site nucléotidique et poche à anion confondues
- Effet de la force ionique
Comparaison des liaisons moléculaires avec les effets cellulaires
- Effet sur la migration cellulaire
- Effet sur l’invasion cellulaire
- Toxicité
- Comparaison et corrélation
- Des différents effets cellulaires
- Des résultats cellulaires et de MS
- Bilan
Activité oxydase
- Observation de l’oxydation de hPEBP1 en présence de FMN
- Hypothèse sur le mécanisme d’oxygénation
- Monooxygénase à flavine
- Oxydation par échange direct avec une molécule substrat
- Carte peptidique de l’oxydation de hPEBP1 en présence de FMN
- Spécificité de la réaction d’oxygénation en présence de FMN
- Photo-oxydation en présence de FMN
- Absence d’oxydation avec les analogues de FMN
Activité phosphodiestérase-5
- Résultats et discussion
Activité GTPase ou ATPase
Matériels
Production de hPEBP1 (100)
Protocole de dessalage
- Dessalage des nucléotides
- Dialyse des protéines
- Micro gel filtration
Conditions de digestion
Conditions d’analyse
- Conditions ESI natives
- Conditions ESI dénaturantes
Paramètres instrumentaux
- ESI-IT
- MALDI-TOF
- ESI-UHR-Qq-TOF (maXis)


![Figure 11 : Principales étapes de la formation des métastases (A. Bellahcène, V. Castronovo (Université de Liège)) [c]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465568.70712/37.892.114.786.182.733/figure-principales-étapes-formation-métastases-bellahcène-castronovo-université.webp)



