Ce choix implique souvent la synthèse de nouveaux ligands ou la modification de ligands déjà existants, afin d'adapter leurs propriétés électroniques et stériques aux besoins de la réaction (« ligand tuning ». 9 Dans un premier temps, nous avons réalisé la synthèse de nouveaux phosphores chiraux ligands par atropoisomérie bident et monodent, analogues des diphosphines SYNPHOS® et DIFLUORPHOS®, synthétisées et brevetées par notre laboratoire et la société SYNKEM en 2001 (Schéma 12).
L’atropoisomérie
L'encombrement stérique des substituants dans cette liaison est tel que le taux d'interconversion est suffisamment faible pour permettre la séparation des deux énantiomères.31 Ce type d'énantiomérie se retrouve généralement dans les systèmes biphényle (ou plus généralement biaryle). dont la libre rotation autour de la liaison sp2-sp2 est entravée. Le sens de rotation observé permet alors de déterminer la configuration absolue de la molécule à l'aide des stéréodescripteurs R et S.
Les différentes familles de diphosphines chirales par atropoisomérie Les deux premiers exemples de diphosphines chirales par atropoisomérie sont les
Les différentes familles de diphosphines chirales par atropisomérie Les deux premiers exemples de diphosphines chirales par atropisomérie sont.
Diphosphines à motif binaphtyle
En particulier, les analogues p-Tol-BINAP et DM-BINAP (Xyl-BINAP) ont permis d'obtenir d'excellentes sélectivités dans l'hydrogénation asymétrique des liaisons C=O catalysée par des complexes de ruthénium. De même, ces ligands ont été utilisés pour l'hydrogénation asymétrique de β-cétoesters et de β-(acylamino)acrylates catalysée par des complexes de ruthénium, et les résultats obtenus sont excellents (Schéma 35).85.
Diphosphines à motif biphényle
De ce fait, l'excès énantiomérique obtenu en hydrogénation asymétrique des α-déhydroaminoacides et des énamides, catalysée par les complexes du rhodium, est supérieur à 90 % et dépasse ainsi de 20 à 40 % celui obtenu avec NAPHOS ou BINAPO. Les propriétés catalytiques de HexaPHEMP ont été évaluées dans l'hydrogénation asymétrique de β-déhydroaminoesters, d'imines et de cétones aromatiques catalysées par des complexes de ruthénium.
Diphosphines dépourvues de symétrie C 2
- Méthodes de synthèse des diphosphines chirales par atropoisomérie Il existe deux stratégies principales de rétrosynthèse des diphosphines chirales par
Ces diphosphines asymétriques ont été testées dans des réactions d'hydrogénation asymétriques de cétones et d'oléfines fonctionnalisées catalysées par le ruthénium, ainsi que dans l'addition 1,4 d'acides arylboroniques à des énones catalysées par des complexes de rhodium.152. La deuxième stratégie, décrite dans le schéma 62, permet la synthèse d'un motif monoaryle phosphorylé, correctement fonctionnalisé pour permettre une réaction de couplage carbone-carbone conduisant au biaryle bisphosphorylé (voie B).
Méthodes de couplage aryle-aryle
Des méthodes alternatives de réaction d'Ullmann pour la formation de liaisons aryle-aryle ont été appliquées à la synthèse de diphosphines atropoisomères. Une voie de synthèse originale a également été développée par Sannicolò en 2001 pour la synthèse d'une diphosphine mixte hétéroaryl-phényle (Schéma 74).
Méthodes de dédoublement
Par exemple, l’équipe Shan201 a développé une procédure de résolution du binaphthol qui repose sur la formation de borates cycliques chiraux. L'équipe Delogu202 a développé une méthode pour cliver les biphénols dérivés du 2,2'-dihydroxy-6,6'-diméthoxy-1,1'-biphényle, basée sur la formation de phosphorothioamidates diastéréomères203, comme le montre la figure 85. Comme le montre la figure 85. sur la figure 88, l'équipe Hua207 a utilisé le chlorure d'acylcamphane comme solvant pour le 8,8'-dihydroxy-1,1'-binaphtyle.
Modifications des substituants du phosphore
Les deux exemples de cette nouvelle famille de diphosphines sont présentés dans le schéma 97 de la série BIPHEMP et SEGPHOS.218. La méthode de phosphorylation de BINOL développée par l'équipe de Cai en 1994185a pour le procédé Merck de synthèse de BINAP a été utilisée par la société Takasago pour la synthèse de divers analogues de BINAP219 comme le montre le schéma 99. Cette méthode de couplage catalysée par le carbone-phosphore a été largement palladium catalysé récemment dans la série biphényle pour la synthèse d'analogues Cl-MeO-BIPHEP comme le montre le schéma 101 222. Les auteurs ont également choisi d'utiliser un intermédiaire biphénol énantiopur, qui est converti en bis (triflate) par une méthode classique.
Présentation des objectifs
Enfin, chaque énantiomère de l'oxyde de phosphine est réduit avec du trichlorosilane dans du xylène à 140°C en présence de tributylamine avec un rendement de 90 % pour donner les diphosphines énantiomériquement pures (R) et (S)-SYNPHOS® (ee >. Cette méthode). nécessite la synthèse du dérivé iodé 4, qui est obtenu à partir de l'oxyde de phosphine 2 par une séquence d'ortholithiation/iodation réalisée à -78°C en présence de diisopropylamide de lithium (LDA) dans des réacteurs de 800 litres avec un rendement de 85%. Le squelette est synthétisé comme précédemment par couplage d'Ullmann via le dérivé iodo 7 pour donner le bis (oxyde de phosphine) (rac) -8, qui est ensuite clivé par l'acide dibenzoyltartrique ou par HPLC préparative chirale.
Synthèse d’analogues du ligand SYNPHOS
Schéma rétrosynthétique et choix des cibles
On remarque que la présence de groupements phényle 3,5-disubstitués sur les atomes de phosphore de la diphosphine augmente significativement l'excès énantiomérique obtenu pour l'essentiel du diastéréomère cis (ee = 87–97% avec les ligands b à e au lieu de 66% avec (S)-MeO-BIPHEP). D'une manière générale, il a été observé que les diphosphines comportant des groupements 3,5-diméthyl-phényl (méta-xylyle) sur des atomes de phosphore permettaient d'obtenir des catalyseurs de type RuCl2 (1,2-diamine)(Xyl-). diphosphine) extrêmement sélective dans l'hydrogénation asymétrique des cétones prochirales non fonctionnalisées, tolérant une très grande diversité de substrats. Ce ligand a récemment prouvé son efficacité dans une réaction asymétrique de Pauson-Khand catalysée par des complexes de cobalt.234 La présence du groupe para-tolyle sur les atomes de phosphore permet d'augmenter très significativement les excès énantiomériques pour les quatre substrats testés dans cette réaction (Schéma 116).
Synthèse d’un intermédiaire commun énantiopur de type bis(phosphonate) 1. Synthèse des arylphosphonates
Après distillation sous pression réduite du chlorure de thionyle et du diméthylformamide, le composé (S)-16 est obtenu sous forme d'un solide jaune, utilisable directement dans l'étape d'arylation. Le bis (oxyde de phosphine) (R) -17b est obtenu avec un rendement de 44 % en utilisant du 4-méthyl-phényllithium comme agent d'arylation. Ce rendement est comparable au rendement de l'étape d'arylation dans la synthèse du m-Xyl-SYNPHOS 18a (50% dans les deux étapes de chloration et d'arylation), ce qui tend à prouver que l'étape limitante dans cette séquence réactionnelle est bien l'étape d'arylation. .
Conclusion et perspectives
- Synthèse de nouveaux biphénols fluorés chiraux par atropoisomérie : valorisation du motif bi(tétrafluorobenzodioxane)
Synthèse de nouveaux biphénols fluorés chiraux par atropoisomérie : valorisation du motif bi(tétrafluorobenzodioxane) Valorisation du motif bi(tétrafluorobenzodioxane). Par exemple, le 5,5'-dichloro-6,6'-diméthoxy-biphényl-2,2'-diol énantiopur a été utilisé par la société Bayer comme intermédiaire clé dans la synthèse des bis(phosphines), telles que Cl- MeO-BIPHEP et ses analogues, mais aussi toute une série de phosphites (Schéma 138).240. Afin de valoriser le squelette bi(tétrafluorobenzodioxane), qui à ce jour n'a jamais été utilisé pour la synthèse de ligands chiraux du phosphore, nous avons envisagé la synthèse de deux nouveaux biphénols énantiopurs 20 et 21 basés sur ce motif atropoisomère (Schéma 139).
Synthèse de biphénols énantiopurs à motif bi(tétrafluorobenzodioxane) 1. Schéma rétrosynthétique
Le biphénol 20 a donc été obtenu à partir du 2,2,3,3-tétrafluoro-6-hydroxybenzodioxane 22 en trois étapes (protection, couplage, déprotection) avec un rendement global de 51 %. Ces rendements sont trop faibles pour envisager la coupure du biphénol 20 par cette méthode. Le biphénol 20 et 0,5 équivalent de chlorure de N-benzylcinchonidinium sont agités sous reflux d'acétonitrile pendant 4 heures comme indiqué sur le schéma 151.
RMN 1 H
- Application à la synthèse de nouveaux phosphoramidites chiraux 1. Rappels bibliographiques
- Conclusion et perspectives
Le ligand phosphoramidite (+)-30 est obtenu avec un rendement modeste de 32%, après 18 heures d'agitation dans du toluène à 100°C, en présence d'une quantité catalytique de chlorure d'ammonium. Nous avons testé différents états de couplage Suzuki de l'acide phénylboronique sur le dérivé dibromé 21 . Les résultats obtenus avec le ligand (R)-MonoPhos correspondent à ceux décrits dans la littérature.255 Le produit d'hydrogénation est obtenu avec une conversion totale en moins d'une heure de réaction (tof = 227 h-1) avec ' un excès énantiomérique de 96% (entrée 1).
Rappels bibliographiques
Synthèse des catalyseurs chiraux ruthénium-diphosphine
En particulier, le complexe Ikariya a été utilisé pour la préparation du premier catalyseur mononucléaire Ru((R)-BINAP)(η3-OAc)2, synthétisé par Noyori en 1986 (Schéma 182).297 Une étude par diffraction des rayons X de ce Le complexe a révélé une structure mononucléaire hexacoordonnée pseudo-octaédrique.298. En 1991, l'équipe de Heiser a développé une synthèse générale de diacétates de ruthénium Ru(P*P)(η3-OCOR)2 (R = CF3, CH3) en utilisant le précurseur achiral Ru(cod)(η3-méthylallyl)2 (Schéma 185). 302 L'échange direct du cyclooctadiène par les diphosphines atropoisomères (BINAP, BIPHEMP, MeO-BIPHEP) est assez difficile et la réaction nécessite le passage par un intermédiaire Ru(cod)(η3-OCOCF3)2. En 1994, une synthèse simplifiée des dihalogénures de ruthénium Ru(P*P)X2 a été développée en laboratoire.308 Ceci est réalisé en une seule étape à partir du complexe Ru(cod)(η3-méthylallyl)2 dans des conditions douces.
Applications des catalyseurs in situ Ru(P*P)X 2 en hydrogénation asymétrique Les catalyseurs de type Ru(P*P)Br 2 obtenus par la méthode de synthèse in situ
- Influence des propriétés stériques et électroniques des diphosphines atropoisomères en hydrogénation asymétrique
En revanche, dans le cas de l'hydrogénation asymétrique de cétones fonctionnalisées telles que les β-cétoesters, les intermédiaires précis et les mécanismes impliqués dans le cycle catalytique n'ont été identifiés que très récemment. Un cycle catalytique proposé par Noyori pour l'hydrogénation asymétrique de β-cétoesters catalysée par des complexes chiraux de ruthénium Ru (P * P) X2 est présenté dans le schéma 191.4a,289. Ces revues bibliographiques ont permis de mieux comprendre le rôle déterminant joué par les diphosphines chirales à travers l'atropoisomérie dans le contrôle de la sélectivité du processus catalytique, notamment en hydrogénation asymétrique.
Profil stérique des diphosphines chirales par atropoisomérie 1. Rappels bibliographiques
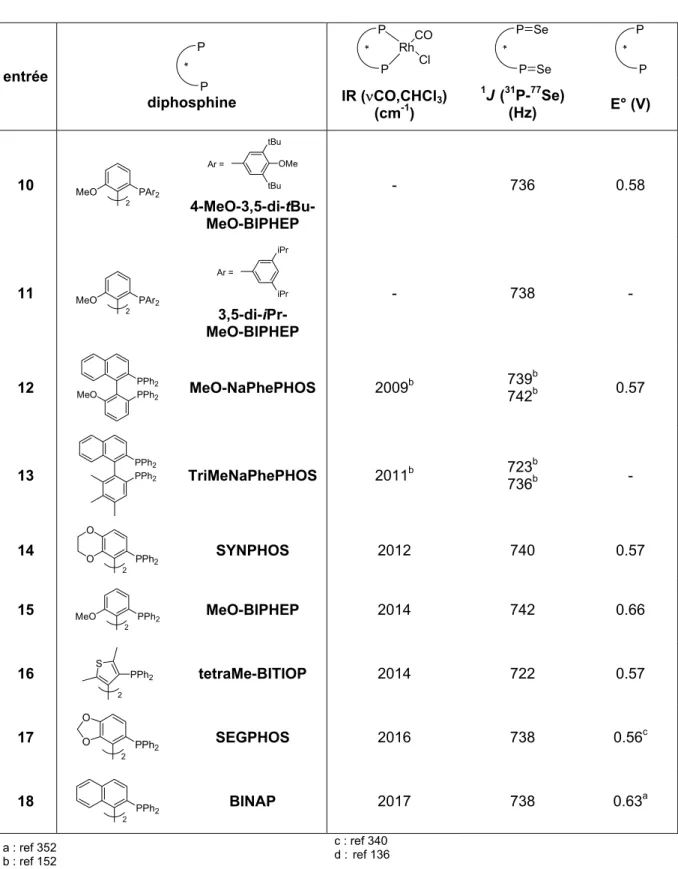
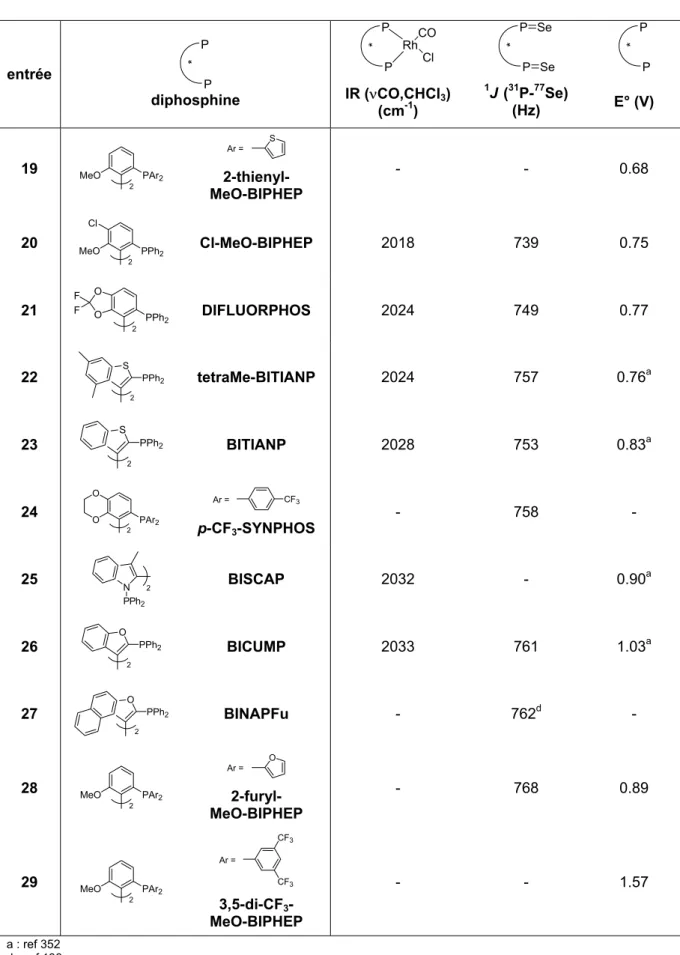
Les valeurs d'angle dièdre recueillies selon le type de structure (bis(oxyde de phosphine), complexe PdCl2(L*), complexe [Rh(L*)(diène)]X (X = BF4 ou ClO4) sont données dans le tableau 12. L'introduction de para-substituants (p-Tol-SYNPHOS et p-CF3-SYNPHOS) ne modifie pratiquement pas l'angle dièdre du biaryl. Nous montrons que l'angle dièdre θ de l'unité biaryl est le paramètre sérique de choix pour quantifier l'unité stérique. effets des diphosphines chirales dus à l'atropoisomérie.
Profil électronique des diphosphines chirales par atropoisomérie 1. Rappels bibliographiques
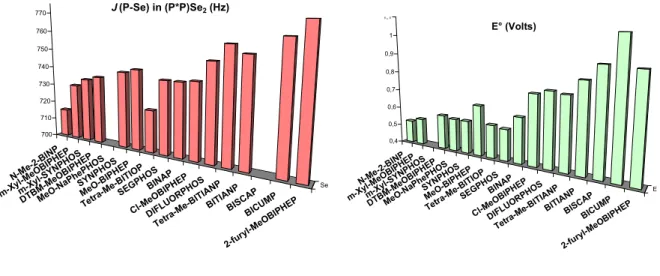
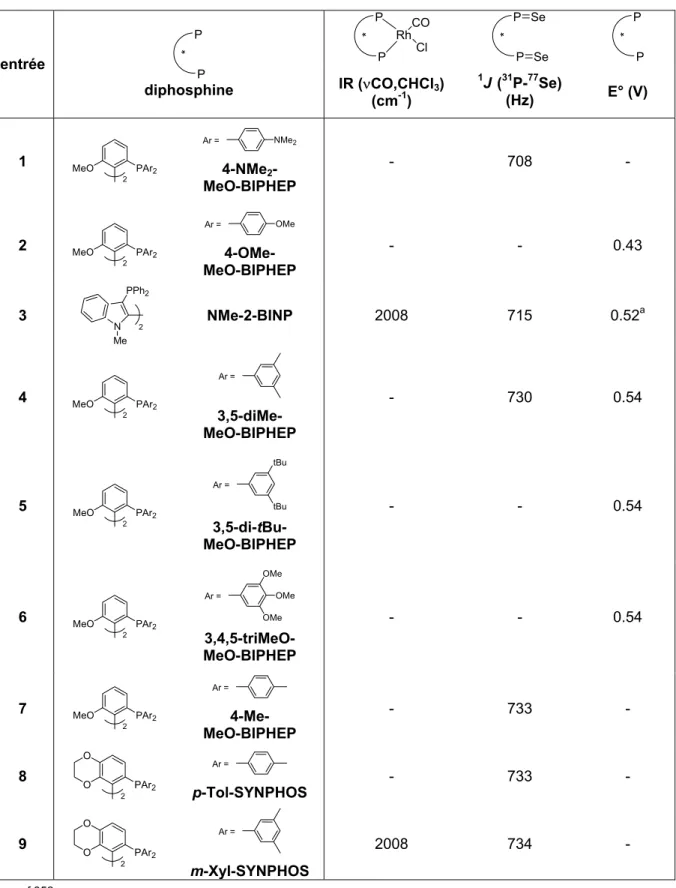
La comparaison des différentes valeurs obtenues de ν(CO) permet de déterminer la classification des diphosphines P*P en fonction de la densité électronique présente sur le phosphore. Afin d'évaluer avec précision les propriétés électroniques des ligands SYNPHOS et DIFLUORPHOS au sein de la famille des diphosphines atropoisomères, nous avons décidé d'évaluer les profils électroniques d'une trentaine de diphosphines de ce type selon les trois échelles électroniques que nous venons de décrire. L'échelle électronique des ligands du motif biphényle obtenue à partir des données infrarouges des complexes ν(CO) [Rh(CO)Cl(P*P)] permet la classification des diphosphines présentée dans le Schéma 220.
Influence des paramètres stéréo-électroniques sur la cinétique en hydrogénation asymétrique
Les cinq diphosphines à motif biphényle que nous avons comparées dans cette étude sont représentées sur la figure 223. Les différentes courbes de consommation d'hydrogène en fonction du temps sont rassemblées sur la figure 6 pour les cinq ligands que nous avons comparés. Les différentes courbes de consommation d'hydrogène en fonction du temps pour ces expériences sont présentées sur la figure 7.
Influence des paramètres stéréo-électroniques sur la sélectivité en hydrogénation asymétrique
Le graphique 8 présente la variation de l'excès énantiomérique en fonction de l'angle dièdre θ du squelette biaryle de la diphosphine utilisée (BINAP, MeO-BIPHEP, SYNPHOS ou DIFLUORPHOS). Comme on peut le voir sur la figure 9, pour tous les substrats de la série 1 (notamment les composés 34e et 34g), plus le ligand est riche en électrons (ν(CO plus faible), plus l'excès énantiomérique augmente. Comme précédemment, on voit dans Les graphiques 10 et 11 ont cherché à visualiser l'influence de l'angle dièdre θ et des propriétés électroniques des diphosphines sur les excès énantiomériques obtenus en hydrogénation pour les substrats de cette série.
Conclusion
- Utilisation des catalyseurs Ru-SYNPHOS ® et Ru- DIFLUORPHOS ® pour la synthèse d’alcools chiraux d’intérêt industriel
Les stratégies que nous avons mises en œuvre pour parvenir au développement de diverses synthèses d'alcools chiraux d'intérêt industriel et synthétique sont présentées dans le chapitre suivant. L'utilisation des catalyseurs Ru-SYNPHOS® et Ru-DIFLUORPHOS® pour la synthèse d'alcools chiraux d'intérêt industriel DIFLUORPHOS® pour la synthèse d'alcools chiraux d'intérêt industriel. Dans chaque cas, nous présenterons brièvement l'intérêt synthétique de chaque composé et les méthodes de synthèse par catalyse asymétrique décrites dans la littérature.
Synthèse de catalyseurs Ru-SYNPHOS ® et Ru-DIFLUORPHOS ® préformés Le travail préalable à cette étude d’optimisation a été la synthèse de catalyseurs de
Dans ce travail, nous présenterons donc les travaux d'optimisation de différents couples substrat/ligand identifiés lors d'une précédente étude comparative en hydrogénation asymétrique catalysée par des complexes de ruthénium (Schéma 231). Synthèse de catalyseurs Ru-SYNPHOS® et Ru-DIFLUORPHOS® préformés Le travail préliminaire à cette étude d'optimisation a été la synthèse des catalyseurs. Nous avons ensuite utilisé ces différents catalyseurs Ru-SYNPHOS (36a, 37a) et Ru-DIFLUORPHOS (36b, 36c, 37b) lors de l'optimisation des systèmes catalytiques d'hydrogénation asymétrique présentés dans le Schéma 231.
Valorisation du ligand DIFLUORPHOS ® dans l’hydrogénation asymétrique de β-cétoesters halogénés
Cette caractéristique se traduit par la présence de quatre états de transition diastéréomères dans le mécanisme d'hydrogénation de ce substrat par des complexes chiraux de ruthénium. Les résultats de ces différents tests d'hydrogénation du 4-chloroacétoacétate d'éthyle sont rassemblés dans le tableau 29. Les excès énantiomériques obtenus avec les deux ligands SYNPHOS et DIFLUORPHOS dans l'hydrogénation asymétrique de l'acétate de benzoyle d'éthyle sont rappelés au début du tableau 31 (ee = 97% , entrée 1 et ee = 92%, entrée 2).
Valorisation du ligand SYNPHOS ® dans l’hydrogénation asymétrique de cétones β-fonctionnalisées