Le troisième chapitre présente la préparation de complexes du platine avec les ligands obtenus précédemment. Le quatrième chapitre se concentre sur la réactivité des complexes du platine avec les nucléosides et l'ADN sous différentes formes : plasmides superenroulés et structure en épingle à cheveux de l'ADN.
Etude Bibliographique
Introduction
Les métaux mis en avant dans cette thèse sont le platine, pour ses propriétés alkylantes des bases nucléiques, et le cuivre, pour ses propriétés coupantes des brins d'ADN. La recherche et le développement des complexes de platine sont présentés dans la section I.2., les complexes de cuivre sont présentés dans la section I.3.
Complexes de platine : « alkylation » de l’ADN
- Cisplatine, historique
- Cisplatine, chimiothérapie
- Cisplatine, mode d‟action et réactivité
- Cisplatine, phénomènes de résistance
- Cisplatine, analogues utilisés en chimiothérapie
- Nouvelles générations de complexes de platine
- a Les complexes de platine mononucléaires
- b Les complexes de platine polynucléaires
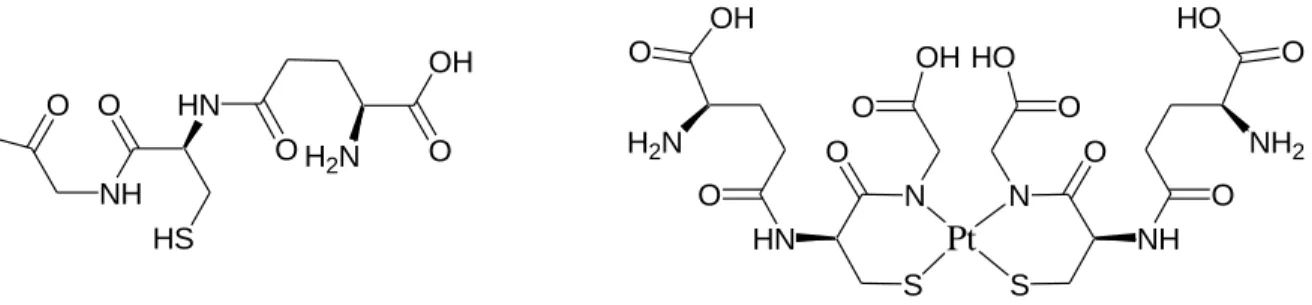
Toutes les bases d'ADN ont des sites de liaison potentiels au platine (Figure 3). La majeure partie de la formation d'adduit intrabrin-1,2 d(GpG) s'explique par la géométrie du complexe du platine.
Complexes de cuivre : coupure oxydative de l’ADN
- Coupure oxydative (généralité)
- Mécanisme de coupure de l‟ADN par le complexe [Cu I/II (phen) 2 ] +/2+
- Exemples de complexes basés sur le système Cu(phen) 2
- Autres exemples de complexes de cuivre pouvant provoquer une coupure de l‟ADN
Démonstration du mécanisme d'excision de l'ADN à l'aide du complexe 1,10-phénanthrolinecuivre(I) en présence de peroxyde d'hydrogène.97. Néanmoins, l'oxydation du carbone C5' est une voie minoritaire pour l'induction du clivage de l'ADN par le complexe [CuI/II(phen)2]+/2+.

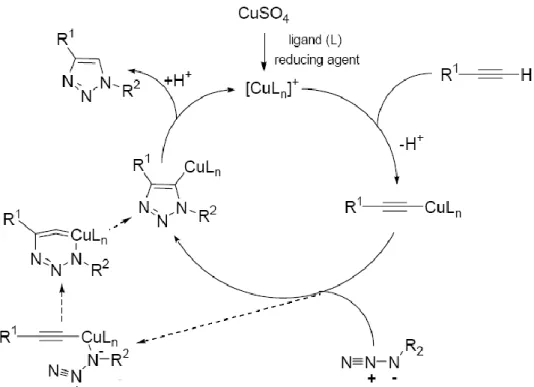
Chimie click : Réaction de cycloaddition 1,3-dipolaire alcyne-azoture
- Le concept de la chimie click
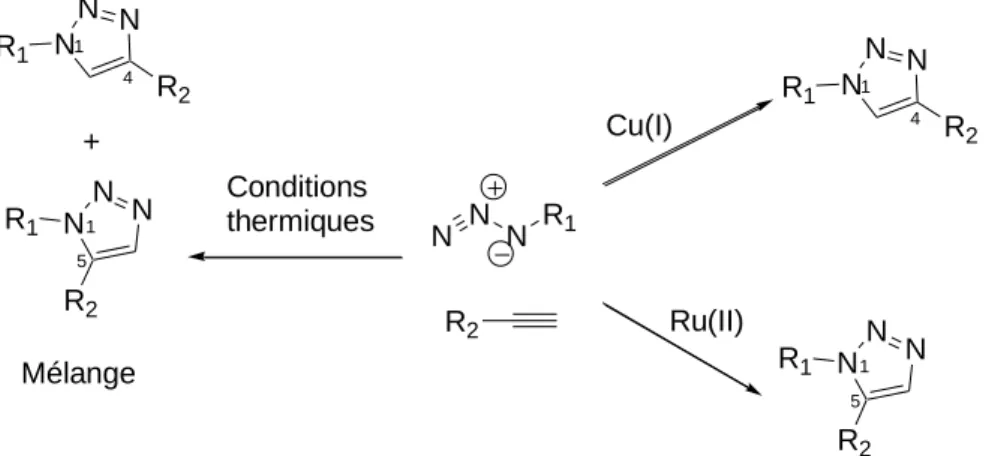
- Cycloadditions de Huisgen
- Les sources de cuivre pour la cycloaddition 1,3-dipolaire azoture-alcyne catalysée
- a Formation du catalyseur cuivre(I) par réduction des sels de cuivre(II)
- b Formation du catalyseur Cu(I) par addition de sels de Cu(I)
- c Catalyseurs Cu(I) stables
- d Autres sources de cuivre
- Applications de la cycloaddition CuAAC
- a Les triazoles comme bioisostères
- b Concept „peptides modifiés‟
- c Conjugaison de molécules
- d Produits naturels modifiés
- e Synthèses de dendrimères
- f Immobilisation de molécules sur un support
- g Concept de réaction click in situ
- h Concept de ligand click pour chélater les métaux
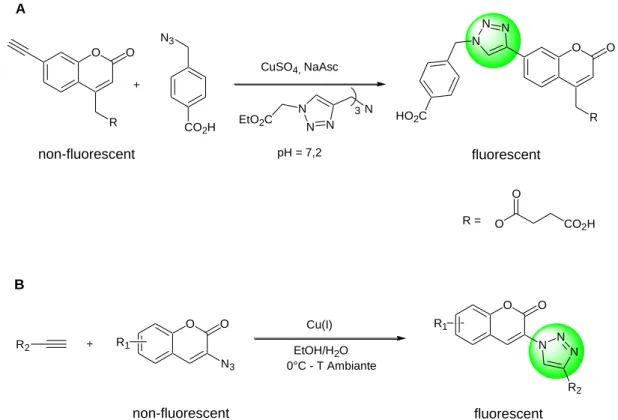
- i Réactions de CuAAC fluorogéniques
- j Concept de marquage des systèmes cellulaires
- a Acylation d‟amine : formation des chaînes amides
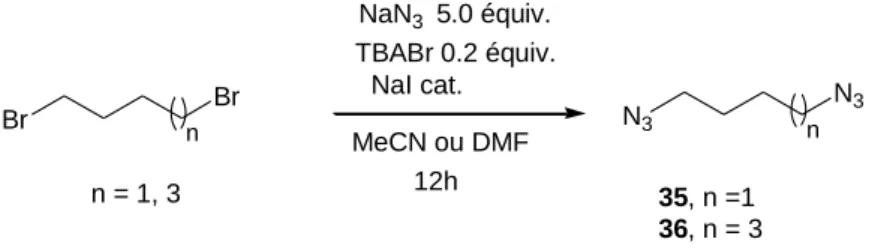
- b Synthèse des précurseurs azotures
- c Synthèse des triazoles
- Synthèses des ligands triazoles avec une modification de la pince
- a Variation de l‟amine participant à la chélation
- b Synthèse d‟un ligand triazole tridente
- Synthèse d‟un ligand triazole « inversé »
Parmi toutes les réactions de chimie click, la cycloaddition CuAAC reste la réaction la plus étudiée à ce jour. Ce catalyseur respecte les conditions d'une réaction clic, il est particulièrement soluble dans les solvants hydrocarbonés qui lui permettent d'être facilement isolé des produits de réaction par simple filtration. L'utilisation de CuAAC en combinaison avec d'autres réactions chimiques a permis la synthèse rapide d'une grande variété de structures d'intérêt biologique.
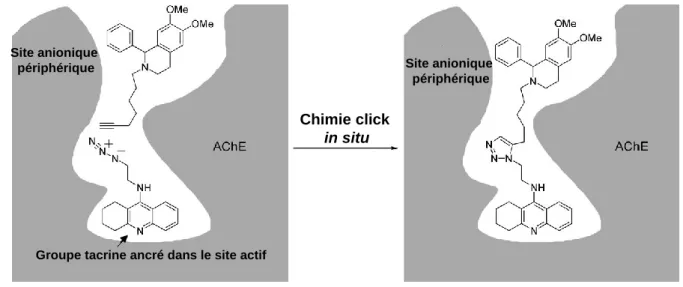
Les différentes applications dans le domaine de la chimie et de la biologie du CuAAC sont brièvement présentées ci-dessous. Représentation schématique de la réaction de cycloaddition alcyne-azide au sein du site actif de l'acétylcholinestérase (AChE). CuAAC a été utilisé pour la synthèse de ligands du palladium et d'autres métaux de transition dans le domaine de la catalyse.
Synthèses des ligands bis -triazole
- Synthèses des ligands bis-triazoles possédant un pont aliphatique
- Synthèse d‟un ligand bis-triazole avec un pont aliphatique intégrant une amine
- Synthèses de ligands bis-triazole possédant un pont ammonium
- Synthèse d‟un ligand bis-triazole inversé avec un pont di-ammonium
Pour obtenir un ligand bis-triazole bis-trident, nous avons fait réagir le diazide 36 avec de la propargyl diamine 31 brute (schéma 8). La synthèse d'un ligand bis-triazole ayant une amine centrale dans l'espaceur reliant deux hétérocycles a été réalisée. Après acidification, le ligand bis-triazole 42 est obtenu sous forme de chlorhydrate par filtration avec un rendement de 69.
Le produit 44, obtenu avec un rendement de 92%, est isolé par extraction et ne nécessite pas de purification supplémentaire pour poursuivre la synthèse. Pour synthétiser un ligand bis-triazole bis-trident, le diazide 46 est mis à réagir avec la propargyl diamine 31 dans un mélange eau/méthanol (1/1, v/v) (Schéma 16). Le composé 52 est ensuite méthylé par la méthode Eschweiher-Clarke dans l'eau à reflux pour donner le produit 53 qui est isolé par simple filtration avec un rendement de 43.
Conclusion
Préparation de complexes de platine avec des ligands 1,2,3-
Introduction
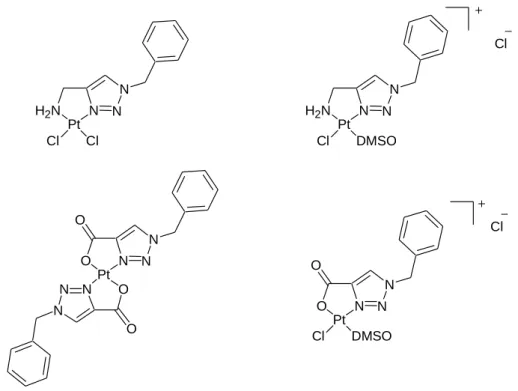
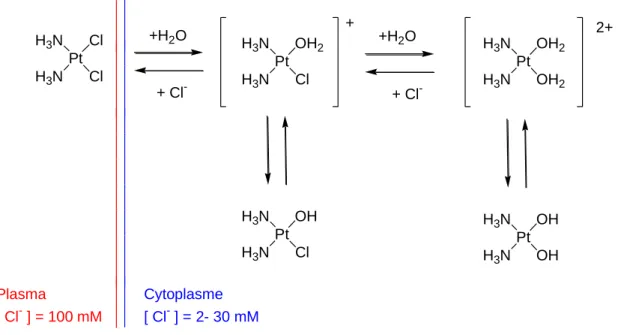
Les premiers tests de platination de ligands triazole bidentés ont été réalisés en laboratoire avec deux sources différentes de platine. Une procédure générale d'obtention de tous les complexes a été mise en place, le ligand (sous forme de chlorhydrate) et le sel de platine sont dissous séparément dans l'eau. Les complexes du platine considérés dans cette thèse seront des complexes neutres ou cationiques pour lesquels la coordination du métal sera de type N2Cl2, N3Cl ou N4.
Pour cela, nous avons utilisé comme source de platine les sels K2PtCl4, K[PtCl3NH3] (trichloromonoamineplatinate(II) de potassium ou sel de Cossa ; Figure 84) et le cisplatine commercial. Cette stratégie a été principalement envisagée pour les complexes binucléaires du platine afin de permettre des ponts à longue portée. Dans certains cas, nous avons également utilisé le cisplatine directement pour former des complexes chargés avec une coordination N4 afin d'obtenir des composés plus solubles dans l'eau que leurs analogues N3Cl.
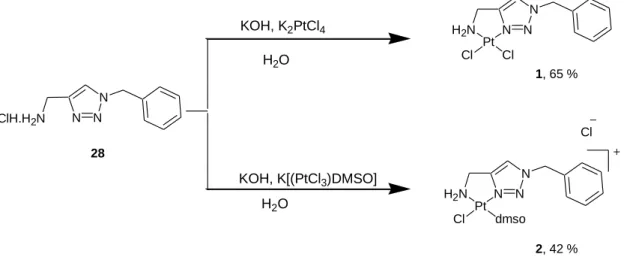
Préparation des complexes mononucléaire de platine
- Complexes mononucléaires de platine avec les ligands triazole-amine portant une
- Complexes mononucléaire de platine avec des ligands triazole-amine alkylés
- Complexes avec le ligand bidente triazole-amine 28 et différentes sources
- Complexe palladié avec le ligand 28
- Complexe mononucléaire de platine avec le ligand tridente triazole-diamine
- Complexe mononucléaire de platine avec le ligand triazole inversé
Pour obtenir le complexe dicime 72, le ligand 28 a été mis à réagir avec du cisplatine dans l'eau pendant 3 à 4 jours à température ambiante. Le complexe peut être formé de la même manière en chauffant le mélange réactionnel pendant 5 heures à 40°C. Le complexe chargé positivement formé est soluble dans l’eau, ce qui nous a permis d’effectuer des analyses RMN 1H, 13C et spectrométrie de masse.
Dans le cas de 73, le ligand 28 a réagi avec du sel de Cossa dans l'eau. Sachant que la coordination du platine est de type N3Cl, nous pensons avoir obtenu le complexe 75 en mélange avec 76. Par souci d'homogénéité, nous avons préféré utiliser le protocole standard en faisant réagir le ligand 34 avec K2PtCl4 dans l'eau dans 6 jours dans le noir.
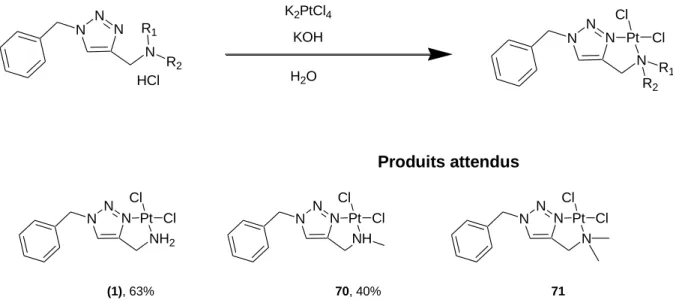
Préparation des complexes binucléaires de platine
- Complexes binucléaires de platine comportant des ligands bis-bidentes bis-
- Complexe binucléaires de platine comportant le ligand bis-tridentes bis-triazole à
- Complexes binucléaires de platine comportant des ligands bis-bidentes bis-
- Complexe binucléaire de platine comportant des ligands bis- bis-bidentes bis-
- Conclusion
Pour pallier les problèmes de solubilité rencontrés précédemment, nous avons cherché à obtenir des complexes cationiques. Nous avons décidé de former le complexe aquatique du complexe 81 dans l'espoir d'obtenir un produit soluble et analysable. Cependant, dans le but d'obtenir des complexes solubles plus faciles à analyser, nous avons essayé de modifier la coordination du platine en échangeant les deux chlorures par du NH3 puisque nous avions réussi à obtenir le produit soluble 72, dont la coordination métallique est identique.
Nous avons tenté d'obtenir le complexe 85 à partir du cisplatine, comme cela a été réalisé avec succès pour le composé 72. Dans cette section, la complexation du platine (II) avec différentes familles de ligands triazole a été réalisée. Par conséquent, nous avons utilisé d’autres sources de métaux (cisplatine et sel de Cossa) pour former des complexes cationiques afin d’augmenter la solubilité dans l’eau.
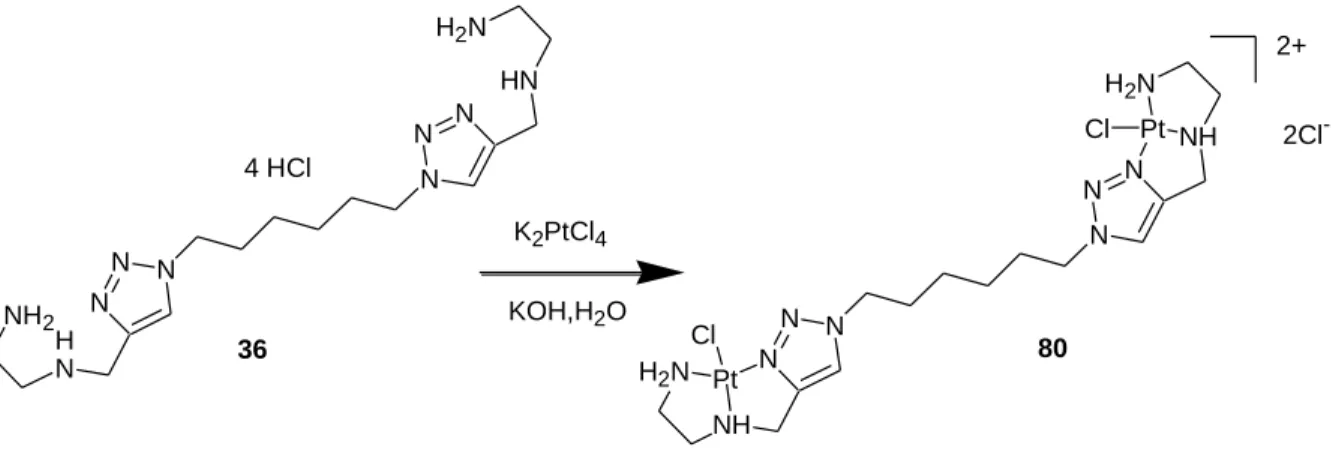
Réactivité des complexes avec l’ADN
Introduction
L'activité biologique des complexes platine 1,2,3-triazole bidène faisait déjà l'objet d'une étude avant mon arrivée au laboratoire, montrant, dans certains cas, leur cytotoxicité. Dans un premier temps, nous avons proposé d'étudier leurs interactions avec les nucléosides avant d'envisager une étude sur l'ADN. Pour cela, nous sommes partis d'un modèle simple, la guanosine, pour identifier les adduits du platine et la partie guanine du nucléoside.
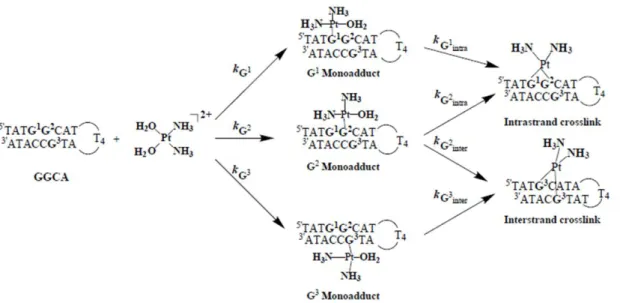
Enfin, nous avons décidé d'étudier plus en détail le mode d'interaction des complexes avec une séquence d'ADN auto-complémentaire à structure en épingle à cheveux pour tenter de quantifier les différents types d'adduits formés (mono, intra ou interbin).
Interaction des complexes métalliques (Pt, Pd) avec la guanosine.108
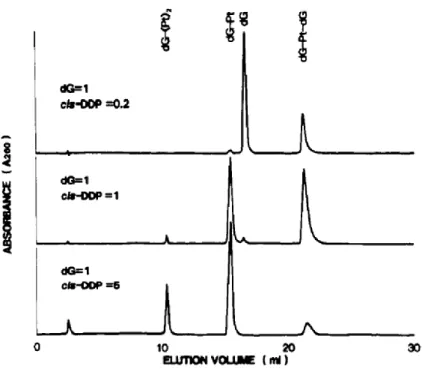
En présence d'un excès de désoxyguanosine (dG), le produit majoritaire correspond à un adduit dG-Pt-dG (Figure 102). Chromatogramme HPLC pour la séparation des produits issus de la réaction du dérivé aqueux du complexe platine(1) avec la guanosine. Ceci confirme une platination de l'azote N-7 de la guanosine par le complexe 1, comme déjà rapporté pour le cisplatine.
Du fait de l'asymétrie du complexe, le spectre présente deux ensembles de signaux distincts pour la partie nucléosidique (cela n'est pas observé dans le cas de l'adduit symétrique avec le cisplatine).183 L'attribution des signaux a été faite grâce à l'analyse d'un Spectre RMN de corrélation 1H-1H (COSY). Quant à l’analogue du platine, deux ensembles distincts de signaux sont observés pour le fragment nucléoside, en raison de l’asymétrie de la molécule. La formation de complexes cationiques apparaît plus facile dans le cas du palladium, phénomène que l'on attribue à la plus grande facilité de formation d'espèces aqueuses.
Interaction du complexe métallique (Pt) avec l’ADN en structure
- Rappel bibliographique
- Interaction du complexe de platine 1 avec l‟hairpin
Chromatogramme HPLC du mélange réactionnel résultant de l'action du dérivé diaqua en épingle à cheveux du cisplatine. Nous nous sommes concentrés sur la réactivité du complexe 1 en épingle à cheveux du platine par rapport au cisplatine. Dans le cas du complexe 1, en plus du clamp initial, un seul produit est détecté.
Dans ces conditions de réaction, peu d'adduits se forment généralement par rapport à la quantité initiale d'épingle à cheveux. Les complexes aqueux ont été directement mis à réagir avec une épingle à cheveux dans l'eau dans les mêmes conditions de réaction que ceux-ci. Dans le cas de l'aquacomplexe 1, la quantité d'épingle à cheveux restante est bien inférieure à celle obtenue avec le complexe 1, mais plusieurs produits sont formés (comparaison des figures 115 et 117).
Conclusion
Les conditions HPLC utilisées avant l’entrée dans le spectromètre de masse ne permettent pas de séparer les différents produits, leur identification n’a donc pas pu être réalisée.
Introduction
Youngs présente une CI50 similaire à celle du cisplatine dans les lignées cellulaires ovariennes et mammaires.191. Après la découverte des activités anticancéreuses de ces différents métallo-NHC, l’équipe a décidé de réaliser des tests d’activité biologique sur des NHC à base de cuivre(I).
Activité catalytique du [CuCl(SIMes)] pour la CuAAC et
- Criblage d‟activité des cuivre(I)-NHC
- Criblage d‟activité du [CuCl(SIMes)] en présence d‟additifs chélatant le métal . 125
- Toxicité du complexe cuivre(I)-NHC
- Induction de la coupure de l‟ADN par le complexe cuivre(I)-NHC in vitro
Au cours de ces travaux, le complexe [Cu(ICy)2]PF6 s'est révélé très efficace pour catalyser la réaction de cycloaddition entre l'azide de benzyle et le phénylacétylène. Criblage additif de la réaction CuAAC entre l'azide de benzyle et le phénylacétylène catalysée par le complexe [CuCl(SIMes)]. Résultats de dépistage additif pour la réaction CuAAC entre l'azide de benzyle et le phénylacétylène catalysée par le complexe [CuCl(SIMes)].173.
De plus, on peut noter que le complexe [CuCl(SIMes)] présente une cytotoxicité inférieure à micromolaire, concentration comparable aux valeurs retrouvées dans la littérature pour les complexes de cuivre [CuI/II(phen)2] et Cu (Clip-phen).196. Expériences comparatives sur le clivage oxydatif du plasmide pcDNA4TO avec le complexe [Cu(phen)]2+ et le complexe [CuCl(SIMes)]. Le même phénomène est observé pour le complexe [CuCl(SIMes)] avec des temps plus longs de 24 et 48 h (lignes 9 et 10, respectivement).
![Figure 121. Criblage d’activité de complexe [Cu(NHC) 2 ]X pour la réaction de CuAAC entre l’azoture de benzyle et le phénylacétylène](https://thumb-eu.123doks.com/thumbv2/1bibliocom/464546.70034/138.893.119.779.276.591/figure-criblage-activité-complexe-réaction-azoture-benzyle-phénylacétylène.webp)
Conclusion
Il semble que [CuCl (SIMes)] soit capable d'induire une rupture de l'ADN différemment de celle du cisplatine. Après une heure d'agitation à température ambiante, les phases sont séparées et la phase aqueuse est extraite avec de l'acétate d'éthyle (2 x 20 ml). Le mélange est agité à 80°C pendant 24 heures, puis, après retour à température ambiante, extrait à l'acétate d'éthyle (3 x 20 mL).
Le précipité formé est filtré sous pression réduite, lavé à l'éthanol (3 mL), puis à l'éther (3 mL) pour donner le chlorhydrate de 1,2,3-triazole attendu. Le précipité formé est filtré sous pression réduite, lavé à l'éthanol (3 mL), puis à l'éther (3 mL) pour donner le chlorhydrate de 1,2,3-triazole attendu avec une pureté satisfaisante. Le précipité est filtré sous pression réduite, lavé à l'eau (5 mL), puis à l'éthanol (5 mL) et à l'éther pour obtenir le complexe de platine (II) sous forme solide.
Après retour à température ambiante, le mélange a été extrait dans l'éther (3 x 20 mL), les phases organiques ont été réunies et séchées sur sulfate de magnésium, filtrées et évaporées sous pression réduite pour donner 27, liquide incolore (10,20 g ; 76, 60 mmol) avec un rendement de 97. Le composé 62 est dissous dans un minimum d'eau, puis passé sur résine Dowex 50 x 8 (chargée en K+) pour donner le sel de platine 63 sous forme d'un solide orange après évaporation de l'eau (rendement quantitatif).