SÉLECTION DES PLANTES DE L’ÉTUDE
Critères de sélection des plantes
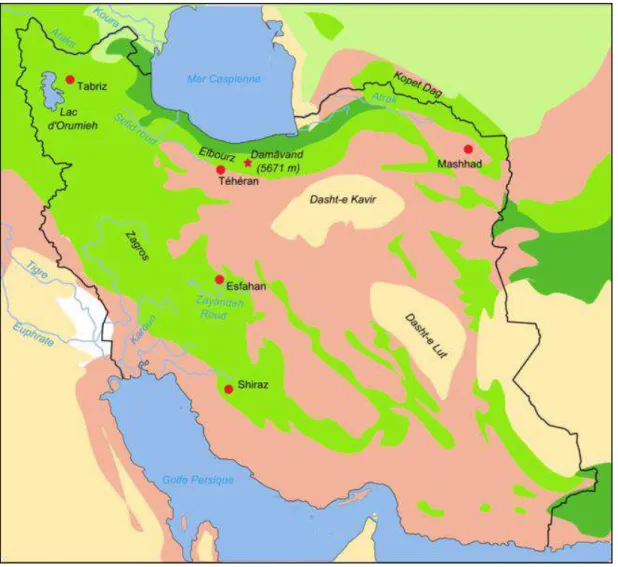
- Origine géographique
- Iran
- Guadeloupe
- Utilisation traditionnelle
- Aspects botanique et chimiotaxonomique
- Les apports de la littérature
Selon l’Organisation mondiale de la santé, 30 entreprises produisent actuellement des plantes médicinales naturelles en Iran. Afin de découvrir de nouvelles molécules et/ou de nouvelles voies d'application thérapeutique (ou cosmétique), il est plus raisonnable de choisir des plantes peu ou pas manipulées chimiquement et biologiquement.
Les plantes sélectionnées
- Catalogue plantes sélectionnées
Détection et détermination de la toxicité (ex. aflatoxines) ou de la phototoxicité (ex. furocoumarines) de composés. Détermination de la structure du composé 1 : Ce composé se présente sous la forme d'une poudre beige soluble dans le méthanol.
SYNTHÈSE BIBLIOGRAPHIQUE
Objectif de l’étude
- La résistance aux antibiotiques
- Les produits naturels dans la découverte des médicaments
- Les plantes et leurs composés antimicrobiens
La résistance aux antimicrobiens est devenue un problème de santé publique de plus en plus important dans le monde. 46 Depuis la découverte des antibiotiques dans les années 1950, l’utilisation de dérivés végétaux comme antimicrobiens est pratiquement inexistante, mais la nécessité de résoudre le problème de la résistance a motivé le lancement de nouvelles recherches dans ce domaine.
Présentation des espèces végétales les plus actives
- La famille des Lamiacées
- Hyptis atrorubens Poit
Les espèces du genre Hyptis contiennent des huiles essentielles riches en thymol, camphre ou citral, ce qui peut expliquer les propriétés antiseptiques, vermifuges, expectorantes et sédatives de ces plantes. Une étude récente sur Hyptis pectinata (L.) Poit., montre la présence de 7 flavonoïdes (dont le circiliol, le cirsimarit) et de 4 phénylpropanoïdes (dont l'acide rosmarinique, le 3-O-méthyl rosmarinate) chez cette espèce [140].

2.1.1.1. Caractéristiques botaniques
Caractéristiques botaniques : Hyptis atrorubens est une plante rampante à dressée, de 15 à 60 cm de haut, aux tiges filiformes, souvent légèrement poilues.

2.1.1.2. Synonymes et noms vernaculaires
2.1.1.3. Répartition géographique
2.1.1.4. Utilisation en médecine traditionnelle
La décoction de feuilles est utilisée contre le rhume et la grippe ainsi que contre les vers intestinaux. Une infusion de feuilles est utilisée contre le rhume, la grippe, les parasites intestinaux et l'indigestion [147].
2.1.1.5. Travaux antérieurs
Les polyphénols
2.1.2.1. Les flavonoïdes
Flavonoïdes : Ce sont des pigments qui colorent les fleurs, les fruits et parfois les feuilles. Les flavonoïdes, qui occupent une position dominante dans le groupe des phénols, sont des métabolites secondaires omniprésents dans les plantes.
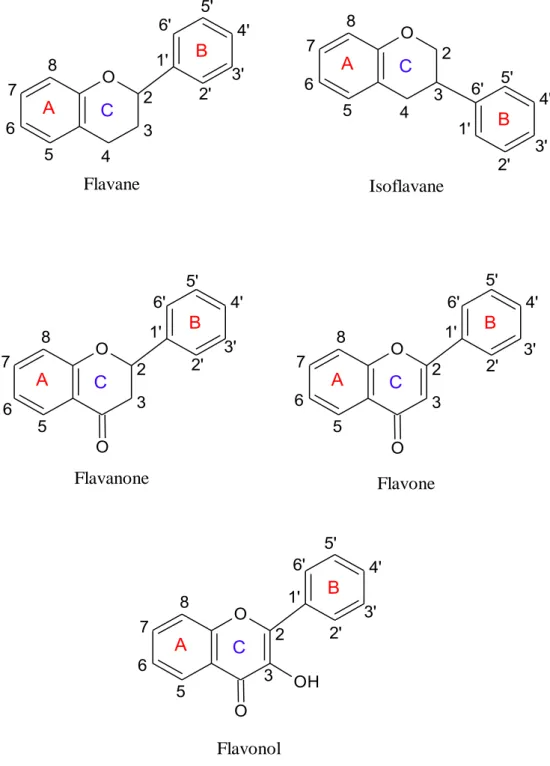
2.1.2.2. Les acides-phénols
Satureja khuzestanica Jamzad
Perovskia abrotanoides Karel
Perovskia abrotanoides est utilisée en médecine traditionnelle iranienne pour le traitement de la fièvre. Les villageois de la province iranienne d'Ispahan appliquaient une compresse préparée avec les racines broyées de cette espèce végétale, de l'eau, de l'huile de sésame et de la cire pour traiter les lésions cutanées causées par la leishmaniose.[47] De plus, l'huile volatile de Perovskia abrotanoides est non toxique et a des effets antibactériens et antifongiques [47].
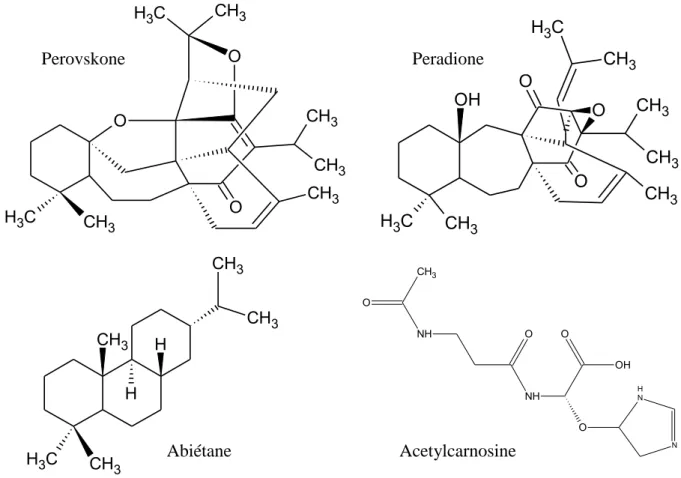
Une autre étude réalisée sur l'extrait méthanolique de Perovskia abrotanoides confirme la présence de 7 diterpénoïdes de type abietane et de 2 dérivés de l'acétylcarnosine (Figure 17) [48].
Phlomis anisodonta Boiss
Les plantes appartenant au genre Phlomis contiennent différentes classes de glucosides iridoïdes, de flavonoïdes, de phénylpropanoïdes, de phényléthanols et de diterpènes (156). Un certain nombre d'espèces du genre Phlomis sont utilisées en médecine traditionnelle comme stimulants, toniques, analgésiques, agents antidiabétiques, antipyrétiques, agents antidiarrhéiques, agents antiallergiques, antisérums et antihémorroïdes. Certains travaux ont montré diverses activités biologiques, telles que des activités anti-nociceptives et anti-inflammatoires.
La Salvia, l'un des plus grands genres de la famille des Lamiacées, comprend près de 900 espèces réparties dans le monde.

Salvia mirzayanii Rech. f. & Esfand
La Salvia mirzayanii est utilisée en médecine traditionnelle pour traiter la diarrhée, les douleurs abdominales, les maux de tête, l'hypercholestérolémie, le diabète et également pour la cicatrisation des plaies [79]. Les parties aériennes de cette espèce sont utilisées dans la médecine traditionnelle iranienne comme antidiabétiques, antispasmodiques et pour traiter les douleurs d'estomac [12]. De plus, plusieurs études ont montré les différentes activités biologiques de cette plante ; il possède des propriétés antibactériennes, une activité antioxydante (éliminateur de radicaux libres), des activités antiglycation et des effets neuroprotecteurs.
Des études antérieures ont montré la présence de spatulenol, un sesquiterpène dans cette plante qui a des effets immunomodulateurs (Figure 21) [158].
La famille des Apiacées
- Dorema ammoniacum D. Don
- Ferula assa-foetida L
- Ferulago contracta Boiss. et Hausskn
Quatre composés ayant une action inhibitrice sur l'acétylcholinestérase ont été isolés de l'extrait chlorométhylène de la résine de cette plante, à savoir : l'amorésinol, le dshamiron, le doremon A et son analogue (nouveau composé) (Figure 23) [165]. Ferula assa-foetida est l'une des espèces les plus importantes parmi les 30 espèces du genre Ferula en Iran. Une étude biologique récente a évalué l'activité antivirale de trente composés isolés de la résine de Ferula assa-foetida.
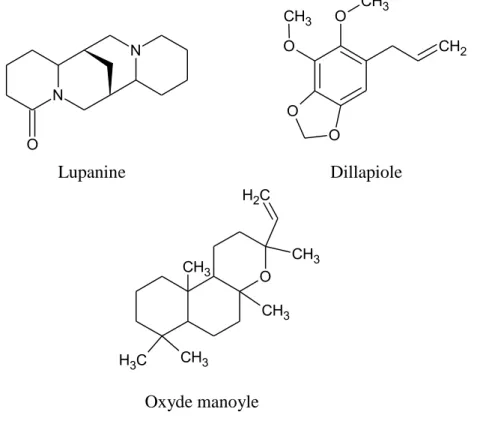
Les isomères de la lupanine, du dillapiole et de l'oxyde de manoyle ont été signalés comme étant des composés bioactifs du genre Ferulago (Figure 27) [177].

Les souches microbiennes testées
- Effet antimicrobien
- Mécanisme d’effet antimicrobien
- Caractéristiques des souches bactériennes utilisées
- Stenotrophomonas maltophilia
- Staphylococcus epidermidis
- Enterococcus faecalis
- Escherichia coli
- Klebsiella pneumoniae
- Pseudomonas aeruginosa
- Proteus mirabilis
- Providencia stuartii
- Salmonella sp
- Serratia marcescens
- Acinetobacter baumanii
- Citrobacter freundii
- Enterobacter cloacae
- Enterobacter aerogenes
- Mycobacterium smegmatis
- Staphylococcus aureus
- Staphylococcus lugdunensis
- Staphylococcus warneri
- Corynebacterium
- Enterococcus sp
- Caractéristiques des souches fongiques utilisées
- Candida albicans
- Les dermatophytes
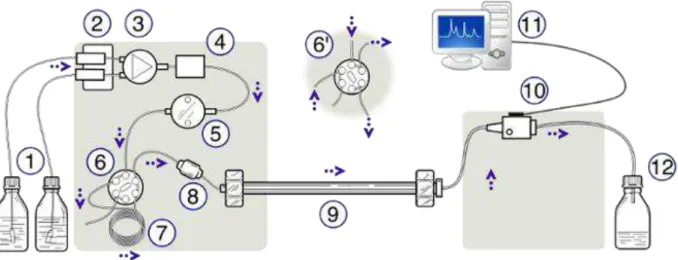
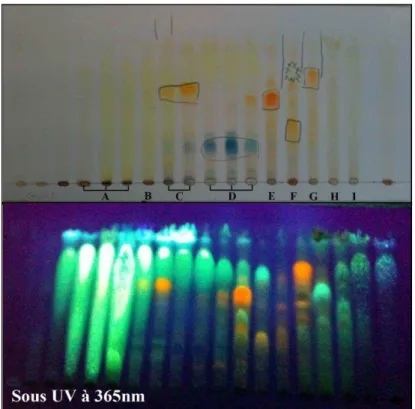
La colonne est remplie d'une phase stationnaire qui peut être de la silice ou du Sephadex®. Les valeurs CMI ont été enregistrées à la concentration la plus faible du composé ne montrant aucune croissance microbienne. Pour finaliser la culture dans les boîtes de Pétri, 1 ml de suspension est prélevé dans chaque tube pour remplir les puits de la plaque d'ensemencement automatique (appareil STEERS) (Figure 49).
Prélevez ensuite 100 l de chaque tube et ajoutez-le au puits -1 de la boîte correspondante. Nous avons également observé qu'une concentration de 50 µg/ml de l'extrait méthanolique de Conocephalum conicum détruisait 32% de la population cellulaire par rapport au témoin. L'acide rosmarinique (C18H16O8) est un ester de l'acide caféique et de la fonction alcool aliphatique de l'acide 3,4-dihydroxyphényllactique.
Le rosmarinate de méthyle a été initialement isolé de la plante Rabdosia serra (Lamiaceae) [211]. Progrès récents dans la connaissance de la flore de Guadeloupe et de Martinique, Acta Botanica Gallica.
MATÉRIEL ET MÉTHODES
Extraction de matériaux végétaux
- Matériel végétal
- Protocole d’extraction général
- Procédure d’extraction des tiges d’Hyptis atrorubens Poit
- Procédure d’extraction des fleurs d'Alcea rosea L
Techniques chromatographiques de séparation
- Chromatographie sur couche mince (CCM) analytique
- Chromatographie sur couche mince préparative (CCM prép.)
- Chromatographie en phase liquide (CPL)
- Chromatographie liquide moyenne pression (CLMP)
- Chromatographie liquide à haute performance (CLHP)
- Analyse quantitative des composés par CLHP
Un mélange de composés est déposé sur un support solide (phase stationnaire) qui est immergé dans un solvant (phase mobile) qui se déplace par capillarité le long de la phase stationnaire. La taille et le diamètre de la colonne sont déterminés en fonction de la masse et de la pureté de l'échantillon à fractionner. La taille et le diamètre de la colonne sont déterminés en fonction de la masse et de la pureté de l'échantillon.
En sortie de colonne les composés sont détectés à l'aide d'un détecteur (qui peut être UV, IR...) (Figure 41).

Détermination des structures chimiques
- Spectrométrie de masse
- Détermination des structures chimiques par RMN
La résonance magnétique nucléaire ou RMN est une technique d'analyse spectroscopique non destructive qui permet d'accéder à la structure des molécules. Ces spectres fournissent des informations différentes et complémentaires qui permettent de déterminer la structure des molécules. Concernant le spectre du proton (RMN 1H), plusieurs paramètres doivent être observés et analysés.
93 - Intégration : air sous la courbe d'un pic proportionnel au nombre de protons résonnant à cet endroit.

Étude in vitro de l’activité cytotoxique (antiproliférative)
Tests biologiques
- Essais antimicrobiens
- Préparation des extraits végétaux
- Préparations des différentes concentrations
- Préparation des souches microbiennes et culture in vitro
- Bioautographie
- Préparation des plaques CCM
- Préparation de la gélose ensemencée
- Détermination de la CMI et de la CMB en microplaque
- Dénombrement bactérien (killing curves ou kill-time)
- Préparation de la suspension bactérienne
- Préparation des extraits végétaux
- Préparation des différents tubes
- Préparation des plaques 24 puits
- Préparation des boîtes de Petri
- Courbes de croissance bactérienne
- Préparation de la suspension bactérienne
- Préparation des extraits végétaux
- Préparation des différents tubes
La méthode de dilution en milieu liquide permet de déterminer les paramètres (CMI, CMB) d'inhibition de la croissance des microbes par des extraits ou des principes actifs. Préparation des extraits de plantes : Après avoir déterminé la CMI pour chaque produit, des dilutions doivent être préparées à des concentrations de la CMI et quatre fois la CMI. La croissance d'une bactérie consiste en une augmentation coordonnée de la masse de ses éléments constitutifs.
La biogenèse des flavonoïdes nous amène à considérer comme hypothèse la plus simple une 6- et 8-disubstitution phénolique de la benzopyrone.

RÉSULTATS
Évaluation de l’activité cytotoxique
Les résultats obtenus sont traités par le logiciel Gen5 et exprimés selon une courbe dose-effet qui reflète le pourcentage de cellules vivantes en fonction de la concentration de la molécule étudiée. Cette courbe permet de calculer la CI50 correspondant à la concentration de la molécule pour laquelle on observe une réduction de 50% de la viabilité cellulaire par rapport à un contrôle n'ayant subi aucun traitement (Figure 62). Les valeurs IC50 après évaluation de l'activité antiproliférative des extraits méthanoliques des sept plantes sont présentées dans le tableau 14.
114 Les résultats montrent que l'extrait méthanolique de Plagiomnium undulatum a une activité cytotoxique sur les cellules HT-29 (IC50 = 14 µg/ml).
Évaluation de l'activité antibactérienne des extraits
Il faut savoir que tous les extraits examinés étaient actifs contre un minimum de 2 et un maximum de 36 micro-organismes. 121 Les résultats montrent que les micro-organismes Gram-positifs sont plus sensibles à la plupart des extraits de plantes. La CMI (la plus faible concentration d’antibiotique qui inhibe toute croissance visible) est déterminée pour chaque couple bactérie-antibiotique.
En comparant la CMI aux concentrations critiques, on détermine la sensibilité ou la résistance de la bactérie à l'antibiotique.
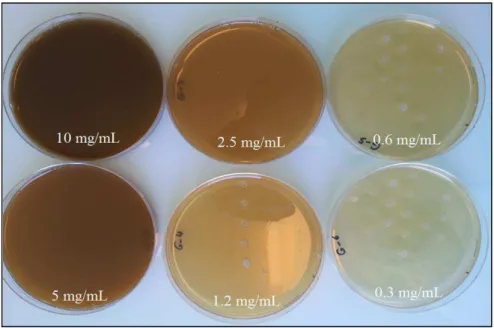
Détermination de la CMI et de la CMB (milieu liquide)
Certaines plantes testées ont fait l'objet de plusieurs études (par exemple Salvia mirzayanii), mais leur activité antibactérienne n'avait jamais été évaluée sur l'ensemble des micro-organismes utilisés pour cette étude, ce qui nous a permis de confirmer nos résultats. De manière générale, les tableaux 15 et 16 montrent que les bactéries Gram-positives sont beaucoup plus sensibles que les bactéries Gram-négatives. En effet, contrairement aux bactéries Gram+, les bactéries Gram- possèdent une membrane externe en plus du peptidoglycane [197].
Le peptidoglycane est poreux et laisse passer de nombreuses substances, ce qui n'est pas le cas de la membrane externe des bactéries à Gram négatif, qui s'oppose notamment à la pénétration des antibiotiques hydrophobes.
Travaux sur la plante sélectionnée Hyptis atrorubens Poit
- Résultats biologiques préliminaires
- Sélection de l’extrait optimal pour l’inhibition antimicrobienne
- Choisir les souches sensibles et l'organe le plus actif de la plante
- Séparation et purification des composés actifs
- Première étape de fractionnement
- Découvrir des fractions actives par bioguidage
- Deuxième étape de fractionnement
- Purification des composés actifs
- Détermination de structure des composés
- Détermination de structure du composé 1
- Détermination de structure du composé 2
- Détermination de structure du composé 3
- Détermination de structure du composé 4
- Analyse quantitative des quatre composés
- Activité antibactérienne des composés isolés
- Détermination de la CMI et de la CMB
- Effets synergiques entre les composés
- Dénombrement bactérien (killing curves ou kill-time)
Compte tenu de la faible activité antifongique, nous avons uniquement concentré notre étude sur l’activité antibactérienne de l’extrait hydrométhanolique de tiges d’Hyptis atrorubens. Pour les fractions B et E, nous avons utilisé deux colonnes de silice en phase inversée (RP-18) de 46 cm de longueur et 5 et 2 cm de diamètre (pour les fractions B et E, respectivement). Enfin, nous avons vérifié l'activité antibactérienne de chaque composé isolé par bioautographie contre la souche Staphylococcus epidermidis 5001.
A ce stade, nous avons décidé de rechercher des effets synergiques entre les quatre composés pour tenter d'expliquer les mécanismes compensatoires en termes de dilution dans l'extrait.
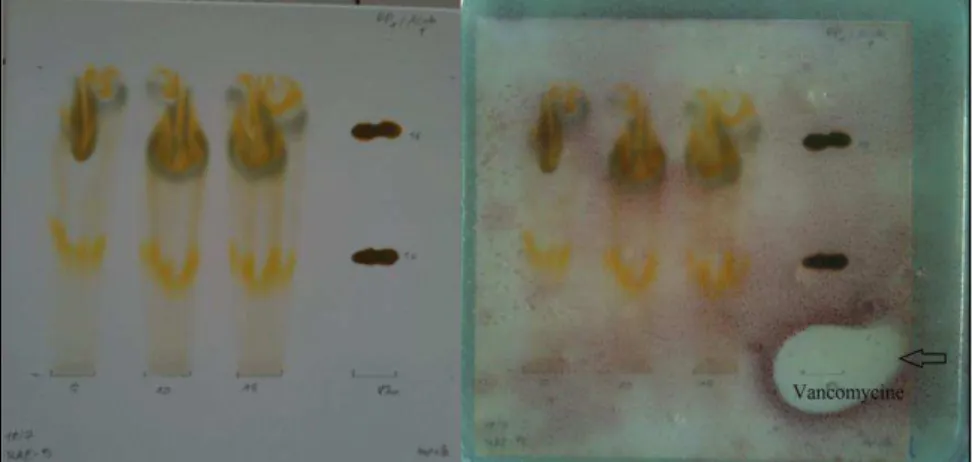
4.5.3.1. Staphylococcus epidermidis 5001
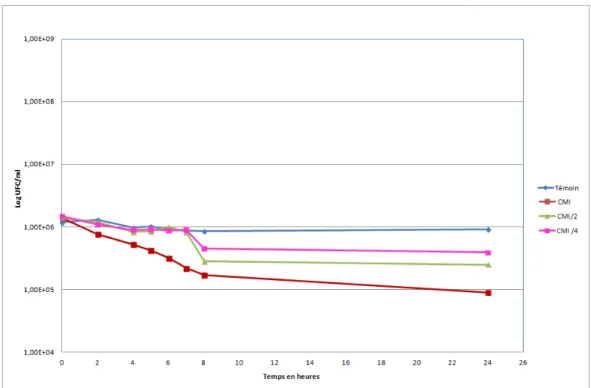
Enfin, l’effet de la combinaison des quatre composés contre Enterococcus faecalis C159-6 a montré la CMI la plus basse observée dans cette étude (0,07 mg/ml). En fonction des résultats obtenus, nous avons réalisé les courbes bactéricides présentées dans les graphiques 1 à 4. Staphylococcus epidermidis 5001 : nous avons observé que le composé RA, à quatre fois la CMI (1,25 mg/ml), réduisait la croissance bactérienne autorisée de 5 %. un temps de 240.
Stenotrophomonas maltophilia : D'après les graphiques 3 et 4, on voit que le produit 1, avec quatre fois la CMI (1,25 mg/ml), a eu une action très rapide (en 15.
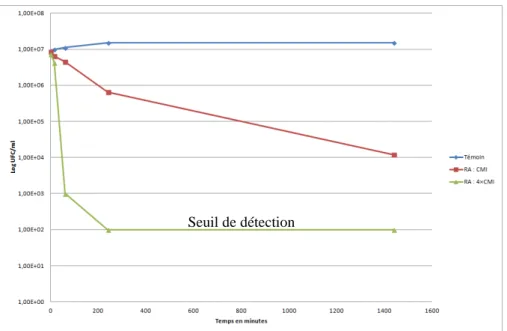
4.5.3.2. Stenotrophomonas maltophilia
Courbe de croissance à 37 °C
Aux concentrations sous-inhibitrices, la phase de latence est plus longue et le niveau de croissance bactérienne n'a pas encore atteint le niveau de contrôle après 24 heures. Ce test nous a confirmé que les concentrations sous-inhibitrices ont toujours un effet significatif sur la croissance bactérienne. De plus, les phases stationnaires des concentrations sous-inhibitrices sont respectivement de un et deux logs sous contrôle.
Courbe de croissance à 4 °C : A cette température, lorsque les bactéries restent en phase stationnaire, les concentrations sous-inhibitrices n'ont aucun effet.
Courbe de croissance à 4 °C
Les graphiques montrent que les deux composés à la concentration minimale inhibitrice ont lentement diminué le nombre de bactéries par rapport au test de durée de destruction. Dans la figure 6, on observe presque la même chose pour la RM, bien que les résultats soient légèrement plus faibles. 159 Cependant, comme le montre le graphique 7, la concentration CMI de PR (0,3 mg/ml) a réduit le nombre de bactéries jusqu'à un log après 24 h (des résultats comparables ont été obtenus pour MR ).
Enfin, en comparant les quatre graphiques de la courbe de croissance, nous observons presque la même activité inhibitrice (un log) pour la CMI des deux composés (à 4 °C et 37 °C), ce qui signifie que l'activité antibactérienne ne nécessite pas de multiplication bactérienne. et se manifeste au même niveau, lorsque les bactéries sont en phase stationnaire.
Travaux phytochimiques sur Alcea rosea L
- Isolement et purification des flavonoïdes d’Alcea rosea L
- Détermination structurale des flavonoïdes d’Alcea rosea L
- Détermination de structure du composé 5
- Détermination de structure du composé 6
- Détermination de structure du composé 7
Antinociceptive effects of the essential oil of Dracocephalum kotschyi in the mouse writing test, Journal of Pharmaceutical Sciences 7: 76-9. Extraction and identification of the essential oil components of Salvia lachnocalyx Hedge., Iranian Journal of Medicinal and Aromatic Plants. Antibacterial activity of essential oils from Iranian plants (Mazandaran province), Journal of Essential Oil Bearing Plants.
Medicinal plants of Gilan province and their applications, Iranian Journal of Medicinal and Aromatic Plants.

DISCUSSION
CONCLUSION ET PERSPECTIVES
ANNEXES