Après avoir obtenu une surface permettant l'immobilisation de l'ADN, nous l'utiliserons pour la mesure en temps réel de la formation de complexes protéiques avec l'ADN. En effet, cette protéine joue un rôle central dans le mécanisme de recombinaison homologue et de réparation de l’ADN chez l’humain. Pour ce faire, nous avons utilisé une protéine également impliquée dans les processus de recombinaison de l’ADN.
Nous orienterons ensuite nos investigations vers un type spécifique de biorécepteurs et de transducteurs adaptés à l'étude de l'interaction entre l'ADN simple brin (sb) et/ou double brin (db) (motifs sondes) avec les protéines. (analytes cibles) .
Les analytes cibles et leurs motifs sondes
Les analytes cibles
Un grand nombre d’analytes cibles peuvent être trouvés dans la littérature, allant des simples molécules organiques aux molécules biologiques. Ainsi, dans l'analyse des fluides biologiques (sang, sérum, urine), on retrouve la détection de molécules organiques, [4, 5] via des biocapteurs enzymatiques, comme le glucose, [6, 7] le cholestérol ou encore l'acide lactique. Par ailleurs, de nombreuses études sur le dosage et la détection (/présence) de molécules biologiques peuvent être trouvées dans la littérature.
14] Cet appareil permet de détecter la présence ou l'absence d'une séquence d'ADN spécifique.
Les motifs sondes
9] On retrouve également le dosage de nombreuses autres molécules organiques, principalement dans le cadre du contrôle qualité alimentaire/santé/dopage/eau, comme les nitrates, [10] les phénols [11] les métaux lourds (en détectant leurs ions métalliques comme Hg2+), [12] dopamine, [13] etc. On retrouve également dans ce contexte la détection de protéines, l'utilisation d'anticorps spécifiques qui, de par leurs formes particulières, sont capables d'associer spécifiquement la protéine cible. Pour la détection des protéines, on retrouve également l’utilisation de petites séquences d’ADN appelées aptamères.
Pour ce faire, un seul brin d’ADN est immobilisé en surface ; L'ADN alors en solution doit être sous forme simple brin pour pouvoir s'hybrider avec son brin complémentaire immobilisé.
Les biorécepteurs
Enchevêtrement
Par exemple, dans le cas d'une photopolymérisation (voir Figure 1.4), l'enzyme est prémélangée à la solution de monomère utilisée pour former le film polymère. Cela ne nécessite pas de modifications préalables des motifs sondes, ce qui permet de maintenir l'intégrité de l'activité du motif sonde. L'une des principales limitations de ce type de système est la diffusion éventuelle des échantillons de la sonde en dehors de la matrice, ce qui entraîne une diminution de l'efficacité du biocapteur.
Le manque d’accessibilité à l’ADN réduit en fait l’interaction entre le motif de la sonde et l’analyte cible (ADN ou protéine).
Adsorption
Par exemple, il a été facilement démontré qu'un biocapteur développé pour la détection d'ions de métaux lourds par « réticulation » de la phosphatase alcaline avec de la BSA dans du glutaraldéhyde sur une électrode conservait son activité pendant un mois en solution à 4 °C. Les liaisons chimiques formées lors de la réaction modifient en effet la géométrie de l’enzyme et provoquent une perte d’activité, c’est-à-dire une perte d’efficacité du biocapteur. Ces liaisons provoquent également des changements conformationnels dans la structure de l'enzyme.
De plus, les modifications chimiques des sites actifs peuvent également être affectées lors de la formation des liaisons croisées.
Liaison covalente - Affinité
Dans le cas où l'unité sonde est finalement modifiée par un groupe azoture, cela se traduit principalement par trois types de fonctions (réactions) permettant l'immobilisation. Le principal avantage de l’immobilisation par liaison covalente est la spécificité de la liaison entre le motif sonde et la fonction d’ancrage. Le film polymère ainsi formé à la surface de l'électrode de travail a une fonction directe de biotine (voir Figure 1.7-A).
On retrouve également dans le cas de l'immobilisation du brin d'ADN la formation d'un complexe biotine-(strept)avidine, où la fonction biotine se retrouve à l'extrémité du brin d'ADN et dans ce cas l'avidine est plutôt fixée en surface ( voir figure 1.7-B).
Les transducteurs
Les électrodes
La quantité de courant mesurée par l'électrode dépend également de la distance entre l'espèce et la surface. Lorsqu'il s'associe à l'aptamère, il se déplie et éloigne la sonde rédox de la surface. L'évolution de la surface d'une électrode peut alors être étudiée via la résistance du transfert électronique entre la surface de l'électrode et une sonde rédox en solution.
La production d'une réaction électrochimique est à l'origine d'un transfert électronique au niveau de la double couche compacte qui assure le passage d'un courant faradique (IF = dQF/dtetQF = ne−F).
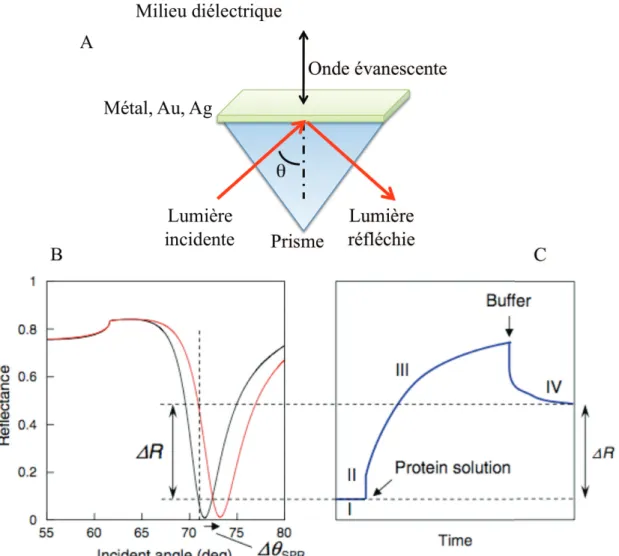
Optique et Résonance PLasmonique de Surface (SPR)
Pour ce faire, nous effectuons une spectroscopie d'impédance électrochimique en mode non faradique (nous nous appuyons uniquement sur le courant capacitif et le mouvement des charges de surface). On peut alors relier la concentration de pyruvate en solution à la diminution de la bande d’absorption du NADH. Ainsi, après avoir montré le schéma général de fonctionnement d'un SPR, la réflexion de la lumière réfléchie en fonction de l'angle enregistré est représentée sur la figure 1.14-B.
On peut donc, à partir de cette mesure, rapporter la variation de l'angle en fonction du temps de réaction, suivant ainsi chaque étape de la réaction.
Microbalance à Cristal de Quartz - QCM
Considérant cette partie (Figure 1.17-A, étape 1) de la réaction comme un équilibre, les auteurs ont considéré les équations suivantes. Cette réaction peut être suivie de la réduction de la variation de fréquence (et donc de l'augmentation de masse) lors de l'étape 2 (Figure 1.17-A, étape 2). La dernière partie de la réaction enzymatique de l’ADN polymérase se produit lorsque les brins d’ADN sont complètement reconstruits.
Au contraire, sur la figure 1.18-B, l'ajout de la protéine se produit en présence de Mg2+.
Microscopie à Force Atomique - AFM
On peut donc facilement avoir une retransmission des profils de surface (soit en mode contact, soit sans contact/résonant) selon les trois directions de l'espace (xyz). 67] ont pu reconstruire un modèle de liaison protéique à l'ADN double brin à partir d'images AFM. La première est la mesure de la force d’interaction qui existe entre la molécule de pointe et la molécule de surface.
Pour ce faire, nous effectuons des courbes d'approche de pointe et mesurons la force de retour.
Conclusion du Chapitre 1
Electropolymérisation
FIGURE 2.2 – Mécanisme général de l’électropolymérisation du thiophène, potentiel enregistré en relation avec l’ECS (Saturated Calomel Electrode) selon Sharma et al. Les dimères formés sont insolubles, ils précipitent puis sont adsorbés à la surface de l'électrode de travail. La modification de surface par électropolymérisation de monomères électroactifs permet d'intégrer un grand nombre de groupements en surface.
A titre d'exemple, dans les travaux de O'Neil et al. [81] on retrouve une rugosité de l'ordre de 8,1 nm pour une épaisseur de couche de 60 nm dans le cas d'un poly(bithiophène).
Les SAM
Ces charges locales provoquent une modification de la conformation locale de la structure et entraînent la conjugaison des liaisons π. Puisque le potentiel qui permet la formation du polymère est supérieur à +1 V/ECS, à la fin de la réaction d'électropolymérisation on obtient effectivement le polymère sous une forme chargée. Pour éviter le problème de rugosité de surface provoqué par la couche organique et aller vers la formation d'une couche organique de type monocouche, des techniques de modification de surface telles que le SAM (monocouche auto-assemblée) ou encore l'électrogreffage ont été mises en avant dans la littérature. .
L'assemblage de ces molécules se fait de bout en bout ayant une forte affinité avec la surface. Ensuite, la présence d'une chaîne alkyle ou de cycles aromatiques permet l'organisation de la couche en créant des forces répulsives de type Van der Waals entre les chaînes (voir figure 2.3). 84] Pour former ce type de monocouche organique, les surfaces sont d'abord traitées et nettoyées afin d'obtenir le plus de groupements silanol/hydroxyle possible en surface.
La surface est ensuite immergée dans une solution contenant un précurseur des types suivants : alkyltrichloro-, alkyltriméthoxy- ou encore alkyltriéthoxysilane qui réagissent spécifiquement avec les groupements hydroxyles de la surface. Bien que le mécanisme de formation des monocouches soit encore débattu (dépendant de nombreux paramètres), la formation de monocouches auto-assemblées selon cette approche reste facile à mettre en œuvre. Il est cependant difficile de les reproduire pour obtenir une couche unique bien définie.
85, 86] De plus, cette surface présente des limitations dues à la sensibilité particulière de la liaison Si – O. 90] Cette stabilité réduite dans le temps est une limitation qui se fait particulièrement sentir lorsqu'il est nécessaire de réaliser plusieurs étapes de modifications chimiques après la formation de la monocouche organique.
Modification de Surface par Electrogreffage - Electro-réduction
En fait, le principal défaut de cette méthode est le contrôle de l’épaisseur de la couche organique. Formation d'une couche organique constituée de la fonction Ar-SO2Cl à la surface d'un cristal de quartz d'or. Ainsi, seuls les spectres de la surface modifiée par la couche organique Ar-SO2Cl sont représentés sur la Figure 2.23.
Mesure de l'épaisseur de la couche organique par la méthode AFM "scratch". On voit sur la figure 2.27 une variation négative rapide de la fréquence après l'injection d'ADNsb (fin de variation ≈ 15 s). On remarque sur la figure 3.11 différentes évolutions de courbes en fonction de la concentration.
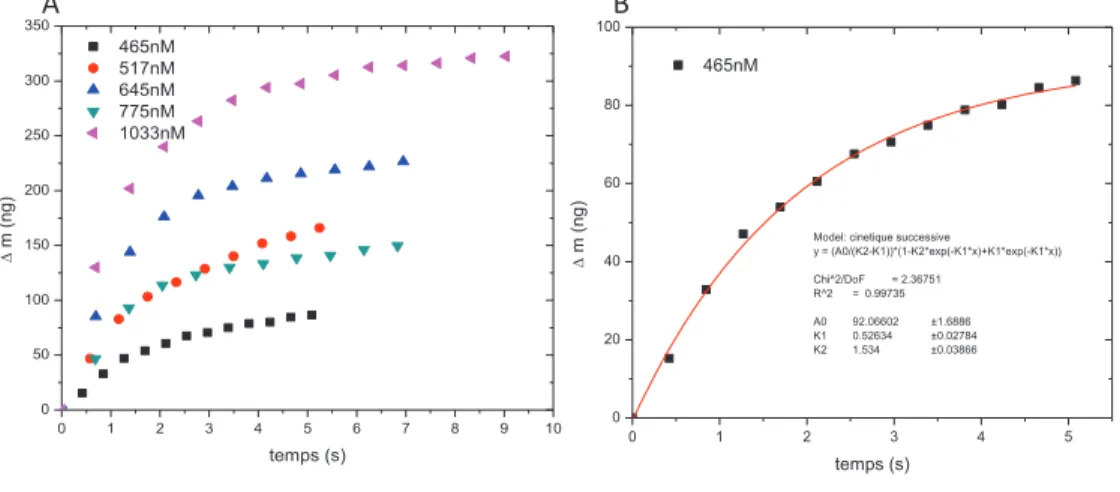
On peut alors résumer la séquence de réaction pour la formation du filament HsRad51 selon On obtient alors, dans le cas de la concentration initiale en protéine de 465 nm, la figure 3.25. On peut néanmoins constater que la présence de l'inhibiteur tend à modifier l'aspect général de la courbe.
La figure 4.1 montre les mécanismes généraux de transposition pour les classes 1 et 2. On peut alors voir sur la figure 4.21 la présence d'ADNdb (qui présente une forme légèrement hélicoïdale) aux extrémités de la protéine.