Le deuxième chapitre sera consacré à l'optimisation des conditions de purification de l'éthylglyoxylate (GEt), sa polymérisation et les propriétés thermiques du PGEt. Le quatrième chapitre de cette thèse présentera une étude détaillée de la dégradation de la PGEt par hydrolyse in vitro et proposera un mécanisme.
BIBLIOGRAPHIE
Les polymères biodégradables fleurissent actuellement en raison de leurs nombreuses applications à forte valeur ajoutée, comme les matériaux à usage médical (sutures, broches, prothèses chirurgicales, etc.) ou à usage pharmaceutique (matrice à libération contrôlée de principe actif, etc.). La définition de la biodégradation, et des polymères biodégradables en général, qui est très controversée dans la littérature, il est important de débuter cette partie bibliographique.
1.1 – Généralités
Les processus impliqués lors de la biodégradation sont nombreux et complexes et comportent deux étapes principales. La dégradation se produit en coupant les liaisons ester de la chaîne polymère, pour libérer des fragments (oligomères, monomères (6)) plus facilement décomposés par les micro-organismes.

1.2 – Polymères biodégradables usuels
Le PLA et le PGA ainsi que leurs copolymères font partie de la famille des poly(α-hydroxyacides). Les applications médicales sont apparues dans les années 1970 en raison de la capacité du corps humain à dégrader ces matériaux.

1.3 – Polymères issus des micro-organismes
Pour améliorer et contrôler la dégradabilité du PCL, un grand nombre de copolymères ont été envisagés avec d'autres lactones comme le glycolide, le lactide et la valérolactone. Ainsi, un grand nombre d’homopolymères et copolymères de type PHA présentant des propriétés physiques intéressantes ont été identifiés (29,30).
2 – P OLYGLYOXYLATE DE METHYLE
2.1 – Synthèse du polyglyoxylate de méthyle
- a – Purification du glyoxylate de méthyle
- b – Température plafond et choix de la température de polymérisation . 13
- d – Blocage des extrémités hydroxyles du PGMe
Comme dans le cas de nombreux monomères carbonyles (tableau I.3), le GMe a une faible température plafond (Tp). Une étude menée par Monsanto(52) sur l'effet de la température de polymérisation du GMe a montré peu d'effet sur la longueur de la chaîne lorsque cette température est comprise entre -70 et -20°C.

2.2 – Saponification contrôlée du PGMe
D'après les travaux de Brachais (49), les terminaisons éther par EVE ou DHP ne permettent pas une terminaison complète de chaîne et conduisent à une dépolymérisation du PGMe. On suppose que cela est dû à l’utilisation d’un acide comme catalyseur, qui n’est pas complètement éliminé lors de la purification du PGMe.
2.3 – Dégradation du PGMe
Monsanto(62), qui ne s'intéressait qu'à la forme saponifiée du PGMe, le polyglyoxylate de sodium, a étudié en détail sa biodégradabilité.
2.4 – Toxicité du PGMe
Quant au polysel, la sécurité orale est comparable à celle du PGMe.
2.5 – Applications pharmaceutiques
- a – Etude de la libération prolongée du métoprolol
- b – Etude de la libération rapide de la progestérone
Un protocole expérimental a été développé pour produire des lyophilisats de copolymères acide glyoxylique - méthylglyoxylate contenant de la progestérone très finement divisée (figure I.14). Ces lyophilisats permettent la libération et la solubilité immédiates de la progestérone en milieu aqueux en optimisant l'équilibre hydrophile/hydrophobe.
2.6 – Conclusion
Holten, Properties of Lactic Acid and Chemistry of Lactic Acid and Derivatives, Verlag Chemie, Vienna, Germany, 1971.
SYNTHESE ET CARACTERISATION DU
1 – P URIFICATION DU GLYOXYLATE D ’ ETHYLE
Dans la littérature, GEt est utilisé après simple évaporation du solvant présent dans le mélange ou tel quel pour les réactions de type Friedel et Crafts. C’est pourquoi nous nous sommes inspirés des travaux sur le polyglyoxylate de méthyle pour choisir la méthode de purification la plus efficace du GEt.
1.1 – Purification du glyoxylate d’éthyle (GEt)
Les résultats obtenus dans le tableau II.2 montrent que plus la quantité de P2O5 est importante, plus le rendement est faible, mais plus le degré de polymérisation est élevé, ce qui indique que GEt est susceptible de contenir moins d'impuretés susceptibles de perturber la polymérisation (terminaison, transfert ). La quantité d'impuretés présentes dans le distillat est difficile à déterminer car le monomère polymérise spontanément au contact du verre (notamment dans le tube RMN) et toutes les analyses (chromatographie, RMN) ne donnent que des résultats d'un mélange monomère/oligomère.

2 – E TUDE DE LA POLYMERISATION DU GLYOXYLATE D ’ ETHYLE
2.1 – Détermination de la température plafond
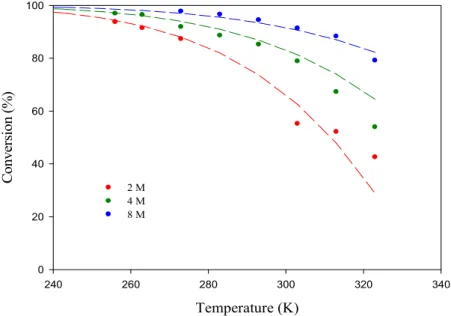
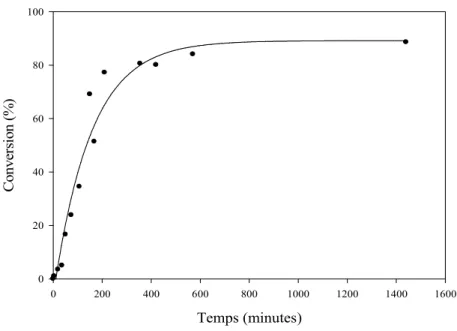
La figure II.6 montre l'évolution de la conversion à différentes concentrations en fonction de la température comprise entre 253 et 323 K, soit en dessous de la température d'ébullition du CDCl3. La courbe de ln[M]e en fonction de 1/T (figure II.7) permet alors de calculer les grandeurs thermodynamiques (tableau II.3).
![Figure II.5 : Evolution du spectre RMN 1 H du PGEt en fonction de la température dans CDCl 3 pour [M] 0 = 8M](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465438.70647/44.892.106.817.347.811/figure-evolution-spectre-rmn-pget-fonction-température-cdcl.webp)
2.2 – Etude des conditions de polymérisation du GEt
- a – Choix de l’amorceur de polymérisation
- b – Influence de la concentration en amorceur
- c – Choix du solvant de polymérisation
D'après la figure II.6 et pour une concentration en GEt de 9,9 M, la conversion devrait en réalité être supérieure à 95 %. Sur la figure II.8, nous avons montré l'évolution théorique de la masse molaire d'un côté.

3 – E TUDE DU BLOCAGE DES EXTREMITES DU P OLYGLYOXYLATE D ’ ETHYLE PAR DES
Les valeurs de concentration choisies sur la figure II.10 correspondent à celles que nous avons généralement utilisées lors de nos tests, soit 9,9 M pour la concentration en GEt pour la polymérisation et 7,4 M pour la modification des points après ajout des réactifs. On a donc décidé de choisir arbitrairement une quantité fixe de terminateur correspondant à une masse molaire de PGEt de 3000 g.mol-1, l'excès de réactif, s'il existe, est éliminé lors de la purification de la PGEt par précipitation.
3.1 – Terminaison uréthane avec des isocyanates
Dans les deux cas les polymères sont parfaitement finis et aucun signal de l'aldéhyde à 9,3 ppm n'est détectable sur le spectre RMN (Figure II.11). La présence d'aldéhyde mettrait en effet en évidence l'existence de chaînes incomplètes ou partiellement complétées qui se dépolymériseraient lors de la dilution dans le solvant d'analyse.

3.2 – Comparaison des Mn SEC et RMN
Les masses molaires obtenues par RMN 1H sont bien inférieures à celles déterminées par SEC, cet effet est d'autant plus accentué que le Mn augmente. Le premier est la formation d'allophanates (dus à l'utilisation d'un excès de phényl...isocyanate lors de la terminaison), la quantité de phényles par chaîne est alors supérieure à deux, le MnRMN est sous-estimé, cet effet s'accentue pour les masses molaires plus importantes (excès plus important isocyanate).

3.3 – Analyse RMN 13 C
Seule la dyade « b » a une influence sur le processus de propagation lorsque la triéthylamine est utilisée comme initiateur, dans le cas de la polymérisation du GEt. Dans le cas d'un amorçage au butyllithium, le résultat est proche du résultat d'un procédé bernoullien.

4 – P ROPRIETES THERMIQUES
4.1 – Analyse enthalpique différentielle
4.2 – Analyse thermo-gravimétrique
- a – Influence du blocage des extrémités
- b – Influence de la longueur de chaîne
- c – Analyses isothermes
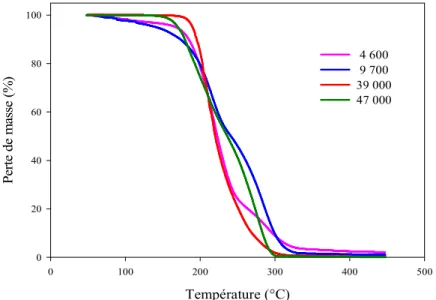
La résistance thermique des PGEt à terminaison phényle de masses molaires comprises entre 4600 et 47 000 g.mol-1 a été caractérisée par TGA (figure II.17). Nous avons également étudié plus en détail la résistance thermique du PGEt terminé par de l'isocyanate de phényle pendant une heure.
5 – C ONCLUSION
COPOLYMERISATION DU STYRENE PAR ATRP
1 – P RINCIPE DE L ’ATRP
C'est pourquoi, pour obtenir des copolymères de structure choisie, nous avons utilisé une méthode de polymérisation radicalaire vivante contrôlée. En effet, l'inhomogénéité du milieu affecte le mécanisme réactionnel et la cinétique, se traduisant par un indice de polymolécularité supérieur à 1,5 et un mauvais contrôle de la polymérisation.

2 – C ARACTERISATION DU MACROAMORCEUR
Le tableau III.1 présente quelques résultats obtenus pour cette terminaison pour une même concentration initiale de triéthylamine de 3,6.10-3 M et de GEt de 9,9 M dans le dichlorométhane. Comme dans le chapitre précédent, on voit que plus la masse molaire est grande, plus l’indice de polymolécularité est élevé.

2.2 – Caractérisation du macroamorceur par spectrométrie de masse
Nous avons ensuite analysé la PGEt terminée par le bromure de 2-bromo-2-méthylpropionyle (Figure III.8). Ainsi, la figure III.9 montre d'une part la masse théorique pour n = 13 et d'autre part un agrandissement de la figure précédente.
![Figure III.7 : Spectres de masse théoriques [M+ Na] + d’un PGEt monobromé (a), c](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465438.70647/74.892.282.612.322.518/spectres-théoriques-monobromé-possédant-extrémité-bloquée-hydroxyle-dibromé.webp)
3 – C OPOLYMERISATION DU STYRENE PAR ATRP
3.1 – Choix des conditions de polymérisation
3.2 – Copolymérisation du styrène en masse
Un déplacement du pic vers des masses molaires plus élevées ainsi que l'absence de signal dans le PGEt de départ confirment que Br-PGEt-Br joue bien le rôle de macroinitiateur. En pesant après purification du copolymère et en supposant que toutes les extrémités Br-PGEt-Br ont commencé, le pourcentage de conversion en polystyrène a été estimé à 65 %.

4 – E TUDE CINETIQUE
L'acidification du milieu lors de la dégradation du PGEt entraîne une accélération automatique de la réaction. Chaque essai correspond à trois examens du sol seul (témoins) et à trois examens du matériel à analyser (échantillons).
5 – A NALYSE THERMO - GRAVIMÉTRIQUE
6 – E TUDE DE LA STABILITE DU B R -PGE T -B R
Les résultats obtenus pour le suivi et 35 jours après la synthèse et la purification de Br-PGEt-Br sont présentés sur la Figure III.19. La cinétique est toujours d'ordre 1, mais l'effet inhibiteur s'ajoute à l'effet inhibiteur et augmente avec le vieillissement de Br-PGEt-Br.

7 – C ONCLUSION
On considérera donc que HAG, en milieu aqueux, réagira peu ou pas du tout avec l'éthanol lors de la dégradation du PGEt (figure IV.3). Seule la Tg, après séchage sous vide, a ensuite été suivie en fonction du degré d'avancement de la dégradation du PGEt (figure IV.14).
DEGRADATION DU POLYGLYOXYLATE D’ETHYLE
1 – E TUDE PRELIMINAIRE SUR MOLECULES MODELES
1.1 – Hydrate de l’acide glyoxylique
La dégradation du PGEt s'effectuant en tube RMN, c'est à dire en milieu fermé, le HAG sera en présence d'éthanol. Nous avons donc étudié l'évolution du spectre RMN 1H de HAG en présence d'un excès d'éthanol.

1.2 – Dégradation de l’hydrate de glyoxylate d’éthyle
1.3 – Diéthoxyacétate d’éthyle
Après 16 jours, le DEAE n’est détecté qu’à l’état de traces et les seules espèces majeures encore présentes sont le HAG et l’éthanol. A t = 7 jours, les signaux HGEt ne sont détectés que sous forme de traces et les pics principaux restants sont ceux de HAG et d'éthanol.

1.4 – Mécanisme de dégradation du HGEt
Dès le premier jour de dégradation, HGEt libère de l'éthanol car le rapport des intégrations des pics HGEt/éthanol diminue. Ainsi, en milieu aqueux (conditions d'hydrolyse du PGEt), et malgré la présence d'éthanol, le HGEt conduit quasi exclusivement à du HAG et seules des traces pourraient être attribuées à la présence de DEAE et/ou DEAA.
2 – D EGRADATION DU POLYGLYOXYLATE D ’ ETHYLE
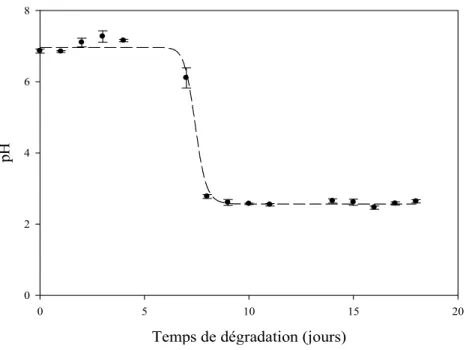
C'est pourquoi nous avons pris la précaution de travailler avec des films de PGEt de faible épaisseur (0,3 mm) et de surfaces similaires (environ 0,5 cm²). Une deuxième étude a porté sur le comportement de la PGEt directement dans l'eau, par pHmétrie d'une part et par RMN 1H d'autre part.
2.1 – Etude à 37°C en atmosphère saturée en eau
- a – Prise en eau
- b – Perte de masse
- c – Chromatographie d’exclusion stérique
- d – Analyse enthalpique différentielle
- e – Interprétations
Ce résultat est cohérent avec le début de la courbe de prise d'eau (figure IV.10). C'est ce que l'on observe sur la courbe IV.11, où la perte de masse démarre à partir du 15ème jour.

2.2 – Etude à 37°C dans l’eau
- a – Suivi pHmétrique
- b – Suivi par RMN 1 H
- c – Spectrométrie de masse
A partir des spectres RMN 1H obtenus précédemment et des intégrations des différents pics, nous avons pu déterminer les pourcentages de libération des principales espèces détectées : HAG, éthanol et HGEt (Figure IV.19). Pour mieux comprendre cette technique, la fragmentation du HAG (Figure IV.22) et les ions théoriques attendus (Tableau IV.3) sont présentés ci-dessous.
3 – C ONCLUSION
La latence présente lors de la première étude ne se retrouve pas en écotoxicité. Ce protocole est identique à l’étude de biodégradation de la cellulose (112 mg de cellulose micronisée de 90 µm/25 g de sol).

BIODEGRADABILITE ET TOXICITE DU
1 – B IODEGRADATION
Une autre technique pour évaluer la biodégradation d'un composé consiste en des tests en milieu aqueux (5), qui présentent l'avantage d'être faciles à mettre en œuvre. Cependant, le laboratoire ne dispose pas du matériel nécessaire. Nous avons utilisé une méthode plus simple et moins coûteuse qui est une adaptation de la norme ASTM D proposée par l’Unité de Chimie Organique Moléculaire et Macromoléculaire (UCO2M – UMR 6011) de l’Université du Maine.

1.1 – Test de respirométrie
En fonction des quantités de matières premières, la quantité maximale de CO2 qui sera rejetée peut être calculée comme suit. Ainsi, le taux de biodégradation de la PGEt s'exprime en faisant le rapport entre la quantité de CO2 rejetée par la PGEt (échantillon CO2 -CO2contrôle) et la quantité de CO2 théorique rejetée.

1.2 – Résultats obtenus
Nous nous sommes alors basés sur les prescriptions de la norme NFU52-001 relative aux « matériaux biodégradables pour l'agriculture et l'horticulture ». Le même profil est observé au début de l'analyse de la cellulose, mais la biodégradation se produit de manière plus monotone pour atteindre 95% de rejet de CO2 en 170 jours.

1.3 – Ecotoxicité
2 – P HYTOTOXICITE
2.1 – Principe des essais
Ce test confirme la non-toxicité de la PGEt lors de sa biodégradation vis-à-vis des micro-organismes qui conservent leur capacité à dégrader une nouvelle source de carbone. En effet, l'essai 1 permet préférentiellement de déterminer les effets de la biodégradation du PGEt sur la croissance des feuilles et l'évolution de la biomasse tandis que l'essai 2 permet également de connaître l'impact de ce polymère sur l'émergence des plantes, c'est-à-dire dans la germination des graines.
2.2 – Etude sur la germination
Sachant que les graines de cresson et d'orge germent en 7 jours environ, les deux tests réalisés sont complémentaires. Des résultats très similaires sont obtenus pour l'essai 2, qui correspond au placement de graines alors que la PGEt est déjà fortement biodégradée.
2.3 – Influence du PGEt sur la croissance et la biomasse de l’orge
2.4 – Conclusions
Dans les deux cas, plus la PGEt est présente dans le sol, plus la concentration en sous-produits ou micro-organismes sera élevée et donc plus l'effet nocif sera accentué. Cet effet dose permet de connaître les limites de l’utilisation de la PGEt dans les applications agronomiques.

3 – T OXICITE
3.1 – Hématotoxicité
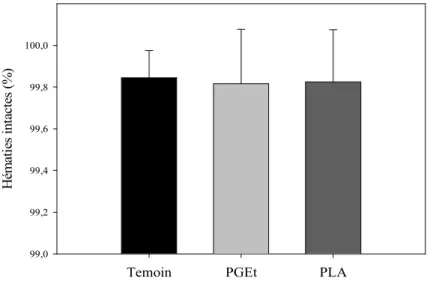
Les valeurs obtenues pour la PGEt sont essentiellement identiques à celles du PLA et du contrôle, de l'ordre de 99,8% de globules rouges intacts après 2 heures de contact. Ils ont été placés dans les mêmes concentrations et les mêmes conditions d'analyse que le PGEt (figure V.11).
3.2 – Toxicité du PGEt sur C. Elegans
- a – Principe de l’essai
- b – Résultats
48 heures après l'éclosion, env. vingt vers vivants et placés sur une gélose sans nourriture sur laquelle un échantillon (50 µL) de la solution de dégradation du PGEt ou de l'eau stérile (témoin) a été placé. Pour confirmer cela, le produit final de la dégradation du PGEt, HAG seul, a ensuite été testé dans les mêmes conditions de test (Figure V.15).

4 – C ONCLUSION
0,6 : teneur en carbone de 1 ml de la solution de sulfate double d'ammonium et de fer. m : masse de l’échantillon d’analyse de sol. 50 µl de la solution (PGEt, HAG ou H2O (témoin)) sont répartis sur des boîtes de Pétri de 35 mm (minimum 3 par condition à tester) recouvertes de milieu C vivant.