Complexes de 2,3BTCOH 2 203
Microorganismes utilisés et conditions de culture 212
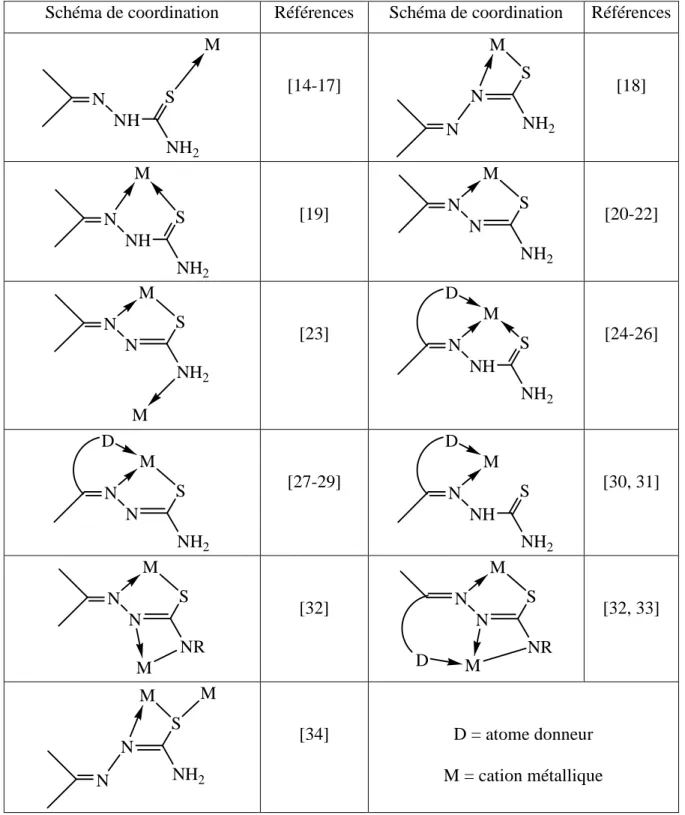
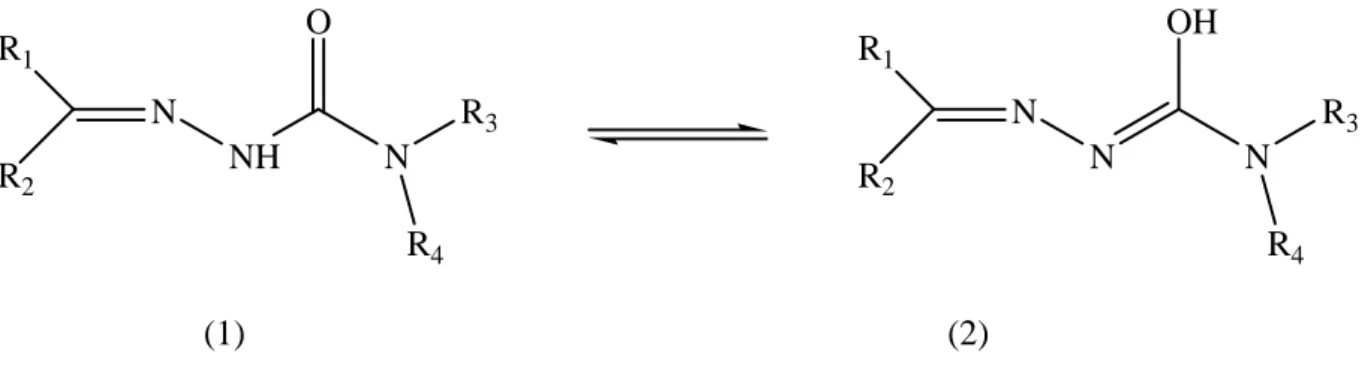
Les thiosémicarbazones, semicarbazones et oximes ont une grande capacité à former des complexes avec les métaux de transition. En effet, peu de travaux ont été publiés dans la littérature sur les oximes, les semicarbazones et/ou les thiophène thiosemicarbazones.
INTRODUCTION
LES THIOSEMICARBAZONES
Présentation des thiosemicarbazones
Dans le cas du thiosemicarbazone pyridine-2-carboxaldéhyde (PyTsc), l'atome de soufre ayant la densité électronique la plus élevée devrait conduire à la meilleure liaison avec l'ion métallique. Figure 1-6 : Formes tautomères et résonance de la forme polaire de la pyridine-2-carboxaldéhyde (PyTsc) thiosemicarbazone.
Les complexes métalliques des monothiosemicarbazones
C'est le cas du complexe thiosemicarbazone de l'acétophénone de formule (Me2Ga)[PhMeCNNC- (S)NPh](GaMe2), présenté ci-dessous (Figure 1-16) [32]. C'est le cas du complexe thiosemicarbazone de l'acide α-cétoglutarique avec le cuivre (II) de formule générale [Cu(H2ct)Cl]n.[Cu(H2ct)Cl]2.
![Figure 1-9 : Structure de [Re(CO) 3 Br(HL 2 )].](https://thumb-eu.123doks.com/thumbv2/1bibliocom/463805.69493/27.892.214.704.293.737/figure-1-9-structure-re-co-br-hl.webp)
Les complexes métalliques des dithiosemicarbazones et des bis(thiosemicarbazones)
Les ligands sont généralement tétradentés et forment souvent des complexes mononucléaires tels que le complexe du 1-phénylglyoxal bis(N(3)-diéthylthiosemicarbazone) avec l'ion cuivre(II) [54]. Dans le cas du complexe benzylbis(thiosemicarbazone) avec le cadmium(II), deux ligands et deux ions métalliques forment le complexe.
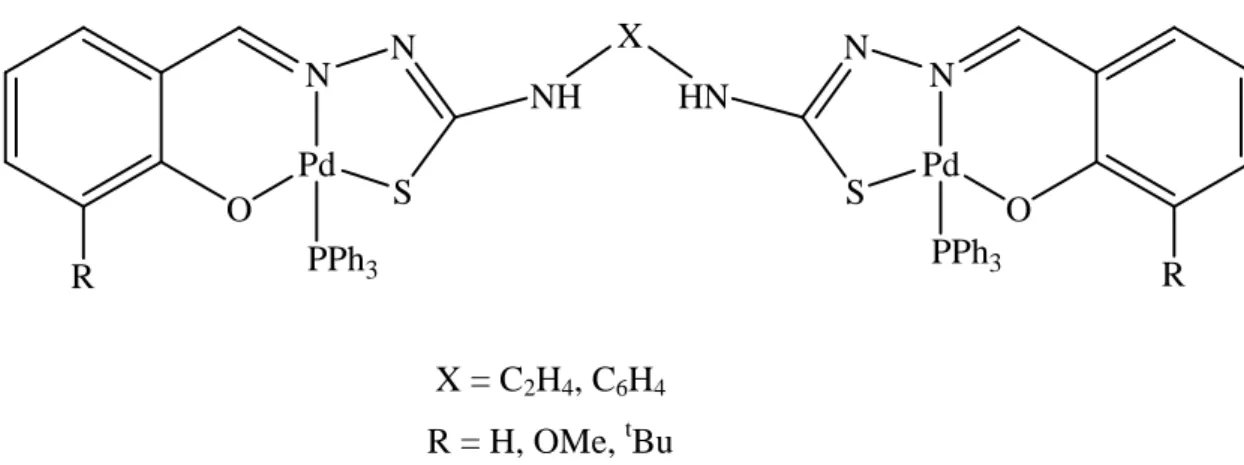
LES SEMICARBAZONES
Présentation des semicarbazones
Ici aussi, la possibilité de formation d'une liaison de coordination augmente si les substituants aldéhyde ou cétone contiennent des atomes donneurs supplémentaires [63]. La semicarbazone présente plusieurs modes de coordination, mais ceux-ci sont moins diversifiés que dans le cas des thiosemicarbazones.
Complexes métalliques des monosemicarbazones
Dans la plupart des cas, il existe un autre site coordinateur en plus de celui du semicarbazone. Une monosemicarbazone peut également former des complexes binucléaires, comme dans le cas des complexes di-2-pyridylcétone N4-phénylsemicarbazone avec le cadmium (II).
Complexes métalliques de disemicarbazones et de bis(semicarbazones)
LES OXIMES
- Généralités sur les oximes
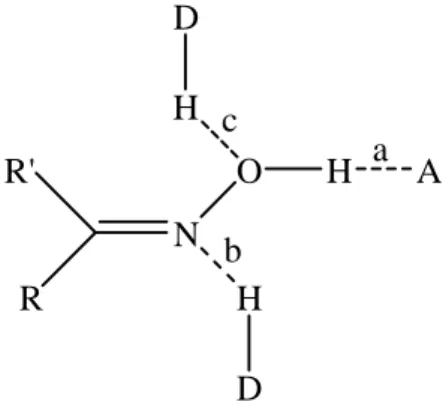
- Les liaisons hydrogène
- Les différents modes de coordination des oximes
- Complexes métalliques des oximes
Selon les différentes voies de complexation, le groupe oxime participe à la coordination grâce à l'azote de l'imine et l'oxygène de l'hydroxyle (ligands bidentés) ou. L'oxime peut être un ligand bidenté, participant à la coordination via l'azote de l'imine et l'oxygène de l'hydroxyle.
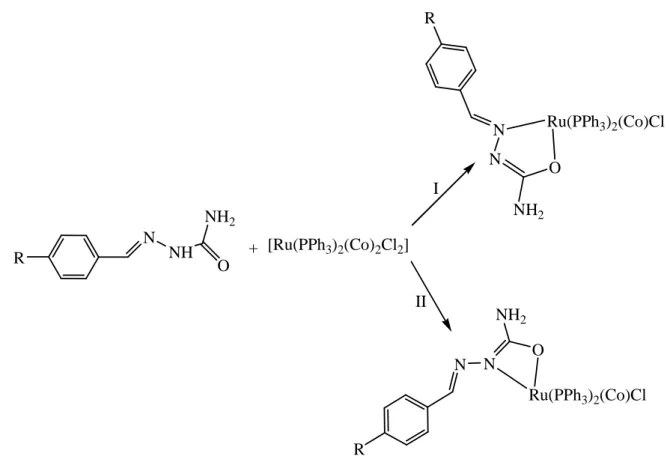
LIGANDS MIXTES
Dans l'oxime de propiophénone, le métal est de coordination 4 et les atomes de coordination sont l'atome d'azote de l'oxime et l'atome d'oxygène du carbonyle. Dans le cas de complexes impliquant deux fonctions, l'oxime intervient de la même manière et lie la semicarbazone (ou thiosemicarbazone) grâce à l'atome d'azote de l'imine et l'atome de soufre du thion (ou l'atome d'oxygène du carbonyle).
.H 2 O.](https://thumb-eu.123doks.com/thumbv2/1bibliocom/463805.69493/60.892.203.707.197.638/figure-53-structure-du-complexe-sm-hl-no.webp)
PROPRIETES BIOLOGIQUES
Nous avons montré dans notre laboratoire que des complexes d'oximes [106] ou de furanes semicarbazones [107-109] présentent des propriétés cytotoxiques. Par ailleurs, nous avons noté le faible nombre de publications décrivant des complexes métalliques de composés thiophènes et, celles décrites, concernent principalement des dérivés dont les groupes fonctionnels sont en position 2 du cycle.
CONCLUSION
Les complexes métalliques de dérivés simples du thiophène, tels que le thiosemicarbazone 2-acétyl thiophène, [115] sont actifs contre diverses souches bactériennes (B. macerans, A. aureus, E. coli). Dans le cas de complexes avec le zinc(II) ou le cadmium(II), le ligand peut être monodenté. En effet, ces composés ont très rarement été décrits comme ligands impliqués dans des complexes métalliques.
Dans chaque chapitre nous décrirons d'abord les méthodes de synthèse des ligands (ligands monofonctionnels puis bifonctionnels), puis celles des complexes avant de s'intéresser aux structures cristallines dont seront dérivées les structures de tous les complexes.
SYNTHESES
Synthèse des ligands
Synthèse des complexes
Ce complexe est obtenu en ajoutant 15 mL de 3TTSCH (1 g ; 5 mmol, éthanol) à une solution de CuBr2 (1,2 g ; 5 mmol, 15 mL, éthanol), le complexe est immédiatement précipité et la solution est portée au reflux de l'éthanol. en une heure, puis le complexe est isolé selon la procédure habituelle. Le mélange est porté à reflux avec de l'éthanol pendant 5 heures, après quoi le complexe est isolé selon la méthode habituelle. Le complexe précipite immédiatement et la solution est portée à reflux avec de l'éthanol pendant une heure, après quoi le complexe est isolé selon le mode opératoire habituel.
Cependant, la solution est portée au reflux avec de l'éthanol pendant une heure, après quoi le complexe est isolé selon la procédure habituelle.
ÉTUDE CRISTALLOGRAPHIQUE
Etude cristallographique des ligands
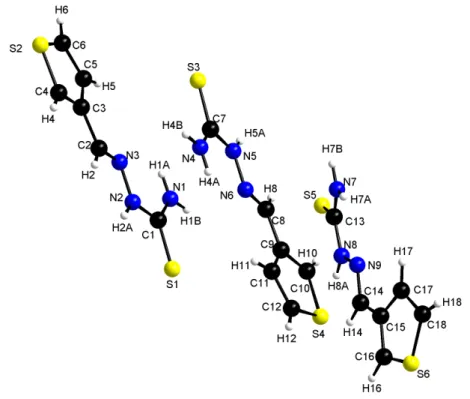
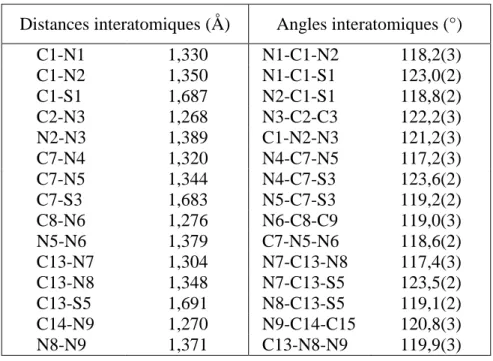
La vue en perspective de la structure cristalline avec numérotation atomique est présentée ci-dessous dans la figure 2-3. Chaque molécule indépendante fait partie d'un plan principal, la première et la seconde molécules étant presque parallèles l'une à l'autre ; par contre, le plan de la troisième molécule fait un angle de 54,17° avec la première molécule et de 53,69°. Chaque molécule indépendante est pratiquement plane, et la plus grande déviation par rapport à ce plan est observée avec les atomes de soufre de la thiosemicarbazone.
En revanche, le plan de la troisième molécule forme un angle de 54,17° avec celui de la première molécule et de 53,69° avec celui de la seconde.
Etude cristallographique des complexes
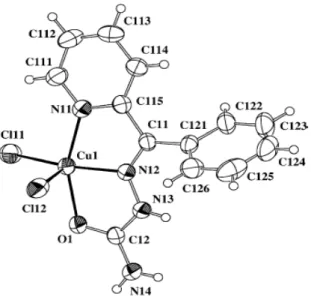
Dans le complexe [Ni(3TTSC)2], la coordination entre les deux ligands et le nickel est réalisée par le soufre du thioamide (sous forme thiol déprotoné) et l'azote de l'imine de chaque ligand [13]. Les groupements thiosemicarbazone de ce complexe changent de configuration et donc l'atome de soufre S1 et celui de l'azote imine N3 sont en position cis par rapport à la liaison C1-N2. Les groupes thiosemicarbazone de ce complexe conservent toujours la même configuration que dans le ligand seul et donc l'atome de soufre S1 et celui de l'azote imine N3 sont en transposition par rapport à la liaison C1 – N2.
Le complexe [CdBr2(3TTSCH)2] a une géométrie tétraédrique autour de l'ion Cd2+ et seul l'atome de soufre du thioamide est impliqué dans la coordination.
![Tableau 2-9 : Conditions d’enregistrement et résultats des affinements de [Ni(3TTSC) 2 ]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/463805.69493/94.892.149.766.135.747/tableau-2-9-conditions-enregistrement-résultats-affinements-3ttsc.webp)
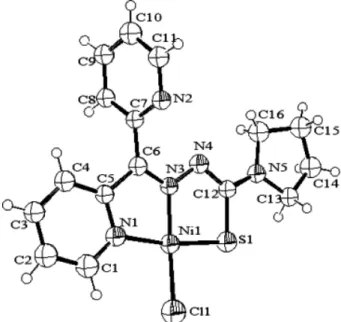
Le complexe [C6H5N2S][ZnCl3(C6H4N2S)] cristallise dans un système triclinique avec un groupe spatial P-1 et une cellule unitaire (Z = 1). La structure du complexe [C6H5N2S][ZnCl3(C6H4N2S)] se compose de deux parties, la première partie anionique [ZnCl3(C6H4N2S)]- contient un ligand lié par une liaison de coordination à l'anion (ZnCl3)- et la deuxième partie est constituée d'un cation ascendant [C6H5N2S ]+, c'est-à-dire une molécule de thiéno-[2,3-d] pyridazine protonée au niveau de l'atome d'azote (Figure 2-26). Dans ce complexe, une coordination s'effectue entre la thiéno-[2,3-d]pyridazine et l'ion Zn2+ via l'un des atomes d'azote de la pyridazine.
Dans la structure cristalline, les molécules s'empilent dans des plans parallèles, seuls les ions chlorure des anions ZnCl3 se trouvent en dehors de ces plans (Figure 2-27a).
![Tableau 2-20 : Conditions d’enregistrement et résultats des affinements de [C 6 H 5 N 2 S][ZnCl 3 (C 6 H 4 N 2 S)]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/463805.69493/114.892.150.764.166.791/tableau-2-20-conditions-enregistrement-résultats-affinements-zncl.webp)
DETERMINATION DE LA STRUCTURE DES AUTRES COMPLEXES
Complexes de la 3TTSCH
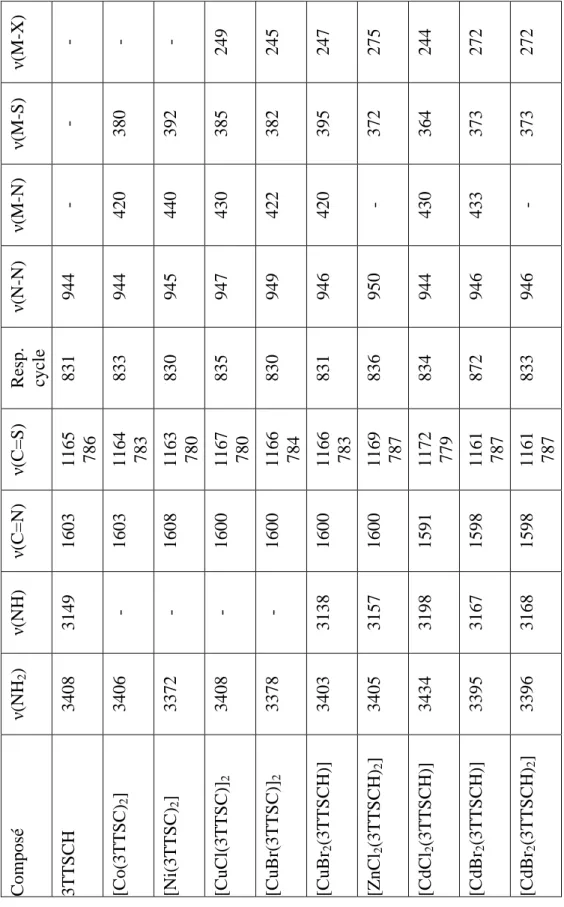
Les données des spectres RMN 1H du ligand et de ses complexes avec Zn(II) et Cd(II) (diméthylsulfoxyde D6) sont rassemblées dans le tableau 2-24. Enfin, dans le cas de [CuBr2(3TTSCH)], on observe l'apparition d'un pic de fusion endothermique vers 195 °C, suivi d'un pic de cristallisation très intense à 238 °C. Le composé [ZnCl2(3TTSCH)2] présente un pic de fusion à 198 °C, suivi de plusieurs petits pics de décomposition exothermique à partir de 210 °C.
Enfin, dans le cas de [CdBr2(3TTSCH)2] un net pic de fusion est observé à 211 °C, la décomposition commence à 230 °C avec de nombreux petits pics.
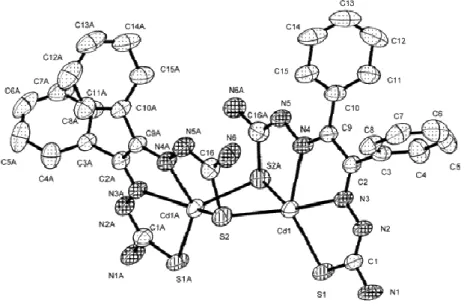
Complexes de la 2,3BTSTCH 2
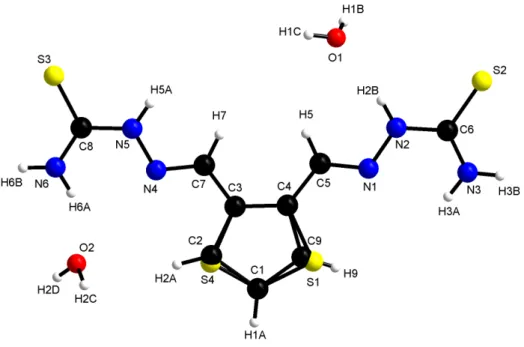
La première correspond au départ des molécules d’eau, et la seconde à la fusion des molécules. Le premier large pic exothermique (100 °C) témoigne d'un réarrangement de la structure sans cristallisation, structure dont la fusion s'observe à 137 °C. L'ion cuivre(II) est situé dans un environnement tétraédrique déformé (proche du plan carré), et les atomes de coordination sont l'atome d'azote (imine) et l'atome S de la fonction thiol déprotoné pour assurer l'électroneutralité [33] (Figure 2 -36).
Le spectre infrarouge montre que le ligand est déprotoné et sous forme thiol par disparition de la bande ν(NH).
![Figure 2-34 : Structure du complexe [CoBr 2 (2,3BTSTCH 2 )].](https://thumb-eu.123doks.com/thumbv2/1bibliocom/463805.69493/132.892.317.596.549.820/figure-2-34-structure-du-complexe-cobr-3btstch.webp)
CONCLUSION
Le complexe [Cu (2,3BTSTC)] présente une géométrie carrée planaire et les deux groupes thiosemicarbazone sont déprotonés, comme dans la plupart des complexes bifonctionnels de thiosemicarbazone avec du cuivre (II). Les complexes de cadmium (II) présentent une géométrie tétraédrique dans le cas de la thiosemicarbazone monofonctionnelle dans laquelle elle est bidentée en raison de l'atome de soufre et de l'atome d'azote de l'imine. Avec le bis(thiosemicarbazone), les complexes ont une géométrie octaédrique dans laquelle chaque groupe fonctionnel est bidenté (atome de soufre et atome d'azote de l'imine).
Le mélange est porté au reflux de l'éthanol en tube fermé sous pression pendant 24 heures.
ETUDE CRISTALLOGRAPHIQUE
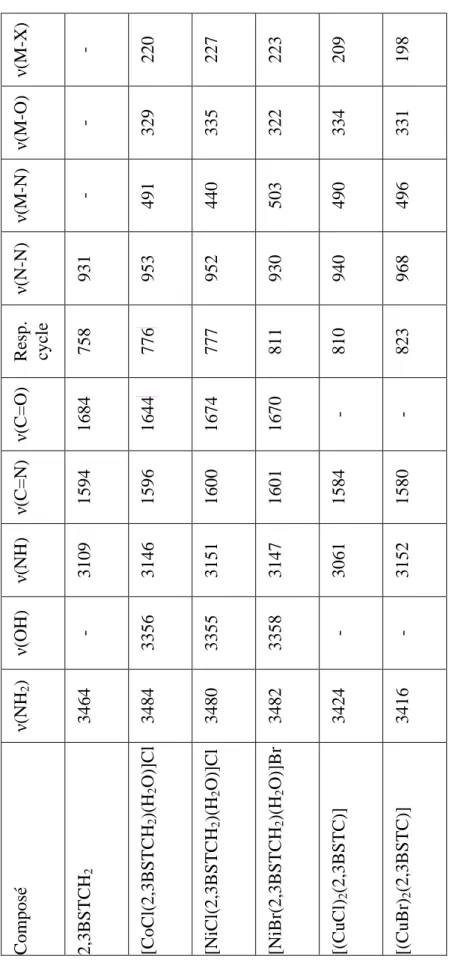
Etude cristallographique du complexe [NiBr(2,3BSTCH 2 )(H 2 O)]Br
La vue de la structure cristalline avec la numérotation des atomes est présentée à la figure 3-12. En revanche, les liaisons de part et d'autre de ce plan sur l'axe sont sensiblement différentes : la liaison avec l'atome d'oxygène de la molécule d'eau a une longueur de 2,143 Å, tandis que la liaison avec l'ion bromure a une longueur de 2,620 Å. Les liaisons hydrogène relient un atome d'hydrogène dans un groupe NH dans une molécule complexe avec un ion bromure situé dans une cellule voisine (Figure 3-16 (a)).
De même, les ions bromure à l'intérieur de la cellule (Figure 3-16 (b)) échangent une liaison hydrogène avec une molécule complexe dans la cellule voisine.
![Tableau 3-10 : Distances et angles interatomiques du complexe [NiBr(2,3BSTCH 2 )(H 2 O)]Br](https://thumb-eu.123doks.com/thumbv2/1bibliocom/463805.69493/161.892.209.684.125.499/tableau-distances-angles-interatomiques-complexe-nibr-3bstch-br.webp)
DETERMINATION DES STRUCTURES DES COMPLEXES
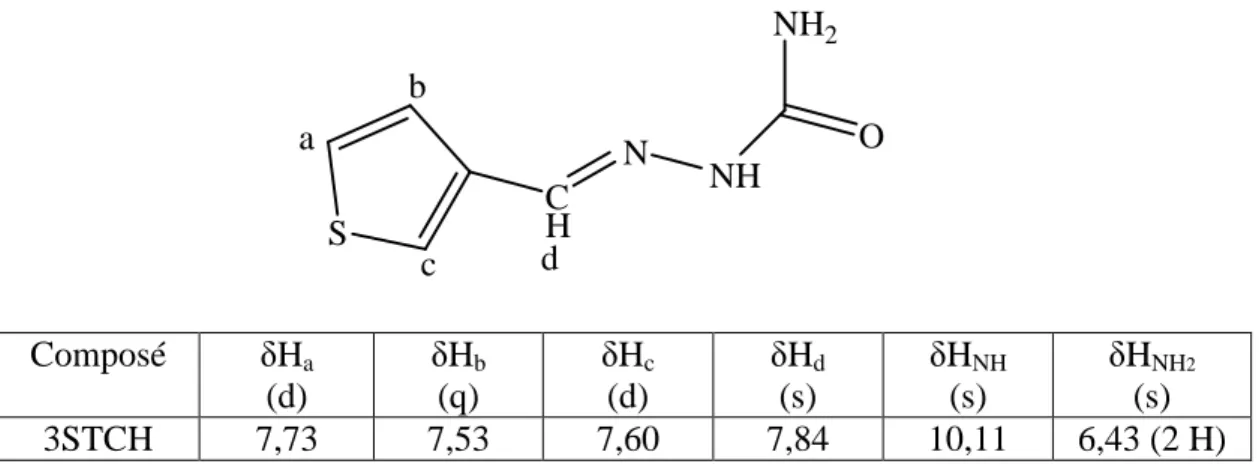
Complexes de la 3STCH
Les données du spectre RMN 1H dans l'hexadeutérédiméthylsulfoxyde du ligand sont rassemblées dans le tableau 3-13. Dans le cas du complexe [NiBr2(3STCH)2], seuls des pics endothermiques apparaissent à 231 et 259 °C, le premier pouvant indiquer une fusion du complexe. Dans le diagramme du complexe [CuCl2(3STCH)], un pic de recristallisation exothermique apparaît à 143 °C pouvant correspondre à une cristallisation, suivi de deux larges exothermes et enfin d'une série de pics exothermiques entre 300 et 360 °C indiquant sa décomposition.
Comme le montre la figure 3-18, le mode de coordination est similaire à celui observé dans le cas de la thiosemicarbazone (chapitre 2), où l'atome d'oxygène remplace l'atome de soufre.
Complexes avec la 2,3BSTCH 2
La vue en perspective de la structure cristalline, avec numérotation atomique, est présentée à la figure 3-22. Dans le groupe fonctionnel oxime en position 2, nous observons une géométrie cis autour de la double liaison carbone-azote C6-N2. En revanche, on note une géométrie trans autour de la double liaison C5-N1 dans le groupe oxime en position 3.
Dans le groupe fonctionnel oxime, nous observons une géométrie trans autour de la double liaison carbone-azote C5-N1 (Figure 4-10).

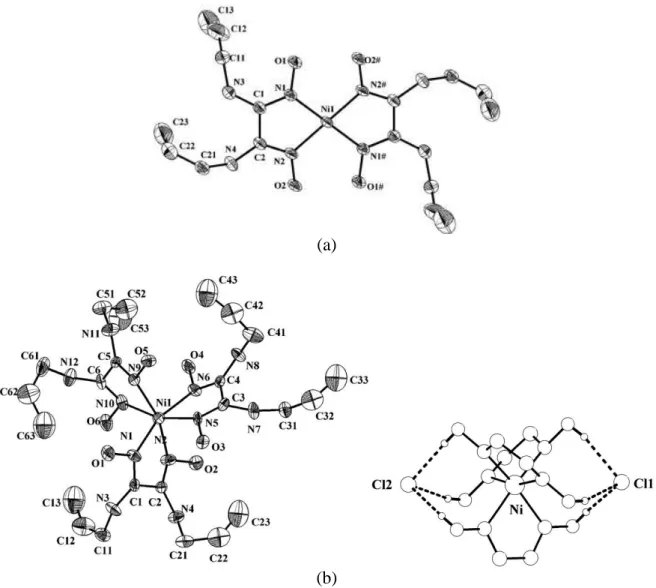
![Figure 1-51 : Structure des complexes Ni(L2).(NO 3 ) 2 (a) et [Ni 2 (L2)Cl 4 (DMF)] 2 (b)](https://thumb-eu.123doks.com/thumbv2/1bibliocom/463805.69493/58.892.210.710.119.950/figure-structure-des-complexes-ni-l2-no-dmf.webp)